-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Lokálne reakcie po uhryznutí hadom – klinické skúsenosti
Local reactions after snakebite – clinical experience
The authors present a comprehensive view of the current knowledge of Vipera berus in conjunction with the injection of poison (envenomation). Most often it is a seasonal occurrence in the range of spring, summer to autumn months (March – October) and most often it is the Vipera berus. Case reports point to the care and management of patients after snake venom poisoning.
Key words:
Vipera berus, envenomation, snakebite severity score, haemorrhagic swelling, antiserum
Autoři: Z. Podmanická 1; S. Dluholucký 1,2; K. Králinský 1,2; V. Rajčanová 1
Působiště autorů: II. DK SZÚ, Detská fakultná nemocnica s poliklinikou, Banská Bystrica 1; Fakulta zdravotníctva SZÚ so sídlom v Banskej Bystrici 2
Vyšlo v časopise: Čes-slov Pediat 2018; 73 (5): 332-342.
Kategorie: Přehledový článek
Souhrn
Autori prezentujú komplexný pohľad na súčasné poznatky po uhryznutí vretenicou (Vipera berus) v spojení so vstreknutím jedu (envenomáciou). Najčastejšie sa jedná o sezónny výskyt v rozmedzí jarných, letných až jesenných mesiacov (marec – október) a najčastejšie je to vretenica severná (obyčajná). Kazuistikami poukazujú na starostlivosť a manažment pacientov po intoxikácii hadím jedom.
Klúčové slová:
vretenica, envenomácia, skóre závažnosti, hemoragický opuch, antisérum
ÚVOD
Autori prezentujú komplexný pohľad na súčasné poznatky po uhryznutí vretenicou (Vipera berus) v spojení so vstreknutím jedu (envenomáciou). Najčastejšie sa jedná o sezónny výskyt v rozmedzí jarných, letných až jesenných mesiacov (marec – október) [1]. Z voľne žijúcich jedovatých hadov na území strednej Európy predstavuje riziko Vipera berus (vretenica severná, obyčajná) [2].
Práca zahŕňa všeobecné fakty z epidemiológie, toxikológie, poznatky o zložení a účinkoch jedu, z ktorých vyplývajú možnosti symptomatickej liečby. Hady z rodu Viperideae, ktoré sa nachádzajú na našom území, vyvolávajú u pacientov bez komorbidít ľahkú až stredne ťažkú intoxikáciu [2, 3]. Zdravotné riziko závisí aj od množstva vpraveného jedu a miesta envenomácie. Periférne lokalizované tukové tkanivá majú lepšiu prognózu ako lokalizácia na tvári alebo priamo do cievy [4, 5].
Práca obsahuje aj praktické informácie o poskytnutí prednemocničnej a následne nemocničnej starostlivosti [2]. Dôraz sa kladie na včasné zhodnotenie skóre závažnosti do 4–6 hodín – SSS (Snakebite Severity Score), ktoré sú známe aj pod starším názvom štokholmské kritériá [2, 6]. Kritériá posudzujú celkový stav (kardiovaskulárny systém, respiračný systém, gastrointestinálny systém, neuromuskulárny systém, hematologické abnormality a lokálne príznaky). Čím je skóre vyššie, tým viac sa prikláňa k podaniu špecifickej liečby – heterológneho polyvalentného antiséra, ktorého podanie môže mať pre pacienta ťažšie následky ako samotný účinok jedu (viperidae) [4, 5, 6].
Klinické skúsenosti sú podložené konkrétnymi kazuistikami z ostatných rokov 2016–2017. Pre prejavy lokálneho charakteru sa k podaniu špecifického antiséra nepristúpilo.
EPIDEMIOLÓGIA UHRYZNUTIA HADOM VO SVETE A V EURÓPE
Prvé práce venované odhadom mortality pacientov po uhryznutí hadom vo svete pochádzajú z prác Swaroop a Grab z roku 1954 [7]. Štatické spracovanie poskytla neskôr WHO (Svetová zdravotnícka organizácia) [8]. Celosvetovo dominujú hydrofóbne hady. Incidencia uhryznutia suchozemskými hadmi je najvyššia v oblastiach s najvyšším výskytom hadov, a to sú oblasti: juhovýchodnej Ázie (oblasť Indie, Malajsie Indonézie), južnej Ameriky, subsaharskej Afriky [9]. Tu je incidencia viac ako 100 uštipnutí na 100 000 obyvateľov/1 rok [10]. Envenomácia v Indii sa odhaduje na 81 000 ročne, čo je najvyššie na svete, ďalej nasleduje Srí Lanka, Vietnam a Brazília [11]. Situácia bola spracovaná Chippauxom v roku 1998 (obr. 1) [12].
Obr. 1. Regionálny výskyt uhryznutia hadom vo svete (na 100 000 osôb za rok) z údajov r 1998. Upravené podľa [12]. ![Regionálny výskyt uhryznutia hadom vo svete (na 100 000 osôb za rok)
z údajov r 1998. Upravené podľa [12].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/8d6d8bac0dfcca21632d789ed863e5ef.jpeg)
Rozloženie hadov a ich toxicita sú tiež rôzne. Kým jed hydrofóbnych hadov je myotoxický, jed hadov z čeľade Epiladae (Kobra, Kraits) neurotoxický s prudkými život ohrozujúcimi následkami, jed hadov z čeľade Viperidae má prevažne hematotoxické účinky s miernymi následkami [13].
Výskyt uhryznutia hadom v európskych krajinách je nízky a vzhľadom na neprítomnosť voľne ži-júcich vysoko toxických hadov sú následky po uhryznutí oproti iným čeľadiam miernejšie (obr. 2) [2, 12, 13]. Výnimkou sú prípady publikované v krajinách južnej Európy: vo východnom Maďarsku v roku 2008 a 2013 a Francúzku 2002 s neurotoxickými prejavmi po uhryznutí V. berus berus, V. berus bosniensis, V aspis francisciredi [14, 15, 16]. Morbidita je pomerne vysoká, mortalita nízka [2].
Obr. 2. Distribúcia jednotlivých druhov hadov z čeľade Viperideae v Európe. Upravené podľa [1]. ![Distribúcia jednotlivých druhov hadov z čeľade Viperideae v Európe. Upravené
podľa [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/6b5befb578d4cc12cc0ee73b323b06fe.jpeg)
Vo Veľlkej Británii sa uvádza 14 fatálnych prípadov za 100 rokov (1876–1976). V Maďarsku zaznamenali 1 smrteľný prípad v priebehu 36 rokov (1970–2006) [2, 17]. V Českej republike nezaznamenali smrteľný prípad v priebehu 15 rokov (1999–2013) [18]. Na Slovensku NTIC (Národné toxikologické informačné centrum) dlhodobo neregistruje smrteľný priebeh. V roku 2016 bolo evidovaných 34 uhryznutí, z toho 3 vretenice, antidotum nebolo podané. V roku 2017 bolo evidovaných 23 uhryznutí, z toho 2 vretenice, antidotum nebolo podané [19].
UHRYZNUTIE VRETENICOU
Vretenica je pokojný had, nikdy aktívne neútočí [2]. Analýzy príčin uhryznutia poukazujú na významný vplyv človeka pri uhryznutí. Hady z čeľade Viperideae sú prirodzenými predátormi pre hlodavce. Uhryznutia vznikajú väčšinou v súvislosti s neopatrnými pohybmi v miestach ich výskytu (prisadnutie, behanie s obnaženými končatinami), alebo pri nezdravej suverenite detí – kedy ho chcú chytiť, pohladkať [2, 3, 5]. Na Slovensku je rozšírená v lokalitách od 400–600 m.n.m. na slnečných, ale aj vlhkých miestach, na okrajoch lesov, horských lúkach, okrajoch polí, aj vo vyššie položených oblastiach v pásme kosodreviny [2, 4]. Vretenice dosahujú dĺžku do 60–80 cm, samce sú menšie. Sfarbené sú v odtieňoch sivej, hnedosivej s čiernou kľukatou čiarou, ale môžu sa vyskytovať aj úplne čierne bez rozpoznateľnej kľukatej čiary [2, 4].
Uhryznutie je obranný reflexný dej, slúžiaci na ochromenie koristi. Nie vždy je spojený s vpravením jedu z jedových žliaz (envenomáciou) – to predstavuje približne 60 % prípadov, 40 % uhryznutí je tzv. suchých, t.j. bez prítomnosti jedu [4]. Predilekcia je hlavne na končatinách: 51 % na rukách, 38 % na nohách a v iných lokalizáciách (gluteálna oblasť, krk atď.). Typickým príznakom sú dve symetrické ranky vo vzdialenosti 4–8 mm [5].
PATOFYZIOLOGICKÉ ÚČINKY JEDU VIPERA BERUS
Jed vretenice je zložený polypeptid. LD50 letálna dávka, ktorá spôsobí úhyn 50 % testovaných živočíchov, sa udáva 0,86 μg/g (0,71–1,01 μg/g), niektorí autori uvádzajú už 15–20 mg [2, 21]. Množstvo jedu dospelej vretenice dosahuje 60 % letálnej dávky pre dospelého človeka [5]. Maximum účinku je od 0,5–4 hodín, T1/2 – polčas rozpadu jedu je 6–16 hodín [22]. Účinky sú závislé od dávky.
Jed sa skladá sa z 25 peptidov, enzýmov, ligandov slúžiacich k imobilizácii obete [22]. Má proteolytické, fibrinolytické, antikoagulačné účinky a u niektorých druhoch vreteníc, vyskytujúcich sa geograficky najmä v oblastiach južnej a strednej Európy, aj neurotoxické účinky [12–16] (obr. 3). Obsahuje hyaluronidázu, hydrolázy, aminokyseliny, histamín, bradykinín, toxické polypeptidy, serínové proteázy, metaloproteinázy, fosfolipázu A2 [21–24].
Obr. 3. Patofyziologické účinky hadieho jedu. Upravené podľa [24]. ![Patofyziologické účinky hadieho jedu. Upravené podľa [24].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/eaaf05210233cc951fc82d28248e19ac.jpeg)
Dochádza k aktivácii viacerých kaskád. Aktivácia kaskády kyseliny arachidónovej cez fosfolipázu A2, aktivácia prozápalových cytokínov TNFα, IL-1, IL-6, IL-10, IFNγ spolu s prítomnosťou ďalších enzýmov – hyaluronidázy, histamínu vedie k zápalovému edému [22, 23]. Aktiváciou komplementu alternatívnou cestou vzniká angioedém. Zvyšuje sa cievna permeabilita, objavujú sa vaskulitické zmeny na cievach. Znižuje sa prekrvenie orgánov, môže sa rozvinúť DIC – diseminovaná intravaskulárna koagulácia, ktorá spolu s vaskulitídou môže viesť k tkanivovému poškodeniu. Dochádza k zmenám v aktivácii koagulačnej kaskády (deficit koagulačných faktorov, predĺženie časov zrážania) a k hemostatickej inbalancii (inhibícia agregácie trombocytov). Vplyvom serínových proteáz (SVSPs) sa aktivuje kalikreín-kinínová kaskáda, fibrinogenéza [24]. Zmeny vedú k lokálnej hemorágii.
Ďalším momentom podporujúcim hemorágiu je vplyv enzýmu metaloproteinázy závislej od zinku (SVMPs). Vedie k destabilizácii kolagénových vlákien bazálnej membrány kapilár [23]. Výsledkom je hemoragický edém s hemokoncentráciou a únikom cirkulujúceho objemu s poklesom krvných elementov (leukocytov, erytrocytov, krvných doštičiek, zložiek plazmy vrátane koagulačných faktorov – obr. 4) [23, 24].
Obr. 4. Patofyziologické účinky hadieho jedu. Dvojkroková aktivácia SVMPs-metalopropteinázy hadieho jedu vedúca k degradácii bazálnej membrány kapilár s následnou hemorágiou. Upravené podľa [23]. ![Patofyziologické účinky hadieho jedu. Dvojkroková aktivácia SVMPs-metalopropteinázy
hadieho jedu vedúca k degradácii bazálnej membrány kapilár s následnou hemorágiou.
Upravené podľa [23].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/53e4d13877889d6c2f30eb5dc4a46007.jpeg)
Účinok neurotoxínov na úrovni neuromuskulárnych synáps je zodpovedný za prudký až letálny priebeh envenomácie. Dochádza k svalovej a nervovej paralýze. Prvé príznaky vzhľadom na rýchle vstrebávanie jedu je možné verifikovať už v priebehu niekoľkých minút po envenomácii. Varovnými príznakmi sú celková malátnosť, obrna tvárového svalstva, ptóza viečka, obrna hladkého svalstva dúhovky, zahlienenie dýchacích ciest. Tieto účinky patria k celkovým príznakom a sú súčasťou skórovacieho systému [2, 5, 6, 24, 26].
KLINICKÝ OBRAZ
Klinický obraz závisí od druhu jedu, dávky jedu a miesta uhryznutia [2, 5, 14–16]. Najnebezpečnejšie sú oblasti hlavy, krku a silne prekrvených tkanív [4]. Keďže v našich podmienkach nie je rutinná možnosť stanovenia kvality a kvantity jedu, vychádza sa z klinických príznakov a laboratórnych parametrov. 70–80 % pacientov nemá žiadne symptómy, alebo len slabú lokálnu reakciu [22]. Príznaky môžu byť lokálne, systémové alebo hematologické spôsobené edémom a hemorágiou. Sekundárne môžu byť alterované rôzne orgány hypoxiou, hypoperfúziou s následnou nekrózou tkanív.
Najčastejšie vzniká lokálny edém už od 0,5–1 hodiny po envenomácii [2, 21, 22]. Môže progredovať, maximum dosahuje do 48–72 hodín, môže byť až extenzívny – hemoragický [3, 4, 25]. Bolesť môže byť minimálna napriek rozšíreniu jedu v organizme. Dochádza k zväčšeniu regio-nálnych lymfatických uzlín a zmene farby kože (sufúzie po hemorágii) až po nekrotické zmeny kože [4].
Systémové prejavy môžu nastúpiť už 5 minút po envenomácii a môžu pretrvávať niekoľko hodín [4]. Hodnotia sa jednotlivé systémy: kardiovaskulárny systém, respiračný systém, gastrointestinálny systém, neuromuskulárny systém, uropoetický systém. Vyžadujú si monitorovanie vitálnych funkcií, príjmu, výdaja tekutín.
Hematologické resp. laboratórne abnormality sa môžu manifestovať s časovým odstupom, preto je potrebné opakované monitorovanie vnútorného prostredia (krvný obraz, hemokoagulačné vyšetrenia, acidobáza, biochemické parametre, moč) [2, 3, 5].
Hodnotenie klinických a laboratórnych príznakov je možné podľa tvz. štokholmských kritérií, alebo novšie v zahraničnej literatúre uvádzaných SSS (Snakebite Severity Score – skóre závažnosti po uhryznutí hadom) v priebehu prvých 4–6 hodín po envenomácii (tab. 1) [2, 5, 6, 26].
Tab. 1. SSS (Snakebite Severity Score) – skóre závažnosti po uhryznutí hadom 4–6 hodín po envenomácii. Upravené podľa [2, 3, 6, 26]. ![SSS (Snakebite Severity Score) – skóre závažnosti po uhryznutí hadom 4–6 hodín po envenomácii. Upravené podľa [2, 3, 6, 26].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/fcbd4cf513628cf900039e1ba2966830.jpeg)
TERAPIA
Terapeutické postupy zahŕňajú prednemocničnú starostlivosť – prvú pomoc a nemocničnú starostlivosť. V prednemocničnej starostlivosti sa odporúča: Upokojiť pacienta. Zostať v bezpečnej vzdialenosti od hada. Udržiavať ranu pod úrovňou srdca. Imobilizovať pacienta, odstrániť šperky, prípadne topánky na postihnutej končatine. Zapamätať si farbu, typ, prípadne realizovať fotodokumentáciu hada. Naložiť elastickú bandáž podľa Sutherlanda a vyhľadať najbližšiu nemocnicu [2, 3, 27].
Neodporúča sa: Používať škrtidlo – absorbcia jedu hlbokými kostnými cievami do artériovej cirkulácie zväčší pôvodnú traumu! Prikladať ľad, vypaľovať ranu – zhoršenie lokálneho poškodenia! Realizovať excíziu rany – hrozí poškodenie ciev a nervov! Vysať jed ústami – zanesenie infekcie! Vymývať ranu! Podávať kofeinové alebo alkoholické nápoje – urýchľujú vstrebávanie jedu! Chytať hada! [2, 3, 4, 27].
Nemocničná starostlivosť zahŕňa medikamentóznu liečbu, monitorovanie vitálnych funkcií a vnútorného prostredia. Medikamentózna liečba vychádza z patofyzio-logických poznatkov o účinkoch jedu a aktivácie zápalových, fibrinolytických, kinínových kaskád. S vyplavením histamínu, serínových proteáz, s rizikom anafylaktickej reakcie (pacienti s hypersenzitivitou na blanokrídly hmyz) – symptomatická liečba, alebo v prísnej indikácii podanie heterológneho antiséra [2–6, 18, 26, 28],
A. Symptomatická liečba
Liečba podľa príznakov je iniciálna, zahŕňa intravenóznu liečbu: protizápalovú, antiedematóznu: celkové kortikosteroidy hydrokortison/metylprednisolon 2–4 mg//kg/dávku i.v., antihistaminiká bisulepin i.v. [3–5, 25]. Prevencia DIC: nízkomolekulový heparín 0,1 IU/10 kg à 12 hod. s.c. a súčasne pre zabezpečenie cievnej reológie, ktorá môže byť ohrozená tlakom progredujúceho edému na cievy: pentoxifylín 0,6 mg/kg/hod. i.v. [5, 25].
Keďže z hadích zubov bolo izolovaných viacero závažných potencionálnych patogénov (Pseudomonas aeruginosa, Clostridium spp., Corynebacterium spp., Staphylococcus), pri infekcii rany je indikovaná celková antibiotická liečba. Z ATB sa preferujú širokospektrálne cefalosporíny alebo chránené aminopenicilíny [29].
Vitaminózna liečba: na podporenie pevnosti cievnej steny vitamín C (Acidum ascorbicum 170 mg/m2/deň, i.v), na podporenie tvorby koagulačných faktorov vitamín K 1,25–20 mg 1x denne podľa hodnôt času zrážania PTT [4]. Ďalej infúzna liečba, liečba šoku, kyslíková terapia podľa príznakov a i. [2 ,4, 5, 25].
B. Špecifická imunoterapia
Pri závažných systémových príznakoch (hypotenzia, gastrointestinálne poruchy, neurotoxicita, a iné), alebo pri lokálnych príznakoch v lokalizáciách zvýšene prekrvených tkanív s nízkym obsahom tuku v oblasti hlavy a krku (extenzívny opuch pery) je indikovaná špecifická imunoterapia [5, 18].
Klinicky preukázanými skúškami je antisérum vysoko účinné pri neutralizácii toxínov zodpovedných za systémové účinky, ako je krvácanie, koagulopatia, hemodynamické poruchy, neurotoxicita [30]. Historicky sa datuje podanie antiséra ako prvá voľba po uhryznutí hadom. Ako uvádzajú literárne zdroje 90-tich rokov, podávalo sa profylakticky – bez čakania na celkovú reakciu pri primoošetrení rany spolu s podaním antitetanovej vakcíny. Podanie antiséra sa spája s rizikom včasnej reakcie – anafylaktickej reakcie (niekoľko minút po podaní), ale aj oneskorenej reakcie – sérovej choroby (5–14 dní po podaní), preto treba zvažovať riziko oproti benefitu pre pacienta [5, 30–32].
Rôzna technológia prípravy antiséra deklaruje rôznu bezpečnosť. Vyskytujú sa antiséra s obsahom celej molekuly IgG, novšie preparáty sú zložené z fragmentov F(ab) získaných digesciou IgG pepsínom. Zmeny v molekulovej hmotnosti účinnej látky, imunologické divergencie vedú k rôznym farmakokinetickým profilom s evidentnými farmakodynamickými dôsledkami, ako je opis opätovného výskytu envenomizácie – najmä pri použití F(ab) antivenómov [31].
Pre rozhodovanie o podaní antiséra slúžia už spomínané tzv. štokholmské kritériá, alebo SSS (Snakebite Severity Score) – skóre závažnosti po uhryznutí hadom. Dôležitý je časový horizont účinnosti antiséra, pretože účinky samotného jedu sú krátke 4–6 hodín (max. účinok jedu 0,5–4 hod, T1/2 6–16 hod) a neskôr nastupujú účinky vyššie popísaných aktivovaných kaskád a antisérum už nemá substrát. Neskoré podanie špecifickej terapie je spojené s neúčinnosťou voči samotnému jedu a zvýšeným zdravotným rizikom pre pacienta v podobe adverzných reakcií [2, 5, 6, 26]. Liečebný algoritmus podľa SSS pre terapiu po uhryznutí hadom udáva: 0–3 body: ľahká envenomácia, postačujúca symptomatická liečba; 4–7 bodov: stredne závažná envenomácia, podanie iniciálnej špecifickej imunoterapie; 8–20 bodov: ťažká envenomácia vyžadujúca si iniciálnu až opakovanú špecifickú imunoterapiu [6, 26].
V prípade rozhodnutia sa o aplikácii polyvalentného heterológneho antiséra treba postupovať podľa odporú-čaní výrobcu a realizovať frakcionované podanie [32]. T.č. je dostupný poľský preparát Viper Venom antitoxin 500 AU/5 ml i.m./i.v./s.c. (zbavený Fc fragmentu imunoglobulínu). Vzhľadom na vysoké riziko adverzných reakcií je úvodne potrebné realizovať intrakutánny test so zriedeným preparátom, odčítava sa o 10–20 minút. Pri negativite možno podať celú dávku i.m. V život ohrozujúcom stave sa podáva s premedikáciou (adrenalín, antihistaminká) i.v. V prípade pretrvávania klinických prejavov otravy možno pristúpiť k opakovanému podaniu o 1–2 hodiny. V prípade pozitivity intrakutánneho testu so zriedeným preparátom je nutné pristúpiť k desenzibilizácii, ktorá spočíva v subkutánnej aplikácii postupne sa navyšujúcich koncentrácií antiséra (riedené antisérum 1 : 10 s objemom 0,1–0,5 ml s.c. à 30 minút až 1 hodinu. Ak je bez reakcie, pokračuje sa neriedeným antisérom 0,2–0,5 ml s.c. à 30 minút, následne sa podá zostatok i.m. [32]. Vždy treba zvažovať riziko a benefit pre pacienta s ohľadom na výskyt adverzných reakcií (anafylaxia, sérová choroba) a opätovný výskyt envenomácie pri aj po podaní F(ab) antienómov [30–33].
V českej štúdii Valenty a kol., kde bolo sledovaných 191 pacientov za 15 rokov (1999–2013) po envenomácii, bolo zaznamenaných 25,7 % pacientov so systémovými prejavmi, 47,6 % pacientov s lokálnymi príznakmi, 26,7 % pacien-tov bolo asymptomatických. V 12,6 % prípadoch bolo podané antisérum (najmä u pediatrických pacientov, u pacientov s hypotenziou a gastrointestinálnymi príznakmi a trom deťom s lokálnym extenzívnym opuchom pery) [18].
ĎALŠIE MOŽNOSTI TERAPIE
A. Skrížená reaktivita antisér
V literatúre sú údaje o skríženej reaktivite polyklonálnej protilátkovej terapie s preparátom ViperaTAb® nielen proti V. berus, ale aj iným hadom z čeľade viperidae: V. aspis, V. ammodytes a V. latastei [34]. Neutralizačné protilátky reagovali skrížene v testoch in vitro (ELISA a immunoblothing) [34]. V klinickej aplikácii u pacientov po envenomácii V. ammodytes sa zmiernili len príznaky edému a trombocytopénie, neurotoxické príznaky to neovplyvnilo [35].
B. Chirurgická liečba
V prípadoch rozvoja závažných lokálnych komplikácií po envenomácii – celulitídy a kompartment syndrómu (najmä po envenomácii vysokotoxických hadov v Indii) sa pristupovalo k chirurgickému ošetreniu – fasciotómii [36]. V súčasnosti sa chirurgická liečba využíva pri debridemente a rekonštrukcii mäkkých tkanív, vďaka využívaniu terapie v hyperbarických komorách [36, 37].
C. Hyperbarická komora
Pri využití hyperbarickej komory pri celulitíde a kompartment syndróme vzniknutého po envenomácii na končatinách sa redukovala potreba fasciotómií [36, 37]. Autori z Taiwanu identifikovali aj nezávislé rizikové faktory rozvoja týchto lokálnych komplikácií PSCS (post-snakebite compartment syndrome): leukocytóza so zvýšeným počtom segmentovaných neutrofilov, elevácia ALT, elevácia AST v priebehu 48 hodín po envenomácii [38].
KAZUISTIKY
Kazuistiky počas ostatných rokov 2016–2017 z pracoviska II. DK SZU DFNsP Banská Bystrica poukazujú na starostlivosť a manažment pacientov po intoxikácii hadím jedom. Vo všetkých prípadoch sa jednalo o lokálne príznaky po envenomácii. Rozsah klinických príznakov koreloval s predpokladanou dávkou jedu a predpokladanou toxicitou (rutinná serologická diagnostika nie je k dispozícii). Celkovo 5 pediatrických pacientov s envenomáciou počas letných mesicov jún – august, s lokalizáciou uhryznutia do končatín (horná končatina 3-krát, dolná končatina 2-krát). Pri envenomácii do hornej končatiny vo všetkých prípadoch deti aktívne a cielene chytali hada. Pri envenomácii do dolných končatín išlo o náhodné uhryznutie (1-krát nedostatočná ochrana – bosé dieťa, 1-krát neúmyselné zastupenie hada).
Kazuistika 1
Takmer 10-ročný chlapec sa pokúšal v lese chytiť malého čierneho hadíka (jún 2016), 1-krát mu ušiel, 2-krát ho uhryzol do palca ľavej ruky (bol ľavák). Klinicky sa do pol hodiny rozvinuj lokálny opuch s miernou hemorágiou. Laboratórne parametre boli v norme. Edém v priebehu 72 hodín progredoval na celú ĽHK až do axily. Bola prítomná axilárna lymfadenopatia. Pacientove neurocirkulačné pomery boli monitorované aj objektivizované ultrasonograficky. K regresii edému došlo na 6. deň symptomatickej liečby. Liečba sa eskalovala postupne, ako progredoval edém (obr. 5). Najskôr antihistaminiká, neskôr kortikosteroidy, reologiká, antibiotiká, vitamíny.
Obr. 5. 10-ročný chlapec po envenomácii do palca ľavej hornej končatiny. A – Lokálny opuch ruky. B – Lokálny opuch s miernou hemorágiou bez hematologických abnormalít. C – Progresia edému na celú ľavú hornú končatinu až do axily, bez neurocirkulačnej poruchy (USG). D – Regresia edému na 6. deň symptomatickej liečby.
Fig. 5. 10-year-old boy after envenomation to the left upper limb. A – Local swelling of the hand. B – Local swelling with mild haemorrhage without haematological abnormalities. C – Edema progression to the entire left upper limb up to the axilla, without neurocirculatory disorder (USG ). D – Regression of edema on the 6th day of symptomatic treatment.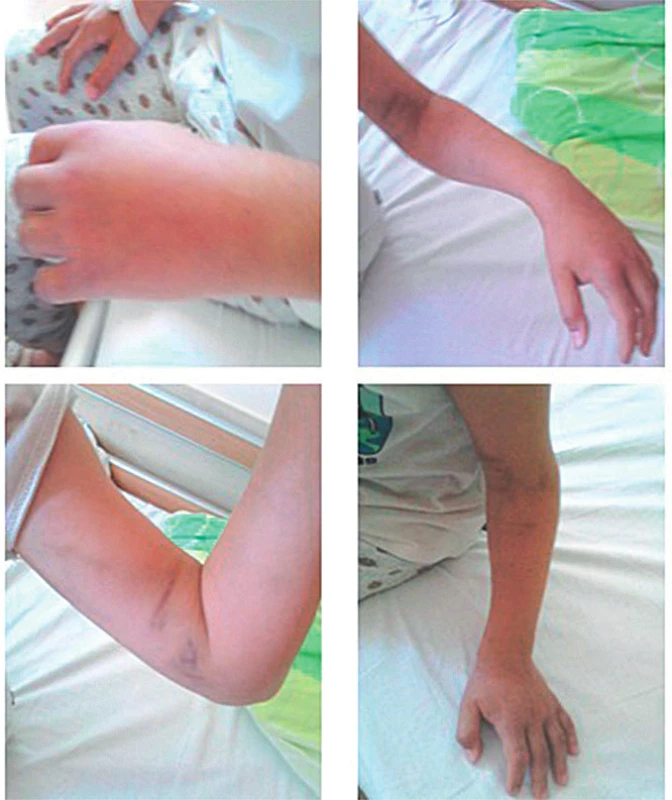
Hospitalizácia trvala 6 dní, celková dĺžka liečby do 10 dní.
Kazuistika 2
3,5-ročné dovtedy zdravé dievča behalo bosé po vysokej tráve a niečo ho uhryzlo do oblasti pravého vnútorného členka. Hada nevideli (pozn.: epizóda sa stala 1 týždeň po predchádzajúcom pacientovi). Lokálne boli prítomné tri drobné ranky v rozmedzí do 1 cm a postupne sa rozvíjal edém mäkkých tkanív aj so známkami podkožnej hemorágie. Klinicky bolo vyslovené suspícium na envenomáciu. Volila sa eskalačná symptomatická liečba pri postupnej progresii hemoragického edému. Dieťa bolo bez celkovej symptomatológie. V priebehu nadchádzajúcich 72 hodín hemoragický edém presahoval postihnutú končatinu, zasahoval do oblasti malej panvy. Hemorágia sa prejavila aj vo vnútornom prostredí s potrebou substitučnej liečby erytrocytárnou masou a bielkovinami (anemický syndróm, pokles hemoglobínu o viac ako 15 %). Po 72 hodinách sa klinický stav stabilizoval a postupne regredoval (obr. 6, graf 1).
Obr. 6. 3,5-ročná pacientka po envenomácii do vnútorného členka pravej dolnej končatiny. A – Lokálny opuch s miernou hemorágiou, drobné 3 ranky pri vnútornom členku. B – Progresia edému na celú pravú dolnú končatinu + hemorágia do podkožia do 24 hodín. C – Hemoragický edém s hemorágiou do podkožia celej pravej dolnej končatiny do 48 hodín. D – Progresia hemoragického edému do suprapubickej oblasti do 72 hodín.
Fig. 6. 3.5-year-old female patient after envenomation into an inner ankle of the right lower limb. A – Local swelling with mild hemorrhage, small 3 ranks at the inner ankle. B – Progression of edema to whole right lower limb + subcutis hemorrhage within 24 hours. C – Hemorrhagic edema with subcutis hemorrhage to whole lower right leg under 48 hours. D – Progression of hemorrhagic edema to the suprapubic.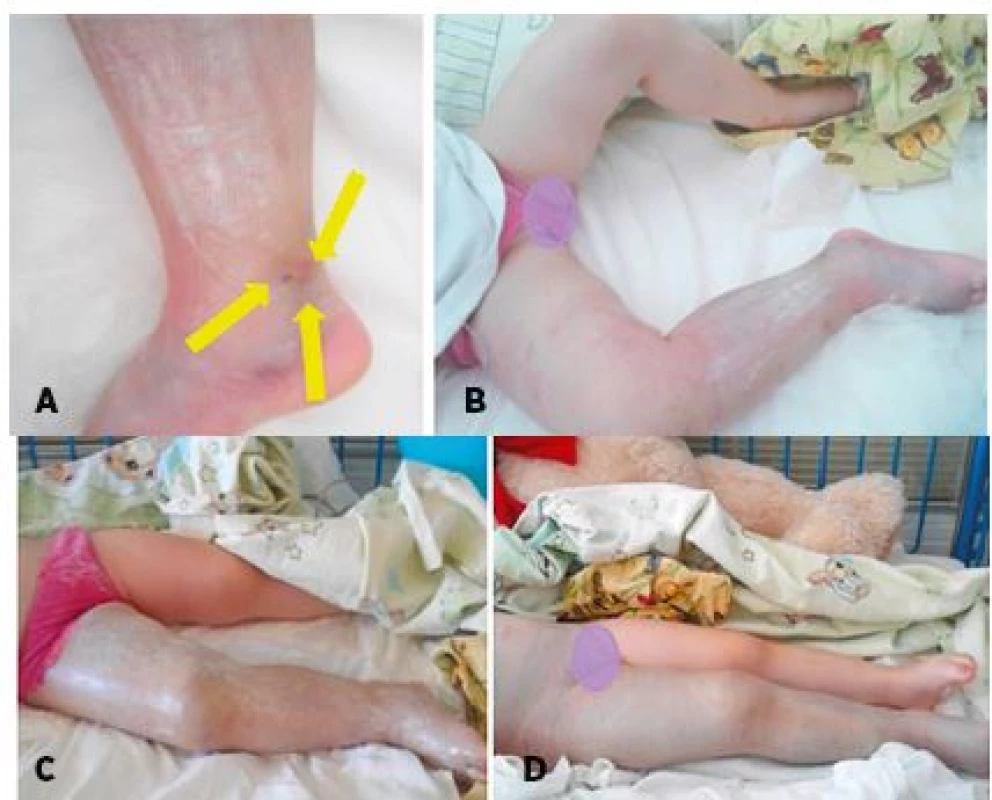
Graf 1. Anemizácia s poklesom celkových bielkovín v dôsledku krvácania.
CB – celkové bílkoviny, Hgb – hemoglobin, Htk – hematokrit, Quick – protrombínový čas
Hospitalizácia trvala 7 dní, dĺžka liečby do 10 dní, rekonvalescencia ad integrum do 21 dní.
Kazuistika 3
14-ročný chlapec behal vo vysokých členkových kožených teniskách po vysokej tráve a niečo ho uhryzlo do priehlavku ľavej dolnej končatiny (júl 2017). Hada nevideli. Pre nález dvoch symetrických raniek v rozmedzí 1 cm ešte lekárom záchrannej služby bola aplikovaná antiedematózna liečba. K regresii edému došlo do 2 hodín po aplikácii hydrokortizonu (v dávke zodpovedajúcej hmotnosti pacienta). Po 12 hodinách bola končati-na bez lokálnej zmeny (obr. 7).
Obr. 7. 14-ročný pacient po envenomácii do priehlavku ľavej dolnej končatiny. A – Regresia edému do 2 hodín po aplikácii hydrokortisonu. B – Po 12 hodinách – končatina ad integrum.
Fig. 7. 14-year-old patient after envenomation in the left lower leg instep. A – Regression of edema within 2 hours after hydrocortisone administration. B – After 12 hours – limb ad integrum.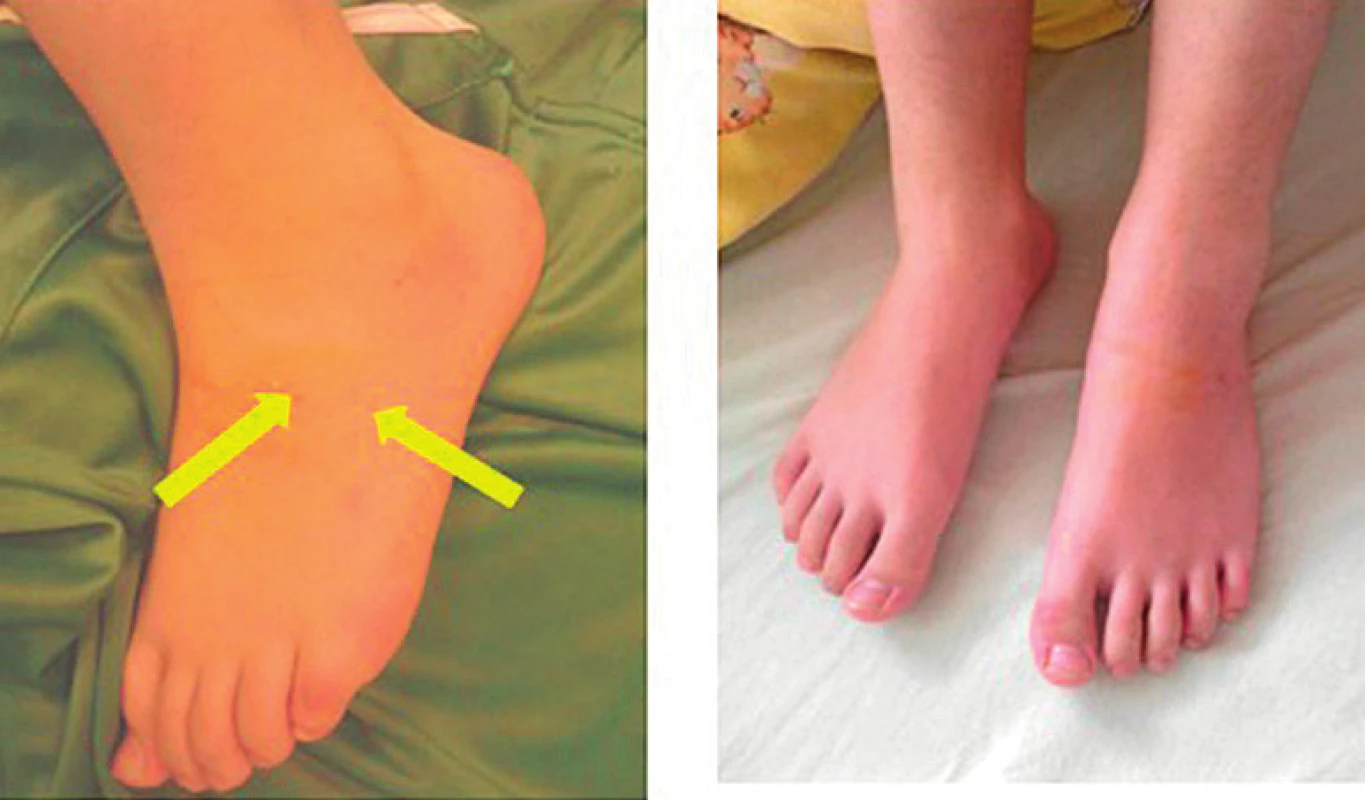
Hospitalizácia trvala 24 hodín, rekonvalescencia ad integrum do 12 hodín, dĺžka liečby do 72 hodín.
Kazuistika 4
17-ročný chlapec chytal vretenicu v oblasti Veľkej Fatry. Bol uhryznutý do oblasti palca pravej hornej končatiny (bol pravák). Bola zvolená úvodne komplexná deeskalačná liečba a k regresii hemoragického edému došlo na 3. deň (obr. 8).
Obr. 8. 17-ročný pacient po envenomácii do palca pravej hornej končatiny. A – Mierny edém prstov pravej hornej končatiny. B – Rana po 24 hodinách. C – Regresia edému na 3. deň symptomatickej liečby.
Fig. 8. 17-year-old patient after envenomation in the thumb of the right upper limb. A – Mild edema of the right upper limb. B – Injure after 24 hours. C – Regression of edema on 3rd day of symptomatic treatment.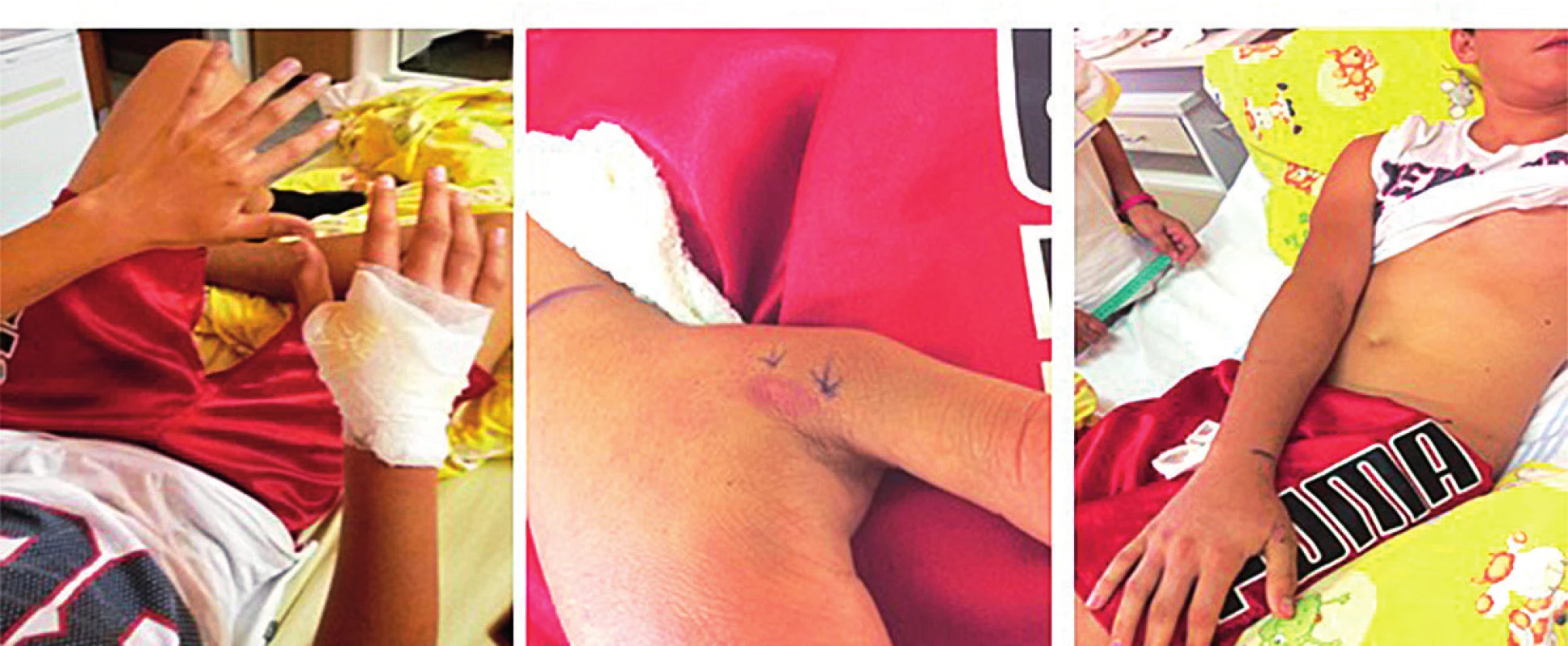
Dĺžka hospitalizácie 3 dni, rekonvalescencia ad integrum 6 dní, dĺžka liečby do 6 dní.
Kazuistika 5
7-ročný chlapec chytal vretenicu v oblasti Pohorelej. Hadov choval doma otec, hadov sa nebál. Envenomácia bola do ukazováka pravej hornej končatiny (bol pravák). Volená symptomatická deeskalačná liečba, k regresii edému došlo na na 3. deň (obr. 9).
Obr. 9. 7-ročný pacient po envenomácii do ukazováka pravej hornej končatiny. A – Rana po 24 hodinách. B – Pohľad na opuch pravej hornej končatiny do úrovne lakťa. C – Regresia edému na 3. deň symptomatickej liečby – pohľad z palmárnej strany. D – Regresia edému na 3. deň symptomatickej liečby – pohľad z volárnej strany.
Fig. 9. 7-year-old patient after envenomation in the foreleg of the right upper limb. A – Injure after 24 hours. B – View of swelling of the right upper limb to the heel level. C – Regression of edema on 3rd day of symptomatic treatment – view from the palmar side. D – Regression of edema on 3rd day of symptomatic treatment – view from the volary side.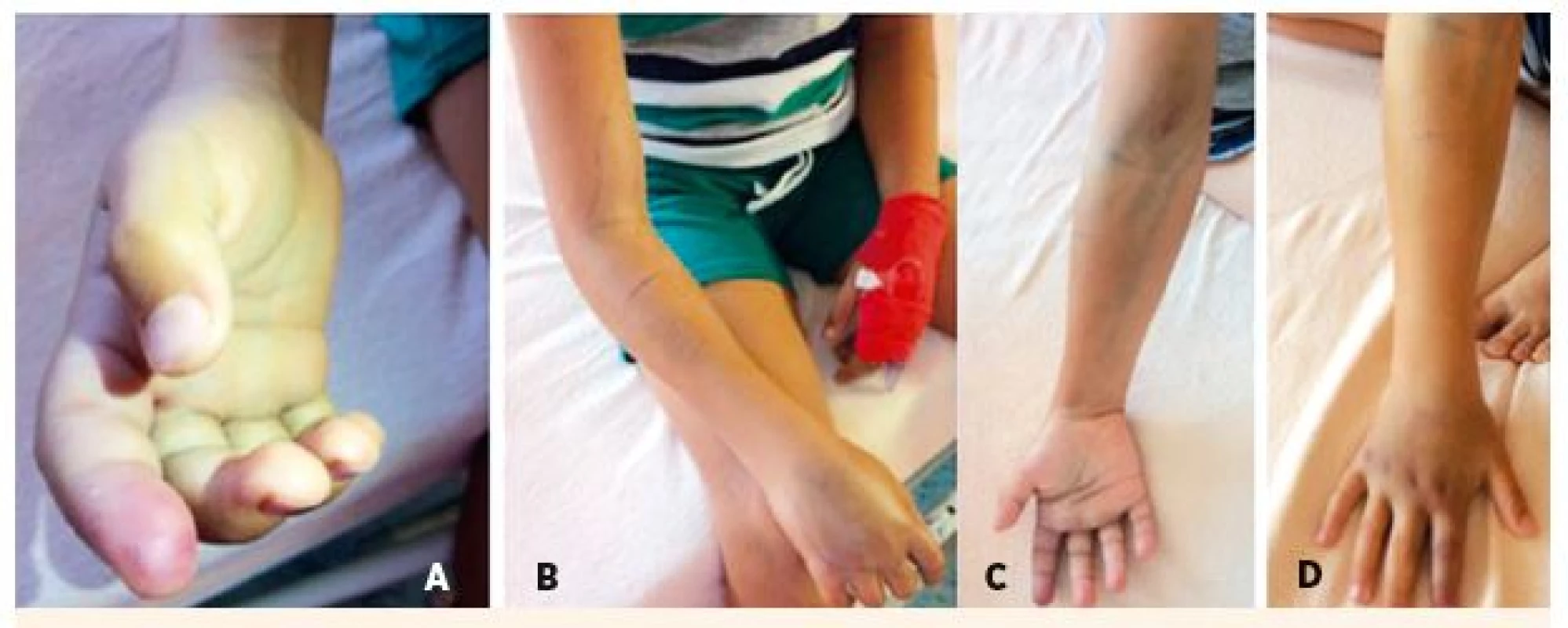
Dĺžka hospitalizácie 3 dni, rekonvalescencia ad integrum 6 dní, dĺžka liečby do 6 dní.
VÝSLEDKY
Pacienti s problematikou envenomácie sa v našich podmienkach vyskytujú sporadicky. Na pracovisku DFNsP Banská Bystrica v rokoch 2014–2015 neboli zaznamenané žiadne prípady, v roku 2016 dva prípady, v roku 2017 tri prípady. Pacienti s envenomáciami boli ošetrovaní v letných mesiacoch (jún – august).
V uvedených prípadoch išlo o lokálne príznaky s lokalizáciou uhryznutia na končatinách. Jeden-krát sa vyskytol extenzívny opuch v.s. po dvojnásobnej envenomácii. Za envenomácie lokalizované do horných končatín bol zodpovedný sám pacient – deti sa snažili vretenicu chytiť. Envenomácie s lokalizáciou do dolných končatín boli u detí, ktoré sa pohybo-vali v zarastených neprehľadných prírodných podmien-kach.
Dĺžka hospitalizácie u detí bola variabilná podľa závažnosti klinických príznakov a reakcie na podávanú liečbu, a to od 24 hodín až po 7 dní. Prepustenie bolo indikované až pri regresii klinických a laboratórnych príznakov (pokles obvodu sledovanej končatiny v cm, organizácia podkožných hematómov a sufúzií). U dvoch pacientov, kde sa postupovalo eskalačnou symptomatickou liečbou – podľa progresie príznakov, trvali príznaky, dľžka hospitalizácie aj liečba dlhšie. U troch pacientov, u ktorých sa postupovalo skorou deeskalačnou symptomatickou liečbou (včasná blokáda PLA2), sa dosiahli lepšie klinické výsledky, skrátila sa doba hospitalizácie aj celkovej liečby (tab. 2). Profylakticky sa antiedémová liečba ordinovala ešte do 72 hodín po ukončení hospitalizácie. Žiadne z detí sa po prepustení nevrátilo pre opätovné ťažkosti.
Tab. 2. Pacienti ošetrovaní v rokoch 2016–2017. 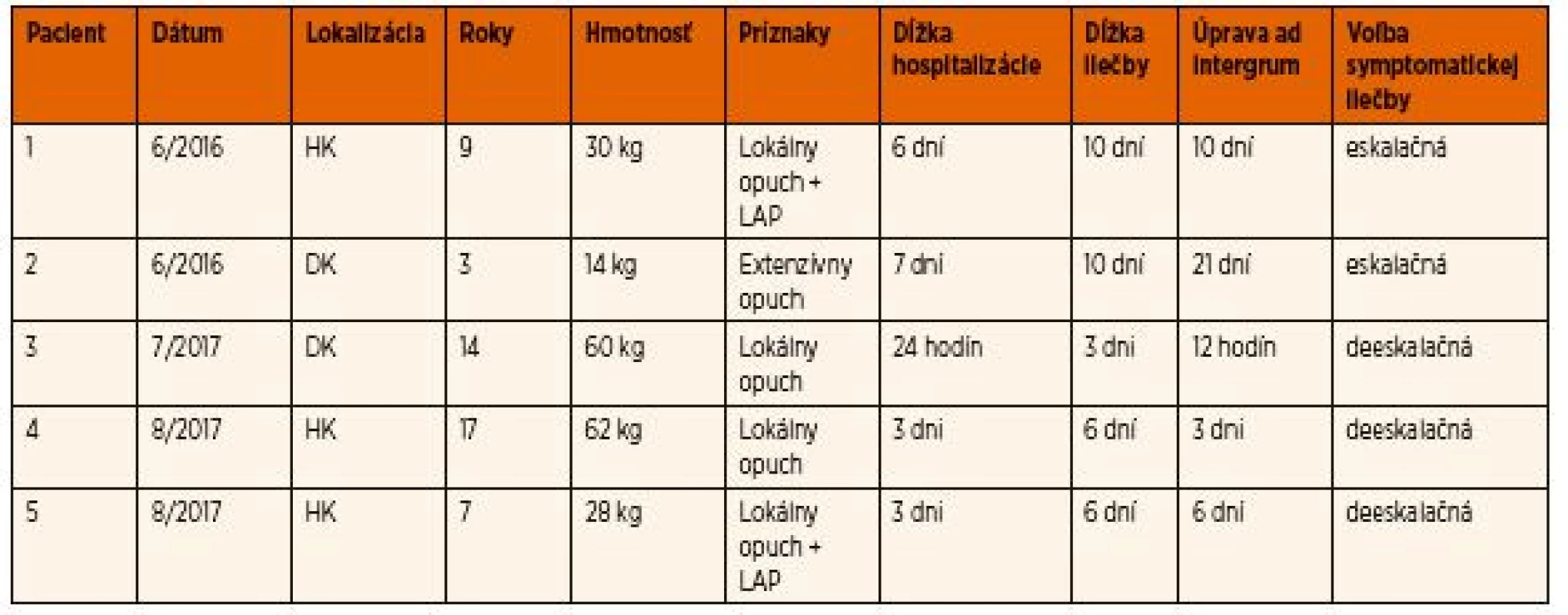
K podaniu antiséra sa terapeuticky nepristúpilo u žiad-neho dieťaťa. Antisérum je rezervované pre závažné stavy, alebo uhryznutie v kritických lokalizáciách. V minulosti bolo antisérum podávané nielen terapeuticky, ale aj profylakticky [5]. Pre riziko závažných adverzných reakcií sa od roku 2000 profylakticky nepodáva a terapeutické podanie na pracovisku DFNsP Banská Bystrica od roku 2000 zatiaľ nebolo indikované [5].
NOVÉ POZNATKY A MOŽNOSTI LIEČBY
Zámerne neuvádzam pokroky a nové možnosti terapie v štandardnej terapii. Následky uhryznutia hadom majú zatiaľ rozdielny geografický význam a nie sú identické účinky jedu Vipera berus vyskytujúcej sa v oblastiach strednej a severnej Európy a južnej Európy, kde majú aj neurotoxický potenciál. Uhryznutie hadom je hlavne epidémiou vidieckych tropických oblastí, kde každoročne postihuje viac ako 5 miliónov ľudí s evidenciou mortality 94 000/ročne [12]. Rôzne zdravotnícke organizácie zaradili problematiku do kategórie Zanedbávaných tropických chorôb a venujú potenciál k rozvoju nových možností terapie [39].
Vývoj antisér genetickou imunizáciou zvierat
Cieľom vývoja nových antisér je redukcia adverzných reakcií u polyvalentných antisér (u zvierat imunizovaných s použitím celého jedu). Zníženie imunogenicity antisér by malo znížiť imunizáciu voči antigénom (toxínom), ktoré nie sú vysokotoxické a zamerať sa na špecifické toxíny, najmä metaloproteinázy (SVMP) a neurotoxíny. Zviera sa imunizuje izolovanou DNA špecifických sekvencií. Špecifická imunizácia by mala viesť k redukcii podania veľkých objemov antisér, ktorá sa spája so zvýšeným rizikom vývoja adverzných reakcií [40].
Nové možnosti terapie inhibítormi toxických enzýmov
Nové možnosti terapie sú v tzv. malých molekulách – inhibítoroch enzýmov fosfolipázy A2, inhibítoroch metaloproteinázy závislej od zinku SVMPs a inhibítoroch serínových proteáz SVSPs. Zástupcom inhibítorov PLA2 je verespladib (aj aktívny metabolit methyl-varespladib) v II. fáze klinických štúdií, pôvodne vyvinutý na liečbu akútneho koronárneho syndrómu [39, 41]. Zástupcom inhibítorov metaloproteinázy závislej od zinku SVMPs sú batimastat – účinnejší pri inhibícii hemoragickej aktivity, a marimastat pri inhibícii fibrinolytickej aktivity [42]. Inhibítor serínových proteáz SVSPs – PIVL inhibuje adhéziu ľudských cievnych endotelových buniek a migráciu na fibrinogén a fibronektín spôsobom závislým od dávky [39, 41, 42].
Terapeutický potenciál toxínov hadieho jedu
Niektoré toxíny hadieho jedu majú veľký potenciál ako liečivá. Cytotoxíny jedu kobra majú protirakovinový potenciál a sú účinné v liečbe určitých typov leukémií: promyelocytárna leukémia, ľudský pľúcny adenokarcinóm [43]. PLA2 sa môže využiť na liečbu auto-imunitných porúch, ktoré sú spôsobené dysregulovanou endogénnou aktivitou PLA2. Metaloproteináza zá-vislá od zinku SVMPs môže byť navrhnutá na liečbu hlbokej žilovej trombózy a neurodegeneratívnych porúch [43].
Zoznam použitých skratiek
SSS (Snakebite Severity Score) – skóre závažnosti po uhryznutí hadom
WHO (World Health Organization) – Svetová zdravotnícka organizácia
NTIC – Národné toxikologické informačné centrum na Slovensku
PHK – pravá horná končatina
LD50 (Dosis letalis) –stredná smrteľná dávka, ktorá spôsobí úhyn 50 % testovaných živočíchov
TNFα – tumor nekrotizujúci faktor alfa
IL-1 – interleukín 1
IL-6 – interleukín 6
IL-10 – interleukín 10
IFNγ – interferón gama
DIC – diseminovaná intravaskulárna koagulácia
SVMPs (snake venoms metalloproteinases) – metaloproteináza hadieho jedu
SVSPs (snake venoms serin proteases) – serínové proteázy hadieho jedu
ATB –antibiotiká
Fc – fragment konštantnej časti ťažkých reťazcov imunoglobulínu
i.v. – intravenózne
i.m. – intramuskulárne
s.c. – subkutánne
ALT – alanínaminotransferáza
AST – aspartátaminotransferáza
PSCS (post-snakebite compartment syndrome) – kompartment syndróm po uhryznutí hadom
PLA2 – fosfolipáza A2
MUDr. Zuzana Podmanická
II. DK DFNsP
Nám. L. Svobodu 4
974 09 Banská Bystrica
Slovenská republika
e-mail: zuzana.podmanicka@dfnbb.sk
Zdroje
1. Chippaux JP. Epidemiology of snakebites in Europe: a systematic review of the literature. Toxicon 2012 Jan; 59 (1): 86–99.
2. Bátora I. Ako postupovať pri uhryznutí hadom. Int Med 2012; 12 (5): 208–211.
3. Valenta J. Co dělat při ušknutí zmijí obecnou. Int Med 2011; 13 (5): 222–224.
4. Kresánek J. Uhryznutie vretenicou. Lekárnik 2009; 14 (5): 50–51.
5. Dluholucký S, Králinský K, et al. Uhryznutie zmyjou u detí - niektoré kontroverzné otázky a vlastné skúsenosti. Čes-slov Pediat 2001; 56 (9): 438–442.
6. Daley BJ. Snakebite treatmens and management. 2017. [online]. http://emedicine.medscape.com/article/168828-treatment.
7. Swaroop S, Grab B. Snakebite mortality in the world. Bull World Health Organ 1954; 10 (1): 35–76.
8. World Health Organization: Progress in the characterization of venoms and standardization of antivenoms. 58th ed. Geneva: WHO Offset Publication, 1981.
9. Rifaie F, Maharani T, Hamidy A. Where did venomous snakes strike? A Spatial statistical analysis of snakebite cases in Bondowoso regency, Indonesia. HAYATI Journal of Biosciences 2017; 24 (3): 142–148.
10. Bochner R. The international view of envenoming in Brazil: myths and realities. J Venom Anim Toxins Incl Trop Dis 2013; 19( 29): 1–10.
11. Thapar R, Darshan BB, Unnikrishnan B, et al. Clinico-epidemiological profile of snakebite cases admitted in a tertiary care centre in south India: A 5 years study. Toxicol Int 2015; 22 (1): 66–70.
12. Chippaux JP. Snake-bites: appraisal of the global situation. Bull World Health Organ 1998, 76 (5): 515–524. [online] http://www.snakebiteinitiative.org/?page_id=657.
13. Babuj A. Snakebite management. 2015 [online] https://www.slideshare.net/9489649295/snake-bite-management-43980824.
14. Malina T, Babocsay G, Krecsák L, Erdész C. Further clinical evidence for the existence of neurotoxicity in a population of the european adder (Vipera berus berus) in eastern Hungary: second authenticated case. Wilderness Environ Med 2013; 24 (4): 378–383.
15. Malina T, Krecsák L, Jelić D, et al. First clinical experiences about the neurotoxic envenomings inflicted by lowland populations of the Balkan adder, Vipera berus bosniensis. Neurotoxicology 2011; 32 (1): 68–74.
16. De Haro L, Robbe-Vincent A, Saliou B, et al. Unusual neurotoxic envenomations by Vipera aspis aspis snakes in France. Hum Exp Toxicol 2002; 21 (3): 137–145.
17. Ried HA. Adder bites in Britain. Br Med J 1976; 2 (6028): 153–156.
18. Valenta J, Strach Z, Stříteský M, Michálek P. Common viper bites in the Czech Republic – epidemiological and clinical aspects during 15 year period (1999–2013). Prague Med Rep 2014; 115 (3–4): 120–127.
19. Batora I. Uhryznutie vretenicou na Slovensku [online]. Osobitné sdelenie, 4. júla 2018.
20. Chippaux JP. Epidemiology of snakebites in Europe: a systematic review of the literature. Toxicon 2012 Jan; 59 (1): 86–99.
21. Calderón L, Lomonte B, Gutiérrez JM, et al. Biological and biochemical activities of Vipera berus (European viper) venom. Toxicon 1993; 31 (6): 743–753.
22. Czajka U, Wiatrzyk A, Lutyńska A. Mechanism of Vipera berus venom activity and the principles of antivenom administration in treatment. Przegl Epidemiol 2013; 67 (4): 641–646.
23. Gutiérrez JM. Review: Hemorrhage caused by snake venom metalloproteinases: A journey of discovery and understanding. Toxins 2016; 8 (4): 93.
24. Fatima LD, Fatah C. Pathophysiological and pharmacological effects of snake venom components: molecular targets. J Clin Toxicol 2014; 4 (2): 1–9.
25. Valenta J. Terapie ušknutí zmijí obecnou u dětí. Pediatr praxi 2010; 11 (3): 201–203.
26. Santrock D. Crotalide polyvalent antivenin (CroFab) protocol, [online]. http://www.hosp.uky.edu/pharmacy/formulary/criteria/Crotalidae_Polyvalent_Antivenin_Protocol.pdf 2008.
27. Snakebite Treatment First Aid & Emergencies. WebMD. [online]. https://www.webmd.com/first-aid/snakebite-treatment.
28. Reimers AR, Weber M, Müller UR. Are anaphylactic reactions to snake bites immunoglobulin E-mediated? Clin Exp Allergy 2000; 30 (2): 276–282.
29. Gwaltney-Brant SM. Overview of snakebite. MSD manual veterinary manual. [online]. https://www.msdvetmanual.com/toxicology/snakebite/overview-of-snakebite.
30. Gutiérrez JM, Theakston RDG, Warrell DA. Confronting the neglected problem of snake bite envenoming: the need for a global partnership. Eglested Disease, 2006 June.
31. De Silva HA, Ryan NM, De Silva HJ. Adverse reactions to snake antivenom, and their prevention and treatment. Br J Clin Pharmacol 2016; 81 (3): 446–452.
32. Viper venom antitoxin. [online]. file:///C:/Users/zpodmanicka/Downloads/viper-venom-antitoxin-spc%20(2).pdf.
33. Lepak MR, Bochenek SH, Bush SP. Severe adverse drug reaction following crotalidae polyvalent immune Fab (Ovine). Annals of Pharmacotherapy 2015; 49 (1): 145–149.
34. Casewell NR, Al-Abdulla I, Smith D, et al. Immunological cross-reactivity and neutralisation of European viper venoms with the monospecific Vipera berus antivenom ViperaTAb. Toxins (Basel) 2014; 6 (8): 2471–2482.
35. Brvar M, Kurtović T, Grenc D, et al. Vipera ammodytes bites treated with antivenom ViperaTAb: a case series with pharmacokinetic evaluation. Clin Toxicol (Phila) 2017; 55 (4): 241–248.
36. Gold BS, Barish RA, Dart RC, et al. Resolution of compartment syndrome after rattle snake envenomation utilizing non-invasive measures. J Emerg Med 2003; 24 (3): 285–288.
37. Korambayil PM, Ambookan PV, Abraham SV, et al. A multidisciplinary approach with hyperbaric oxygen therapy improve outcome in snake bite injuries. Toxicol Int 2015; 22 (1): 104–109.
38. Hsu CP, Chuang JF, Hsu YP, et al. Predictors of the development of post-snakebite compartment syndrome. Scand J Trauma Resusc Emerg Med 2015; 23 (97): 1–7.
39. Knudsen C, Laustsen AH. Recent advances in next generation snakebite antivenoms. Trop Med Infect Dis 2018; 3 (42): 1–13.
40. Ramos HR, Ho PL. Developing snake antivenom sera by genetic immunization: a review. In: Gopalakrishnakone P, et al. Clinical Toxinology in Asia Pacific and Africa. Dordrecht : Springer Reference, 2015 : 401–414.
41. Lewin M, Samuel S, Merkel J, Bickler P. Varespladib (LY315920) appears to be a potent, broad - spectrum, inhibitor of snake venom phospholipase A2 and a possible pre-referral treatment for envenomation. Toxins (Basel) 2016; 8 (9): 1–16.
42 Morjen M, Honoré S, Bazaa A, et al. PIVL, a snake venom Kunitz-type serine protease inhibitor, inhibits in vitro and in vivo angiogenesis. Microvasc Res 2014; 95 (1): 149–156.
43. Gasanov SE, Dagda RK, Rae ED. Snake venom cytotoxins, phospholipase A2s, and Zn2+ - dependent metalloproteinases: mechanisms of action and pharmacological relevance. J Clin Toxicol 2014; 4 (1): 1–34.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2018 Číslo 5- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Editorial: Přesahy dětské kardiologie
- Prenatální detekce srdečních vad a její důsledky
- Screening rizika náhlé srdeční smrti v dětském věku – mýtus nebo realita?
- Manažment pacientov s rizikom náhlej kardiálnej smrti
- Výskyt vrozených srdečních vad – dopad prenatální diagnostiky
- Nespokojenost žen s vlastním tělem v třetím trimestru těhotenství
- Mentální anorexie s raným začátkem, diagnostika a terapie
- Turnerův syndrom a anomálie aortálního oblouku čtyřikrát jinak
- Lokálne reakcie po uhryznutí hadom – klinické skúsenosti
- Vzpomínka na MUDr. Františka Brzobohatého, emeritního primáře dětského oddělení Oblastní nemocnice Kolín
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Mentální anorexie s raným začátkem, diagnostika a terapie
- Výskyt vrozených srdečních vad – dopad prenatální diagnostiky
- Prenatální detekce srdečních vad a její důsledky
- Lokálne reakcie po uhryznutí hadom – klinické skúsenosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



