-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Akútne poškodenie obličiek (AKI) u detí – liečba a prognóza
Acute Injury in Children – Therapy and Prognosis
Authors of this review summarize current treatment modalities and prognosis of acute kidney injury in children.
Key words:
acute kidney injury, children, therapy, prognosis
Autoři: M. Mráz; Ľ. Podracká
Působiště autorů: prednostka prof. MUDr. Ľ. Podracká, CSc. ; I. Klinika detí a dorastu LF UPJŠ a DFN, Košice
Vyšlo v časopise: Čes-slov Pediat 2010; 65 (3): 132-140.
Kategorie: Postgraduální vzdělávání
Souhrn
Autori prinášajú aktuálny pohľad na liečbu a prognózu akútneho poškodenia obličiek v detskom veku.
Kľúčové slová:
Na (mmol) = [140 – aktuálna koncentrácia
akútne poškodenie obličiek, deti, liečba, prognóza
Na (mmol/l)] x hmotnosť (kg) x 0,6Menej častou iónovou poruchou pri AKI je hypernatriémia (Na ≥150 mmol/l). Vzniká najčastejšie ako dôsledok retencie sodíka alebo deplécie vody. U euvolemických detí sa pri hypernatriémii podáva furosemid v dávke 1–5 mg/kg i.v. Insenzibilné straty tekutín sa hradia polovičným fyziologickým roztokom. Rýchlosť poklesu nátria pri liečbe nesmie prekročiť 2 mmol/l/hod., inak hrozí edém mozgu. V prípadoch závažnej dysnatriémie nereagujúcej na konzervatívnu liečbu je indikovaná akútna eliminačná liečba.
Porucha glomerulovej filtrácie pri AKI môže byť spojená s retenciou fosforu a sekundárnou hypokalciémiou, ktorá pri súčasnej hyperkaliémii provokuje dysrytmie až zástavu srdca [1]. K ďalšiemu prehĺbeniu hypokalciémie u detí s AKI vedie podávanie furosemidu. V prípade závažnej hypokalciémie sa preto odporúča podať Ca-gluconicum intravenózne [2]. K úprave hypokalciémie vedie aj podávanie (kalciových) viazačov fosforu s jedlom a obmedzenie príjmu fosforu v strave. Definitívnou možnosťou korekcie porúch kalcium-fosforového metabolizmu pri AKI je akútna eliminačná liečba.
2.3.2 Poruchy acidobázickej rovnováhy
Základnou poruchou acidobázickej rovnováhy spojenou s AKI je metabolická acidóza (MAC), ktorá je dôsledkom poruchy vylučovania vodíkových katiónov obličkami. Korekciu intravenózne podaným bikarbonátom vyžaduje iba závažná MAC s hodnotou artériového pH <7,2 alebo koncentráciou bikarbonátov <16 mmol/l [2].
Množstvo bikarbonátu (mmol) potrebné na korekciu MAC sa vypočíta podľa vzorca:
Deficit bikarbonátu (mmol) = 0,3 x hmotnosť (kg)
x base excess (BE)1 mmol bikarbonátu = 2 ml 4,2% Na-Bic
Bikarbonát sa podáva postupne (jedna tretina z vypočítaného množstva v priebehu prvých 8 hodín), pre riziko objemového preťaženia dieťaťa, možný rozvoj hypernatriémie (4,2% Na-bikarbonát obsahuje 500 mmol Na/l) a potenciálne zhoršenie intracelulárnej acidózy. Alternatívnym postupom je perorálne podanie bikarbonátu v empirickej dávke 1–2 mmol/kg/deň u dojčiat alebo 70 mmol/m2/deň u starších detí, v 2–4 dávkach [1]. U pacientov so súčasne prítomnou hypokalciémiou je ešte pred úpravou MAC bikarbonátom potrebné aplikovať Ca-gluconicum ako prevenciu prehĺbenia deficitu ionizovaného kalcia a rozvoja tetánie [2].
2.4 Kontrola krvného tlaku
Častým sprievodným znakom AKI je volumová hypertenzia vznikajúca na podklade objemového preťaženia dieťaťa pri oligoanúrii. Najčastejšie sprevádza renálne príčiny AKI – akútnu glomerulonefritídu a HUS [8]. Od volumovej hypertenzie je potrebné odlíšiť kompenzačné zvýšenie krvného tlaku s chladnou perifériou vznikajúce na podklade reflexnej vazokonstrikcie pri hypovolémii (aktivácia systému renín-angiotenzín-aldosterón) [1].
Základným režimovým opatrením v liečbe hypertenzie sprevádzajúcej AKI je obmedzenie príjmu tekutín a nátria [8]. Ak pri klinicky závažnej hypertenzii nedôjde k zvýšeniu diurézy ani po intravenóznom podaní furosemidu, aplikuje sa nifedipín v maximálnej dennej dávke 3 mg/kg [1]. Hypertenzná kríza s klinickými prejavmi encefalopatie (cefalea, vracanie, porucha vedomia, kŕče) je indikáciou na kontinuálne intravenózne podanie nitroprusidu sodného (0,5–10 μg/kg/min.). Liečivo je pre jeho nestabilitu potrebné chrániť pred svetlom a pri dlhšom podávaní (hodiny) monitorovať koncentráciu tiokyanátu v sére, čo je zvlášť dôležité u pacientov s poruchou obličkových funkcií (preventívnym opatrením brániacim rozvoju kyanidovej toxicity metabolitov nitroprusidu sodného je súčasné podávanie tiosulfátu sodného). Intravenózna aplikácia urapidilu (25 mg s možným opakovaním dávky pri nezlepšení stavu po 5 minútach) si pri hypertenznej kríze vyžaduje zvýšenú opatrnosť, nakoľko liečivo môže pre svoj sedatívny účinok modifikovať príznaky hypertenznej encefalopatie [2, 8]. Pokles krvného tlaku v priebehu prvých 24 hodín liečby hypertenznej krízy by nemal prekročiť 25 % oproti prvej nameranej hodnote. V prípadoch, ak závažná hypertenzia pretrváva aj napriek intenzívnej medikamentóznej liečbe, je indikovaná akútna eliminácia.
V skupine kriticky chorých detí s AKI (zvyčajne pri sepse) je častá závažná hemodynamická nestabilita s hypotenziou vyžadujúca kontinuálnu podporu vazopresormi a inotropne aktívnymi látkami (noradrenalín, dopamín). U hemodynamicky nestabilných pacientov možno v prípade potreby využiť kontinuálne eliminačné metódy liečby.
2.5 Nutričná podpora
Dôležitou súčasťou terapie AKI je zabezpečenie dostatočného nutričného príjmu dieťaťa. Uprednostňuje sa perorálny alebo enterálny príjem (sondou) s cieľom dodania dostatočného množstva energie vo forme sacharidov, esenciálnych aminokyselín a nenasýtených mastných kyselín. Denné množstvo prijatých bielkovín nemá presiahnuť 0,6 g/kg telesnej hmotnosti. Preferujú sa bielkoviny rastlinného pôvodu. Ani po zlepšení klinického stavu a úprave laboratórnych parametrov sa neodporúča prekračovať dávku 0,8–1 g bielkovín/kg/deň [9]. V spektre tukov sa uprednostňujú nenasýtené mastné kyseliny [9].
U kriticky chorých detí a detí neschopných enterálneho príjmu sa výživa podáva parenterálnou cestou [1]. Zvýšenú pozornosť je potrebné venovať obsahu nátria, kália a fosforu v aplikovanej formule [2, 8]. Súčasne je potrebné zabezpečiť zvýšený kalorický príjem dieťaťa s adekvátnym obsahom glukózy, esenciálnych aminokyselín, proteínov (0,5–2 g/kg/deň v závislosti od hmotnosti a koncentrácie urey), lipidov (2 g/kg/deň) a stopových prvkov [1, 2, 9]. Najvyššie nároky na príjem proteínov majú deti liečené peritoneálnou dialýzou (1–3 g/kg/deň) [1]. Pri oligoanúrii je podanie dostatočného množstva výživy a tekutín limitované – riešením je akútna eliminačná liečba, ktorá ultrafiltráciou zabezpečí potrebnú objemovú rezervu. Kvalitatívne a kvantitatívne vyvážená nutričná podpora pri AKI minimalizuje akumuláciu dusíkatých katabolitov, prispieva k stabilite vnútorného prostredia a vedie k rýchlejšej rekonvalescencii dieťaťa s AKI [1, 9].
3. Eliminačné metódy v liečbe akútneho poškodenia obličiek u detí
V závažných, inak nezvládnuteľných prípadoch AKI je potrebné konzervatívne terapeutické armentárium rozšíriť o akútnu eliminačnú liečbu. Jej indikácie sumarizuje tabuľka 2.
Tab. 1. Indikácie akútnej eliminačnej liečby u detí [2, 3, 10, 11]. ![Indikácie akútnej eliminačnej liečby u detí [2, 3, 10, 11].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/c078cb6292a3fee0877ac63ffd181526.png)
U detí s AKI možno využiť tri základné terapeutické modality – peritoneálnu dialýzu (PD), hemodialýzu (HD) a kontinuálne eliminačné metódy (CRRT). Ich hlavné výhody a nevýhody sumarizuje tabuľka 3. V indikovaných prípadoch (atypický hemolyticko-uremický syndróm) sa u detí okrem akútnej eliminácie využíva aj plazmaferéza [12].
Tab. 2. Výhody a nevýhody jednotlivých akútnych eliminačných metód [1]. ![Výhody a nevýhody jednotlivých akútnych eliminačných metód [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/a66371bc00bb1303973248e8091b7512.png)
PD – peritoneálna dialýza, HD – hemodialýza, CRRT – kontinuálne eliminačné metódy Nadradenosť ani jednej z akútnych eliminačných metód vo vzťahu k prežívaniu detských ani dospelých pacientov s AKI nebola doposiaľ potvrdená v žiadnej z publikovaných štúdií [8]. Rozhodnutie o indikácii konkrétnej modality sa posudzuje prísne individuálne. Vzhľadom na vysokú mortalitu najzávažnejších foriem AKI je však potrebné liečbu akútnymi eliminačnými metódami aplikovať včas (urea <27 mmol/l, kreatinín <380 μmol/l) a vyvarovať sa rozvoju závažného tekutinového preťaženia (>10–15% nárast hmotnosti pacienta od prijatia) [3, 6, 7].
3.1 Peritoneálna dialýza
Peritoneálna dialýza (PD) je tradičná, jednoduchá a dobre prepracovaná akútna eliminačná metóda u detí. Jej hlavnou výhodou je možnosť aplikácie vo všetkých vekových skupinách pacientov, bez ohľadu na stav cirkulácie a potrebu cievneho prístupu a heparinizácie. U novorodencov a dojčiat s problematickým cievnym prístupom je PD často jedinou možnosťou eliminačnej liečby AKI. PD by sa nemala používať u detí s vrodenými poruchami metabolizmu a intoxikáciami (pomalý klírens solútov) a u pacientov so závažným pľúcnym edémom alebo defektmi bránice (diafragmatická hernia) pre možné zhoršenie kardiopulmonálnej kompenzácie [1, 2].
Princípom PD je jednoduchá difúzia solútov cez semipermeabilné peritoneum do dialyzačného roztoku. Požadovanú ultrafiltráciu zabezpečuje suprafyziologická koncentrácia glukózy v dialyzačnom roztoku (osmotický princíp). Vzhľadom na vysoké straty bielkovín je počas PD potrebné zvýšiť ich denný príjem v podávanej (par)enterálnej výžive. Súčasne je potrebné sledovať koncentráciu fosforu, ktorý nie je súčasťou roztokov na peritoneálnu dialýzu a v prípade potreby ho dieťaťu s AKI substituovať. U detí so závažnou malnutríciou alebo vyhliadkou dlhšej dialyzačnej liečby sú dostupné špeciálne roztoky so zvýšeným obsahom aminokyselín [13].
PD sa v akútnych indikáciách realizuje automaticky, prostredníctvom cyclera (kontinuálna cyklická peritoneálna dialýza, CCPD), na ktorý sa dieťa napája po niekoľkých krátkych manuálnych výmenách. Kontinuálny 24-hodinový cycling sa v úvode realizuje malým množstvom dialyzačného roztoku (10 ml/kg/napúšťanie). Podľa tolerancie a klinického stavu dieťaťa sa náplň postupne zvyšuje až na 40 ml/kg/napúšťanie. Dĺžka pôsobenia je krátka, pohybuje sa v rozmedzí 20–40 minút, za stáleho monitoringu tekutinovej bilancie a vnútorného prostredia dieťaťa. Kratšie cykly zabezpečujú vyššiu ultrafiltráciu a klírens urey, pri cykloch s dlhším ekvilibriom sa zvyšuje klírens kreatinínu a fosforu. Klírens solútov pri PD je vždy podstatne nižší v porovnaní s hemodialýzou (klírens kreatinínu dosiahnutý po 4-hodinovej HD je ekvivalentný klírensu kreatinínu pri 24-hodinovej PD) [14].
Najčastejšie komplikácie PD sú mechanické – súvisia s presakovaním dialyzačného roztoku v mieste inzercie peritoneálneho katétra. Najzávažnejšou komplikáciou PD je peritonitída, deťom so zavedeným peritoneálnym katétrom sa preto preventívne podávajú antibiotiká parenterálnou cestou (najčastejšie cefalosporíny 1. generácie).
3.2 Hemodialýza
HD je najefektívnejšia akútna eliminačná modalita vo vzťahu ku klírensu solútov (difúzia po koncentračnom gradiente z krvi, cez membránu dialyzátora, do dialyzačného roztoku). Metóda súčasne umožňuje rýchlu a presnú ultrafiltráciu vody. Udržanie adekvátneho volumového statusu u oligoanurických detí s AKI je dôležité vo vzťahu k ich klinickému stavu (prevencia rozvoja edémov, kontrola krvného tlaku), ordinovanej liečbe (možnosť podania adekvátneho množstva solútov, výživy, liekov a transfúznych prípravkov) a ďalšej prognóze (vysoká mortalita detí s hyperhydratáciou). Hlavnou nevýhodou HD je potreba cievneho prístupu, ktorý je problematický predovšetkým u dojčiat a malých detí. Ďalším limitujúcim faktorom v tejto vekovej skupine pacientov je možný rozvoj závažnej cirkulačnej nestability súvisiacej s prítomnosťou veľkého extrakorporálneho objemu krvi pri nízkej hmotnosti pacienta alebo základnej diagnóze (kardiochirurgické operácie, sepsa). V skupine cirkulačne stabilných detí je však HD zlatým štandardom spomedzi všetkých eliminačných metód liečby AKI. Všetky deti liečené HD musia byť schopné transportu na dialyzačnú jednotku.
Akútna HD sa realizuje po kanylácii centrálnej žily (v. subclavia, v. femoralis) pomocou dvojlumenového dialyzačného katétra (8 F u detí do 30 kg, 11 F u detí nad 30 kg) [2]. Prietok krvi pri akútnej HD dosahuje 2–8 ml/kg/min., prietok dialyzátu je 500–800 ml/min. [2]. Heparinizácia je individuálna, v závislosti od aktuálneho stavu hemokoagulácie pacienta (bolus heparínu 5–50 U/kg, polovičná dávka bolusu kontinuálne). APTT sa pri adekvátnej heparinizácii pohybuje v rozmedzí 60–90 sekúnd. Účinok heparínu možno v prípade potreby neutralizovať intravenóznou aplikáciou protamínu. Pri vysokom riziku krvácania (kardiochirurgické operácie, sepsa) sa uprednostňuje bezheparínová dialýza.
Dĺžka trvania akútnej HD je zvyčajne 4 hodiny s frekvenciou 1x denne. U detí s plazmatickou koncentráciou urey >40 mmol/l je trvanie HD najviac 90–120 minút kvôli vysokému riziku rozvoja dysekvilibria a edému mozgu. V takýchto prípadoch je nutná okamžitá intravenózna aplikácia manitolu (1 g/kg) [1]. Dlhšie trvanie HD (zvyčajne 6–12 hodín) s nižšími aplikovanými prietokmi krvi a dialyzačného roztoku (200, resp. 100 ml/min.) sa označuje ako SLED (sustained low-efficiency dialysis) a patrí medzi hybridné techniky spájajúce v sebe výhody intermitentných a kontinuálnych eliminačných metód.
Najčastejšou komplikáciou v priebehu HD je hypotenzia, pri ktorej sa aplikuje bolus fyziologického roztoku (5 ml/kg) priamo do hemodialyzačného setu spolu s úpravou polohy pacienta.
3.3 Kontinuálne eliminačné metódy
CRRT sú v súčasnosti zlatým štandardom liečby AKI v skupine kriticky chorých, hemodynamicky nestabilných detí, ktoré nemôžu podstúpiť HD (obr. 1 a 2). V priebehu uplynulých 30 rokov sa CRRT úplne transformovali z pôvodne artério-venóznych techník s množstvom lokálnych cievnych komplikácií na moderné, softvérom prístroja riadené a kontrolované veno-venózne metodiky využívané v súčasnosti [15].
Obr. 1. CVVHD (kontinuálna veno-venózna hemodialýza) u kriticky chorého dieťaťa. Fig. 1. CVVHD in critically ill patient. 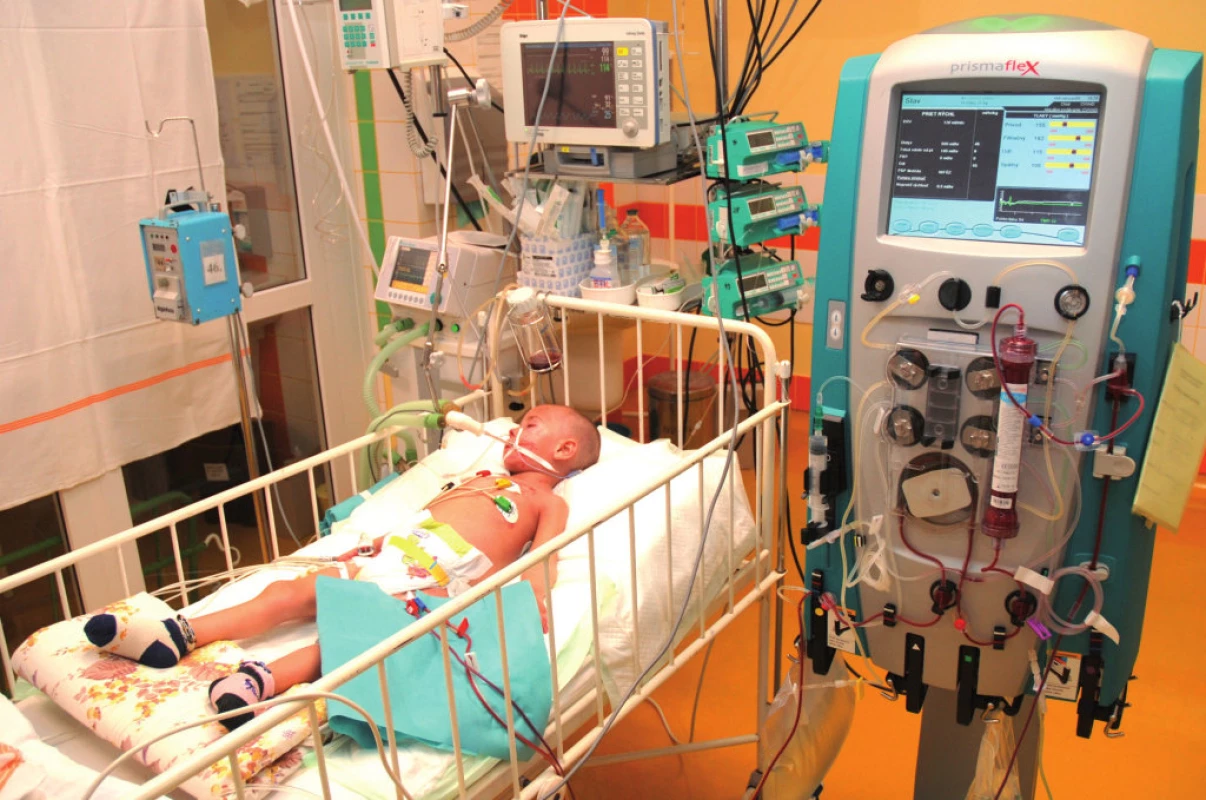
Obr. 2. CVVHDF (kontinuálna veno-venózna hemodiafiltrácia) u kriticky chorého dieťaťa. Fig. 2. CVVHDF in critically ill patient. 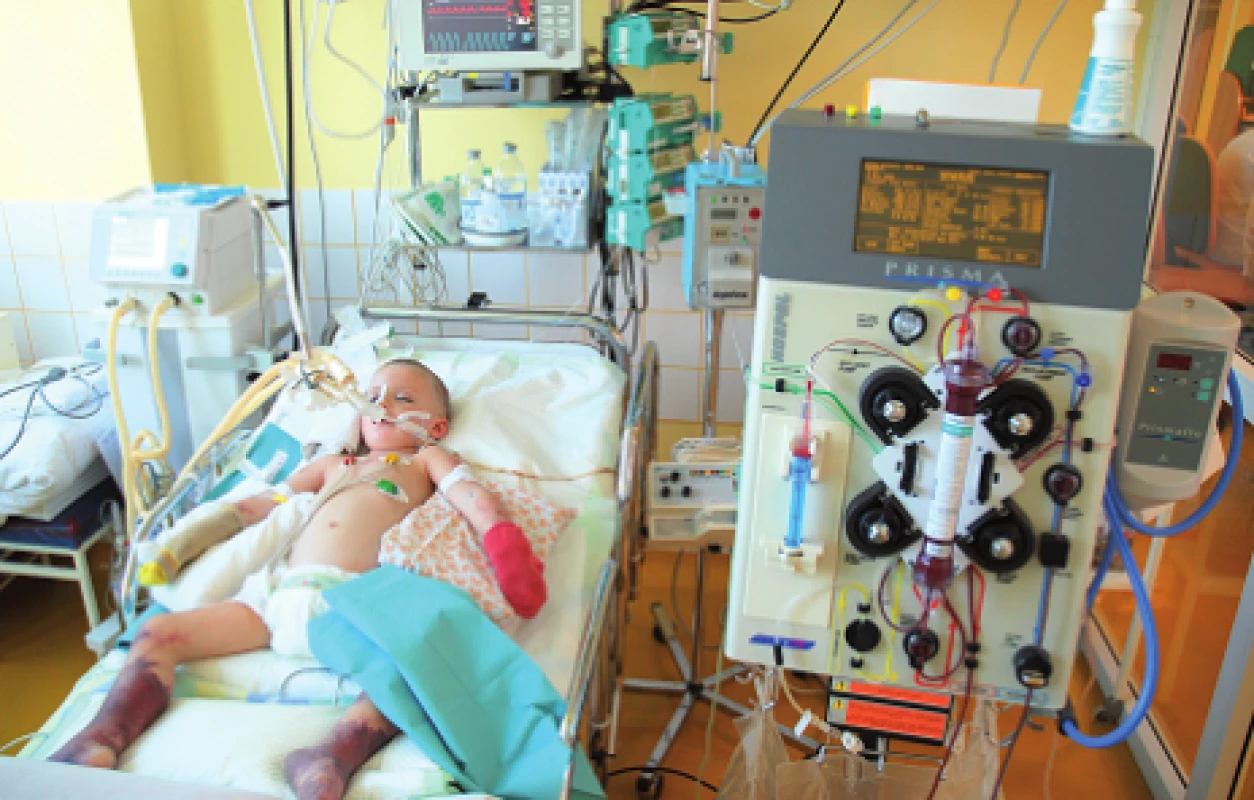
V praxi sa využívajú tri modality CRRT:
- Kontinuálna veno-venózna hemofiltrácia (CVVH)
- Kontinuálna veno-venózna hemodialýza (CVVHD)
- Kontinuálna veno-venózna hemodiafiltrácia (CVVHDF)
U detí s objemovým preťažením bez potreby eliminácie uremických toxínov a solútov možno realizovať pomalú kontinuálnu ultrafiltráciu (SCUF) pracujúcu na jednoduchom princípe ultrafiltrácie vody (až 8000 ml/hod.). Pomocou prístroja na CRRT je v indikovaných prípadoch možné vykonať aj terapeutickú výmenu plazmy (napr. atypický HUS). Jedným z mála obmedzení využitia CRRT v pediatrii je problematický cievny prístup u malých detí (novorodenci, dojčatá). Heparinizáciu potrebnú pre normálny chod týchto metodík možno u detí s vysokým rizikom krvácania (rozvinutá sepsa, stavy po veľkých operačných výkonoch) nahradiť regionálnou citrátovou antikoaguláciou s monitorovaním koncentrácie ionizovaného kalcia v krvi pacienta a jeho substitúciou intravenóznou cestou.
Využitie CRRT predpokladá adekvátne prístrojové a personálne vybavenie, odvďačí sa však výbornou kontrolou uremických parametrov a tekutinovej bilancie v čase (životnosť jedného setu môže byť až 48 hodín). Prístup na akútnu elimináciu pomocou CRRT sa zabezpečuje kanyláciou centrálnej žily dvojlumenovým dialyzačným katétrom, rovnako ako pri HD. Prietok krvi pri CCRT dosahuje 5–10 ml/kg/min., prietok substitučného roztoku (CVVH), dialyzátu (CVVHD) alebo oboch súčasne (CVVHDF) je 2000 ml/1,73 m2/min. (ekvivalent dávky 35 ml/kg/hod. odporúčanej u dospelých pacientov), čo je niekoľkonásobne menej ako pri intermitentnej HD [2].
Nakoľko preferencia ani jednej z CRRT metodík v liečbe AKI u hemodynamicky nestabilných detí vo vzťahu k ich prežívaniu nie je v súčasnosti podporená dôkazom adekvátnej sily, za najdôležitejší faktor efektívnej liečby sa považuje práve adekvátna aplikovaná dávka [8].
Hlavnou výhodou metodík pracujúcich na princípe konvekcie (CVVH) je eliminácia molekúl so strednou hmotnosťou (mediátory sepsy). Benefit takejto liečby vo vzťahu k prognóze a prežívaniu kriticky chorých pacientov s AKI sa však doposiaľ nepotvrdil. U detí so závažnou urémiou sa častejšie uprednostňujú metodiky pracujúce na princípe difúzie (CVVHD), kvôli rýchlejšej eliminácii látok s nízkou molekulovou hmotnosťou. Výhody eliminácie malých a stredných molekúl v sebe kombinuje CVVHDF.
Najčastejšou komplikáciou v priebehu CRRT je koagulácia vo filtri, ktorá limituje jeho životnosť. Pri prolongovanom trvaní CRRT u detí dochádza k poklesu telesnej teploty (dostupné sú ohrievacie telesá liniek setu), rozvoju hypofosfatémie a k poklesu koncentrácie aminokyselín a vitamínov v krvi dieťaťa.
4. Prognóza akútneho poškodenia obličiek u detí
Morbidita a mortalita detí s AKI priamo súvisí so stupňom poškodenia obličiek podľa klasifikácie pRIFLE. Najvyššiu mieru prežívania a dobrú renálnu prognózu majú pacienti so stupňom pRIFLE R. Prežívanie a prognóza pacientov s vyššími stupňami pRIFLE klesá. Trvalé poškodenie obličiek u detí po AKI s prechodom do terminálneho štádia chronickej obličkovej choroby (ESRD) – stupeň E, sa vyvinie asi v 10 % všetkých prípadov, a to častejšie u detí s glomerulovou (napr. atypický HUS) ako tubulárnou príčinou AKI, signifikantne častejšie u detí liečených intermitentnou HD ako CRRT, a tiež častejšie u detí s preexistujúcou CKD [16, 17]. Po epizóde AKI dochádza u všetkých detí k zániku istého množstva funkčných nefrónov a obličky môžu aj napriek úprave klinického stavu a laboratórnych parametrov pracovať na funkčnú rezervu [9]. Všetky deti po prekonanom AKI preto vyžadujú dlhodobé ambulantné sledovanie s pravidelným monitorovaním krvného tlaku a obličkových funkcií a vyšetrením močového sedimentu a kvantitatívnej proteinúrie.
K zlepšeniu nepriaznivej prognózy a k zníženiu stále vysokej mortality združenej s AKI u detí by v budúcnosti mohli viesť nasledujúce postupy:
- rozdelenie pacientov s akútnym poškodením obličiek podľa jednotlivých stupňov klasifikácie pRIFLE
- využitie nových močových biomarkerov vo včasnej diagnostike AKI (NGAL, KIM-1, IL-18)
- včasná a účinná liečba zachovávajúca primeranú perfúziu obličkovým parenchýmom a forsírujúca diurézu (fenoldopam)
- včasný začiatok akútnej eliminačnej liečby v skupine kriticky chorých detí s AKI
- prevencia iatrogénne navodeného tekutinového preťaženia pri oligoanúrii
MUDr. Martin Mráz, PhD.
I. Klinika detí a dorastu LF UPJŠ a DFN
Tr. SNP 1
040 11 Košice
Slovenská republika
e-mail: maciak23@hotmail.com
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Natálne a neonatálne zubyČlánek Laktózová intolerance
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2010 Číslo 3- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Chromozomálna štúdia u novorodencov v regióne Prešov (Slovensko)
- Oneskorený nástup puberty a znížený rast ako prvé príznaky Swyerovho syndrómu?
- Natálne a neonatálne zuby
- Laktózová intolerance
- Akútne poškodenie obličiek (AKI) u detí – liečba a prognóza
- Možnosti lázeňské léčby v Léčebně Dr. Filipa v Poděbradech
- Dětská psycholožka PhDr. Marie Nesrstová sedmdesátnicí!
- Životní jubileum MUDr. Petra Pešáka, primáře dětského oddělení Krajské nemocnice Tomáše Bati, a.s. Zlín
- XIV. kolokvium o dedičných metabolických poruchách
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Laktózová intolerance
- Akútne poškodenie obličiek (AKI) u detí – liečba a prognóza
- Oneskorený nástup puberty a znížený rast ako prvé príznaky Swyerovho syndrómu?
- Natálne a neonatálne zuby
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



