-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Inhalovaný oxid dusnatý v léčbě těžkého respiračního selhání dětí
Inhaled Nitric Oxide in Treatment of Severe Respiratory Failure in Children
Objective:
1) To assess impact of iNO on oxygenation and ventilation parameters during artificial lung ventilation (CMV a HFOV) in children with severe acute hypoxic respiratory failure. 2) To asses impact of iNO on ventilator settings. 3) To determine frequency of iNO complication. 4) To evaluate impact of iNO on children’s mortality.Design:
Prospective observational study.Setting:
Clinic of Pediatric Anesthesiology and Resuscitation, Faculty Hospital Brno and Clinic of Pediatric and Teen-age Medicine, General Faculty Hospital in Prague.Material and method:
All study participants met following criteria: Age between 28 days and 18 years, diagnosis of AHRF based on ARDS and protective CMV or HFOV failure. Exclusion of patients with congenital heart disease comorbidity was applied. All patients were treated according to ALI/ARDS protocol used in both before-mentioned departments since 1997. This protocol includes protective CMV (with optimized PEEP, recruitment manoeuvres and permissive hypercapnia), prone position, TGI, HFOV and iNO.Patients were divided into 6 groups:
With regard to iNO response – responders (improvement of PaO2/FiO2 for ≥20% within first 60 minutes after iNO administration) and non-responders (the others), with regard to type of artificial lung ventilation – CMV and HFOV and with regard to outcome – survivors and dead.In all cases following characteristics were recorded:
non-indexed parameters (demographic data, duration of hospitalization, ventilation and iNO, ARDS origin, primary diagnosis, PRISM score, outcome) and indexed parameters (NO concentration, pH, paCO2, paO2, HCO3-, AaDO2, PaO2/FiO2, OI, ventilator settings, iNO complication).
Indexed parameters were recorded in time 0 h (before iNO administration) and then in time 1, 6, 12, 24, 36, 48, 72 and 96 hr after iNO administration.Results:
A total number of 30 children was enrolled into study. All patients were admitted to two aforementioned departments from 1997 to 2007. There were no significant differences between responders and non-responders and children – CMV and HFOV in non-indexed parameters. Survivors compared with the deceased subjects had a longer period of hospitalization, less time spent on HFOV and had lower PRISM score.
Authors have demonstrated a positive effect of iNO on improvement of oxygenation ( ↓AaDO2, ↑paO2/FiO2, ↓OI against time 0 hr – before iNO deploying) from 6 to 36 hr in responders, survivors and HFOV. Any statistically significant improvement wasn’t recorded in non-responders, deceased and CMV. iNO has not improved ventilation and acidobasic parameters in any group of patients.
Responders and survivors have had better oxygenation parameters than non-responders and deceased. Children on HFOV have had worse oxygenation parameters than CMV, but with regard to dynamic of oxygenation parameters improvement, they have had better profit from iNO.
Authors haven’t proved impact of iNO on ventilator settings. During iNO administration they have recorded no complication. Mortality of children was 60% (18/30).Conclusion:
iNO has transient effect on improvement in oxygenation from 6 to 36 hr after iNO initiation in children. iNO has no significant impact on improvement of ventilating and acid basic parameters. There si no evidence that iNO affects ventilation settings neither CMV nor HFOV. There is low probability of complications using iNO up to 20 ppm. iNO does not influence mortality in children with AHRF.Key words:
nitric oxide, inhalation, acute respiratory failure, oxygenation, conventional mechanical ventilation (CMV), high frequency oscillatory ventilation (HFOV)
Autoři: L. Marek 1; V. Vobruba 2; P. Košut 1; P. Srnský 2; J. Žurek 1; L. Koudelková 1; L. Košinová 1; M. Fedora 1
Působiště autorů: Klinika dětské anesteziologie a resuscitace, Pracoviště dětské medicíny, Fakultní nemocnice Brno přednosta doc. MUDr. M. Fedora, PhD. 1; Jednotka intenzivní a resuscitační péče Kliniky dětského a dorostového lékařství Všeobecné fakultní nemocnice, Praha přednosta prof. MUDr. J. Zeman, DrSc. 2
Vyšlo v časopise: Čes-slov Pediat 2009; 64 (6): 283-295.
Kategorie: Původní práce
Souhrn
Cíl studie:
1) zhodnotit vliv iNO na oxygenační a ventilační parametry v průběhu UPV (CMV a HFOV) u dětí s těžkou respirační insuficiencí; 2) zhodnotit dopad iNO na nastavení UPV; 3) zhodnotit četnost komplikací iNO; 4) zhodnotit vliv iNO na mortalitu dětí.Typ studie:
Prospektivní observační studie.Název a sídlo pracoviště:
Klinika dětské anesteziologie a resuscitace Fakultní nemocnice Brno a Jednotka intenzivní a resuscitační péče Kliniky dětského a dorostového lékařství Všeobecné fakultní nemocnice v Praze.Materiál a metoda:
Do studie byli zařazeni pacienti (věk 28 dnů – 18 roků) s dg. hypoxického respiračního selhání na podkladě ARDS, u kterých selhaly protektivní CMV nebo HFOV. Vylučovacím kritériem byla USG potvrzená vrozená srdeční vada. Všichni pacienti byli léčeni podle protokolu ALI/ARDS používaného na obou výše zmíněných pracovištích od roku 1997. Protokol zahrnuje protektivní CMV (s optimalizovaným PEEP, recruitment manévry a s permisivní hyperkapnií), polohování pacienta (pronační poloha), TGI, HFOV a iNO.Pacienti byli rozděleni na 6 skupin:
podle odpovědi na iNO na „respondery“ (pacienti, u nichž došlo do 1 hodiny po nasazení iNO ke zlepšení PaO2/FiO2 o ≥20 %) a „non-respondery“ (ostatní pacienti), podle způsobu ventilace na „CMV“ a „HFOV“ a podle přežití na „zemřelé“ a „přeživší“.U všech pacientů byly zaznamenány:
neindexované parametry (demografické údaje, trvání hospitalizace, ventilace a iNO, původ ARDS, vstupní diagnóza, PRISM skóre, úmrtí) a indexované parametry (koncentrace NO, pH, paCO2, paO2, HCO3-, AaDO2, PaO2/FiO2, OI, parametry UPV, komplikace iNO). Indexované parametry byly zaznamenávány v čase 0 h (před nasazením iNO) a dále v časech 1, 6, 12, 24, 36, 48, 72 a 96 hodin po nasazení iNO.Výsledky:
Do studie bylo zařazeno 30 dětí hospitalizovaných na KDAR, FN Brno a na JIRP KDDL, VFN v Praze v letech 1997–2007. V neindexovaných parametrech nebyl mezi repondery a non-respondery a mezi dětmi na CMV a HFOV žádný významný rozdíl. Děti přeživší měly oproti zemřelým delší dobu hospitalizace, kratší dobu strávenou na HFOV a nižší PRISM skóre.
Autoři prokázali pozitivní vliv iNO na oxygenaci ( ↓AaDO2, ↑paO2/FiO2, ↓OI oproti hodnotám parametrů před nasazením iNO) mezi 6. a 36. hodinou ve skupinách respondeři, přeživší a HFOV. Žádné zlepšení nezaznamenali ve skupinách non-respondeři, zemřelí a CMV. V žádné ze skupin této studie iNO nezlepšoval ventilační parametry ani parametry ABR.
Respondeři a přeživší děti měli lepší oxygenační parametry než non-respondeři a zemřelé děti. Děti na HFOV měly horší oxygenační parametry než děti na CMV, ale z pohledu dynamiky zlepšení oxygenačních parametrů z inhalace iNO profitovaly více.
Autorům se nepodařilo prokázat vliv iNO na nastavení CMV ani HFOV. V průběhu iNO ve studii nezaznamenali žádné nežádoucí účinky iNO. Mortalita dětí byla 60 % (18/30).Závěr:
INO přechodně zlepšuje oxygenaci u dětí, a to mezi 6.–36. hodinou po nasazení. INO nemá vliv na ABR, ventilační parametry ani na nastavení UPV. V průběhu inhalace NO v koncentracích do 20 ppm je nízké riziko výskytu nežádoucích účinků. Inhalovaný oxid dusnatý neovlivňuje mortalitu dětí s AHRF.Klíčová slova:
oxid dusnatý, inhalace, akutní respirační selhání, oxygenace, konvenční mechanická ventilace (CMV), vysokofrekvenční oscilační ventilace (HFOV)Úvod
Stále dokonalejší schémata moderní konvenční mechanické plicní ventilace, která v sobě odrážejí současné pokročilé chápání patofyziologie respiračních poruch, provázená čím dál tím vyspělejším přístrojovým vybavením anesteziologicko-resuscitačních oddělení a jednotek intenzivní a resuscitační péče spolu s bohatšími zkušenostmi lékařů umožňují v porovnání s minulostí daleko úspěšnější zvládání širokého spektra plicních postižení bez nutnosti užití nekonvenčních metod, jako je vysokofrekvenční oscilační ventilace (HFOV), částečná tekutinová ventilace (PLV), celková tekutinová ventilace (TLV), extrakorporální membránová oxygenace (ECMO) apod., vyhrazených pouze několika málo superspecializovaným pracovištím.
Velmi sofistikované hybridní režimy umělé plicní ventilace jsou v současnosti již samozřejmou součástí moderních ventilátorů a v rukou zkušených odborníků jsou velmi silným nástrojem při zvládání většiny onemocnění postihujících respirační systém. I ty nejmodernější přístroje a postupy jsou však ve svých možnostech stále limitovány závažností postižení lokalizovaného na alveolokapilární úrovni. Tyto limity se projevují zejména v případech, kdy patologie významněji postihuje plicní vaskulární aparát a naše terapeutická snaha se soustředí na úrovni výměny plynů mezi alveolem a plicní kapilárou na stranu vaskulární, tedy na oblast, kterou nejsme schopni ovlivnit žádnou ventilační strategií.
Kromě léčby základního onemocnění a vhodného režimu protektivní ventilace je v těchto případech nezbytné farmakologické ovlivnění zvýšené plicní vaskulární rezistence. Jako nejideálnější se stále jeví použití inhalovaného oxidu dusnatého jako selektivního plicního vazodilatátoru. Bohužel ani takto vedená terapie vždy nesplní naše očekávání. Její účinek v některých případech selhává a my se tak setkáváme s případy pacientů, kterým nejsme přes veškerou naši snahu schopni pomoci.
Zde je náš dluh a pokračování naší cesty ve výzkumu a chápání patofyziologie plicních procesů a možností jejich ovlivnění.
Cíl práce
- Zhodnotit vliv iNO na oxygenační a ventilační parametry v průběhu UPV (CMV a HFOV) u dětí s těžkou respirační insuficiencí provázenou limitací plicní perfuze a distribuce.
- Zhodnotit dopad iNO na nastavení UPV ve smyslu snížení „agresivity“ ventilačního režimu (snižování FiO2, VT, PIP u CMV a FiO2 a Paw u HFOV).
- Zhodnotit četnost komplikací iNO (oběhová nestabilita, plicní edém, methemoglobinemie, netraumatické krvácení).
- Zhodnotit vliv iNO na mortalitu pacientů.
Soubor pacientů a metoda
Do studie byli zařazeni dětští pacienti (věk 28 dnů – 18 roků) s diagnózou těžkého hypoxického repiračního slehání (AHRF) na podkladě syndromu akutního respiračního selhání (ARDS) podle kritérií ACCP Consensus Conference z roku 1994 [1]: náhlý vznik, PaO2/FiO2 ≤200 mm Hg, bilaterální plicní infiltráty na RTG, PCWP ≤18 mm Hg nebo nepřítomnost levostranného srdečního selhání, u kterých selhaly protektivní CMV nebo HFOV, viz dále.
Vylučovacím kritériem studie byla USG prokázaná vrozená srdeční vada. Všichni pacienti byli léčeni podle protokolu ALI/ARDS [2] používaného na obou výše zmíněných pracovištích od roku 1997. Protokol zahrnuje protektivní konvenční mechanickou ventilaci (tlakově řízenou CMV s PEEP a recruitment manévry) s permisivní hyperkapnií, polohování pacienta – pronační polohu, aplikaci inhalovaného oxidu dusnatého (iNO), tracheální insuflaci vzduchu (TGI), vysokofrekvenční oscilační ventilaci (HFOV), parciální kapalinovou ventilaci (Partial Liquid Ventilation, PLV) a extrakorporální membránovou oxygenaci (ECMO). Strategie konvenční ventilace je založena na principech protektivní plicní ventilace a vychází z doporučení ACCP (American College of Chest Physicians) z roku 1994 [1].
Oxygenaci jsme ovlivňovali manipulací s FiO2 (do 0,6) a středním tlakem v dýchacích cestách (Paw), který jsme zvyšovali pomocí PEEP. Úvodní nastavení PEEP bylo nad 5 cmH2O a postupně byl zvyšován o 1 cmH2O, dokud nedošlo ke zvýšení compliance respiračního systému (nebylo dosaženo tlaku nad dolním inflekčním bodem). Kromě manipulace s PEEP byly k otevření atelektatických plicních oblastí prováděny otevírací (recruitment) manévry, „sigh“ ventilace, kdy je pacient čtyřikrát (po 15 minutách) během 1 hodiny ventilován třemi dechy s dechovým objemem 10 ml/kg a další 2 hodiny je nastavení CMV bez „sigh“.
Při PEEP nad 15 cmH2O a dále trvající hypoxemii (paO2 <10 kPa) byl upraven poměr inspiria k exspiriu na poměr 1 : 1 při snaze o co nejnižší možné FiO2. Při přetrvávající hypoxemii byla u pacientů oběhově stabilních bez kraniotraumatu (〈ICP) a nestabilních fraktur použita pronační poloha.
Ventilaci jsme prováděli dechovými objemy VT <7 ml/kg, PIP jsme limitovali hodnotou 30 cmH2O. Při nutnosti zvyšovat PEEP a při dosažení maximálního, námi limitovaného PIP (při snižování rozdílu tlaků v dýchacích cestách) byly tolerovány snižující se hodnoty dechového objemu blížící se 3 ml/kg při pH nad 7,20. Při vzestupu paCO2 >10 kPa a/nebo poklesu pH pod 7,20 byla aplikována tracheální insuflace vzduchu (TGI).
Indikací k přepojení pacienta z konvenční mechanické ventilace na nekonvenční vysokofrekvenční oscilační ventilaci byla nutnost použít FiO2 >0,6 a Paw >15 cmH2O k dosažení saturace periferní krve ≥90 % nebo přetrvávající hyperkapnie a/nebo acidóza při konvenční ventilaci s tracheální insuflací vzduchu.
Po přepojení z CMV na HFOV bylo základní nastavení Paw o 2–5 cm H2O vyšší než na konvenčním režimu bezprostředně před přepojením na HFOV. Následně byl Paw postupně zvyšován o 1 cmH2O až do okamžiku výrazného zlepšení saturace periferní krve (>97 %) a zároveň bylo možné snížit FiO2 na 0,6 a méně při zachování saturace nad 90 %.
Limitem zvyšování Paw byly známky hyperinflace plic (deprese kardiovaskulárního systému reprezentovaná známkami oběhové nestability nebo rozepětí plic nad 9. žebro podle RTG snímku).
V případech, kdy byl přítomen air-leak syndrom (pneumotorax, pneumomediastinum, pneumoperikard, intersticiální plicní emfyzém), byla manipulace s Paw poněkud odlišná. Po dosažení optimálního plicního objemu jsme snížili Paw o 1–2 cm H2O a tolerovali jsme zvýšení FiO2 nad 0,6 k dosažení saturace periferní krve >85 %, a to po přechodnou dobu (do 24 hodin), event. do resorpce air-leak.
Nastavení frekvence (f) je nepřímo úměrné hmotnosti pacienta. Kojenci měli úvodní f 10 Hz, batolata a menší děti 5–10 Hz a pacienti s hmotností nad 30 kg měli úvodní frekvenci 5 Hz.
Tlaková amplituda (ΔP, dP) byla při napojení na HFOV nastavena empiricky a postupně upravena podle paCO2 s maximem 70 cm H2O. Pokud tato hodnota dP nebyla z hlediska ventilace dostatečná, zvyšovali jsme ji o 1–2 cm H2O maximálně však do 100 cm H2O a poté snižovali f o 1–2 Hz s efektem prodloužení doby inspiria (a exspiria).
V případě selhání všech výše zmíněných metod, tedy v případě, že nedošlo ke zlepšení poměru PaO2/FiO2 nebo došlo k jeho zhoršení (PaO2/FiO2 <100 mm Hg), jsme provedli (pokud se tak nestalo v předchozím průběhu hospitalizace) echokardiografické vyšetření k vyloučení dosud nediagnostikované zkratové srdeční vady a v negativním případě jsme aplikovali inhalovaný oxid dusnatý (iNO). Tímto okamžikem byl pacient zařazen do naší studie.
Počáteční dávka NO byla 1 ppm. Následně byla dávka NO zvyšována po 15 minutách, a to na 5, 10, 15 a 20 ppm s cílem zvýšit PaO2/FiO2 o ≥20 %. Ve čtyřech případech jsme byli nuceni zvýšit přechodně dávku NO na 40 ppm. Limitací zvyšování koncentrace NO byla hladina methemoglobinu ≥5 %, oběhová nestabilita, klinické a/nebo RTG známky vzniku či zhoršení plicního edému a krvácivých projevů. Ukončení iNO (postupné snižování koncentrace) bylo umožněno po stabilizaci oxygenačních paramerů po dobu nejméně 24 hodin.
Pacienti byli rozděleni do 6 skupin: Podle odpovědi na iNO na „respondery“ (pacienti, u nichž došlo během první hodiny po nasazení inhalace oxidu dusnatého ke zlepšení PaO2/FiO2 o ≥20 %) a „non-respondery“ (ostatní pacienti), podle způsobu ventilace bezprostředně před nasazením a v průběhu převážné části inhalace NO na pacienty na konvenční ventilaci („CMV“) a na vysokofrekvenční oscilaci („HFOV“) a podle přežití na „zemřelé“ a „přeživší“.
U všech pacientů byly zaznamenány: pohlaví (mužské – m, ženské – ž), věk (roky), hmotnost (kg), celková doba hospitalizace (dny), doba ventilace (hodiny), celková doba ventilace (UPV), doba konvenční mechanické ventilace (CMV), doba vysokofrekvenční oscilační ventilace (HFOV), délka iNO (hodiny), původ ARDS (plicní – P, mimoplicní – M), kategorie primární diagnózy (interní – M, chirurgická – S, traumatologická – T, onkologická – O), závažnost stavu s predikcí mortality (PRISM [3]), přežití, koncentrace NO (ppm), laboratorní měřené parametry (pH, paCO2, paO2, HCO3-), počítané parametry (AaDO2, Horowitzův index – PaO2/FiO2, oxygenační index – OI = Paw x FiO2 x 100/paO2), parametry umělé plicní ventilace (u CMV – FiO2, frekvence RR (min-1), dechový objem VT (l), PIP (cmH2O), Paw (cmH2O), PEEP (cmH2O) a u HFOV – FiO2, frekvence f (Hz), amplituda tlaku ∆P (cmH2O), Paw (cmH2O)) a komplikace iNO (po nasazení či zvýšení koncentrace – oběhová nestabilita, vznik či zhoršení plicního edému, methemoglobinémie a krvácivé epizody).
Koncentrace NO, laboratorní měřené parametry, počítané parametry, parametry umělé plicní ventilace a komplikace iNO byly zaznamenávány v čase 0 h (nejdéle 1 hodinu před nasazením iNO) a dále pak v čase 1, 6, 12, 24, 36, 48, 72 a 96 hodin po nasazení iNO. Tyto parametry jsou dále v textu souhrnně označovány jako indexované parametry.
Veškeré testy byly matematicky vyhodnoceny profesionálním statistickým softwarovým nástrojem STATISTICA verze 8.0, copyright©SatSoft, Inc.
Pro zjištění rozdílů v neindexovaných parametrech mezi výše zmíněnými skupinami jsme použili metodu neparametrického porovnání dvou skupin se statistickou významností stanovenou Mannovým-Whitneovým U-testem. Pro zjištění rozdílů indexovaných parametrů uvnitř jednotlivých skupin průběžně oproti předchozí hodnotě a hodnotě parametru v čase 0 h jsme zvolili metodu neparametrického porovnání dvou proměnných se statistickou významností vypočítanou Wilcoxonovým párovým testem. Za statisticky významnou byla považována hodnota p <0,05.
Výsledky
Do studie bylo zařazeno celkem 30 dětských pacientů. Nejčastější příčinou respiračního selhání (celkem 15 případů) byla infekční pneumonie, přičemž v 9 případech šlo o virovou pneumonii a v 6 případech o pneumonii bakteriální. U 10 dětí byl příčinou respiračního selhání septický šok (z toho v 7 případech jako komplikace onkologických onemocnění – hemoblastóz, 5 akutních lymfoblastických leukémií – ALL a 2 akutních myeloblastických leukémií – AML). Ve třech případech bylo příčinou respiračního selhání dětí polytrauma jako následek autonehody, v jednom případě se jednalo o komplikaci náhlé příhody břišní (peritonitida při perforovaném apendixu) a v jednom případě šlo o pacienta s bronchopulmonální dysplazií (BPD) chronicky závislého na iNO. Základní data souboru pacientů uvádí tabulka 1. V základních datech se skupiny respondeři a non-respondeři nelišily (tab. 2).
Tab. 1. Demografická data, délka ventilací, délka iNO, PRISM skóre. 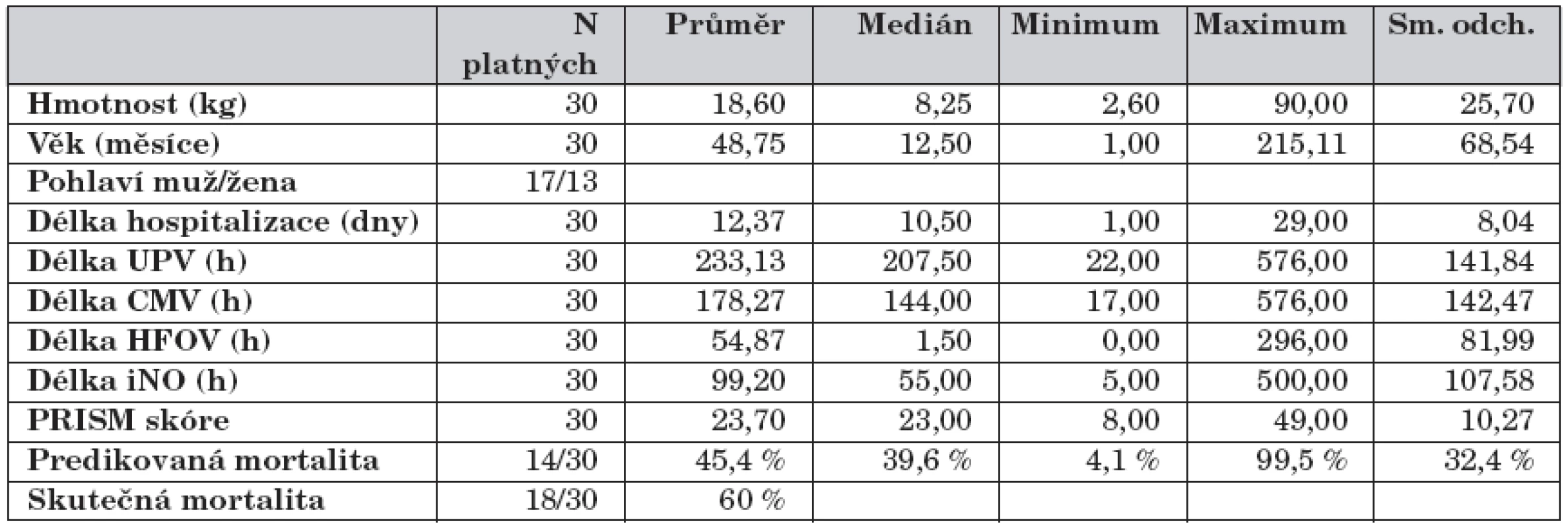
UPV – celková doba ventilace, CMV – konvenční ventilace, HFOV – vysokofrekvenční oscilace, iNO – inhalovaný oxid dusnatý Tab. 2. Rozdíly mezi skupinou respondeři a non-respondeři. 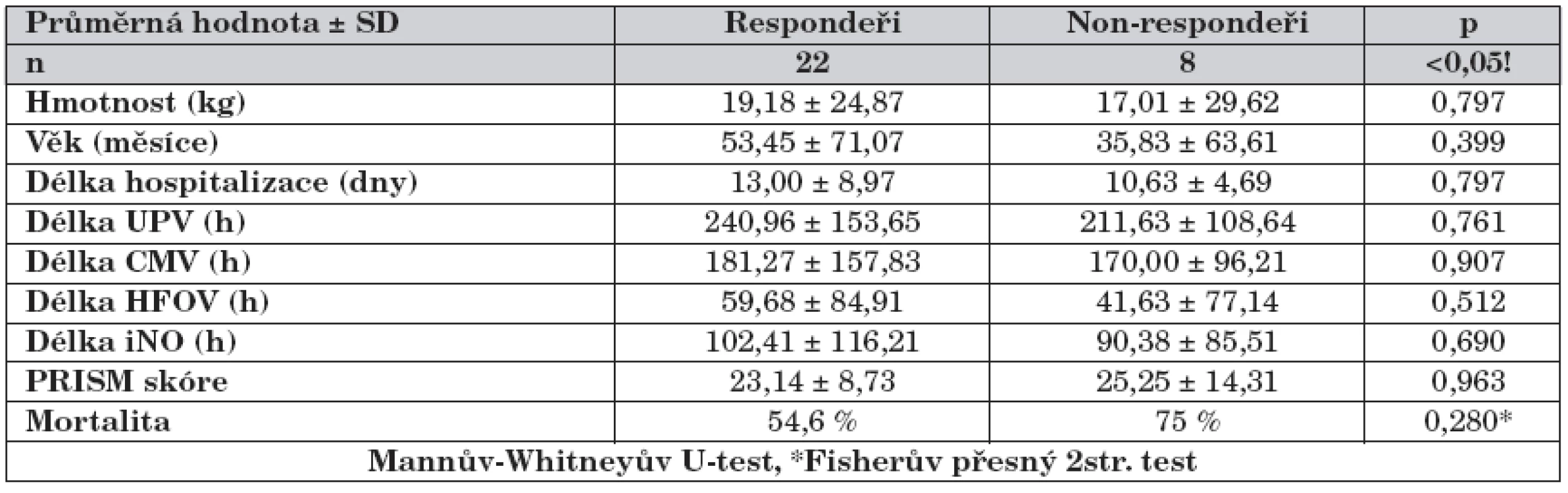
UPV – celková doba ventilace, CMV – konvenční ventilace, HFOV – vysokofrekvenční oscilace, iNO – inhalovaný oxid dusnatý Vstupní oxygenační index (OI) byl u responderů i non-responderů téměř shodný. V dalším průběhu iNO se OI u responderů postupně snižoval až do 12. hodiny, poté se hodnota OI opět zvyšovala, přičemž v čase 1–36 h byla hodnota OI statisticky významně nižší než v čase 0 h (před nasazením iNO), graf 1. U non-responderů docházelo průběžně jen ke zvyšování OI (graf 2). Statisticky významně se obě skupiny lišily pouze v první hodině (graf 3).
Graf 1. Respondeři, změna OI v čase. 
Graf 2. Non-respondeři, změna OI v čase. 
Graf 3. Respondeři vs non-respondeři, srovnání OI. 
Ostatní oxygenační parametry měly u obou skupin (respondeři/non-respondeři) podobný časový průběh jako OI a stejný byl i rozdíl mezi skupinami v čase 1 h.
Vstupní průměrná koncentrace iNO byla stejná u responderů i non-responderů (20 ppm). U responderů jsme mohli postupně koncentraci snižovat do 36 h (13 ppm), poté nebylo další snižování do 96 h možné. U non-responderů nebylo možné vstupní koncentraci snižovat v celém sledovaném intervalu 1–96 hodin. Rozdíly v koncentracích NO mezi oběma skupinami nebyly statisticky významné.
Pacienti zemřelí měli oproti přeživším významně kratší dobu hospitalizace, delší dobu strávili na HFOV a měli vyšší PRISM skóre (tab. 3).
Tab. 3. Rozdíly mezi skupinou přeživší a zemřelí. 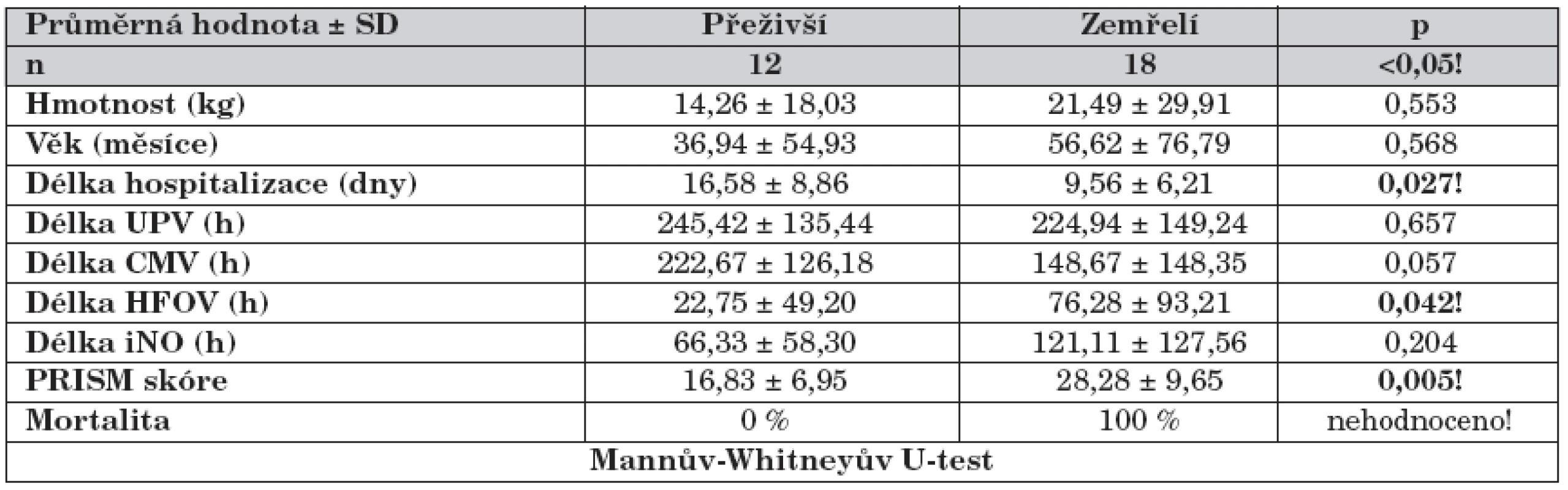
UPV – celková doba ventilace, CMV – konvenční ventilace, HFOV – vysokofrekvenční oscilace, iNO – inhalovaný oxid dusnatý Po přechodném zhoršení OI v 1. hodině se hodnota OI u přeživších pacientů snižovala až do 36 h a poté se opět zvyšovala. V čase 6–36 hodin byla hodnota OI významně nižší než v čase 0 h (graf 4). U zemřelých pacientů nedošlo ke statisticky významnému snížení OI v celém průběhu iNO (graf 5). Obě skupiny se lišily ve vstupním OI (0 h) a v časech 6 a 36 hodin, kdy pacienti skupiny zemřelí měli významně vyšší hodnoty OI (graf 6).
Graf 4. Přeživší, změna OI v čase. 
Graf 5. Zemřelí, změna OI v čase. 
Graf 6. Zemřelí vs přeživší, srovnání OI. 
Ostatní oxygenační parametry měly u obou skupin (přeživší/zemřelí) podobný časový průběh jako OI, avšak na rozdíl od OI se v těchto parametrech obě skupiny statisticky významně nelišily.
Vstupní průměrná koncentrace iNO byla stejná u přeživších i zemřelých (20 ppm). U přeživších jsme mohli postupně koncentraci snižovat do 36 h (14 ppm), poté jsme byli nuceni přechodně koncentraci zvýšit (17 ppm) a od 48. hodiny jsme mohli postupně koncentraci dále snižovat až na 5 ppm v 96. hodině. U zemřelých nebylo možné vstupní koncentraci snižovat v celém sledovaném intervalu 1–96 hodin. Rozdíly v koncentracích NO mezi oběma skupinami nebyly statisticky významné.
Pacienti na HFOV se od pacientů na CMV lišily pouze v délce HFOV (tab. 4). U pacientů na CMV nedocházelo k významnému snižování OI (graf 7), zatímco u pacientů na HFOV docházelo k postupnému snižování OI do 12. hodiny, kdy byla hodnota OI významně nižší než před nasazením iNO a mezi 12. a 96. hodinou se již OI dále nesnižoval (graf 8). Skupina HFOV měla významně vyšší vstupní OI (0 h) a OI v čase 24 h než skupina CMV (graf 9).
Tab. 4. Rozdíly mezi skupinou CMV a HFOV. 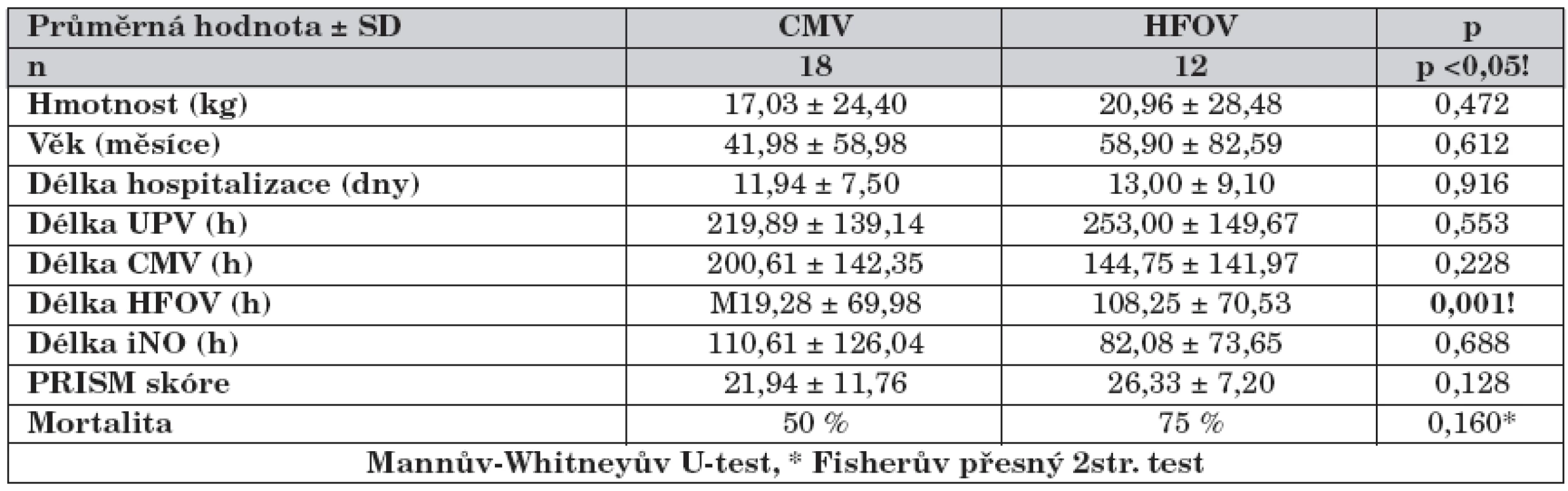
CMV – konvenční ventilace, HFOV – vysokofrekvenční oscilace, UPV – celková doba ventilace, iNO – inhalovaný oxid dusnatý Graf 7. CMV (konvenční mechanická ventilace), změna OI v čase. 
Graf 8. HFOV (vysokofrekvenční oscilace), změna OI v čase. 
Graf 9. CMV (konvenční mechanická ventilace) vs HFOV (vysokofrekvenční oscilace), srovnání OI. 
Ostatní oxygenační parametry měly u obou skupin (CMV/HFOV) podobný časový průběh jako OI, avšak na rozdíl od OI se v těchto parametrech obě skupiny statisticky významně nelišily.
Vstupní průměrná koncentrace iNO byla stejná u pacientů na CMV i HFOV (20 ppm). U pacientů na CMV jsme mohli postupně koncentraci snižovat do 24 h (15 ppm), poté jsme byli nuceni koncentraci opět zvyšovat na 18 ppm v 96. hodině. U pacientů na HFOV jsme mohli snížit koncentraci NO až ve 24 h (15 ppm), další snižování až do 96. hodiny nebylo možné. Rozdíly v koncentracích NO mezi oběma skupinami nebyly statisticky významné.
V žádné ze skupin pacientů studie inhalovaný NO nezlepšoval ventilační parametry ani acidobazickou rovnováhu (paCO2, pH a HCO3-).
Nepodařilo se nám prokázat statisticky významný vliv iNO na nastavení režimů UPV (u CMV – FiO2, VT, RR, PIP, PEEP a u HFOV – f, Paw, dP).
Během inhalace NO jsme u oběhově stabilních pacientů nezaznamenali pokles systémového krevního tlaku a u pacientů oběhově nestabilních, tj. s farmakologickou podporou oběhu Dopaminem nebo Dobutaminem s/bez Noradrenalinu, s nebo bez volumexpanderů nasazených před započetím iNO, ani jsme nezaznamenali potřebu dávky těchto farmak zvyšovat v časové souvislosti s nasazením či zvyšováním koncentrace iNO. Z tohoto pohledu tedy můžeme vyloučit vliv iNO (v dávkách do 20 ppm) na stabilitu systémového krevního oběhu.
U žádného z pacientů nebyl v průběhu inhalace NO zaznamenán vznik či zhoršení plicního edému. U pacientů, u kterých došlo během iNO ke zhoršení oxygenačních parametrů, neprokázal RTG snímek plic zhoršení nálezu oproti snímku před nasazením iNO. Hladiny methemoglobinu se u všech pacientů studie v celém průběhu aplikace iNO pohybovaly pod 2 % celkového množství hemoglobinu. Aplikované koncentrace iNO ≤20 ppm (výjimečně přechodně u čtyř pacientů 40 ppm) tedy nevedly ke vzniku methemoglobinémie (metHb >5 % celkového hemoglobinu).
U žádného z pacientů studie nebyl v průběhu inhalace NO zaznamenán vznik krvácení nebo zhoršení poruchy hemostázy diagnostikované před nasazením iNO.
Diskuse
Přechodný účinek zlepšení oxygenace pacientů s akutním respiračním selháním léčených inhalovaným oxidem dusnatým byl opakovaně prokázán mnoha klinickými studiemi.
Metaanalýza Sokol et al. [4] shrnující údaje z RCT studií dětí a dospělých pacientů udává statisticky významný rozdíl v OI mezi pacienty terapeutických skupin a pacienty skupin kontrolních do 96. hodiny po nasazení iNO, kdy pacienti terapeutické skupiny měli významně nižší OI než pacienti skupiny kontrolní. K postupnému snižování OI (snižování oproti hodnotě v předchozím čase) docházelo do 48. hodiny. Po 48. hodině nebyla další snížení statisticky významná, nicméně hodnoty OI byly až do 96. hodiny statisticky významně nižší než před nasazením iNO. Stejná metaanalýza dále popisuje přechodné zlepšení paO2/FiO2, a to do 24. hodiny po nasazení iNO. Po 24. hodině nebyla další zlepšení statisticky významná.
U dětí (respondeři, přeživší) zařazených v naší studii bylo zlepšení oxygenace (OI) statisticky významné v čase 6–36 hodin po nasazení iNO. Po 36. hodině již ke zlepšování oxygenačních parametrů nedocházelo a zároveň tyto hodnoty nebyly statisticky významně lepší než před nasazením iNO. U dětí na HFOV bylo významné zlepšení OI pouze ve 12. hodině. U non-responderů, zemřelých a dětí na CMV nedošlo ke statisticky významnému zlepšení OI v celém průběhu iNO. Závažnost plicního postižení hodnocená vstupním OI byla srovnatelná v obou studiích (děti naší studie: OI = 22; SD = 16; pacienti Sokol et al.: OI = 17; SD = 7). Celkový klinický stav pacientů před zahájením iNO jsme nemohli porovnat, protože ve srovnávané studii nebyly uvedeny výsledky skórovacích systémů. Kratší dobu, po kterou iNO působil na zlepšení oxygenace (statisticky významné zlepšení oproti času 0 h) u našich pacientů, lze vysvětlit rozdílnou metodikou manipulace s iNO. Zatímco ve většině studií zahrnutých do metaanalýzy Sokol et al. bylo snižování iNO umožněno podle jednotlivých protokolů nejdříve po 72. hodině, u pacientů naší studie jsme iNO snižovali podle protokolu ALI/ARDS, tj. jakmile došlo ke stabilizaci oxygenačních parametrů pacienta po dobu alespoň 24 hodin.
Dělení na respondery a non-respondery se ukázalo jako vhodné pro odhad úspěšnosti pokračující aplikace iNO ve smyslu zlepšování oxygenačních parametrů. Non-respondeři neprofitovali z další aplikace iNO, tj. jejich oxygenační parametry se v průběhu iNO na rozdíl od responderů nezlepšovaly. Zlepšení oxygenačních parametrů u responderů však nemělo žádný vliv na jejich přežití (nebyl statisticky významný rozdíl v mortalitě responderů a non-responderů).
Přeživší pacienti měli na vstupu a v průběhu iNO lepší oxygenační parametry než pacienti zemřelí. Výsledky srovnání OI skupin CMV a HFOV vyznívají na první pohled ve prospěch skupiny CMV, nicméně pokud si uvědomíme, že skupina HFOV měla významně vyšší vstupní OI a podíváme se na dynamiku změny OI ve skupině HFOV a srovnáme ji s dynamikou OI skupiny CMV, musíme přiznat větší benefit kombinace HFOV a iNO. Ačkoli měli pacienti skupiny HFOV z aplikace iNO větší užitek ve smyslu zlepšování oxygenace, v mortalitě se skupiny HFOV a CMV statisticky nelišily.
V žádné ze skupin pacientů naší studie inhalovaný NO nezlepšoval ventilační parametry ani acidobazickou rovnováhu (paCO2, pH a HCO3-). Možné vysvětlení lze vyvodit ze schopnosti CO2 snadněji difundovat přes alveolokapilární membránu a tudíž oproti O2 menší závislosti na celkové ploše účastnící se výměny plynů v plicích. Podstatně větší vliv na ventilační parametry má tak tvorba CO2 závislá na aktuálním stavu metabolismu a jeho eliminace z prostředí alveolu, tj. způsob ventilace (VT a RR u CMV, ΔP a f u HFOV). Posledně zmíněný fakt potom nejpravděpodobněji vysvětluje naše výsledky, protože ve snaze o protektivní ventilaci jsme v rámci protokolu ALI/ARDS uplatňovali jeho nedílnou součást, a to permisivní hyperkapnii. Zde spatřujeme nedostatek studie, kdy důsledné dodržování výše zmíněného protokolu v podstatě znemožnilo zhodnocení tohoto cíle. Vzhledem k nedostatku dat z dosud publikovaných studií nemůžeme potvrdit ovlivnění ventilačních paramerů inhalovaným NO.
V průběhu iNO jsme v naší studii nezaznamenali žádné nežádoucí účinky. V současnosti nejsou dostupné důkazy o negativním vlivu iNO v dávkách do 20 ppm na stabilitu systémového krevního oběhu. Metaanalýza Sokol et al. neuvádí vznik hypotenze u žádného pacienta zařazených studií.
Neexistují důkazy, že by inhalovaný NO ve výše zmíněných koncentracích vedl ke vzniku závažné methemoglobinémie (nad 5 % celk. Hb). Pouze u jednoho pacienta ze všech studií zařazených do metaanalýzy Sokol et al. 2003 [4] byla zmíněna hladina metHb vyšší než 5 %. Přesnou dávku iNO v ppm u tohoto pacienta však studie neuvádí.
Z dosud publikovaných prací není dostatek dat průkazně spojujících aplikaci NO se vznikem závažných krvácivých stavů. U dvou pacientů metaanalýzy Sokol et al. 2003 [4] byla zaznamenána netraumatická krvácení v průběhu aplikace iNO. U jednoho pacienta bylo po intravenózním podání urokinázy a heparinu, pro prodělaný infarkt myokardu, diagnostikováno intracerebrální krvácení a u druhého bylo zmíněno blíže nespecifikované netraumatické krvácení s potřebou krevní transfuze.
V současné době nejsou dostupné studie popisující vznik či zhoršení plicního edému v průběhu aplikace NO.
Pro srovnání mortality pacientů jsme vybrali starší RCT studii Dobbyns z roku 1999 [5], která měla nejvíce relevantních dat (tab. 5).
Tab. 5. Srovnání mortality dětí naší studie s RCT studií Dobbyns et al. [5]. ![Srovnání mortality dětí naší studie s RCT studií Dobbyns et al. [5].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/a47d2f2e93b3cc0d3ffcc4c4346c19dc.png)
CLD – chronická plicní nemoc Zde je nutno zdůraznit fakt, že mortalita pacientů s diagnózou akutního hypoxického respiračního selhání je ve většině případů výsledkem multiorgánového slehání nebo sepse. Pacienti s izolovaným postižením plic mají prokazatelně nižší mortalitu než pacienti s multiorgánovým postižením. Z tohoto pohledu tedy daleko více o přežití rozhoduje závažnost celkového postižení organismu pacienta než samotného postižení plic [6].
Předkládané výsledky naší práce tuto skutečnost potvrzují. Respondeři a děti na HFOV, ačkoli měli v průběhu iNO lepší oxygenační parametry nebo u nich došlo k významnějšímu zlepšení těchto parametrů, se v mortalitě nelišili od non-responderů a dětí na CMV. Naopak fakt, že se výše zmíněné skupiny nelišily v závažnosti celkového stavu, vyjádřené PRISM skóre, dobře koresponduje se srovnatelnou mortalitou skupin.
Vyšší mortalita dětských pacientů naší studie oproti metaanalýze je tak při méně závažném plicním postižení (nižším vstupním OI) vysvětlitelná závažnějším celkovým stavem (vyšším průměrným PRISM skóre) našich pacientů.
Výsledky naší studie jsou plně v souladu s dostupnými literárními údaji.
Závěr
Inhalovaný oxid dusnatý přechodně zlepšuje oxygenaci u dětí s těžkým respiračním selháním, a to mezi 6.–36. hodinou po nasazení. Z hlediska ovlivnění oxygenace u dětí s ARDS se jeví jako účinnější kombinace iNO s HFOV oproti kombinaci s CMV.
Inhalovaný oxid dusnatý nemá vliv na ventilační parametry (paCO2) ani na parametry acidobazické rovnováhy (pH a HCO3-). Dále nemá vliv na nastavení konvenční mechanické ventilace ani na nastavení vysokofrekvenční oscilační ventilace.
V průběhu inhalace NO v koncentracích do 20 ppm je nízké riziko vzniku či zhoršení oběhové nestability, plicního edému, methemoglobinémie (metHb >5 % celk. Hb) a vzniku či progrese krvácivých epizod. Inhalovaný oxid dusnatý neovlivňuje mortalitu dětí s AHRF.
Došlo: 9. 12. 2008
Přijato: 10. 3. 2009
MUDr. Lukáš Marek
Rerychova 14
635 00 Brno
e-mail: lmarek@email.cz
Zdroje
1. Slutsky AS, et al. ACCP Consensus Conference: mechanical ventilation. Intensive Care Med. 1994;20 : 64–79.
2. Fedora M. Vliv terapeutického protokolu na mortalitu syndromu akutní respirační tísně v dětském věku. Habilitační práce. Brno: LF MU, 2005 : 44–47.
3. Pollack MM, et al. Pediatric risk of mortality score. Crit. Care Med. 1988;16 : 1110–1116.
4. Sokol J, Jacobs SE, Bohn D. Inhaled nitric oxide for acute hypoxic respiratory failure in children and adults: a meta-analysis. Review. Anesth. Analg. 2003;97(4): 989–998.
5. Dobyns EL, Cornfield DN, Anas NG, Fortenberry JD, Tasker RC, et al. Multicenter randomized controlled trial of the effects of inhaled nitric oxide therapy on gas exchange in children with acute hypoxemic respiratory failure. J. Pediatr. 1999;134(4): 406–412.
6. Macrae D, Field D, Mercier JC, Möller J, et al. Inhaled nitric oxide therapy in neonates and children: reaching a European consensus. Intensive Care Med. 2004;30 : 372–380.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2009 Číslo 6- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Kortikosteroidy a azathioprin v prvním roce léčby Crohnovy nemoci u dětí
- Inhalovaný oxid dusnatý v léčbě těžkého respiračního selhání dětí
- Klinický význam vyšetřování mutací v genu pro transkripční faktor PROP1 u dětí s vrozeným deficitem růstového hormonu
- Seznam čtenářů se správnou odpovědí na kontrolní otázky k doškolovacímu článku z č. 2/2009 Wallenfels J.: Očkování proti tuberkulóze
- Pověry a mýty o kojenecké výživě
- Dny dětské endokrinologie 2009
- Zemřel emeritní přimář dětského oddělení v České Lípě MUDr. Vratislav Hadrava (13. 1. 1930 – 7. 3. 2009)
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Kortikosteroidy a azathioprin v prvním roce léčby Crohnovy nemoci u dětí
- Inhalovaný oxid dusnatý v léčbě těžkého respiračního selhání dětí
- Klinický význam vyšetřování mutací v genu pro transkripční faktor PROP1 u dětí s vrozeným deficitem růstového hormonu
- Dny dětské endokrinologie 2009
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



