-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Poškození plic nesprávnou strategií umělé plicní ventilace v experimentální studii
Lung Injury Caused by Incorrect Strategies of Mechanical Lung Ventilation in Experimental Study
Objective:
The aim was to determine whether the incorrect strategy during 60 minutes damaged lungs and determine the possibility of influencing pulmonary venous congestion and prevent complications of artificial ventilation.Setting:
The study was comparative, closed, randomized and double blind. The research takes place in accredited Animal Research Laboratory.Material and methods:
With the approval of the ethics committee were enrolled in 20 domestic swine piglets, 6 weeks old, average weight 28 kg (range 26–33 kg). In general anesthesia were ventilated 60 minutes by two different strategies, and divided into 4 groups. Control Group A – VTin tidal volume 7 ml/kg, without surgery (n=4), Group B – VTin 7 ml/kg with an aortic aneurysm (n=8), Group C – VTin 14 ml/kg, aortic aneurysm, a group of D – VTin 14 ml/kg, aortic aneurysm and dopamine (n=4). In study were monitored pulmonary mechanics, preload of both heart ventricles and the quality of blood circulation. After taking lung tissue, blood, and photo the animals were killed. Lung tissue samples were histologically examined for control and serum levels of soluble adhesion molecules (CAMs).Results:
After 60 minutes of incorrect ventilation strategy (groups C and D) were diffusion alveolar damage, decreased pulmonary dynamic compliancy (dC; p<0.05) and increased pulmonary artery pressure (PAP; p<0.01), preload of both heart ventricles (CVP; p<0.01 and PAoP; p<0.001) and plasmatic levels of soluble adhesion molecules (CAMs; p<0.05). In group D were lower CVP (p<0.05), PAoP (p<0.05) and CAMs (p<0.01).Conclusion:
Incorrect ventilation strategy after 60 minutes damaged the lungs, reduced the quality of blood circulation and induced an inflammatory response. Dopamine decreased venous congestion and inflammatory response. Protective ventilation strategy wind did not cause complications.Key words:
tidal volume, diffuse alveolar damage, venous congestion, inflammatory reaction
Autoři: J. Kobr 1; V. Třeška 2; J. Moláček 2; J. Kočová 3; O. Topolčan 4; J. Fremuth 1
Působiště autorů: Dětská klinika, Univerzita Karlova v Praze, Lékařská fakulta v Plzni a Fakultní nemocnice, Plzeň přednosta doc. MUDr. J. Kobr, PhD. 1; Chirurgická klinika, Univerzita Karlova v Praze, Lékařská fakulta v Plzni a Fakultní nemocnice, Plzeň přednosta prof. MUDr. V. Třeška, DrSc. 2; Ústav histologie a embryologie, Univerzita Karlova v Praze, Lékařská fakulta v Plzni a Fakultní nemocnice, Plzeň vedoucí doc. MUDr. J. Kočová, CSc. 3; Centrální laboratoř pro imunoanalýzu, Univerzita Karlova v Praze, Lékařská fakulta v Plzni a Fakultní nemocnice, Plzeň vedoucí prof. MUDr. O. Topolčan, CSc. 4
Vyšlo v časopise: Čes-slov Pediat 2009; 64 (12): 639-647.
Kategorie: Původní práce
Souhrn
Úvod:
Cílem bylo zjistit, zda nesprávná strategie v horizontu 60 minut poškodí plíce a ověřit možnosti ovlivnění kongesce v plicním žilním řečišti a prevence komplikací umělé plicní ventilace.Typ studie:
Komparativní, uzavřená, randomizovaná, dvojitě zaslepená.Místo:
Lékařská fakulta UK v Plzni, experimentální laboratoř.Materiál a metodika:
Se souhlasem etické komise bylo do studie zařazeno 20 selat prasete domácího, stáří 6 týdnů, průměrné hmotnosti 28 kg (rozmezí 26–33 kg). V celkové anestezii byla selata ventilována 60 minut dvěma rozdílnými strategiemi a rozdělena do 4 skupin. Kontrolní skupina A – dechový objem VTin 7 ml/kg, bez operace (n = 4), skupina B – VTin 7 ml/kg s aneuryzmatem aorty (n = 8), skupina C – VTin 14 ml/kg s aneuryzmatem aorty, skupina D – VTin 14 ml/kg, aneuryzma aorty a dopamin (n = 4). Sledována byla plicní mechanika, předtížení srdečních komor a kvalita krevního oběhu. Po odběru plicní tkáně, krve a fotodokumentaci byla zvířata utracena. Vzorky tkáně plic byly histologicky vyšetřeny a v séru stanoveny kontrolní hladiny solubilních adhezivních molekul (CAMs).Výsledky:
Po 60 minutách nesprávné strategie ventilace (skupiny C a D) došlo k difuznímu alveolárnímu poškození, klesla dynamická plicní poddajnost (dC; p <0,05) a stoupl tlak v plicnici (PAP; p <0,01), předtížení obou komor (CVP; p <0,01 a PAoP; p <0,001) i hladiny solubilních adhezivních molekul (CAMs; p <0,05). Ve skupině D byly nižší CVP (p <0,05), PAoP (p <0,05) a CAMs (p <0,01).Závěry:
Nesprávná strategie ventilace po 60 minutách poškodila plíce, snížila kvalitu krevního oběhu a indukovala zánětlivou reakci. Dopamin snížil kongesci v žilním řečišti a zánětlivou reakci. Protektivní strategie ventilace nezpůsobila komplikace.Klíčová slova:
dechový objem, difuzní alveolární poškození, žilní kongesce, zánětlivá reakceÚvod
U kriticky nemocných dětí je umělá plicní ventilace metodou volby pro podporu nebo náhradu funkce respiračního systému. Hodnota dechového objemu má rozhodující význam pro efektivitu umělé plicní ventilace. Děti jsou často ventilovány vysokými objemy a tlaky v ve snaze udržet nebo zvýšit saturaci hemoglobinu. Zlepšení výměny plynů je vždy přechodné a za cenu vysokých dechových objemů, hyperinflace plicních sklípků a poškození pacienta [1].
Studie byla motivována klinickou praxí ve snaze objasnit nevyřešené otázky dětské intenzivní medicíny. Rozhodli jsme se pro experimentální práci, protože vědomě vystavovat kriticky nemocné děti nešetrné ventilační strategii za účelem výzkumu není etické [2]. Ze zvířat střední velikosti má prase domácí s lidmi srovnatelnou anatomii i fyziologii oběhového i dýchacího systému [3–5]. Vybrali jsme selata s vyšším dotížením levé srdeční komory po chirurgickém zákroku jako relevantní zvířecí model zátěže krevního oběhu. Koncept studie vycházel z klinické zkušenosti a publikovaných studií [6–9]. Ve studii byly sledovány funkční i strukturální změny plic, kvalita krevního oběhu a intenzita zánětlivé reakce organismu při dvou rozdílných strategiích umělé plicní ventilace. Protektivní koncept nízkých dechových objemů a podílu kyslíku ve vdechované směsi plynů byl porovnán s nesprávnou strategií umělé plicní ventilace s vysokými dechovými objemy a koncentracemi kyslíku.
Cílem práce bylo zjistit, zda je možné při nesprávné strategii očekávat poškození plic v horizontu 60 minut, ověřit možnost ovlivnění kongesce v plicním žilním řečišti a prevence komplikací umělé plicní ventilace.
Materiál a metodika
Komparativní, uzavřená, randomizovaná a dvojitě slepá studie proběhla se souhlasem etické komise a v souladu s Vyhláškou č. 311/97 Sb., §12 „O chovu a využití pokusných zvířat“ na akreditovaném experimentálním pracovišti Lékařské fakulty Univerzity Karlovy v Plzni.
Experimentální model
Náhodným výběrem bylo do studie zařazeno celkem 20 klinicky zdravých selat prasete domácího z kontrolovaného chovu, šest týdnů starých, průměrné hmotnosti 28 kg (rozmezí 26–33 kg).
Zajištění zvířat a celková anestezie
Po kombinované intramuskulární premedikaci (atropin 0,07 mg/kg a azaperon 5,0 mg/kg) byl zajištěn periferní žilní vstup na ušním boltci zvířete kanylou. Po standardním úvodu do anestezie (thiopental 10,0 mg/kg) byla všechna zvířata orotracheálně intubována kanylou s okluzní manžetou (ID 5,5 mm). V pokračující anestezii byla všem punkčně kanylována v. jugularis interna, zaveden sheath (5 F) a modifikovaným termodilučním katétrem typu Swan-Ganz (polyuretan; 4 F) provedena pravostranná srdeční katetrizace. Správné uložení katétru v zaklínění plicnice bylo ověřeno sonograficky a tlakovou křivkou na monitoru. Infuzní pumpou byly podávány infuze krystaloidů (1/1 H). Vybrané skupině zvířat byl lineárním dávkovačem kontinuálně podáván dopamin v dávce 3,0 µg/kg/min. Seldingerovou metodou byla v celkové anestezii punkčně zavedena arteriální linka do abdominálního úseku aorty nad odstupem renálních tepen (polyuretan; 22 G). Hodnoty systémového arteriálního tlaku byly snímány monitorem. K umělé plicní ventilaci trvalým pozitivním tlakem byl použit ventilátor Siemens Elema 900 v konstantně nastaveném, řízeném a tlakem kontrolovaném režimu se směsí kyslíku a vzduchu. Intravenózní celková anestezie byla vedena kombinací ketamin 1,5–3,0 mg/kg, fentanyl 0,5–1,0 µg/kg a azaperon 3,0–4,0 mg/kg, periferní svalová paralýza jednotlivými intravenózními aplikacemi pancuronia v dávkách 0,1–0,2 mg/kg [10]. Hodnoty pulzní oxymetrie byly snímány čidlem na ušním boltci zvířete a měřeny monitorem.
Metoda výzkumu
Celkem 20 selat bylo v celkové anestezii a periferní svalové relaxaci za stejných podmínek ventilováno konvenčním režimem. Dvanáct zvířat bylo ventilováno respektováním zásad „lung protective strategies“ [11, 12] nízkými dechovými objemy (7 ml/kg) a koncentracemi kyslíku, 8 selat vysokými dechovými objemy (14 ml/kg) a koncentracemi kyslíku ve vdechované směsi plynu (FiO2) za účelem dosažení hyperinflace a poškození plicních sklípků. Třicet minut po zavedení invazivních vstupů a stabilizaci zvířat, intervalu zotavení, byla studie zahájena (čas -1). V době zahájení (čas -1) a po 60 minutách umělé plicní ventilace (čas -2) byly každému zvířeti měřeny parametry dynamické plicní mechaniky, předtížení obou srdečních komor a standardní parametry krevního oběhu. Závěrem studie byly zvířatům odebrány kontrolní krevní vzorky pro stanovení solubilních adhezivních molekul v séru, v pokračující celkové anestezii byla provedena torakotomie, fotodokumentace plic a z oblasti obou dorzobazálních laloků byly odebrány vzorky plicní tkáně k histologickému zpracování.
Plicní ventilace trvalým pozitivním tlakem byla řízena parametry: Počet řízených dechů (respiratory rate; RR; dechy/min), inspirační čas (inspiratory time; Tin; s), inspirační tlak (inspiratory pressure; Pin; cmH2O), pozitivní end-exspirační tlak (positive end-expiratory pressure; PEEP; cmH2O) a frakce kyslíku ve vdechované směsi (inspiratory fraction of oxygen; FiO2). Z ventilátoru byla odečítána data dynamické plicní mechaniky: Vrcholový inspirační tlak (peak of inspiratory pressure; PIP; cmH2O), střední tlak v dýchacích cestách (mean pressure in airways; Paw; cmH2O), inspirační dechový objem (inspiratory tidal volume; VTin; ml/kg), minutový dechový objem (minute volume; MV; ml/min). Dynamická plicní poddajnost byla vypočtena (dynamic lung compliance; dC; ml/cmH2O).
Pro hodnocení předtížení srdečních komor a krevního oběhu byla měřena srdeční pulzová frekvence (heart rate; HR; pulzy/min), systolický a diastolický systémový arteriální tlak (invasive blood pressure; IBP; mm Hg) a střední tlaky: Centrální žilní tlak (central venous pressure; CVP; cmH2O), v pravé síni srdeční (right atrial pressure; RAP; cmH2O), v pravé komoře (right ventricle pressure; RVP; cmH2O), ve kmeni plicnice (pulmonary artery pressure; PAP; cmH2O) a okluzní tlak v zaklínění plicnice (pulmonary artery occlusive pressure; PAoP; cmH2O) [13].
V plazmě zvířat byly v čase -1 a čase -2 studie stanoveny lymfocyty aktivované intercelulární (intercellular adhesive molecules; ICAM) a cévním endotelem aktivované vaskulární solubilní adhezivní molekuly-1 (vascular adhesive molecules; VCAM). Metodou slepého pokusu bylo sérum zvířat zpracováno alogenními prasečími séry (Immunotech-Liana BMS; BMS ICAM/BMS VCAM) a data porovnána s referenčními hodnotami: ICAM 4,94 ± 0,005 ng/ml a VCAM 8,49 ± 0,005 ng/ml.
Z obou dorzobazálních plicních laloků zvířat byly odebrány vzorky plicní tkáně, fixovány 10% pufrovaným roztokem formolu a odeslány k histologickému zpracování. Metodou dvojitého slepého pokusu byly preparáty vyšetřeny elektronovým mikroskopem.
Rozdělení zvířat
Bez chirurgické intervence byla 4 selata, 16 zvířat bylo tři týdny po operačním naložení manžety na abdominální aortu s ultrasonograficky potvrzeným experimentálním aneuryzmatem aorty a vyšším dotížením levé srdeční komory [14].
Skupina A – Kontrolní skupina, dechový objem 7 ml/kg
Čtyři neoperovaná zvířata byla v celkové anestezii a periferní svalové paralýze ventilována 60 minut v nastavení: RR = 24/min, Tin = 0,8 s, Pin = 20 cmH2O, PEEP = 6 cmH2O, FiO2 = 0,21.
Skupina B – Dechový objem 7 ml/kg
Do skupiny bylo zařazeno 8 zvířat s aneuryzmatem aorty, která byla 60 minut řízeně ventilována v nastavení: RR= 24/min, Tin = 0,8 s, Pin = 20 cmH2O, PEEP = 6 cmH2O, FiO2 = 0,21.
Skupina C – Dechový objem 14 ml/kg
Do skupiny byla zařazena 4 selata s aneuryzmatem aorty, která byla 60 minut ventilována v nastavení: RR = 28/min, Tin = 1,2 s, Pin = 30 cmH2O, PEEP = 4 cmH2O, FiO2 = 1,0.
Skupina D – Dechový objem 14 ml/kg s farmakologickou protekcí
Do skupiny byla zařazena 4 zvířata s aneuryzmatem aorty a inotropní podporou krevního oběhu kontinuální infuzí dopamin (3,0 µg/kg/min), zvířata byla 60 minut ventilována v nastavení: RR = 30/min, Tin = 1,2 s, Pin = 30 cmH2O, PEEP = 4 cmH2O, FiO2 = 1,0.
Statistické zpracování
Získaná data byla zaznamenána do PC databáze a statisticky zpracována. Vypočteny byly parametrické hodnoty: průměr (mean), směrodatná odchylka (SD) a 95% interval konfidence (95% CI) s vyjádřením spolehlivosti souboru. Pro porovnání dat mezi skupinami a v jednotlivých skupinách byly použity nepárový t-test a párový Wilcoxonův test.
Ukončení experimentu
Selata byla utracena v souladu s aktuálně platnými předpisy České republiky a EU o práci s laboratorními zvířaty. V pokračující celkové anestezii a periferní svalové relaxaci byl zvířatům intravenózně aplikován kardioplegický roztok (10% Thomas sol.) v průměrné dávce 30 ± 5 ml. Mrtvá těla experimentálních zvířat byla profesionálními pracovníky odstraněna standardním postupem.
Výsledky
Dynamická plicní mechanika
Data dynamické plicní mechaniky v průběhu studie a porovnání hodnot mezi skupinami A–D jsou uvedeny v tabulce 1.
Tab. 1. Dynamická plicní mechanika a rozdíly mezi skupinami A – D v průběhu studie (n = 40). 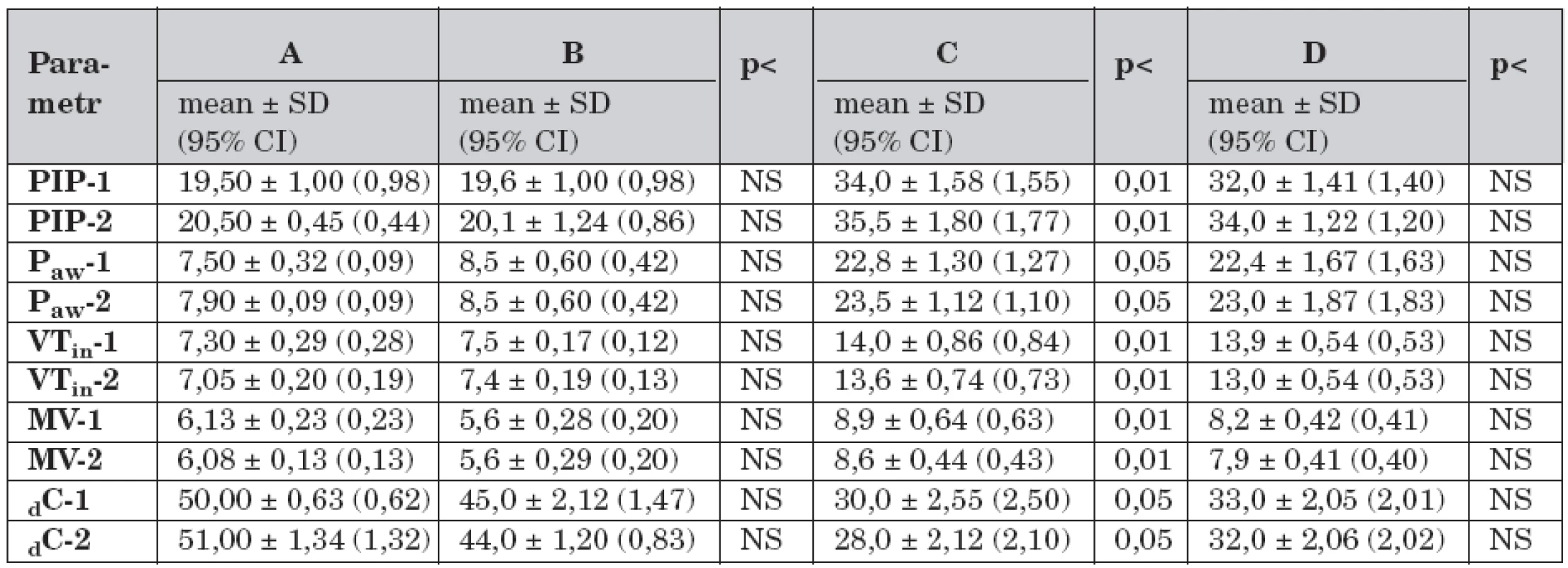
Legenda: A – kontrolní skupina, dechový objem 7 ml/kg, B – dechový objem 7 ml/kg, C – dechový objem 14 ml/kg a FiO2 1,0, D – dechový objem 14 ml/kg, FiO2 1,0 a farmakologická protekce (dopamin 3,0 μg/kg/min), PIP-1 – vrcholový inspirační tlak v čase -1 (cmH2O), PIP-2 – vrcholový inspirační tlak v čase -2, Paw-1 – střední tlak v dýchacích cestách v čase -1 (cmH2O), Paw-2 – střední tlak v dýchacích cestách v čase -2, VTin-1 – dechový objem v čase -1 (ml/kg), VTin-2 – dechový objem v čase -2 (cmH2O), MV-1 – minutový dechový objem v čase -1 (ml/min), MV-2 – minutový dechový objem v čase -2, dC-1 – dynamická plicní poddajnost v čase -1 (ml/cmH2O), dC-2 – dynamická plicní poddajnost v čase -2, NS – není signifikantní Ve skupině B (n = 8) se hodnoty dynamické plicní mechaniky v čase -1 nelišily od skupiny A. Ve skupině B nedošlo k významným rozdílům dat mezi časem -1 a časem -2.
Ve skupině C (n = 4) byly v čase -1 vyšší hodnoty PIP (t-test 8,02; p <0,01), Paw (t-test 6,68; p <0,05), VTin (t-test 11,07; p <0,01), MV (t-test 7,53; p <0,01), dC (t-test 6,84; p <0,05) v porovnání se skupinou A. Ve skupině C byl v čase -2 vyšší PIP (t-test 4,89; p <0,01).
Ve skupině D (n = 4) byly v čase -1 vyšší hodnoty PIP (t-test 7,32; p <0,01), Paw (t-test 6,03; p <0,05), VTin (t-test 5,72; p <0,01), MV 7,8 (t-test 6,63; p <0,01), dC (t-test 5,2, p < 0,05) než ve skupině A. V porovnání se skupinou B byly vyšší hodnoty PIP (t-test 6,85; p <0,01), Paw (t-test 6,13; p <0,05), VTin (t-test 9,79; p <0,01), MV (t-test 6,11; p <0,01) a nižší hodnoty dC (t-test 7,06; p <0,05). Ve skupině D nebyl mezi časem -1 a časem -2 významný rozdíl dat.
Saturace hemoglobinu kyslíkem (SpO2) byla v průběhu studie a souhrnu všech dat skupin A–D (n = 40) v mezích referenčních hodnot (96 ± 2,35 %).
Morfologické změny plicní tkáně
Strukturální změny plicního parenchymu byly hodnoceny vizuálně a doloženy histologickým vyšetřením odebrané tkáně.
Zvíře skupiny B, ventilované dechovým objemem 7 ml/kg a plíce z torakotomie jsou na obrázku 1. Elektronový mikroskopický nález plicní tkáně téhož zvířete je na obrázku 2.
Obr. 1. Plíce selete skupiny B z torakotomie. Fig. 1.The piglet lung of group B fromthoracotomy. 
Legenda: V průběhu ventilace normální konfigurace, poddajnost a kolorit plicních křídel. Legend: In the course of ventilation of normal configuration, compliance and color of the right and left lung. Obr. 2. Elektronový mikroskopický nález plicní tkáně téhož zvířete. Fig. 2. Electronmicroscopic finding in lung tissue of the same animal. 
Legenda: Normální architektura a vzdušnost plicních sklípků bez patologického obsahu. Alveolární septa mírně infiltrovaná, cévy sept mírně dilatované, v části bronchiolů malé množství sekretu. Legend: Normal architecture and airiness of lung alveoli without pathological content. Alveolar septa are slightly infiltrated, vessels of the septa are mildly dilated, and there is a small amount of secretion in a part of bronchioli. Zvíře skupiny C, ventilované dechovým objemem 14 ml/kg a plíce z torakotomie jsou na obrázku 3. Elektronový mikroskopický nález plicní tkáně téhož zvířete je na obrázku 4.
Obr. 3. Plíce selete skupiny C z torakotomie. Fig. 3. The piglet lung of group C from thoracotomy. 
Legenda:V průběhu ventilace se periodicky střídají okrsky hyperinflace s kondenzací plicní tkáně, kopírující průběh žeber. Plicní křídla mají nízkou poddajnost a známky nehomogenní kongesce v plicním žilním řečišti. Legend: In the course of ventilation areas of hyperinflation are periodically alternating with condensation of lung tissue, copying the course of ribs.The right and left lungs exhibit low compliance and signs of inhomogeneous congestion in the lung vascular bed. Obr. 4. Elektronový mikroskopický nález plicní tkáně téhož zvířete. Fig. 4. Electronmicroscopic finding in lung tissue of the same animal. 
Legenda: Těžká dekonfigurace až destrukce alveolů štěrbinovitého lumen snížené vzdušnosti s destrukcí pneumocytů typu 1 (označeno šipkou), náznakem eozinofilních membrán a infiltrací sept makrofágy v okolí trombotizovaných venul. Legend: Severe reconfiguration up to destruction of alveoli of slot-like lumen of decreased airiness with destruction of pneumocytes type 1 and suggested eosinophilic membranes and macrophage infiltration of septa in the surroundings of thrombotic venulas. Krevní oběh a předtížení srdečních komor
Získaná data krevního oběhu v průběhu studie jsou ve skupinách A–D uvedena v tabulce 2.
Tab. 2. Krevní oběh a rozdíly mezi skupinami A – D v průběhu studie (n = 40). 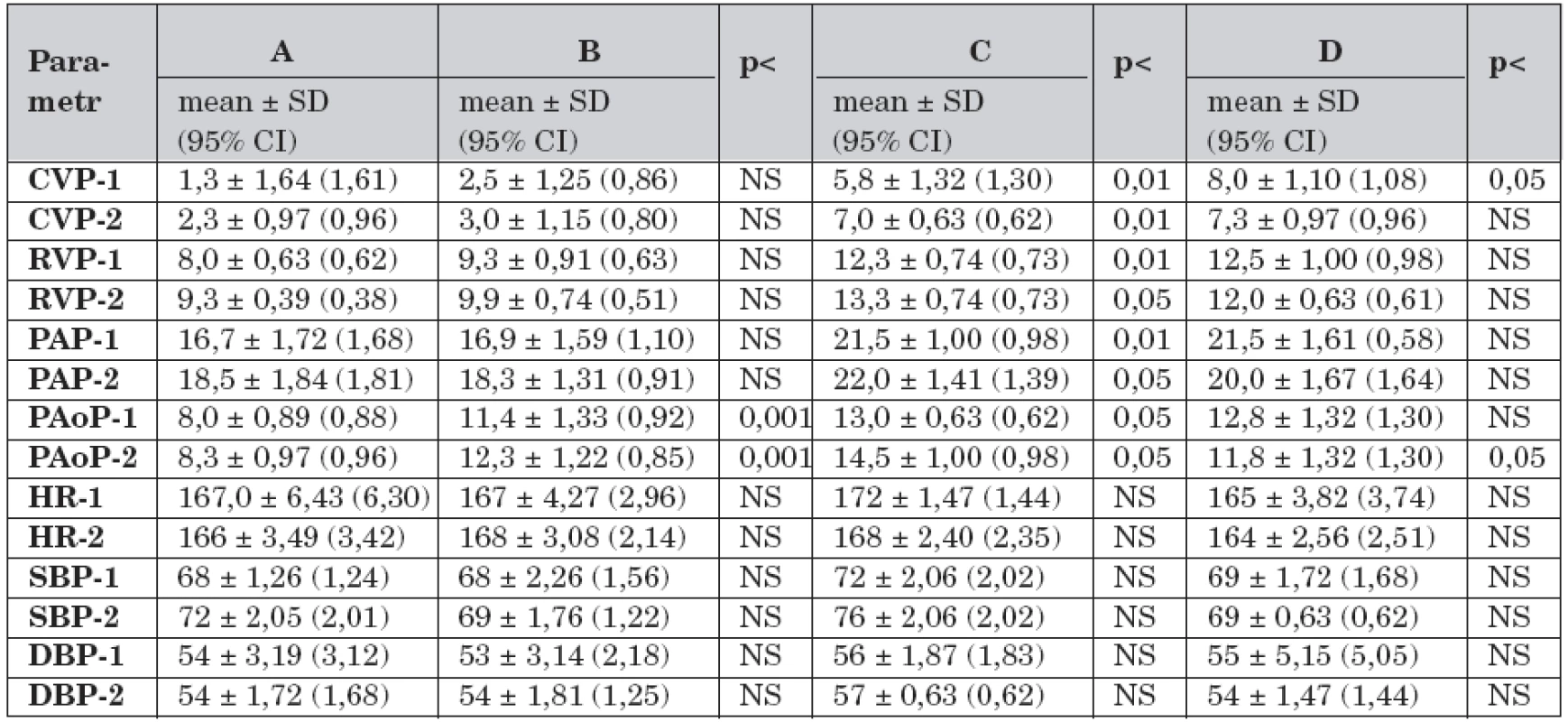
Legenda: A – kontrolní skupina, dechový objem 7 ml/kg, B – dechový objem 7 ml/kg, C – dechový objem 14 ml/kg a FiO2 1,0, D – dechový objem 14 ml/kg, FiO2 1,0 a farmakologická protekce (dopamin 3,0 μg/kg/min), CVP-1 – střední centrální žilní tlak v čase -1 (mm Hg), CVP-2 – střední centrální žilní tlak v čase -2, RVP-1 – střední tlak v pravé komoře v čase -1 (mm Hg), RVP-2 – střední tlak v pravé komoře v čase -2, PAP-1 - -střední tlak v plicnici v čase -1 (mm Hg), PAP-2 – střední tlak v plicnici v čase -2, PAoP-1 – střední okluzní tlak v plicnici v čase -1 (mm Hg), PAoP-2 – střední okluzní tlak v plicnici v čase -2, HR-1 – srdeční frekvence v čase -1 (pulzy/min), HR-2 – srdeční frekvence v čase -2, SBP-1 – systolický krevní tlak v čase -1 (mm Hg), SBP-2 – systolický krevní tlak v čase -2, DBP-1 – diastolický krevní tlak v čase -1 (mm Hg), DBP-2 – diastolický krevní tlak v čase -2, NS – není signifikantní Ve skupině A (n = 4) se data v čase -1 a čase -2 lišila pod hladinou významnosti (t-test 1,17; p = 1,301). Ve skupině B (n = 8) došlo v čase -2 ke zvýšení RVP (t-test -0,82; p <0,01), PAP (t-test -0,73; p <0,01) a PAoP (t-test -0,64; p <0,01).
Ve skupině C (n = 4) byly v čase -1 vyšší hodnoty CVP (t-test 3,8; p <0,01), RVP (t-test 3,47; p <0,01), PAP (t-test 1,04; p <0,01), PAoP (t-test 12,62; p <0,001) než ve skupině A. V čase -2 stouply ve skupině C hodnoty CVP (t-test -0,24; p <0,01), RVP (t-test -0,89; p <0,01), PAP (t-test -0,20; p <0,01) a PAoP (t-test -0,87; p <0,001) a klesly hodnoty IBP (t-test 4,84; p <0,05).
Ve skupině D (n = 4) byly v čase -1 vyšší hodnoty CVP (t-test 9,73; p <0,01), RVP (t-test 11,87; p <0,01), PAP (t-test 7,66; p <0,01), PAoP (t-test 6,52; p <0,05) v porovnání se skupinou A. V porovnání se skupinou B byly ve skupině D vyšší hodnoty CVP (t-test 7,02; p <0,01), RVP (t-test 8,95; p <0,01), PAP (t-test 3,57; p <0,05). V čase -2 ve skupině D byly nižší hodnoty CVP (t-test 6,31; p <0,05) a PAoP (t-test 5,97; p <0,05).
Nesprávná strategie umělé plicní ventilace (skupiny C–D, n = 8) v porovnání s protektivní strategií (skupiny A–B, n = 12) vedla ke zvýšení hodnot CVP (t-test 4,07; p <0,01), PAP (t-test 1,35; p <0,01) a PAoP (t-test 8,43; p<0,05). Ve skupině D byly nižší hodnoty PAoP (t-test 8,89; p <0,01) a vyšší hodnoty IBP (t-test 6,74; p <0,05) v porovnání se skupinou C.
Zánětlivá reakce
Data solubilních adhezivních molekul v průběhu studie jsou uvedena po skupinách A–D v tabulce 3.
Tab. 3. Solubilní adhezivní molekuly a rozdíly mezi skupinami A – D v průběhu studie (n = 30). 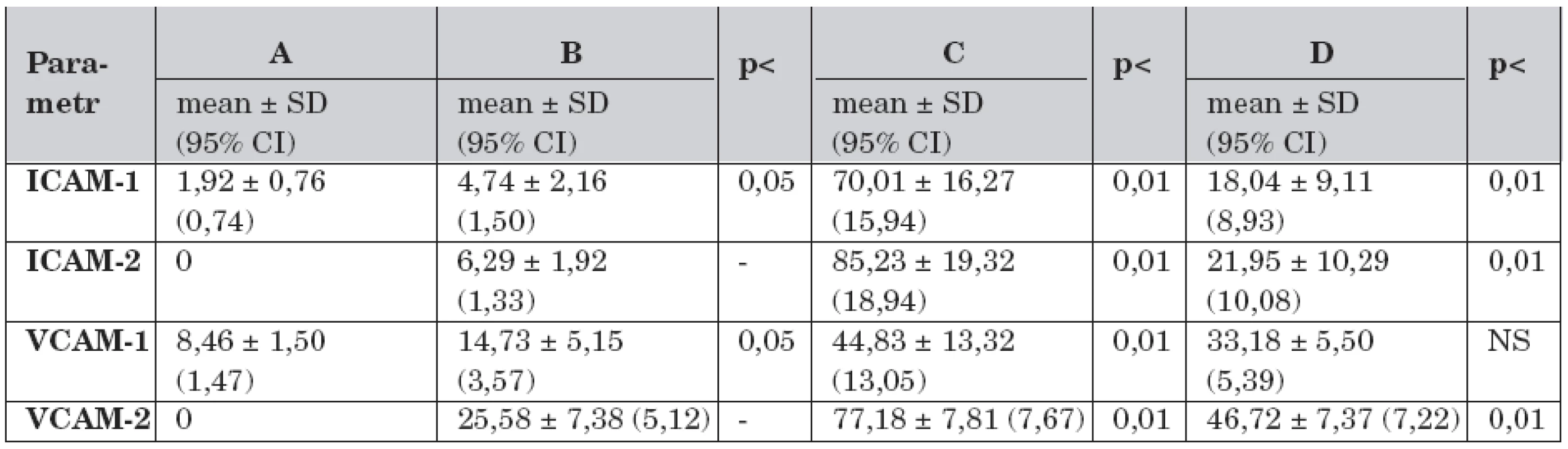
Legenda: A – kontrolní skupina, dechový objem 7 ml/kg, B – dechový objem 7 ml/kg, C – dechový objem 14 ml/kg a FiO2 1,0, D – dechový objem 14 ml/kg, FiO2 1,0 a farmakologická protekce (dopamin 3,0 μg/kg/min), ICAM-1 – intercelulární solubilní adhezivní molekuly-1 v čase -1 (ng/ml), ICAM-2 – intercelulární solubilní adhezivní molekuly-1 v čase -2, VCAM-1 – vaskulární solubilní adhezivní molekuly-1 v čase -1 (ng/ml), VCAM-2 – vaskulární solubilní adhezivní molekuly-1 v čase -2 V čase -1 byly ve výběru zvířat ventilovaných nesprávnou strategií (skupiny C–D; n = 8) vyšší hladiny ICAM (t-test -1,08; p <0,05) i VCAM (t-test -0,74; p <0,05) v porovnání s výběrem ventilovaných protektivně (skupiny A–B; n = 12).
V čase -2 byly v obou výběrech vyšší hladiny CAMs při porovnání s časem -1. Ve výběru protektivně ventilovaných ICAM (t-test -0,80; p <0,05) a VCAM (t-test 2,86; p <0,05), ve výběru s nesprávnou strategií ventilace ICAM (t-test -1,12; p <0,05) i VCAM (t-test -1,12; p <0,05). Ve výběru s nesprávnou strategií ventilace byl nalezen rozdíl mezi skupinami. Ve skupině D byly nižší hladiny ICAM (t-test 7,15; p <0,01) i VCAM (t-test 13,87; p <0,01) v porovnání se skupinou C.
Změny exprese solubilních adhezivních molekul v průběhu studie a ve skupinách A–D dokumentuje graf 1.
Graf 1. Změny exprese solubilních adhezivních molekul ve skupinách A–D (n = 20). Legenda: ICAM – intercelulární solubilní adhezivní molekuly-1 v čase -1 (ng/ml), ICAM/2 – intercelulární solubilní adhezivní molekuly-1 v čase -2, VCAM – vaskulární solubilní adhezivní molekuly-1 v čase -1 (ng/ml), VCAM/2 – vaskulární solubilní adhezivní molekuly-1 v čase -2, A – kontrolní skupina, dechový objem 7 ml/kg, B – dechový objem 7 ml/kg, C – dechový objem 14 ml/kg a FiO<sub>2</sub> 1,0, D – dechový objem 14 ml/kg, FiO<sub>2</sub> 1,0 a farmakologická protekce (dopamin 3,0 μg/kg/min) 
Studie proběhla bez tlakového poškození plic a bez předčasného úhynu experimentálních zvířat.
Diskuse
Každá forma umělé plicní ventilace je v porovnání se spontánním dýcháním ve své podstatě nefyziologická. Naše studie se snažila objasnit nedořešené otázky v oboru intenzivní medicíny, týkající se strategie umělé plicní ventilace.
Ve shodě s klinickými zkušenostmi a publikovanými údaji [11, 12, 15] výsledky naší studie dokumentují, že protektivní strategie umělé plicní ventilace neovlivnila dynamickou mechaniku a morfologii plic, předtížení srdečních komor nebo kvalitu krevního oběhu. Zvířata skupin B–D byla ve studii znevýhodněna vyšším dotížením levé srdeční komory po bandáži a rozvoji experimentálního aneuryzmatu abdominálního úseku aorty. Endotel operované aorty zvířat indukoval expresi vaskulárních solubilních adhezivních molekul pod hladinou statistické významnosti.
Z výsledků klinických i experimentálních studií vyplývá, že nešetrná strategie umělé plicní ventilace parenchym plic „primárně“ traumatizuje mechanicky, fyzikálními vlivy. Poškození plic vysokým tlakem (barotrauma) nebo objemem (volumtrauma) je reálnou komplikací nesprávné strategie umělé plicní ventilace. Difuzní poškození plicních sklípků je projevem poškození plic vysokým dechovým objemem v souvislosti s umělou plicní ventilací. Odborné společnosti je na konsensuálních konferencích přesně definovaly a označily termíny ventilátorem indukované (VILI) nebo zhoršované poškození plic (VALI) [15]. Navazující studie postupně upozornily na příčinné souvislosti periodického střídání hyperinflace s kolapsy plicních sklípků v průběhu ventilace, dekompartmentaci systému [16–18] a expresi solubilních adhezivních molekul. Kombinace nežádoucích mechanických vlivů a vysoké koncentrace kyslíku ve vdechované směsi plynů vyvolává oxidativní stres, urychluje proces destabilizace systému a uvolnění prozánětlivých cytokinů do periferní krve [19–20]. Cirkulující prozánětlivé cytokiny poškozují orgány a systémy, včetně „sekundárního“ poškození plic [21–24]. Poškození plic má v permanentní kardiopulmonální interakci přímý vliv na výkon srdce i kvalitu krevního oběhu [25–28].
Pro potřeby studie jsme vytvořili model nesprávné strategie umělé plicní ventilace kombinací obou zmíněných faktorů, vysokého dechového objemu a koncentrace kyslíku. Ventilační přístroj v průběhu dechového cyklu zaznamenával hodnoty inspiračního a exspiračního dechového objemu, minutového dechového objemu a změny tlaku v dýchacích cestách. Při nesprávné strategii ventilace v průběhu 60 minut vzrostla dynamická rezistence dýchacích cest a klesala hodnota exspiračního dechového objemu i dynamické plicní poddajnosti. Pro udržení hodnot exspiračního dechového objemu bylo nutné upravovat nastavení a zvyšovat inspirační tlak.
Studie prokázala, že umělá plicní ventilace s nesprávnou strategií po 60 minutách byla příčinou snížení dynamické plicní poddajnosti, kongesce v plicním žilním řečišti a difuzního poškození plicních sklípků s nehomogenním snížením vzdušnosti, destrukcí pneumocytů typu 1, tvorbou eozinofilních membrán a buněčnou infiltrací sept. U zvířat bez inotropní podpory krevního oběhu v průběhu studie stouply hodnoty středního tlaku v plicním arteriálním řečišti (p <0,01) a předtížení pravé (CVP; p <0,01) i levé srdeční komory (PAoP; p <0,001). Selata s inotropní podporou krevního oběhu tolerovala vysoké dechové objemy lépe. Z pohledu systémové hemodynamiky byl příznivý pokles předtížení obou srdečních komor (CVP; p <0,05 a PAoP; p <0,05). Klinicky i statisticky nevýznamné bylo zvýšení systémového krevního tlaku a pulzové srdeční frekvence. Výsledky studie podporují hypotézu, že dopamin snižuje kongesci v plicním žilním řečišti a zvyšuje systolickou funkci levé srdeční komory.
Umělá plicní ventilace s nesprávnou strategií indukovala během 60 minut zvýšení plazmatických hladin obou solubilních adhezivních molekul (p <0,05). Ve skupině s inotropní podporou krevního oběhu bylo zvýšení CAMs významně nižší (p <0,01). Otázkou je, zda dopamin ovlivnil expresi solubilních adhezivních molekul zprostředkovaně nebo přímo.
Závěry
Studie splnila vytčené cíle a dokumentovala následující skutečnosti:
Umělá plicní ventilace s vysokým dechovým objemem a koncentrací kyslíku poškodila v průběhu 60 minut funkčně i strukturálně plíce, snížila kvalitu krevního oběhu a vyvolala systémovou zánětlivou reakci. Ventilace nízkým dechovým objemem nezpůsobila žádnou z uvedených komplikací.
Inotropní podpora krevního oběhu přispěla ke snížení kongesce v plicním žilním řečišti a exprese solubilních adhezivních molekul.
Z experimentální studie je možné převzít do klinické praxe pouze poučení: Děti v kritickém stavu by měly být ventilovány s maximální ohleduplností.
Finanční podpora: Výzkumný záměr MŠMT a Lékařské fakulty UK v Plzni č. MSM 0021620819-6096, grant Ministerstva zdravotnictví České republiky č. IGA MZ ČR č. NA/7653-3.
Došlo: 24. 8. 2009
Přijato: 10. 11. 2009
Doc. MUDr. Jiří Kobr, PhD.
Dětská klinika FN Plzeň
Alej Svobody 80
304 60 Plzeň
e-mail: jiri.kobr@lfp.cuni.cz
Zdroje
1. Mascia L, Zanierato M, Ranieri VM. Acute respiratory distress syndrome: 25 years of progress and innovation. In: Kuhlen R, Moreno R, Ranieri M, Rhodes A. 25 Years of Progress and Innovation in Intensive Care Medicine. Berlin: Medizinisch Wissenschaftliche Verlagsgesellschaft, 2007 : 109–117.
2. Truong RD. Ethical assessment of pediatric research protocols. Intensive Care Med. 2008;34 : 198–202.
3. Fedora M, Kobr J. Dýchací trakt a umělá plicní ventilace. In: Intenzivní péče v pediatrii. Praha: Galén, 2008 : 337–341.
4. Hedenstierna G, Hammond M, Mathieu-Costello O, Wagner PD. Functional lung unit in the pig. Resp. Physiol. 2000;120(2): 139–149.
5. Jackson PG, Cockcroft P. Handbook of Pig Medicine. Chapter 4: Diseases of the respiratory systém. Saunders Elsevier, 2007 : 70–82.
6. Feihl F, Broccard AF. Interactions between respiration and systemic hemodynamics. Part I: Basic concepts. Intensive Care Med. 2009;35 : 45–54.
7. Feihl F, Broccard AF. Interactions between respiration and systemic hemodynamics. Part II: Practical implications in critical care. Intensive Care Med. 2009;35 : 198–205.
8. Calfee CS, Eisner MD, Parsons PE, Thompson BT, Conner ER, Matthaz MA, Ware LB. Soluble intercellular adhesion molecule-1 and clinical outcomes in patients with acute lung injury. Intensive Care Med. 2009;35 : 248–257.
9. Harada K, Tamura M, Toyono M, et al. Effect of dobutamine on a Doppler echocardiographic index of combined systolic and diastolic performance. Pediatr. Cardiol. 2002;23 : 613–617.
10. Jackson PG, Cockcroft P. Handbook of Pig Medicine. Chapter 15: Analgesia, anesthesia, and surgical procedures in the pig. Saunders Elsevier, 2007 : 30–241.
11. Verbrugge SJ, Lachmann B, Kesecioglu J. Lung protective ventilatory strategies in acute lung injury and acute respiratory distress syndrome: from experimental findings to clinical application. Clin. Physiol. Funct. Imaging 2007;27(2): 67–90.
12. Miller MP, Mayer S. Lung protective strategy during mechanical ventilation of a pediatric patient with ARDS is associated with reduced incidence of chest tube insertion for pneumothoraces but with increased incidence of chest tubes insertion for pleural effusion. Chest 2005;128(4): 225S–407S.
13. Takano JS. Chapter 133 – Advanced haemodynamic monitoring: Pulmonary artery and left atrial cathetrization. In: Levin DL, Morris FC (eds.). Essentials of Pediatric Intensive Care. 2nd ed. Churchill Livingstone Inc.,1997 : 1234–1248.
14. Molacek J, Treska V, Kobr J, Certik B, Skalicky T, Kuntscher V, Krizkova V. Optimalization of the model of abdominal aortic aneurysm – experiment in an animal model. J. Vasc. Res. 2008;526 : 1–5.
15. Tsoukias NM, Dabdub D, Wilson AF, George SC. Effect of alveolar volume and sequential filling on the diffusion capacity of the lungs: II. Experiment. Resp. Physiol. 2000;120(3): 251–271.
16. Eichinger M, Walterspacher S, Schulz T, Tetzlaff K, Röcker K, Muth CM, Puderbach M, Kauczor HU, Sorichter S. Lung hyperinflation: foe or friend? Eur. Respir. 2008;32 : 1113–1116.
17. Dreyfuss D, Saumon G. Ventilator-induced lung injury: lessons from experimental studies. Am. J. Respir. Crit. Care Med. 1998;157(1): 294–323.
18. Rossi A, Ganassini A, Poles G, Grossi V. Pulmonary hyperinflation and ventilator-dependent patients. Eur. Respir. J. 1997;10 : 1663–1674.
19. Grioir BP, Bryant D, Thompson M. Myocardial failure in children with severe systemic inflammatory response. Abstract the IPA World Congress of Pediatrics, 1998, Amsterdam, Nederland.
20. Tremblay LN, Valenza R, Riberio SP, et al. Injurious ventilatory strategies increase cytokines and c-fos m-RNA expression in an isolated rat lung model. J. Clin. Invest. 1997;99 : 944–952.
21. International consensus conferences in intensive care medicine. Ventilator-associated lung injury in ARDS. Intensive Care Med. 1999; 25 : 1444-1452
22. Russell JA, Walley KR. Acute Respiratory Distress Syndrome. London: Cambridge University Press, 1999.
23. Secor VH. Multiple Organ Dysfunction and Failure, Pathophysiology and Clinical Implications. 2nd ed. New York: Mosby-Year Book Inc., 1996.
24. Slutsky AS, Tremblay LN. Multiple system organ failure: is mechanical ventilation a contributing factor. Am. J. Respir. Crit. Care Med. 1998;157 : 1721–1725.
25. Pinsky MR. Heart-lung interactions during positive-pressure ventilation. New Horiz. 1999;2(4): 443–456.
26. Haney MF, Johansson G, Häggmark S, Biber B. Heart-lung interactions during positive pressure ventilation: left ventricular pressure-volume momentary response to airway pressure elevation. Acta Anaest. Scand. 2001;45(6): 702–801.
27. Steingrub JS, Tidswell M, Higgins TL. Hemodynamic consequences of heart-lung interactions. J. Intensive Care Med. 2003;18(2): 92–99.
28. Koganov Y, Weiss YC, Oppenheim A, Elmi A, Pizov R. Positive end-expiratory pressure increases pulmonary venous vascular resistance in patients after coronary artery surgery. Crit. Care Med. 1997;25(5): 767–772.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2009 Číslo 12- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Poškození plic nesprávnou strategií umělé plicní ventilace v experimentální studii
- Probiotické kmeny v mateřském mléce – mýtus nebo skutečnost?
- Chrápanie a obštrukčné spánkové apnoe v detskom veku z pohľadu otorinolaryngológa
- Preventivní intervenční programy v oblasti zdravé výživy dětí – projekty Světové zdravotnické organizace v boji proti dětské obezitě
- Ošetřovatelská péče o novorozence v Anglii
- Přelomová práce týkající se účinku zákazu kouření na veřejných místech
- Doc. MUDr. Hana Houšťková, CSc. – významné životní jubileum
- Za primářem MUDr. Vladimírem Rambouskem
- Za emeritním primářem MUDr. Jindřichem Jilečkem (6. 5. 1918 – 1. 9. 2009)
- MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chrápanie a obštrukčné spánkové apnoe v detskom veku z pohľadu otorinolaryngológa
- Doc. MUDr. Hana Houšťková, CSc. – významné životní jubileum
- Preventivní intervenční programy v oblasti zdravé výživy dětí – projekty Světové zdravotnické organizace v boji proti dětské obezitě
- Poškození plic nesprávnou strategií umělé plicní ventilace v experimentální studii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



