-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nežádoucí účinky po podání BCG vakcíny v ČR v letech 2001–2006
Autoři: J. Mladá
Působiště autorů: Oddělení farmakovigilance, Státní ústav pro kontrolu léčiv, Praha vedoucí MUDr. J. Mladá
Vyšlo v časopise: Čes-slov Pediat 2008; 63 (4): 223-225.
Kategorie: Aktuální téma
K očkování proti TBC se v ČR od roku 2000 používá BCG VACCINE SSI. V 1 ml rekonstituované BCG vakcíny je Mycobacterium bovis (BCG – Bacillus Calmette-Guérin) stratus Danicus 1331 0,75 mg, 0,75 mg, ≥2,0 x 106 ≤8,0 x 106 CFU, jedná se o živý, oslabený kmen. Od června roku 2001 byl u nás zaveden očkovací kalendář, v rámci kterého byla BCG vakcína podávána v novorozeneckém věku a první dávky dalších očkování v devátém, nejpozději ve dvanáctém týdnu života. Povinné očkování bylo rozšířeno o vakcínu proti hemofilovým onemocněním a hepatitidě typu B.
Po intradermální aplikaci BCG vakcíny dochází ke vzniku lokální zánětlivé reakce, odtud se mykobakteria dostávají do regionálních lymfatických uzlin a dále se šíří do celého organismu, což zajišťuje vznik buněčné imunity. Hranice mezi „fyziologickou reakcí“ a nežádoucím účinkem vakcíny tak nejsou z biologického hlediska zcela ostré. Lze předpokládat, že na rozsahu lokální zánětlivé reakce se podílí i způsob provedení intradermální aplikace.
Analyzovali jsme nežádoucí účinky BCG vakcinace, které byly hlášeny Státnímu ústavu pro kontrolu léčiv (SÚKL). Při analýze jsme vycházeli z informací uvedených v Souhrnu údajů o přípravku BCG VACCINE SSI a doporučení WHO pro klasifikaci nežádoucích účinků po BCG vakcinaci.
Za nežádoucí účinky podléhající hlášení se považují:
- ulcerace nebo absces v místě očkování velikosti 10 mm a více u novorozenců, 20 mm a více u školních dětí,
- kolikvace nebo zvětšení lymfatických uzlin (více než 10 mm) – axilárních, supraklavikulárních nebo na levé straně krku,
- vznik keloidní jizvy,
- osteomyelitis,
- diseminovaná BCG infekce,
- BCG meningitis.
Od roku 2001 SÚKL obdržel 2747 hlášení podezření na nežádoucí účinek po podání BCG vakcíny (tab. 1).
Tab. 1. Počty hlášení podezření na nežádoucí účinek po podání BCG vakcíny. 
¹v roce 2006 byla část hlášení zaslána v rámci speciálního sledování a tato hlášení nejsou zařazena do následujících analýz U hlášení z let 2001–2002 není dostupná podrobná analýza reakcí. Z hlášení obdržených v letech 2003–2006 (2343 hlášení) nesplňovalo 290 kritéria nežádoucího účinku po BCG vakcinaci (jednalo se o fyziologickou reakci nepřesahující 10 mm po primovakcinaci a 20 mm po revakcinaci). Ve většině případů, které splňovaly kritéria nežádoucího účinku, se jednalo o lokální reakce buď v místě aplikace, nebo v místních lymfatických uzlinách. Další časté reakce především po revakcinaci představovaly keloidní jizvy. Nejzávažnější nežádoucí účinky se vyskytují pouze velmi vzácně. Ve 4 případech byla ve sledovaném období hlášena osteomyelitis v různých lokalizacích a ve 4 případech byla BCG vakcína podána novorozencům s vrozeným imunodeficitem a následně došlo k rozvoji generalizované miliární tuberkulózy.
Hlášené nežádoucí reakce je možné rozdělit do dvou velkých skupin: u první skupiny došlo ke vzniku nežádoucího účinku pouze po podání BCG vakcíny. U druhé skupiny, která představuje zhruba čtvrtinu hlášení, hlásící uvedl, že došlo k reaktivaci již klinicky zhojené reakce po BCG vakcinaci po aplikaci jedné nebo více dávek polyvalentní vakcíny, nejčastěji tetravalentní vakcíny proti tetanu, pertusi (celulární), difterii a invazivním hemofilovým infekcím a po současném podání vakcíny proti hepatitidě B. Hlášena byla však i souvislost s podáním tetravakcíny obsahující acelulární pertusovou složku či s vakcínami hexavalentními.
V grafu 1 jsou uvedeny počty nežádoucích účinků podle lokalizace (v místě podání či v lymfatických uzlinách) v obou skupinách. U nežádoucích účinků souvisejících pouze s podáním BCG vakcíny tvoří dvě třetiny reakce v místě podání vakcíny a třetinu reakce v lymfatických uzlinách. Při aktivaci již jednou klinicky zhojené reakce po podání BCG vakcíny tvoří reakce v regionálních uzlinách až polovinu ze zaznamenaných reakcí. Detailní rozdělení nežádoucích účinků podle velikosti a typu reakce v jednotlivých letech je uvedeno v tabulce 2, součet za období 2003–2006 v tabulce 3.
Graf 1. Počty nežádoucích účinků podle lokalizace (v místě podání či v lymfatických uzlinách). 
Tab. 2. Detailní rozdělení nežádoucích účinků podle velikosti a typu reakce v jednotlivých letech. 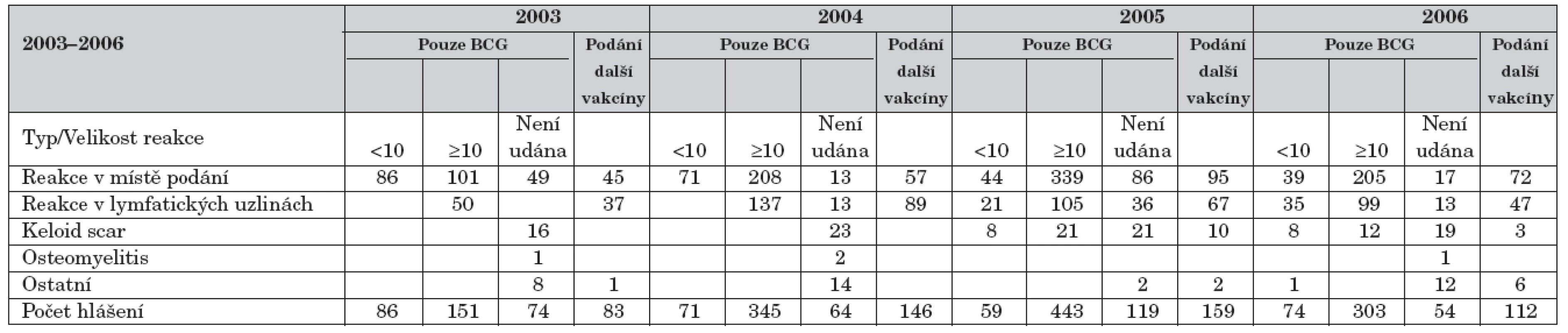
Tab. 3. Sumární informace o nežádoucích účincích za období 2003–2006. 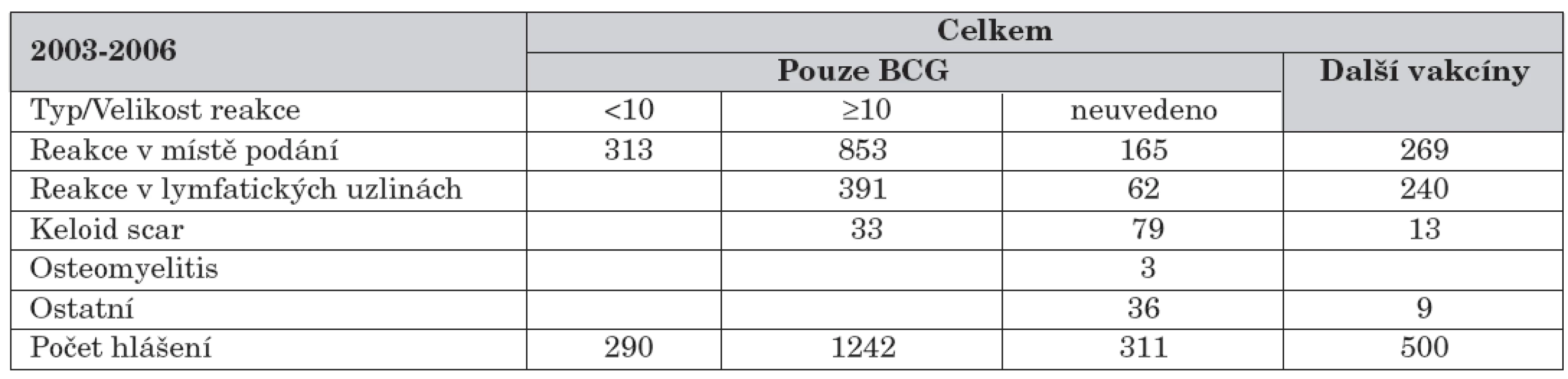
V roce 2005 došlo k nárůstu počtu reakcí v místě podání vakcíny. Při podrobné analýze se ukázalo, že byl hlášen zvýšený výskyt těchto reakcí pouze ve dvou regionech. Nárůst hlášených reakcí pravděpodobně souvisel s nesprávnou technikou očkování v těchto lokalitách.
V roce 2006 byl počet spontánních hlášení nižší, protože někteří hlásitelé zasílali svá hlášení v rámci zvláštního sledování výskytu nežádoucích účinků po podání BCG vakcíny organizovaného SÚKL ve spolupráci s kalmetizačními zařízeními. Tato hlášení nebyla zařazena mezi spontánní hlášení.
Data získaná ze spontánních hlášení mají své limitace. Odhadujeme, že na SÚKL je obvykle hlášeno mezi 0–1 % případů nežádoucích účinků. U hlášení BCG komplikací je toto procento o něco vyšší, přesto lze předpokládat, že nárůst počtu hlášení v letech 2001–2006 byl patrně způsoben spíše osvětou mezi hlásícími než skutečným nárůstem případů.
Podle odhadů je na SÚKL v současné době hlášeno mezi 8–10 % všech případů nežádoucích účinků, které se vyskytly v souvislosti s podáním BCG. Tyto odhady jsou založeny na počtech případů obdržených ze sledování organizovaného SÚKL v první polovině roku 2006.
V rámci tohoto sledování bylo na kalmetizačních odděleních z celé ČR vyšetřeno 9032 dětí, u nichž bylo popsáno 197 případů výskytu nežádoucích účinků v souvislosti s podáním BCG. Ve 122 případech (62 % z nežádoucích účinků) se jednalo o nežádoucí účinky pouze po podání BCG a v 75 případech (38 % z nežádoucích účinků) došlo k reaktivaci již zhojené reakce po podání dalších vakcín podle očkovacího kalendáře. U 3491 dětí byla také sledována délka hojení „fyziologické“ reakce po podání BCG. U 284 dětí (8,1 %) délka hojení jinak fyziologické reakce po podání BCG přesáhla 12 týdnů (průměrná délka hojení u těchto dětí byla 19 týdnů), tedy dobu určenou pro zahájení podání dalšího očkování podle očkovacího kalendáře.
Ochranná imunita proti TBC infekci vyvolaná BCG vakcinací je především imunita buňkami zprostředkovaná. Antigenní nálož podaná v rámci očkování proti tetanu, difterii, pertusi, hemofilovým infekcím a hepatitidě B ve třetím, čtvrtém a pátém měsíci způsobuje aktivaci hlavně složek humorální imunity. Možný mechanismus vzniku reaktivace BCG primokomplexu po podání dalších vakcín souvisí pravděpodobně s interakcí mezi buněčnou a humorální složkou imunity, která ovlivňuje imunitní rovnováhu v lymfatických uzlinách či jizvě po podání BCG. Zdá se, že interval mezi podáním BCG a dalšího očkování je příliš krátký pro úplné zhojení BCG primokomplexu. Reaktivace se začaly objevovat až po zařazení očkování proti hemofilovým infekcím a hepatitidě B do povinného očkovacího kalendáře.
Z údajů dostupných SÚKL vyplývá, že od roku 2001 se objevil nový typ nežádoucích účinků (reaktivace již klinicky zhojené reakce po BCG vakcinaci). Podle sdělení odborníků zabývajících se problematikou onemocnění TBC a BCG vakcinací nebyla takováto reakce pozorována před rozšířením očkovacího kalendáře o očkování proti hemofilovým infekcím a hepatitidě B. Tato skutečnost by měla být zvažována při úvahách o skladbě očkovacího kalendáře. U novorozenců z nerizikového prostředí se při zachování současného rozsahu očkování zdá být ideálním řešením přesun podání BCG vakcíny až do doby, kdy je ukončeno základní očkování hexavalentní vakcínou.
MUDr. Jana Mladá
Oddělení farmakovigilance
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
e-mail: jana.mlada@sukl.cz
Zdroje
1. WHO, Surveillance of adverse events following immunisation. Expande programme on immunisation. Geneva: WHO, 1997.
2. Souhrn údajů o přípravku BCG vaccine SSI, poslední revize textu 30. 7. 2003.
3. Křepela K. Dětská tuberkulóza a BCG vakcinace. Vox Pediatrie 2002;9 : 24–25.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2008 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Hrozí zneužití a diskreditace lékařské genetiky
- Vliv některých faktorů na počet kojených dětí při propuštění z porodnice v letech 2000 až 2004 v ČR
- Pertuse a GER – dvě příčiny dlouhodobého kašle
- Poškodenie srdca po rádioterapii v detskom veku
- Morfologický pohľad na ontogenézu týmusu človeka
- Faktory ovplyvňujúce veľkosť a involúciu týmusu detí
- Historie dětské nefrologie v bývalém Československu a později v ČR
- Očkování proti pneumokokovým nákazám
- Nežádoucí účinky po podání BCG vakcíny v ČR v letech 2001–2006
- VIII. Teyschlův pediatrický den
- XXI. seminář „Prevence ischemické choroby srdeční od dětského věku“ v Poděbradech
- VIII. ČESKÝ PEDIATRICKÝ KONGRES S MEZINÁRODNÍ ÚČASTÍ
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Pertuse a GER – dvě příčiny dlouhodobého kašle
- Morfologický pohľad na ontogenézu týmusu človeka
- Faktory ovplyvňujúce veľkosť a involúciu týmusu detí
- Nežádoucí účinky po podání BCG vakcíny v ČR v letech 2001–2006
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



