-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Pneumologická cytodiagnostika – state of the art 2019
Cytodiagnostics in Pneumology – State of the Art 2019
Pulmonary cytology represents one of the basic diagnostic methods in pneumopathology. It is primarily focused on: 1) assessment of biologic nature of the pathologic process (recommended terminology and classification according to the The Papanicolaou Society of Cytopathology guidelines, 2016), 2) typing of malignant tumors (according to the WHO Classification of Tumours of the Lung, 2015), 3) assessment of mediastinal and hilar lymph nodes (including preoperative staging), 4) attaining adequate material for ancillary testing, 5) bronchoalveolar lavage (BAL) differential cell count and cytopathology studies. The need for sufficient amount of material especially in tumour diagnostics in the era of targeted therapy/personalized medicine is increasing. In pneumocytology, the diagnostic yield is greatly improved by endobronchial ultrasound-guided (EBUS) fine-needle aspiration accompanied by rapid on-site evaluation (ROSE) provided by a cytopathologist. This process gives the possibility to carefully handle and triage the specimen for diagnostic procedures as well as specific ancillary studies. When carcinoma is suspected, both cytology and biopsy specimens should be obtained whenever possible and reviewed together to achieve the highest specificity and diagnostic concordance. If no histology sample is available, attaining adequate material in the cell block becomes crucial, as it enables to carry out immmunohistochemical methods and molecular genetic testing from cytology material. For optimal acquisition, processing and testing of limited specimens in pneumocytology, as well as in pulmonary histopathology, the key issue is to establish and operate a multidisciplinary team including a cytopathologist/surgical pathologist, radiologist and pulmonologist.
Keywords:
pulmonary cytology – cytodiagnostics – tumors of the lung – EBUS – BAL – bronchoscopy
Autoři: Linda Čapková; Petra Galgonková
Působiště autorů: Ústav patologie a molekulární medicíny 2. LF UK a FN Motol, Praha, Česká republika
Vyšlo v časopise: Čes.-slov. Patol., 55, 2019, No. 1, p. 24-33
Kategorie: Přehledový článek
Souhrn
Pneumologická cytodiagnostika je jednou ze základních diagnostických metod v pneumopatologii. Mezi její hlavní indikace patří: 1) stanovení biologické povahy patologického procesu (diagnostické kategorie dle doporučení Papanicolaouovy cytologické společnosti aktualizované v roce 2016), 2) určení typu maligního nádoru (terminologie dle WHO klasifikace z roku 2015), 3) hodnocení stavu mediastinálních a hilových lymfatických uzlin (umožňující mimo jiné upřesnit staging nádorového onemocnění), 4) zajištění materiálu pro následná specializovaná vyšetření, 5) posouzení a stanovení rozpočtu bronchoalveolární laváže. Požadavek na množství kvalitního materiálu se obzvláště v diagnostice nádorových lézí díky novým terapeutickým možnostem závislým na prediktivních biomarkerech neustále zvyšuje. K efektivnímu odběru a využití tohoto materiálu přispívá zejména bronchoskopické vyšetření za kontroly endobronchiálního ultrazvuku (EBUS) a rychlé posouzení vzorku cytopatologem v době odběru (ROSE; rapid-on-site-evaluation). Při podezření na nádorové onemocnění by měl být pokud možno vždy odebrán vzorek jak na cytologické, tak na histologické vyšetření. V případě, že nelze provést bioptický odběr, je doporučeno zajistit materiál rovněž na vyšetření cytobloku, umožňujícího z cytologického materiálu provádět metody imunohistochemické, molekulární i cytogenetické. Hlavní důraz v pneumocytologické, stejně jako v pneumohistopatologické diagnostice je kladen na multidisciplinární spolupráci týkající se uspořádání odběru a cílené směrování často velmi limitovaného materiálu na specializovaná vyšetření. Úzká spolupráce patologa/cytopatologa, v optimálním případě posuzujícího zároveň cytologický i histologický vzorek, s pneumologem, radiologem a molekulárním biologem je zásadní nejen z důvodu stanovení co nejpřesnější diagnózy, ale též k provedení prediktivních vyšetření a zhodnocení markerů senzitivity či rezistence na léčbu.
Klíčová slova:
pneumologická cytologie – cytodiagnostika – nádory plic – bronchoskopie
PNEUMOLOGICKÁ CYTODIAGNOSTIKA
– STATE OF THE ART 2018
Cytologické vyšetření je v pneumologii jednou z nejvýznamnějších a často prvotní morfologickou diagnostickou metodou u pacientů s respirační symptomatologií či plicní abnormalitou detekovanou zobrazovacími metodami. Pneumologická cytodiagnostika je využívána hlavně k posouzení nádorových lézí, nalézá ale také uplatnění v diferenciální diagnostice celé řady dalších patologických procesů, například zánětlivých onemocnění, difúzních intersticiálních plicních procesů či pleurálních výpotků. Co se týče karcinomu plic, přibližně u 70 % pacientů je stále diagnostikován v lokálně pokročilém či metastázujícím, a tedy inoperabilním stádiu onemocnění (http://www.uzis.cz/katalog/zdravotnicka-statistika/novotvary). Metodou volby k získání diagnostického materiálu jsou proto minimálně invazivní techniky a jediným dostupným materiálem jsou často vzorky cytologické. S ohledem na terapii bylo v diagnostice bronchogenního karcinomu po dlouhou dobu postačující rozdělení na kategorie malobuněčného (SCLC) a nemalobuněčného karcinomu (NSCLC). Vzhledem k novým léčebným možnostem u pacientů s NSCLC, které se objevily v posledních dvou desetiletích, však musí být jeho jednotlivé subtypy pokud možno jednoznačně odlišeny. Odebraný materiál navíc není využíván pouze k přesnější morfologické diagnostice, ale i k následným imunohistochemickým a molekulárně-genetickým vyšetřením (EGFR, ALK, ROS1, PD-L1 a dalším), na kterých závisí potenciální nasazení cílené léčby. Požadavek na množství kvalitního materiálu se tak přirozeně zvyšuje. K jeho efektivnímu odběru a využití výrazně přispívá bronchoskopické vyšetření za kontroly endobronchiálního ultrazvuku (EBUS) a rychlé posouzení vzorku cytologem v době odběru (ROSE – rapid-on-site-evaluation). To umožňuje rozhodnout, jestli je vzorek reprezentativní nebo je indikován další odběr, eventuálně zda je vhodné zhotovení tzv. cytobloku, umožňujícího z cytologického materiálu provádět vyšetření imunohistochemická, molekulární i cytogenetická (1). Při podezření na nádorové onemocnění by měl pokud možno být vždy odebrán vzorek jak na cytologické, tak na histologické vyšetření, resp. vyšetření cytobloku, a tyto vzorky by měly být posuzovány společně. Jedině takový postup vede k optimální diagnostické přesnosti (2) (viz Doporučený postup histologického vyšetření karcinomu plic; http://www.patologie.info/standardy/21). V návaznosti na výše zmíněné změny došlo v posledních letech k úpravě klasifikačního systému nejen pro malé bioptické vzorky, ale také pro cytologické odběry (3,4).
V České republice jsou v současnosti laboratoře pneumologické cytologie buď součástí oddělení patologie či fungují jako samostatné cytologické laboratoře v rámci pneumologických oddělení (5). V poslední době převažuje trend přesunout tuto problematiku z rukou trénovaných pneumologů do odbornosti patologů, resp. cytopatologů. Kvůli nedostatku specialistů však v zájmu zajištění dostupnosti ROSE přetrvává možnost získat licenci v pneumologické cytologii rovněž pro pneumology (viz Dohoda zástupců Společnosti českých patologů, České pneumologické a ftizeologické společnosti a Společnosti klinické cytologie z 5.2.2015, www.pneumologie.cz/upload/1467110620.docx). V zahraničí se na ROSE zčásti podílejí též cytologičtí laboranti (6).
TYPY MATERIÁLU V PNEUMOLOGICKÉ CYTOLOGII, ZPŮSOB ODBĚRU A JEHO ZPRACOVÁNÍ
Laboratoř pneumologické cytologie provádí vyšetření biologického materiálu získaného dvěma základními postupy, a to exfoliativními metodami a punkčními odběry. Mezi exfoliativní cytologické metody patří v oblasti pneumocytodiagnostiky nátěry aspirátu z povrchu bronchiální sliznice, nátěry buněk oddělených z povrchu sliznice kartáčkem (brush), otisky tkáně z odběru bronchiální klíšťkovou biopsií či transbronchiální biopsií plicního parenchymu, preparáty zhotovené z materiálu získaného výplachem bronchu či bronchoalveolární laváží (BAL) a v neposlední řadě z indukovaného sputa. Punkční cytologická diagnostika zahrnuje materiál z perbronchiální aspirace mediastinálních či hilových lymfatických uzlin a extramurálně uložených ložisek tenkou jehlou, z punkce pleurálních (event. perikardiálních) výpotků a punkce periferních lymfatických uzlin či podkožních rezistencí suspektních z nádorového procesu (perkutánní FNA).
Standardně se z převážné většiny odebraného materiálu provede tenký nátěr na podložní sklo, který se fixuje zaschnutím. Materiál z BAL a pleurální (či perikardiální) tekutina jsou zpracovány v cytocentrifuze se zrychlením a délkou centrifugace uzpůsobenými tak, aby nedocházelo k cytolýze. Vzniklý sediment je následně pomocí filtračního papírku přenesen na podložní sklo. Barvení preparátů probíhá klasicky dle Papanicolaoua či některým barvením ze skupiny Romanowski: dle Giemsy, Wright-Giemsy, May-Grünwald-Giemsy či rychlým barvením Diff-Quik®, trvajícím ve třech krocích celkově pouhých 20 - 30 sekund (7) a využívaným zejména při ROSE.
Při výčtu technik zpracování materiálu v plicní cytologii nelze opomenout cytoblok, který v dnešní době požadující precizní oddělení jednotlivých diagnostických kategorií karcinomu plic významně zvyšuje výtěžnost cytologického vyšetření. Cytoblok se zhotovuje nejčastěji z odběrů FNA či z výpotků různou metodikou (např. ShandonTMCytoblockTM) a spočívá ve sběru shluků buněk fixovaných v pufrovaném formolu a následně zpracovaných obdobně jako bioptický materiál zalitím do parafínových bločků (FFPE) (8,9). Proto je cytoblok možno využít k široké paletě vyšetření, zejména imunohistochemických, samozřejmě za předpokladu adekvátního typu a množství materiálu. Kombinace cytologických preparátů s cytoblokem ve velké části případů postačuje k definitivní diagnóze. Cytoblok by proto měl být nedílnou součástí cytologického vyšetření u pacienta s podezřením na nádorové onemocnění v případě, že nelze provést bioptický odběr (10). Metodu cytobloku lze s výhodou použít i v diagnostice nenádorových lézí, jako například při postižení lymfatických uzlin granulomatózním procesem u pacientů se sarkoidózou.
VÝHODY A LIMITACE CYTOLOGICKÉHO VYŠETŘENÍ V PNEUMOLOGII
Mezi nejvýznamnější výhody cytologického vyšetření obecně patří relativně malá invazivita odběru a tím minimalizované riziko vzniku komplikací pro pacienta při získání vzorku. Neopomenutelnými výhodami jsou také rychlost vyšetření, jeho nízké finanční náklady a možnost opakovat odběr v krátkém časovém horizontu. S rozvojem bronchoskopických odběrových technik postupně vzrůstá i senzitivita cytologického vyšetření. Nejvyšší diagnostické přesnosti dle výsledku studií dosahuje aspirace tenkou jehlou (FNA) za kontroly některou ze zobrazovacích metod, především ultrazvuku či počítačové tomografie (11-13). V metaanalýze 20 studií dokonce nebyl shledán signifikantní rozdíl v senzitivitě a specificitě diagnózy karcinomu plic z biopsie tlustou jehlou oproti tenkojehlové aspiraci (14). Endobronchiálním vyšetřením s odběrem vzorku pod ultrazvukovou kontrolou (EBUS) je možné provést exfoliativní odběry pomocí kartáčku či aspirace současně s punkcí centrálně uloženého nádorového ložiska či mediastinálních a hilových lymfatických uzlin tenkou jehlou (EBUS-FNA). Výhodou odběru FNA oproti klasickým punkčním biopsiím je možnost opakovaných punkcí v rámci jednoho vyšetření se získáním většího množství materiálu, vyšší podíl nádorových buněk v cytologickém vzorku oproti stromatu a díky fixaci zaschnutím vyšší kvalita nukleových kyselin pro molekulární vyšetření oproti fixaci ve formolu.
Hlavní nevýhodu cytologického vyšetření představuje nižší celková spolehlivost (shoda s definitivní diagnózou) oproti vyšetření histologickému. Dle publikovaných studií se pro histologicky ověřené léze přesnost cytologické diagnózy pohybuje v rozmezí 70 - 80 % v závislosti na typu odběru (15). Senzitivita jedné z nejlépe hodnocených metodik, EBUS-FNA, se v jednotlivých studiích pohybovala v intervalu 50 - 92 % a specificita se blížila 100 % (16-18). Pokud byla v době odběru posuzována adekvátnost vzorku (ROSE), zvýšila se senzitivita až na 93 - 96 % (19). Falešná negativita bývá nejčastěji důsledkem kvalitativních nedostatků při odběru materiálu. Dalšími příčinami může být hypocelularita vzorku, obzvláště při překrytí krví či zánětlivými elementy. Právě ROSE s posouzením adekvátnosti vzorku významně pomáhá ke snížení počtu falešně negativních výsledků. Nejlepší strategií ke zvýšení diagnostické výtěžnosti je jednotlivé techniky odběru vzájemně kombinovat, např. bronchiální aspirát a stěr kartáčkem s odběrem klíšťkovou biopsií či tenkojehlovou aspirací. Falešně pozitivní případy se mohou vyskytovat při záměně benigního procesu (reaktivní atypie pneumocytů II. typu či bronchiálního epitelu, hyperplázie bazálních buněk či reaktivní změny metaplastických dlaždicových buněk) za malignitu, vyskytují se však vzácněji (20). Mezi nevýhody cytologického vyšetření spadá též nemožnost posouzení vztahu nádoru k okolí a limitace až nemožnost validního posouzení vzorku při vystupňovaných odběrových artefaktech.
INDIKACE CYTOLOGICKÉHO VYŠETŘENÍ V PNEUMOLOGII
Indikace cytologického vyšetření v pneumologii mají svá specifika vycházející z problematiky plicních onemocnění a jejich diagnostiky obecně. Co do techniky odběru, resp. typu získaného materiálu, se jednotlivé indikace dosti překrývají, jak u benigních, tak maligních plicních lézí. Patří mezi ně následující:
Stanovení biologické povahy patologického procesu. Nejčastěji je cytologické vyšetření požadováno z diferenciálně diagnostických důvodů u ložiskových plicních procesů, kde napomáhá v další terapeutické rozvaze, a to zejména u pacientů, kteří nejsou schopni podstoupit diagnostický operační výkon.
Určení typu maligního nádoru. V rámci plicní cytologie jde u inoperabilních nálezů především o klasifikaci karcinomu do jedné ze dvou základních skupin (malobuněčný a nemalobuněčný) a dle možnosti upřesnění nemalobuněčného typu karcinomu (adenokarcinom, dlaždicobuněčný karcinom, event. NSCLC, blíže nespecifikovaný).
Hodnocení stavu mediastinálních a hilových lymfatických uzlin – staging nádoru. Cytopatologové hrají důležitou roli také v určení rozsahu onemocnění, resp. posouzení operability nádoru, zejména díky zhodnocení nitrohrudních lymfatických uzlin pomocí EBUS-FNA.
Zajištění materiálu pro následná specializovaná vyšetření. Z důvodů zpřesnění diagnostiky a terapeutické indikace je nezbytné získat dostatečné množství vhodného materiálu pro provedení imunohistochemických, cytogenetických a molekulárně-genetických vyšetření.
Posouzení a stanovení rozpočtu BAL. Toto vyšetření slouží k posouzení difúzních plicních lézí a bývá součástí diagnostického algoritmu u granulomatózních plicních procesů (zejména sarkoidózy).
I. STANOVENÍ BIOLOGICKÉ POVAHY PROCESU
Papanicolaouova společnost pro cytopatologii (P.S.C.) vydala v roce 2016 aktualizovanou doporučenou terminologii pro referování závěrů cytologických vyšetření v pneumologii (21,22). Ta bere v úvahu upravenou klasifikaci pro malé bioptické vzorky a cytologická vyšetření a rovněž pomocné vyšetřovací metodiky doporučené WHO klasifikací nádorů plic (23). Zjednodušený přehled tohoto dělení je uveden v tabulce 1. Zatímco WHO klasifikace popisuje jasně definované jednotky, systém P.S.C. nabízí navíc kategorii nediagnostickou a dvě hraniční skupiny. Ty umožňují vyjádřit míru jistoty, s jakou je cytopatolog schopen vyloučit malignitu, a pomáhají tak snížit počet falešně negativních i falešně pozitivních výsledků (22). Stratifikace rizika malignity u jednotlivých diagnostických kategorií pomáhá pneumologovi rozhodnout, jak pokračovat v dalším diagnostickém a terapeutickém algoritmu.
Tab. 1. Diagnostické kategorie navržené Papanicolaouovou cytopatologickou společností pro oblast pneumologické cytologie, aktualizované v roce 2016. 
Modifikováno dle Layfield et al. (22)
* dle typu a podtypu nádoru
SFT – solitární fibrózní tumorDo nediagnostické kategorie (I.) řadíme nálezy, které neposkytují bližší informaci o plicním ložisku identifikovaném zobrazovacími metodami. Příčinou může být způsob odběru či technické nesrovnalosti při zhotovení preparátu, jeho fixaci nebo barvení. Preparáty jsou buď nehodnotitelné nebo v nich nalézáme řasinkové, pohárkové a bazální epitelie bronchů, kubickou výstelku bronchiolů, pneumocyty a alveolární makrofágy. V tomto případě samozřejmě přítomnost elementů spadajících do kategorie „negativní nález“ možnost malignity nevylučuje.
Kategorie „negativní nález“ (II.) obsahuje celou řadu zánětlivých a degenerativních procesů. Těmi jsou např. akutní zánětlivé změny konzistentní s diagnózou abscesu či pneumonie, granulomatózní záněty (sarkoidóza, mykotické a mykobakteriální infekce), virové pneumonie, infekce Pneumocystis jiroveci, cytologické změny popisované při plicním infarktu či lokalizovaném primárním plicním amyloidu. V případě neurčitého nálezu na zobrazovacích metodách bez jasně definovaných ložiskových změn a nepřítomnosti maligních či atypických buněk v cytologickém materiálu lze vzorek označit za negativní ve smyslu malignity i v případě nálezu blandních respiračních epitelií, pneumocytů či alveolárních makrofágů.
Kategorie „atypické změny“ (III.) by měla být používána minimálně, neboť má poměrně nízkou reprodukovatelnost. Umožňuje vyjádřit diagnostickou nejistotu spíše se přiklánějící k nenádorovému procesu, avšak nádor (benigní či maligní) jednoznačně nevylučuje. Může jít o vzorky obsahující buňky s atypiemi výraznějšími než asociovanými se zánětem či reparací, ale ještě nedosahujícími stupně atypií, které vídáme u nálezů suspektních z malignity. Jednoznačné rozhodnutí může být navíc limitováno nízkou celularitou vzorku. Do této kategorie rovněž spadají vzorky pouze s některými, avšak ne všemi rysy, které by postačovaly k přiřazení k diagnostické jednotce ze skupiny benigních či low-grade nádorových lézí.
Skupina benigních či low-grade nádorových lézí (IV.) je rezervovaná pro více diagnostických jednotek (tab. 1), jejichž specifické cytologické rysy nalézáme v konkrétním vyšetřovaném cytologickém vzorku. Do této skupiny spadají benigní nádory a nádory, které jsou obvykle benigní, ale mají i svůj maligní protějšek, který není možné na základě cytologického vyšetření bezpečně diferencovat. Benigní nádory a pseudotumorózní léze neinfekční etiologie představují až 30 % vzorků získaných transthorakální tenkojehlovou aspirací, neboť jsou často identifikovány náhodně zobrazovacími metodami jako solitární plicní uzly (21). Pro klinika nález z této kategorie znamená, že by měl usilovat o maximálně možný konzervativní přístup zejména v případech špatného zdravotního stavu u starších a polymorbidních pacientů.
Nálezy spadajících do kategorie „suspektní z malignity“ (V.) představují vzorky s morfologickými rysy poukazujícími na malignitu, ale nejsou zcela diagnostické z důvodu nízké celularity či nedostatečně výrazných morfologických rysů. Rovněž tato skupina by vzhledem k relativně nízké opakovatelnosti měla být užívána co nejméně. Pro multidisciplinární tým znamená tento závěr nutnost pečlivé rozvahy a korelace s klinickými a radiologickými údaji před dalším diagnostickým či definitivním terapeutickým postupem.
Kategorie maligních nálezů (VI.) se vyznačuje vysokou reproducibilitou a diagnostickou přesností, což vyplývá z jednoznačných maligních cytologických rysů. Spadají do ní diagnostické jednotky malobuněčný karcinom, karcinoid, adenokarcinom, dlaždicobuněčný karcinom, nemalobuněčný karcinom blíže nespecifikovaný, lymfomy, metastatické karcinomy a sarkomy a další méně časté jednotky. Problematikou subtypizace základních primárních plicních malignit z cytologického materiálu se bude zabývat další část této publikace.
Mezi nejčastější diferenciálně diagnostické problémy při zařazení nálezů do jedné z výše uvedených kategorií patří zejména identifikace benigních elementů bronchopulmonálního systému, které mohou vykazovat různé stupně sekundárních atypií (reaktivní atypie ciliárního epitelu či dlaždicovou metaplázii) v důsledku zánětlivého procesu či proběhlé chemoterapie anebo radioterapie. Hyperplázie pneumocytů II. typu, která se vyskytuje v asociaci s organizující se pneumonií, některými procesy infekční etiologie či plicním infarktem, může imitovat adenokarcinom. V nátěrech pak nalézáme trojrozměrné shluky buněk s poměrně vysokým nukleocytoplazmatickým poměrem a hyperchromními jádry, hrubou strukturou chromatinu a nápadnými jadérky. Odlišení benigní a maligní povahy procesu je v takových případech extrémně obtížné. Ke správné diagnóze může pomoci nízká buněčnost, větší mezery mezi buňkami a pilovité okraje kohezivních skupin buněk, které podporují diagnózu reaktivní léze. V případě malignity jsou dominující buněčnou populací buňky nádorové, zatímco početně nápadná zánětlivá populace buněk upřednostňuje benigní povahu procesu. V aspirátech z lymfatických uzlin může být obtížné odlišit malobuněčný karcinom od non-hodgkinských lymfomů z malých lymfocytů (obr. 1A) a obzvláště při výraznějších odběrových a fixačních artefaktech pak v některých případech rovněž od reaktivních změn nenádorových lymfocytů (obr. 1B). Problematikou k samostatnému pojednání je odlišení aktivovaných a degenerativně změněných mezotelií v pleurálním výpotku od elementů adenokarcinomu či maligního mezoteliomu (24).
Obr. 1. Diferenciální diagnostika lymfocytárních afekcí. V aspirátech z lymfatických uzlin může být obtížné odlišit malobuněčný karcinom od non-hodgkinských lymfomů z malých lymfocytů a v některých případech rovněž od reaktivních změn nenádorových lymfocytů.
A – nátěr z EBUS-FNA mediastinální lymfatické uzliny při infiltraci chronickou lymfatickou leukémií (CLL) (Giemsa, 400x)
B – nátěr z EBUS-FNA mediastinální lymfatické uzliny s roztěrovými a fixačními artefakty lymfocytů (Giemsa, 200x)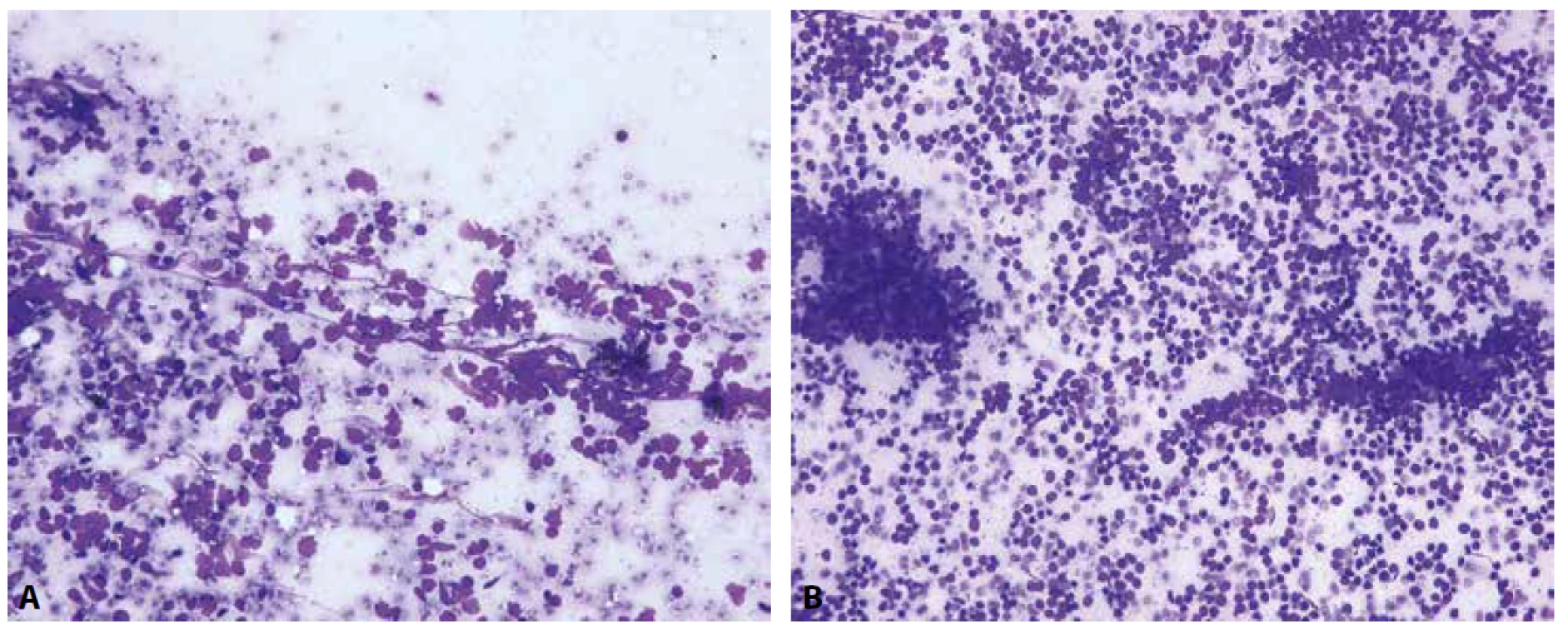
II. URČENÍ TYPU MALIGNÍHO NÁDORU
Morfologická verifikace nádoru a rozsahu nádorového procesu je nezbytným předpokladem pro určení klinického stádia onemocnění a jeho následnou léčbu. Dle údajů z Národního onkologického registru (http://www.uzis.cz/registry-nzis/nor) je v České republice stále přibližně 20 % nádorů plic diagnostikováno pouze cytologicky. Histologický odběr často není technicky proveditelný nebo by byl pro pacienta příliš zatěžující, eventuálně je materiál odebraný k histologickému vyšetření nediagnostický. Odlišit cytologicky SCLC od NSCLC pouze na základě morfologických kritérií je možné přibližně v 90 % případů. Typ NSCLC je doporučeno specifikovat, kdykoliv je to z morfologických rysů možné, nicméně až ve 40 % případů se cytologicky nedaří najít jednoznačně identifikující rysy (2).
Adenokarcinom je cytologicky charakterizovaný trojrozměrnými kohezivními skupinami buněk, pseudopapilárními či acinárními formacemi nebo pravými papilami s fibrovaskulárním stromatem. Typicky mají jednotlivé buňky bazofilní cytoplazmu, která může být homogenní, jemně granulární či pěnitá, často bývá průsvitná a/nebo vakuolizovaná. Jádra jsou většinou uložená excentricky, s variabilní strukturou chromatinu a jedním nápadným jadérkem (obr. 2A). V některých případech je možné z architektoniky nádorových buněk v nátěrech usuzovat na podtyp adenokarcinomu, nicméně tyto rysy jsou většinou nespecifické a vzhledem k minimálnímu terapeutickému významu není v současné době potřeba bližší cytologickou subkategorizaci adenokarcinomu provádět.
Obr. 2. Základní diagnostické jednotky maligních epitelových nádorů plic.
A – metastatický adenokarcinom s excentricky umístěnými jádry a místy patrnou vakuolizací cytoplazmy (EBUS-FNA mediastinální lymfatické uzliny; Diff- -Quik®, 400x)
B – otisk excize endobronchiálně rostoucího dlaždicobuněčného karcinomu s denzní plachtovitou cytoplazmou a nepravidelnými jádry s hrubým chromatinem (Diff-Quik®, 400x)
C - metastáza malobuněčného karcinomu, charakteristického skupinkami menších buněk s úzkým cytoplazmatickým lemem a arteficiální deformací jader (perkutánní tenkojehlová aspirace subklavikulární lymfatické uzliny; Diff-Quik®, 400x)
D – karcinoid bronchu - poměrně uniformní buňky s bazofilní jemně granulární cytoplazmou, tvořící trabekuly (rozlišení mezi typickým a atypickým karcinoidem není z cytologického vyšetření možné) (nátěr z endobronchiálního aspirátu; Giemsa, 200x)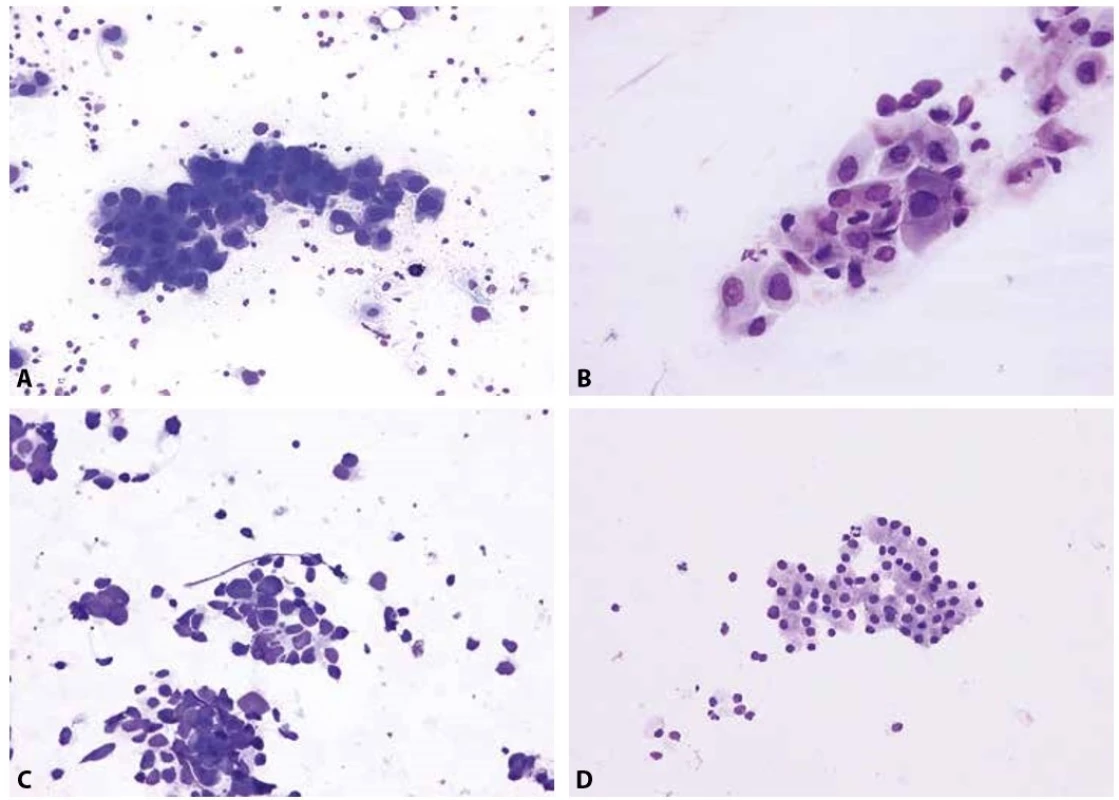
Dlaždicobuněčná diferenciace se v nádorech cytologicky projevuje jako keratinizace cytoplazmy, tj. změna její barvitelnosti – v Papanicolaouově barvení do žlutooranžova až červena, v Romanowskiho barvení do namodralých odstínů. Cytoplazma nabývá denzního, kompaktního vzhledu. Nádorové buňky se vyskytují v kohezivních shlucích či jako jednotlivé pleomorfní elementy. Mají kulatý či oválný až protáhlý tvar, někdy až charakteristického vzhledu „pulce“, a zřetelné hranice cytoplazmy. Jádra bývají uložena centrálně, jsou hyperchromní, místy až pyknotická, bez nápadných jadérek (obr. 2B).
V případě nízce diferencovaných nádorů, kde není možné morfologicky identifikovat rysy žádné z výše uvedených kategorií, je nutné přistoupit k vyšetření imunocytochemickému nebo imunohistochemickému. S výhodou se v tomto případě používá právě materiál v cytobloku, neboť jednotlivé metodiky není nutné separátně validovat pro použití na cytologickém materiálu, ale lze využít FFPE protokoly (25). Pro potřeby této publikace používáme pro imunoperoxidázové barvení na cytologických sklech termín imunocytochemie, na preparátech z cytobloku termín imunohistochemie. Panely protilátek používaných v těchto indikacích jsou obdobné jako pro vyšetřování materiálu z resekátu či malých bioptických vzorků (2). Obzvlášt v cytologii, kde je množství materiálu omezené, je nutné použít co nejvíce limitovaný panel protilátek, aby bylo zachováno maximální množství vzorku k případným následným molekulárním vyšetřením (26). V cytologických výstupech jsou logicky častěji než u vyšetření histologických používány diagnostické kategorie NSCLC, spíše adenokarcinom či NSCLC, spíše dlaždicobuněčný karcinom apod. (2, 4). I přes imunocytochemickou / imunohistochemickou typizaci je v některých případech velice obtížné až nemožné typy NSCLC cytologicky odlišit a spadají do kategorie NSCLC, blíže nespecifikovaný (NSCLC, NOS) (21). Dle výsledků studií dosahuje shoda cytologické a histologické diagnózy adenokarcinomu vs. dlaždicobuněčného karcinomu bez použití dalších speciálních barvení 50 - 70 %, nicméně s použitím imunocytochemie / imunohistochemie se významně zvyšuje a použití kategorie NSCLC, NOS klesá pod 10 % případů i v případě cytologických vzorků (27,28).
Malobuněčné karcinomy jsou cytologicky charakterizované jednotlivými malými až středně velkými buňkami s úzkým cytoplazmatickým lemem, případně menšími skupinkami buněk obdobného vzhledu. Jádra nádorových buněk mají charakteristický jemně granulární rovnoměrně rozložený chromatin a nenápadná či chybějící jadérka. Typicky jsou přítomny odběrové artefakty se „stíracím“ efektem jader, který koreluje s histologicky dobře známým Azzopardiho fenoménem (obr. 2C). Nádorové buňky jsou často fragmentované a pozadí je nekrotické. Odlišení SCLC od NSCLC může být obtížné a bývá zdrojem diagnostických omylů (29). Někdy vedou k záměně cytoplazmatické změny malobuněčného karcinomu s pseudoglandulárními či skvamoidními rysy a rovněž velikost jader obou kategorií se může překrývat. V těchto případech pomohou k odlišení SCLC od NSCLC zejména rysy jaderné (chybění jadérek, typický vzhled chromatinu, překrývání jader, apoptotická tělíska a relativně vysoký počet mitóz), a pokud je k dispozici vhodný materiál, samozřejmě imunocytochemické / imunohistochemické vyšetření.
Buňky karcinoidu se v cytologických nátěrech vyskytují ve skupinkách a mohou vytvářet palisády, trabekuly či aciny. Jednotlivé buňky jsou poměrně uniformní, kulaté či oválné až vřetenité a mají bazofilní jemně granulární cytoplazmu (obr. 2D). Rozlišení mezi typickým a atypickým karcinoidem není z cytologického vyšetření možné.
Na tomto místě je vhodné připomenout, že dle doporučení IASLC/ATS/ERSC by měly být vzorky cytologické pokud možno interpretovány ve spojitosti s histologickými vzorky z malých odběrů. Tyto metody se vzájemně doplňují a jedině jejich kombinací je možné dosáhnout zvýšení přesnosti definitivní diagnózy a omezení diagnostické kategorie NSCLC, NOS na minimum (2). Diagnostika dalších vzácnějších jednotek přesahuje rámec tohoto přehledového článku.
III. HODNOCENÍ STAVU MEDIASTINÁLNÍCH A HILOVÝCH LYMFATICKÝCH UZLIN - STAGING NÁDORU
Hlavními indikacemi k cytologickému vyšetření mediastinálních a hilových lymfatických uzlin jsou staging a restaging karcinomu plic, diagnostika karcinomu plic bez viditelné endobronchiální léze, staging extrathorakálního nádorového onemocnění a diagnostika granulomatózního procesu.
Bronchoskopické vyšetření pod kontrolou EBUS je výhodnou minimálně invazivní alternativou mediastinoskopie a videoasistované thorakoskopie zejména pro staging mediastinálních a hilových lymfatických uzlin u pacientů s karcinomem plic, kde zásadně ovlivňuje další terapeutická rozhodnutí (30). Tato metoda v kombinaci s ROSE umožňuje přesnější transbronchiální aspiraci lymfatických uzlin těchto lokalizací tenkou jehlou. Materiál je z odběrové jehly ihned přenesen a rozetřen na podložní sklo a nabarven jednou z rychlých barvících metod (nejčastěji barvením Diff-Quik®), a na místě zhodnocen. Tento proces celkově netrvá déle než několik minut. Pokud je získán diagnostický materiál, je možno EBUS-FNA ukončit a minimalizovat tak rizika spojená s celkovou anestezií. Optimálně jsou v případě diagnózy maligního nádoru a únosnosti délky trvání vyšetření pro pacienta provedeny další aspirace tenkou jehlou, materiál je zpracován metodou cytobloku a v reálném čase je makroskopicky zhodnocena jeho adekvátnost pro vyšetření prediktivních biomarkerů. V případě suspekce z lymfoproliferativního procesu je možné indikovat odběr materiálu na průtokovou cytometrii či molekulární vyšetření ke stanovení klonality procesu. Pokud je v průběhu ROSE diagnostikován granulomatózní proces (obr. 3A,B), je možné zaslat materiál z dalších odběrů na mikrobiologické vyšetření apod.
Obr. 3. Granulomatózní proces je cytologicky charakterizovaný nálezem epiteloidních buněk a případně buněk obrovských mnohojaderných.
A – obrovská mnohojaderná buňka s asteroidní inkluzí (šipka) u pacienta se sarkoidózou (nátěr z EBUS-FNA nitrohrudní lymfatické uzliny, Diff-Quik®, 400x)
B – epiteloidní buňky, vyskytující se ve shlucích mezi buňkami uzliny, mají protáhlý tvar jader, jemný chromatin a bohatou, nezřetelně ohraničenou cytoplazmu (nátěr z EBUS-FNA lymfatické uzliny u pacienta se sarkoidózou; Diff-Quik®, 400x)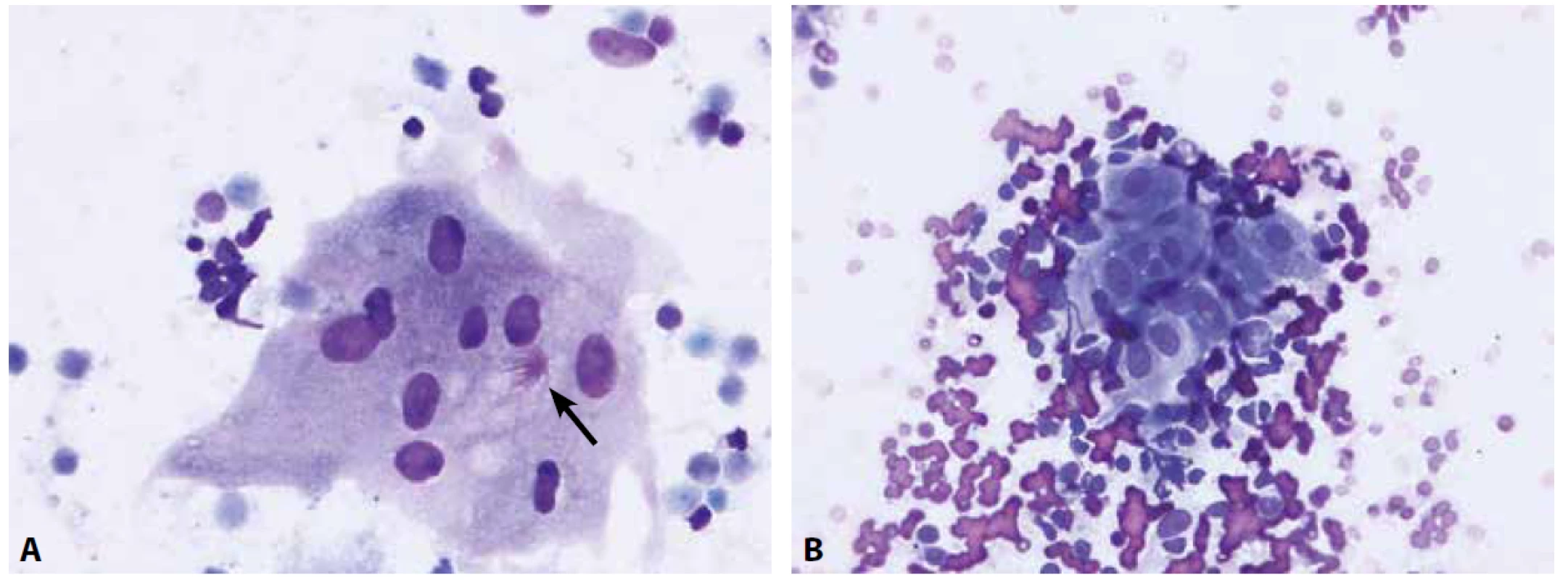
Kombinací EBUS-FNA s ROSE lze omezit opakovaná bronchoskopická vyšetření v celkové anestezii na minimum a nahradit i řadu diagnostických chirurgických výkonů, zejména mediastinoskopií. Pro zvýšení konkordance s konečnou diagnózou a optimalizaci směrování adekvátního materiálu k následným vyšetřovacím modalitám jsou zásadní zkušenosti hodnotící osoby (cytopatologa či pneumocytologa) (31). Obecně představuje ROSE cytologickou paralelu k histologickému peroperačnímu vyšetření. Senzitivita a pozitivní prediktivní hodnota této metodiky je udávána přes 90 % (32), negativní prediktivní hodnota je ovšem nižší, zejména vzhledem k časové limitaci jak odběru, tak analýzy vzorku či k artefaktům při zpracování odebraného materiálu. Vzorek EBUS-FNA je považován za adekvátní v případě dostatečného množství diagnostického materiálu z patologického procesu nebo přítomnosti benigní lymfoidní populace (většinou bývá udáváno nad 100 lymfocytů a/nebo pigmentovaných makrofágů v každém z minimálně pěti zorných polí s nízkým rozlišením), která indikuje, že odebraný materiál skutečně pochází z lymfatické uzliny (33).
Hlavní nevýhodou ROSE je potřeba kvalifikovaného diagnostika na místě odběru. Vzhledem k časové náročnosti procesu (jedno bronchoskopické vyšetření s EBUS-FNA trvá průměrně 45 - 60 minut) jej není možné na všech pracovištích personálně a zčásti ani finančně zajistit. V konečném efektu se ovšem jedná o ekonomicky výhodnou metodiku, neboť snižuje celkový počet klinických i cytologických vyšetření a vede ke zlepšení diagnostické výtěžnosti následných specializovaných vyšetření (34,35). Proto by ROSE měla být pokud možno součástí každého odběru EBUS-FNA u pacientů se suspekcí z karcinomu plic nebo se zvětšenými mediastinálními či hilovými lymfatickými uzlinami (36).
IV. ZAJIŠTĚNÍ MATERIÁLU PRO NÁSLEDNÁ SPECIALIZOVANÁ VYŠETŘENÍ
S rozmachem cílené léčby karcinomu plic stále stoupají požadavky na následná vyšetření materiálu získaného z oblasti respiračního traktu. Dříve se jednalo hlavně o metody kultivační s detekcí mikrobiálních agens, průtokovou cytometrii k diagnostice lymfoproliferativních onemocnění a imunocytochemická / imunohistochemická vyšetření upřesňující diagnostiku nádorového procesu. Tzv. personalizovaná léčba rozšířila potřebu doplňujících vyšetření zejména o metody molekulární (určující přítomnost klinicky relevantních genetických změn jako bodových mutací, insercí či delecí, změny počtu kopií a chromozomálních aberací), ale i imunohistochemické, jejichž výsledek poukazuje na citlivost vůči jednotlivým specifickým léčebným přípravkům (37). V současnosti se většina testovaných molekulárních cílů týká především adenokarcinomů, resp. NSCLC, NOS, nicméně nové přípravky cílené na dlaždicobuněčné karcinomy jsou ve stádiu vývoje. K podrobnostem týkajícím se molekulární diagnostiky karcinomu plic obecně odkazujeme na přehledový článek z Česko-slovenské patologie a Soudního lékařství z roku 2017 (38).
Testování mutací v genu EGFR je možné spolehlivě provést z FFPE materiálu, a proto je s výhodou mít k dispozici vzorek v cytobloku (39,40). Ve velké části případů jej však limituje hypocelularita (41). Ostatní cytologický materiál (nátěry, výpotky) je co do kvality DNA pro použití metod založených na polymerázové řetězcové reakci (PCR) srovnatelný s materiálem histologickým či materiálem v cytobloku, či dokonce kvalitnější (19,42-44). Nové studie potvrdily též možnost použití materiálu z cytologických preparátů k sekvenování nové generace (NGS) při zachování vysoké senzitivity srovnatelné s FFPE materiálem (45,46). Poměr zastoupení a množství nádorových buněk musí odpovídat analytické senzitivitě platformy používané k molekulární analýze. Ke zvýšení podílu nádorových buněk je možné použít manuální makrodisekci, ve vzácnějších případech eventuálně i laserovou mikrodisekci.
Imunocytochemické testování cytologických nátěrů k identifikaci pacientů vhodných pro léčbu ALK-tyrozinkinázovými inhibitory bylo v nedávné době v USA schválené organizací Food and Drug Administration (FDA), pokud je splněna podmínka přítomnosti minimálního počtu vyšetřovaných buněk (alespoň 100 nádorových buněk) (47). Slibnou skríningovou metodou se ukazuje být i imunocytochemické vyšetření protilátkou proti ROS1. Na cytologických nátěrech je rovněž možné provádět in situ hybridizační vyšetření k detekci přestaveb v genech ALK a ROS1 či určení amplifikace genu MET (48). Imunoperoxidázové i cytogenetické metodiky k testování prediktivních markerů na cytologických vzorcích se však musí nově ověřit a tento proces zatím není obecně standardizován. Většina laboratoří proto upřednostňuje provádění těchto vyšetření z materiálu v cytobloku, neboť se způsobem zpracování nejvíce překrývá se zpracováním malých bioptických vzorků a nepotřebuje projít dalším validačním procesem.
S příchodem imunoterapie dále vyvstala otázka imunocytochemického / imunohistochemického vyšetření exprese PD-L1 na cytologických vzorcích. Na větším souboru pacientů nebylo toto testování validováno a zatím nejsou k dispozici mezinárodní závazná doporučení (49). V České republice je na základě konsenzu týkajícího se metodického aspektu vyšetřování exprese PD-L1 z roku 2016 (http://www.patologie.info/standardy/28) testování z cytobloku možné, pokud materiál pochází ze solidní tkáně (lymfatická uzlina, nádorové ložisko), nikoliv z výpotku.
Cytopatolog je zodpovědný za identifikaci nádorů, které mají být následně molekulárně nebo imunocytochemicky / imunohistochemicky vyšetřeny, a za adekvátnost vyšetřovaného materiálu, jehož výtěžnost se významně zvyšuje právě pomocí EBUS-FNA. Zatímco bez řízeného odběru vzorky v cytobloku nedostačují pro následné molekulární vyšetření až ve 26 % případů, s vhodným usměrněním průběhu odběru pomocí ROSE množství těchto případů klesá na 4 % (6). Schematický diagram příkladu toku materiálu je znázorněn na obr. 4. Trend využití ROSE při cytologických odběrech roste celosvětově právě z důvodů potřeby zajištění dostatečného materiálu pro následná specializovaná vyšetření. Popularita ROSE v poslední době stoupá i v průběhu odběrů jehlových biopsií pod CT kontrolou, kdy se v reálném čase posuzuje adekvátnost odběru zhotovením otisku získané tkáně (touch imprint – TI), a to nejen na poli plicní diagnostiky (50).
Obr. 4. Schematické znázornění toku materiálu při endoskopickém odběru pomocí aspirace tenkou jehlou pod kontrolou endobronchiálního ultrazvuku (EBUS-FNA) a posouzení adekvátnosti materiálu v době odběru (rapid on-site evaluation, ROSE). 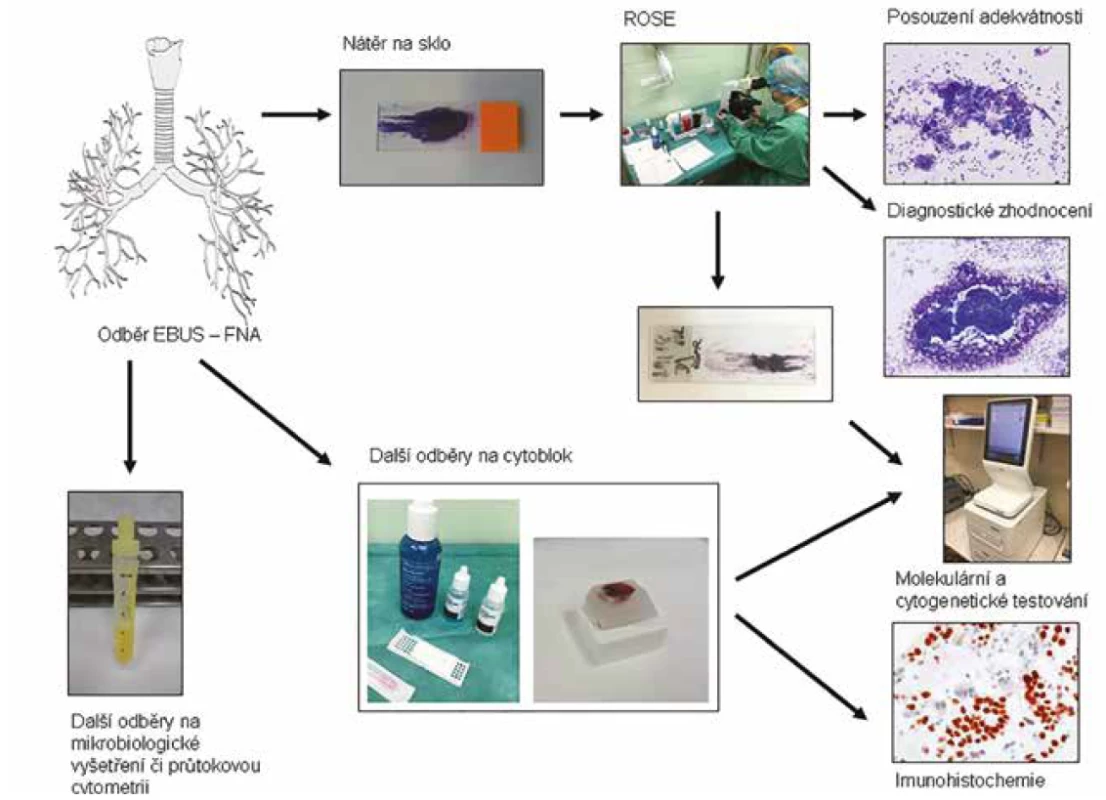
Proces analyzování jednotlivých biomarkerů se liší v závislosti na zvyklostech pracoviště a každá laboratoř musí stanovit vlastní standardní vyšetřovací postupy, které je nutné validovat interně a pokud možno také externě. Je na cytopatologově rozhodnutí, jaký materiál indikuje k jednotlivým speciálním metodám. Na našem pracovišti se osvědčilo použít cytologický vzorek z podložního skla (nátěry, výpotky) k vyšetření EGFR a ponechat materiál v cytobloku k vyšetření imunohistochemickému, eventuálně k fluorescenční in situ hybridizaci (FISH). V případě malého množství materiálu zůstává prioritou testování EGFR nad testováním ALK, jako je tomu u malých bioptických vzorků.
V. POSOUZENÍ A STANOVENÍ ROZPOČTU BAL
Vyšetření bronchoalveolární tekutiny po provedené laváži fyziologickým roztokem (BAL) se provádí zejména u pacientů s neustupujícími pneumoniemi, difúzním plicním infiltrátem či podezřením na intersticiální plicní proces. Pro vyšetření celkového počtu a diferenciálního rozpočtu se nejčastěji používá barvení dle Maye-Grünwalda-Giemsy, pro mikrobiologické vyšetření lze provést barvení PAS, dle Grama či Grocotta. Při hodnocení buněčného rozpočtu je doporučováno prohlédnout minimálně 300, optimálně 600 buněk (51). Výstupy vyšetření BAL poskytnou informace týkající se převahy aktivovaných alveolárních makrofágů (poukazujících na možnost diagnózy deskvamativní intersticiální pneumonie), zvýšeného počtu lymfocytů (u pacientů se sarkoidózou, hypersenzitivní pneumonií či některými virovými či mykobakteriálními plicními procesy), neutrofilů (u chronické obstrukční plicní choroby, bakteriální pneumonie apod.) či eozinofilů (spojovaného s asthma bronchiale a jinými eozinofilními plicními procesy) (viz tabulka 2). U dětských pacientů s rizikem aspirační pneumonie se využívá BAL k detekci lipofágů, jejichž zvýšený počet je asociovaný s gastroezofageáním refluxem. V BAL mohou být rovněž detekovány buňky nádorové, siderofágy u plicních hemoragických syndromů, extracelulární azbestová tělíska či extracelulární PAS pozitivní depozita u plicní alveolární proteinózy. Průkaz kolonií bakterií, mykotických vláken či intracelulárních virových inkluzí má význam v diagnostice oportunních infekcí zejména u imunokompromitovaných pacientů s plicními infiltráty (53). V diagnostice idiopatických intersticiálních plicních procesů hraje cytologické vyšetření BAL okrajovou úlohu a slouží spíše k vyloučení jiných onemocnění připadajících diferenciálně diagnosticky v úvahu (52,53). Nutno podotknout, že se v současné době vyšetření tekutiny z BAL spíše přesouvá ze sféry mikroskopické cytologické diagnostiky do oblasti biochemické, mikrobiologické a molekulárně genetické.
Tab. 2. Přehled kvantitativního hodnocení bronchoalveolární laváže (BAL) dle zastoupení jednotlivých buněčných typů u zdravých dospělých nekuřáků a nejčastější intersticiální plicní procesy asociované s abnormálním rozpočtem BAL. 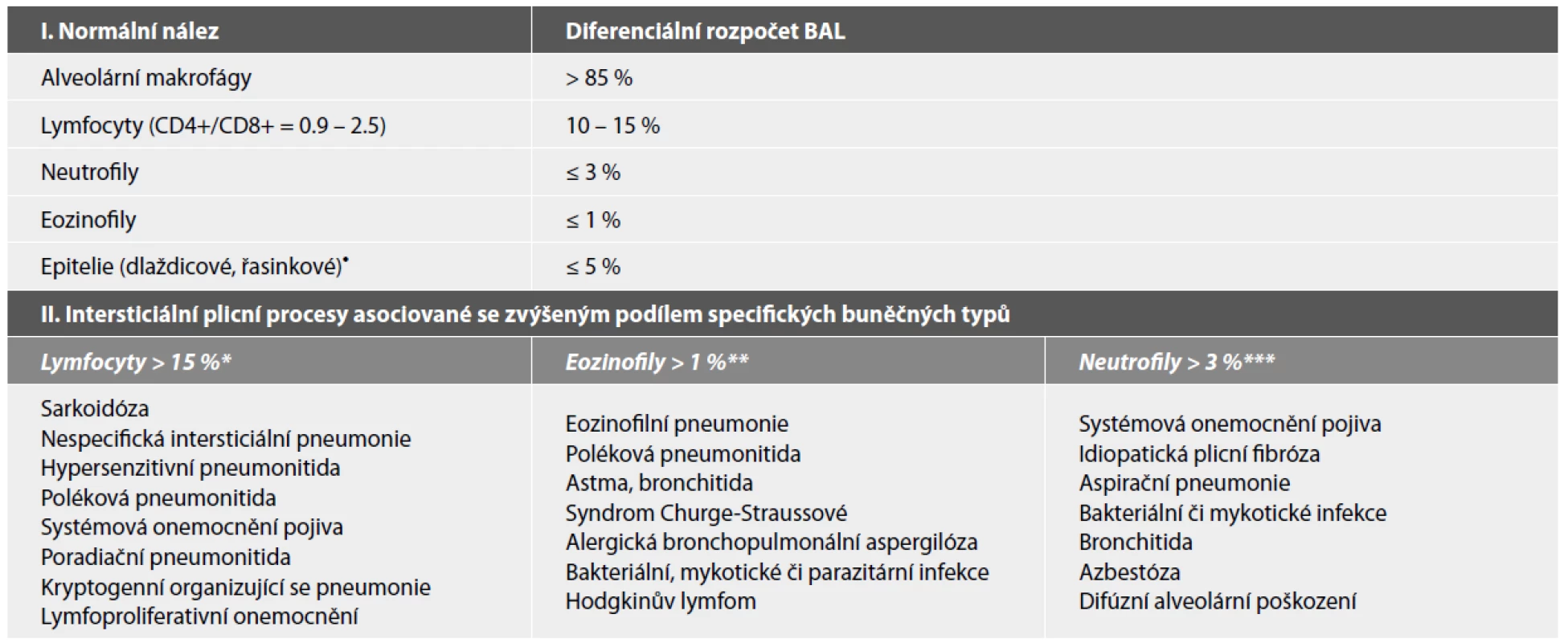
Upraveno dle Meyer et al. (52)
• přítomnost dlaždicových epitelií značí kontaminaci z horních cest dýchacích; zastoupení epitelií > 5 % je známkou suboptimální kvality vzorku
* podíl lymfocytů > 25 % bývá asociován s granulomatózními procesy (sarkoidóza, hypersenzitivní pneumonie, chronická berylióza), buněčným typem nespecifické intersticiální pneumonie (NSIP), lymfoidní intersticiální pneumonií, kryptogenní organizující se pneumonií či lymfomem; přítomnost > 50 % lymfocytů poukazuje na hypersenzitivní pneumonitidu či buněčný typ NSIP
** podíl eozinofilů > 25 % je takřka diagnostický pro akutní či chronickou eozinofilní pneumonii
*** podíl neutrofilů > 50 % provází akutní poškození plicního parenchymu, aspirační pneumonii či hnisavá infekční onemocněníZÁVĚR
S rozvojem endoskopických metod, morfologické diagnostiky z malých odběrů a rozšířením spektra diagnostických protilátek a následných vyšetření v rámci prediktivní diagnostiky získává cytologické vyšetření, resp. vzorek získaný cytologickým odběrem, nový význam. Cytologický materiál (nátěry, otisky, preparáty z výpotků) je plnohodnotným zdrojem DNA pro molekulární vyšetření, zejména mutací genu EGFR. Kvalitní materiál zpracovaný metodou cytobloku slouží k diagnostickým, ale i prediktivním imunohistochemickým vyšetřením (skríningu přestaveb v genech ALK a ROS1, expresi PD-L1) a následným cytogenetickým metodám (detekci přestavby genu ALK a ROS1 či amplifikaci genu MET). Další vyšetření prediktivních biomarkerů budou v následujících letech jistě přibývat. Jsme proto opět postaveni před úkol vytěžit více informací ze stále menšího množství materiálu. Jedině vzorek, který umožňuje splnit výše popsané podmínky, můžeme v dnešní době označit za adekvátní. Předpokládáme, že v budoucnosti tento trend bude ještě sílit, a to nejen na poli cytologie pneumologické, ale i v oblasti cytologických odběrů z jiných orgánových systémů. Konečně, jak napsal Charles Darwin, „není to ten nejsilnější, kdo přežije, ani ten nejinteligentnější, ale ten, kdo se dokáže nejlépe přizpůsobit“. Jako cytopatologové jsme si této výzvy vědomi a jsme připraveni adaptovat pracovní postupy a výstupy měnícím se klinickým požadavkům. V neposlední řadě je třeba na tomto místě zdůraznit nezbytnou multidisciplinární spolupráci jak při indikaci a organizaci odběru, tak v organizaci následného využití odebraného materiálu. Úzká spolupráce patologa, v optimálním případě posuzujícího zároveň cytologický i histologický vzorek, s pneumologem, radiologem a molekulárním biologem je zásadní nejen z důvodu stanovení co nejpřesnější diagnózy, ale i zhodnocení markerů senzitivity či rezistence na léčbu.
PODĚKOVÁNÍ
Děkujeme pracovníkům cytologické laboratoře a bronchoskopickému týmu Pneumologické kliniky 2. LF UK a FN Motol za dlouhodobou spolupráci.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Linda Čapková, Ph.D.
Ústav patologie a molekulární medicíny 2. LF UK a FN Motol
V Úvalu 84, 150 06 Praha 5
tel.: +420-224 435 658
e-mail: linda.capkova@lfmotol.cuni.cz
Zdroje
1. Thunnissen E, Kerr KM, Herth FJ, et al. The challenge of NSCLC diagnosis and predictive analysis on small samples. Practical approach of a working group. Lung Cancer 2012; 76(1): 1-18.
2. Travis WD, Brambilla E, Noguchi M, et al. Diagnosis of lung cancer in small biopsies and cytology: implications of the 2011 International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society classification. Arch Pathol Lab Med 2013; 137(5): 668-684.
3. Travis WD, Brambilla E, Nicholson AG, et al. The 2015 World Health Organization Classification of Lung Tumors: Impact of Genetic, Clinical and Radiologic Advances Since the 2004 Classification. J Thorac Oncol 2015; 10(9): 1243-1260.
4. Travis WD, Brambilla E, Noguchi M, et al. International association for the study of lung cancer/american thoracic society/european respiratory society international multidisciplinary classification of lung adenocarcinoma. J Thorac Oncol 2011; 6(2): 244-285.
5. Vašáková M, Axmann K, Čapková L, et al. Bronchologie a pneumologická cytodiagnostika: Maxdorf; 2017 : 237-240.
6. Sung S, Crapanzano JP, DiBardino D, Swinarski D, Bulman WA, Saqi A. Molecular testing on endobronchial ultrasound (EBUS) fine needle aspirates (FNA): Impact of triage. Diagn Cytopathol 2018; 46(2): 122-130.
7. Piaton E, Fabre M, Goubin-Versini I, et al. Guidelines for May-Grünwald-Giemsa staining in haematology and non-gynaecological cytopathology: recommendations of the French Society of Clinical Cytology (SFCC) and of the French Association for Quality Assurance in Anatomic and Cytologic Pathology (AFAQAP). Cytopathology 2016; 27(5): 359-368.
8. Crapanzano JP, Heymann JJ, Monaco S, Nassar A, Saqi A. The state of cell block variation and satisfaction in the era of molecular diagnostics and personalized medicine. Cytojournal 2014; 11 : 7.
9. Gupta N, Sekar A, Rajwanshi A. Role of FNAC, fluid specimens, and cell blocks for cytological diagnosis of lung cancer in the present era. J Cytol 2015; 32(4): 217-222.
10. Saqi A. The State of Cell Blocks and Ancillary Testing: Past, Present, and Future. Arch Pathol Lab Med 2016; 140(12): 1318-1322.
11. Yang MC, Liu WT, Wang CH, et al. Diagnostic value of endobronchial ultrasound-guided transbronchial lung biopsy in peripheral lung cancers. J Formos Med Assoc 2004; 103(2): 124-129.
12. Chao TY, Chien MT, Lie CH, Chung YH, Wang JL, Lin MC. Endobronchial ultrasonography-guided transbronchial needle aspiration increases the diagnostic yield of peripheral pulmonary lesions: a randomized trial. Chest 2009; 136(1): 229-236.
13. Wang JF, Baidoo C, Collins BT. Improved efficacy of endobronchial ultrasound-guided fine-needle aspiration biopsy in comparison to endobronchial ultrasound-guided miniforceps biopsy. Acta Cytol 2014; 58(2): 125-130.
14. Yao X, Gomes MM, Tsao MS, Allen CJ, Geddie W, Sekhon H. Fine-needle aspiration biopsy versus core-needle biopsy in diagnosing lung cancer: a systematic review. Curr Oncol 2012; 19(1): e16-27.
15. da Cunha Santos G, Lai SW, Saieg MA, et al. Cyto-histologic agreement in pathologic subtyping of non small cell lung carcinoma: review of 602 fine needle aspirates with follow-up surgical specimens over a nine year period and analysis of factors underlying failure to subtype. Lung Cancer 2012; 77(3): 501-506.
16. Layfield LJ, Dodd L, Witt B. Malignancy risk for the categories: Non-diagnostic, benign, atypical, suspicious, and malignant used in the categorization of endobronchial ultrasound guided-fine needle aspirates of pulmonary nodules. Diagn Cytopathol 2015; 43(11): 892-896.
17. Stoll LM, Johnson MW, Burroughs F, Li QK. Cytologic diagnosis and differential diagnosis of lung carcinoid tumors a retrospective study of 63 Cases with histologic correlation. Cancer Cytopathol 2010; 118(6): 457-467.
18. Dahlstrom JE, Langdale-Smith GM, James DT. Fine needle aspiration cytology of pulmonary lesions: a reliable diagnostic test. Pathology 2001; 33(1): 13-16.
19. Rekhtman N, Brandt SM, Sigel CS, et al. Suitability of thoracic cytology for new therapeutic paradigms in non-small cell lung carcinoma: high accuracy of tumor subtyping and feasibility of EGFR and KRAS molecular testing. J Thorac Oncol 2011; 6(3): 451-458.
20. Raab SS, Meier FA, Zarbo RJ, et al. The “Big Dog” effect: variability assessing the causes of error in diagnoses of patients with lung cancer. J Clin Oncol 2006; 24(18): 2808-2814.
21. Layfield LJ, Baloch Z, Elsheikh T, et al. Standardized terminology and nomenclature for respiratory cytology: The Papanicolaou Society of Cytopathology guidelines. Diagn Cytopathol 2016; 44(5): 399-409.
22. Layfield LJ. The Papanicolaou Society of Cytopathology classification for pulmonary specimens: an overview. Cytopathology 2016; 27(3): 149-152.
23. Travis WD, Brambilla E, Burke A, Marx A, Nicholson AG, International Agency for Research on Cancer. WHO classification of tumours of the lung, pleura, thymus and heart. Lyon: International Agency for Research on Cancer; 2015. 412 pages.
24. Hjerpe A, Ascoli V, Bedrossian C, et al. Guidelines for cytopathologic diagnosis of epithelioid and mixed type malignant mesothelioma. Complementary statement from the International Mesothelioma Interest Group, also endorsed by the International Academy of Cytology and the Papanicolaou Society of Cytopathology. Cytojournal 2015; 12 : 26.
25. Kossakowski CA, Morresi-Hauf A, Schnabel PA, Eberhardt R, Herth FJ, Warth A. Preparation of cell blocks for lung cancer diagnosis and prediction: protocol and experience of a high-volume center. Respiration 2014; 87(5): 432-438.
26. Thunnissen E, Allen TC, Adam J, et al. Immunohistochemistry of Pulmonary Biomarkers: A Perspective From Members of the Pulmonary Pathology Society. Arch Pathol Lab Med 2018; 142(3): 408-419.
27. Loo PS, Thomas SC, Nicolson MC, Fyfe MN, Kerr KM. Subtyping of undifferentiated non-small cell carcinomas in bronchial biopsy specimens. J Thorac Oncol 2010; 5(4): 442-447.
28. Nicholson AG, Gonzalez D, Shah P, Pynegar MJ, Deshmukh M, Rice A, Popat S. Refining the diagnosis and EGFR status of non-small cell lung carcinoma in biopsy and cytologic material, using a panel of mucin staining, TTF-1, cytokeratin 5/6, and P63, and EGFR mutation analysis. J Thorac Oncol 2010; 5(4): 436-441.
29. Idowu MO, Powers CN. Lung cancer cytology: potential pitfalls and mimics - a review. Int J Clin Exp Pathol 2010; 3(4): 367-385.
30. Kinsey CM, Arenberg DA. Endobronchial ultrasound-guided transbronchial needle aspiration for non-small cell lung cancer staging. Am J Respir Crit Care Med 2014; 189(6): 640-649.
31. Jain D, Allen TC, Aisner DL, et al. Rapid On-Site Evaluation of Endobronchial Ultrasound-Guided Transbronchial Needle Aspirations for the Diagnosis of Lung Cancer: A Perspective From Members of the Pulmonary Pathology Society. Arch Pathol Lab Med 2018; 142(2): 253-262.
32. Ye T, Hu H, Luo X, Chen H. The role of endobronchial ultrasound guided transbronchial needle aspiration (EBUS-TBNA) for qualitative diagnosis of mediastinal and hilar lymphadenopathy: a prospective analysis. BMC Cancer 2011; 11 : 100.
33. Nayak A, Sugrue C, Koenig S, Wasserman PG, Hoda S, Morgenstern NJ. Endobronchial ultrasound-guided transbronchial needle aspirate (EBUS-TBNA): a proposal for on-site adequacy criteria. Diagn Cytopathol 2012; 40(2): 128-137.
34. Wahidi MM, Herth F, Yasufuku K, et al. Technical Aspects of Endobronchial Ultrasound-Guided Transbronchial Needle Aspiration: CHEST Guideline and Expert Panel Report. Chest 2016; 149(3): 816-835.
35. van der Heijden EH, Casal RF, Trisolini R, al. Guideline for the acquisition and preparation of conventional and endobronchial ultrasound-guided transbronchial needle aspiration specimens for the diagnosis and molecular testing of patients with known or suspected lung cancer. Respiration 2014; 88(6): 500-ř17.
36. Oki M, Saka H, Kitagawa C, Kogure Y, Murata N, Adachi T, Ando M. Rapid on-site cytologic evaluation during endobronchial ultrasound-guided transbronchial needle aspiration for diagnosing lung cancer: a randomized study. Respiration 2013; 85(6): 486-492.
37. Witt BL, Wallander ML, Layfield LJ, Hirschowitz S. Respiratory cytology in the era of molecular diagnostics: a review. Diagn Cytopathol 2012; 40(6): 556-563.
38. Matěj R, Rohan Z, Němejcová K, Dundr P. Molecular pathology of lung cancer in routine diagnostic practice: 2017 update. Cesk Patol 2017; 53(4): 159-166.
39. Harada S, Agosto-Arroyo E, Levesque JA, Alston E, Janowski KM, Coshatt GM, Eltoum IA. Poor cell block adequacy rate for molecular testing improved with the addition of Diff-Quik-stained smears: Need for better cell block processing. Cancer Cytopathol 2015; 123(8): 480-487.
40. Lindeman NI, Cagle PT, Beasley MB, et al. Molecular testing guideline for selection of lung cancer patients for EGFR and ALK tyrosine kinase inhibitors: guideline from the College of American Pathologists, International Association for the Study of Lung Cancer, and Association for Molecular Pathology. J Thorac Oncol 2013; 8(7): 823-859.
41. Knoepp SM, Roh MH. Ancillary techniques on direct-smear aspirate slides: a significant evolution for cytopathology techniques. Cancer Cytopathol 2013; 121(3): 120-128.
42. Shiau CJ, Babwah JP, da Cunha Santos G, et al. Sample features associated with success rates in population-based EGFR mutation testing. J Thorac Oncol 2014; 9(7): 947-956.
43. da Cunha Santos G, Saieg MA. Preanalytic parameters in epidermal growth factor receptor mutation testing for non-small cell lung carcinoma: A review of cytologic series. Cancer Cytopathol 2015; 123(11): 633-643.
44. da Cunha Santos G, Saieg MA, Geddie W, Leighl N. EGFR gene status in cytological samples of nonsmall cell lung carcinoma: controversies and opportunities. Cancer Cytopathol 2011; 119(2): 80-91.
45. Roy-Chowdhuri S, Goswami RS, Chen H, et al. Factors affecting the success of next-generation sequencing in cytology specimens. Cancer Cytopathol 2015; 123(11): 659-668.
46. Karnes HE, Duncavage EJ, Bernadt CT. Targeted next-generation sequencing using fine-needle aspirates from adenocarcinomas of the lung. Cancer Cytopathol 2014; 122(2): 104-113.
47. Zhou F, Moreira AL. Lung Carcinoma Predictive Biomarker Testing by Immunoperoxidase Stains in Cytology and Small Biopsy Specimens: Advantages and Limitations. Arch Pathol Lab Med 2016; 140(12): 1331-1337.
48. Savic S, Bubendorf L. Common Fluorescence In Situ Hybridization Applications in Cytology. Arch Pathol Lab Med 2016; 140(12): 1323-1330.
49. Layfield LJ, Roy-Chowdhuri S, Baloch Z, et al. Utilization of ancillary studies in the cytologic diagnosis of respiratory lesions: The papanicolaou society of cytopathology consensus recommendations for respiratory cytology. Diagn Cytopathol 2016; 44(12): 1000-1009.
50. Gonzalez MF, Akhtar I, Manucha V. Changing Trends and Practices in Cytopathology. Acta Cytol 2017; 61(2): 91-95.
51. Radha S, Afroz T, Prasad S, Ravindra N. Diagnostic utility of bronchoalveolar lavage. J Cytol 2014; 31(3): 136-138.
52. Meyer KC, Raghu G, Baughman RP, et al. An official American Thoracic Society clinical practice guideline: the clinical utility of bronchoalveolar lavage cellular analysis in interstitial lung disease. Am J Respir Crit Care Med 2012; 185(9): 1004-1014.
53. Michael CW, Hoda RS, Saqi A, Kazakov J, Elsheikh T, Azar N, Ohori NP. Committee I: Indications for pulmonary cytology sampling methods. Diagn Cytopathol 2016; 44(12): 1010-1023.
Štítky
Patologie Soudní lékařství Toxikologie
Článek Jaká je vaše diagnóza?
Článek vyšel v časopiseČesko-slovenská patologie

2019 Číslo 1-
Všechny články tohoto čísla
- Aktuální otázky tenkojehlové aspirační biopsie štítné žlázy
- Pneumologická cytodiagnostika – state of the art 2019
- Cytopatologie - State of the Art (2. část)
- Aktuální pohled na močovou cytologii: Co přináší Pařížská klasifikace?
- Primární maligní obrovskobuněčný nádor pažní kosti mikroskopicky napodobující chondroblastom – kazuistika
- Noonanovej syndróm z pohľadu fetopatológa
- MONITOR, aneb nemělo by vám uniknout, že...
- Imunohistochemická diagnostika morbus Hirschsprung pomocí kalretininu
- Opavské Muzeum patologie je moje srdeční záležitost
- Jaká je vaše diagnóza?
- Nový systém pro sjednocené hodnocení tenkojehlových aspiračních cytologií slinných žláz: Co nového přinesl „tzv. Milánský systém reportování“ do cytodiagnostiky lézí slinných žláz?
- Jaká je vaše diagnóza? Odpověď: Difúzny leptomeningeálny glioneuronálny tumor (diffuse leptomeningeal glioneuronal tumor)
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Aktuální otázky tenkojehlové aspirační biopsie štítné žlázy
- Aktuální pohled na močovou cytologii: Co přináší Pařížská klasifikace?
- Noonanovej syndróm z pohľadu fetopatológa
- Pneumologická cytodiagnostika – state of the art 2019
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



