-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Prediktivní diagnostika adenokarcinomu žaludku – stav v roce 2018
Predictive diagnostics of gastric cancer in 2018
Anti-HER2 monoclonal antibody trastuzumab remains the only targeted therapy of gastric carcinoma based on histopathological predictive diagnostics used in current routine clinical practice. In the Czech Republic only the adenocarcinomas with HER2 immunohistochemical score of 3+, together with HER2 amplification detected with in situ hybridization are indicated for treatment with trastuzumab. There has been recent progress in our understanding of the molecular biology of gastric cancer, the role of its tumor microenvironment and vascular supply points to PD-1/PD-L1 and VEGFR2 as possible future targets of targeted therapy. Unfortunately, the interpretation of the results of pharmacological studies, as well as establishing new algorithms of predictive diagnostics are complicated by insufficient molecular stratification of tumors enrolled in the study groups.
Keywords:
stomach – gastric – adenocarcinoma – predictive diagnostics – targeted therapy – HER2 – PD-1 – PD-L1 – VEGFR
Autoři: Ondřej Daum 1,2
; Magdaléna Dubová 1,2; Alena Skálová 1,2; Tomáš Rozkoš 3; Jan Laco 3
Působiště autorů: Šiklův ústav patologie LF UK v Plzni a FN Plzeň 1; Bioptická laboratoř, s. r. o., Plzeň 2; Fingerlandův ústav patologie LF UK v Hradci Králové a FN Hradec Králové 3
Vyšlo v časopise: Čes.-slov. Patol., 54, 2018, No. 1, p. 23-26
Kategorie: Přehledový článek
Souhrn
V současné klinické praxi cílenou terapii žaludečního adenokarcinomu představuje použití anti-HER2 monoklonální protilátky trastuzumabu u nádorů s imunohistochemickým skóre 3+ a zároveň s prokázanou amplifikací genu HER2 in situ hybridizací. Na základě současných poznatků o molekulární biologii adenokarcinomu žaludku, roli nádorového mikroprostředí a jeho cévním zásobení se jako slibné možnosti dalšího vývoje cílené terapie jeví zejména ovlivnění PD-1/PD-L1 a inhibice VEGFR2. Studie efektivity nových postupů cílené terapie, stejně jako zavádění metodik prediktivní diagnostiky, jsou však komplikovány nedostatečnou subtypizací nádorů ve studovaných souborech.
Klíčová slova:
žaludek – adenokarcinom – prediktivní diagnostika – cílená terapie – HER2 – PD-1 – PD-L1 – VEGFR
Počátky cílené terapie adenokarcinomu žaludku založené na morfologické prediktivní diagnostice byly položeny v roce 2010 studií ToGA, která určila kritéria indikace k léčbě monoklonální protilátkou proti HER2 (1). Od té doby došlo jak k pokrokům v poznání molekulární biologie žaludečního karcinomu, tak k vývoji nových monoklonálních protilátek a nízkomolekulárních inhibitorů receptorových tyrozinkináz potenciálně využitelných v cílené terapii žaludečního adenokarcinomu. Pozornost byla věnována možnostem ovlivnění dalších molekul tvořících intracelulární signální kaskády, angiogeneze nebo v současné době velmi oblíbených kontrolních bodů imunitní odpovědi (angl. „immune checkpoints“), která se může v regulaci růstu a šíření některých typů žaludečního adenokarcinomu významně uplatňovat. Přes všechny tyto dílčí úspěchy je však i dnes jedinou schválenou cílenou terapií adenokarcinomu žaludku založenou na prediktivní diagnostice metodami moderní patologie inhibice HER2 monoklonální protilátkou trastuzumabem. V České republice však doznal určitých změn algoritmus indikace této léčby.
HER2
Hlavní a z hlediska širšího praktického využití zatím jedinou cílenou terapií adenokarcinomu žaludku (a kardie) zůstává použití anti-HER2 monoklonálních protilátek (trastuzumab). Základy této terapie a principy její prediktivní diagnostiky byly na stránkách Česko-slovenské patologie popsány již před 6 lety (2). Principy imunohistochemické diagnostiky exprese HER2 zůstaly od té doby nezměněny, z praktických důvodů si dovolujeme zde znovu otisknout původní tabulku (tab. 1) schematicky ilustrující postup imunohistochemického vyšetření, v detailech odkazujeme na původní text. V České republice však doznala změn indikace k následnému vyšetření amplifikace HER2 metodami in situ hybridizace (ISH), a tím pádem i k případné cílené terapii. Zatímco dříve byly k cílené terapii indikovány karcinomy s imunohistochemickým skóre 3+ (bez nutnosti dalšího vyšetření ISH) a karcinomy se skóre 2+, v nichž byla následně metodami ISH prokázána amplifikace HER2, dnes je terapie trastuzumabem hrazena pouze pacientům s nádory s imunohistochemickým skóre 3+ a současně s prokázanou amplifikací HER2 (obr. 1), což jsou kritéria striktnější než požadovaná Českou onkologickou společností (3). To zároveň také znamená, že k vyšetření ISH jsou nyní indikovány pouze žaludeční adenokarcinomy s imunohistochemickým skóre 3+.
Obr. 1. Algoritmus indikace terapie trastuzumabem na základě morfologické prediktivní diagnostiky. 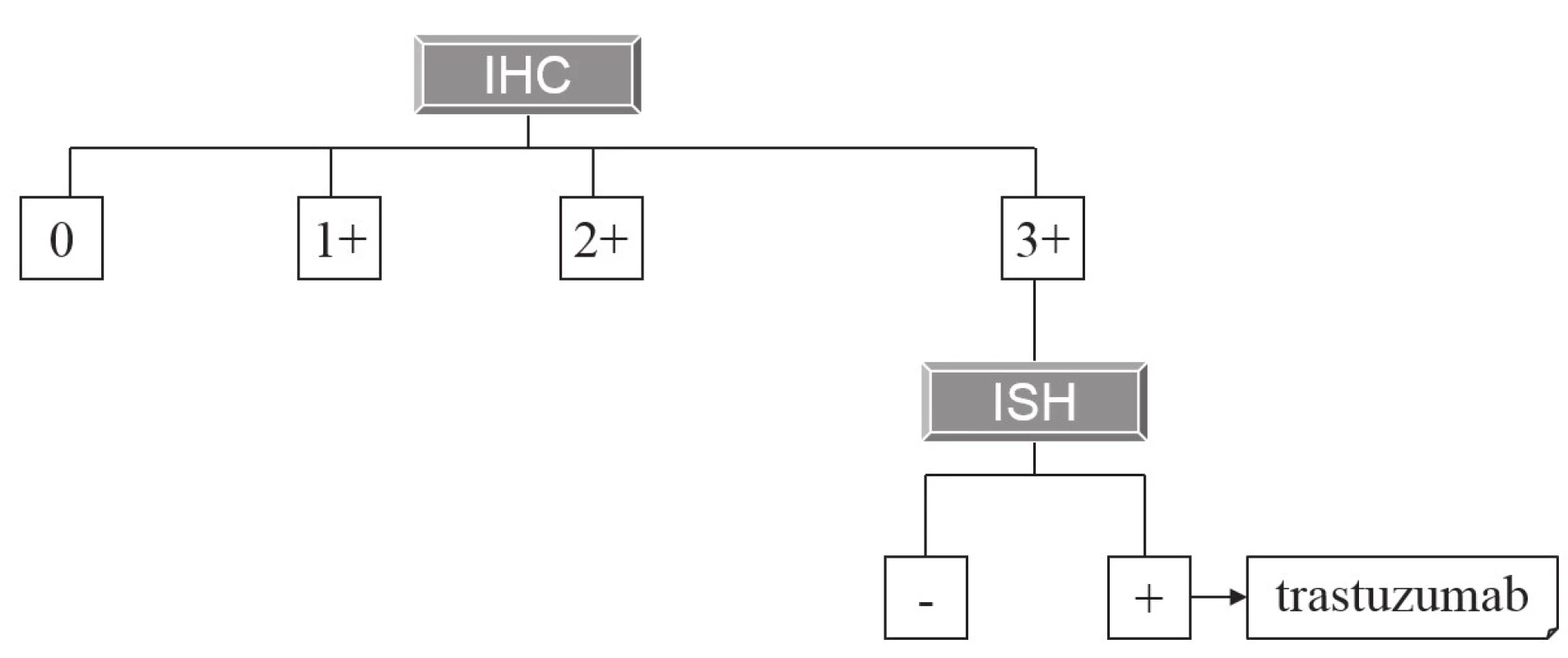
Pouze nádory, které mají imunohistochemické skóre overexprese HER2 3+, jsou indikovány k vyšetření amplifikace HER2 metodou in situ hybridizace. V případě pozitivního výsledku jsou určeny k terapii trastuzumabem. Tab. 1. Kritéria pro imunohistochemické skórování exprese HER2 v adenokarcinomu žaludku. 
Dalšími novinkami v této oblasti je vývoj nových léků ovlivňujících funkci HER2. Dosavadní studie bohužel neprokázaly účinnost nízkomolekulárního inhibitoru receptorových tyrosinkináz EGFR/HER2 lapatinibu (4-6), slibněji se v dosavadních studiích jeví užití pertuzumabu, monoklonální protilátky zabraňující dimerizaci HER2 s jinými receptory rodiny HER (7). Zatím však není známo, zda tento přípravek bude schválen k použití v cílené terapii karcinomu žaludku, ani jaký by případně byl algoritmus příslušné prediktivní diagnostiky.
Další signální kaskády asociované s receptory pro růstové faktory
V posledních letech byly studovány také možnosti využití cílené inhibice EGFR, mTOR nebo MET/HGF. Bohužel klinické studie fáze III neprokázaly účinnost terapie cílené na tyto molekuly, a to často i přes slibné výsledky studií fáze I/II. Otázkou však je, nakolik byly výsledky studií ovlivněny metodikou, která mnohdy nezohledňuje biologickou pestrost žaludečního adenokarcinomu. Například studie terapeutické účinnosti anti-EGFR monoklonálních protilátek cetuximabu (8) a panitumumabu (9) opomíjejí stratifikaci nádorů na základě mutační analýzy genů KRAS a NRAS, která je dobře známá již z problematiky prediktivní diagnostiky kolorektálního karcinomu, stejně jako distribuci těchto mutací v jednotlivých molekulárních podtypech žaludečního karcinomu (10). Kvůli inkompletním poznatkům současné molekulární biologie o regulaci a vzájemném propojení jednotlivých signálních kaskád nemohla být ani studie účinnosti inhibitoru mTOR everolimu založena na racionálním výběru testované skupiny na podkladě vhodných prediktivních markerů (11). K inhibici signální kaskády MET/HGF byly vyvinuty jednak monoklonální protilátky proti růstovému faktoru hepatocytů (HGF, scattered factor, SF) onartizumab a rilotumumab, jednak nízkomolekulární inhibitory receptorové tyrozinkinázy receptoru pro růstový faktor hepatocytů (MET) crizotinib, foretinib, tivantinib (12-16). Výsledky klinických studií jsou však zatím rozporuplné, pravděpodobně zejména kvůli nedostatečnému zohlednění heterogenity imunohistochemické pozitivity MET, nejasnému vztahu mezi intenzitou exprese na membráně nádorových buněk a procentem pozitivních buněk, a nezařazení mutační analýzy KRAS a PIK3CA mezi kritéria pro indikaci k této cílené léčbě (17).
Molekulární klasifikace žaludečního adenokarcinomu a inhibice PD-1/PD-L1
V současné době se již jeví koncepce nádoru jako jedné nemoci s nebo bez aktivace určité signální kaskády jako neudržitelná. Naopak, současným trendem je subtypizace jednotlivých nádorů (a tedy i žaludečního adenokarcinomu) do skupin charakterizovaných určitými molekulárními znaky, v optimálním případě asociovanými i s charakteristikami morfologickými a klinickými. V roce 2014 byla představena klasifikace TCGA (The Cancer Genome Atlas), která rozděluje žaludeční adenokarcinom na 4 podskupiny: s nestabilitou mikrosatelitů (MSI), asociovanou s infekcí EBV, s chromozomální nestabilitou (CIN) a se stabilním genomem (GS) (18). O rok později navázala na TCGA klasifikace ACRG (Asian Cancer Research Group) (19), jejíž podskupiny do značné míry korespondují s podskupinami podle TCGA a dále je rozvíjejí (tab. 2) (20,21).
Tab. 2. Současné molekulární klasifikace adenokarcinomu žaludku. 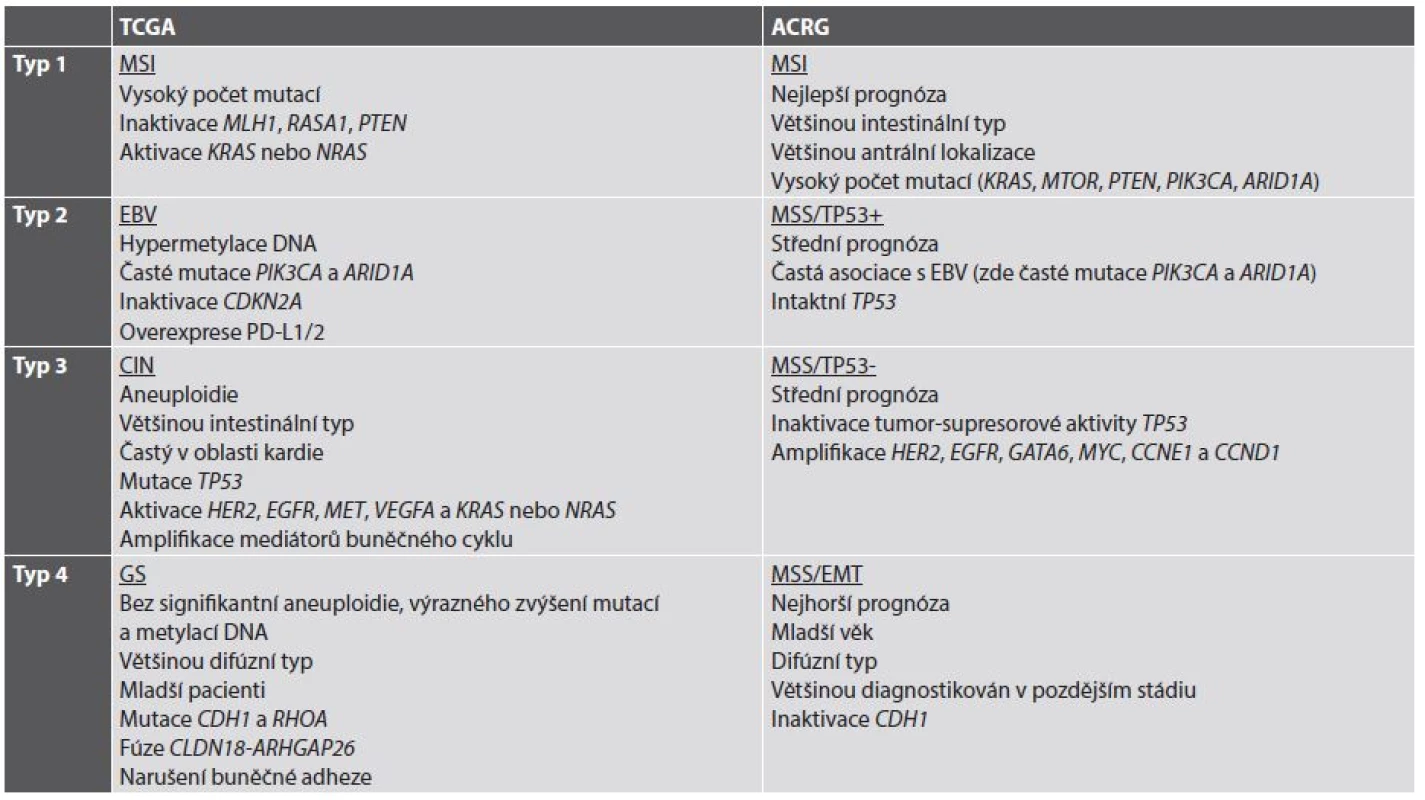
Volně podle (20,21). TCGA: The Cancer Genome Atlas. ACRG: Asian Cancer Research Group (další zkratky viz jejich seznam) Z hlediska cílené terapie a prediktivní diagnostiky je v současné době nejzajímavější informací vyplývající z molekulární klasifikace adenokarcinomu žaludku možnost použití terapie zaměřené na kontrolní body (checkpointy) imunitní reakce, konkrétně na signalizaci PD-1/PD-L1, a to v nádorech se signifikantní expresí neoantigenů na povrchu nádorových buněk v důsledku četných somatických mutací, tedy hlavně v žaludečních adenokarcinomech asociovaných s infekcí EBV a v nádorech s MSI. Protože cílená terapie zaměřená na inhibici PD-1/PD-L1 je v současné době doménou plicní onkologie a patologie, ponechávám bližší výklad jejího mechanismu na příslušné kapitole o prediktivní diagnostice v plicní patologii. V žaludečním adenokarcinomu je z morfologického hlediska exprese PD-L1 asociována s výraznou lymfocytární infiltrací nádoru a s jeho difúzním nebo smíšeným histologickým typem podle Lauréna (22); z klinických parametrů je asociována s velikostí nádoru, hloubkou invaze, lymfatickými metastázami a špatnou prognózou (22-24). Dosavadní klinické studie s monoklonálními protilátkami proti PD-1 pembrolizumabem a nivolumabem prokázaly objektivní odpověď u některých pacientů s (neselektovanými) žaludečními karcinomy zařazenými do těchto studií (25,26). I přes tyto dílčí úspěchy však dosud není jasné, zda cílená terapie adenokarcinomu žaludku inhibitory signalizace PD-1/PD-L1 bude schválena, stejně jako nejsou dosud známá případná kritéria selekce pacientů pro tuto terapii.
Inhibice angiogeneze
Vzhledem k nesporné roli vaskularizace nádoru v jeho šíření je pochopitelné, že i u žaludečního adenokarcinomu se zájem obrací také k možnostem inhibice angiogeneze. Na rozdíl od kolorektálního karcinomu se neprokázalo prodloužení celkového přežití u pacientů se žaludečním adenokarcinomem léčeným monoklonální protilátkou proti VEGF bevacizumabem (27,28); jako terapeuticky účinná se však prokázala monoklonální protilátka proti VEGFR2 ramucirumab (29,30) a nejnověji nízkomolekulární inhibitor receptorové tyrozinkinázy téže molekuly apatinib (31). I přes účinnost těchto látek v klinických studiích a možnosti jejich schválení pro léčbu žaludečního adenokarcinomu nejsou v současné době patrné tendence k selekci pacientů pro tuto terapii na základě morfologické diagnostiky.
ZÁVĚR
I přes značné pokroky v porozumění molekulární patogenezi žaludečního adenokarcinomu je jeho cílená terapie stále založena na trastuzumabu, monoklonální protilátce proti HER2, ačkoli se v České republice změnila indikační kritéria založená na imunohistochemickém vyšetření a in situ hybridizaci. Další potenciální novinkou v anti-HER2 terapii by mohlo být zavedení pertuzumabu, který inhibuje tvorbu heterodimerů HER2 s jinými receptory rodiny HER, do kombinované léčby s trastuzumabem. U nádorů asociovaných s infekcí EBV a u adenokarcinomů s nestabilitou mikrosatelitů se také jako perspektivní jeví možnost využití blokády imunitního checkpointu PD-1/PD-L1 monoklonálními protilátkami proti PD-L1. Prodloužení celkového přežití také lze očekávat od inhibice VEGFR2. V současné době však histopatologická prediktivní diagnostika hraje stále roli pouze v indikaci léčby trastuzumabem.
PODĚKOVÁNÍ
Tento výstup vznikl v rámci projektu Specifického vysokoškolského výzkumu 2017–260 391, programu PROGRES Q40/11 a projektu BBMRI-CZ LM2015089.
The work was supported by the grant SVV 2017–260 391, by program PROGRES Q40/11 and by project BBMRI-CZ LM2015089.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
SEZNAM ZKRATEK
ARHGAP26: Rho GTPase Activating Protein 26
ARID1A: AT-rich Interactive Domain-Containing Protein 1A
CCND1: Cyclin D1
CCNE1: Cyclin E1
CDH1: Cadherin 1
CDKN2A: Inhibitor cyklin-dependentní kinázy 2A (Cyclin-dependent Kinase Inhibitor 2A)
CIN: Chromozomální nestabilita (Chromosome Instability)
CLDN18: Claudin 18
EGFR: Receptor pro epidermální růstový faktor (Epidermal Growth Factor Receptor)
GATA6: GATA-Binding Factor 6
GS: Stabilita genomu (Genome stability)
HER: Lidský receptor pro epidermální růstový faktor (Human Epidermal Growth Factor Receptor)
HGF: Růstový faktor hepatocytů (Hepatocyte Growth Factor)
HGFR: Receptor pro růstový faktor hepatocytů (Hepatocyte Growth Factor Receptor, MET)
ISH: In situ hybridizace
KRAS: homolog virového onkogenu Kirsten Rat Sarcoma
MLH1: MutL homolog 1
MSI: Nestabilita mikrosatelitů (Microsatellite Instability)
MSS/EMT: Nádor se stabilitou mikrosatelitů a epiteliálně-mezenchymální tranzicí
MSS/TP53-: Nádor se stabilitou mikrosatelitů a inaktivací tumor-supresorové funkce genu TP53
MSS/TP53+: Nádor se stabilitou mikrosatelitů a intaktní tumor-supresorovou funkcí genu TP53
mTOR: Mechanistický (dříve savčí) cíl rapamycinu (mechanistic (formerly mammalian) Target of Rapamycin)
MYC: Lidský homolog virového onkogenu ptačí myelocytomatózy (Avian Myelocytomatosis Viral Oncogene Homolog)
NRAS: gen Neuroblastoma RAS
PD-1: Receptor programované smrti-1 (Programmed Death Receptor-1)
PD-L1: Ligand receptoru programované smrti-1 (Programmed Death Ligand-1)
PIK3CA: Katalytická podjednotka alfa Fosfatidylinositol 3-kinázy (Phosphatidylinositol-4,5-Bisphosphate 3-Kinase Catalytic Subunit Alpha)
PTEN: Phosphatase and Tensin Homolog
RASA1: Aktivátorový protein 1 GTPázy proteinu RAS (RAS p21 Protein Activator 1, Ras GTPase Activating Protein)
RHOA: Ras Homolog Gene Family, Member A
SF: Scattered Factor
TP53: Tumor Protein 53
VEGF: Vaskulární endoteliální růstový faktor (Vascular Endothelial Growth Factor)
VEGFR2: Receptor pro vaskulární endoteliální růstový faktor 2 (Vascular Endothelial Growth Factor Receptor 2)Adresa pro korespondenci:
Doc. MUDr. Ondřej Daum, Ph.D.
Šiklův ústav patologie LF UK a FN Plzeň
Edvarda Beneše 13, 305 99 Plzeň
tel.: +420377402523
email: DAUM@fnplzen.cz
Zdroje
1. Bang YJ, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet 2010; 376(9742): 687-697.
2. Daum O, Skálová A, Rozkoš T, Laco J. Prediktivní diagnostika HER2 v adenokarcinomu žaludku. Cesk Patol 2011; 47(4): 160-163.
3. Vyzula R. Modrá kniha České onkologické společnosti (23. aktualizace). Brno: Masarykův onkologický ústav; 2017 : 228.
4. Satoh T, Xu RH, Chung HC, et al. Lapatinib plus paclitaxel versus paclitaxel alone in the second-line treatment of HER2-amplified advanced gastric cancer in Asian populations: TyTAN-a randomized, phase III study. J Clin Oncol 2014; 32(19): 2039-2049.
5. Lorenzen S, Riera Knorrenschild J, Haag GM, et al. Lapatinib versus lapatinib plus capecitabine as second-line treatment in human epidermal growth factor receptor 2-amplified metastatic gastro-oesophageal cancer: a randomised phase II trial of the Arbeitsgemeinschaft Internistische Onkologie. Eur J Cancer 2015; 51(5): 569-576.
6. Hecht JR, Bang YJ, Qin SK, et al. Lapatinib in combination with capecitabine plus oxaliplatin in human epidermal growth factor receptor 2-positive advanced or metastatic gastric, esophageal, or gastroesophageal adenocarcinoma: TRIO-013/LOGiC - a randomized phase III trial. J Clin Oncol 2016; 34(5): 443-451.
7. Kang YK, Rha SY, Tassone P, et al. A phase IIa dose-finding and safety study of first-line pertuzumab in combination with trastuzumab, capecitabine and cisplatin in patients with HER2-positive advanced gastric cancer. Br J Cancer 2014; 111(4): 660-666.
8. Lordick F, Kang YK, Chung HC, et al. Capecitabine and cisplatin with or without cetuximab for patients with previously untreated advanced gastric cancer (EXPAND): a randomised, open-label phase 3 trial. Lancet Oncol 2013; 14(6): 490-499.
9. Waddell T, Chau I, Cunningham D, et al. Epirubicin, oxaliplatin, and capecitabine with or without panitumumab for patients with previously untreated advanced oesophagogastric cancer (REAL3): a randomised, open-label phase 3 trial. Lancet Oncol 2013; 14(6): 481-489.
10. Queiros P, Pinheiro H, Carvalho J, et al. KRAS mutations in microsatellite instable gastric tumours: impact of targeted treatment and intratumoural heterogeneity. Virchows Arch 2015; 467(4): 383-392.
11. Ohtsu A, Ajani JA, Bai YX, et al. Everolimus for previously treated advanced gastric cancer: results of the randomized, double-blind, phase III GRANITE-1 study. J Clin Oncol 2013; 31(31): 3935-3943.
12. Lennerz JK, Kwak EL, Ackerman A, et al. MET amplification identifies a small and aggressive subgroup of esophagogastric adenocarcinoma with evidence of responsiveness to crizotinib. J Clin Oncol 2011; 29(36): 4803-4810.
13. Shah MA, Wainberg ZA, Catenacci DV, et al. Phase II study evaluating 2 dosing schedules of oral foretinib (GSK1363089), cMET/VEGFR2 inhibitor, in patients with metastatic gastric cancer. PLoS One 2013; 8(3): e54014.
14. Hack SP, Bruey JM, Koeppen H. HGF/MET-directed therapeutics in gastroesophageal cancer: a review of clinical and biomarker development. Oncotarget 2014; 5(10): 2866-2880.
15. Jardim DL, de Melo Gagliato D, Falchook GS, et al. MET aberrations and c-MET inhibitors in patients with gastric and esophageal cancers in a phase I unit. Oncotarget 2014; 5(7): 1837-1845.
16. Kang YK, Muro K, Ryu MH, et al. A phase II trial of a selective c-Met inhibitor tivantinib (ARQ 197) monotherapy as a second - or third-line therapy in the patients with metastatic gastric cancer. Invest New Drugs 2014; 32(2): 355-361.
17. Metzger ML, Behrens HM, Boger C, Haag J, Kruger S, Rocken C. MET in gastric cancer - discarding a 10% cutoff rule. Histopathology 2016; 68(2): 241-253.
18. Cancer Genome Atlas Research Network. Comprehensive molecular characterization of gastric adenocarcinoma. Nature 2014; 513(7517): 202-209.
19. Cristescu R, Lee J, Nebozhyn M, et al. Molecular analysis of gastric cancer identifies subtypes associated with distinct clinical outcomes. Nat Med 2015; 21(5): 449-456.
20. Hayakawa Y, Sethi N, Sepulveda AR, Bass AJ, Wang TC. Oesophageal adenocarcinoma and gastric cancer: should we mind the gap? Nat Rev Cancer 2016; 16(5): 305-318.
21. Chan BA, Jang RW, Wong RK, Swallow CJ, Darling GE, Elimova E. Improving outcomes in resectable gastric cancer: A review of current and future strategies. Oncology (Williston Park) 2016; 30(7): 635-645.
22. Li Z, Lai Y, Sun L, et al. PD-L1 expression is associated with massive lymphocyte infiltration and histology in gastric cancer. Hum Pathol 2016; 55(9): 182-189.
23. Wu C, Zhu Y, Jiang J, Zhao J, Zhang XG, Xu N. Immunohistochemical localization of programmed death-1 ligand-1 (PD-L1) in gastric carcinoma and its clinical significance. Acta Histochem 2006; 108(1): 19-24.
24. Thompson ED, Zahurak M, Murphy A, et al. Patterns of PD-L1 expression and CD8 T cell infiltration in gastric adenocarcinomas and associated immune stroma. Gut 2017; 66(5): 794-801.
25. Muro K, Chung HC, Shankaran V, et al. Pembrolizumab for patients with PD-L1-positive advanced gastric cancer (KEYNOTE-012): a multicentre, open-label, phase 1b trial. Lancet Oncol 2016; 17(6): 717-726.
26. Goode EF, Smyth EC. Immunotherapy for gastroesophageal cancer. J Clin Med 2016; 5(10).
27. Van Cutsem E, de Haas S, Kang YK, et al. Bevacizumab in combination with chemotherapy as first-line therapy in advanced gastric cancer: a biomarker evaluation from the AVAGAST randomized phase III trial. J Clin Oncol 2012; 30(17): 2119-2127.
28. Shen L, Li J, Xu J, et al. Bevacizumab plus capecitabine and cisplatin in Chinese patients with inoperable locally advanced or metastatic gastric or gastroesophageal junction cancer: randomized, double-blind, phase III study (AVATAR study). Gastric Cancer 2015; 18(1): 168-176.
29. Fuchs CS, Tomasek J, Yong CJ, et al. Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (REGARD): an international, randomised, multicentre, placebo-controlled, phase 3 trial. Lancet 2014; 383(9911): 31-39.
30. Wilke H, Muro K, Van Cutsem E, et al. Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW): a double-blind, randomised phase 3 trial. Lancet Oncol 2014; 15(11): 1224-1235.
31. Li J, Qin S, Xu J, et al. Randomized, double-blind, placebo-controlled phase III trial of apatinib in patients with chemotherapy-refractory advanced or metastatic adenocarcinoma of the stomach or gastroesophageal junction. J Clin Oncol 2016; 34(13): 1448-1454.
Štítky
Patologie Soudní lékařství Toxikologie
Článek vyšel v časopiseČesko-slovenská patologie

2018 Číslo 1-
Všechny články tohoto čísla
- Prediktivní diagnostika u karcinomu prsu – co je nového pro rok 2018?
- Predikce odpovědi metastatického kolorektálního karcinomu na cílenou anti-EGFR léčbu
- Prediktivní diagnostika adenokarcinomu žaludku – stav v roce 2018
- Hodnocení zánětlivé infiltrace (tumor infiltrujících lymfocytů – TIL) u maligního melanomu
- Update terapeuticko-indikační patologie (2. díl)
- Dediferencovaný karcinom ovaria – kazuistika
- Prof. MUDr. Alena Linhartová, DrSc.
- Nefunkční karcinom parathyroidey v terénu parathyreomatózy. Kazuistika
- S novou předsedkyní akreditační komise našeho oboru o specializačním vzdělávání
- Marginálie z 13. kongresu EADO v Aténach
- MONITOR ANEB NEMĚLO BY VÁM UNIKNOUT, ŽE...
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hodnocení zánětlivé infiltrace (tumor infiltrujících lymfocytů – TIL) u maligního melanomu
- Dediferencovaný karcinom ovaria – kazuistika
- Prediktivní diagnostika u karcinomu prsu – co je nového pro rok 2018?
- Predikce odpovědi metastatického kolorektálního karcinomu na cílenou anti-EGFR léčbu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



