-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Diferenciální diagnostika chronické pankreatitidy a duktálního adenokarcinomu pankreatu
Differential diagnosis of the chronic pancreatitis and the pancreatic ductal adenocarcinoma
The histopathological distinction of pancreatic ductal adenocarcinoma (PDA) and chronic pancreatitis represents one of the most difficult differential diagnosis in surgical pathology, especially in small biopsy specimens and frozen sections. Practically usable morphological criteria, which allow an efficient differential diagnosis of these lesions have been determined by a number of authors. The perineural and vascular invasion represent findings, which are entirely diagnostic for PDA; however, they are rarely detectable in small biopsy specimens as well as in the presence of solitary naked ducts in fat without surrounding pancreatic elements or fibrous tissue, which also supports the diagnosis of PDA. The features that are suggestive of PDA include random haphazard distribution of ductal structures, irregular ductal contours, ruptured ducts, nuclear enlargement, pleomorphism, hyperchromatism, and mitoses. Uniterrupted proliferation of numerous ducts (>50), ducts lying adjacent to arterioles, intraluminal cellular debris, and hyperchromatic raisinoid nuclei represent less frequently displayed features that also support the diagnosis of PDA. On the contrary, the preserved lobular arrangement, clusters of uniform ductal units, smooth ductal contours, ducts related to the remaining acini and islets, and finding of intraluminnal mucoprotein plugs favor a benign process over PDA.
The combination of presented criteria and features should enable a reliable differential diagnosis of invasive pancreatic cancer and chronic pancreatitis.Keywords:
chronic pancreatitis – pancreatic ductal adenocarcinoma – pseudotumor – differential diagnosis
Autoři: M. Hermanová; J. Lenz
Působiště autorů: I. patologicko-anatomický ústav LF MU a FN u sv. Anny, Brno
Vyšlo v časopise: Čes.-slov. Patol., 48, 2012, No. 3, p. 135-140
Kategorie: Přehledový článek
Souhrn
Histopatologické odlišení pankreatického duktálního adenokarcinomu (PDA) a chronické pankreatitidy představuje jednu z nejsložitějších diferenciálních diagnóz v bioptické patologii, zejména při hodnocení malých biopsií a biopsií peroperačních. Řadou autorů byla stanovena prakticky využitelná morfologická kritéria umožňující účinnou diferenciální diagnostiku těchto lézí. Průkaz perineurální či vaskulární invaze je pro PDA jednoznačně diagnostický, ale v malých bioptických vzorcích nebývá tento znak obvykle zastižen, stejně jako přítomnost solitárních duktálních formací v tukové tkáni bez vazby k ostatním pankreatickým elementům či fibróze, které také podporují diagnózu PDA. Nepravidelná náhodná distribuce duktálních struktur, nepravidelné kontury duktů, tzv. ruptury duktů, zvětšená jádra, pleomorfie, hyperchromazie a mitózy představují rovněž nálezy podporující diagnózu PDA. Méně často je prokázána přítomnost konglomerátů >50 duktálních jednotek, aniž by byly přerušeny jinými pankreatickými strukturami, duktů v těsném sousedství arterioly, intraluminální buněčné debris a hyperchromatických rozinkovitých jader, tj. znaků, které rovněž podporují diagnózou PDA. Naopak, zachované lobulární uspořádání, přítomnost klastrů uniformních duktálních jednotek, hladké kontury duktů, dukty v zachovalém vztahu k perzistujícím acinárním strukturám i ostrůvkům endokrinního pankreatu a intraluminálně přítomnost mukoproteinových zátek a kalcifikátů favorizují diagnózu benigního procesu před PDA. Kombinace prezentovaných kritérií a znaků by měla umožnit spolehlivou diferenciální diagnostiku invazivního pankreatického karcinomu a chronické pankreatitidy.
Klíčová slova:
chronická pankreatitida – duktální adenokarcinom pankreatu – pseudotumor – diferenciální diagnózaHlavním úskalím diferenciální diagnostiky chronické pankreatitidy (CP) je její odlišení od pankreatického duktálního adenokarcinomu (PDA). Tento diagnostický problém nabývá zásadně na významu zejména při hodnocení malých biopsií (charakteru punkčních biopsií či probatorních excizí) a biopsií peroperačních (1–4). Odlišení obou nozologických jednotek se v těchto situacích často stává nelehkou výzvou, které musí čelit ve své diagnostické praxi i zkušený patolog. Důvodem komplikované diferenciální diagnostiky těchto lézí je skutečnost, že CP je asociována se značnými architektonickými a cytologickými alteracemi pankreatu (1,2). Zánik predilekčně acinárních buněk, provázený rozvíjející se fibrózou, peri - i intralobulární, způsobuje distorzi perzistujících duktálních elementů a rozvoj morfologického obrazu, který imituje infiltrující PDA. Součástí struktur dobře diferencovaných PDA jsou totiž tubulární formace imitující benigní pankreatické dukty. Tyto nádorové tubuly bývají lemovány jednou vrstvou kuboidních buněk připomínajících nenádorové duktální epitelie, mají objemnou cytoplazmu a jádra polarizovaná při bazi buněk. Nádorový infiltrát je ve většině případů provázen výraznou desmoplastickou reakcí stromatu variabilní celularity a infiltruje pankreatickou tkáň, aniž by docházelo k její kompletní destrukci. Situaci komplikuje i skutečnost, že PDA způsobuje obstrukční chronickou pankreatitidu ve tkáni bezprostředně sousedící s nádorovým infiltrátem. Navíc je CP často asociovaná s jadernými abnormitami duktálního epitelu a zcela validní odlišení reaktivních cytonukleárních atypií a dysplastických změn je v některých situacích rovněž limitované. Současně nelze opomenout fakt, že CP, hereditární i sporadická, je asociována se zvýšeným rizikem vzniku PDA (5,6) a v terénu CP se dysplastické duktální léze charakteru pankreatických intraepiteliálních neoplazií (PanIN) vyskytují četněji (7,8).
Některé formace pankreatických elementů neduktální histogeneze mohou rovněž imitovat struktury invazivních karcinomů. Ostrůvky endokrinního pankreatu jsou ve tkáni CP poměrně rezistentní strukturou. Zánik acinárních struktur způsobuje jejich pseudohyperplastický či pseudoinfiltrativní vzhled (obr. 1), který může imitovat endokrinní neoplazie a v asociaci s neoplastickými žlázkami PDA i smíšené duktální-neuroendokrinní neoplazie (1,2,9). Acinární formace mohou před vlastním zánikem tvořit tzv. tubulární komplexy provázené intralobulární fibroprodukcí, které mohou v některých případech rovněž imitovat struktury infiltrujícího PDA (1,2).
Obr. 1. Chronická pankreatitida (CP). Pseudohyperplastická a pseudoinfiltrativní morfologie ostrůvku endokrinního pankreatu v terénu CP. Blandní cytologie, centrálně lokalizovaná jádra a charakteristická chromatinová kresba („pepř a sůl“) favorizují diagnózu benigní struktury. Barveno hematoxylinem eozinem (zvětšení 100x). 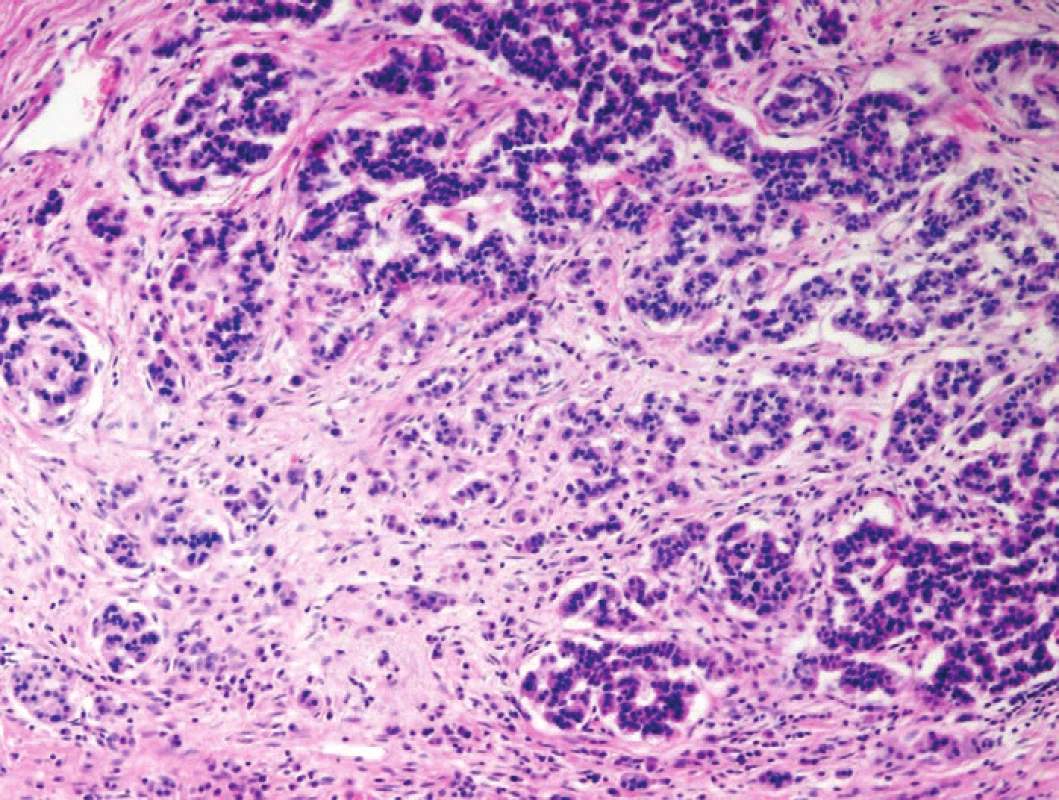
V práci jsou prezentovány klinické faktory, makroskopické i histopatologické a cytologické nálezy a kritéria (tab. 1), které při správné aplikaci představují účinný nástroj pro odlišení CP a PDA v rutinní diagnostické praxi.
Tab. 1. Histopatologické znaky odlišující duktální adenokarcinom a chronickou pankreatitidu. 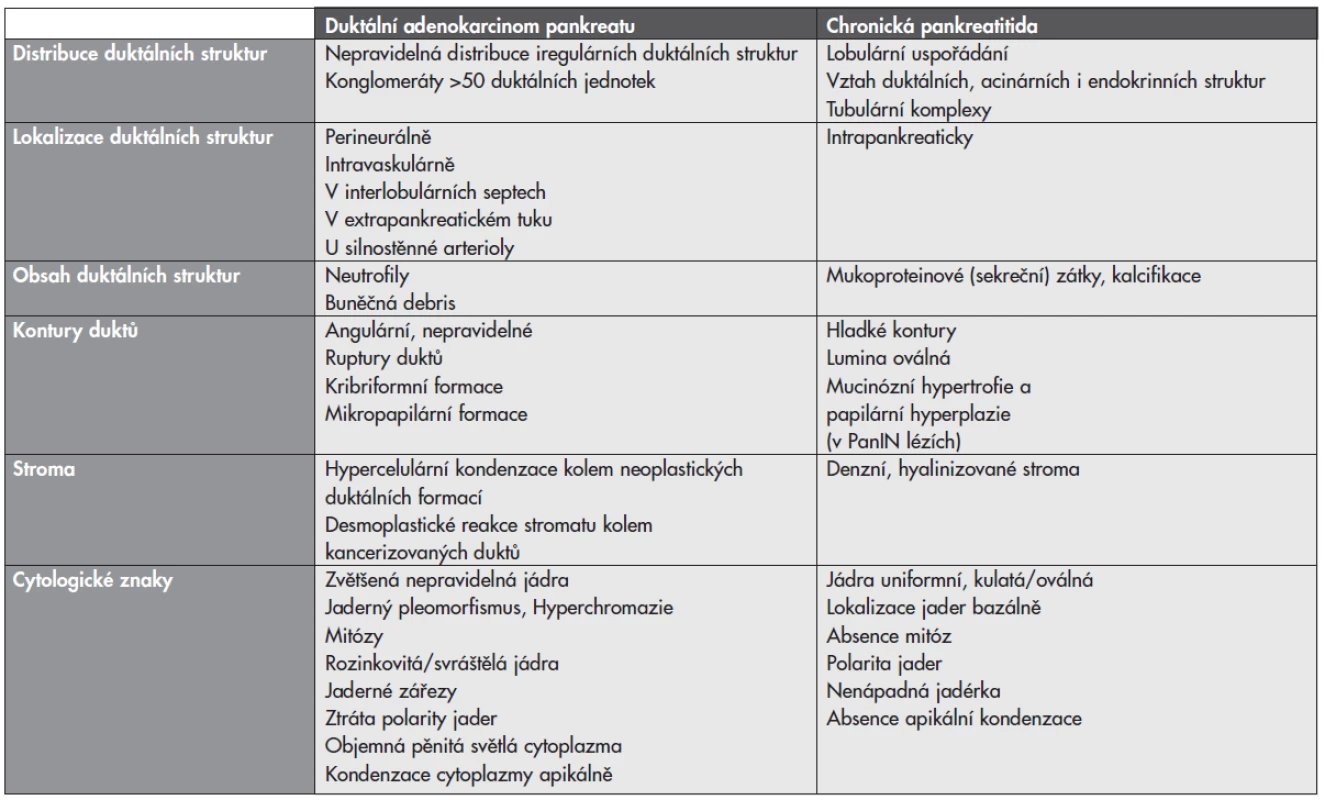
KLINICKÉ FAKTORY
Před vlastním mikroskopickým hodnocením preparátů je velmi důležitá analýza klinických dat a anamnézy pacienta. PDA se velmi vzácně vyskytuje před 40. rokem věku, naopak CP není v mladším věku nálezem výjimečným (10). Pacienti s CP mají obvykle dlouhou anamnézu klinických obtíží. Chronická alkoholická, hereditární i tzv. paraduodenální pankreatitida se rozvíjejí na podkladě relabující akutní pankreatitidy, často komplikované formacemi pseudocyst (11–13). Ikterus, který se u těchto pacientů může rozvinout, se obvykle objeví až po několikaletém průběhu onemocnění. Většina pacientů s PDA je starších 50 let, nemá v anamnéze pankreatitidu ani alkoholismus a prezentuje se náhle vzniklým bezbolestným ikterem. Výjimkou z těchto „pravidel“ je problematika autoimunitní pankreatitidy, které věnujeme samostatné shrnutí na konci článku.
MAKROSKOPICKÉ NÁLEZY
Hodnocení makroskopického nálezu lze prakticky aplikovat pouze na resekáty pankreatu. U chronické alkoholické a hereditární pankreatitidy je fibrotizace nerovnoměrně distribuována se střídajícími se úseky fibrotizace a zachovalého lobulárního uspořádání parenchymu. Celkově je u CP postižení pankreatu difúznější a konzistence tkáně s chronickou pankreatitidou elastičtější ve srovnání se žlázou infiltrovanou PDA. V hlavním a/nebo v sekundárních duktech se často vyskytují kalcifikované mukoproteinové zátky. Běžným nálezem je průkaz pseudocyst, predilekčně extrapankreaticky lokalizovaných. Případná stenóza hlavního pankreatického duktu má postupně se zužující charakter. U paraduodenální pankreatitidy jsou zánětlivé, fibrotické a cystické změny predilekčně lokalizovány ve stěně duodena, ve žlábku mezi duodenem a pankreatem a v přiléhající pankreatické tkáni (14–17). Makroskopický nález autoimunitní pankreatitidy imituje obraz PDA nejvýrazněji. Změny jsou vyjádřeny zejména v hlavě pankreatu, která je zvětšená, postižení je difúzní se zánikem normální lobulární struktury pankreatu. Součástí obrazu je i stenóza hlavního pankreatického vývodu a časté postižení extrahepatálních žlučových cest (17,18).
PDA tvoří ve většině případů solidní ložisko v hlavě pankreatu, nejčastěji o průměru 2 – 3 cm, postihující i ductus choledochus, způsobující těžkou abruptní stenózu jeho intrapankreatického segmentu a prestenotickou dilataci. Nekrózy nepředstavují typický nález, kalcifikace a pseudocysty nebývají přítomny.
HISTOPATOLOGICKÉ NÁLEZY
Lobularita
Pro hodnocení lobularity volíme malé zvětšení. I ve tkáni CP s velmi pokročilou fibrotizací si perzistující struktury acinární (často ve formě tzv. tubulárních komplexů – duktulárně transformovaných acinů), formace malých duktů i ostrůvky endokrinního pankreatu udržují lobulární uspořádání odrážející původní lobulární strukturu pankreatické tkáně (1,2). Vztah perzistujících acinů a ostrůvků k duktálním formacím zůstává zachován, formace tubulárních komplexů tvoří uniformní klastry s hladkými vnějšími konturami, zjevně ohraničené od okolní fibrotické tkáně (obr. 2). Ve tkáni CP se prakticky nikdy nevyskytují konglomeráty >50 duktálních jednotek, aniž by byly přerušeny jinými pankreatickými strukturami. Jedinou výjimkou je tzv. adenóza (též označovaná jako adenomatoidní duktální hyperplazie), jejíž odlišení od karcinomu je snadné. Je charakterizována přítomností zřetelných lobulů tvořených malými, cytologicky blandními mucinózními dukty v těsném kontaktu. Vzácně zde bývají vyjádřeny mírné cytonuklerání atypie, lobulární architektonika je však vždy zachována (1). Pro PDA je charakteristická ztráta lobulárního uspořádání a přítomnost nepravidelně distribuovaných duktulárních struktur různých tvarů i velikostí (obr. 3). Přítomnost takto nepravidelných duktulárních formací v interlobulárních septech je rovněž suspektní z diagnózy PDA (obr. 4).
Obr. 2. Chronická pankreatitida (CP). Perzistující lobulární uspořádání epiteliálních struktur pankreatické tkáně v terénu CP se zachovalou vazbou duktálních struktur na reziduální acinární struktury a ostrúvky endokrinního pankreatu. Barveno hematoxylinem eozinem (zvětšení 40x). 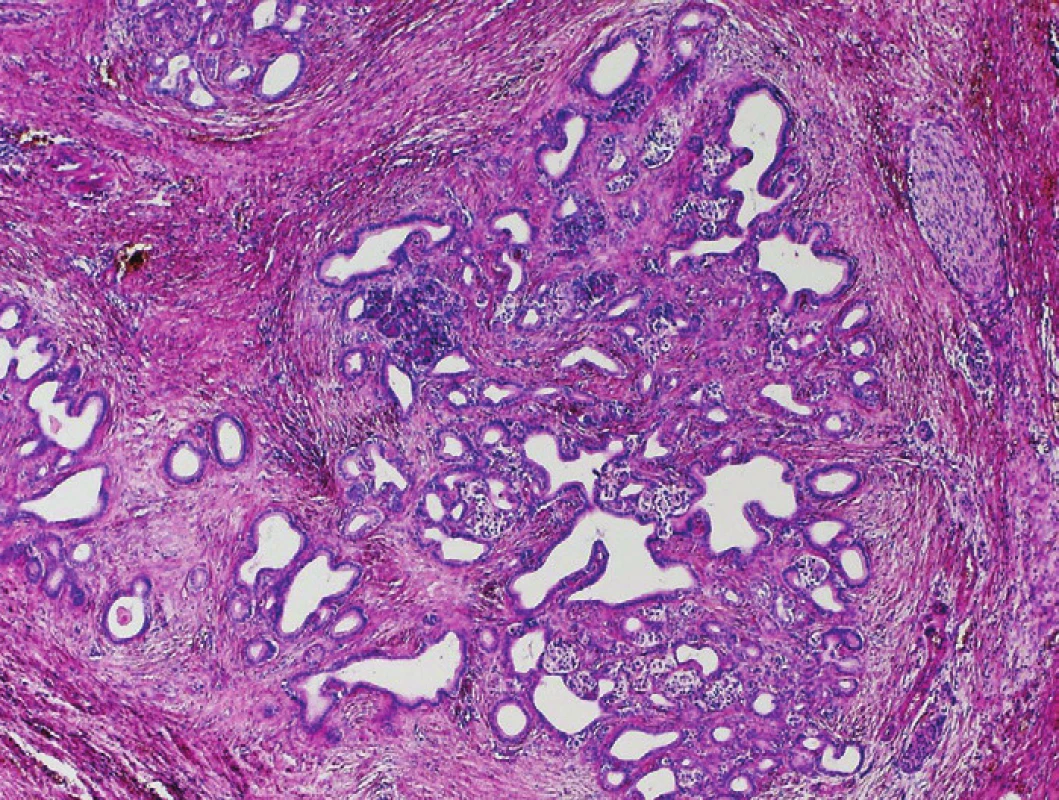
Obr. 3. Pankreatický duktální adenokarcinom (PDA). Infiltrující nepravidelné neoplastické duktální struktury PDA, fokálně s vyjádřenými „rupturami duktů“, s asociovanými makrofágy a detritem intraluminálně. Barveno hematoxylinem eozinem (zvětšení 100x). 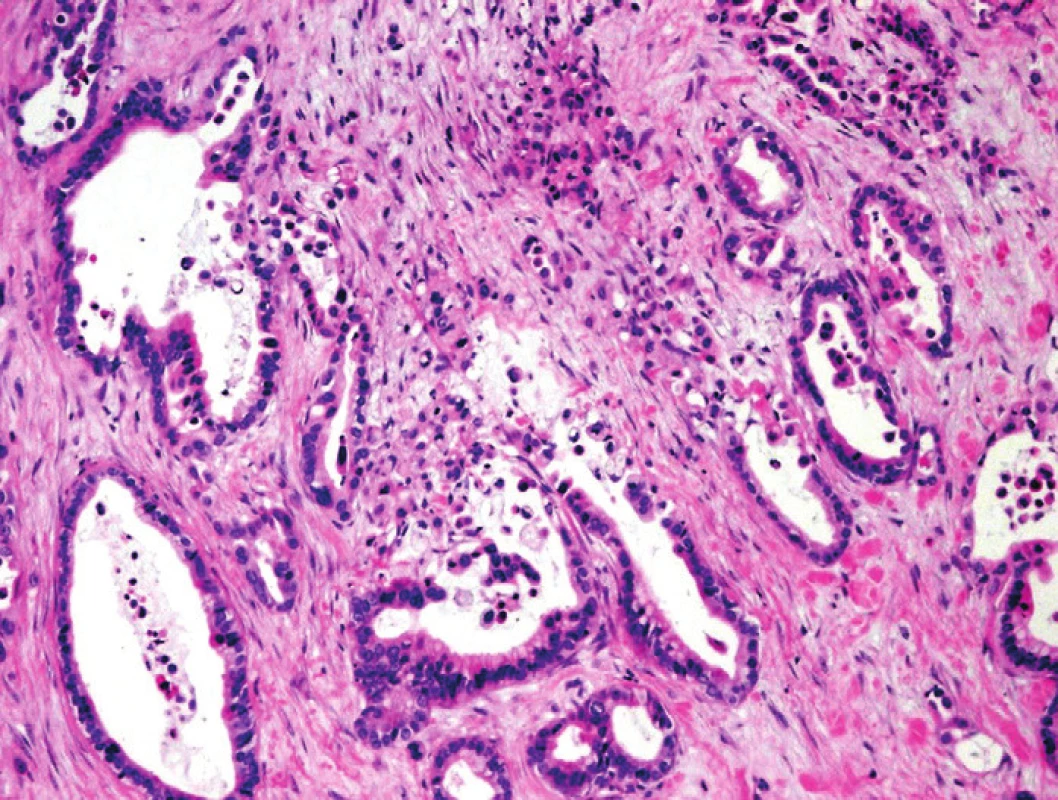
Obr. 4. Pankreatický duktální adenokarcinom (PDA). Interlobulární fibrotizované septum s přítomností nepravidelné duktální formace PDA bez zjevné destrukce přiléhajících lobulárnû formovaných struktur pankreatu. Barveno hematoxylinem eozinem (zvětšení 40x). 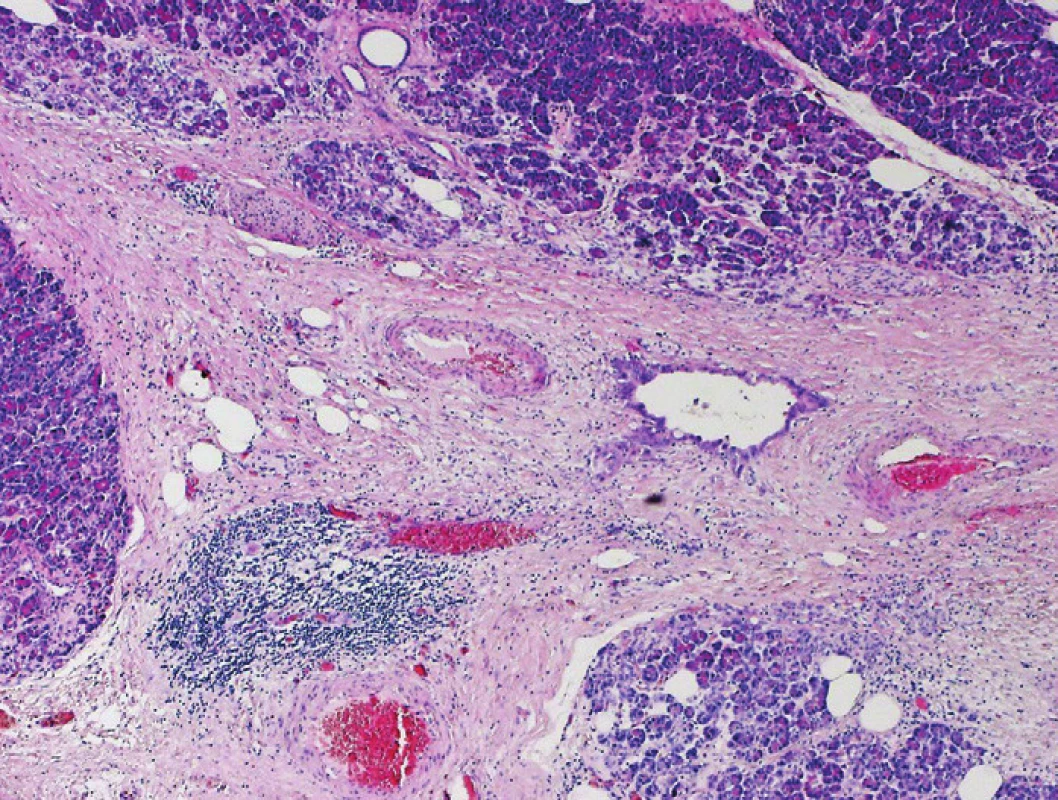
Duktální formace
Kontury benigních duktů jsou hladké, lumina oválná, narozdíl od angulárních nepravidelných kontur charakteristických pro PDA. Pro benigní žlázové formace je charakteristická absence tzv. „ruptur“ duktů. Tyto pro PDA charakteristické struktury jsou definovány jako dukty, které částečně postrádají epiteliální výstelku a jsou v těchto úsecích lemovány buněčnou mezenchymální tkání, s pronikajícím hlenem a perifokální akumulací makrofágů. Intraluminálně často nacházíme buněčnou debris a neutrofily (obr. 3). Ve tkáni CP je epiteliální výstelka duktů zachovaná a intraluminálně bývá identifikován slabě acidofilní mukoproteinový sekret (tzv. sekreční zátky), často kalcifikující, postrádající buněčné elementy (1,2,4).
Stromální reakce a nálezy extrapankreatické
V PDA můžeme pozorovat hypercelulární kondenzaci stromatu kolem velkých neoplastických tubulárních struktur stejně jako kolem konglomerátů malých infiltrativně rostoucích neoplastických tubulárních formací s nepravidelnými angulovanými konturami (obr. 5). Desmoplastická reakce stromatu stejného charakteru je vyjádřena i kolem kancerizovaných duktů s lézemi charakteru PanIN-3. Na rozdíl od CP, kde stroma je obvykle denzní a hyalinizované (1,2).
Obr. 5. Pankreatický duktální adenokarcinom (PDA). Celulární kondenzace stromatu kolem nepravidelné angulární neoplastické duktální formace PDA. Cytologicky vyjádřené znaky malignity. Barveno hematoxylinem eozinem (zvětšení 200x). 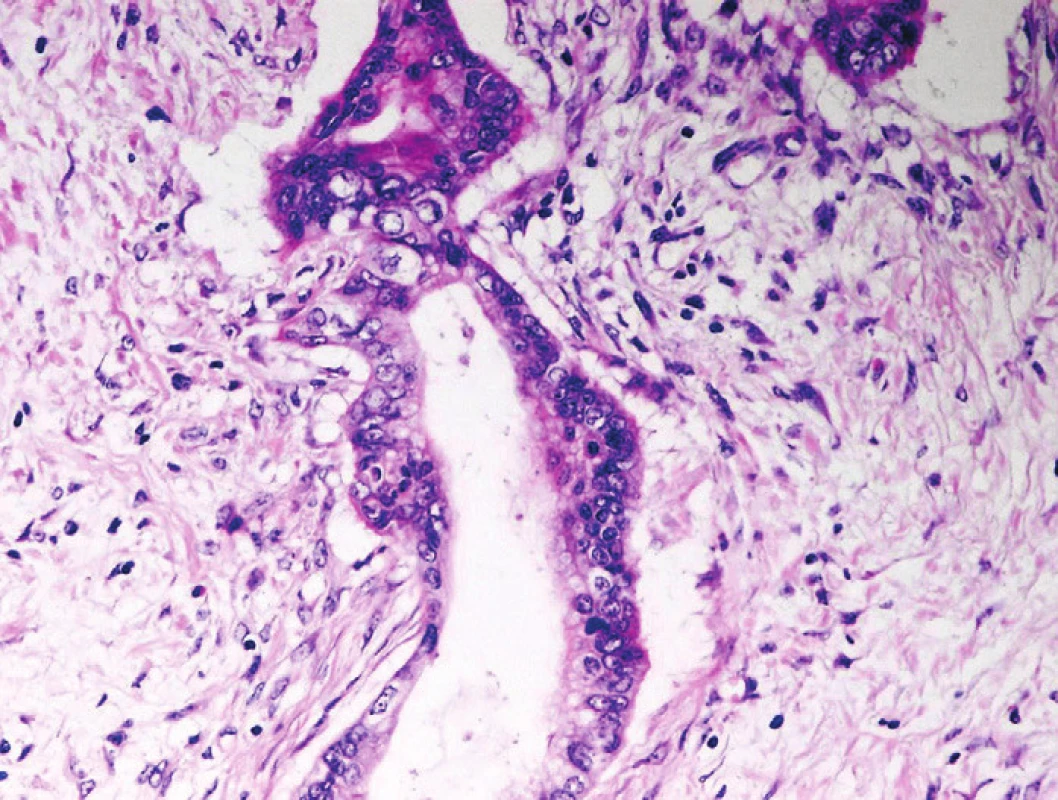
Dalším užitečným znakem favorizujícím diagnózu PDA je průkaz dobře diferencované glandulární formace, která může morfologicky imitovat PanIN-1 lézi, v těsné blízkosti silnostěnné arterioly (19,20). Nelze však opomenout, že v extrémních případech CP s masivní atrofizací se tento obraz může také velmi vzácně vyskytnout (21). Obdobně průkaz solitárních dobře diferencovaných glandulárních formací v tukové tkáni, bez průkazného vztahu k ostatním pankreatickým elementům či fibróze (obr. 6), favorizuje diagnózu PDA (22). Při hodnocení tohoto nálezu je třeba mít na paměti skutečnost, že v terénu lipomatózního pankreatu se mohou vyskytovat benigní duktální formace, které jsou však prakticky vždy lemovány úzkým lemem fibrózy či jsou ve vazbě na reziduální aciny či struktury endokrinního pankreatu.
Obr. 6. Pankreatický duktální adenokarcinom (PDA). Solitární glandulární formace PDA v tukové tkáni bez vazby na ostatní pankreatické struktury či fibrózu. Barveno hematoxylinem eozinem (zvětšení 200x). 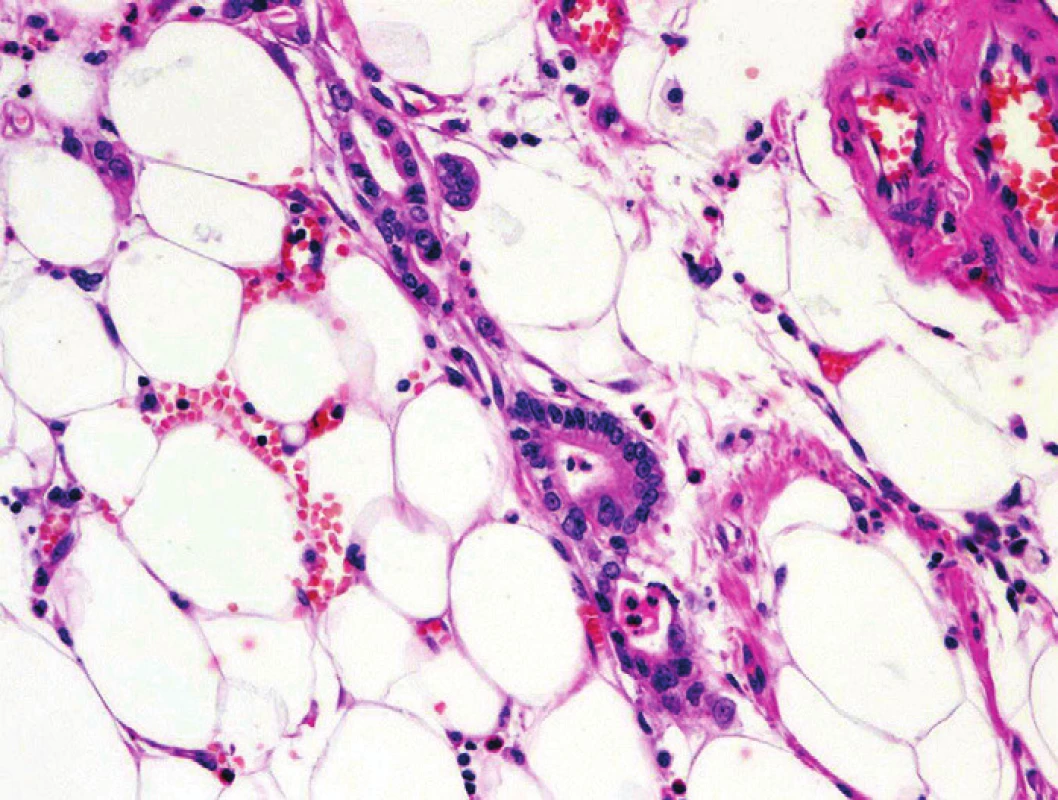
Pro PDA je jednoznačně diagnostický průkaz perineurální invaze (PNI), kterou lze při extenzivních blokování identifikovat téměř ve všech resekátech s PDA (23–25). Maximum fokusů PNI bývá identifikováno v nervových pleteních extrapankreatických měkkých tkáních a podél ductus choledochus, které ale obvykle nebývají cílem probatorních excizí, punkčních či peroperačních biopsií. Při hodnocení bioptických vzorků je třeba odlišit PNI od pseudoinvaze. V nejednoznačných případech je třeba verifikace přítomnosti duktálně diferencovaných nádorových struktur v perineurálním prostoru. Imunohistochemický průkaz epiteliálního membránového antigenu (EMA) umožní vizualizaci buněk perineuria a upřesní lokalizaci suspektních struktur. Diagnostické rozpaky může ve zhmožděných biopsiích způsobit i obraz hyperplazie perineurálních buněk, který se může vyskytnout v terénu CP. Je třeba mít na paměti, že morfologie nádorových duktálních epitelií invadujících nervy je epiteloidní a formace nádorových buněk adenoidní, na rozdíl od vřetenobuněčných elementů hyperplastického perineuria. Navíc, glandulární neoplastické formace invadující nervy jsou obvykle excentricky lokalizované, cirkumferenční uspořádání je málo časté. V limitovaných diagnostických biopsiích zatížených artefakty může k validnímu odlišení stromálních struktur od struktur periferních nervů přispět i imunohistochemický průkaz S100 proteinu. PNI může rovněž imitovat struktura ostrůvku endokrinního pankreatu adherující k perifernímu nervu (obr. 7) v terénu CP (1,2).
Obr. 7. Struktura ostrůvku endokrinního pankreatu adherující k perifernímu nervu v terénu CP. Barveno hematoxylinem eozinem (zvětšení 200x). 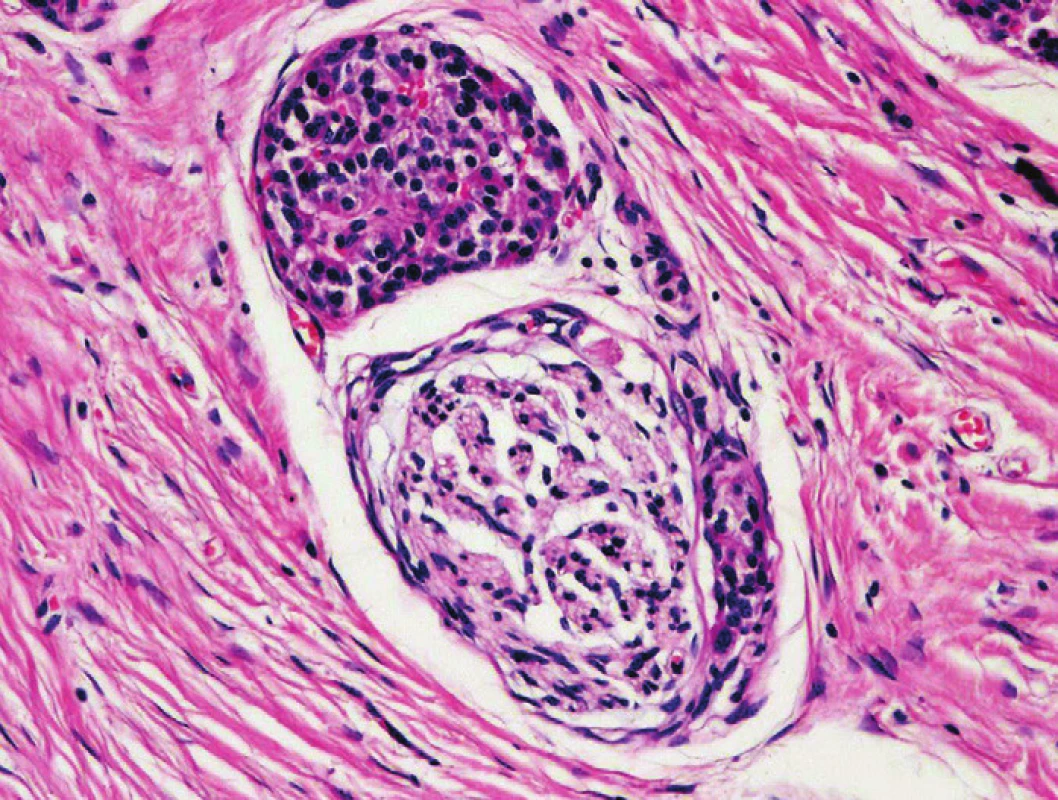
Ložiska vaskulární (obvykle venózní) invaze jsou stejně jako PNI lokalizovaná predilekčně v extrapankreatických měkkých tkáních a téměř se nevyskytují intratumorálně. Obdobně jako u PNI, jsou i neoplastické struktury invadující cévy obvykle dobře diferencované a jejich odlišení od benigních duktů bez verifikace vazby na cévní struktury může být problematické.
CYTOLOGICKÁ KRITÉRIA
Ve tkáni CP jsou dukty a tubulární komplexy tvořeny diferencovanými buňkami s minimálně vyjádřenou anizocytózou a anizonukleózou. Jádra jsou oválná, lokalizovaná ve větších duktech bazálně. Jadérka nejsou patrná nebo jsou nenápadná. Zpravidla nejsou přítomny mitotické figury. Výstelka benigních duktů může vykazovat známky mucinózní hypertrofie a papilární hyperplazie odpovídající lézím charakteru pankreatických intraepiteliálních neoplazií (PanIN) stupně 1A nebo 1B (tab. 2). Příležitostně jsou zastiženy ve tkáni CP PanIN-2 léze, výskyt PanIN-3 lézí v CP je zcela výjimečný (26).
Tab. 2. Morfologické znaky pankreatických intraepiteliálních neoplazií (PanIN). 
Jádra nádorových epitelií PDA jsou zvětšená (s průměrem odpovídajícím až 3 lymfocytům), s nepravidelnými jadernými konturami, prominujícími jadérky, s výraznou anizonukleózou (varibilita velikosti až 4 : 1 v rámci jednotlivé neoplastické tubulární formace), hyperchromazií a mitózami (4,27). Charakteristická je ztráta jaderné polarity definovaná jako variace v lokalizaci jader v rámci individuální neoplastické tubulární formace (obr. 5). Vyskytují se struktury kribriformní, v rámci některých variant PDA („large-duct“ varianta) i formace mikropapilární postrádající však fibrovaskulární stroma (28). PDA silně imitujícím benigní proces je tzv. „foamy-gland“ varianta PDA, charakterizovaná přítomností neoplastických glandulárních formací lemovaných vysokými kolumnárními mucinózními buňkami s dobře polarizovanými jádry a objemnou pěnitou světlou cytoplazmou, s kondenzací cytoplazmy apikálně. Při barvení mucikarmínem je tato oblast pozitivně zbarvena, ostatní cytoplazma pěnitých buněk zůstává nezbarvena. Jádra jsou u této varianty typicky rozinkovitá, svraštělá (29). Přítomnost jaderných zářezů je rovněž znakem favorizujícím diagnózu PDA a vyskytuje se rovněž u benigně vyhlížejících variant PDA.
IMUNOHISTOCHEMICKÉ NÁLEZY
Průkaz exprese karcinomembryonálního antigenu (CEA), MUC1, p53 a Ki67/MIB1 může přispět k úspěšné diferenciální diagnostice mezi CP a PDA. CEA a MUC1 jsou cytoplazmaticky (často pouze apikálně) exprimovány v buňkách PDA a v normálních či zánětem postižených duktálních epiteliích se nevyskytují. Proliferační index Ki67 je významně vyšší v nádorových epiteliích PDA (včetně dobře diferencovaných PDA) a obvykle výrazně přesahuje 5 % (2, 30). Jaderná akumulace p53 je prokazatelná u cca 60 % PDA (31) a při správně zvoleném metodickém postupu (32) průkazu exprese p53 se prakticky nevyskytuje u CP. Alternativně lze využít i průkaz exprese DPC4, jehož chybějící exprese je prokazatelná v přibližně polovině případů PDA (33).
AUTOIMUNITNÍ PANKREATITIDA
Klinický obraz, nálezy zobrazovacích metod i makroskopický vzhled autoimunitní pankreatitidy (AIP) velmi výrazně imitují PDA (17,34). Histologický obraz AIP je však zcela odlišný od PDA a jejich záměna je při histologickém vyšetření téměř vyloučena. V biopsiích pacientů s AIP jsou popisovány dva druhy histopatologických nálezů, konkrétně obraz lymfoplazmocytární sklerózující pankreatitidy (LPSP, typ 1) a idiopatické duktocentrické pankreatitidy (IDCP, typ 2), také označované jako AIP s granulocytárními epiteliálními lézemi (s denzním periduktálním zánětem asociovaným s destrukcí duktálního epitelu neutrofilními granulocyty) (18,35). Histopatologické znaky AIP umožňují s vysokou specificitou i senzitivitou jejich odlišení od ostatních forem chronické pankreatitidy. AIP obvykle postrádá znaky diagnostické pro alkoholickou chronickou pankreatitidu jako je přítomnost sekrečních zátek a kalcifikátů, dilatovaných nepravidelných duktů, formací pseudocyst a nekróz tukové tkáně. Vzájemné odlišení výše specifikovaných typů AIP je však limitované. Společným jmenovatelem obou forem AIP je přítomnost periduktálního lymfoplazmocytárního infiltrátu a příznačné tzv. storiformní fibrózy lokalizované periduktálně, perivenózně i v peripankreatické tukové tkáni. Obliterující flebitida rovněž patří do obrazu LPSP, u které lze imunohistochemicky verifikovat signifikantní zmnožení IgG4 pozitivních plazmocytů (>10 IgG4+ plazmocytů/1 pole velkého zvětšení). U IDCP je storiformní fibróza i obliterující flebitida méně prominující a přítomnost granulocytárních epiteliálních lézí představuje znak odlišující tuto formu AIP (obr. 8). IgG4 pozitivní plazmocyty zcela chybí nebo je jejich počet velmi malý (<10 IgG4+ plazmocytů / 1 pole velkého zvětšení). Zánětlivé změny jsou u IDCP obvykle omezeny na pankreas (18,35).
Obr. 8. Granulocytární epiteliální léze – denzní periduktální zánûtlivá infiltrace s destrukcí duktálního epitelu neutrofilními granulocyty. Barveno hematoxylinem eozinem (zvětšení 100x). 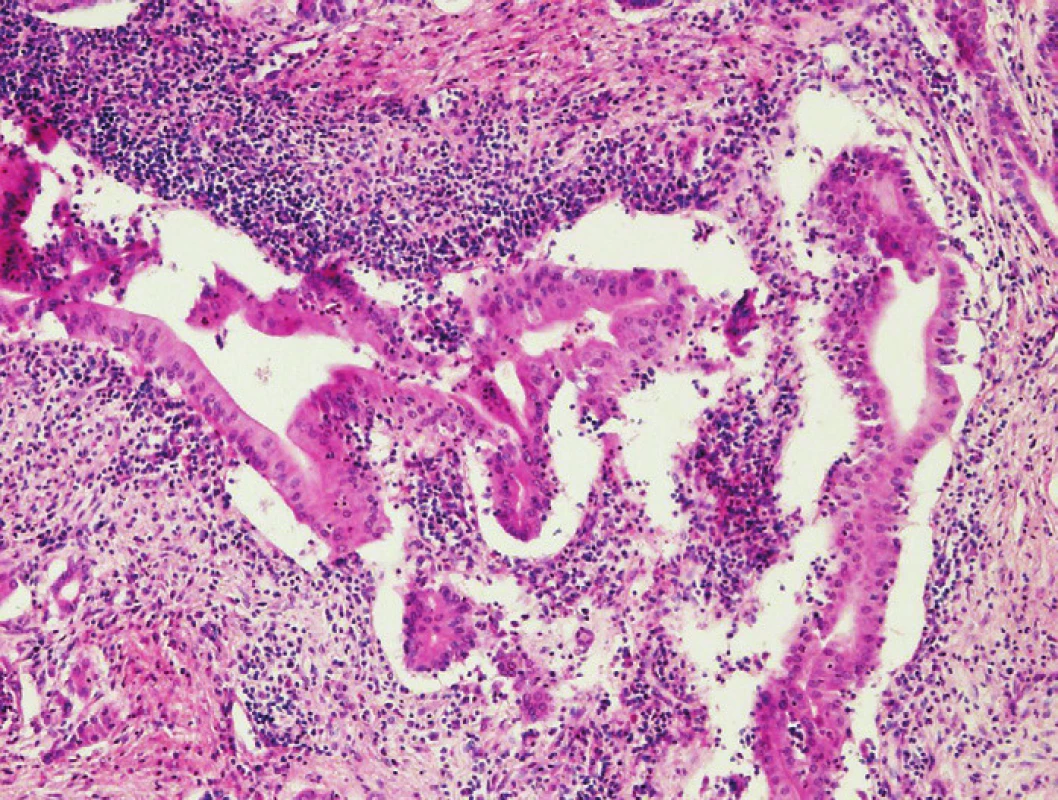
I v klinickém obraze pacientů s LPSP (typ 1) a IDCP (typ 2) lze vysledovat jisté odlišnosti. Pozitivita autoprotilátek, ač nespecifických, hypergamaglobulinémie a odpověď na terapii steroidy podporují autoimunitní etiologii LPSP, často sdružené i s jinými sklerozujícími lézemi ve vztahu k IgG4. Častější je postižení mužů vyššího věku. IDCP se rovněž vyznačuje odpovědí na terapii steroidy, vyskytuje se obvykle izolovaně (výjimečně v asociaci s idiopatickými střevními záněty, jmenovitě ulcerózní kolitidou), pacienti jsou přibližně o dekádu mladší ve srovnání s LPSP, není vyjádřena pohlavní predilekce a spekuluje se, že může jít o orgánově-specifické (pankreas) autoimunitní onemocnění (18,35).
ZÁVĚR
Karcinom pankreatu imituje široké spektrum nenádorových lézí. Diferenciální diagnostika chronické pankreatitidy a duktálního adenokarcinomu pankreatu stále představuje komplikovanou kapitolu chirurgické patologie vyžadující podrobnou znalost klinických i histopatologických nálezů sledovaných nozologických jednotek. Prezentovaná kritéria a nálezy favorizující jednotlivé sledované diagnózy jsou prakticky aplikovatelná v každodenní rutinní diagnostické praxi a přes své limitace umožňují odlišení benigních a maligních lézí pankreatu ve většině bioptických vzorků.
Adresa pro korespondenci:
Prof. MUDr. Markéta Hermanová, Ph.D.
I. patologicko-anatomický ústav LF MU a FN u sv. Anny, Brno
Pekařská 53, 656 91 Brno
tel: 543 183 218; fax: 543 183 217
email: marketa.hermanova@fnusa.cz
Zdroje
1. Adsay NV, Bandyopadhyay S, Basturk O, et al. Chronic pancreatitis or pancreatic ductal adenocarcinoma? Semin Diagn Pathol 2004; 21(4): 268–276.
2. Klöppel G, Adsay NV. Chronic pancreatitis and the differential diagnosis versus pancreatic cancer. Arch Pathol Lab Med 2009; 133(3): 382–387.
3. Cioc AM, Ellison EC, Proca DM, Lucas JG, Frankel WL. Frozen section diagnosis of pancreatic lesions. Arch Pathol Lab Med 2002; 126(10): 1169–1173.
4. Hyland C, Kheir SM, Kashlan MB. Frozen section diagnosis of pancreatic carcinoma: a prospective study of 64 biopsies. Am J Surg Pathol 1981; 5(2): 179–191.
5. Raimondi S, Lowenfels AB, Morselli-Labate AM, Maisonneuve P, Pezzilli R. Pancreatic cancer in chronic pancreatitis; aetiology, incidence, and early detection. Best Pract Res Clin Gastroenterol 2010; 24(3): 349–358.
6. Malka D, Hammel P, Maire F, et al. Risk of pancreatic adenocarcinoma in chronic pancreatitis. Gut 2002; 51(6): 849–852.
7. Volkholz H, Stolte M, Becker V. Epithelial dysplasias in chronic pancreatitis. Virchows Arch A Pathol Anat Histol 1982; 396(3): 331–349.
8. Tannapfel A, Witzigmann H, Wittekind C. Pancreatic intraepithelial neoplasia in chronic pancreatitis. Zentralbl Chir 2001; 126(11): 879–883.
9. Ohike N, Jürgensen A, Pipeleers-Marichal M, Klöppel G. Mixed ductal-endocrine carcinomas of the pancreas and ductal adenocarcinomas with scattered endocrine cells: characterization of the endocrine cells. Virchows Arch 2003; 442(3): 258–265.
10. Lüttges J, Stigge C, Pacena M, Klöppel G. Rare ductal adenocarcinoma of the pancreas in patients younger than age 40 years. Cancer 2004; 100(1): 173–182.
11. Klöppel G, Detlefsen S, Feyerabend B. Fibrosis of the pancreas: the initial tissue damage and the resulting pattern. Virchows Arch 2004; 445(1): 1–8.
12. Ammann RW, Heitz PU, Klöppel G. Course of alcoholic chronic pancreatitis: a prospective clinicomorphological long-term study. Gastroenterology 1996; 111(1): 224–231.
13. Klöppel G, Maillet B. The morphological basis for the evolution of acute pancreatitis into chronic pancreatitis. Virchows Arch A Pathol Anat Histopathol 1992; 420(1): 1–4.
14. Klöppel G. Chronic pancreatitis, pseudotumors and other tumor-like lesions. Mod Pathol 2007; 20 Suppl 1: S113–131.
15. Zamboni G, Capelli P, Scarpa A, et al. Nonneoplastic mimickers of pancreatic neoplasms. Arch Pathol Lab Med 2009; 133(3): 439–453.
16. Adsay NV, Basturk O, Klimstra DS, Klöppel G. Pancreatic pseudotumors: non-neoplastic solid lesions of the pancreas that clinically mimic pancreas cancer. Semin Diagn Pathol 2004; 21(4): 260–267.
17. Adsay NV, Basturk O, Thirabanjasak D. Diagnostic features and differential diagnosis of autoimmune pancreatitis. Semin Diagn Pathol 2005; 22(4): 309–317.
18. Chari ST, Kloeppel G, Zhang L, Notohara K, Lerch MM, Shimosegawa T. Histopathologic and clinical subtypes of autoimmune pancreatitis: the Honolulu consensus document. Pancreatology 2010; 10(6): 664–672.
19. Sharma S, Green KB. The pancreatic duct and its arteriovenous relationship: an underutilized aid in the diagnosis and distinction of pancreatic adenocarcinoma from pancreatic intraepithelial neoplasia. A study of 126 pancreatectomy specimens. Am J Surg Pathol 2004; 28(5): 613–620.
20. Adsay VN, Bandyopadhyay S, Basturk O. Duct adjacent to a thick-walled medium-sized muscular vessel in the pancreas is often indicative of invasive adenocarcinoma. Am J Surg Pathol 2006; 30(9): 1203–1205.
21. Wachtel MS, Miller EJ. Focal changes of chronic pancreatitis and duct-arteriovenous relationships: avoiding a diagnostic pitfall. Am J Surg Pathol 2005; 29(11): 1521–1523.
22. Bandyopadhyay S, Basturk O, Coban I, Thirabanjasak D, et al. Isolated solitary ducts (naked ducts) in adipose tissue: a specific but underappreciated finding of pancreatic adenocarcinoma and one of the potential reasons of understaging and high recurrence rate. Am J Surg Pathol 2009; 33(3): 425–429.
23. Pour PM, Bell RH, Batra SK. Neural invasion in the staging of pancreatic cancer. Pancreas 2003; 26(4): 322–325.
24. Nagakawa T, Kayahara M, Ueno K, et al. A clinicopathologic study on neural invasion in cancer of the pancreatic head. Cancer 1992; 69(4): 930–935.
25. Liu B, Lu KY. Neural invasion in pancreatic carcinoma. Hepatobiliary Pancreat Dis Int 2002; 1(3): 469–476.
26. Lüttges J, Diederichs A, Menke MA, Vogel I, Kremer B, Klöppel G. Ductal lesions in patients with chronic pancreatitis show K-ras mutations in a frequency similar to that in the normal pancreas and lack nuclear immunoreactivity for p53. Cancer 2000; 88(11): 2495–2504.
27. Weger AR, Lindholm JL. Discrimination of pancreatic adenocarcinomas from chronic pancreatitis by morphometric analysis. Pathol Res Pract 1992; 188(1–2): 44–48.
28. Kosmahl M, Pauser U, Anlauf M, Klöppel G. Pancreatic ductal adenocarcinomas with cystic features: neither rare nor uniform. Mod Pathol 2005; 18(9): 1157–1164.
29. Adsay V, Logani S, Sarkar F, Crissman J, Vaitkevicius V. Foamy gland pattern of pancreatic ductal adenocarcinoma: a deceptively benign-appearing variant. Am J Surg Pathol 2000; 24(4): 493–504.
30. Klöppel G, Lüttges J. The pathology of ductal-type pancreatic carcinomas and pancreatic intraepithelial neoplasia: insights for clinicians. Curr Gastroenterol Rep 2004; 6(2): 111–118.
31. Scarpa A, Capelli P, Mukai K, et al. Pancreatic adenocarcinomas frequently show p53 gene mutations. Am J Pathol 1993; 142(5): 1534–4543.
32. Nenutil R, Smardova J, Pavlova S, et al. Discriminating functional and non-functional p53 in human tumours by p53 and MDM2 immunohistochemistry. J Pathol 2005; 207(3): 251–259.
33. Schutte M, Hruban RH, Hedrick L, et al. DPC4 gene in various tumor types. Cancer Res 1996; 56(11): 2527–2530.
34. Suda K, Takase M, Fukumura Y, Kashiwagi S. Pathology of autoimmune pancreatitis and tumor-forming pancreatitis. J Gastroenterol 2007; 42 Suppl 18 : 22–27.
35. Shimosegawa T, Chari ST, Frulloni L, et al. International consensus diagnostic criteria for autoimmune pancreatitis: guidelines of the International Association of Pancreatology. Pancreas 2011; 40(3): 352–358.
Štítky
Patologie Soudní lékařství Toxikologie
Článek vyšel v časopiseČesko-slovenská patologie

2012 Číslo 3-
Všechny články tohoto čísla
- Pseudotumors & MIMICKERS
- SLINNÉ ŽLÁZY VYPADAJÍ V MIKROSKOPU TAK KRÁSNĚ!
- HEMATOPATOLOGIE, UROPATOLOGIE, NEFROPATOLOGIE...
- Pseudotumors & Mimickers: Přehled vybraných pseudotumorů s uvedením nádorů, které mohou mikroskopicky imitovat
- Melanocytární pseudotumory
- Změny ve specializačním vzdělávání v patologii od roku 2012
- Diferenciální diagnostika chronické pankreatitidy a duktálního adenokarcinomu pankreatu
- Obrovskobuněčné léze kostí a jejich diferenciální diagnostika
- Pseudotumory varlete a adnexálních testikulárních struktur
- Patologie slinných žláz
- Primární dlaždicobuněčný karcinom vagíny vzniklý na podkladě skvamózní inkluzní cysty zadní stěny vagíny – popis případu
- Sarkomatoidní (metaplastický) vřetenobuněčný karcinom prsu vznikající ve fyloidním tumoru s rozsáhlou skvamózní metaplázií – kazuistika a přehled literatury
- Rozbor histopatologických pitevních nálezů u 8 pacientů s chřipkovou (H1N1) pneumonií
- Imunoexprese adiponektinového receptoru typu 1 v lidském střevě
- Historie a současnost tenkojehlové aspirační cytologie
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Obrovskobuněčné léze kostí a jejich diferenciální diagnostika
- Diferenciální diagnostika chronické pankreatitidy a duktálního adenokarcinomu pankreatu
- Sarkomatoidní (metaplastický) vřetenobuněčný karcinom prsu vznikající ve fyloidním tumoru s rozsáhlou skvamózní metaplázií – kazuistika a přehled literatury
- Melanocytární pseudotumory
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



