-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Gynekologické prekancerózy z pohledu klinika dnes a zítra
Gynaecological precanceroses from the clinical perspective – today and tomorrow
During the last twenty-five years an enormous shift in our knowledge of cancerogenesis in all gynaecological precancerous and cancerous diseases can be seen. Early diagnosis of these lesions of the lower genital tract (vulva, vagina and cervix) is enabled mainly due to easy access. The major role in the pathogenesis of most precancerous lesions can be accounted to high risk human papillomavirus. Recently, new information about HPV genotypisation of single precancerous lesions and single histological cancer types were revealed. Thus we can better estimate the effect of vaccines on different age groups of women in relation to different types of cancer. The development and introduction of prophylactic vaccines into clinical practice was one of the major improvements of current medicine. Precancerous and cancer lesions of endometrium make themselves known by early symptoms such as perimenopausal and postmenopausal bleeding. Optimal diagnostic and therapeutic procedures have to be based on close cooperation between the clinician and pathologist.
Keywords:
precancerosis – HPV – genotyping – screening – prophylactic vaccination
Autoři: Lukáš Rob 1
; Helena Robová 1
; Roman Chmel 1
; P. Škapa 2
Působiště autorů: Gynekologicko porodnická klinika UK 2. LF Praha a FN Motol 1; Ústav patologie a molekulární medicíny UK 2. LF Praha a FN Motol 2
Vyšlo v časopise: Čes.-slov. Patol., 48, 2012, No. 1, p. 9-14
Kategorie: Přehledový článek
Souhrn
V posledních pětadvaceti letech jsme svědky výrazného posunu ve znalostech kancerogeneze všech gynekologických prekanceróz, ale i zhoubných nádorů ženských reprodukčních orgánů. Efektivní časná diagnostika je proveditelná zejména díky dobré přístupnosti dolního genitálního traktu (DGT) a zaměřuje se na vyhledávání prekanceróz a časných stadií invazivních karcinomů. Významnou roli v patogenezi většiny prekanceróz DGT hraje perzistentní infekce rizikovými humánními papilomaviry. V současnosti se rozšiřují naše znalosti o genotypizaci HPV u jednotlivých stupňů prekanceróz a u jednotlivých histologických typů karcinomů. Tím jsme schopni lépe definovat efekt jednotlivých vakcín na skupiny žen dle závažnosti a dle histologického typu léze. Vývoj a uvedení profylaktických vakcín do klinické praxe je jedním z nejvýznamnějších pokroků lékařství posledních 10 let. Prekancerózy a časná stadia karcinomů endometria je možné diagnostikovat díky časnému příznaku, kterým je perimenopausální nebo postmenopausální krvácení. Optimálnímu diagnosticko terapeutický postup u všech prekanceróz musí vycházet z úzké spolupráce klinika a patologa.
Klíčová slova:
prekancerózy – HPV – genotypizace – skríning – profylaktická vakcinaceV posledních pětadvaceti letech jsme svědky výrazného posunu ve znalostech kancerogeneze všech gynekologických prekanceróz, ale i zhoubných nádorů ženských reprodukčních orgánů. Efektivní časná diagnostika je proveditelná zejména díky dobré přístupnosti dolního genitálního traktu (DGT – vulva, pochva, děložní hrdlo) a zaměřuje se na vyhledávání prekanceróz a časných stadií invazivních karcinomů. Významnou roli v patogenezi většiny prekanceróz DGT hraje perzistentní infekce rizikovými humánními papilomaviry. Vývoj a uvedení profylaktických vakcín do klinické praxe je jedním z nejvýznamnějších pokroků medicíny posledních 10 let. Prekancerózy a časná stadia karcinomů endometria je možné diagnostikovat díky časnému příznaku, kterým je perimenopausální nebo postmenopausální krvácení z dělohy. Nejkomplikovanější problém představuje časná diagnostika zhoubných nádorů vejcovodu, ovarií a peritonea, kde i přes nové poznatky o patogenezi nejsme schopni detekovat prekancerózy a ani časná stadia invazivních karcinomů. Léčba zhoubných gynekologických nádorů se dnes stále více přesunuje do specializovaných onkogynekologických center. V rámci oboru gynekologie a porodnictví byla proto vytvořena subspecializace onkogynekologie. Stejný trend existuje i v oblasti patologie. Terapie malignity dnes zpravidla začíná na společném týdenním mezioborovém semináři, jehož je patolog nepostradatelnou součástí. To umožňuje všem zúčastněným rozšiřovat své znalosti, zvyšovat diagnostickou spolehlivost a následně optimálně individualizovat léčbu. Histopatologické parametry jednotlivých zhoubných nádorů jsou v řadě případů klíčovými faktory individualizace terapie. Diagnostika prekanceróz, ale i jejich chirurgická léčba, je však zájmem poměrně široké skupiny privátních gynekologů a gynekologů z regionálních nemocnic. Histopatologická diagnostika prekanceróz je rutinní praxí všech patologicko-anatomických pracovišť. Tento fakt přináší pro obě strany řadu úskalí od adekvátnosti odběru, orientace vzorků, jejich fixaci až po interpretaci výsledků. Neustálá aktualizace současných znalostí je tedy velmi důležitá. Z pohledu onkogynekologů se v přehledu pokusíme shrnout dnešní poznatky o prekancerózách, vlastní zkušenosti a úskalí diagnostiky, včetně shrnutí trendu léčby těchto stavů.
PREKANCERÓZY VULVY
Zhoubné nádory vulvy jsou relativně raritními nádory, přičemž v České republice ročně diagnostikujeme 175–200 nových případů, které představují incidenci 3,5–4,0/100 000 žen. Trend incidence je v posledních 25 letech mírně vzestupný, což lze dát zejména do souvislosti s prodlužujícím se věkem žen (průměrný věk žen se v České republice za 25 let posunul z 72 na 78 let). Průměrný věk žen s invazivními nádory vulvy je 74 let. V současnosti zaznamenáváme mírný nárůst nových případů spinocelulárních karcinomů i u žen do věku 50 let, což souvisí s infekcí vysoce rizikovými typy HPV a stále častějším kouřením mladých žen. Více než 90 % nových zhoubných nádorů představují spinocelulární karcinomy, jejich prekurzorům se budeme věnovat obšírněji.
Melanomy jsou druhou nejčastější skupinou (4–7 %). Na vulvě přitom chybí nejvýznamnější rizikový faktor, jímž je její vystavení slunečnímu záření. Nález dysplastických névů, superficiálně se šířícího melanomu in situ nebo atypické melanocytární dysplazie je raritní. Základem léčby pigmentových prekancerózních změn je jejich chirurgická exstirpace s makroskopicky minimálně desetimilimetrovým lemem. V rutinní praxi doporučujeme odstraňovat všechny pigmentové léze vulvy, neboť ženy nejsou většinou schopny sledovat změny jejich charakteru. V diferenciální diagnostice může tyto léze imitovat ložisko VIN s hyperpigmentací. Z pohledu klinika je u multifokálních ložisek mnohdy velmi obtížné dodržet dostatečný bezpečnostní lem, a proto v praxi akceptujeme i 5 mm okraj s následnou bedlivou dispenzarizací. Rozsáhlejší a radikálnější excize mohou následně snižovat kvalitu života u sexuálně aktivních žen.
Různé histologické varianty adenokarcinomů tvoří 1–2 % zhoubných nádorů vulvy a zastižení jejich prekursorů je v klinické praxi s výjimkou Pagetovy choroby kazuistické. Tato diagnóza pro klinika skýtá několik úskalí. Studie ukazují, že ve více než 10 % lze ve spodině diagnostikovat adenokarcinom. To vyžaduje radikálnější hloubku excize. Okraje těchto lézí nebývají ostré a jasně detekovatelné. To často vede k odstranění léze non in sano. Větší soubory udávají až 40–55 % lokálních recidiv. Při této diagnóze je nutno pátrat po adenokarcinomech v jiných lokalizacích. Ostatní zhoubné nádory jsou raritní, nepřesahují 2 % ze všech zhoubných nádorů vulvy a jejich prekurzory nejsou známé.
Vulvární intraepiteliální neoplazie (VIN)
Současná klasifikace prekanceróz zohledňuje dnešní znalosti o patogenezi těchto změn. VIN obvyklého typu (u-VIN) je asociována s onkogenními HPV a VIN diferencovaného typu (d-VIN) není asociována s HPV infekcí. V biopsiích vulvárních lézí, které obsahují prekancerózu, je u-VIN zastižena v 85–90 %, tedy daleko častěji než d-VIN (10–15 %). Onkogenní HPV však prokážeme pouze u 1/3 invazivních spinocelulárních karcinomů vulvy (1). Tento rozpor mezi frekvencí HPV asociovaných prekanceróz a HPV asociovaných karcinomů vulvy je dobře vysvětlitelný. Prekancerózy u-VIN se vyskytují u mladších žen, jsou to vyvýšená ložiska, často s hyperpigmentací nebo s hyperkeratózou (kolposkopicky leukoplakií), často multifokální, s kratší symptomatologií pruritu, v okolí lézí je většinou normální epitel bez známek vulvární dermatózy. Tyto faktory přivádějí mladší ženy ke svým gynekologům, přičemž řada z nich je již sledována pro předchozí epiteliální léze děložního hrdla. To vše umožňuje častější diagnostiku, navíc je všeobecně akceptován názor, že v případě u-VIN je pomalejší progrese do invazivního karcinomu než v případě léze bez souvislosti s HPV. Neléčené léze mají tendenci se šířit do poševního introitu, pochvy nebo do perianální krajiny.
Daleko obtížnější klinická diagnostika je u d-VIN. Tyto léze ve většině případů vznikají v terénu vulvárních dermatóz, nejčastěji lichen sclerosus, který je daleko častější u starších žen po menopauze u nichž je pruritus častým symptomem. Ztenčení epiteliální vrstvy, změny v subepiteliálních vrstvách s lokální zánětlivou reakcí vedou k dlouhodobému pruritu, vzniku exkoriací vyvolaných škrábáním nebo u obéznějších žen třením. Ložisko d-VIN bývá v tomto terénu solitární, většinou je mírně vyvýšené s nebo bez hyperkeratózy. Kolposkopický obraz postrádá varovné znaky cervikálních prekanceróz, zejména změn cévní kresby. Hojící se exkoriace ztěžují určení správné diagnózy. Ženy v 7. a 8. deceniu většinou rezignují na návštěvu u gynekologa a přicházejí až s mnohdy pokročilým invazivním karcinomem. Má pro klinika význam přesná histopatologická diagnóza u-VIN versus d-VIN? Ano, toto rozlišení má význam jak pro léčbu, tak pro intervaly kontrol (2,3). V současnosti neznáme přesnou incidenci prekanceróz vulvy.
Léčba u-VIN
Po bioptické verifikaci klinicky nejsuspektnějšího ložiska by měla následovat expertní kolposkopie (vulvoskopie). Výsledkem by měl být přesný popis rozsahu změn, popis poševního introitu, samotné pochvy a také děložního hrdla s cílem vyloučení či potvrzení multifokálního postižení celého DGT. Součástí vyšetření musí být i kolposkopie perianální krajiny. K hodnocení změn při nativní kolposkopii používáme 5% kyselinu octovou. Nákres ložisek by měl být součástí zdravotnické dokumentace pacientky. Cílem pečlivého vyšetření je minimalizace rizika přehlédnutí ložiska, které je již podezřelé z invaze a kde by excize tkáně měla být vedena v hlubší subepiteliální vrstvě. Chirurgická ablace klasickým nožem je vhodná u menšího ložiska. U sexuálně aktivních žen je nevýhodou ztráta tkáně a riziko vzniku jizvy. Menší ložiska lze odstranit vysokofrekvenční radiokličkou, tedy technikou používanou u konizací na děložním hrdle. Metodou volby u větších a vícečetných ložisek je však CO2 laserová ablace, která se dle nálezu provádí ve formě tangenciálních excizí, nebo tangenciální skining hemivulvectomie. Hojení je sice prolongované, ale nedochází ke ztrátě tkáně. Recidivy z perzistence HPV jsou časté a chirurgickou léčbu je třeba ve více než 50 % opakovat. Z konzervativních postupů se zkouší imiquimod (ALDARA), imunomodulační krém nebo v experimentech fotodynamická terapie. Výsledky nechirurgických postupů nejsou v dlouhodobém sledování zatím uspokojivé.
Budoucnost – profylaktické vakcíny. Převážná většina HPV asociovaných lézí na vulvě je spojena s HPV typem 16, dosavadní výsledky vakcinací ukazují vysokou efektivitu protekce u naivní populace v případech obou na trh uvedených vakcín (Cervarix, Silgard). S ohledem na věkovou distribuci vulvárních HPV asociovaných prekanceróz bude efekt profylaktické vakcinace patrný až po několika desetiletích (3). Terapeutické vakcíny jsou nyní v klinických zkouškách, nejdále je vakcína proti HPV 16, kde se slibnými výsledky byla ukončena fáze II a probíhá fáze III, včetně efektu na u-VIN.
Léčba d-VIN
Zásadní je časná diagnostika, která však má řadu úskalí. V současnosti je vhodné odhalit všechny ženy s vulvárními dermatózami (lichen sclerosus – LS, lichen simplex chronicus – LSCH). Současná lokální léčba kortikoidy a protizánětlivá léčba dokáže výrazně redukovat svědění u 90 % žen. Není ale prokázáno, že by tato lokální léčba redukovala riziko vzniku d-VIN a karcinomů. V dlouhodobém sledování je riziko vzniku karcinomu u postmenopausální ženy s lichen sclerosus 4–5 %. Redukce pruritu může povzbudit i postmenopausální ženy k šestiměsíčním kontrolám s poučením, že recidiva svědění nebo změna povrchu epitelu vulvy může vést k časnější diagnostice d-VIN nebo počínající invazi. Bohužel, rychlost progrese z LS přes d-VIN do invaze může být v mnoha případech i v intervalu méně než 6 měsíců (2). Adekvátní léčbou d-VIN je chirurgická excize s cca 10 mm lemem makroskopicky zdravé tkáně. Konzervativní metody nejsou vhodné.
PREKANCERÓZY POCHVY
Primární zhoubné nádory pochvy jsou relativně málo četné a v České republice ročně diagnostikujeme 35–50 nových případů, což představuje incidenci 0,4 až 0,6/100 000. Častější než primární jsou nádory metastatické nebo nádory prorůstající z jiných orgánů malé pánve. Prekancerózy VAIN (vaginální intraepiteliální neoplazie) a jejich problematika je podobná problematice cervikálních prekanceróz. Většina žen s prekancerózou pochvy měla nebo má lézi na děložním hrdle. S VAIN se v klinické praxi nejčastěji setkáváme po hysterektomiích. Prvním krokem je biopsie z kolposkopicky nejsuspektnějších ložisek, kterou je většinou vhodné provést v celkové anestesii po předchozí infiltraci parakolpia. To umožní provést excizi i s částí subepiteliální vrstvy. V případě VAIN I u žen se sexuální aktivitou odkládáme chirurgické řešení a provádíme expertní kolposkopii v intervalu 4–6 měsíců. Terapeutickým výkonem u prekanceróz je zpravidla parciální kolpektomie.
PREKANCERÓZY DĚLOŽNÍHO HRDLA
V České republice je ročně diagnostikováno okolo 1000 nových karcinomů děložního hrdla a ročně na toto onemocnění umírá 300–380 žen. Incidence je i přes mírný pokles během posledních 30 let stále vysoká a pohybuje se mezi 19–20/100 000 žen s mortalitou 6–7/100 000. To nás v EU řadí mezi země horší poloviny a je to jasným důkazem současné neefektivní skríningové strategie. Výrazné rozdíly v incidenci a mortalitě existují mezi kontinenty, ale rozdíly můžeme pozorovat i mezi evropskými zeměmi. V Evropě je vyšší incidence a mortalita v bývalých postkomunistických zemích s jednoznačným „východ–západ“ gradientem. Bohužel tento trend přetrvává i po více než 20 letech od pádu Berlínské zdi i naší „sametové revoluce“ (4). Epidemiologické studie posledních dvou dekád vedly k jednoznačnému závěru, že cervikální intraepiteliální neoplazie II. a III. stupně (CIN II a III) a karcinomy děložního hrdla jsou sexuálně přenosná onemocnění, u nichž je spouštěcím mechanizmem perzistující infekce jedním z 15 onkogenních, tzv. rizikových typů humánních papilomavirů (5–8). Dnes víme, že se s touto infekcí do 30 let věku setká více než 80 % sexuálně aktivních žen s více než jedním sexuálním partnerem. Ve většině případů se však organismus ženy s touto infekcí vypořádá a eliminuje ji (9). Přesnou incidenci prekanceróz můžeme pouze odhadovat.
Podle současných doporučení většinu skvamózních intraepiteliálních lézí nízkého stupně (LG SIL – CIN I) sledujeme a pouze perzistující LG léze jsou indikací k ošetření (10). Skvamózní intraepiteliální léze vysokého stupně (HG SIL – CIN II, III) by se s výjimkou těhotenství měly chirurgicky léčit (11). Časná diagnostika adenoprekanceróz je velice obtížná a v bioptickém materiálu konizací je poměr AIS versus HG SIL 1 : 75. Dle výkazů plátců je v ČR prováděno ročně více než 9 000 excizních výkonů tedy konizací. Lze předpokládat, že v 50–60 % jsou výkony prováděny pro high grade léze, což by mělo znamenat, že v ČR je ročně diagnostikováno 4–5 000 high grade lézí.
V současnosti víme, že v případě HG SIL se prokáží onkogenní HPV typy v 99,5 % lézí. U spinocelulárních karcinomů lze onkogenní HPV typy prokázat v 99 % a u adenokarcinomů v 96 %. Podle dnes dostupných studií lze vyvodit jasné závěry: téměř všechny těžké prekancerózy jsou spojeny s onkogenními HPV typy a pouze velmi malá část cervikálních karcinomů může vzniknout bez vlivu onkogenních HPV (12,13). K infekci HPV dochází nejvíce u mladých žen na začátku sexuálního života, ve skupině 20-25 let prokážeme aktuální infekci až u 30 %. Ve věkové kohortě 25 až 35 let nastává postupný pokles a okolo 35. roku prokážeme HPV infekci jen u 5–8 % žen (13). Současné studie na některých populacích ukazují, že mezi 40.–50. rokem života dochází k druhému menšímu vzestupu incidence HPV vysoce rizikových (HR) infekcí. Nejpravděpodobnější vysvětlení spočívá v možnosti získání nových infekcí se změnou sexuálních partnerů, jak u mužů, tak i u žen, protože předchozí prodělaná přirozená infekce nepředstavuje ochranu před reinfekcí.
V současnosti je k dispozici několik genotypizačních studií, podle nichž je možné konstatovat, že existují rozdíly v distribuci jednotlivých onkogenních typů mezi kontinenty a i mezi různými zeměmi jednotlivých kontinentů (12,13). Spektrum HPV typů je nejširší u lehkých prekanceróz a se závažností léze stoupá zastoupení HPV vakcinačních typů 16 a 18, které jsou celosvětově zastoupeny u 71 % spinocelulárních karcinomů. HPV typy 31, 33, 35 a 45 společně s HPV 16 a 18 se vyskytují v 90 % spinocelulárních karcinomů (12,13). U adenokarcinomů jsou též nejvíce zastoupeny typy 16, 18 a 45, přičemž tyto tři typy lze detekovat u 94 % z nich (13). Vlastní, zatím nepublikovaná data, na naší populaci z genotypizace více než 250 invazivních karcinomů a více než 280 HG lézí se mírně liší, a to ve prospěch vakcinačních typů HPV 16 a 18. Ty jsou zastoupeny v 76 % spinocelulárních karcinomů, a společně s typy 31, 33 a 45 celkem u 90 % z nich. V souboru „českých adenokarcinomů“ byly detekovány pouze tři typy HPV, a to 16, 18 a 45. Co tato čísla znamenají pro praxi? Pokud připustíme, že by vakcína mohla mít tzv. „zkříženou protektivitu“ i na příbuzné nevakcinační typy (tj. typy 31, 33, 35 a 45), jak prokazují klinické studie bivalentní vakcíny (14,15), lze předpokládat, že bychom u naivních žen vakcinovaných touto vakcínou zabránili v naší populaci vzniku více než 90 % CIN III, téměř eliminovali adenokarcinomy vyvolané HPV viry (tj. 95 % adenokarcinomů) a zabránili i vzniku více než 85 % dlaždicobuněčných karcinomů. V nejbližší době budou publikována data z Evropské multicentrické studie HERACLES (více než 3500 těžkých prekanceróz) a SCALE (více než 3500 invazivních karcinomů). Tyto recentní genotypové studie z 13 zemí EU budou poměrně důležité pro modely efektivity jednotlivých vakcín.
Management suspektních kolposkopických a cytologických nálezů
Spolupráce a dobrá informovanost mezi gynekologem a histopatologem je klíčem k minimalizaci chyb. Vlastní diagnostiko-terapeutické algoritmy dnes vycházejí z výsledků cytologie, kolposkopie a stále více klademe důraz na reprodukční plány. V současnosti se v naší zemi používá cytologická klasifikace – tzv. Bethesda systém. V tab. 1 jsou ideální korelace mezi kolposkopií, cytologií a histopatologií. Kolposkopii dnes dělíme na základní, kterou by měl ovládat každý gynekolog a expertní, která je certifikovaným kurzem pod patronací ČLK. Získání expertní kolposkopie vyžaduje doložení ve dvou následujících letech minimálně 50 tzv. HG lézí a vyšších, biopticky ověřených a přezkoušení v jednom ze tří školících center. Seznam gynekologů (cca 40) s touto licencí lze nalézt na www.kolposkopie.cz. Na těchto stránkách lze nalézt i oficiální konsensus pro řešení jednotlivých cytologických a kolposkopických nálezů.
Tab. 1. Ideální korelace mezi kolposkopií, cytologií a histopatologií u prekanceróz děložního hrdla 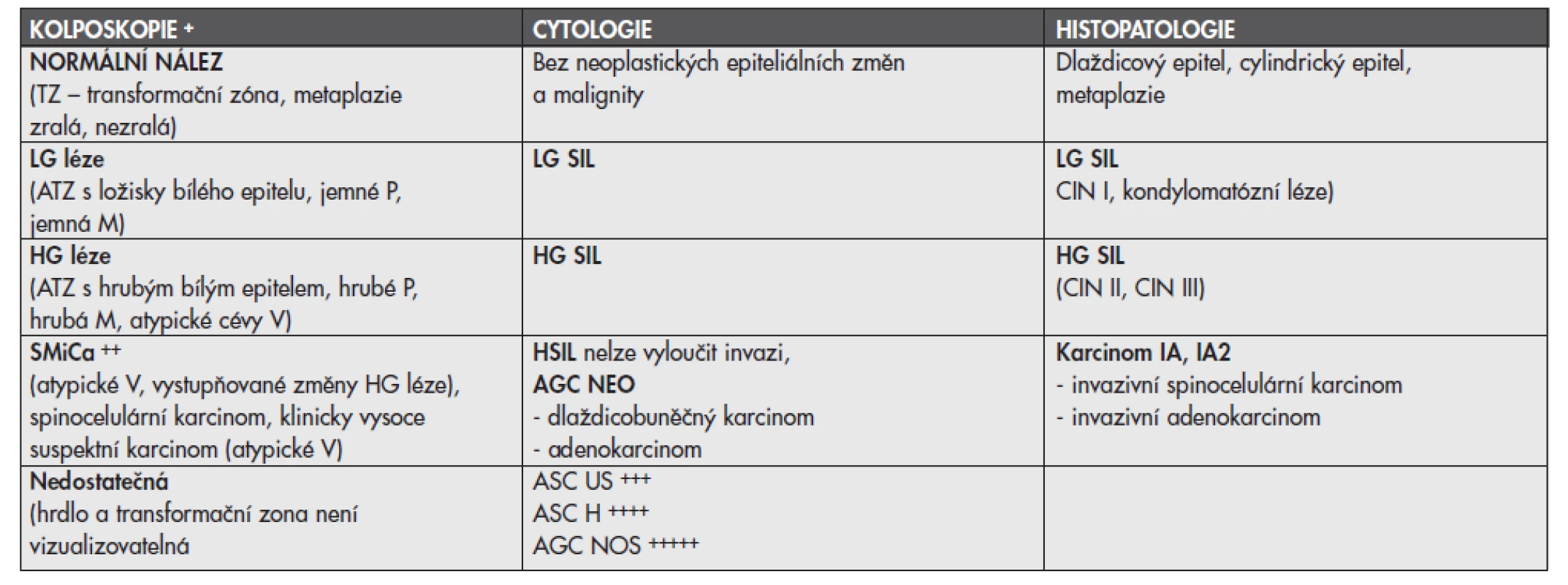
+ každá histopatologická průvodka by měla obsahovat kolposkopický závěr, v praxi je i významne uvedení a popis změn ve vztahu k jednotlivým kvadrantům cervixu, k endocervikalnimu kanálu (ATZ typ I – plně kolposkopicky vizualizovatelná, kolposkopicky se léze nešíří do kanálu hrdla, ATZ typ II – léze zasahuje do endocervixu, ATZ typ III léze zasahuje do endocervixu a proximálni konec není viditelný, ATZ typ IV – léze zcela v endocervikalnim kanálu). ++ expertní kolposkopie na základě cévních atypií je schopna vyslovit podezřeni na počínající invazi SMiCa – význam tato subkategorie je v tom, že pokud není kolposkopicky jasný karcinom, kdy stačí excize či malá punch biopsie v potvrzeni diagnózy a je nutno podezření na mikrokarcinom verifikovat adekvátně velkým odběrem tkáně - konizaci (LETZ, jehlovou konizací nebo konizací noIem). +++ kategorie ASC US nemá přímou korelaci – do 2 % se pod ní může skrývat HG léze a výše, v 5–15 % LG léze. ++++ ASC H – tato kategorie nemá též přímou korelaci, klinik ji však musí považovat za závažnější nález než LG SIL. V 25–35 % nalézáme LG SIL, v 50–70 % HG SIL, 1–3 % invazivní karcinom. +++++ AGC NOS – tato kategorie opět nemá kolposkopickou ani patologickou korelaci, v 5–15 % nalézáme LG SIL, do 2 % HG SIL a do 5 % žlázové atypie, do 1 % in situ adenokarcinom. zkratky: ATZ – atypická transformační zóna, SMiCa – suspektní mikrokarcinom Diagnostická biopsie je častým úskalím, neboť získaná tkáň svým rozměrem, zhmožděním či nedokonalou orientací může ztěžovat nebo až znemožňovat stanovení přesné histopatologické diagnózy. Diagnostické abraze endocervixu jsou u prekanceróz nevhodným výkonem. V současnosti je u kolposkopicky vizualizovatelných lézí výkonem volby cílená excize skalpelem nebo častěji dnes využívaná kolposkopicky cílená punch biopsie. Tyto malé odběry je nutno provádět ostrými bioptickými kleštěmi s optimálním rozměrem excizní plochy 7x5mm. K vyšší diagnostické spolehlivosti těchto malých odběrů přispívá domluva o technice orientace a fixace mezi klinikem a patologem. Patologická tkáň většinou dosahuje do okrajů a tato biopsie má pouze stanovit stupeň intraepiteliální léze.
Excizní metody ošetření hrdla jsou nejčastějším diagnosticko-terapeutickým výkonem. V současnosti zcela vytlačily destrukční metody (kryoterapii, laserovou vaporizaci, elektrodiatermokoagulaci), které neumožňovaly histopatologické zpracování tkáně.
Excizní metody lze rozdělit na konizace (konické vytnutí tkáně), které se dříve prováděly skalpelem nebo nůžkami (studená konizace), laserovým paprskem (laserová konizace), a ty, které se dnes nejčastěji provádějí vysokofrekvenčními kličkami (loop excision of transformation zone - LETZ, LLETZ), nebo vysokofrekvenčními jehlami (needle cone). Druhou skupinou výkonů jsou cylindrické dissekce. Jak již sám název napovídá, cílem je vytnout větší část endocervikálního kanálu a současně se snažit o minimální odstranění zdravého stromatu. Tyto výkony provádíme většinou vysokofrekvenční jehlou s odstřižením endocervikálního okraje nůžkami, laserem, obtížněji pomocí kombinace skalpelu a nůžek. Pracoviště, na které je žena s cervikální patologií odeslána, by mělo individualizovat typ a hloubku excize dle kolposkopického nálezu. Cílem by měla být snaha o co nejmenší odstranění stromatu hrdla zejména u žen ve fertilním věku. Dnes máme poměrně jasná data, že konizace u žen ve fertilním věku je rizikovým faktorem pro předčasný porod a že opakované konizace ve fertilním věku jsou vysoce rizikovým faktorem pro předčasný porod (16,17). U exocervikálně lokalizovaných lézí se používá LETZ konizace (umožňuje excizi v jednom řezu do hloubky 10 až 12 mm) nebo mělká konizace jehlou. Endocervikálně lokalizované léze je vhodnější řešit jehlovou konizací, jehlovou cylindrickou dissekcí nebo konizací skalpelem. Optimálně je konus nebo tkáň cylindrické dissekce dodána v jednom neporušeném preparátu. Bohužel, řada gynekologů dodá konus v několika „řízcích“ a pak je orientace a interpretace nálezu pro patologa velmi obtížným nebo až neřešitelným problémem. Dalším častým prohřeškem radiochirurgických metod je termické poškození okrajů preparátu. Nejzávažnější je termické poškození endocervikálního okraje preparátu. K zamezení termického poškození je vhodné endocervikální část odstříhnout nůžkami. Histopatologický popis by měl vždy obsahovat makropopis s jasně definovanou plochou a hloubkou preparátu. Ve vlastním popisu by mělo být vyjádření k okrajům a k případným termickým artefaktům, tedy i ke kvalitě preparátu. Jedině rychlá zpětná kontrola může zlepšit kvalitu těchto jinak jednoduchých chirurgických výkonů. Používání nízkých frekvencí nevhodného přístroje při řezu, pomalost vedení řezu při nezkušenosti s výkonem, nevhodná velikost kličky, nekvalitní klička nebo její vícenásobné použití, jsou nejčastější prohřešky, které ztěžují a mnohdy zcela znemožňují kvalitní patologickou interpretaci nálezu.
Budoucnost – dnes je jasné, že v blízké budoucnosti je třeba přehodnotit kategorii CIN II lézí a jejich zařazení do společné kategorie HG SIL s CIN III. Odlišný profil HPV jasně ukazuje, že část lézí CIN II více odpovídá LG lézím, které by bylo možno sledovat a ušetřit zejména ženy ve fertilním věku konizací. Hledání spolehlivého markeru rizika progrese je v klinické praxi zejména pro ženy ve fertilním věku velice důležité.
Plošná profylaktická vakcinace není už v některých zemích budoucností, ale současností. Dnes jsou na českém i světovém trhu registrované dvě vakcíny. Kvadruvalentní (proti typům 16, 18 a 6, 11) – SILGARD, v některých zemích je distribuován pod názvem GARDASIL, a bivalentní (proti typům 16, 18) – CERVARIX. Obě vakcíny prokazují vysokou efektivitu proti vakcinačním typům v naivní populaci, a to jak pro perzistentní infekci, tak pro prekancerózy (14,18,19). Obě vakcíny se liší technologií výroby, přičemž zásadním rozdílem je použité adjuvans. Současná data poukazují na rozdílné výsledky v titrech protilátek při dlouhodobém sledování (20). Obě vakcíny prokázaly minimum závažných nežádoucích účinků a jsou jednoznačně bezpečné. Přidaná hodnota kvadruvalentní vakcíny tkví v ochraně proti „benigním“ HPV typům, které vyvolávají u žen tzv. condylomata acuminata. Přidaná hodnota bivalentní vakcíny je zejména v tzv. „cross – protekci“, tedy zkřížené protekci i proti blízkým nevakcinačním typům. Současné studie ukazují zejména fascinující protektivitu proti typu 45, který je v naší populaci zastoupen u 17 % adenokarcinomů a u 5 % spinocelulárních karcinomů. Adenokarcinomy unikají časné detekci poměrně často i v zemích s dobře organizovaným skríningovým programem. Pokud i další data potvrdí vysokou efektivitu dostupných vakcín proti HPV typům 18 a 45, tak by u vakcinovaných bivalentní vakcínou byl vznik adenokarcinomu velmi raritní a jednalo by se o vzácné varianty, které nejsou asociovány s HPV. Bivalentní vakcína navíc prokazuje i částečný efekt proti u nás poměrně častým typům 31, 33 a 35, které se vyskytují u 10 % spinocelulárních karcinomů a v relativně vysokém procentu těžkých prekanceróz. Současná data ukazují až na 93% protekci u CIN III lézí (14,15). Plošná vakcinace 13. a 14. letých dívek by tedy v horizontu 15 až 20 let zredukovala významně počet HG lézí, a tím i konizací, a v následujících 10 letech i počet invazivních karcinomů.
PREKANCERÓZY ENDOMETRIA
V České republice je ročně diagnostikováno téměř 1 800 nových karcinomů endometria a ročně na toto onemocnění umírá téměř 500 žen. Incidence má v posledních 25 letech stále vzestupný charakter a blíží se 35/100 000 žen. Karcinomy endometria jsou tedy nejčastějším zhoubným nádorem ženských reprodukčních orgánů s maximem výskytu po menopause s průměrným věkem 61 let. Incidence diagnostikovaných prekanceróz, za které považujeme atypické hyperplazie, není tak častá jako například incidence prekanceróz děložního hrdla (21,22). V 85 % se hyperplazie projevují nepravidelným nebo postmenopausálním děložním krvácením. Vzácněji jsou u postmenopausálních žen asymptomatické nálezy zachyceny ultrazvukem, a to u žen léčených Tamoxifenem nebo u kterých bylo ultrazvukové vyšetření indikováno z jiné příčiny. V terminologii hyperplazií je dnes zpochybňován koncept WHO 1994 klasifikace, která dělila hyperplazie na simplexní hyperplazii a komplexní hyperplazii a na vlastní prekancerózy, mezi které byly řazeny simplexní atypická hyperplazie a komplexní atypická hyperplazie. Řada škol používá pouze zjednodušenou terminologii – atypická hyperplazie a nebo používá koncept endometriální intraepiteliální neoplazie (23,24). Pro klinickou praxi je však klíčové rozlišení hyperplazie nevykazující atypie a atypické hyperplazie. Průměrný věk žen s atypickou hyperplazií je 53 let a jde tedy o ženy v perimenopause nebo postmenopause a to usnadňuje terapeutické rozhodování. Pouze výjimečně se s nálezy atypických hyperplazií setkáváme u žen ve fertilním věku. Zde je management složitější. V současnosti v diagnostice intrauterinních patologií používáme klasickou kyretáž hrdla a těla, hysteroskopickou diagnostiku s cíleným hysteroskopickým odběrem biopsie nebo hysteroskopii s následnou kyretáží. Hysteroskopie má nespornou výhodu u lokalizovaných a polypozních lézí. Nález ložiska s atypiemi na atrofickém pozadí endometria je vzácný a raritní, většinou takto zachytíme již invazivní karcinomy II. typu. U nálezů hyperplastického endometria je však vhodné získat abrazí co nejvíce tkáně pro histopatologické zpracování. Malé biopsie prováděné často ambulantní minihysteroskopií jsou málo reprezentativní a mohou být příčinou oddálení správné diagnózy. V literatuře se u nálezů atypické hyperplazie nalezne v následné hysterektomii dobře diferencovaný karcinom v 18–37 % případů (22).
Léčba atypické hyperplazie
V současnosti je pouze atypická hyperplazie u ženy plánující těhotenství vhodná pro hormonální léčbu gestageny. Jsou vedeny diskuze o dávkovacích schématech a délce podávání, nejčastěji medroxyprogesteronacetátu nebo megestrolacetátu. Tyto ženy patří do péče onkogynekologických center. Experimenty s aplikací intrauterinního tělíska s levonorgestrelem na povrchu nejsou přesvědčivé. Po systémové hormonální léčbě v délce 3–6 měsíců se provádí kontrolní hysteroskopie. Ta by měla být provedena za měsíc po vysazení léčby nebo po první menstruaci a při normalizaci nálezu je vhodné ženy zařadit do IVF programu. Pokud se jim podaří otěhotnět a další graviditu neplánují, doporučujeme hysterektomii, kterou sami považujeme za první volbu u všech žen s nálezem atypické hyperplazie po skončení reprodukční činnosti. Je nutno se zaměřit na příčinu hyperestrinního stavu a vyloučit zejména hormonálně aktivní ovariální nádory. Dlouhodobá hormonální léčba gestageny u premenopausálních i postmenopausálních žen zvyšuje signifikantně riziko (RR = 1,5–1,8) vzniku karcinomu prsu. To je spolu s častými recidivami nejpádnější argument proti konzervativním postupům. Za alternativní postupy lze považovat aplikaci intrauterinního tělíska s gestagenem (MIRENA) nebo hysteroskopické ablace endometria. Oba postupy považujeme za nevhodné. Po hysteroskopických ablacích dochází často k tvorbě synechií a adekvátní sledování těchto žen je mnohdy nemožné.
Budoucnost – v současnosti nejsou reálná žádná rychlá řešení redukující nejčastější rizikový faktor, kterým je obezita postmenopausálních žen.
ZÁVĚR
V posledních dvou dekádách se významně rozšířily znalosti o patogenezi většiny gynekologických prekanceróz a karcinomů. V řadě lokalizací to přináší změny klasifikace a terminologie. Základ úspěšného diagnosticko-terapeutického postupu spočívá v úzké spolupráci klinika a patologa. Snahou klinika by mělo být poskytnout patologovi adekvátní informace a co nejoptimálnější vzorek pro stanovení správné diagnózy. Zpětná kontrola a jasné diagnostické závěry pomáhají minimalizovat chyby v terapeutických postupech.
Adresa pro korespondenci:
Prof. MUDr. Lukáš Rob, CSc.
Gynekologicko - porodnická klinika
UK 2. LF a FN Motol, Praha
V Úvalu 84, Praha 5, 15006
e-mail: lukas.rob@lfmotol.cuni.cz
Zdroje
1. Van Beurden M, ten Kate FW, Tjong AH et al. Human papillomavirus DNA in multicentric vulvar intraepithelial neoplasia. Int J Gynecol Pathol 1998; 17 : 12–16.
2. Van de Nieuwenhof HP, van der Avoort IA, de Hullu JA. Review of squamous premalignant vulvar lesion. Crit Rev Oncol Hematol 2008; 68 : 131–156.
3. Škapa P, Zámečník J, Hamšíková E et al. Human papillomavirus (HPV) profiles of vulvar lesions: possible implications for the classification of vulvar squamous cell carcinoma precursors and for the efficacy of prophylactic HPV vaccination. Am J Surg Pathol 2007; 31 : 1834–1843.
4. Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008; Int J Cancer 2010; 127 : 2893–2917.
5. Munoz N, Bosch FX, de Sanjose S, et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med 2003; 348 : 518–527.
6. Smith JS, Lindsay L, Hoots B, et al. Human papillomavirus type distribution in invasive cervical cancer and high grade cervical lesions: a meta-analysis update. Int J Cancer 2007; 121 : 621–632.
7. Schiffman M, Kjaer SK. Chapter 2: Natural history of anogenital human papillomavirus infection and neoplasia. J Natl Cancer Inst Monogr 2003; 31 : 14–19.
8. Koshiol J, Lindsay L, Pimenta JM, et al. Persistent human papillomavirus infection and cervical neoplasia: a systematic review and meta-analysis. Am J Epidemiol 2008; 168 : 123–137.
9. Bosch FX, Burchel AN, Schiffman M, et al. Epidemiology and natural history of infections and type-specific implications in cervical neoplasia. Vaccine 2008; 26: Suppl 10 : 1–16.
10. Rob L, Robová H, Kačírek J, Pluta M. Prekancerózy děložního hrdla – management abnormálních nálezů na děložním hrdle. Modern Gynekol Porod 2003; 12 : 665–675.
11. Robova H, Rob L, Pluta et al. Squamous intraepithelial lesion – microinvasive carcinoma of the cervix during pregnancy. Eur J Gynaecol Oncol 2005; 26 : 611–614.
12. Schiffman M, Castle PE, Jeronimo J, et al. Human papillomavirus and cervical cancer. Lancet 2007; 370 : 890–907.
13. de Sanjose S, Quint WG, Alemany L, et al. Human papillomavirus genotype attribution in invasive cervical cancer: a retrospective cross-sectional worldvide study. Lancet Oncol 2010; 11 : 1048–1056.
14. EMEA. Cervarix summary of product characteristicsEMEA/H/C/ 721II/1711.Available at:http://ec.europa.eu/health/documents/ community-register/html/h419.htm. Accessed 15 September 2010.
15. Huh WK, Paavonen J, Naud P, et al. For the Patricia study group. Efficasy of the HPV-16/18AS04-adjuvanted vaccine in women according to their initial DNA and serostatus: PATRICIA end-of-study results. IGCS 2010; Abstract.
16. Arbyn M, Kyrgiou M, Simoens c, et al. Perinatal mortality and other severe adverse pregnancy outcomes associated with treatment of cervical intraepithelial neoplasia: meta-analysis. BMJ 2008; 337 : 1284–1290.
17. Kyrgiou M, Koliopoulos G, Martin-Hirch P, et al. Obstetric outcomes after conservative treatment for intraepithelial or early invasive cervical lesions: systematic review and meta-analysis. Lancet 2006; 367 : 486–498.
18. EMEA. Gardasil summary of product characteristics EMEA/H/C/ 703/II/26. Available at: http://ec.europa.eu/health/documents/community-register/html/h357.htm Accessed 15 September 2010.
19. Munos N, Manalastas R, Pitisuttithum P, et al. Safety, immunogenicity, and efficacy of quadrivalent human papillomavirus (types 6, 11, 16, 18) recombinant vaccine in women aged 24-25 years: a randomised, double-blind trial. Lancet 2009; 373 : 1949–1957.
20. Einstein MH, Baron M, Levin MJ, et al. Comparison of the immunogenicity and safety of Cervarix TM and Gardasil® human papillomavirus (HPV) cervical cancer vaccines in healthy women aged 18–45 years. Hum Vaccin 2009; 5 : 705–719.
21. Mutter GL, Kauderer J, Baak JPA, Alberts DA. Biopsy histomorphometry predicts uterine myoinvasion by endometrial carcinoma: A Gynecologic Oncology Group Study. Hum Pathol 2008; 39 : 866–874.
22. Merisio C, Berretta R, De IA et al. Endometrial cancer in patients with preoperative diagnosis of atypical endometrial hyperplasia. Eur J Obstet Gynecol Reprod Biol 2005; 122(1): 107–111.
23. Reed SD, Newton KM, Garcia RL et al. Complex hyperplasia with and without atypia: clinical outcome and implications of progestin therapy. Obstet Gynecol 2010; 116 : 365–375.
24. Semere LG, Ko E, Johnson NR et al. Endometrial intraepithelial neoplasia clinical correlates and outcomes: A practice-based experience. Obstet Gynecol 2011; 118 : 255–263.
Štítky
Patologie Soudní lékařství Toxikologie
Článek Prekancerózní léze vulvyČlánek Gynekologické prekancerózyČlánek PULMOPATOLOGIEČlánek JAKÁ JE VAŠE DIAGNÓZA?Článek UROPATOLOGIEČlánek NEUROPATOLOGIE
Článek vyšel v časopiseČesko-slovenská patologie

2012 Číslo 1-
Všechny články tohoto čísla
- Prekancerózní léze vulvy
- Co je nového v cytodiagnostice cervikálních prekanceróz?
- Gynekologické prekancerózy
- Prekancerózy endometria, děložní tuby a ovaria: přehled současné problematiky
- PULMOPATOLOGIE
- JAKÁ JE VAŠE DIAGNÓZA?
- Neuroendokrinní adenom středouší s prorůstáním do zevního zvukovodu
- UROPATOLOGIE
- JAKÁ JE VAŠE DIAGNÓZA? - ODPOVĚĎ
- Některé endoskopické biopsie se dnes od cytoblokových vzorků zase tolik neliší
- Vaginálny myofibroblastóm so žliazkami exprimujúcimi mamárne a prostatické antigeny
- Recidivujúci multifokálny leiomyosarkóm močového mechúra 22 rokov po liečbe bilaterálneho (hereditárneho) retinoblastómu: popis prípadu a prehľad literatúry
- NEUROPATOLOGIE
- Primární neuroendokrinní karcinom jater
- PATOLOGIE ORL OBLASTI, ORTOPEDICKÁ PATOLOGIE, PATOLOGIE GIT...
- PATOLOGIE ORL OBLASTI, ORTOPEDICKÁ PATOLOGIE, PATOLOGIE GIT...
- IN MEMORIAM MUDr. Zdeňku Madákovi
- Gynekologické prekancerózy z pohledu klinika dnes a zítra
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Gynekologické prekancerózy z pohledu klinika dnes a zítra
- Prekancerózní léze vulvy
- Co je nového v cytodiagnostice cervikálních prekanceróz?
- Prekancerózy endometria, děložní tuby a ovaria: přehled současné problematiky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



