-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Relativní adrenální insuficience a vazopresor-rezistentní hypotenze u kriticky nemocných novorozenců
Relative adrenal insufficiency and vasopressor-resistant hypotension in critically ill newborns
A significant proportion of critically ill neonates with hypotension in intensive care units do not respond to volume administration or vasopressors/inotropic circulatory support. The incidence of this refractory hypotension, or vasopressor-resistant hypotension (VRH), is inversely proportional to gestational age. VRH can have a major impact on the mortality and morbidity of these patients. Adrenal insufficiency is currently considered to be its main cause. Particularly relative adrenal insufficiency (RAI) occurs when the amount of cortisol production in the adrenal glands is insufficient for to the severity of illness.
This review article summarizes the basics of hypothalamic-pituitary-adrenal axis physiology in the embryonic and fetal period and the fundamental aspects of RAI and VRH pathophysiology in critically ill and very preterm neonates. Diagnostic and therapeutic options, including side effects with regard to the long-term prognosis of exposed patients, are also discussed.
Keywords:
cortisol – relative adrenal insufficiency – vasopressor-resistant hypotension – critically ill neonate
Autoři: I. Berka 1,2; J. Kučera 1
Působiště autorů: Ústav pro péči o matku dítě, Praha 1; 3. lékařská fakulta Univerzity Karlovy, Praha 2
Vyšlo v časopise: Čes-slov Neonat 2022; 28 (1): 36-41.
Kategorie: Přehledový článek
Souhrn
Kriticky nemocní, oběhově nestabilní novorozenci na jednotkách intenzivní péče až ve třetině případů nereagují adekvátně na volumexpanzi nebo oběhovou podporu katecholaminy. Výskyt této refrakterní hypotenze nebo vazopresor-rezistentní hypotenze (VRH) stoupá s mírou nezralosti a může mít zásadní dopad na mortalitu a morbiditu nejen těžce nezralých pacientů. Za její hlavní příčinu je v současnosti považována adrenální insuficience, především ve smyslu relativní adrenální insuficience (RAI), kdy je množství produkce kortizolu v nadledvinách nedostatečné vzhledem k tíži onemocnění.
Tento přehledový článek shrnuje jak základy fyziologie hypothalamo-pituitárně-adrenální osy v embryonálním a fetálním období a elementární aspekty patofyziologie RAI a VRH u kriticky nemocných a těžce nezralých novorozenců, tak diagnostické a terapeutické možnosti, včetně nežádoucích účinků, s ohledem na dlouhodobou prognózu exponovaných.
Klíčová slova:
kortizol – relativní adrenální insuficience – vazopresor-rezistentní hypotenze – kriticky nemocný novorozenec
ÚVOD
Aktivace hypothalamo-pituitárně-adrenální (HPA) osy a produkce kortizolu v zona fasciculata kůry nadledvin jsou základem adaptační fáze odpovědi organismu na stres. Kortizol má širokou paletu účinku, především ve smyslu udržování glykemické a minerální homeostázy v séru, zachování integrity kapilárního řečiště a jeho přiměřené vaskulární permeability [1]. Působí imunomodulačně a snižuje intenzitu systémové zánětové odpovědi [2]. Nedostatečná produkce je označována jako adrenální insuficience. V případě produkce nedostatečné, vzhledem k tíži onemocnění nebo stresu, hovoříme o relativní, případně funkční adrenální insuficienci (RAI) [1]. Vazba mezi limitovanou adrenální odpovědí na stres u kriticky nemocných pacientů a jejich zvýšenou mortalitou je popisována od 80. let minulého století [3]. RAI tak představuje potenciálně život ohrožující komplikaci. U novorozenců jsou k dispozici přesvědčivá data o adrenální insuficienci v kontextu těžké nezralosti, sepse nebo obecně celkové nestability základních životních funkcí [4, 5, 6].
Hlavním uváděným příznakem RAI je oběhová nestabilita s hypotenzí a rozvojem šokového stavu bez adekvátní odpovědi na volumexpanzi nebo oběhovou podporu vazopresory, způsobená periferní vazodilatací [7]. Vazopresor-rezistentní hypotenze (VRH), či refrakterní hypotenze, může být ovšem zapříčiněna i těžkou myokardiální dysfunkcí. RAI je tak v současnosti chápána spíše jako možný zdroj VRH a obě komplikace se překrývají pouze částečně, bez nutné asociace [8].
Incidence hypotenze u novorozenců hospitalizovaných na jednotce intenzivní péče (JIP) je 20–50 % [9]. Přibližně 15–30 % nereaguje na podání oběhové podpory vazopresory/inotropy s inverzní korelací ke gestačnímu stáří [10, 11]. VRH tak postihuje 3–15 % novorozenců na JIP. Incidence RAI je nejasná vzhledem k absenci konsenzuálních diagnostických kritérií. Uváděno je široké rozmezí 3–56 % kriticky nemocných novorozenců [1].
Cílem tohoto přehledového článku je shrnutí patofyziologie, současných diagnostických možností, klinických příznaků a případné terapie RAI u kriticky nemocných novorozenců s ohledem na jejich dlouhodobou prognózu.
SOUHRN FYZIOLOGIE HPA OSY V EMBRYONÁLNÍM A FETÁLNÍM OBDOBÍ
HPA osa je aktivována produkcí kortikotropin uvolňujícího faktoru (CRF) v nucleus paraventricularis hypothalamu a jeho uvolněním do kapilár hypothalamo - hypofyzárního portálního systému. V pars distalis předního laloku hypofýzy stimuluje CRF tvorbu adrenokortikotropního hormonu (ACTH). Tato stimulace je u plodu detekovatelná ve 14.–20. týdnu těhotenství, ACTH je ve fetálním séru přítomen od 16. týdne. Do 20. týdne gestace je tak završeno funkční etablování HPA osy [1, 12]. Mezodermální buňky budoucí kůry nadledvin migrují do oblasti horního pólu mesonephros ve 4.–5. týdnu, od 7. týdne jsou v séru přítomny některé adrenální steroidogenní enzymy (např. 21-hydroxyláza, aldosteron-syntáza). Kůra fetálních nadledvin se skládá z robustní primitivní, přechodné a úzké definitivní zóny. Zona glomerulosa a zona fasciculata kůry nadledvin jsou plně diferencovány ve věku 3 let po narození, zona reticularis mezi 4. a 15. rokem. Kortizol je v průběhu fetálního vývoje produkován v primitivní a přechodné zóně, tvorba v definitivní zóně začíná na konci třetího trimestru [12]. Do konce 23. týdne fetální kůra nadledvin nedisponuje 3-beta-hydroxysteroidní dehydrogenázou (3-beta-HSD), která katalyzuje přeměnu pregnenolonu na progesteron. Z tohoto důvodu plod k tvorbě kortizolu používá progesteron produkovaný placentou až do konce 30. týdne těhotenství. V průběhu těhotenství je navíc funkce HPA osy inhibována mateřským kortizolem volně procházejícím placentou. Tato suprese je od 32. týdne postupně snižována dvěma mechanismy. Prvním je zvyšující se aktivita 11-beta-HSD2 v placentě, která vede k inaktivaci maternálního kortizolu přeměnou na kortizon, druhým je zvyšující se produkce CRF placentou na konci třetího trimestru [1, 12].
ZÁKLADNÍ ASPEKTY PATOFYZIOLOGIE RAI A VRH U KRITICKY NEMOCNÝCH NOVOROZENCŮ
Při absenci stresu je více než 90 % kortizolu v séru vázáno na plazmatické bílkoviny a jeho produkce je inhibována negativní zpětnou vazbou snižující hladiny CRF a ACTH. V případě kritického onemocnění (např. infekce, trauma, chirurgický výkon) dochází u dospělých, vzhledem ke stimulaci produkce CRF především prozánětlivými cytokiny a snížení zpětnovazebné inhibice, až k šestinásobnému nárůstu produkce kortizolu. Zároveň dochází k poklesu sérové hladiny albuminu a globulinů vázajících kortizol a ke zvýšení jeho volné frakce [13]. Pokud je odpověď HPA osy insuficientní, dochází k down regulaci kardiovaskulárních adrenergních receptorů a systému renin - -angiotenzin. K výsledné vazodilataci přispívá i up regulace inducibilní NO-syntázy, aktivace ATP-senzitivních draslíkových kanálů a některé prozánětlivé cytokiny (interleukin IL-1, IL-2, IL-6, interferon γ). Patofyziologie RAI u dospělých pacientů byla takto popsána extenzivně [13]. Několik studií popisuje RAI téměř identicky u kriticky nemocných novorozenců, často v prvních dvou týdnech po narození [14, 15]. Obecné mechanismy rozvoje zahrnují adrenální hypoperfuzi při hypotenzi, snížení vazby ACTH na adrenální receptory vlivem cytokinů (např. TNFα) nebo absenci adrenálních rezerv při zvýšení metabolických nároků [8, 16].
Donošení nebo mírně nezralí (≥ 34. týden gestace) kriticky nemocní novorozenci s VRH mají, na rozdíl od novorozenců s adekvátní odpovědí na volumexpanzi a oběhovou podporu, zvýšené sérové hladiny pregnenolonu, 17-hydroxy-pregnenolonu a dehydroepiandrosteronu (DHEA). V sérových hladinách kortizolu a kortizonu se významně neliší. DHEA inhibuje expresi 11-beta-HSD1, který řídí přeměnu kortizonu zpět na kortizol. Akumulace substrátů pro 3-beta-HSD naznačuje, že právě limitovaná aktivita tohoto enzymu u novorozenců může významně přispívat k rozvoji RAI a následně VRH [17]. Dalším navrženým mechanismem rozvoje RAI u této skupiny pacientů v období prvních pěti dnů po narození je insuficience HPA osy. Tuto hypotézu podporuje detekce nízkých sérových hladin kortizolu a ACTH u kriticky nemocných a zároveň adekvátní reakce na podání nízké dávky exogenního ACTH [18]. Mechanismus rozvoje RAI je tudíž komplexní ve smyslu působení různých faktorů (obr. 1).
Obr. 1. Mechanismus rozvoje relativní adrenální insuficience a vazopresor-rezistentní hypotenze 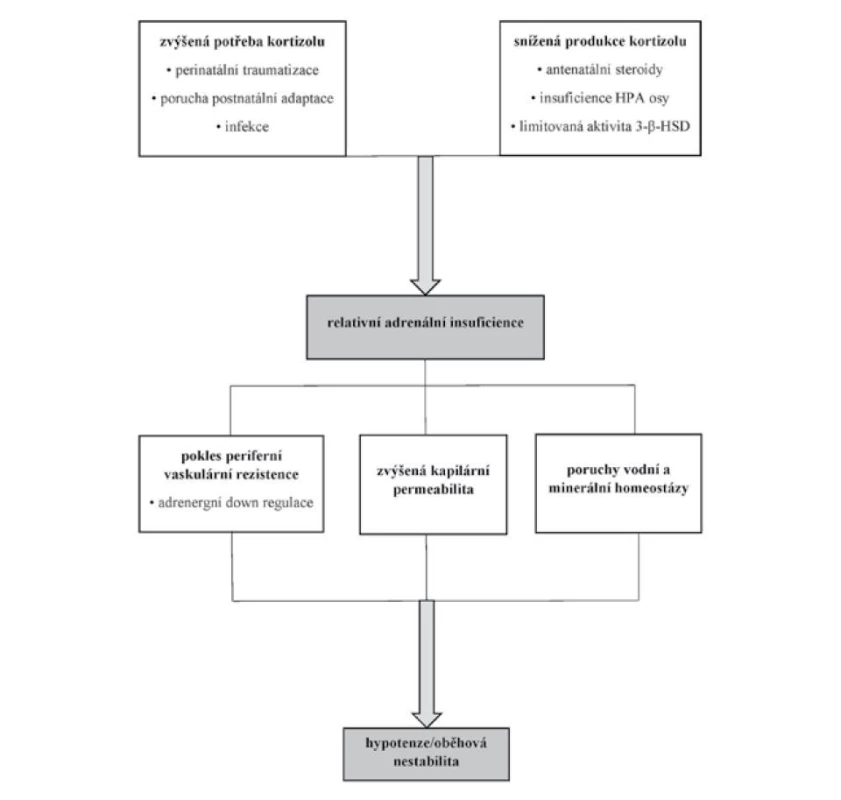
U středně a především těžce nezralých (≤ 28. týden) novorozenců je nejen předpoklad suprese HPA osy mateřským kortizolem a absencí stimulace CRF z placenty, ale i zásadně snížené aktivity 3-beta-HSD [8].
DIAGNOSTIKA A KLINICKÝ OBRAZ RAI
Diagnostika adrenální insuficience, případně RAI, je u dospělých a pediatrických pacientů založena na stanovení sérové hladiny kortizolu při klinickém podezření/ kritickém onemocnění, nebo na stimulačních testech HPA osy pomocí analogů CRF a ACTH. Mezní hodnota sérové hladiny kortizolu je 500 nmol/l, mezní hodnota stimulované hladiny kortizolu po podání především ACTH v dávce 1 μg/kg je 250 nmol/l. Stimulační test může být indikován při rozmezí hladin 500 až 1000 nmol/l [8, 19]. Podobné diagnostické hodnoty byly navrženy pro kriticky nemocné zralé a mírně nezralé novorozence [18]. U těžce nezralých novorozenců (< 30. týden gestace) byla dokumentována nízká bazální hladina kortizolu 4. den po narození (277 nmol/l, SD 144) a neadekvátní odpověď na stimulaci ACTH (215 nmol/l 30 minut po podání) při nutnosti umělé plicní ventilace [20]. Nízké hladiny kortizolu jsou u nezralých novorozenců v prvních 2 týdnech po narození asociovány s hypotenzí, vysokými dávkami vazopresorů/ inotropů, perzistencí ductus arteriosus a rozvojem bronchopulmonální dysplazie [20, 21, 22]. Uváděná mezní hodnota sérové hladiny kortizolu u nezralých novorozenců je 138 nmol/l [19]. Hlavním diagnostickým problémem, použití hodnot sérového a stimulovaného kortizolu, jsou nálezy velmi nízkých hladin u klinicky naprosto stabilních novorozenců a nálezy „normálních“ hodnot u kriticky nemocných. Konkrétní měřená hodnota může být ovlivněna zralostí novorozence, dobou odběru, mírou stresové zátěže nebo podáním antenatálních steroidů [19, 23]. Variabilita sérového a stimulovaného kortizolu u nezralých dětí v prvních 2 týdnech po narození je velmi vysoká, tudíž, na základě dostupných dat, v současnosti neexistuje konsenzuální referenční rozmezí normy [23, 24]. Důsledkem nemožnosti interpretace výsledků laboratorní diagnostiky je velmi různorodá klinická praxe. Na některých pracovištích je léčba indikována podle sérových, případně stimulovaných hladin kortizolu, zatímco na jiných se laboratorní diagnostika nepoužívá [23]. Opakovaně uváděnou diagnostickou možností by mohlo být, na základě dat ze zvířecího modelu RAI (pavián), měření volného kortizolu v moči [19, 25]. Sonografické zobrazení nadledvin je obvykle bez patologického nálezu (obr. 2) a v diagnostice RAI se nepoužívá.
Obr. 2. Sonografické zobrazení levé ledviny a nadleviny (šipka) u nezralého novorozence (26. týden), nález je bez patologie 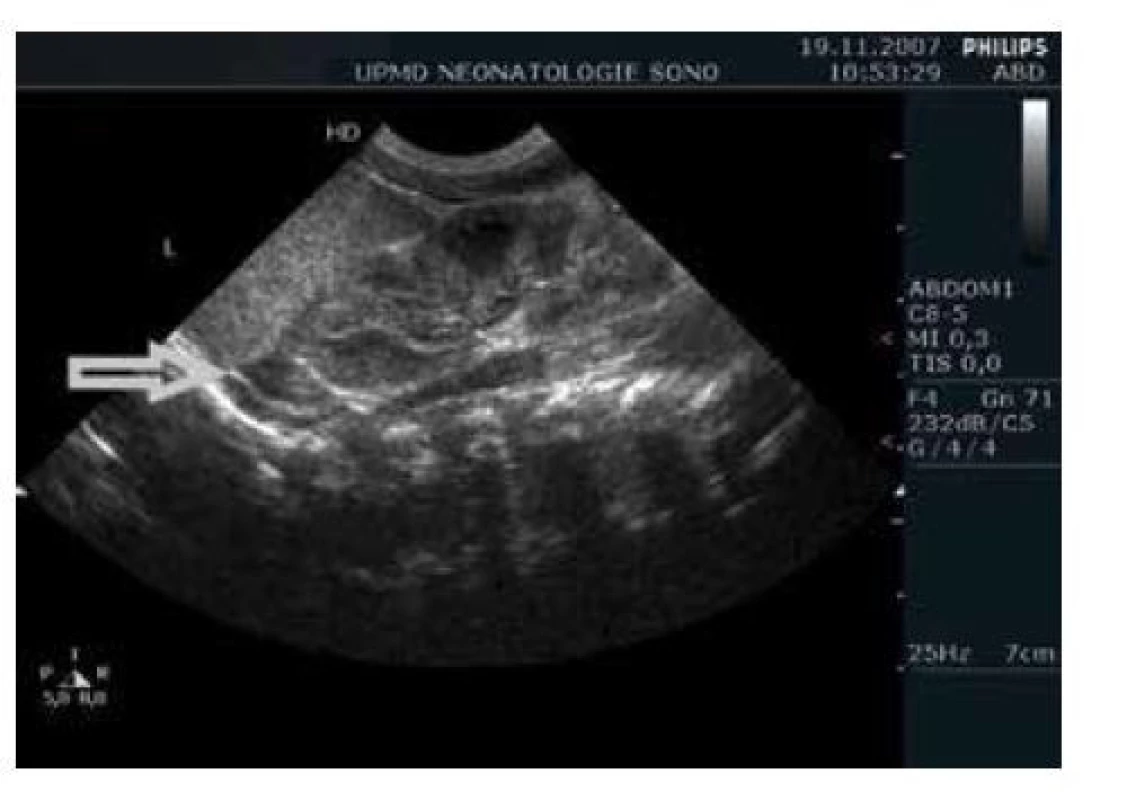
Klinická symptomatologie RAI zahrnuje především oběhovou nestabilitu s rozvojem hypotenze, jejíž příčinou je nízká periferní vaskulární rezistence. Nemusí být vždy vazopresor-rezistentní. Iniciální odpověď na zahájení oběhové podpory může být u některých pacientů adekvátní, avšak k normotenzi jsou nutné vysoké dávky katecholaminů. Například u dopaminu je to dávka ≥ 15 μg/kg/minutu [26]. Myokardiální funkce vyjádřená např. frakčním zkrácením je obvykle normální (obr. 3), v případě progrese šokového stavu může však být i snížená [19]. Mezi další symptomy patří hyponatremie, hypoglykemie, hyperkalemie, metabolická acidóza a intolerance stravy [19, 23]. Metabolické abnormality a poruchy vnitřního prostředí při RAI mohou být u kriticky nemocných v podmínkách intenzivní péče méně vyjádřeny [19].
Obr. 3. Normální funkce myokardu vyjádřená frakčním zkrácením levé komory (FS > 25 %) 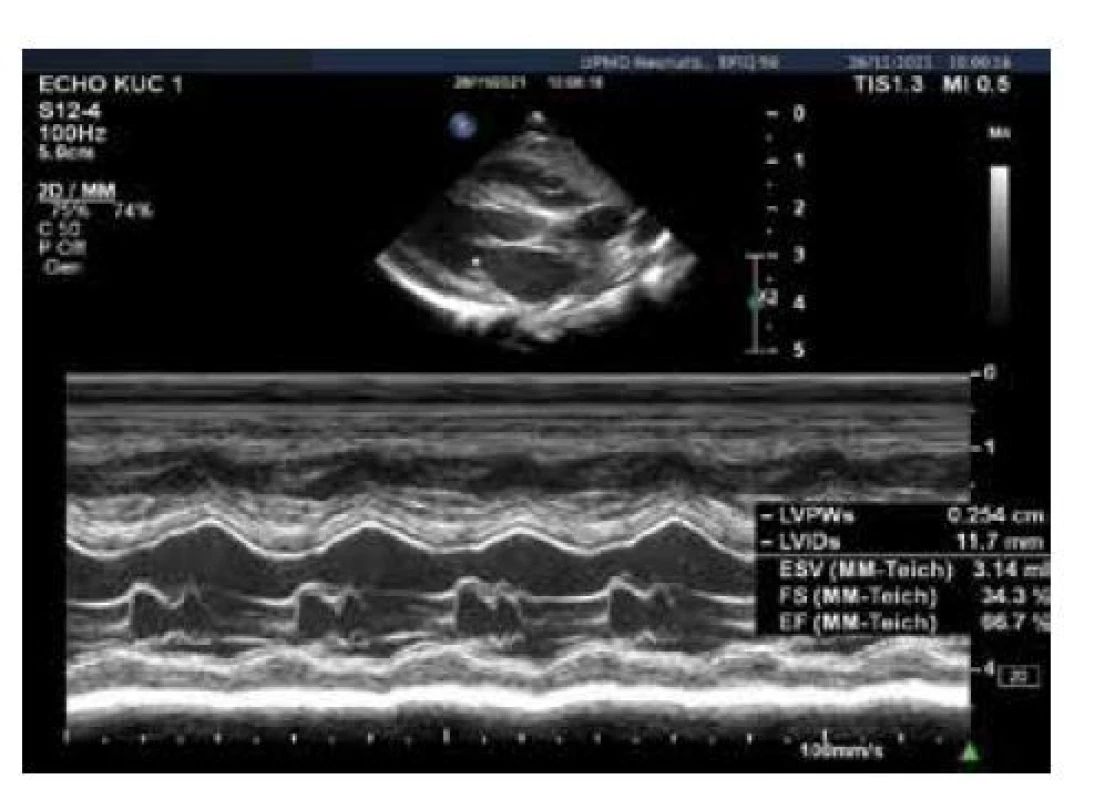
TERAPIE
Data o terapii RAI vycházejí buď z léčby oběhového selhání u kriticky nemocných novorozenců, nebo z profylaxe u těžce nezralých. Podání dexametazonu i hydrokortizonu prokazatelně zvyšuje krevní tlak při VRH přibližně 2 hodiny po podání [26, 27]. Expozice dexametazonu v prvním týdnu po narození je ovšem silně asociována s narušením dlouhodobého neurologického vývoje [28]. Příčinou je pravděpodobně glukokortikoidní efekt a absence působení mineralokortikoidního, což vede k apoptóze nervových buněk [29]. Hydrokortizon je tak v současnosti lékem volby, nicméně dávkovací rozmezí použité ve studiích zaměřených na VRH je velmi široké. Stanovení optimálního dávkovacího režimu navíc komplikuje identická struktura hydrokortizonu a kortizolu společně s velmi limitovanými informacemi o farmakokinetice hydrokortizonu u novorozenců různého gestačního stáří [8, 19]. Biologický poločas nevázaného hydrokortizonu u nezralých novorozenců (62 pacientů, medián 28. týden) byl stanoven na 2,9 hodin a po dosažení 35. týdne postmenstruačního stáří klesá [30]. Současná doporučení tak navrhují minimální možnou efektivní iniciační dávku 1 mg/kg s udržovací dávkou 0,5 mg/kg podávanou v rozmezí 8–12 hodin u nezralých a 6 až 8 hodin u donošených novorozenců [8, 31]. Pokračování v terapii je indikováno pouze v případě klinické odpovědi ve smyslu zvýšení krevního tlaku v časovém horizontu 2–4 hodiny a možnosti snižovat dávku oběhové podpory vazopresory/inotropy za 6–12 hodin [8, 26, 27, 31].
I délka terapie hydrokortizonem je zdrojem kontroverze a shoda panuje pouze na doporučení, aby byla nejkratší možná. Není jasné, zda zahájit vysazování v situaci, kdy je možné snižovat dávky oběhové podpory, nebo až po úplné oběhové stabilizaci. Vysazování by mělo být, je-li to možné, postupné (vzhledem k exogenní supresi HPA osy). U donošených novorozenců by doba podávání obvykle neměla přesáhnout 7 dnů, u nedonošených 14 [19, 31].
V protokolech čtyř randomizovaných, placebem kontrolovaných studií profylaxe RAI hydrokortizonem u těžce nezralých novorozenců trvalo podání 10 až 15 dnů. Ve třech z nich byla dávka 1 mg/kg/den po dobu 7–12 dnů následovaná dávkou 0,5 mg/kg/den 3 dny před vysazením [32, 33, 34, 35].
NEŽÁDOUCÍ ÚČINKY TERAPIE RAI A PROGNÓZA LÉČENÝCH PACIENTŮ
Mezi relativně časté krátkodobé nežádoucí účinky terapie hydrokortizonem, které mohou vést i k nutnosti vysazení, se řadí hyperglykemie a hypertenze. Obě komplikace jsou u těžce nezralých novorozenců problematické s ohledem na vysoké riziko peri-/intraventrikulární hemoragie [8]. Pozdní sepse a krvácení do gastrointestinálního traktu také postihují především léčené těžce nezralé [36]. Asociace mezi současným podáním kortikosteroidu a inhibitoru cyklooxygenázy v prvním týdnu po narození s rozvojem spontánní intestinální perforace (SIP) je velmi silná [32, 37]. Vzácně může dojít k rozvoji hypertrofie myokardu [8].
Dlouhodobé následky u zralých a nezralých novorozenců léčených hydrokortizonem pro VRH jsou v současnosti neznámé [8]. U těžce nezralých pacientů léčených profylaktickým podáním hydrokortizonu v nízké dávce nebyla zjištěna vyšší incidence dětské mozkové obrny, jejich neurokognitivní vývoj v 18. až 22. měsíci byl srovnatelný, nebo v některých aspektech i lepší než v kontrolní skupině [38, 39]. Léčení pacienti měli vyšší míru přežití bez bronchopulmonální dysplazie a přežití do propuštění, méně často u nich byl indikován farmakologický uzávěr perzistující tepenné dučeje. I přes zvýšené riziko pozdní sepse a SIP je časná profylaxe RAI v nízké dávce hodnocena u těžce nezralých jako přínosná [40]. Oproti tomu dávky přesahující 2 mg/kg/den jsou asociovány se zvýšenou mortalitou u novorozenců porozených ve 30. a nižším týdnu gestace [41].
ZÁVĚR
V současné době je již k dispozici dostatek dat o RAI a VRH u kriticky nemocných a těžce nezralých novorozenců na jednotkách intenzivní péče. Přestože neexistují jednotná klinická nebo laboratorní kritéria k zahájení podání hydrokortizonu, jeho použití v praxi narůstá, hlavně kvůli zjevnému klinickému efektu na oběhovou stabilizaci [36, 42]. Obecně lze o zařazení hydrokortizonu do terapeutického protokolu hypotenze a oběhové nestability uvažovat se zvyšujícím se stupněm nezralosti a zhoršujícím se klinickým stavem. Vzhledem k řadě krátkodobých i dlouhodobých nežádoucích účinků je racionální použití minimální účinné dávky, volba délky terapie podle stupně nezralosti a klinické odpovědi i důsledný monitoring léčených pacientů.
Konflikt zájmu: žádný.
Doručeno do redakce: 24. 1. 2022
adresa pro korespondenci:
MUDr. Ivan Berka
Ústav pro péči o matku a dítě
Podolské nábřeží 157
147 00 Praha 4
e-mail: ivan.berka@upmd.eu
Zdroje
1. Fernandez EF, Watterberg KL. Relative adrenal insufficiency in the preterm and term infant. J Perinatol 2009; 29(Suppl 2): S44–S49. doi:10.1038/jp.2009.24
2. Chrousos GP. The hypothalamic-pituitary-adrenal axis and immune - mediated inflammation. N Engl J Med 1995; 332 : 1351–1362.
3. de Jong FH, Mallios C, Jansen C, Scheck PA, Lamberts SW. Etomidate suppresses adrenocortical function by inhibition of 11 beta-hydroxylation. J Clin Endocrinol Metab 1984; 59(6): 1143–1147. doi:10.1210/jcem-59-6-1143
4. Scott SM, Watterberg KL. Effect of gestational age, postnatal age, and illness on plasma cortisol concentrations in premature infants. Pediatr Res 1995; 37(1): 112–116. doi:10.1203/00006450 - 199501000-00021
5. Soliman AT, Taman KH, Rizk MM, Nasr IS, Alrimawy H, Hamido MS. Circulating adrenocorticotropic hormone (ACTH) and cortisol concentrations in normal, appropriate-for-gestational-age newborns versus those with sepsis and respiratory distress: Cortisol response to low-dose and standard-dose ACTH tests. Metabolism 2004; 53(2): 209–214. doi:10.1016/j.metabol.2003.09.005
6. Fernandez E, Schrader R, Watterberg K. Prevalence of low cortisol values in term and near-term infants with vasopressor-resistant hypotension. J Perinatol 2005; 25(2): 114–118. doi:10.1038/ sj.jp.7211211
7. Langer M, Modi BP, Agus M. Adrenal insufficiency in the critically ill neonate and child. Curr Opin Pediatr 2006; 18(4): 448–453. doi:10.1097/01.mop.0000236397.79580.85
8. Kumbhat N, Noori S. Corticosteroids for Neonatal Hypotension. Clin Perinatol 2020; 47(3): 549–562. doi:10.1016/j. clp.2020.05.015
9. On behalf of the HIP consortium, Stranak Z, Semberova J, et al. International survey on diagnosis and management of hypotension in extremely preterm babies. Eur J Pediatr 2014; 173(6): 793–798. doi:10.1007/s00431-013-2251-9
10. Fernandez E, Watterberg K, Faix R, et al. Incidence, management, and outcomes of cardiovascular insufficiency in critically ill term and late preterm newborn infants. Am J Perinatol 2014; 31(11): 947–956. doi:10.1055/s-0034-1368089
11. Verma RP, Dasnadi S, Zhao Y, Chen HH. A comparative analysis of ante - and postnatal clinical characteristics of extremely premature neonates suffering from refractory and non-refractory hypotension: Is early clinical differentiation possible? Early Hum Dev 2017; 113 : 49–54. doi:10.1016/j.earlhumdev.2017.07.010
12. Quintos JB, Boney CM. Transient adrenal insufficiency in the premature newborn. Curr Opin Endocrinol Diabetes Obes 2010; 17(1): 8–12. doi:10.1097/MED.0b013e32833363cc
13. Cooper MS, Stewart PM. Corticosteroid insufficiency in acutely ill patients. N Engl J Med 2003; 348(8): 727–734. doi:10.1056/ NEJMra020529
14. Kamath BD, Fashaw L, Kinsella JP. Adrenal insufficiency in newborns with congenital diaphragmatic hernia. J Pediatr 2010; 156(3): 495–497.e1. doi:10.1016/j.jpeds.2009.10.044
15. Soliman AT, Taman KH, Rizk MM, Nasr IS, AlRimawy H, Hamido MSM. Circulating adrenocorticotropic hormone (ACTH) and cortisol concentrations in normal, appropriate-forgestational - age newborns versus those with sepsis and respiratory distress: Cortisol response to lowdose and standard-dose ACTH tests. Metabolism 2004; 53(2): 209–214. doi:10.1016/j. metabol.2003.09.005
16. Watterberg KL. Adrenocortical function and dysfunction in the fetus and neonate. Semin Neonatol 2004; 9(1): 13–21. doi:10.1016/j.siny.2003.08.003
17. Khashana A, Saarela T, Ramet M, Hallman M. Cortisol intermediates and hydrocortisone responsiveness in critical neonatal disease. J Matern Fetal Neonatal Med 2017; 30(14): 1721–1725. doi:10.1080/14767058.2016.1223032
18. Fernandez EF, Montman R, Watterberg KL. ACTH and cortisol response to critical illness in term and late preterm newborns. J Perinatol 2008; 28(12): 797–802. doi:10.1038/jp.2008.190
19. Fernandez EF, Cole CH. The neonate with relative adrenal insufficiency and vasopressor resistance. In: Seri I, Kluckow M, Polin RA (eds). Hemodynamics and cardiology, neonatology questions and controversies. Elsevier 2018.
20. Huysman MWA, Hokken-Koelega ACS, De Ridder MAJ, Sauer PJ. Adrenal function in sick very preterm infants. Pediatr Res 2000; 48(5): 629–633.
21. Ng PC, Lee CH, Lam CWK, et al. Transient adrenocortical insufficiency of prematurity and systemic hypotension in very low birthweight infants. Arch Dis Child Fetal Neonatal Ed 2004; 89(2): 119–126.
22. Watterberg KL, Scott SM, Backstrom C, Gifford KL, Cook KL. Links between early adrenal function and respiratory outcome in preterm infants: airway inflammation and patent ductus arteriosus. Pediatrics 2000; 105(2): 320–324.
23. Weiss, M.E., Caldarelli, L., Hageman, J.R., Littlejohn, E. Relative Adrenal Insufficiency in Premature Infants: State of the Art. NeoReviews 2015; 16(8): 474–480.
24. Ng PC. Is there a “normal” range of serum cortisol concentration for preterm infants? Pediatrics 2008; 122(4): 873–875.
25. Yoder B, Martin H, McCurnin DC, Coalson JJ. Impaired urinary cortisol excretion and early cardiopulmonary dysfunction in immature baboons. Pediatr Res 2002; 51(4): 426–432. doi:10.1203/00006450-200204000-00006
26. Noori S, Friedlich P, Wong P, Ebrahimi M, Siassi B, Seri I. Hemodynamic changes after lowdosage hydrocortisone administration in vasopressor-treated preterm and term neonates. Pediatrics 2006; 118(4): 1456–1466. doi:10.1542/peds.2006-0661
27. Noori S, Siassi B, Durand M, Acherman R, Sardesai S, Ramanathan R. Cardiovascular effects of low-dose dexamethasone in very low birth weight neonates with refractory hypotension. Neonatology 2006; 89(2): 82–87. doi:10.1159/000088289
28. Yeh TF, Lin YJ, Huang CC, et al. Early dexamethasone therapy in preterm infants: A follow-up study. Pediatrics 1998; 101(5): e7. doi:10.1542/peds.101.5.e7
29. Crochemore C, Lu J, Wu Y, et al. Direct targeting of hippocampal neurons for apoptosis by glucocorticoids is reversible by mineralocorticoid receptor activation. Mol Psychiatry 2005; 10(8): 790–798. doi:10.1038/sj.mp.4001679
30. Vezina HE, Ng CM, Vazquez DM, Barks JD, Bhatt-Mehta V. Population pharmacokinetics of unbound hydrocortisone in critically ill neonates and infants with vasopressor-resistant hypotension. Pediatr Crit Care Med 2014; 15(6): 546–553.
31. Watterberg KL. Hydrocortisone dosing for hypotension in newborn infants: Less is more. J Pediatr 2016; 174 : 23–26. doi:10.1016/j.jpeds.2016.04.005
32. Watterberg KL, Gerdes JS, Cole CH, Aucott SW, Thilo EH, Mammel MC, et al. Prophylaxis of early adrenal insufficiency to prevent bronchopulmonary dysplasia: A multicenter trial. Pediatrics 2004; 114 : 1649–1657.
33. Peltoniemi O, Kari MA, Heinonen K, Saarela T, Nikolajev K, Andersson S, et al. Pretreatment cortisol values may predict responses to hydrocortisone administration for the prevention of bronchopulmonary dysplasia in high-risk infants. J Pediatr 2005; 146 : 632–637.
34. Bonsante F, Latorre G, Iacobelli S, Forziati V, Laforgia N, Esposito L, et al. Early low-dose hydrocortisone in very preterm infants: a randomized, placebo-controlled trial. Neonatology 2007; 91 : 217–221.
35. Baud O, Maury L, Lebail F, Ramful D, El Moussawi F, Nicaise C, et al. Effect of early low-dose hydrocortisone on survival without bronchopulmonary dysplasia in extremely preterminfants (PREMILOC): A doubleblind, placebo-controlled, multicentre, randomised trial. Lancet 2016; 387 : 1827–1836.
36. Masumoto K, Kusuda S. Hemodynamic support of the micropreemie: Should hydrocortisone never be left out? Semin Fetal Neonatal Med 2021; 26(3): 101222. doi:10.1016/j.siny.2021.101222
37. Nguyen J, Thompson I, Wertheimer F, Ebrahimi M, Huang E, Siassi B, Noori S. Acetaminophen treatment is associated with closure of patent ductus arteriosus but may increase risk of intestinal perforation. E-PAS 2016 : 3855.506.
38. Watterberg KL, Shaffer ML, Mishefske MJ, et al. Growth and neurodevelopmental outcomes after early low-dose hydrocortisone treatment in extremely low birth weight infants. Pediatrics 2007; 120(1): 40–48. doi:10.1542/peds.2006-3158
39. Baud O, Trousson C, Biran V, et al. Association between early low-dose hydrocortisone therapy in extremely preterm neonates and neurodevelopmental outcomes at 2 Years of age. JAMA 2017; 317(13): 1329. doi:10.1001/jama.2017.2692
40. Shaffer ML, Baud O, Lacaze-Masmonteil T, Peltoniemi OM, Bonsante F, Watterberg KL. Effect of Prophylaxis for Early Adrenal Insufficiency Using Low-Dose Hydrocortisone in Very Preterm Infants: An Individual Patient Data Meta-Analysis. J Pediatr 2019; 207 : 136–142.e5. doi:10.1016/j.jpeds.2018.10.004
41. Tolia VN, Bahr TM, Bennett MM, et al. The Association of Hydrocortisone Dosage on Mortality in Infants Born Extremely Premature. J Pediatr 2019; 207 : 143–147.e3. doi:10.1016/j. jpeds.2018.11.023
42. Rios DR, Moffett BS, Kaiser JR. Trends in pharmacotherapy for neonatal hypotension. J Pediatr 2014; 165 : 697–701.
Štítky
Neonatologie Neonatologická sestra
Článek Editorial
Článek vyšel v časopiseČesko-slovenská neonatologie
Nejčtenější tento týden
2022 Číslo 1- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Fexofenadin – nesedativní a imunomodulační antihistaminikum v léčbě alergických projevů
- Isoprinosine nově bez indikačních a preskripčních omezení
- Cytomegalovirové infekce u novorozenců a dětí
- Inosin pranobex v léčbě chřipky a dalších respiračních infekcí virové etiologie
-
Všechny články tohoto čísla
- Perzistující plicní hypertenze u novorozenců: patofyziologie, diagnostika a terapie
- Postavení funkční echokardiografie v diagnostice akutní oběhové deteriorace u novorozenců
- Farmakoterapie oběhového selhání novorozenců
- Relativní adrenální insuficience a vazopresor-rezistentní hypotenze u kriticky nemocných novorozenců
- Editorial
- Near-infrared spektroskopie v posuzování hemodynamických změn u novorozenců
- Současné možnosti měření perfuze u novorozenců
- Význam placentární transfuze ve vztahu ke kardiopulmonální stabilizaci novorozence a závažné neonatální morbiditě
- Hypertrofie myokardu u novorozence
- Okluze retinální arterie u extrémně nezralého novorozence s Escherichia coli meningitidou
- Česko-slovenská neonatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Perzistující plicní hypertenze u novorozenců: patofyziologie, diagnostika a terapie
- Hypertrofie myokardu u novorozence
- Význam placentární transfuze ve vztahu ke kardiopulmonální stabilizaci novorozence a závažné neonatální morbiditě
- Farmakoterapie oběhového selhání novorozenců
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



