-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hypertrofie myokardu u novorozence
Neonatal myocardial hypertrophy
Transient myocardial hypertrophy in the neonate is most frequently seen in infants of diabetic mothers, in monochorionic twins after transfusion syndrome, in premature infants given steroids, in neonates after intrauterine closure of arterial duct or severe fetal distress with congestive heart failure. In many cases we assume combined etiology e.g. hyperinsulinism and steroids or inotropes administration. Echocardiographic findings and management of most severe cases are very similar regardless different etiologies.
Keywords:
neonate – myocardial hypertrophy
Autoři: J. Kučera
Působiště autorů: Ústav pro péči o matku a dítě, Praha
Vyšlo v časopise: Čes-slov Neonat 2022; 28 (1): 55-61.
Kategorie: Přehledový článek
Souhrn
V novorozeneckém věku se s přechodnou hypertrofií myokardu nejčastěji setkáváme u dětí diabetických matek (infant of diabetic mother, IDM), po transfuzním syndromu dvojčat (twin to twin transfusion syndrome, TTTS), u nezralých novorozenců léčených steroidy, u novorozenců po intrauterinním uzávěru tepenné dučeje (ductus arteriosus, DA) a např. u novorozenců po těžkém fetálním distresu, kteří prodělali městnavé srdeční selhání. U řady případů je možné předpokládat i kombinaci příčin – například hyperinzulinismus s léčbou steroidy nebo inotropy. Přes různou etiologii bývají echokardiografické nálezy podobné a principy léčby nejvážnějších případů shodné.
Klíčová slova:
novorozenec – hypertrofie myokardu
ÚVOD
Hypertrofie myokardu (myocardial hypertrophy, MH) u novorozenců je heterogenní onemocnění charakterizované odlišnostmi ve struktuře a funkci myokardu při absenci strukturální vady srdce. V pozdějším věku má většina případů hypertrofie myokardu genetickou příčinu – asi v 80 %. Nejčastěji se jedná o mutace v genech kódujících kontraktilní proteiny sarkoméry, dále o vrozené poruchy metabolismu (např. střádavé choroby) a mitochondriální vady, RASopatie (např. syndrom Noonanové) nebo jiné vzácnější syndromy a neuromuskulární onemocnění jako je Friedrichova ataxie [5]. Geneticky podmíněným hypertrofiím by měl být rezervován název „hypertrofická kardiomyopatie“ (hypertrophic cardiomyopathy, HCM). HCM mívají velmi vzácně projevy již v novorozeneckém věku a (na rozdíl od MH s jinou etiologií) zpravidla neustupují a mají špatnou prognózu. Echokardiograficky jsou všechny typy MH prakticky nerozlišitelné [12]. K určení etiologie pak vede cesta přes anamnézu, hodnocení vývoje nálezu v čase a podrobné genetické vyšetření nebo i biopsii myokardu.
Diagnóza je echokardiografická, vodítkem však může být i kardiomegalie na RTG nebo známky hypertrofie na EKG. Často jde o překvapivé vedlejší nálezy. Pozorujeme zvýšenou tloušťku komorového septa a/nebo stěn komor (obr. 1 a 2). Arbitrážní hranicí bývá odchylka tloušťky komorového +2SD od normy. Měření lze provádět jak z M-mode, tak z B obrazu (obr. 3 a 4). Objem postižené komory je snížený. Zhoršená bývá zejména diastolická funkce. Při obstrukci výtokového traktu komory je narušena i její systolická funkce.
Obr. 1. Echokardiografie, B obraz, modifikovaná čtyřdutinová projekce v diastole a systole. Výrazná hypertrofie myokardu se zmenšeným objemem komor. Pacient byl akceptorem při transfuzním syndromu dvojčat. 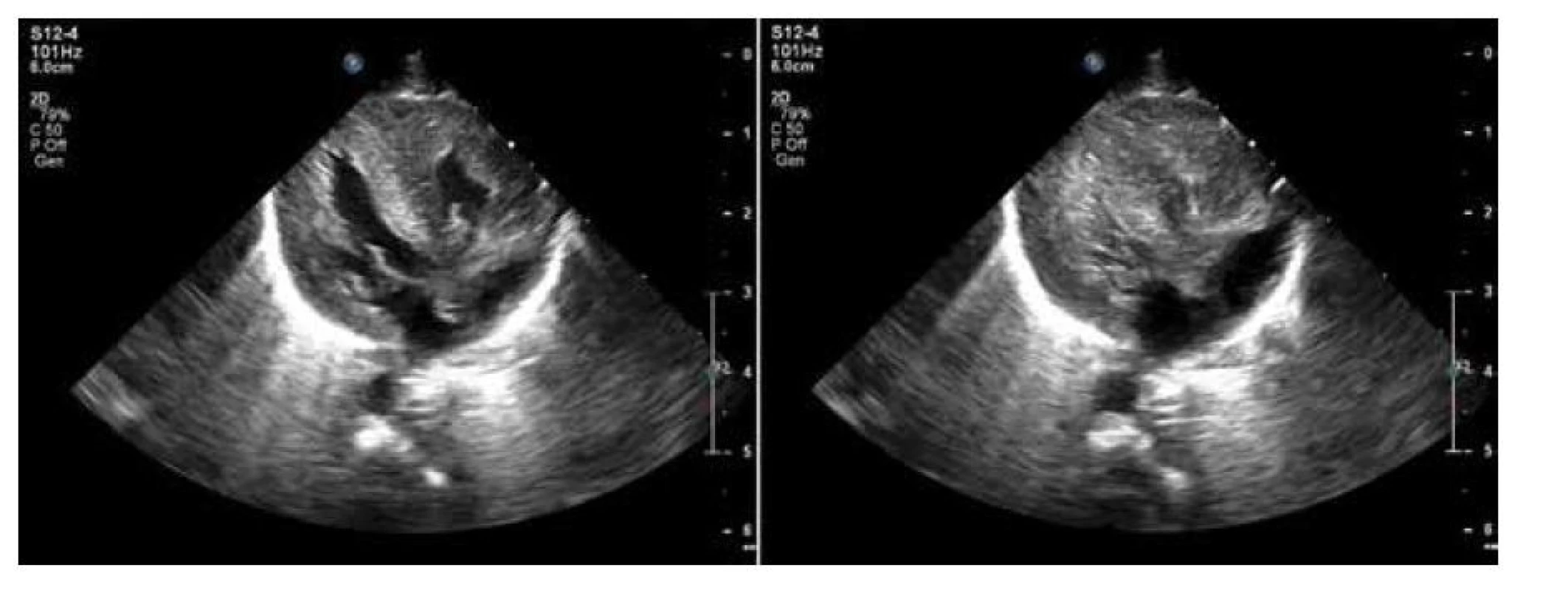
Obr. 2. Echokardiografie, B obraz, projekce v krátké ose v diastole a systole (tentýž pacient jako na obr. 1) 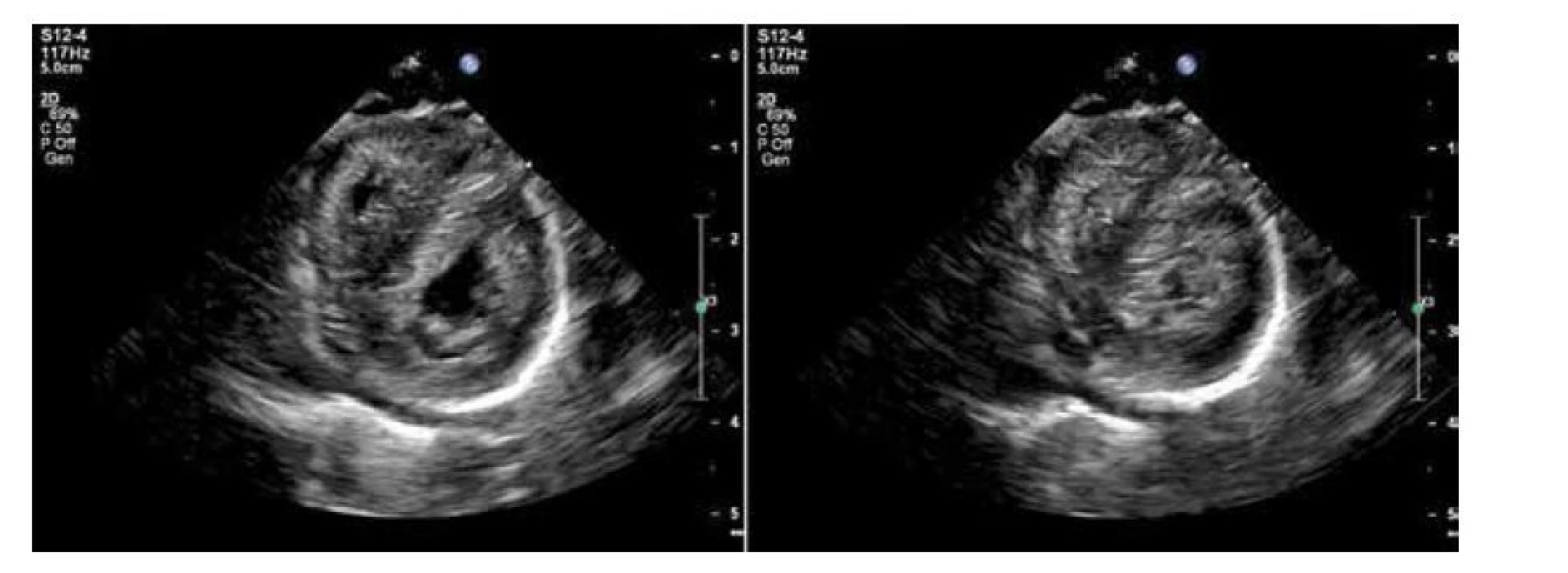
Obr. 3. Echokardiografie, M-mode levé komory, hypertrofie myokardu, měření šíře komorového septa v systole a diastole (pacient po čtyřdenním podávání hydrokortizonu) 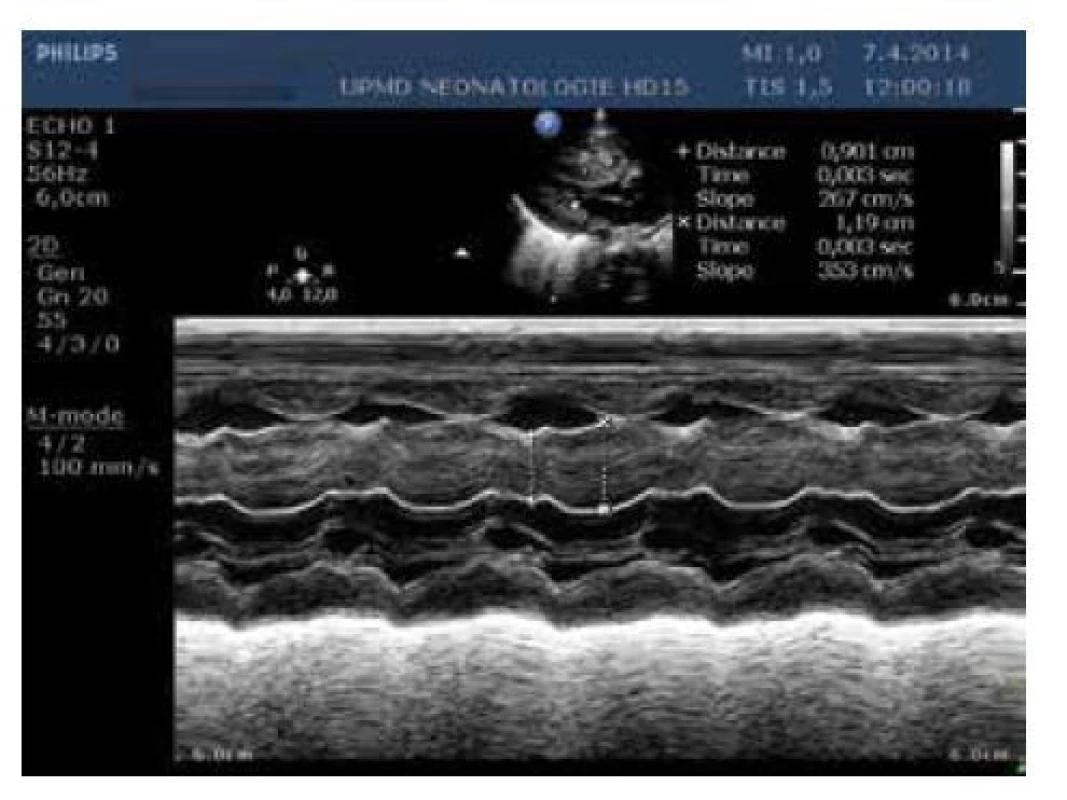
Obr. 4. Echokardiografie, B obraz, hypertrofie myokardu, měření šíře komorového septa v systole a diastole. Pacient akceptorem při transfuzním syndromu dvojčat, komplikovaném akutní fetofetální transfuzí po úmrtí dvojčete. Těžká anemie korigována transfuzí in utero 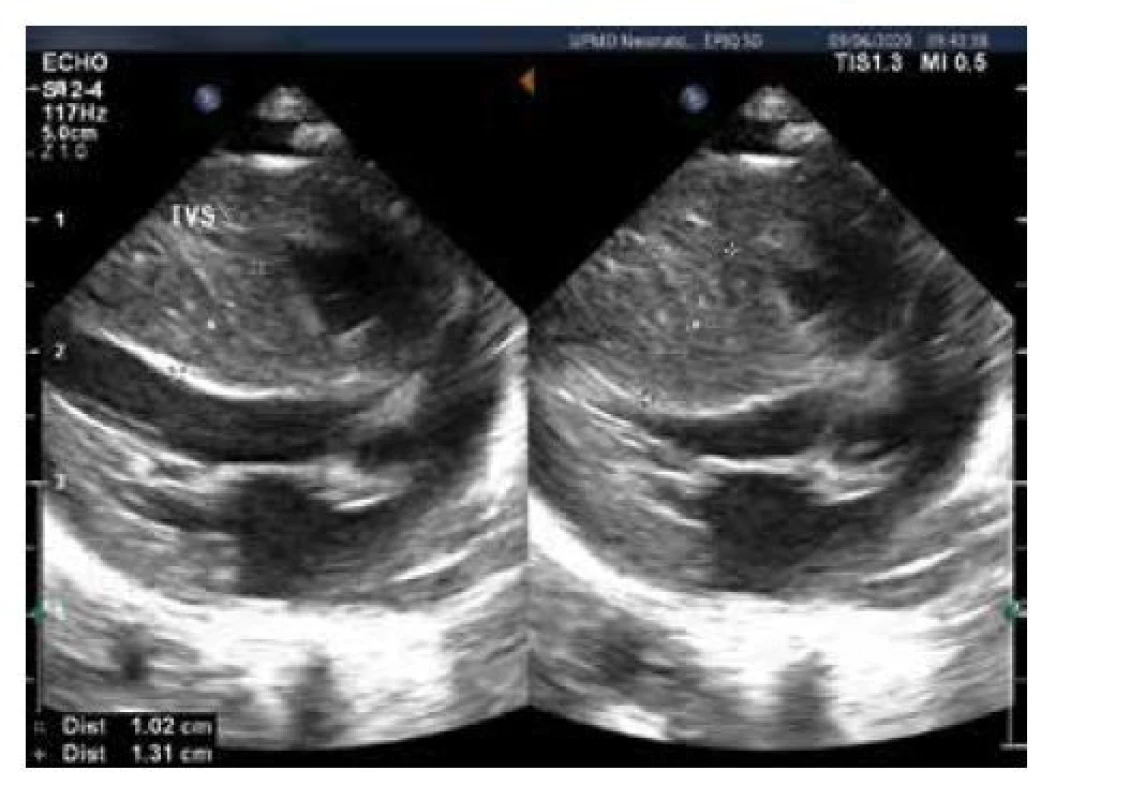
Klinicky je naštěstí většina případů i pokročilé MH bez příznaků. Onemocnění má po pominutí příčiny přirozeně příznivý průběh. Přesto mohou být jednotlivé případy vážné až fatální, zvláště při nepříznivých dalších okolnostech (komorbidita, tachykardie, nevhodná farmakologická léčba, dehydratace). Prvním klinickým projevem může být systolický šelest při obstrukci výtokového traktu levé nebo pravé komory.
HYPERTROFIE MYOKARDU NOVOROZENCE DIABETICKÉ MATKY
Pregestační diabetes má 0,5–2 % těhotných. Gestační diabetes vznikne u dalších 2–4 %. Hypertrofie myokardu se u dětí diabetických matek (IDM) v nějaké míře projeví u 30 % z nich. Symptomatických je mezi 3–30 %. Incidence je vyšší u matek s diabetem I. typu. MH u IDM vymizí zpravidla do 2 týdnů až 4 měsíců. Hypertrofie myokardu u IDM je anabolickým následkem mateřské hyperglykemie a fetálního hyperinzulinismu. Inzulin působí zvýšení syntézy a ukládání tuku a glykogenu v buňkách fetálního myokardu [5]. Vysoká hladina glukózy negativně ovlivňuje zrání myokardu a vyvolává intenzivní proliferaci kardiomyocytů [11]. Přes všeobecně příznivou prognózu se ale může vyskytnout případ s dramatickým průběhem.
Hypertrofie postihuje ve většině případů pouze komorové septum. Mírné případy mají zhoršenou diastolickou funkci levé komory při její normální systolické funkci. U těžších případů postihuje hypertrofie i stěny komor a může dojít v extrémním případě až k obstrukci výtokového traktu levé komory (left ventricular outflow tract obstruction, LVOTO). Obstrukce vzniká mezi předním cípem mitrální chlopně a komorovým septem, kde pozorujeme turbulentní zrychlený tok (obr. 5 a 6). Následkem je snížený srdeční výdej.
Obr. 5. Echokardiografie, barevný M-mode levé komory, střední hypertrofie komorového septa s akcelerací toku mezi předním cípem mitrální chlopně a komorovým septem (modrožlutý turbulentní signál) 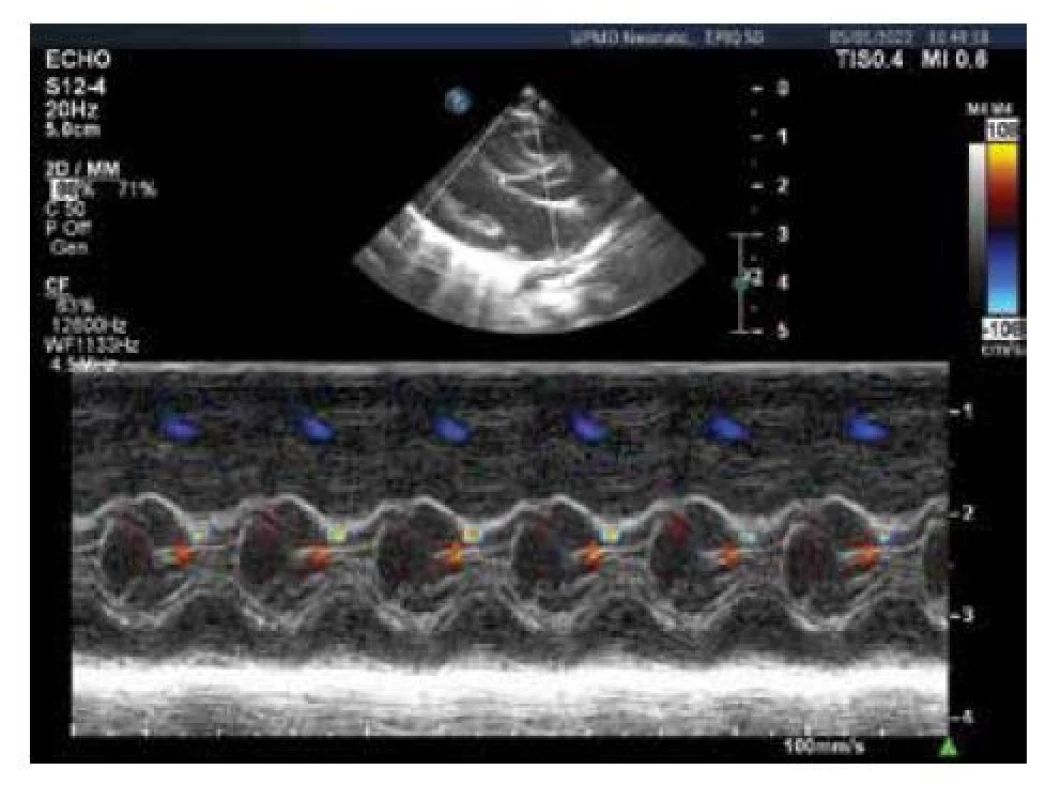
Obr. 6. Echokardiografie, CW Doppler, obstrukce výtokového traktu levé komory s akcelerací toku (tentýž pacient jako na obr. 4) 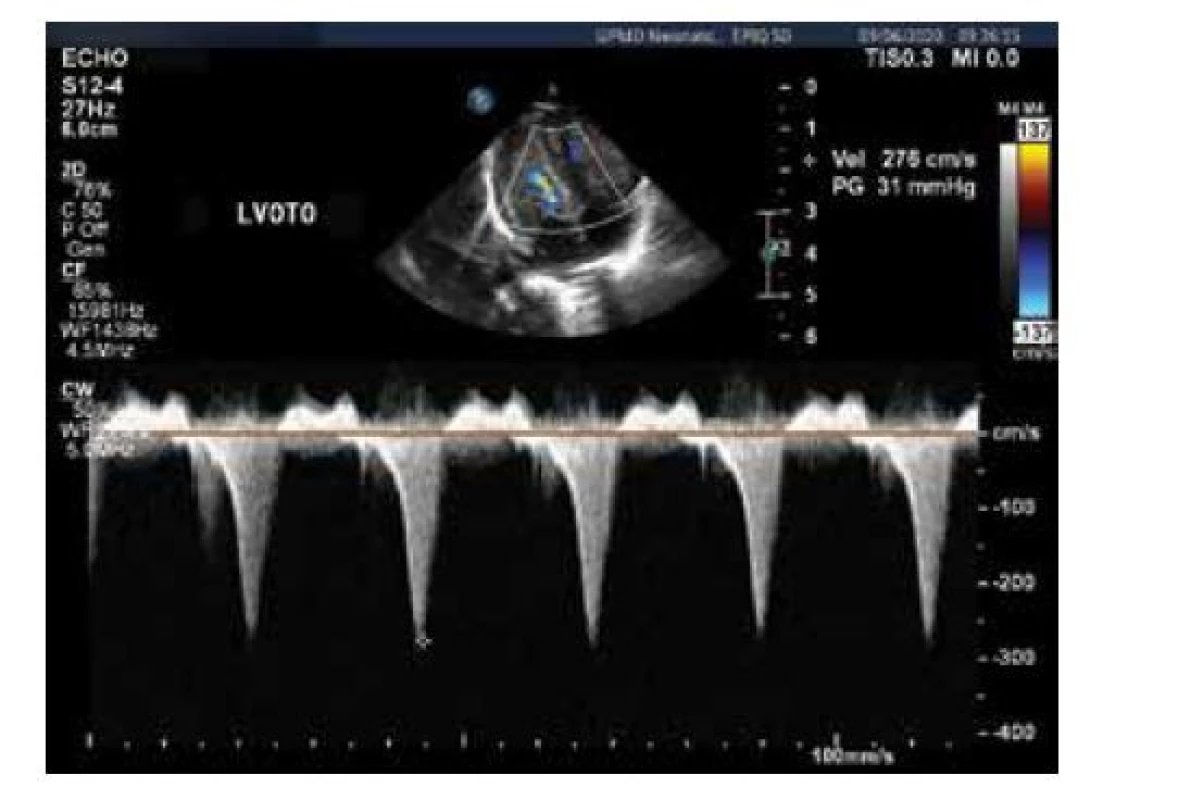
Při léčbě je důležité podávat dostatečné množství tekutin, kterým zajistíme optimální plnění komor (preload). Naopak jsou kontraindikována diuretika. Udržování přiměřeně vysokého afterloadu sníží nežádoucí gradient přes LVOTO. Prevence tachykardie je další důležitou součástí léčby [8].
Farmakologická léčba využívá většinou betablokátory. Je popsáno také použití intravenózního esmololu, jehož výhodou je krátký biologický poločas a tím dobrá titrovatelnost efektu. Po zlepšení echokardiografického nálezu je možný přechod na perorálně podávaný propranolol [5]. V případech těžkého stavu s hypotenzí se nově ukazuje jako vhodný lék vasopresin (ADH). Absorpce vody a současně systémová vazokonstrikce mají potenciál příznivě ovlivnit preload i afterload bez tachykardie. Vedlejším účinkem je však hyponatremie, kterou lze zvládnout upraveným přívodem natria. Podávání vasopresinu v publikovaných kazuistikách překvapivě nevedlo k oligurii, protože se současně zvýšila diuréza zlepšením krevního tlaku. Přechodnou hyponatremii přičítají autoři spíše zvýšené exkreci natria. Při léčbě vasopresinem pozorovali zřetelné snížení tlakového gradientu na LVOTO [3]. Publikovaná data jsou slibná, ale chybí robustní kontrolované randomizované studie. Inotropy, jinak obvyklá volba u oběhově nestabilních novorozenců, jsou kontraindikovány – zhoršují LVOTO a zkracují plnící čas (filling time), čímž mohou zhoršit srdeční výdej [3].
HYPERTROFIE MYOKARDU U MONOCHORIÁLNÍCH DVOJČAT PO TRANSFUZNÍM SYNDROMU
Zcela odlišnou etiologii hypertrofie myokardu mají příjemci při transfuzním syndromu (TTTS) monochoriálních biamniálních (monochorionic diamnotic, MCDA) dvojčat. Tito pacienti daleko častěji vyžadují intenzivní péči, protože jsou zatíženi více rizikovými faktory, jako je prematurita a intrauterinně prodělané stavy oběhové nestability, které mohou extrémně vést až k hydropsu plodu nebo k intrauterinnímu úmrtí.
TTTS se vyskytuje u 10–15 % MCDA dvojčat. Neléčení nese riziko zvýšené mortality a závažné morbidity. Vznik funkčních změn na srdci je následkem nestejně velkých cirkulujících objemů (hypovolemie a hypervolemie), které vedou k systolické a diastolické dysfunkci, a to zejména u příjemců. Tyto zprvu funkční změny mohou dokonce vést ke vzniku získané strukturální srdeční vady u příjemce, vzácně u dárce. Patofyziologickým podkladem TTTS je existence arteriovenózních, arterioarteriálních a venovenózních spojek ve společné placentě. TTTS se nejčastěji projeví mezi 15. až 25. týdnem těhotenství. Vznik může být plíživý i akutní. Primárně hemodynamicky abnormální situace je doprovázená endokrinními změnami. Léčba TTTS in utero laserovou koagulací (fetoscopic laser coagulation, FLC) cévních spojek může přirozeně progresivní povahu onemocnění zvrátit [9].
U příjemce je vysoký preload s absolutním nárůstem cirkulujícího objemu a srdečního výdeje. Hypervolemie vede přes dilataci myokardu k sekreci natriuretických peptidů, síňového natriuretického proteinu (ANP) a mozkového natriuretického proteinu (BNP). Následkem toho je zvýšená diuréza a vzniká polyhydramnion. Stoupá také cévní rezistence (afterload) a tím krevní tlak. Hypertenze u příjemce je přisuzována řadě vazoaktivních mediátorů, zejména endotelinu, ale také aktivaci systému renin-angiotenzin (RAS). Endotelin způsobuje hypertrofii myokardu nepřímo přes hypertenzi, ale také přímo, a to stimulací myocytů, které způsobují remodelaci myokardu. Zdrojem endotelinu je částečně placenta a částečně dárce. Endokrinní vlivy se podílejí na MH, která bývá výraznější, než by odpovídalo prostému objemovému přetížení. MH je doprovázená zvětšením srdce, snížením compliance myokardu a regurgitací atrioventrikulárních chlopní.
Dárce je vystaven hypovolemii a hypoperfuzi, která způsobuje oligurii a oligohydramnion. Na hypoperfuzi reaguje organismus dárce aktivací systému renin-angiotenzin. V důsledku toho stoupá vaskulární rezistence. Cirkulace dárce je hypovolemická, zároveň však hyperdynamická. Nastane-li vazokonstrikce i v placentě, může to vést k redistribuci oběhu plodu a k růstové restrikci.
Vývoj TTTS u plodů může být hodnocen skórovacími systémy. Původní hodnocení (pětistupňová klasifikace podle Quintera) zahrnovalo velikost močového měchýře plodu dárce, umbilikální Doppler a Doppler v ductus venosus, přítomnost hydropsu, ev. úmrtí plodu. Novější přístup zahrnuje také hodnocení srdce příjemce pomocí indexu výkonnosti myokardu (myocardial performance index, MPI), který využívá Dopplerem měřených systolických časových intervalů. Hodnota MPI je nepřímo úměrná míře myokardiální dysfunkce (komorové hypokinezi). Dalšími hodnocenými ukazateli je hypertrofie myokardu (pravé nebo obou srdečních komor), rozměr srdce, charakter průtoku na atrioventrikulárních (AV) chlopních a přítomnost obstrukce výtokového traktu pravé komory (RVOTO) a/nebo regurgitaci na chlopni plicnice [9].
Diastolická dysfunkce u příjemce předchází vzniku systolické dysfunkce. Změny se projeví dříve u pravé než u levé komory. Tato sekvence je specifická pro TTTS a pomůže odlišit jiné komplikace u monochoriálních biamniálních dvojčat, včetně selektivní růstové restrikce. Hypertrofický myokard má sníženou poddajnost (compliance) a může způsobovat až monofázický průtok AV chlopněmi. Rovněž u dárce se může projevit zhoršení diastolické funkce pravé komory jako následek zvýšené cévní rezistence placenty.
Vývoj tíže TTTS je velmi obtížně predikovatelný. U TTTS II. stupně dle Quintera má 65 % recipientů již změny na myokardu. Problémem je, že zařazení hodnocení srdce do rozhodování o intervenci (FLC) může vést k nadhodnocení stupně TTTS, a může tak vést častěji ke zbytečnému provedení této rizikové procedury. Výsledky takových předčasných intervencí jsou pak optimističtější než těch indikovaných pouze podle Quinterovy klasifikace. Měření stupně postižení srdce je časově náročné a např. při polyhydramniu i zatěžující pro pacientku. Optimální kombinace Quinterovy klasifikace a údajů o srdci recipienta se mezi centry liší a dále se hledá.
Nejefektivnější léčbou oběhové situace u TTTS je FLC, která ve velké míře oddělí cirkulace obou plodů. Vedle úpravy hemodynamické situace zamezí také nežádoucímu přestupu hormonů mezi plody. Během výkonu se zhorší oběhová situace příjemce, avšak po několika dnech nastává zlepšení funkce myokardu. Podobně u dárce vede FLC zprvu k relativnímu objemovému přetížení (extrémně až k přechodnému hydropsu). Tyto změny lze omezit pořadím okludovaných spojek, kdy je snaha dříve přerušit cévy od dárce k příjemci než cévy s opačným směrem toku. Větší vliv na rychlost zotavení může mít doba trvání TTTS než jeho stupeň při výkonu [9].
Zajímavá je asociace TTTS a vyšší incidence strukturálních srdečních vad, jejichž vznik je pravděpodobně indukován abnormální hemodynamikou a/nebo hormonálními vlivy. Až u 20 % příjemců jde o anomálie výtokového traktu pravé komory (right ventricular outflow tract, RVOT), dysplazie, stenózy, insuficience či funkční atrezie chlopně plicnice. U dárců se zdá být mírně vyšší incidence koarktace aorty [9].
Mechanismus vzniku strukturálních vad není zcela jasný. Předpokládá se, že u příjemců postupně vzniká hypertrofie myokardu pravé komory (right ventricle, RV), následovaná její systolickou dysfunkcí a hypertenzí, trikuspidální insuficiencí a až neschopností RV vyvinout dostatečný tlak k otevření pulmonální chlopně. Následuje vznik subvalvulární obstrukce RVOT (RVOTO) a valvulární stenózy plicnice. U dárců se předpokládá, že při vysoké placentární rezistenci, hypovolemii a sníženém srdečním návratu je omezen průtok krve v aortě. Následkem je porucha růstu aorty, vedoucí až ke vzniku koarktace. Někdy bývá rovněž zmiňován vyšší výskyt defektů síňového septa, který je pravděpodobně indukován vyšším průtokem přes foramen ovale v průběhu TTTS. Společným rysem je tedy narušený růst struktur v důsledku abnormálního průtoku [15].
Postnatálně je u všech dvojčat s TTTS doporučeno provést echokardiografické vyšetření. U recipientů je třeba se zaměřit na hypertrofii myokardu, RVOTO, perzistující plicní hypertenzi a průtok plicnicí; u dárců na koarktaci aorty a funkci levé komory [5]. U příjemců pozorujeme hypertrofii myokardu a výraznou trikuspidální regurgitaci. Ejekční frakce levé komory bývá v normě, přestože podrobnější vyšetření může vykazovat mírné známky zhoršené kontraktility. Zlepšením kontraktility může hypertrofie zprvu ještě progredovat, obvykle však vymizí do 2 týdnů až 2 měsíců a je považována za reverzibilní stav. Histopatologicky bývá obraz myokardiální hypertrofie s endokardiální fibroelastózou. Stenóza či atrezie plicnice jsou mnohem vzácnější než hypertrofie. Mohou dokonce vzniknout až postnatálně. Incidence bývá 5 % u příjemců. V nejtěžších případech je popsána i nutnost balónkové valvuloplastiky. Při výrazné hypertrofii myokardu se vzácněji může objevit kromě obstrukce výtokového traktu pravé komory i jeho obstrukce v levé komoře. LVOTO může být také zhoršena uzávěrem tepenné dučeje, který sníží preload levé komory [15].
U novorozenců narozených s větším časovým odstupem od provedení FLC nemusí být snadná identifikace dárce a příjemce. U dárce i příjemce je indikován monitoring krevního tlaku. Růstová restrikce s dysfunkcí myokardu, chronická hypoperfuze ledvin, změny cévní rezistence a samotná prematurita jsou rizikovými faktory pro vznik hypertenze. Zvýšené riziko trvá i pro pozdější věk [9].
Údaje o specifické léčbě MH u novorozenců po TTTS u MCDA dvojčat jsou v literatuře velmi sporadické a nejsou opřené o kontrolované randomizované studie. Pacienti se většinou rodí nezralí a často mívají komplikovaný respirační průběh s plicní hypertenzí. I velmi výrazné hypertrofie myokardu jsou většinou dobře snášeny nebo jsou zcela asymptomatické. U těžších případů s oběhovou nestabilitou je důležitá iniciálně volumoterapie. Dále je vhodné nepodávat léky, které mohou hypertrofii zhoršit (steroidy, inzulin, inotropy).
HYPERTROFIE MYOKARDU PO INTRAUTERINNÍM UZÁVĚRU TEPENNÉ DUČEJE
U plodu odklání tepenná dučej (ductus arteriosus, DA) 90 % průtoku z plicního do systémového řečiště. Průchodnost DA je podmínkou normální fetální cirkulace. Uzávěru DA brání mj. prostaglandin E2 (PGE2) a nízká oxemie. Uzavře-li se DA intrauterinně, vede to u plodu ke zvýšenému plicnímu průtoku, dilataci pravé komory, plicní hypertenzi s městnavým srdečním selháním, trikuspidální regurgitaci a následně k hypertrofii pravé komory až k úmrtí plodu. U novorozence lze očekávat potřebu mechanické ventilace, inhalace oxidu dusnatého a ev. až léčbu ECMO. V literatuře jsou popsány jak případy s mírným, tak s fatálním neonatálním průběhem. Trvá-li uzávěr DA dlouho, lze předpokládat remodelaci plicního řečiště a obtížný průběh. Naopak dojde-li k porodu brzy po uzávěru DA, průběh bývá mírnější. Spolehlivá data o prospěšnosti pokusů znovu otevřít DA pomocí PGE2 nebo milrinonu chybí [2].
Většina případů intrauternního uzávěru DA nemá jasnou vyvolávající příčinu. Riziko uzávěru DA zvyšuje podávání inhibitorů cyklooxygenázy (indometacin, salicyláty) a glukokortikoidů matce. Na zvířatech byl prokázán tento efekt u metylxantinů (kofein) a nesteroidních antiflogistik (NSAID).
Při časném echokardiografickém vyšetření nenacházíme průchodný DA a pozorujeme malý objem pravé komory s hypertrofií jak její přední stěny, tak komorového septa a dále trikuspidální insuficienci s vysokým gradientem. Levá komora má normální stěnu [1].
HYPERTROFIE MYOKARDU PO EXPOZICI STEROIDŮM
Všichni nedonošení mají mírně širší komorové septum a změny ve struktuře a funkci RV. Mají prokazatelně omezenou schopnost kardiovaskulární adaptace na zátěž. Již steroidy podávané matce ovlivní komplexní proces dozrávání myokardu, včetně změny způsobu růstu kardiomyocytů od proliferativního k hypertrofickému. Přes trend ke sníženému postnatálnímu používání steroidů a jejich dávek při léčbě chronického plicního onemocnění se nadále setkáváme s nezralými novorozenci, u kterých se po jejich podání rozvine hypertrofie myokardu. Byl prokázán vztah mezi různě dlouhým podáváním dexametazonu a vznikem přechodné hypertrofie myokardu [14]. Cochranova databáze potvrzuje, že léčba steroidy je spojena se zvýšeným rizikem vzniku MH a hypertenze [6]. Vztah k dávce a délce podávání je překvapivě nevýrazný.
Patofyziologický mechanismus vzniku hypertrofie není dosud přesně vysvětlen. Jednou z teorií je, že steroidy bývají podávány u dětí s oběhovou nestabilitou, která je spojena s nižší hladinou kyslíku, podobnou fetálnímu prostředí. To samo může vést ke zvýšené proliferaci kardiomyoctů. Dexametazon může ovlivnit hospodaření s kalciem a aktivuje kalcineurin. U krys vede antenatální podávání dexametazonu ke zvýšené proliferaci kardiomyocytů [11].
Hypertrofie bývá nejvýraznější 1–3 týdny od podání steroidů (kromě dexametazonu i hydrokortizonu) a následně ustupuje, někdy velmi pomalu. Postihuje komorové septum a zadní stěnu levé komory. U některých pacientů se může nález vyvinout až do obrazu LVOTO. Dlouhodobé následky nejsou jasné [14]. Zjištění signifikantní hypertrofie myokardu s LVOTO je indikací k přerušení podávání steroidů.
HYPERTROFIE MYOKARDU PO PRODĚLÁNÍ AKUTNÍHO FETÁLNÍHO DISTRESU
Podle některých autorů může být vyvolavatelem přechodné MH i prodělaný akutní fetální distres doprovázený ischemií myokardu [13]. Projeví se buď smrtí plodu, nebo těžkou oběhovou nestabilitou ihned po porodu s hydropsem, nebo bez něj. Intenzivní postnatální léčba, včetně steroidů a inotropů, se může výrazně podílet na vzniku pozdější přechodné hypertrofie myokardu [7]. Na obr. 7 je echokardiografický nález u pacienta s těžkou fetální anemií a hydropsem, pořízený 1., 7. a 39. den života. Iniciálně měl známky městnavého srdečního selhání, postupně se rozvinula MH, která vymizela do propuštění. Pacient byl v 1. týdnu života léčen transfuzemi, volumoterapií, katecholaminy a krátce i steroidy. Hypertrofie myokardu byla však popsána i po těžké fetální anemii při Rh izoimunizaci, kde jedinou léčbou byla výměnná transfuze [4]. Na mechanismu vzniku MH v těchto situacích se pravděpodobně podílí jak ischemie a dilatace myokardu, tak současně endokrinní vlivy. U plodů s těžkou imunní anemií a hypertrofií myokardu byly prokázány zvýšené hladiny endogenních katecholaminů [10, 13].
Obr. 7. Echokardiografie u pacienta s hydropsem a těžkou fetální anemií: a – čtyřdutinová projekce 1. den života, městnavé srdeční selhání; b – čtyřdutinová projekce 7. den života, hypertrofie myokardu; c – dlouhá osa 39. den života, normální nález 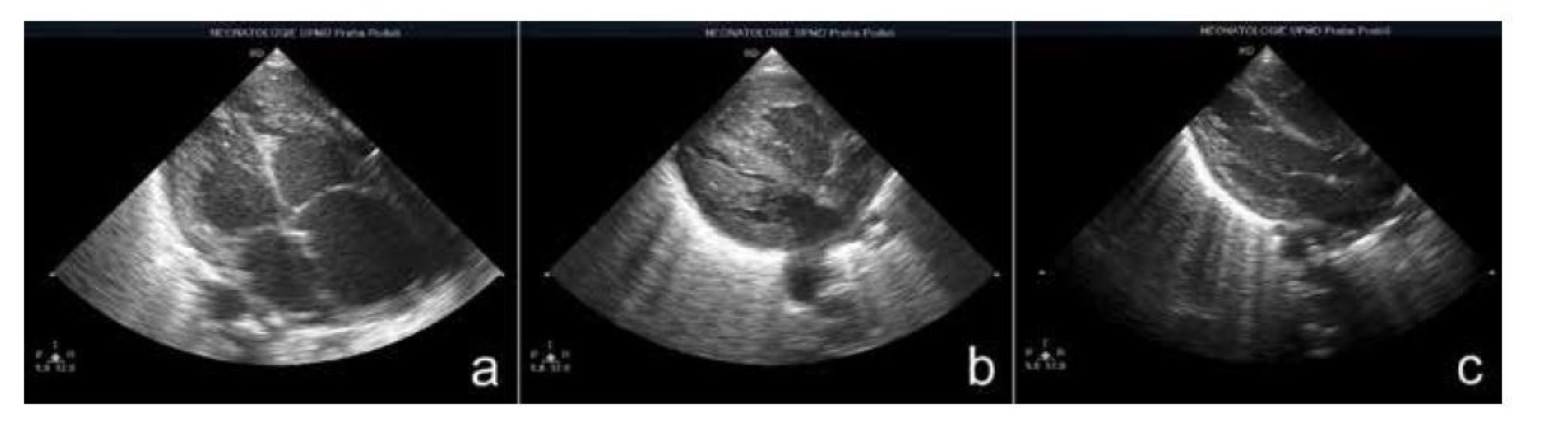
Různá doba trvání a rychlost nástupu příčiny a také vliv postnatální léčby ovlivňuje echokardiografický obraz. MH může být pozorovatelná již první dny po porodu nebo se rozvine až v 1. týdnu života. Zprvu bývá postiženo jen komorové septum, později se může objevit hypertrofie zadní stěny levé komory a někdy až LVOTO. Stav bývá doprovázen biochemickými a elektrofyziologickými známkami ischemie myokardu [13].
Řada kazuistik o hypertrofii myokardu po fetálním distresu podceňuje vliv podaných léků před vlastním zachycením hypertrofie a pravděpodobně se jedná o souběh příčin (ischemie myokardu, léky). Etiologicky se jedná o situaci, která má mnoho společných rysů s hypertrofií myokardu u monochoriálních dvojčat po TTTS (fetální srdeční selhání a endokrinní odezva).
ZÁVĚR
Hypertrofie myokardu se u novorozenců objevuje v různých scénářích a kromě těch s genetickým původem mívá příznivý přirozený průběh. Nejzávažnější a nejčastější bývají případy spojené s transfuzním syndromem monochoriálních dvojčat, jejichž průběh zatěžují i další rizikové faktory – zejména prematurita. Časně provedené základní echokardiografické vyšetření u oběhově nestabilních pacientů pomůže v určení etiologie, vyloučí strukturální vadu, odstraní pochybnosti o době vzniku hypertrofie a při zavřené tepenné dučeji ukáže s vysokou pravděpodobností na možnou příčinu. Informace o výrazné hypertrofii, případně o obstrukci výtokových traktů komor, ovlivní taktiku přívodu tekutin a volbu léků při oběhovém selhání. Pokud během hospitalizace hypertrofie zřetelně neustoupí, měl by být konzultován kardiolog a genetik.
Konflikt zájmu: žádný.
Došlo do redakce: 28. 2. 2022
Adresa pro korespondenci:
MUDr. Jáchym Kučera
Ústav pro péči o matku a dítě
Podolské nábřeží 157
147 00 Praha 4
e-mail: jachym.kucera@atlas.cz
Zdroje
1. Alp H, Karatas Z, Baysal T. Transient severe isolated right ventricular hypertrophy in neonates. J Clin Neonatol 2014; 3 (3): 161–163. doi: 10.4103/2249-4847.140405
2. Aslam M, Christou HA. Intrauterine closure of the ductus drteriosus: Implications for the neonatologist, Am J Perinatol 2009; 26 : 473–478. doi: 10.1055/s-0029-1214247
3. Boyd SM, Rileay KL, Giesinger RE, McNamara P. Use of vasopressin in neonatal hypertrophic obstructive cardiomyopathy: Case series. J Perinatol 2020. doi: 10.1038/s41372-020-00824-7
4. Carter BS, DiGiacomo JE, Balderston SM, Wiggins JV, Merenstein GB. Disproportionate septal hypertrophy associated with erythroblastosis fetalis. Arch Pediatr & Adol Med 1990; 144(11): 1225–1228. doi: 10.1001/archpedi.1990.021503
5. Codazzi AC, Ippolito R, Novara C, Tondina E, Cerbo RM, Tzialla C. Hypertrophic cardiomyopathy in infant newborns of diabetic mother: A heterogeneous condition, the importace of anamnesis, physical examination and follow-up. Ital J Pediatr 2021; 47 : 197. doi: 10.1186/s13052-021-01145-x
6. Doyle LW, Cheong JL, Ehrenkranz RA, Halliday HL and Cochrane neonatal group. Late (> 7 days) systemic postnatal corticosteroids for prevention of bronchopulmonary dysplasia in preterm infants. Cochrane Database Syst Rev 2017; 10: CD001145. doi: 10.1002/14651858.CD001145.pub4
7. Kucera J, Kucerova I, Cunat V. Non-immune hydrops fetalis – case report. Ultrasound Obstet Gynaecol 2006; 28(4): 555. doi: 10.1002uog.3562
8. Levy PT, Tissot C, Horsberg Eriksen B, Nestaas E, Rogerson S, McNamara P, El-Khuffash, de Boode WP. Application of neonatologist performed echocardiography in the assessment and management of neonatal heart failure unrelated to congenital heart disease. Pediatric Research 2018; 84 : 78–88. doi: 10.1038/ s41390-018-0075-z
9. Manning N, Archer N. Cardiac manifestations of twin–to–twin transfusion syndrome. Twin Res Human Gen 2016; 19(3): 246–254. doi:10.1017/thg.2016.20
10. Oberhoffer R, Grab D, Keckstein J, Högel J, Terinde R, Lang D. Cardiac changes in fetuses secondary to immune hemolytic anemia and their relation to hemoglobin and catecholamine concentrations in fetal blood. Ultrasound Obstet Gynecol 1999; 13 : 396–400. doi: 10.1046/j.1469-0705.1999.13060396.x
11. Seok H, Oh JH. Hypertrophic cardiomyopathy in infants from the perspective of cardiomyocyte maturation. Korean Circ J 2021; 51(9): 733–751. doi: 10.4070/kcj.2021.0153
12. Stegeman R, Pauuw ND, de Graaf R, van Loon RLE, Termote JUM, Breur MPJ. The etiology of cardiac hypertrophy in infants. Scientific Reports 2021; 11(1). doi: 10.1038/s41598-021-90128-3
13. Vaillant MC, Chantepie A, Casasoprana A, Chamboux C, Suc AL, Gold F, Laugier J. Transient hypertrophic cardiomyopathy in neonates after acute fetal distress. Pediatr Cardiol 1997; 18(1), 52–56. doi: 10.1007/s002469900110
14. Vrselja A, Pillow JJ, Black MJ. Effect of preterm birth on cardiac and cardiomyocyte growth and the consequences of antenatal 3896. doi: 10.3390/jcm10173896
15. Yoda H. Fetal and neonatal circulatory disorders in twin to twin transfusion syndrome. J Nippon Med Sch 2019; 86 : 192–200. doi: 10.1272/jnms.JNMS.2019_86-301
Štítky
Neonatologie Neonatologická sestra
Článek vyšel v časopiseČesko-slovenská neonatologie
Nejčtenější tento týden
2022 Číslo 1- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Isoprinosine nově bez indikačních a preskripčních omezení
- Fexofenadin – nesedativní a imunomodulační antihistaminikum v léčbě alergických projevů
- Cytomegalovirové infekce u novorozenců a dětí
- Pacienti s infekcemi HPV a EBV a možnosti léčebné intervence pomocí inosin pranobexu
-
Všechny články tohoto čísla
- Perzistující plicní hypertenze u novorozenců: patofyziologie, diagnostika a terapie
- Postavení funkční echokardiografie v diagnostice akutní oběhové deteriorace u novorozenců
- Farmakoterapie oběhového selhání novorozenců
- Relativní adrenální insuficience a vazopresor-rezistentní hypotenze u kriticky nemocných novorozenců
- Editorial
- Near-infrared spektroskopie v posuzování hemodynamických změn u novorozenců
- Současné možnosti měření perfuze u novorozenců
- Význam placentární transfuze ve vztahu ke kardiopulmonální stabilizaci novorozence a závažné neonatální morbiditě
- Hypertrofie myokardu u novorozence
- Okluze retinální arterie u extrémně nezralého novorozence s Escherichia coli meningitidou
- Česko-slovenská neonatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Perzistující plicní hypertenze u novorozenců: patofyziologie, diagnostika a terapie
- Hypertrofie myokardu u novorozence
- Význam placentární transfuze ve vztahu ke kardiopulmonální stabilizaci novorozence a závažné neonatální morbiditě
- Farmakoterapie oběhového selhání novorozenců
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



