-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Molekulární vlastnosti klinicky signifikantního karcinomu prostaty
Molecular characteristics of clinically significant prostate carcinoma
In last years, diagnostics and treatment of localized prostate cancer were improved. Introduction of a new methods caused rising detection of patients, for whom, due to the age or comorbidities, radical therapy is with relative benefit. Decision, whether single cancer is for concrete patient clinically significant or not, is often complicated. Common prognostic factors are not able to solve this problem. Familiar and hereditary prostate cancer definition leads modern scientific research to detection of genetic dispositions of a single patient to develop a disease. There were detected a number of candidate genes and genomic areas, where alterations or polymorphisms are frequently present in patients with prostate cancer or in prostate cancer families. Detail analysis of genetic alterations and polymorphisms and relationships between single genes will be an object of intensive research in next years.
Key words:
prostate cancer, genes, gene expression, polymorphisms, mutations, DNA, mRNA.
Autoři: Marek Schmidt 1; Ladislav Jarolím 1; Jan Soukup 2; Jaroslav Mareš 3
Působiště autorů: Urologická klinika 2. LF UK a FN Motol, Praha 1; Ústav klinické patologie 2. LF UK a FNMotol, Praha 2; Ústav biologie a lékařské genetiky 2. LF UKa FN Motol, Praha 3
Vyšlo v časopise: Ces Urol 2010; 14(3): 129-138
Kategorie: Přehledový článek
Souhrn
V posledních letech došlo k razantnímu zlepšení diagnostiky a léčby lokálně ohraničených forem karcinomů prostaty. Rozvoj nových diagnostických a léčebných metod přináší zvýšený záchyt karcinomu prostaty u pacientů, jejichž věk nebo komorbidity relativizují přínos zavedených léčebných metod. Rozhodování, zda je konkrétní karcinom klinicky signifikantní, bývá často složité. Standardní prognostické faktory dosud tento problém nevyřešily. Familiární a hereditární výskyt karcinomu prostaty oprávněně vede současný výzkum na poli genetiky a namířil své úsilí k odhalování genetických dispozic jedince k vzniku tohoto onemocnění. Byla identifikována řad kandidátních genů i suspektních oblastí genomu, jejichž změny nebo polymorfismy bývají ve zvýšené míře přítomny u pacientů s karcinomem prostaty, případně v rodinách s jeho častějším výskytem. Detailní studium genetických změn a polymorfismů a vztahy mezi jednotlivými geny budou nepochybně v následujících letech předmětem intenzivního studia.
Klíčová slova:
karcinom prostaty, geny, genová exprese, mutace, polymorfismy, DNA, mRNA.Úvod
Karcinom prostaty představuje závažný celosvětový medicínský problém. V Evropě je každoročně diagnostikováno asi 2,6 milionů nových případů. Tvoří asi 11 % všech nádorových onemocnění u mužů a v Evropské unii činí úmrtí na karcinom 9 % všech úmrtí na nádorová onemocnění a je druhou nejčastější onkologickou příčinou úmrtí po karcinomu plic. Přibližně 10 % všech mužů onemocní karcinomem prostaty a 3 % na něj zemřou. Při neustále se prodlužující průměrné délce života a zlepšující se dostupností zdravotní péče současně stoupá počet asymptomatických nemocných se zachyceným karcinomem prostaty, který by se za života pacienta nijak neprojevil. S tím koresponduje i skutečnost, že prevalence onemocnění ve vyspělých státech je trojnásobně vyšší než v rozvojových zemích.
Významné rozdíly v incidenci a mortalitě jsou zaznamenány také v závislosti na rase. Nejvyšší incidence i mortalita se vyskytuje u příslušníků negroidní rasy, kteří mají i dvojnásobné riziko úmrtí ve srovnání s kavkazskou rasou. Nejnižší výskyt je naopak zaznamenán u Asiatů. Kromě zvažovaných genetických faktorů, predispozic a exogenních vlivů (např. strava, infekce nebo karcinogeny) se jako vysvětlení nabízejí sociálně-ekonomické a kulturní příčiny. Výskyt karcinomu prostaty u příslušníků armády různých ras ve stejných životních a sociálních podmínkách (stravování, lékařská péče) se prakticky neliší. Přesto jsou mezirasové rozdíly v incidenci natolik výrazné, že je nelze vysvětlit pouhými odlišnostmi chování a zvyklostí. Podle údajů ÚZIS činila incidence karcinomu prostaty v roce 2005 v České republice 97,1 nových případů na 100 000 obyvatel a mortalita 27,7/100 000. Data z dalších let nejsou k dispozici.
Dnes je většina nádorů prostaty, které nejsou zjistitelné palpačním rektálním vyšetřením detekována biopsií, indikovanou na základě zvýšeného PSA. Většina těchto karcinomů se vyvíjí směrem ke klinické závažnosti. Klinicky nesignifikantních karcinomů je pouze 3,8–16 %. Vyšetření PSA zřejmě není schopné detekovat malé nádory, jejichž sekrece celkovou hladinu markeru nezvyšuje.
Při absenci organizovaného screeningového programu je v době diagnostikování karcinomu klinicky lokalizovaných pouze 55 % tumorů. Asi 30–45 % pacientů s klinicky lokalizovaným onemocněním má při určování patologického stadia extrakapsulární rozšíření karcinomu. Zda se jedná o karcinom prostaty lokalizovaný, nebo lokálně pokročilý má pro pacienta z hlediska kurability zásadní význam. V prognóze dalšího průběhu onemocnění a z něj vyplývajících léčebných postupů mají význam pouze patologickoanatomické stadium, Gleasonovo skóre nádoru a hladina prostatického specifického antigenu (PSA) v séru, která je v současné době jediným prakticky používaným markerem v diagnostice, volbě optimální terapie a sledování průběhu onemocnění a efektu léčby. Sledované genetické faktory zatím nenabyly praktického významu.
Karcinom prostaty a dědičnost
Na polygenním původu onemocnění se kromě exogenních faktorů podílí významnou měrou i genetické dispozice jedince. Odhad relativního rizika vzniku karcinomu prostaty u příbuzných v první linii je 0,64. Příbuzní pacientů mladších než 55 let mají vyšší riziko karcinomu prostaty než ti, u jejichž příbuzných došlo ke vzniku karcinomu prostaty ve vyšším věku. V rodinách s časnějším nástupem onemocnění existuje vyšší počet případů onemocnění. Karcinom prostaty lze rozdělit na tři fenotypy: sporadický, familiární a hereditární. Sporadické karcinomy vznikají u jedinců s negativní rodinnou anamnézou. Familiární karcinom prostaty je definován jako karcinom u muže s více než jedním příbuzným s karcinomem prostaty. Počet postižených členů rodiny a jejich věk v době vzniku karcinomu jsou mezi příbuznými nejdůležitějšími určujícími znaky rizik. Riziko u příbuzných 1. stupně je 2–3× vyšší a stoupá s počtem postižených členů rodiny. Při onemocnění 1, 2 nebo 3 členů rodiny se riziko odhaduje na 2 %, resp. 5 %, resp. 11 %. Relativně rizikovější je postižení bratra než otce (3,0–4,5 vs. 1,9–2,3 %) (1). Hereditární karcinom prostaty je podmnožinou familiární formy a je definován u rodiny s ≥ 3 členy postiženými karcinomem prostaty u tří po sobě jdoucích generací nebo u dvou postižených jedinců, u nichž je karcinom diagnostikován před dovršením 55. roku věku. Zatímco původ karcinomu prostaty je většinou polygenní, existenci skutečně hereditární formy dokazují pozorování, že příbuzní pacientů mladších než 55 let mají vyšší riziko vzniku karcinomu prostaty než ti, u jejichž příbuzných došlo ke vzniku karcinomu prostaty ve vyšším věku. Rozsáhlá skandinávská studie zahrnující 44 788 dvojčat identifikovala, že mezi dvojčaty s karcinomem prostaty je 42 % nádorů hereditárních (2). Sporadické karcinomy tvoří asi 85 % všech karcinomů prostaty a asi 15 % je familiárních a/nebo hereditárních. Hereditární karcinom prostaty tvoří asi 43 % onemocnění vznikajícího v nižším věku (55 let nebo méně) ale pouze 9 % všech karcinomů vznikajících do 85. roku.
Kandidátní geny
Z několika komplexních segregačních analýz byly získány důkazy o hlavních genech vedoucích k náchylnosti ke vzniku a rozvoji karcinomu prostaty. Přitom byla nalezena řada kandidátních genů, jejichž genetické alterace odrážejí predispozice k onemocnění karcinomem prostaty. Většina z nich vykazuje dominantní druh dědičnosti (3). U starších pacientů jsou za vznik hereditárního karcinomu s vysokou pravděpodobností zodpovědné geny na chromozomu X (4).
Kromě popsaných kandidátních genů byly prokázány další oblasti s predispozičními faktory k onemocnění karcinomem prostaty na chromozomech 1q42.2-43, 1p36. Geny vázané na tyto lokality dosud nebyly izolovány, ani blíže popsány.
Další genomové studie větších skupin rodin s hereditárním karcinomem prostaty identifikovaly další oblasti chromozomů spojené s karcinomem prostaty:
HPC1
Gen RNASEL lokalizovaný v lokusu HPC1 (1q24-25) byl prokázán pomocí studií genomu rodin s hereditárním karcinomem a potvrzen vazebnými studiemi (5, 6). Tento gen zřejmě kóduje antivirový a proapoptický enzym RNázu L, která je složkou degradační dráhy RNA a hraje významnou roli při zprostředkování biologického účinku interferonů, zejména při odpovědi na virovou infekci. Ztráta enzymatické aktivity RNázy L způsobuje větší náchylnost k virovým infekcím (7). U rodin s hereditárním karcinomem prostaty byla identifikována řada missense mutací genu RNASEL (8). Na jejich základě bylo prokázáno, že nukleotidový polymorfismus (SNP), 1385G → A způsobující substituci argininu za glutamin (R462Q) souvisí se zvýšeným rizikem karcinomu prostaty v USA, nikoliv však u německé a švédské populace (9–11). Mutovaná alela genu RNASEL s delecí kodonu 157 byla detekována u 6,9 % pacientů s CaP, zatímco u zdravých pacientů byla detekována pouze 2,9 % (12). Další práce popisují alelu genu s terminačním kodonem na pozici 265. aminokyseliny u 4,3 % pacientů s familiárním karcinomem, ale pouze u 1,8 % v kontrolní skupině (13). Epidemiologické údaje ukazují, že mutovaný gen HPC1 je vzácný autozomálně dominantní gen s vysokou penetrancí, což znamená, že i když není u velkého množství karcinomů prostaty přítomen, individuální nositel bude s vysokou pravděpodobností postižen karcinomem prostaty. Karcinomy vázané na HPC1 mají vyšší grade a pokročilejší stadium, přestože u sporadických karcinomů nejsou zaznamenány žádné histologické odlišnosti (14).
HPC2, HPC20, HPCX
Funkce genu ELAC2/HPC2 (17p11) není dosud známa. Polymorfismus tohoto genu byl suspektní ze zvýšeného rizika karcinomu prostaty u japonské populace. Další vazebné studie a genotypizace u různých populací však toto podezření nepotvrdily (15).
Gen HPCX (Xq27-28) byl nalezen na krátkém raménku chromozomu X u rodin s výskytem karcinomu prostaty. Toto bylo potvrzeno dalšími vazebnými studiemi. Bližší detaily o tomto genu zatím nejsou k dispozici (16).
Gen HPC20 (20q13) je další suspektní gen identifikovaný v rodinách s hereditárním karcinomem prostaty. Vazebné studie však jeho vztah k riziku karcinomu prostaty zatím neprokázaly (19).
Geny regulující imunitní reakci
Gen SR-A/MSR1 (8p22-23) patří mezi regulátory zánětu. Tento gen moduluje interakci hostitelských makrofágů, adhezi makrofágů, fagocytózu apoptotických buněk a mikrobů a detoxikaci mikrobiálních produktů. Absence genu SR-A/MSR1 znamená větší náchylnost k bakteriálním infekcím. Mutace genu jsou asociovány s vyšším rizikem karcinomu prostaty. Vyskytují se asi u 3 % pacientů se sporadickým karcinomem, zatímco u zdravých mužů pouze v 0,4 % (17). Bylo také prokázáno, že gen SR-A/MSR1 se podílí na zprostředkování zánětu vedoucího k ateroskleróze (18).
Gen MIC-1 (19p13) patří mezi transformující růstové faktory beta (TGF-β) a reguluje aktivitu makrofágů.
Gen TLR4 (9q32-33) patří do skupiny genů nazvaných TLRs (toll-like receptors), podobných genu octomilky (Drosophila) Toll. Geny TLRs zprostředkovávají vrozenou imunitní reakci na mikrobiální infekci stimulací systému prozánětlivých cytokinů, které simultánně pomáhají potlačit počáteční infekci a stimulovat vývoj adaptivní imunitní reakce (20). Mutace genů TLRs mohou vést k nedostatečnosti mechanismu čištění patogenů a způsobit chronickou zánětlivou reakci na přetrvávající infekci (21).
Gen PON1 (7q21.3) kóduje paraoxanázu, která se váže na lipoprotein o vysoké denzitě v séru a přispívá k detoxikaci organofosfátových sloučenin a karcinogenních, v tucích rozpustných volných radikálů z lipidové peroxidace (22). Stejně jako SR-A/MSR1 i PON1 hraje roli při zprostředkování zánětu vedoucího k ateroskleróze (23).
Reparační geny
Geny CHEK2 (22q12.1), BRCA2 (13q12.3) a OGG1 (3p26.2) jsou významné při opravě DNA.
Gen CHEK2 brání replikaci poškozené DNA koordinací opravy DNA, progresí buněčného cyklu a apoptózy (24).
Gen BRCA2 podporuje opravu poškození dsDNA pomocí homologní rekombinace.
Gen OGG1 je DNA-glykosyláza/AP-lyáza, jež opravuje oxidační poškození DNA (25).
Tumor supresorové geny
Chromozomy 8p a 13q jsou velmi často poškozené u pacientů s karcinomem prostaty, ale také u pacientů s prostatickou intraepiteliální neoplazií (PIN). Na chromozomu 8 jsou to především oblasti 8p12-p21 a 8p22. V této oblasti se nalézá řada kandidátních genů, které by mohly patřit mezi tumor supresorové (např. geny MSR1, NKX3.1 a N33) (tab. 1).
Tab. 1. Přehled hlavních kandidátních genů pro karcinom prostaty Table 1. Main candidate genes for prostate cancer 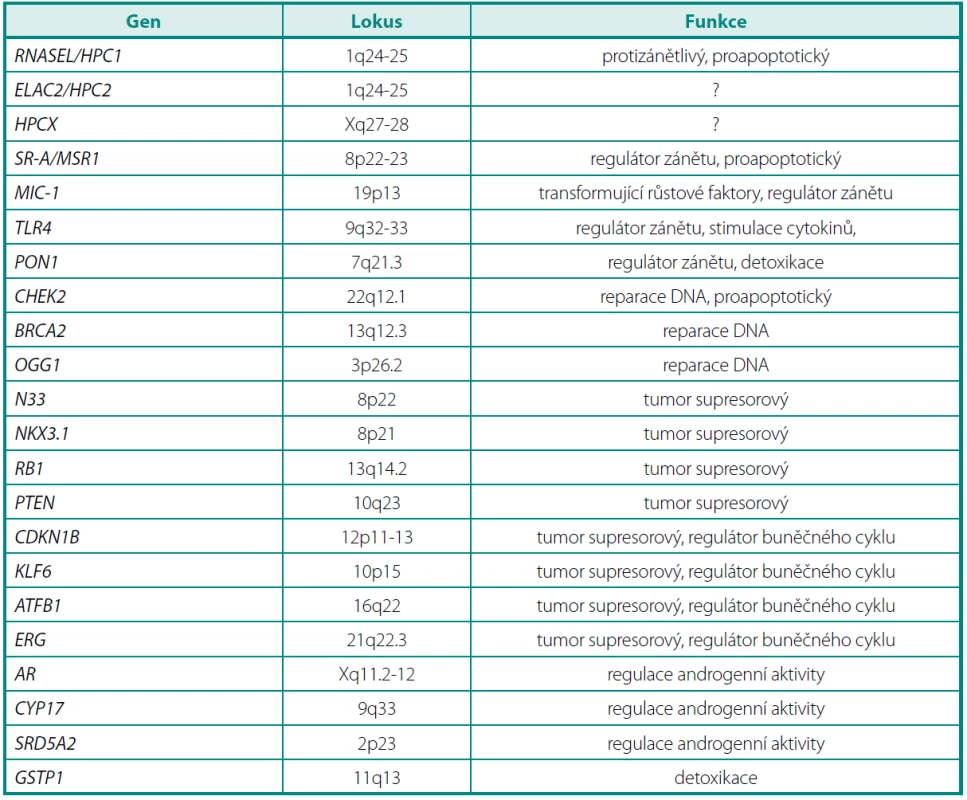
Na chromozomu 13 se vyskytuje retinoblastomový supresorový gen (RB1), jehož delece se běžně vyskytují při časné prostatické kancerogenezi (26).
Gen NKX3.1 (8p21) je specificky exprimován v prostatě. Jeho produktem je prostatický specifický homeoprotein, regulující epiteliální růst a diferenciaci. Oblast 8p21, kde se vyskytuje, vykazuje ztrátu heterozygozity u 85 % karcinomů prostaty. Kompletní ztráta jeho exprese je častá u progrese karcinomu prostaty (27). V časném stadiu onemocnění se běžně vyskytují promotorové metylace a snížená exprese genu korelující se ztrátou alely. Gen PTEN (10q23) – homolog fosfatázy a tensinu – je tumor supresorový gen, který je velmi často deletován a jehož exprese je snížena u karcinomu prostaty. Jeho produktem je lipidová fosfatáza potlačující účinek fosfoinositol - 3-kináz defosforylací fosfatidylinositol - 3,4,5-trifosfátu (lipidové části AKT-kinázy).
U nemocných s karcinomem prostaty jsou časté hypermetylace, delece i hypometylace. Ztráta exprese PTEN je přítomna u lokálně pokročilých nádorů a karcinomů prostaty s vysokým gradingem malignity (28). Pouze nižší procento pacientů s časnými a lokalizovanými karcinomy prostaty mají detekovanou deleci či mutaci genu PTEN, ale více než 50 % metastatických lézí má alteraci genu PTEN (29). Současná ztráta exprese NKX3.1 a PTEN u myší se vyskytuje u agresivnějších forem karcinomu prostaty.
Gen CDKN1B (12p11-13) kóduje inhibitor cyklin-dependentní kinázy p27, který patří do skupiny inhibitorů buněčného cyklu. Ztráta heterozygozity regionu 12p11-13 se vyskytuje u 50 % karcinomů prostaty (30). Snížená či chybějící exprese p27 koreluje s vyšším gradingem nádoru a kratším beznádorovým intervalem. Změny genu PTEN a p27 se spolu často vyskytují v rodinách s familiárním karcinomem prostaty.
Gen KLF6 (10p15) – Kruppel-like zinc finger transkripční faktor 6 vykazuje ztrátu heterozygozity asi u pětiny karcinomů prostaty. Mutace nebo snížená proteinová exprese byla detekována u malého množství karcinomů vysokého gradingu malignity (31).
Gen ATFB1 (16q22) – regulátor buněčného cyklu – je transkripční faktor reagující s onkoproteinem MYB a regulující expresi α-fetoproteinu. Jeho lokus je charakteristický častou ztrátou heterozygozity a 36 % nádorů prostaty obsahuje missense mutace, které zřejmě působí ztrátu proteinové funkce genu (32).
Geny ERG (21q22.3) a ETV1 (7p21.2) patří do skupiny transkripčního faktoru ETS a ve tkáni karcinomu prostaty byla prokázána jejich zvýšená exprese, a to jak u lokalizovaného karcinomu, tak u metastatického s přibližně stejnou frekvencí. Nebyla prokázána u PIN.
Zvláštním typem regulátoru apoptózy je adaptační protein Shb. Při jeho zvýšené expresi je prokázána redukce růstu prostatických nádorových buněk PC3. Děje se tak prostřednictvím inhibitorů c-Abl, které navozují apoptózu nádorových buněk (33).
Geny regulující androgenní aktivitu
Významný vliv na riziko vzniku karcinomu prostaty mají i geny kódující androgenní aktivitu. Do této skupiny patří gen androgenního receptoru (AR), gen cytochromu P-450c17α (CYP17) gen steroidní 5α-reduktázy 2. typu (SRD5A2).
Gen androgenního receptoru AR (Xq11 - 12) je nezbytný pro růst a vývoj prostatických epiteliálních buněk. Obsahuje opakující se polymorfní triplety glutaminu (CAG), jejichž zkrácení vyvolává vyšší transkripční a transaktivační aktivitu androgenního receptoru. Kratší úseky CAG jsou rizikovým faktorem karcinomu prostaty a lokálně pokročilého onemocnění. U Afroameričanů s vysokou incidencí karcinomu prostaty byly prokázány zkrácené úseky polyglutaminů na rozdíl od Asiatů, kde jsou tyto úseky delší (34, 35). Velmi krátké úseky CAG jsou rizikovým faktorem a predisponují k časnějšímu nástupu a recidivě onemocnění. Podobná souvislost byla identifikována i v případě opakujících se úseků polyglycinu (GGC) (35). AR hraje roli dominantního onkogenu u pacientů s pokročilým karcinomem po androgenní deprivaci. Při kastračních hodnotách testosteronu se aktivita AR zvyšuje genovou amplifikací asi u 30 % nádorů (36). Gen AR může být hyperaktivován missense mutacemi a u hormonálně independentních karcinomů jsou časté amplifikace opakujících se sekvencí CAG způsobující hyperaktivace receptoru (37). Aktivace AR u homonálně independentních nádorů může být uskutečněna i jinými mechanismy, jako je vliv koaktivátorů (p160, beta-katenin) nebo účinky kinázy MAP nebo kináz skupiny HER atd.
Gen CYP17 kóduje cytochrom P-450c17α. Tento enzym katalyzuje syntézu pohlavních hormonů. U některých variant genu je pravděpodobná souvislost se zvýšeným rizikem vzniku karcinomu prostaty (38).
SRD5A2 kóduje predominantní isoenzym 5α-reduktázy 2. typu. Byly detekovány polymorfní alely, které kódují tento enzym se zvýšenou aktivitou a jsou asociovány se zvýšeným rizikem a horší prognózou karcinomu prostaty (39).
Studium genetických změn
Bližší zkoumání molekulárních vlastností karcinomu prostaty předpokládá analýzu genových produktů – tzv. genovou expresi nebo přímou identifikaci strukturálních změn genů – mutací nebo chromozomálních aberací. Detekce změny genové exprese ve smyslu zvýšené, snížené či chybějící exprese je podmíněna izolací mRNA z nádorové tkáně a identifikace expresních změn většinou prostřednictvím RT-PCR (reverse transcriptase time polymerase chain reaction). Podobně lze sledovat i proteinové produkty genové exprese. Změny exprese bývají často sdruženy s výskytem určitých nádorů. Detekce hledaných znaků nádorových epiteliálních buněk probíhají na úrovni sekvence RNA (informační RNA – mRNA). Pomocí reverzní transkriptázy (RT) je izolovaná RNA přepsána do komplementární DNA (cDNA) a ta se pak použije jako templát pro reakci PCR. Real-time RT-PCR umožňuje přesnou kvantifikaci hledané sekvence cDNA ve vzorku. Využívá se zde několika možností detekce narůstajícího množství amplikonů. Principiálně nejjednodušší je metoda využívající fluorescenčních barviv (např. Sybr Green), která se interkalují mezi báze DNA (proces, při němž je molekula nebo iont umísťován do hostitelské mřížky). Narůstající fluorescence pak odpovídá vzrůstajícímu množství DNA ve vzorku. V současnosti je nejvíce rozšířená metoda využívající 5-exonukleázové aktivity DNA polymerázy. Klíčové je zde použití oligonukleotidu – sondy (např. TaqMan sonda), která se specificky váže na sekvenci mezi oběma primery. Sonda je na jednom svém konci označena fluorescenční látkou a na druhém konci zhášečem fluorochromu. Při syntéze komplementárních vláken dojde k uvolnění fluorescenční látky a k nárůstu fluorescence, která je detekována a zaznamenána v reálném čase. Na základě standardizačních křivek lze přesně kvantifikovat množství hledané sekvence cDNA (markeru) ve vzorku.
Detailnější studium je možné identifikací změn v genetickém materiálu pomocí komparativní genomové hybridizace (CGH), expresních mikrosouborů, SNP-chipů nebo určením metylačních profilů.
Při mutacích a chromozomálních aberacích bývají poškozeny geny ovlivňující buněčné dělení, diferenciaci buněk, apoptózu, replikaci a reparaci DNA. K nim náleží zejména onkogeny, tumor supresorové geny a mutátorové geny. U některých nádorů je známá korelace mezi druhem či rozsahem chromozomálních změn a výskytem nebo prognózou onemocnění. V těchto případech lze cytogenetické vyšetření využít jako důležité diagnostické a prognostické kritérium. K zobrazení chromozomů se používá řada různých metod v závislosti na rozsahu zkoumaných strukturálních aberací. Nejčastějším postupem je tzv. G-pruhování (G-banding) spočívající ve vystavení chromozomů krátkodobému působení trypsinu a obarvení roztokem Giemsa-Romanowski. Jednotlivé pruhy chromozomů, kde se vyskytují určité geny, jsou poté hodnoceny mikroskopicky.
Z hlediska možného vysvětlení genetického původu nebo náchylnosti k určitým onemocněním jsou zajímavé především jednonukleotidové polymorfismy (SNP) – jednoduché záměny nukleotidů určitého úseku DNA. Nacházejí se v kódujících i nekódujících částech genů a vyskytují se průměrně každých 250–300 bází. Ve srovnání s bodovými mutacemi, jejichž efektem je většinou změna funkce proteinu, je důsledek těchto polymorfismů neidentifikovatelný. Vzhledem k jejich časté lokalizaci v regulačních regionech často způsobují změny genové exprese. SNP představují nejčastější formu genových variací. Analýza SNP je nejčastěji prováděna pomocí čipových technologií, jejichž podstatou je hybridizace studovaného vzorku k sondě na základě komplementarity.
Novou oblastí genetického výzkumu je studium mikroRNA. Jedná se o metodiku zkoumání skupiny RNA, která není zodpovědna za kodování proteinů, ale jejíž funkce spočívají ve vývoji, buněčné diferenciaci, metabolismu a dalších chorobných procesech včetně kancerogeneze (40).
DNA hypermetylace je jedna z nejčastějších a nejlépe popsaných epigenetických abnormalit u CaP. Metylace je charakterizovaná připojením metylové skupiny k cytosinovému reziduu CpG ostrovů vyskytujících se u více než poloviny všech genů (obr. 1). Je zprostředkovaná jednou ze tří DNA metyltransferáz a stupeň metylace hraje kritickou roli v genové expresi. Změny v metylaci mohou vést k transkripční inaktivaci nebo aktivaci genů.
Obr. 1. Lokální metylace CpG Fig. 1. CpG methylation 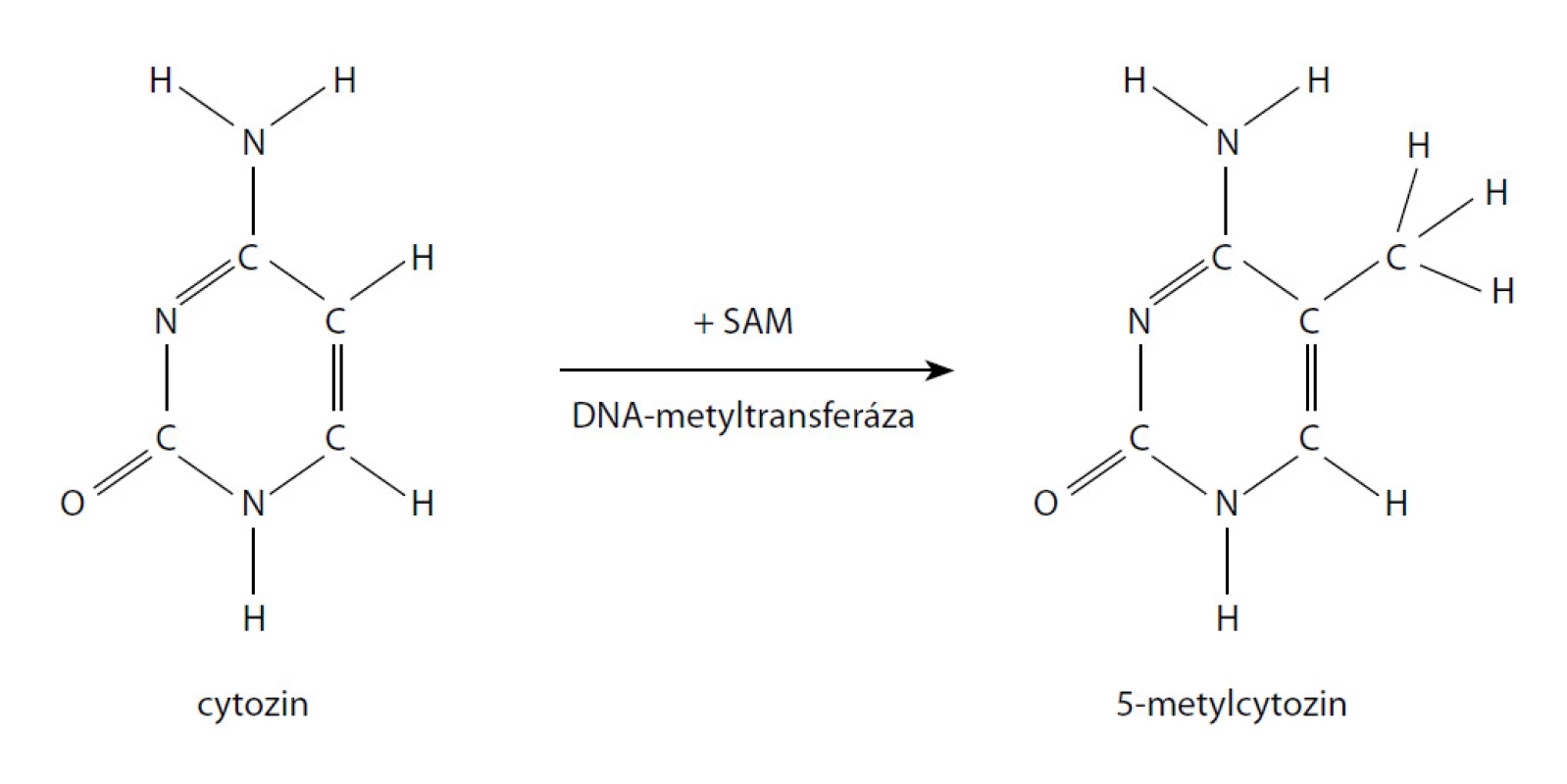
V případě karcinomu prostaty je hypermetylace popsaná u více než 30 genů. Mezi nimi jsou geny tumor-supresorů, geny kontrolující buněčný cyklus, geny kontrolující hormonální regulaci, geny řídící opravy poškozené DNA, invazivitu a morfologii nádorových buněk aj. Hypermetylace je pro většinu genů promoterem v poškození jejich funkce s následnou aktivací tumorigeneze. Příkladem může být hypermetylace ASC (apoptosis-associated specklike protein containing CARD), která je asociována s agresivnějším karcinomem prostaty a vyšším rizikem biochemické recidivy nebo GSTP1 (gen pro glutathion-S-transferázu π1), která chrání DNA před elektrofilními metabolity karcinogenů a reaktivními oxidanty tím, že je konjuguje na glutathion (41, 42).
Legislativní problematika
Většina genetických vyšetření přepokládá odběr nádorové tkáně z kterých je izolována DNA nebo mRNA. Odběr tkáně z lidského těla je upraven zákonem č. 20 z roku 1996, § 26, odstavec (4). Tento zákon podmiňuje odběr tkáně pro potřeby lékařské vědy, výzkumu nebo k výukovým účelům prokazatelným informovaným souhlasem pacienta na základě dobrovolnosti a svobodné vůle. Součástí souhlasu musí být vymezení účelu použití částí těla pacienta. Tento souhlas je součástí zdravotnické dokumentace pacienta. Použití částí těla pacienta nemůže být zdrojem finančního prospěchu nebo jiných výhod pro pacienta nebo fyzických nebo právnických osob po jeho úmrtí; rovněž nemůže být zdrojem finančního prospěchu nebo jiných výhod pro zdravotnické zařízení.
Závěr
Díky intenzivnímu zkoumání lidského genomu, genetických odlišností, polymorfismů, genové exprese a současnému porovnání výsledků s klinickými projevy onkologických onemocnění se objevila řada kandidátních genů, které mohou hrát určitou roli ve vzniku a rozvoji karcinomu prostaty. Přestože statistické metody a detailní sledování nemocných s určitou formou genetické změny potvrzují, především u familiárních a hereditárních karcinomů, pravděpodobnou spojitost genetické změny a nemoci samé, přesná etiopatogeneze a role jednotlivých genů zůstávají zatím nejasné. Proto tyto geny nemůžeme nazývat „nádorovými“ ale pouze „geny náchylnosti“. Vzhledem k vysokému počtu kandidátních genů a oblastí chromozomů, kde dosud ještě nebyly zjištěny konkrétní geny, budou zapotřebí rozsáhlé studie dokumentující korelaci genetických odchylek s určitými typy karcinomu, popřípadě s konkrétními klinickými průběhy. Stejně tak bude nutné odlišit geny zodpovědné za vznik jednotlivých nádorů a geny způsobující obecnou genetickou nestabilitu a dále i vztahy mezi geny náchylnosti navzájem, jak o tom svědčí dostupné údaje o trojici genů NKX3.1, PTEN a CDKN1B. Dalším krokem bude zřejmě posouzení genetických dispozic nemocných ve vztahu k exogenním potenciálním faktorům, jako jsou infekce, výživa, stres a vnější prostředí. Bližší poznání role jednotlivých genů v procesu vzniku a průběhu onemocnění může přinést tolik potřebné prognostické informace a usnadnit i rozhodování, který karcinom je signifikantní a musí být léčen.
Práce byla podpořena grantem GA UK 200 090.
Došlo: 11. 12. 2009
Přijato: 26. 3. 2010
Kontaktní adresa
MUDr. Marek Schmidt
Urologická klinika 2. LF UK a FN Motol
V Úvalu 84,
150 06 Praha 5
e-mail: mschmidt@centrum.cz
Zdroje
1. Lesko SM, Rosenberg L, Shapiro S, et al. Family history and prostate cancer risk. Am J Epidemiol 1996; 144 : 1041–1047.
2. Lichtenstein P, Holm NV, Verkasalo PK, et al. Enviromental and heritable factors in the causation of cancer. Analyses of cohorts of twin from Sweden, Denmark and Finland. N Engl J Med 2000; 343 : 78–85.
3. Gillanders EM, Xu J, Chang BL, et al. Combined genome-wide scan for prostate cancer susceptibility genes. J Nail Cancer Inst 2004; 96 : 1240–1247.
4. Cui J, Staples MP, Hopper JL, et al. Segregation analyses of 1,476 population-based Australian families affected by prostate cancer. Am J Hum Genet 2001; 68 : 1207–1218.
5. Smith JR, Freije D, Carpten JD, et al. Major susceptibility locus for prostate cancer on chromosome 1 suggested by a genome-wide search. Science 1996; 274 : 1371–1374.
6. Eeles RA, Durocher F, Carpten JD, et al. Linkage analysis of chromosome 1q markers in 136 prostate cancer families. Am J Hum Genet 1998; 62 : 653–658.
7. Silverman RH. Implications for RNase L in prostate cancer biology. Biochemistry 2003; 42 : 805–1812.
8. Xiang Y, Wang Z, Murakami J, et al. Effects of RNaseL mutations associated with prostate cancer on apoptosis induced by 2‘,5‘-oligoadenylates. Cancer Res 2003; 63 : 6795–6801.
9. Rennert H, Zeigler-Johnson CM, Addya K, et al. Association of susceptibility alleles in ELAC2/HPC2, RNASEL/HPC1, and MSR1 with prostate cancer severity in European American and African American men. Cancer Epidemiol Biomarkers Prev 2005; 14 : 949–957.
10. Maier C, Haeusler J, Herkommer K, et al. Mutation screening and association study of RNASEL as a prostate cancer susceptibility gene. Br J Cancer 2005; 92 : 1159–1164.
11. Wiklund F, Jonsson BA, Brookes AJ, et al. Genetic analysis of the RNASEL gene in hereditary, familial, and sporadic prostate cancer. Clin Cancer Res 2004; 10 : 7150–7156.
12. Rennert H, Berkovich D, Hubert A, et al. A novel founder mutation in the RNASEL gene, 471delAAAG is associated with prostate cancer in Ashkenazi Jews. Am J Hum Genet 2002; 71 : 981–984.
13. Rokman A, Ikonen T, Seppala EH, et al. Germline alterations of RNASEL gene, a candidate HPC1 gene at 1q25, in patients and families with prostate cancer. Am J Hum Genet 2002; 70 : 1299–1304.
14. Goode EL, Stanford JL, Peters MA, et al. Clinical characteristics of prostate cancer in an analysis of linkage to four putative susceptibility loci. Clin Cancer Res 2001; 7 : 2739–2749.
15. Fujiwara H, Emi M, Nagai H, et al. Association of common missense changes in ELAC2 (HPC2) with prostate cancer in a Japanese cas-control series. J Hum Genet 2002; 47 : 641–648.
16. Baffoe-Bonnie AB, Smith JR, Stephan DA, et al. A genetic epidemiological study of hereditary prostate cancer (HPC) in Finland: localization by linkage disequilibrium of a haplotype in the HPCX region. J Hum Genet 2005; 117 : 307–316.
17. Xu J, Zheng SL, Komiya A, et al. Germline mutations and sequence variants of the macrophager scavenger receptor 1 gene are associated with prostate cancer risk. Nat Genet 2002; 32 : 321–325.
18. De Winther MP, Gijbels MJ, Van Dijk KW, et al. Transgenic mouse models to study the role of the macrophage scavenger receptor class A in atherosclerosis. Int J Tissue React 2000; 22 : 85–91.
19. Bock CH, Cunningham JM, McDonnel SK, et al. Analysis of the prostate cancer-suspectibility locus HPC20 in 172 families affected by prostate cancer. Am J Hum Genet 2001; 68 : 795–801.
20. O’Neil LA, Fitzgerald KA, Bowie AG. The Toll-IL-1 receptor adaptor family grows to five members. Trends Immunol 2003; 24 : 286–290.
21. Zheng SL, Augustsson-Balter K, Chang B, et al. Sequence variants of toll-like receptor 4 are associated with prostate cancer risk: results from the Cancer Prostate in Sweden Study. Cancer Res 2004; 64 : 2918–2922.
22. Marchesani M, Hakkarainen A, Tuomainen TP, et al. New paraoxonase 1 polymorphism 1102V and the risk of prostate cancer in Finnish men. J Nail Cancer Inst 2003; 95 : 812–818.
23. Shih DM, Gu I, Xia YR, et al. Mice lacking serum paraoxonase are susceptible to organophosphate toxicity and atherosclerosis. Nature 1998; 394 : 284–287.
24. Dong X, Wang L, Taniguchi K, et al. Mutations in CHEK2 associated with prostate cancer risk. Am J Hum Genet 2003; 72 : 270–280. 25. Coussens LM, Werb Z. Inflammation and cancer. Nature 2002; 420 : 860–867.
26. Phillips SM, Barton CM, Lee SJ, et al. Loss of the retinoblastoma susceptibility gene (RB1) is a frequent and early event in prostatic tumorigenesis. Br J Cancer 1994; 70 : 1252–1257.
27. Bowen C, Bubendorf L, Voeller HJ, et al. Loss of NKX3.1 expression in human prostate cancers correlates with tumor progression. Cancer Res 2000; 60 : 6111–6115.
28. McMenamin ME, Soung P, Perera S, et al. Loss of PTEN expression in paraffin-embedded primary prostate cancer correlates with high Gleason score and advanced stage. Cancer Res 1999; 59 : 4291–4296.
29. Suzuki H, Freije D, Nusskem DR, et al. Interfocal heterogenity of PTEN/MMAC1 gene alterations in multiple metastatic prostate cancer tissues. Cancer Res 1998; 58 : 204–209.
30. Kibel AS, Freije D, Isaacs WB, Bova GS, et al. Deletion mapping at 12p12-13 in metastatic prostate cancer. Genes Chromosomes Cancer 1999; 25 : 270–276.
31. Chen C, Hyytinen ER, Sun X, et al. Deletion, mutation, and loss of expression of KLF6 in human prostate cancer. Am J Pathol 2003; 162 : 1349–1354.
32. Sun X, Frierson HF, Chen C, et al. Frequent somatic mutations of the transcription factor ATBF1 in human prostate cancer. Nat Genet 2005; 37 : 407–412.
33. Davoodpour P, Landstrom M, Welsh M. Reduced tumor growth in vivo and increased c-Abl activity in PC3 prostate cancer cells overexpressing the Shb adapter protein. BMC Cancer 2007; 7 : 161; http: //www.biomedcentral.com/1471-2401/7/161.
34. Irvine RA, Ma H, Yu MC, et al. Inhibition of p160-mediated coactivation with increasing androgen receptor polyglutamine length. Hum Mol Genet 2000; 9 : 267–274.
35. Hsing AW, Gao YT, Wu G, et al. Polymorphic CAG and GGM repeat lengths in the androgen receptor gene and prostate cancer risk. A population-based case-control study in China. Cancer Res, 2000, 60 : 5111–5116.
36. Ford OH III, Gregory CW, Kim D, et al. Androgen receptor gene amplification and protein expression in recurrent prostate cancer. J Urol 2003; 170 : 1817–1821.
37. Buchanan G, Yang M, Cheong A, et al. Structural and functional consequences of glutamine tract variation in the androgen receptor. Hum Mol Genet 2004; 13 : 1677–1692.
38. Chang B, Zheng SL, Isaacs SD, et al. Linkage and association of CYP17 gene in hereditary and sporadic prostate cancer. Int J Cancer 2001; 95 : 354–359.
39. Nam RK, Toi A, Vesprini D, et al. V89L polymorphism of type-2,5-alpha reductase enzyme gene predicts prostate cancer presence and progression. Urology 2001; 57 : 199–204.
40. Lewis BP, Burge CB, Bartel DP. Conserved seed pairing, often flanked by adenosomes, indicates thousand of human genes are microRNA targets. Cell 2005; 120(1): 15–20.
41. Collard RL, Harya NS, Monzon FA, Maier CE, O´Keefe DS. Methylation of the ASC Gene Promoter is Associated With Agressive Prostate Cancer. The Prostate 2006; 66 : 687–695.
42. Henrique R, Jeronimo C. Molecular detection of prostate cancer: a role for GSTP1 hypermethylation. Eur Urol 2004; 46 : 660–669.
Štítky
Dětská urologie Nefrologie Urologie
Článek vyšel v časopiseČeská urologie
Nejčtenější tento týden
2010 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Editorial
- Molekulární vlastnosti klinicky signifikantního karcinomu prostaty
- Genetické riziko karcinomu prostaty
- Mikrochirurgická operace varikokély u dětí a dospívajících – prospektivní srovnání laparoskopické a otevřené subingvinální operace
- Chronická urinární toxicita 3D-CRT a IMRT karcinomu prostaty
- Srovnání akutní toxicity radioterapie technikou IMRT a IMRT + HDR BRT u pacientů s karcinomem prostaty vysokého rizika rekurence
- Infekce močových cest po cystektomii s kontinentní ortotopickou derivací – Vesica ileale padovana (V.I.P.)
- Naše zkušenosti s aplikací rázové vlny u pacientů s induratio penis plastica (průměrná doba sledování 13 měsíců)
- Postavení magnetické rezonance a magnetické rezonanční spektroskopie při detekci karcinomu prostaty
- Představujeme nové české docenty urologie
- Central European Meeting EAU
- Česká urologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Mikrochirurgická operace varikokély u dětí a dospívajících – prospektivní srovnání laparoskopické a otevřené subingvinální operace
- Naše zkušenosti s aplikací rázové vlny u pacientů s induratio penis plastica (průměrná doba sledování 13 měsíců)
- Postavení magnetické rezonance a magnetické rezonanční spektroskopie při detekci karcinomu prostaty
- Molekulární vlastnosti klinicky signifikantního karcinomu prostaty
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



