-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Moderní mikrochirurgie jako trvalé, bezpečné a šetrné řešení nekrvácejících mozkových výdutí
Autoři: J. Šroubek 1; J. Hanuška 1; O. Šoula 1; R. Tomáš 1; R. Bruna 2; J. Klener 1
Působiště autorů: Neurochirurgické oddělení, Nemocnice Na Homolce, Praha 1; Klinika zobrazovacích metod 2. LF UK a FN Motol, Praha 2
Vyšlo v časopise: Cesk Slov Neurol N 2019; 82(2): 176-182
Kategorie: Původní práce
doi: https://doi.org/10.14735/amcsnn2019176Souhrn
Cíl: Nekrvácející mozkové výdutě (unruptured intracranial aneurysms; UIA) se vzhledem ke stoupající dostupnosti a lepší kvalitě zobrazovacích metod stávají stále častější diagnózou v neurologické a neurochirurgické praxi. Vzhledem k existenci rizika ruptury a krvácení, je na místě zvážit jejich uzávěr. Na indikaci vyřazení výdutě z cirkulace a způsob vyřazení nejsou zcela jednotné názory. Prezentujeme výsledky pacientů s UIA operovaných na našem oddělení v průběhu posledních 9 let a náš pohled na tuto problematiku.
Soubor a metodika: Pacienti s UIA operovaní na našem oddělení byli zahrnuti do souboru, který jsme retrospektivně analyzovali s důrazem na hodnocení bezpečnosti výkonu a úplnosti vyřazení výdutě.
Výsledky: Za 9 let bylo operováno 146 pacientů se 184 incidentálními nebo koincidentálními výdutěmi. Nejčastěji byly výdutě lokalizovány na střední mozkové tepně (40 %). Perioperační komplikace se vyskytly u 10 % pacientů a celková chirurgická morbidita/ mortalita byla 3,5/ 0 %. U 143 pacientů byla provedena kontrolní CTA, která potvrdila úplnou obliteraci výdutě v 99 %. Průměrný follow-up pacientů byl 4,5 roku.
Závěr: Naše výsledky ukazují, že mikrochirurgická léčba UIA je bezpečnou, dlouhodobě účinnou léčbou, dobře tolerovanou pacienty. Zejména v případě UIA, kde hlavním smyslem léčebné intervence je trvalá eliminace rizika krvácení, by měla být vždy zvažována jako léčebná modalita.
Klíčová slova:
nekrvácející mozková výduť – clipping
Úvod
Nekrvácející mozkové výdutě (unruptured intracranial aneurysm; UIA) se vzhledem ke stoupající dostupnosti a lepší kvalitě zobrazovacích metod stávají stále častější diagnózou v neurologické a neurochirurgické praxi. Vznikají tak dvě zásadní klinické otázky: 1. které výdutě vyžadují aktivní řešení a 2. jakým způsobem výduť ošetřit (mikrochirurgicky či endovaskulárně)? Ani na jednu z těchto otázek současná literatura nedává zcela jednoznačnou odpověď. Na podkladě metaanalýz publikovaných souborů vznikají skórovací systémy, podle kterých lze odhadnout pravděpodobnost zakrvácení pro konkrétního pacienta s konkrétní výdutí. Jedná se např. o PHASES (P – Population, H – Hypertension, A – Age, S – Size of aneurysm, E – Earlier subarachnoid haemorrhage from another aneurysm, S – Site of aneurysm) [1], a dále o UIA treatment score (UIATS) [2]. Ty mohou alespoň pomoci klinikovi v odpovědi na první otázku. Ve způsobu léčby je literárně zdůrazňována nižší dlouhodobá efektivita endovaskulární metody při srovnatelném riziku výkonu [3]. V mikrochirurgii je kladen důraz na využití moderních metod, které především díky nízké invazivitě vedou ve svém důsledku k nižší morbiditě výkonu [4].
V naší práci v přehledu uvádíme možnosti moderní mikrochirurgické léčby, diskutujeme o indikaci řešení UIA a na vlastním souboru prezentujeme mikrochirurgickou léčbu jako bezpečnou a dlouhodobě efektivní metodu.
Možnosti moderní mikroneurochirurgie
Stejně jako rozvoj endovaskulárních metod, tak i rozvoj metod moderní mikrochirurgie umožnuje stále bezpečnější vyřazení výdutě z cirkulace.
Mezi novější metody patří:
- snižování invazivity používáním menších operačních přístupů a takzvané bezretrakční techniky (obr. 1);
- liberální použití metod dočasného clippingu, aplikace pilotního klipu a remodelace vaku bipolární koagulací;
- použití moderních metod kontroly průchodnosti magistrálních cév a perforátorů pomocí intraoperační videoangiografie, mikrodopplerografie a kvantitativní flowmetrie (obr. 2, 3);
- použití elektrofyziologického monitoringu;
- možnost použití krátkodobé srdeční zástavy pomocí aplikace adenozinu nebo metody „rapid ventricular pacing“;
- použití technik chirurgie lební baze např. drilling předního klinoidu, orbitozygomatický přístup, far lateral přístup;
- použití nízko - a vysokoprůtokových bypassů;
- použití titanových klipů z důvodu kvalitnější a neinvazivní pooperační kontroly (obr. 4).
Obr. 1. Komplexní vícelaločnaté aneuryzma arteria cerebri media před a po clippingu.
Fig. 1. Complex multilobar middle cerebral artery aneurysm before and after clipping.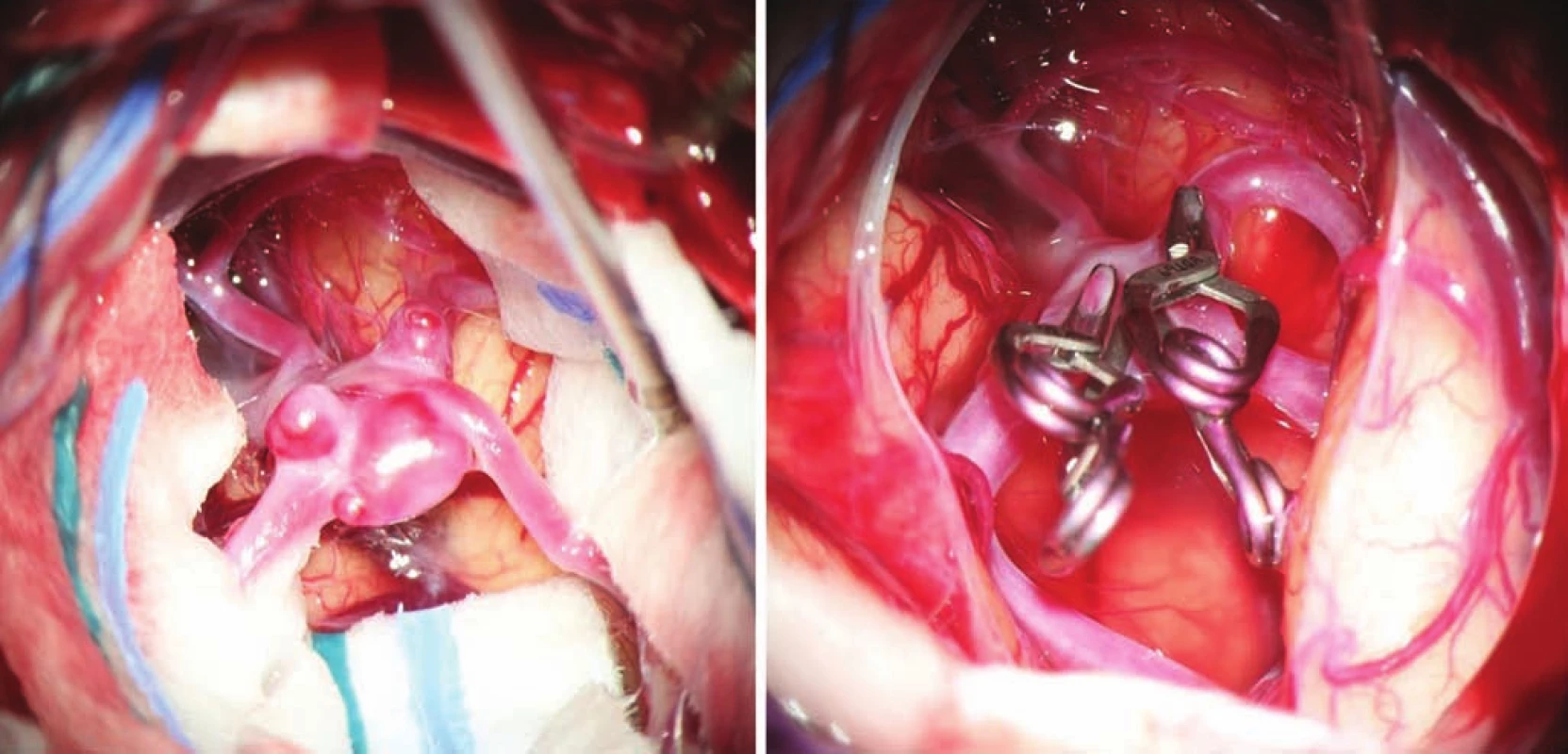
Obr. 2. Videoangiografie s indocyaninovou zelení.
Fig. 2. Indocyanine green videoangiography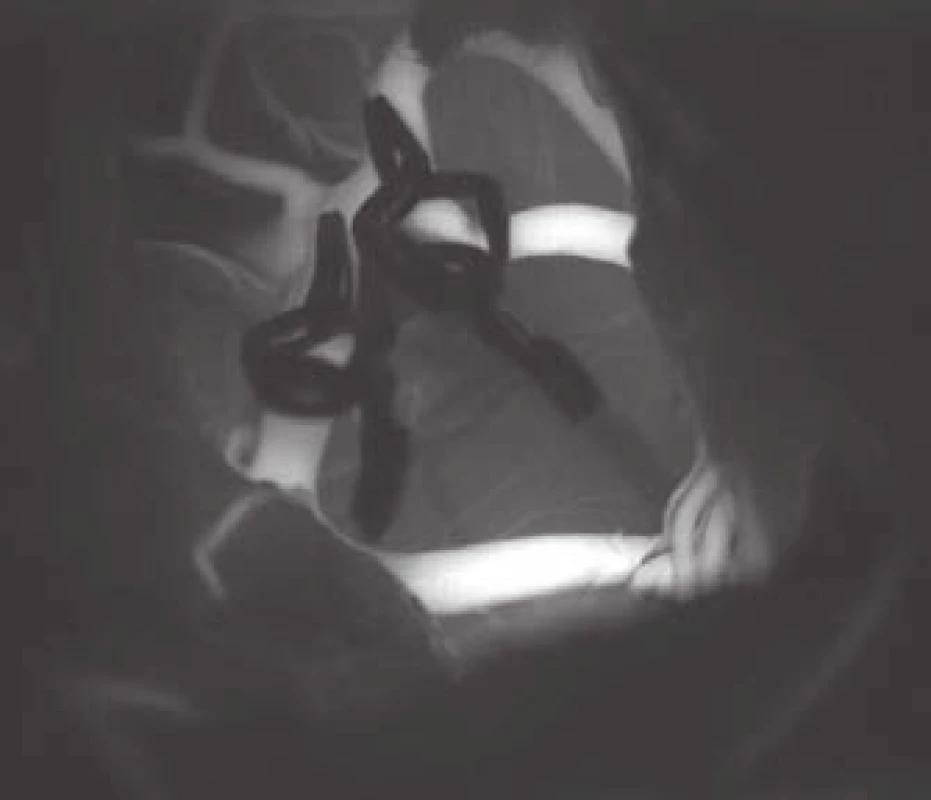
Obr. 3. Měření průtoku v jedné z odstupujících tepen.
Fig. 3. Measuring of the flow in one of the efferent branches.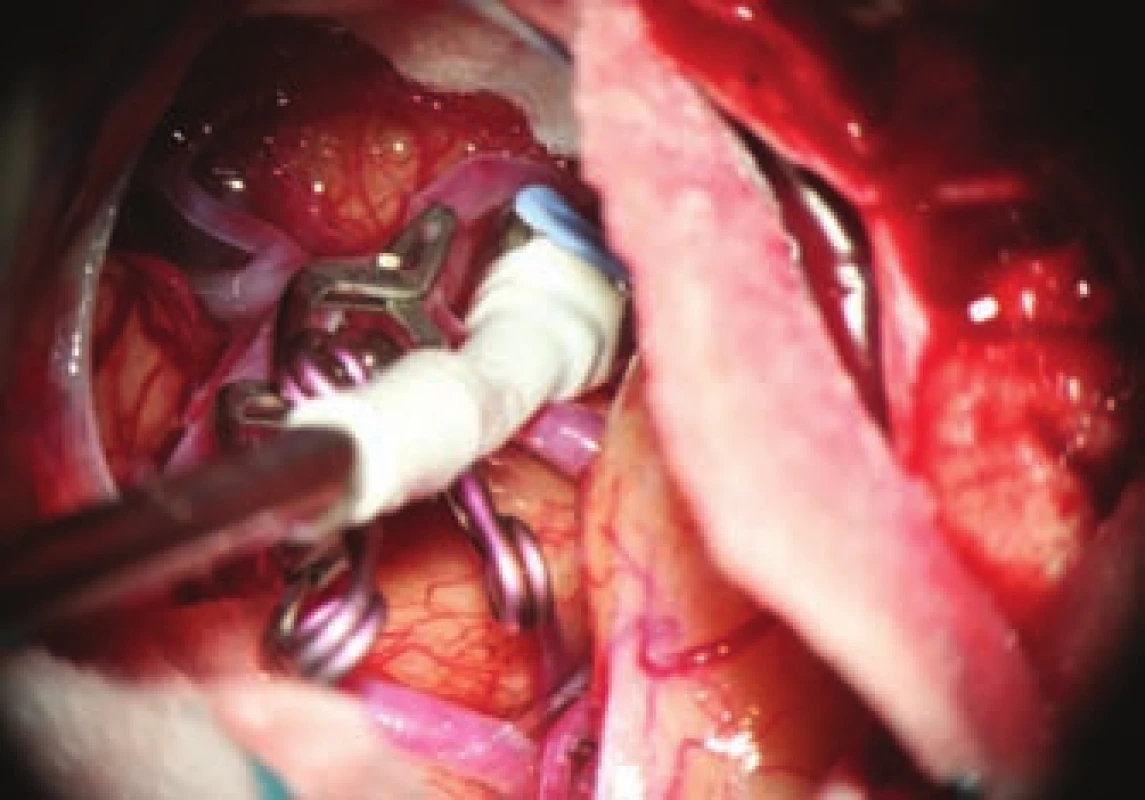
Obr. 4. CTA aneuryzmatu arteria communicans anterior před a po clippingu.
Fig. 4. CTA of the anterior communicating artery aneurysm before and after clipping.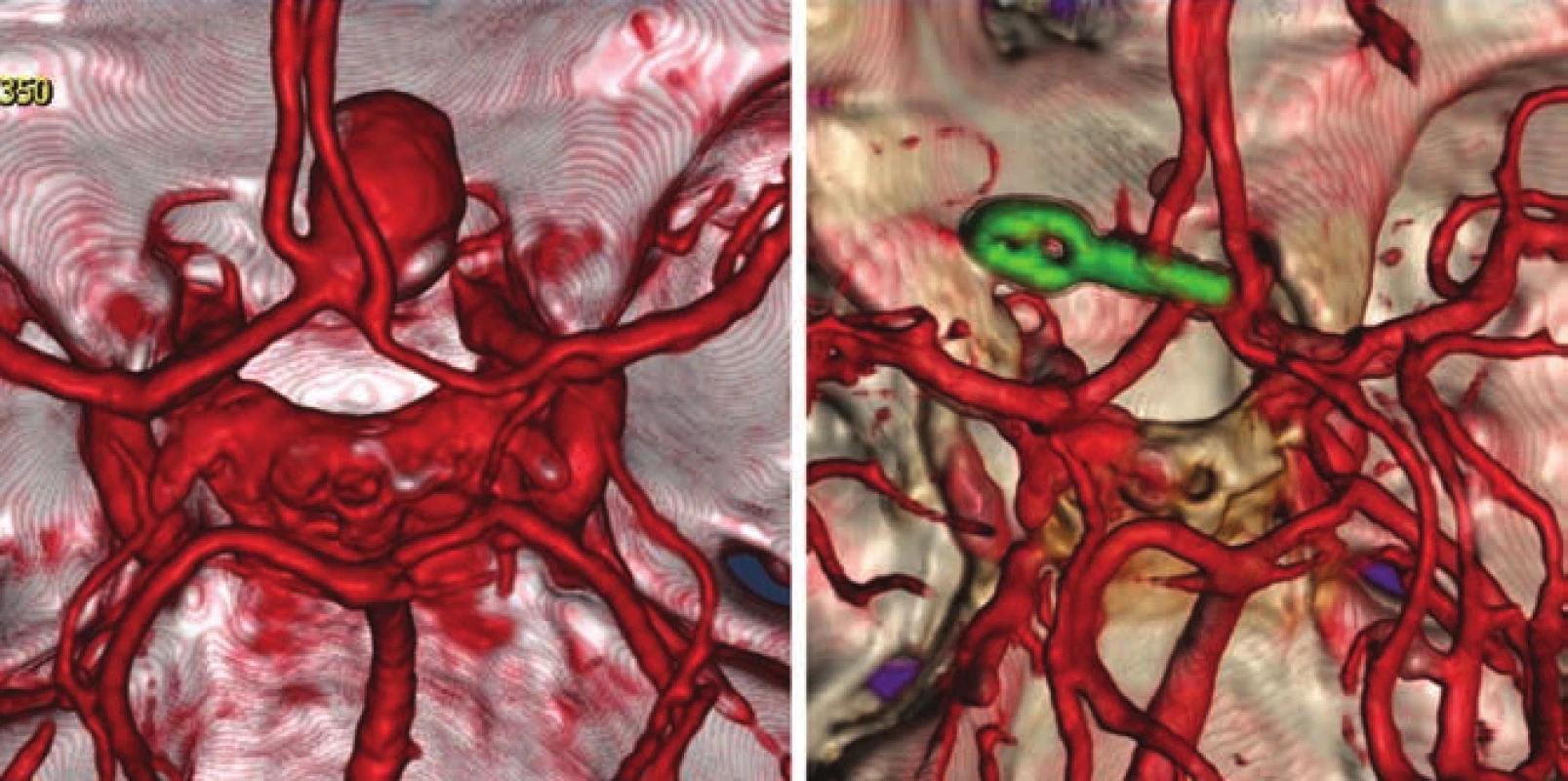
Koncept bezretrakční chirurgie je založen na důsledném adekvátním polohování nemocného, přesném provedení kraniotomie, časné evakuaci mozkomíšního moku a šetrné arachnoidální preparaci. Umožní operovat většinu UIA zcela bez použití dříve rutinně užívaných rigidních retraktorů odtahujících mozek. Výhodou tohoto fyziologického způsobu operování využívajícího gravitaci a dynamickou manipulaci nástroji je nejen prevence v literatuře jasně dokumentovaného rizika poškození mozku rigidními retraktory, ale zejména možnost kontinuálního vnímání chování mozku nástroji (jakási zpětná vazba či „monitoring“) a omezení napnutí struktur vlivem retraktorů s jejich opakovaným přenastavováním.
Operační poloha hlavy je z tohoto pohledu velmi důležitá; principem je napolohovat hlavu tím způsobem, aby mozková tkáň gravitací odpadávala od lebeční spodiny a vytvářela tak spontánně prostor k preparaci. Stejně důležité je adekvátní provedení minipterionální kraniotomie (obr. 5) s odbroušením malého křídla kosti klínové, a tím získání dalšího preparačního prostoru. Po otevření dury pokračujeme ve většině případů rozpreparováním Sylviovy rýhy, čímž augmentujeme prostor dříve získaný odbroušením křídla. Další postup již závisí na lokalizaci výdutě; na jednodušší výdutě bifurkace arteria cerebri media (ACM) postačí limitované cca 15mm otevření Sylviovy rýhy s přímým přístupem k výduti a souvisejícím cévám. Pro většinu paraklinoidních výdutí je nutno přístup doplnit snesením předního klinoidu, otevřením pochvy zrakového nervu s jeho mobilizací a uvolněním tzv. distálního durálního prstence arteria carotis interna (ACI). Klíčem k dostatečné expozici výdutí arteria communicans anterior (ACoA) je rozpreparování interhemisferické rýhy a perforace laminy terminalis umožňující evakuaci likvoru ze III. komory a další relaxaci mozku.
Tab. 1. Minipterionální kraniotomie na CTA.
Fig. 5. Minipterional craniotomy on CTA.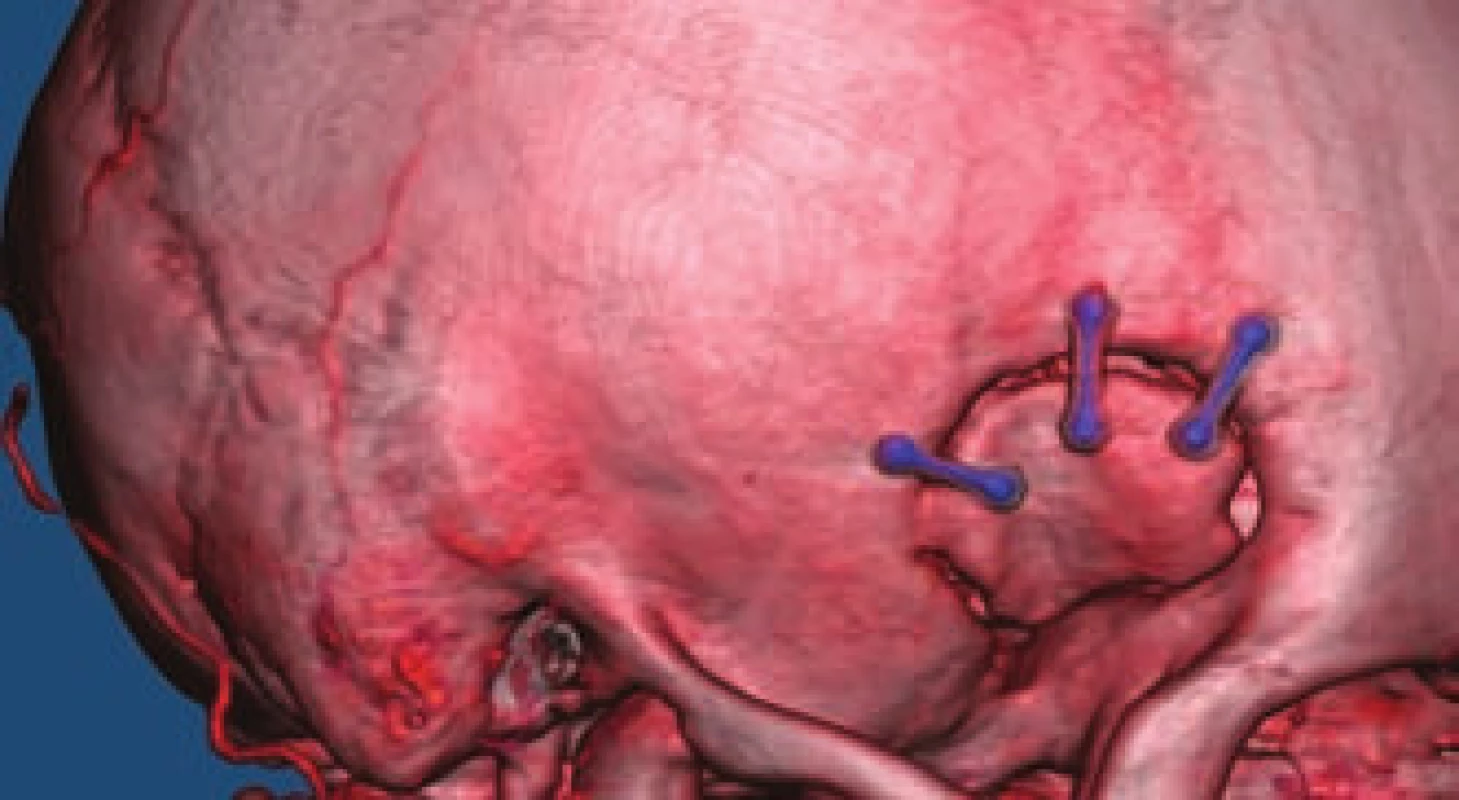
U výdutí distální arteria cerebri anterior (DACA) používáme interhemisférický přístup s aplikací obdobných zásad. Pro aneuryzmata zadní dolní mozečkové tepny (posterior inferior cerebellar artery; PICA) používáme standardně „far lateral“ přístup, pro komplexní výdutě přední cirkulace vzácně orbitozygomatický přístup.
Výsledkem šetrné mikrochirurgické preparace je ozřejmění krčku výdutě a nejlépe vypreparování celého vaku. Tím lze získat dokonalý přehled o anatomické situaci, zejména vztahu krčku výdutě k magistrálním tepnám a perforátorům. Pomocí aplikace dočasného klipu na přívodnou tepnu dosáhneme snížení plnění vaku krví, což umožňuje snadnější a bezpečnější manipulaci s vakem, jeho remodelaci bipolární koagulací a snazší aplikaci pilotního či trvalého klipu. V případě vydatné kolaterální cirkulace je třeba aplikovat dočasné klipy i na eferentní větve. Bezpečná doba dočasného clippingu je omezena řádově na několik min (dle lokalizace a stavu kolaterální cirkulace). Zásadou je zvýšit na tuto dobu krevní tlak na 120 % výchozího. Remodelace vaku znamená zmenšení velikosti a úpravu tvaru větších tenkostěnných vaků tepelným zkrácením elastických vláken ve stěně vaku působením bipolární koagulace. Vak je tak remodelován do zmenšené velikosti, což umožňuje bezpečnější aplikaci finálního klipu. Tzv. pilotní klipy znamenají aplikaci klipu, který výduť zcela neuzavírá, ale mění její tvar tak, aby umožnil snazší a bezpečnější aplikaci finálního klipu. Finální klip musí výduť uzavírat zcela bez reziduálního plnění či ponechání abnormální stěny mimo klip při zachování dostatečného průtoku jak v hlavních magistrálních tepnách, tak perforátorech. V řadě případů je třeba použít klipů více či použít klipy speciální (např. fenestrované).
Zásadní součástí mikrochirurgické léčby výdutí je možnost ověřit vyřazení vaku z oběhu a zejména verifikace průchodnosti souvisejících cév. Vyřazení výdutě je nejlépe ověřeno punkcí vaku. Tam, kde by byla punkce s případným krvácením riziková, lze použít peroperační videoangiografii. Zde však i přes nepřítomnost fluorescence vaku může docházet k jeho nevelkému plnění. Proto metoda není v tomto smyslu zcela spolehlivá. Nesmírně důležité je ověření dostatečného průtoku v souvisejících cévách. Základní metodou je zde peroperační videoangiografie (intravenózní aplikace fluorescenčního barviva indocyaninové zeleně [indocyanine green; ICG], jejíž intravaskulární náplň lze sledovat ve speciálním filtru operačního mikroskopu viz obr. 2). Její přínos je srovnatelný s peroperační katetrizační angiografií s řadou výhod – nulovou invazivitou, možností opakování vyšetření, vizualizací perforátorů. Limitace metody spočívá v tom, že můžeme ověřit pouze průchodnost cév patrných v přímém pohledu mikroskopu. Dále se nejedná o metodu kvantitativní a případné zúžení cévy a redukci průtoku nemusíme detekovat vůbec. Tohoto nedostatku se můžeme vyvarovat využitím flowmetrie, pomocí níž získáme kvantitativní informaci o průtoku i směru toku. Sonda je však relativně objemná a v některých případech ji nelze bezpečně aplikovat na vyšetřované cévy. Orientační informaci o toku krve cévami dává i mikrodopplerografie. V praxi se osvědčuje kombinace všech uvedených metod, u rizikových případů i v kombinaci s elektrofyziologickým monitoringem. Monitorací motorických, event. somatosenzorických evokovaných potenciálů jsme informováni o funkční integritě struktur, které jsou ohroženým povodím zásobovány.
Intravenózní aplikace adenozinu umožňuje krátkodobou (vteřiny až desítky vteřin trvající) reverzibilní extrémní bradykardii až zástavu srdeční činnosti s výrazným poklesem tlaku vedoucí k zástavě krvácení a kolapsu vaku výdutě. To může napomoci řešení krizové situace např. při peroperační ruptuře výdutě nebo usnadnit preparaci či aplikaci klipu tam, kde není možný dočasný clipping. Nevýhodou je nepredikovatelná délka „užitečné“ zástavy u konkrétního nemocného. Alternativou je metoda „rapid ventricular pacing“, kdy předem zavedenou stimulační kardiální elektrodou je navozena extrémní tachykardie s výrazným poklesem tlaku. Výhodou je možnost regulace doby arteriální hypotenze, nevýhodou nutnost předoperačního zavedení stimulační elektrody, což je nevhodné pro „neočekávané“ krizové situace [5].
U komplexních, zejména gigantických či fuziformních, výdutí je v některých případech třeba zvýšit („flow augmentation“) či nahradit („flow replacement“) průtok krve ohroženým řečištěm. K tomu se používají nízkoprůtokové a vysokoprůtokové bypassy přivádějící náhradní cestou krev do ohrože-ného řečiště.
Metodika
Tato retrospektivní studie zahrnuje všechny pacienty, kteří byli operováni na našem neurochirurgickém oddělení pro UIA v období od ledna 2008 do září 2017. Veškeré operace byly provedeny prvním a posledním autorem této práce. Do souboru jsou zařazeny i koincidentální výdutě, které byly řešeny odloženě a po stabilizaci neurologického stavu. Do souboru nejsou zařazeny gigantické výdutě vzhledem k tomu, že se jak rizikem krvácení, tak způsobem ošetření značně odlišují od běžných sakulárních výdutí.
U všech pacientů byla při klinickém vyšetření zjištěna demografická data, klinický stav, modifikovaná Rankinova škála (mRS), abúzus cigaret, přítomnost arteriální hypertenze, lokalizace, velikost a tvar výdutě (dle 3D DSA nebo 3D CTA). Velikost výdutě byla stanovena měřením největšího průměru výdutě.
Při všech operacích byla k dispozici ICG videoangiografie OPMI Pentero 800 (Carl Zeiss Meditec AG, Berlín, Německo) a u posledních 85 pacientů jsme mohli v případě potřeby použít UZ flowmetr HT 331 (Transonic System Inc, Ithaca, NY, USA). Při využití flowmetru jsme hodnotili jeho vliv na strategii klipování. Elektrofyziologický monitoring byl k dispozici dle volby operatéra. Ke klipování byly použity titanové mikrochirurgické klipy YASARGIL Aesculap Braun (Aesculap AG, Tuttlingen, Německo).
Po výkonu jsme sledovali pooperační průběh a komplikace, mortalitu a roční morbiditu (mRS > 2). Dále jsme zaznamenali jakékoliv zhoršení stavu související s operačním výkonem, které pacient či rodinní příslušníci udávali při roční kontrole.
Do jednoho roku po operaci proběhla kontrola vyřazení výdutě pomocí CTA (přístroj Toshiba Aquilion 64 CT scanner [Toshiba, Tokio, Japonsko], pracovní stanice Vitrea – softwarová verze 6.0 [Vital Images Inc., Minnetonka, MN, USA], display konzole softwarová verze V 4.62ER004) a hodnotili jsme event. rezidua vaku. Další kontrolní CTA byla provedena po 3–5 letech.
Výsledky
Za 9 let (2008–2016) bylo na našem neurochirurgickém oddělení operováno 146 pacientů pro 184 UIA. Většina z nich neměla subarachnoidální krvácení v anamnéze (130 pacientů). U zbylých 16 pacientů se jednalo o koincidentální nález po původně ošetřené jiné výduti po krvácení. Do analýzy souboru bylo možné započítat 145 pacientů, u kterých proběhla roční kontrola.
Věkový medián celého souboru byl 55 (31–72 let). Ženy převažovaly nad muži (2,5 : 1) . Kuřáci převažovali nad nekuřáky (3,1 : 1) a hypertoniků bylo více než normotoniků (2,1 : 1). Celkový průměrný follow-up pacientů byl 4,5 roku.
Převažovaly výdutě na ACM (n = 74; 40 %), dále ACoA (n = 42; 23 %), arteria communicans posterior (ACoP) (n = 19; 10 %) a arteria opthalamica (n = 19; 10 %) (obr. 6). Průměrná velikost výdutě u incidentálních byla 8 mm a u koincidentálních 5 mm (obr. 7). Výdutě pod 5 mm byly koincidentální nebo vícečetné, anebo byly přítomny rizikové faktory (např. ženy kuřačky, nepravidelný tvar) výdutě. Nepravidelný tvar či dceřiné vaky se vyskytovaly u 88 (49 %) výdutí.
Tab. 2. Lokalizace aneuryzmat.
ACA – arteria cerebri anterior; ACI – arteria carotis interna; ACM – arteria cerebri media; ACoA – arteria communicans anterior; ACoP – arteria communicans posterior; AChoA – arteria choroidea anterior; AOpth – arteria ophthalmica; DACA – distalní arteria cerebri anterior; PICA – arteria cerebelli posterior inferior
Fig. 6. Aneurysm localization.
ACA – arteria cerebri anterior; ACI – arteria carotis interna; ACM – arteria cerebri media; ACoA – arteria communicans anterior; ACoP – arteria communicans posterior; AChoA – arteria choroidea anterior; AOpth – arteria ophthalmica; DACA – distal arteria cerebri anterior; PICA – arteria cerebelli posterior inferior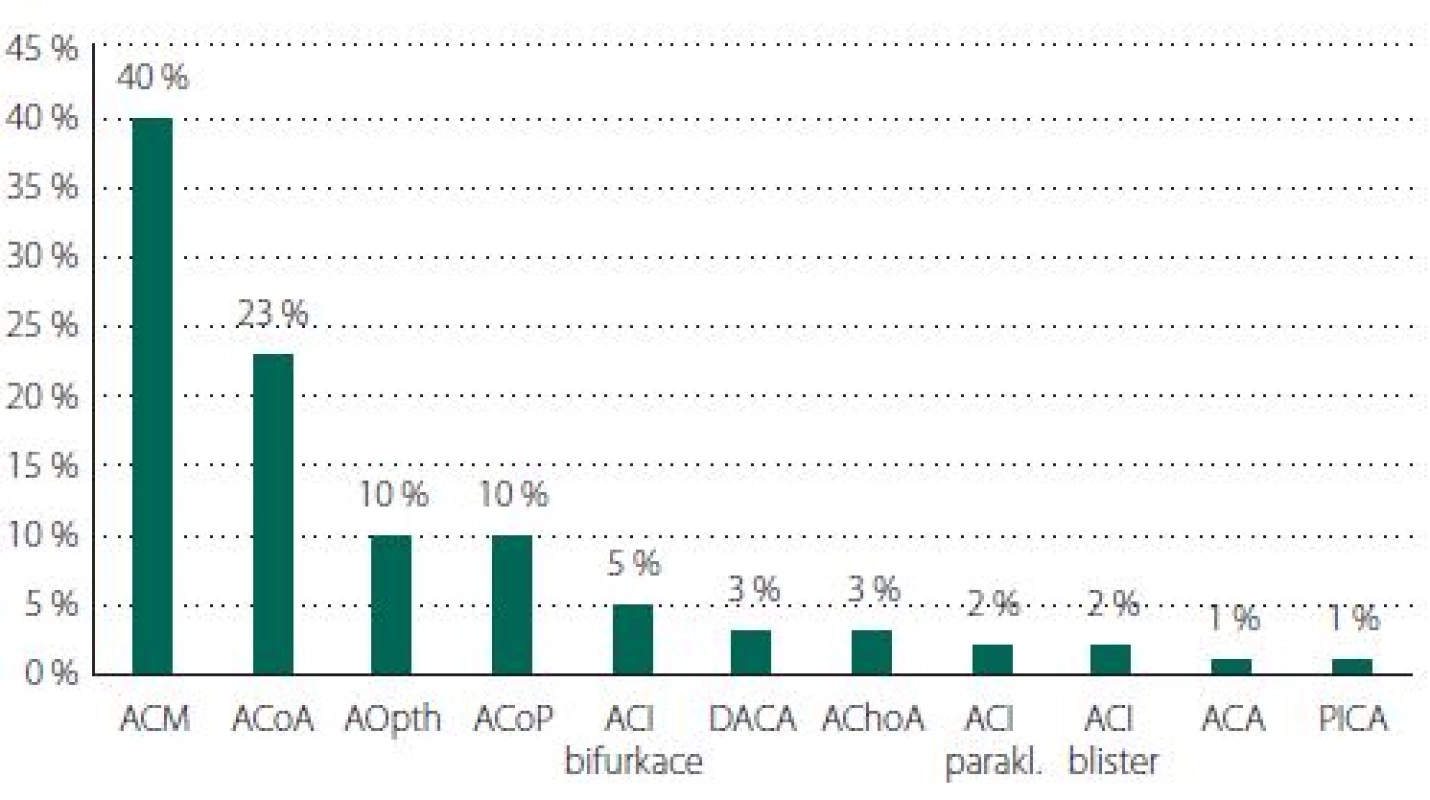
Obr. 5. Velikost aneuryzmat.
Fig. 7. Aneurysm size.
Vícečetné výdutě byly řešeny u 15 pacientů z jedné kraniotomie a u 10 pacientů ze dvou kraniotomií. Celkem bylo provedeno 156 kraniotomií pro celkový počet 184 UIA. Extradurální odbroušení předního klinoidního výběžku bylo provedeno u všech oftalmických a paraklinoidních výdutí, intradurální nebo extradurální parciální snesení klinoidu u 6 výdutí na ACoP.
V průběhu operací byl dočasný klip aplikován na přívodnou tepnu u 45 aneuryzmat (z toho 4× na krční ACI u výdutí oftalmických). Vak jsme remodelovali 22×.
ICG videoangiografii jsme použili k potvrzení vyřazení výdutě ve 151 případech. Osmkrát bylo prokázáno reziduální plnění s nutností přesunutí nebo doplnění další svorky či aplikace booster klipu pro nedovření původní svorky. Poruchu plnění odstupujících větví či perforátorů jsme pomocí ICG zaznamenali 5× s následným příznivým nálezem po přesazení svorky.
Elektrofyziologický monitoring jsme využili u 22 výdutí ACM. U jednoho pacienta došlo po aplikaci dočasného klipu na úsek M1 k poklesu evokovaných potenciálů s nutností povolení svorky a plné restituci potenciálů s příznivým klinickým nálezem. Naopak u pacienta s komplexní výdutí na bifurkaci ACM (s nízkoprůtokovým bypassem) došlo i přes normální nález na evokovaných potenciálech v průběhu výkonu k rozvoji symptomatické ischemie v oblasti bazálních ganglií rezultující v lehkou hemiparézu.
Flowmetr jsme využili z 85 výkonů pouze u 23 operací (18× ACM, 3× DACA, 1× PICA a 1× arteria ophthalmica). U tří výdutí ACM došlo po aplikaci klipu k poklesu hodnot o 25–50 % na jedné z větví M2. Po přesazení klipu byl průtok normalizován u dvou výdutí a u třetí se po uvolnění klipu průtoky nezměnily a zůstaly redukovány i po nové aplikaci svorky. U ostatních výdutí ACM a výdutí v jiných lokalizacích nedošlo ke změně průtoku. U všech pacientů, u kterých byl měřen průtok, nedošlo ke klinicky vyjádřené ischemické příhodě ani změně mRS.
Sto čtyřicet jedna (90 %) operací proběhlo bez pooperační komplikace s příznivým klinickým průběhem. Pooperační komplikace doprovázely 15 (10 %) kraniotomií, z nichž 9 (6 %) nemělo vliv na klinický stav pacienta rok po operaci (pneumonie 1×, chronický subdurální hematom 3×, likvorea 1×, léze n. III., zhoršení vizu 1×, ischemie 2×). Mortalita byla nulová. Při roční kontrole provedené u 145 pacientů mělo 5 (3,5 %) pacientů akcentaci neurologického nálezu ve srovnání s předoperačním stavem, z toho 2 (1,5 %) pacienti měli závažnou morbiditu (mRS > 2) (tab. 1). Roční kontrola neproběhla pouze u jednoho pacienta s příznivým pooperačním průběhem, který 10 měsíců po operaci zemřel z neznámých příčin (sekce nebyla na přání rodiny provedena). U tohoto pacienta neproběhla kontrolní CTA.
Tab. 3. Výsledky chirurgické léčby neprasklých intrakraniálních aneuryzmat. 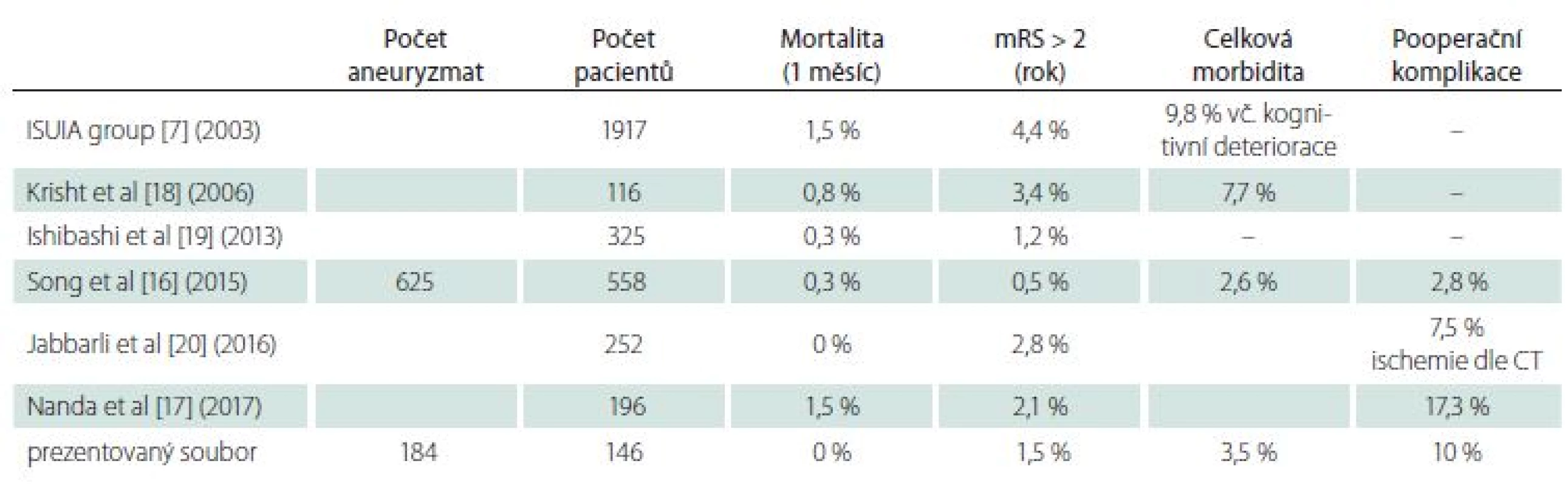
ISUIA – International Study of Unruptured Intracranial Aneurysms; mRS – modifi kovaná Rankinova škála Na kontrolní CTA bylo reziduální plnění vaku nalezeno u 1 (0,5 %) pacienta s výdutí na bifurkaci ACM. U 5 pacientů nebylo kontrolní vyšetření provedeno a u dalších 139 pacientů bylo prokázáno úplné vyřazení výdutě z cirkulace. Ani v jenom případě nedošlo k dislokaci použitých klipů. S odstupem 3–5 let proběhla další kontrolní CTA u 62 pacientů s identickým nálezem stran vyřazených výdutí. Pacient s neúplně vyřazenou výdutí má pravidelné dvouleté kontroly a reziduum se nezvětšuje.
Diskuze
Prevalence výskytu UIA v populaci je poměrně vysoká 2–3 % [6] a počet náhodně diagnostikovaných UIA roste s vyšším počtem prováděných MR a CT vyšetření. Stále častěji je tedy ošetřující lékař vystaven otázce dalšího postupu.
Primárně je potřeba posoudit riziko krvácení konkrétní UIA u daného pacienta. Riziko souvisí především s velikostí a lokalizací výdutě, je vyšší v případě předchozího krvácení z jiné výdutě, při vícečetném výskytu UIA, při přítomnosti dceřiných vaků nebo nepravidelném tvaru a při prokázaném růstu výdutě či výskytu výdutě se symptomatickým projevem. Riziko krvácení se zvyšuje též u kuřáků, hypertoniků, žen a starších pacientů. Na podkladě analýzy metodicky kvalitních prospektivních studií [7–9] navrhli Greving et al skórovací systém PHASES [1], který lze použít jako vodítko při stanovení ročního rizika ruptury. Toto riziko je pak třeba srovnat s rizikem ošetření konkrétní výdutě a samozřejmě s celkovým stavem pacienta (American Society of Anesthesiologist riziko; ASA riziko) a předpokládanou délkou života. Lze také použít poměrně komplikované matematické modely [10].
Dle posledního doporučení European Stroke Organisation [11] je vhodné u pacientů pod 60 let zvažovat řešení jakékoliv výdutě, u pacientů nad 60 let řešení výdutí, které jsou větší než 7 mm.
Druhou zásadní otázkou je, jakým způsobem UIA řešit. Zde se budeme zabývat výdutěmi předního povodí, neboť v zadním povodí jsou téměř vždy indikovány k endovaskulárnímu ošetření. Cílem ošetření by mělo být úplné vyřazení výdutě s minimální morbiditou. U krvácejících výdutí má chirurgické ošetření bezprostředně po výkonu i s roční latencí vyšší morbiditu [12] než endovaskulární metoda, avšak úplné vyřazení výdutě je trvalejší [3]. Pro ošetření UIA není k dispozici kvalitní prospektivní studie, ale z menších studií [13] a jejich metaanalýz [14] vyplývá četnější úplné vyřazení výdutě u klipované skupiny s obdobnou roční morbiditou. Zvláště je patrný rozdíl v kvalitě ošetření výdutě na ACM (úplné vyřazení UIA 97 % klip vs. 53 % coil) [15].
European Stroke Organisation Guidelines [11] neupřednostňují ani jednu z metod a zdůrazňují individuální přístup a zvážení rizikových faktorů každého jednotlivého pacienta (věk, kouření, předchozí subarachnoidální krvácení, lokalizace a velikost aneuryzmatu a riziko metody léčby pro konkrétní typ výdutě).
Srovnání jednotlivých publikovaných souborů chirurgicky ošetřených UIA (tab. 1) je obtížné především ze dvou důvodů.
Prvním je různá definice operační morbidity. Za nepříznivý neurologický výsledek je často paušálně považováno zhoršení neurologického stavu na mRS > 2. Takto velice hrubě definovaná morbidita nepostihuje celou řadu pacientů, u nichž dojde z důvodu operace k trvalému neurologickému deficitu (při zachování mRS < 2), a je přinejmenším sporné, zda operace byla pro ně prospěšná (zvláště u výdutí s nízkým rizikem ruptury). Na druhé straně stojí různé analýzy administrativních databází, které za morbiditu mohou považovat delší pobyt ve zdravotnickém zařízení bez zjištění její příčiny a o skutečné operační morbiditě nemusí vypovídat správně. V lépe zpracovaných souborech jsou uvedeny nejen výsledky zhoršení stavu na škále mRS nebo Glasgow Outcome Scale (GOS), ale i jakákoliv neurologická, interní či chirurgická komplikace operačního výkonu, která vede k prodloužení pobytu v nemocnici nebo k nutnosti operační revize. Některé soubory hodnotí kognitivní změny pomocí testu Mini Mental State Examination nebo detailněji pomocí neuropsychologických vyšetření. Z pohledu pacienta je dle nás zásadní, zda je rok po operaci jeho klinický stav ve srovnání s předoperačním stavem stejný nebo lepší, zda se mohl vrátit do předchozí životní aktivity a jestli má výduť plně vyřazenu z cirkulace. Škály mRS a GOS jsou z tohoto hlediska velmi hrubé a do trvalé morbidity je potřeba započítat jakýkoliv nově vzniklý i malý trvající deficit.
Druhým důvodem problematického srovnání souborů je různá skladba pacientů s odlišnou operační obtížností UIA.
V chirurgické podskupině (1 917 pacientů) multicentrické prospektivní studie ISUIA z roku 2003 byla měsíční mortalita 1,5 % a roční morbidita (mRS > 2) 4,4 % (při zahrnutí kognitivních deficitů pak 9,8 %) [7]. Lepších výsledků dosahovaly analýzy operovaných pacientů s UIA na jednotlivých pracovištích (tab. 1) [16–21]. Vynikající výsledky z jednoho centra publikovali korejští autoři na souboru 1 124 pacientů, kteří byli ošetřeni klipem nebo coilem (1 : 1) dle volby jednoho lékaře (provádějícího oba typy výkonů). Do celkové morbidity započítávali i pooperační komplikace, které nevedly ke zhoršení mRS (přechodná léze III. nervu, subdurální hematom, intracerebrální hematom, epileptický záchvat aj.). Chirurgická skupina s 558 pacienty měla celkovou morbiditu pouze 2,6 %. Roční morbidita s mRS > 2 byla 0,5 % a měsíční mortalita 0,3 % [16]. Endovaskulárně ošetřená skupina se signifikantně nelišila. Nutno zdůraznit, že více než 50 % výdutí bylo < 7 mm. Recentně publikovaný soubor autorů Nanda et al udává při 196 pacientech mortalitu 1,5 % a morbiditu 2,1 %, s pooperačními komplikacemi u 17,3 % pacientů. V tomto souboru byla většina výdutí větších než 1 cm [17]. Krisht et al dosáhli u 116 pacientů s většinou výdutí > 7 mm mortality 0,8 % a trvalé morbidity 3,4 % s přechodnou morbiditou 7,7 % [18]. V našem souboru operovaných pacientů jsme po roce vyšetřili 145 pacientů, z nichž 140 mělo roční kontrolní CTA. Pooperační časná morbidita byla 10 %, měsíční mortalita byla nulová a při roční kontrole měli 2 (1,5 %) pacienti nepříznivý výsledek (mRS > 2), při započtení jakéhokoli nově vzniklého deficitu jich bylo celkem 5 (3,5 %). První pacientkou s mRS > 2 je 62letá žena s komplexní 15mm výdutí na ACoA, kterou jsme indikovali primárně ke coilingu. Pro vysoké riziko endovaskulárního výkonu byl zvolen chirurgický přístup. Peroperačně došlo k ruptuře aneuryzmatu, klipem byl zúžen segment A2 (ICG +) a následně došlo k rozvoji ischemie v povodí ACA rezultující po roce v klinicky lehkou parézu dolní končetiny a organický psychosyndrom (mRS 3). Druhou pacientkou je 37letá žena, která při nálezu koincidentálního malého aneuryzmatu na bifurkaci ACM prodělala peroperačně rupturu z dosud neznámého blister aneuryzmatu na ACI s následným uzávěrem ACI a rezultujícím neurologickým deficitem (mRS 3). U dalších třech pacientů jsme po roce zaznamenali nový neurologický deficit v souvislosti s operačním výkonem (2× ACoA s výsledným psychomotorickým zpomalením a 1× lehká paréza po bypassu s trappingem u komplexní výdutě na ACM). Z 5 uvedených pacientů měli 3 pacienti výdutě na ACoA, které směrovaly nahoru nebo dozadu, a došlo u nich k poranění či uzávěru perforující tepny. U dvou z nich jsme primárně ve shodě se závěrem metanalýzy způsobu řešení UIA na ACoA [21] zvažovali endovaskulární ošetření, které však bylo pro vysoké riziko komplikace odmítnuto, a proto byl zvolen chirurgický postup.
V našem souboru bylo dosaženo úplného vyřazení výdutě u 99 % pacientů. Toto číslo je vyšší než běžně udávaných 90–95 % [16] a je nejspíše nadhodnoceno možnou nepřesností kontrolních CTA, které i přes využití vysoce kvalitního přístroje a softwaru nedosahují stejné přesnosti jako v publikovaných souborech prováděná DSA. CTA však přináší nesporné výhody, a to především svou neinvazivností, a tedy snadnou opakovatelností a možností předoperačního posouzení vztahu aneuryzmatu k bazi lební, které DSA nenabízí. Pooperační kontrola s titanovými klipy je zatížena jistou mírou artefaktů, které lze však správným nastavením, event. využitím softwaru na redukci metalických artefaktů výrazně snížilt a dosáhnout tak vysoké kvality vyšetření [22–24]. Přesto CTA může i přes eliminaci artefaktů zvláště při užití více klipů minout drobná rezidua a lze předpokládat, že se tak mohlo stát i v našem souboru. Na CTA kontrolách po 4 letech jsme však nenašli změnu ve srovnání s roční kontrolou, což znamená, že se ani nezvětšila potenciální rezidua a ani se neobjevily nové výdutě.
Závěr
Mikrochirurgické řešení nekrvácejících výdutí s využitím moderních možností neurochirurgie umožnuje dosáhnout u většiny nemocných trvalé vyřazení výdutě z cirkulace při minimální morbiditě. Většinu výdutí lze ošetřit z malého minipterionálního přístupu s šetrnou bezretrakční intrakraniální dissekcí. Léčba se tak stává pro nemocné méně invazivní a je dobře tolerována.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Práce vznikla za podpory MZ ČR – RVO (Nemocnice Na Homolce – NNH, 00023884), IG141101.
Přijato k recenzi: 6. 11. 2018
Přijato do tisku: 22. 1. 2019
MUDr. Jan Šroubek
Neurochirurgické oddělení
Nemocnice Na Homolce
Roentgenova 37/2
150 30 Praha
e-mail: jan.sroubek@homolka.cz
Zdroje
1. Greving JP, Wermer MJ, Brown RD Jr et al. Development of the PHASES score for prediction of risk of rupture of intracranial aneurysms: a pooled analysis of six prospective cohort studies. Lancet Neurol 2014; 13(1): 59–66. doi: 10.1016/ S1474-4422(13)70263-1.
2. Etminan N, Brown RD Jr, Beseoglu K et al. The unruptured intracranial aneurysm treatment score: a multidisciplinary consensus. Neurology 2015; 85(10): 881–889. doi: 10.1212/ WNL.0000000000001891.
3. Spetzler RF, Zabramski JM, McDougall CG et al. Analysis of saccular aneurysms in the Barrow Ruptured Aneurysm Trial. J Neurosurg 2018; 128(1): 120–125. doi: 10.3171/ 2016.9.JNS161301.
4. Sun H, Safavi-Abbasi S, Spetzler RF. Retractorless surgery for intracranial aneurysms. J Neurosurg Sci 2016; 60(1): 54–69.
5. Konczalla J, Platz J, Fichtlscherer S et al. Rapid ventricular pacing for clip reconstruction of complex unruptured intracranial aneurysms: results of an interdisciplinary prospective trial. J Neurosurg 2018; 128(6): 1741–1752. doi: 10.3171/ 2016.11.JNS161420.
6. Vlak MH, Algra A, Brandenburg R et al. Prevalence of unruptured intracranial aneurysms, with emphasis on sex, age, comorbidity, country, and time period: a systematic review and meta-analysis. Lancet Neurol 2011; 10(7): 626–636. doi: 10.1016/ S1474-4422(11)70109-0.
7. Wiebers DO, Whisnant JP, Huston J et al. International Study of Unruptured Intracranial Aneurysms Investigators. Unruptured Intracranial Aneurysms: Natural History, Clinical Outcome, and Risks of Surgical and Endovascular Treatment. Lancet 2003; 362(9378): 103–110.
8. UCAS Japan Investigators, Morita A, Kirino T et al. The natural course of unruptured cerebral aneurysms in a Japanese cohort. N Engl J Med 2012; 366(26): 2474–2482. doi: 10.1056/ NEJMoa1113260.
9. Juvela S, Poussa K, Lehto H et al. Natural history of unruptured intracranial aneurysms: a long-term follow-up study. Stroke 2013; 44(9): 2414–2421. doi: 10.1161/ STROKEAHA.113.001838.
10. Beneš V, Suchomel P. Mozková aneurysmata a subarachnoidální krvácení. Praha: Mladá Fronta 2017 : 166–167.
11. Steiner T, Juvela S, Unterberg A et al. European Stroke Organisation Guidelines for the management of intracranial aneurysms and subarachnoid haemorrhage. Cerebrovasc Dis 2013; 35(2): 93–112. doi: 10.1159/ 000346087.
12. Molyneux AJ, Kerr RS, Yu LM et al. International Subarachnoid Aneurysm Trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: a randomised comparison of effects on survival, dependency, seizures, rebleeding, subgroups, and aneurysm occlusion. Lancet 2005; 366(9488): 809–817.
13. Darsaut TE, Findlay JM, Magro E et al. Surgical clipping or endovascular coiling for unruptured intracranial aneurysms: a pragmatic randomised trial. J Neurol Neurosurg Psychiatry 2017; 88(8): 663–668. doi: 10.1136/ jnnp-2016-315433.
14. Ruan C, Long H, Sun H et al. Endovascular coiling vs. surgical clipping for unruptured intracranial aneurysm: a meta-analysis. Br J Neurosurg 2015; 29(4): 485–492. doi: 10.3109/ 02688697.2015.1023771.
15. Smith TR, Cote DJ, Dasenbrock HH et al. Comparison of the efficacy and safety of endovascular coiling versus microsurgical clipping for unruptured middle cerebral artery aneurysms: a systematic review and meta-analysis. World Neurosurg 2015; 84(4): 942–953. doi: 10.1016/ j.wneu.2015.05.073.
16. Song J, Kim BS, Shin YS. Treatment outcomes of unruptured intracranial aneurysm; experience of 1,231 consecutive aneurysms. Acta Neurochir (Wien) 2015; 157(8): 1303–1311. doi: 10.1007/ s00701-015-2460-2.
17. Nanda A, Patra DP, Bir SC et al. Microsurgical clipping of unruptured intracranial aneurysms: a single surgeon‘s experience over 16 years. World Neurosurg 2017; 100 : 85–99. doi: 10.1016/ j.wneu.2016.12.099.
18. Krisht AF, Gomez J, Partington S. et al. Outcome of surgical clipping of unruptured aneurysms as it compares with a 10-year nonclipping survival period. Neurosurgery 2006; 58(2): 207–216.
19. Ishibashi T, Murayama Y, Saguchi T et al. Justification of unruptured intracranial aneurysm repair: a single--center experience. AJNR Am J Neuroradiol 2013; 34(8): 1600–1605. doi: 10.3174/ ajnr.A3470.
20. Jabbarli R, Wrede KH, Pierscianek D et al. Outcome after clipping of unruptured intracranial aneurysms depends on caseload. World Neurosurg 2016; 89 : 666–671. doi: 10.1016/ j.wneu.2015.12.043
21. O‘Neill AH, Chandra RV, Lai LT. Safety and effectiveness of microsurgical clipping, endovascular coiling, and stent assisted coiling for unruptured anterior communicating artery aneurysms: a systematic analysis of observational studies. J Neurointerv Surg 2017; 9(8): 761–765. doi: 10.1136/ neurintsurg-2016-012629.
22. Dunet V, Bernasconi M, Hajdu SD et al. Impact of metal artifact reduction software on image quality of gemstone spectral imaging dual-energy cerebral CT angiography after intracranial aneurysm clipping. Neuroradiology 2017; 59(9): 845–852. doi: 10.1007/ s00234-017-1871-6.
23. Kimura Y, Mikami T, Miyata K et al. Vascular assessment after clipping surgery using four-dimensional CT angiography. Neurosurg Rev 2019; 42(1): 107–114. doi: 10.1007/ s10143-018-0962-0.
24. Mamourian AC, Pluta DJ, Eskey CJ et al. Optimizing computed tomography to reduce artifacts from titanium aneurysm clips: an in vitro study. Technical note. J Neurosurg 2007; 107(6): 1238–1243.Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2019 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Intradurálne extramedulárne nádory chrbtice
- Roztroušená skleróza mozkomíšní, úloha střevní mikrobioty v poškozujícím zánětu
- Genetické a neurobiologické aspekty komorbidního výskytu poruch autistického spektra a epilepsie
- Roztroušená skleróza a těhotenství z pohledu gynekologa – možnosti asistované reprodukce
- Roztroušená skleróza mozkomíšní, těhotenství, mateřství a kojení
- Hraje leptin roli v rozvoji intrakraniálních meningeomů?
- Srovnávací studie pacientů s myastenií České a Slovenské republiky
- Moderní mikrochirurgie jako trvalé, bezpečné a šetrné řešení nekrvácejících mozkových výdutí
- Explantace stimulátoru nervus vagus odpovídající protokolu vyšetření magnetickou rezonancí
- Obecné pohyby a neurologický vývoj raného věku u dětí s novorozeneckou hypoglykemií
- Srovnání kosmetického efektu krátkého podélného a příčného kožního řezu při karotické endarterektomii
- Změny v obsahu esenciálních a stopových prvků v lidských degenerujících meziobratlových ploténkách nekorespondují s klinickým stavem pacientů
- Jak náhrada extracelulárního sodíku ovlivňuje distribuci rychlosti vedení periferním nervem u krysy
- Rychlá diagnostika chemokinu CXCL13 v mozkomíšním moku u pacientů s neuroboreliózou
- Aneuryzmatické subarachoidální krvácení v těhotenství – úspěšný kliping po selhání koilingu
- Extra-intrakraniální bypass iniciovaný rehabilitačním lékařem pro kognitivní deterioraci
- Traumatické pseudoaneuryzma arterie temporalis superficialis
- Klíšťová meningitida komplikovaná kardioembolickým intraluminálním trombem v krkavici a mozkovou mrtvicí
- Genetika nervosvalových onemocnění
- Analýza dat v neurologii LXXIV. - Neparametrický Spearmanův koeficient korelace
- Recenze knih
- Doc. Vladimír Škorpil, 100 let od narození zakladatele naší elektromyografie
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Intradurálne extramedulárne nádory chrbtice
- Rychlá diagnostika chemokinu CXCL13 v mozkomíšním moku u pacientů s neuroboreliózou
- Genetika nervosvalových onemocnění
- Roztroušená skleróza a těhotenství z pohledu gynekologa – možnosti asistované reprodukce
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



