-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Klinický přínos radiologických parametrů u lumbální spinální stenózy
Clinical Importance of Radiological Parameters in Lumbar Spinal Stenosis
The relationship between radiological findings (severity of radiological stenosis) and clinical manifestations in lumbar spinal stenosis (LSS) is unclear. The aim of the present study was to point out the discrepancy between radiological and clinical findings in LSS and high prevalence of asymptomatic lumbar stenosis, to evaluate the clinical importance of radiological parameters in diagnostics of LSS and to mention new radiological trends in LSS. According to published studies, LSS is a clinical and radiological syndrome with complex relationships between radiological findings and clinical manifestations. There is a high prevalence of radiological LSS including asymptomatic forms in the general population. Based on experts consensus, five core radiological qualitative parameters have been defined as a minimum standard in a radiological report describing LSS in routine clinical practice. Evaluation of these core radiological parameters is simple with high reproducibility and they describe nerve structures compression in lumbar spinal canal better than isolated quantitative radiological parameters. Magnetic resonance diffusion tensor imaging is a new trend in radiological diagnostics of LSS.
Key words:
lumbar spine – lumbar spinal stenosis – magnetic resonance imaging – diffusion tensor imaging
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: E. Kalíková 1; B. Adamová 1; M. Keřkovský 2; J. Bednařík 1
Působiště autorů: LF MU a FN Brno Neurologická klinika 1; LF MU a FN Brno Radiologická klinika 2
Vyšlo v časopise: Cesk Slov Neurol N 2017; 80/113(4): 400-407
Kategorie: Přehledný referát
doi: https://doi.org/10.14735/amcsnn2017400Souhrn
Vztah mezi radiologickými nálezy (tíží radiologické stenózy) a klinickou manifestací u lumbální spinální stenózy (LSS) je stále nejasný. Cílem práce je upozornit na diskrepanci radiologických a klinických nálezů u LSS a na častý výskyt asymptomatické stenózy, stanovit klinický přínos radiologických parametrů při hodnocení LSS a zmínit se o nových trendech v radiologické diagnostice LSS. Z publikovaných studií vyplývá, že LSS je klinicko-radiologický syndrom s komplexním vztahem mezi radiologickými nálezy a klinickou manifestací. V běžné populaci je častý výskyt radiologické LSS vč. asymptomatických forem. Na základě konsenzu expertů bylo definováno pět základních radiologických kvalitativních parametrů, které jsou doporučeny jako minimální standard při popisu radiologických nálezů u LSS v běžné klinické praxi. Stanovení těchto parametrů je jednoduché, jsou dobře reprodukovatelné a lépe vyjadřují kompresi nervových struktur v páteřním kanálu ve srovnání s izolovanými kvantitativními radiologickými parametry. Mezi nové trendy v diagnostice LSS patří zejména využití zobrazení tenzorů difuze magnetickou rezonancí.
Klíčová slova:
bederní páteř – lumbální spinální stenóza – magnetická rezonance – zobrazení tenzorů difuzeÚvod
Definice pojmu lumbální spinální stenóza (LSS) není stále jednotná. Tento pojem může být používán pro označení radiologických změn bez ohledu na klinickou manifestaci nebo ho lze chápat jako klinický syndrom, jehož příčinou je úzký páteřní kanál v bederní oblasti. Degenerativní LSS je nejnověji definována jako onemocnění, které se vyznačuje zmenšením prostoru pro nervové a cévní struktury v bederní páteři na podkladě degenerativních změn v páteřním kanále. Pokud je symptomatická, vede k různým klinickým syndromům vyznačujícím se bolestí a/ nebo únavností v hýždi a/ nebo v dolní končetině, které se mohou vyskytnout s bolestí nebo bez bolesti v zádech. Pro symptomatickou LSS jsou charakteristické určité provokační a úlevové faktory. Provokační faktory zahrnují vzpřímení, jako je chůze nebo stoj, které indukují neurogenní klaudikace. Mezi úlevové faktory patří předklon, sed a/ nebo ulehnutí [1]. Tato komplexní definice, která byla vytvořena Severoamerickou spinální společností, považuje LSS za klinicko-radiologický syndrom. Lze tedy shrnout, že termín LSS se nověji doporučuje používat pro označení symptomů, které jsou spojeny se zmenšením velikosti lumbálního páteřního kanálu [2]. Za situace, kdy popisujeme pouze patologicko-anatomické nálezy způsobující zúžení páteřního kanálu, je doporučováno používat termín radiologická či anatomická LSS, která může být klinicky symptomatická nebo asymptomatická [3]. Někteří autoři dále navrhují používat termín „úzký páteřní kanál“ za situace, kdy je páteřní kanál zúžen, ale postižení se klinicky nemanifestuje [4].
Z hlediska anatomického může stenóza postihnout centrální páteřní kanál, laterální recesus nebo foramen. Zúžení centrálního páteřního kanálu, který obsahuje durální vak s nervovými kořeny kaudy equiny, bývá asociováno s neurogenními klaudikacemi. Radikulární syndrom bývá projevem stenózy laterálního recesu či foramen [3].
V diagnostice LSS je stále řada nejasností, které vyplývají zejména ze složitého vztahu mezi radiologickým nálezem (tíží zúžení páteřního kanálu) a klinickou manifestací. V běžné klinické praxi se můžeme setkat s tím, že výrazné zúžení páteřního kanálu může být klinicky němé nebo může vést jen k lehkým symptomům. Tuto skutečnost si musíme uvědomit při rozhodování, zda zjištěný radiologický nález je skutečně příčinou potíží pacienta (abychom neoperovali asymptomatické zúžení páteřního kanálu). Také může být obtížné rozhodnout, zda u pacientů s klinicky manifestní LSS při volbě dalšího terapeutického postupu (konzervativní vs. operační řešení) zohlednit spíše tíži radiologických změn či stupeň klinických potíží, které navzájem nemusí korelovat. Stále přetrvává nejednotnost v tom, který z radiologických parametrů vyjadřující zúžení páteřního kanálu je klinicky nejpřínosnější.
Cílem práce je upozornit na diskrepanci radiologických a klinických nálezů u LSS a na častý výskyt asymptomatického zúžení páteřního kanálu v bederní oblasti a stanovit klinický přínos radiologických parametrů při hodnocení LSS. Dále uvádíme nové trendy v radiologické diagnostice LSS.
Výskyt asymptomatického zúžení páteřního kanálu v bederní oblasti
Poměrně často se můžeme setkat se situací, že radiologicky prokázané zúžení páteřního kanálu v bederní oblasti je asymptomatické. Boden et al popsali signifikantní centrální stenózu na magnetické rezonanci (MR) u 21 % asymptomatických jedinců starších 60 let [5]. Tong et al udávají ještě vyšší výskyt centrální stenózy u asymptomatických osob nad 55 let věku – alespoň lehkou stenózu přítomnou nejméně v jedné etáži mělo 72,8 % osob, alespoň střední stenóza byla prokázána u 30,3 % osob a těžká centrální stenóza u 6,1 % osob [6]. Tíže stenózy byla v této studii hodnocena subjektivně neuroradiologem a byly vytvořeny čtyři stupně (normální nález, lehká stenóza, střední stenóza, těžká stenóza).
Rovněž japonští autoři ve své studii provedené na 938 účastnících potvrdili vysoký výskyt asymptomatické centrální stenózy v běžné japonské populaci nad 40 let věku; střední asymptomatickou stenózu vykazovalo 42,9 % populace, těžká asymptomatická stenóza byla prokázána u 25 % populace [7]. V této studii byla střední centrální stenóza definována jako zmenšení normální plochy centrálního páteřního kanálu o jednu až dvě třetiny, těžká stenóza jako zmenšení normální plochy o více než 2/3.
Epidemiologických studií zabývajících se výskytem radiologické LSS v populaci je relativně málo a jejich výsledky nejsou zcela shodné. Prevalence radiologické stenózy vč. asymptomatických forem je v populaci častá, roste s věkem a není popisován signifikantní rozdíl mezi oběma pohlavími [7,8]. Běžné radiologické vyšetření MR neodliší klinicky symptomatickou a asymptomatickou LSS [9,10].
Vztah radiologických nálezů a tíže klinického postižení u pacientů s LSS
Asociace radiologické stenózy a klinických symptomů je ve studiích řešena poměrně často, ale závěry nejsou jednotné (tab. 1). Výsledky řady studií poukazují na diskrepanci mezi velikostí lumbálního kanálu a klinickými symptomy u pacientů s klinickou diagnózou LSS [11 – 21]. Na druhé straně Ogikubo et al dospěli k závěru (úroveň evidence III), že minimální plocha durálního vaku koreluje s bolestmi zad a dolních končetin, s ušlou vzdáleností a kvalitou života u pacientů s centrální spinální stenózou [22]. Jiní autoři popisují signifikantní korelaci mezi disabilitou vyjádřenou pomocí Oswestry dotazníku a přítomností víceetážové stenózy, nicméně neprokázali signifikantní korelaci mezi disabilitou, bolestí zad a dolních končetin, kvalitou života, kvalitou spánku a minimální plochou durálního vaku [23]. Další studie popisuje korelaci disability vyjádřené pomocí Oswestryho dotazníku s plochou a tloušťkou ligamenta flava a korelaci ušlé vzdálenosti s plochou durálního vaku a páteřního kanálu [24].
Tab. 1. Výsledky studií korelující radiologické nálezy a klinické symptomy u pacientů s LSS. 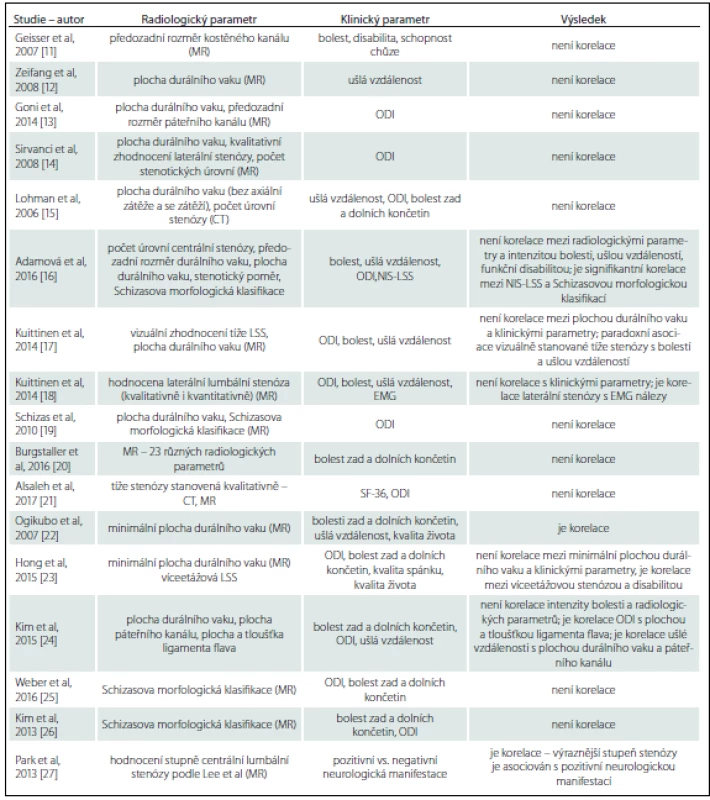
CT – počítačová tomografie; Dotazník SF-36 – dotazník short form 36 – dotazník o kvalitě života; MR – magnetická rezonance; NIS-LSS – skóreneurologického postižení u lumbální spinální stenózy; ODI – swestry dotazník (Oswestry Disability Index) – skóre disability. Za účelem vylepšit a zjednodušit dostupná radiologická kritéria pro LSS byly nově vytvořeny morfologické klasifikační systémy, které jsou založeny na hodnocení množství likvoru kolem nervových kořenů a míry komprese nervových kořenů v durálním vaku [19,28]. Schizas et al definovali sedmistupňovou kvalitativní klasifikaci, durální vak se hodnotí na T2 vážených transverzálních obrazech a posuzuje se poměr obsahu mozkomíšního moku a nervových kořenů v bederní oblasti páteře. Bylo definováno sedm typů (stupňů) nálezů (A1, A2, A3, A4, B, C, D), přičemž stupeň A odpovídá žádné nebo malé stenóze, stupeň B střední stenóze, stupeň C těžké stenóze a stupeň D extrémní stenóze [19,29]. Lee et al vytvořili klasifikační systém, který je založen na hodnocení obliterace předního likvorového prostoru (likvorový prostor před vlákny kaudy equiny) a na stupni separace vláken kaudy equiny na T2 vážených transverzálních obrazech (tab. 2) [28]. Pokud použijeme tato morfologická kritéria ke zhodnocení tíže centrální radiologické stenózy a korelujeme je s klinickými parametry, tak dostáváme opět nejednotné výsledky. Nebyla prokázána korelace mezi morfologickým stupněm stenózy hodnocené pomocí Schizasovy klasifikace a disabilitou, intenzitou bolesti a ušlou vzdáleností, byla však nalezena korelace se stupněm neurologického postižení na DKK (vyjádřeno pomocí skóre neurologického postižení u LSS) [16,19,20,25,26]. Rovněž Park et al prokázali asociaci mezi morfologickým stupněm stenózy a neurologickou manifestací LSS [27].
Tab. 2. Morfologická klasifikace dle Lee et al [28]. ![Morfologická klasifikace dle Lee et al [28].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/e06fcc51bff657baa648f1d4523595a7.png)
Ve studii, kde tíže stenózy byla hodnocena pomocí Schizasovy morfologické klasifikace, bylo prokázáno, že stupeň stenózy C a D (tedy výrazná komprese nervových struktur) je spojen s rizikem neúspěšné konzervativní léčby, zatímco pacienti se stupněm stenózy A a B pravděpodobněji nebudou vyžadovat operaci. Ukazuje se tedy, že morfologie durálního vaku může mít určitou prognostickou hodnotu [19].
Příčiny diskrepance mezi radiologickými a klinickými nálezy u LSS
Důvodů pro diskrepanci radiologických a klinických parametrů u pacientů s LSS je řada. Patří sem nevhodný výběr hodnocených radiologických a klinických parametrů. Při posuzování centrální stenózy se jeví výhodnější klasifikovat morfologii durálního vaku, která lépe odráží kompresi vláken kaudy equiny, než hodnotit izolované kvantitativní radiologické parametry (předozadní průměr či plocha páteřního kanálu nebo durálního vaku). To se promítá i do běžné praxe; spinální chirurgové se při rozhodování o terapii pacientů s LSS opírají především o morfologický vzhled durálního vaku a nikoliv o izolované kvantitativní parametry (plocha durálního vaku) [30]. Z klinických parametrů je rovněž přínosnější posuzovat komplexní parametr, např. tíži neurologického deficitu na DKK, ve srovnání s izolovanými klinickými parametry (bolest, ušlá vzdálenost), které navíc mohou být ovlivněny i různými faktory, jako je aktuální užívání analgetik či přítomnost deprese.
Dále se předpokládá, že úzký páteřní kanál je jen jeden z faktorů v patogenezi neurogenních klaudikací, kde se uplatňují i další mechanizmy vč. adaptace, které mohou vést ke spontánnímu zmírnění bolesti [17]. V jedné studii bylo zjištěno, že pacienti se střední stenózou měli větší bolesti a ušli signifikantně kratší vzdálenost ve srovnání s pacienty s těžkou stenózou. Možným vysvětlením tohoto paradoxního nálezu může být to, že při pokročilé hypertrofii facetových kloubů a pokročilých osteofytech se sníží instabilita bederní páteře. Autoři pak uzavírají, že pokročilé degenerativní změny mohou mít potenciálně protektivní mechanizmus [17].
Důležitý patofyziologický mechanizmus, který způsobuje neurogenní klaudikace, je intermitentní hypoxie vláken kaudy equiny na podkladě venózní kongesce a nedostatečné arteriální vazodilace [31]. Stanovit a kvantifikovat venózní kongesci na MR je však obtížné.
Anatomické poměry v páteřním kanále se mění při vzpřímené poloze, ve které dominují klinické potíže. Rutinní MR se ovšem provádí vleže na zádech a nehodnotí dynamický aspekt LSS. Lohman et al měřili plochu durálního vaku bez axiální zátěže a s axiální zátěží, která simulovala podmínky v páteři při vzpřímené pozici. Došlo k signifikantní změně plochy durálního vaku při axiální zátěži, nicméně signifikantní korelace s klinickými symptomy opět nebyla prokázána [15].
Diskrepance mezi radiologickými nálezy a klinickými symptomy může být ovlivněna též individuální senzitivitou pro bolest. Kim et al prokázali, že senzitivita pro bolest stanovená pomocí dotazníků je jeden z faktorů ovlivňujících tíži symptomů u pacientů s LSS [26].
Vytipování nejpřínosnějších radiologických parametrů popisujících LSS
Pro hodnocení radiologické stenózy je k dispozici řada parametrů. Tradičně jsou to kvantitativní parametry, které vyjadřují rozměr páteřního kanálu. Mezi nejčastěji používané patří předozadní průměr kostěného páteřního kanálu či durálního vaku, příčná plocha durálního vaku, hloubka, výška či úhel laterálního recesu, průměr foramina [29,32 – 34]. V tab. 3 jsou tyto kvantitativní parametry uvedeny spolu s hraničními hodnotami pro definici stenózy. Nevýhodou těchto kvantitativních parametrů je nedostatečná standardizace, nejednotné normy, časově náročnější hodnocení, výraznější zatížení technickými chybami, větší intra - i interindividuální variabilita [33,35]. Z těchto důvodů řada autorů začala používat pro zhodnocení tíže radiologické stenózy semikvantitativní nebo kvalitativní kritéria [35]. Za účelem sjednocení popisů radiologických nálezů u pacientů s LSS a zlepšení komunikace mezi odborníky zabývajících se touto problematikou bylo na základě konsenzu expertů vytipováno pět základních radiologických parametrů nejvhodnějších pro standardní klinické použití [32]. Přehled těchto parametrů je uveden v tab. 4, obr. 1 – 4 zachycují MR obrazy LSS se zhodnocením základních radiologických parametrů. Je zde patrné, že pro standardní klinické použití ke zhodnocení stenózy centrálního kanálu, laterálního recesu i foramina byly vytipovány pouze kvalitativní parametry. Intra - i interindividuální shoda těchto základních kvalitativních radiologických parametrů byla stanovena jako dobrá až výborná [39].
Tab. 3. Přehled nejpřínosnějších kvantitativních parametrů při vyšetření MR popisujících stenózu páteřního kanálu s definovanými hraničními hodnotami [32–34]. ![Přehled nejpřínosnějších kvantitativních parametrů při vyšetření MR popisujících stenózu páteřního kanálu s definovanými hraničními hodnotami [32–34].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/77988575f68ccfe41c9eecfb863d3956.png)
Tab. 4. Přehled základních radiologických parametrů, které byly vytipovány jako minimální standard pro strukturovaný radiologický nález u pacientů s LSS (převzato z práce Andreisek et al [32]). ![Přehled základních radiologických parametrů, které byly vytipovány jako minimální standard pro strukturovaný radiologický nález u pacientů s LSS (převzato z práce Andreisek et al [32]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/57e1134861583bb67335991443ab6d27.png)
a Na základě tíže omezení jsou defi novány tyto stupně: bez stenózy; lehká stenóza (omezení normální velikosti o méně než 1/3); střední stenóza (omezení normální velikosti o více než 1/3 a méně než 2/3); těžká stenóza (omezení normální velikosti o více než 2/3). b Škála má čtyři stupně podle tíže útlaku. Obr. 1. MR vyšetření bederní páteře u pacientky s víceetážovou stenózou páteřního kanálu převážně centrálního typu, tíže stenózy hodnocena dle Schizase et al a dle Lurie et al [19,36]. Obr. 1a) T2 zobrazení v sagitální rovině. Obr. 1b) T2 zobrazení v transverzální rovině v úrovni maxima stenózy v etáži L4–L5; stupeň stenózy C dle Schizase, těžká stenóza dle Lurie (redukce plochy centrálního páteřního kanálu o více než 2/3 normální velikosti). Obr. 1c) T2 zobrazení v transverzální rovině – méně závažné zúžení páteřního kanálu v etáži L3–L4, stupeň stenózy B dle Schizase, střední stenóza dle Lurie (redukce plochy centrálního páteřního kanálu v rozmezí 1/3 až 2/3 normální velikosti). Fig. 1. MRI examination of the lumbar spine in a patient with predominantly central type of multi-segmental spinal canal narrowing, severity of stenosis is classified according to Schizas et al. and Lurie et al. [19, 36]. Fig. 1a) T2-weighted image in the sagittal plane. Fig. 1b) T2-weighted image in the axial plane at the level of maximal spinal stenosis (L4–L5); grade C stenosis according to Schizas; severe stenosis according to Lurie (compromise of the spinal canal area > 2/3 of normal size). Fig. 1c) T2-weighted image in the axial plane – relatively less severe narrowing of the spinal canal at L3–L4 level; grade B stenosis according to Schizas, moderate stenosis according to Lurie (compromise of the spinal canal area between 1/3 and 2/3 of normal size). ![MR vyšetření bederní páteře u pacientky s víceetážovou stenózou páteřního kanálu převážně centrálního typu, tíže stenózy hodnocena dle Schizase et al a dle Lurie et al [19,36].
Obr. 1a) T2 zobrazení v sagitální rovině.
Obr. 1b) T2 zobrazení v transverzální rovině v úrovni maxima stenózy v etáži L4–L5; stupeň stenózy C dle Schizase, těžká stenóza dle Lurie (redukce plochy centrálního páteřního kanálu o více než 2/3 normální velikosti).
Obr. 1c) T2 zobrazení v transverzální rovině – méně závažné zúžení páteřního kanálu v etáži L3–L4, stupeň stenózy B dle Schizase, střední stenóza dle Lurie (redukce plochy centrálního páteřního kanálu v rozmezí 1/3 až 2/3 normální velikosti).
Fig. 1. MRI examination of the lumbar spine in a patient with predominantly central type of multi-segmental spinal canal narrowing, severity of stenosis is classified according to Schizas et al. and Lurie et al. [19, 36].
Fig. 1a) T2-weighted image in the sagittal plane.
Fig. 1b) T2-weighted image in the axial plane at the level of maximal spinal stenosis (L4–L5); grade C stenosis according to Schizas; severe stenosis according to Lurie (compromise of the spinal canal area > 2/3 of normal size).
Fig. 1c) T2-weighted image in the axial plane – relatively less severe narrowing of the spinal canal at L3–L4 level; grade B stenosis according to Schizas, moderate stenosis according to Lurie (compromise of the spinal canal area between 1/3 and 2/3 of normal size).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/f1c6945fc288bc2b511dbfa39b658093.jpg)
Obr. 2. Ukázka klasifikace laterální LSS zobrazené na transverzálních T2 vážených MR obrazech u pacienta s víceetážovým postižením, tíže komprese nervového kořene v laterálním recesu hodnocena dle Bartynski et al [37]. Obr. 2a) V etáži L3–L4 stupeň 1. Obr. 2b) V etáži L4–L5 stupeň 2 s lehkou impresí odstupujícího kořene L5 vlevo (šipka). Obr. 2c) V etáži L2–L3 (více vlevo) stupeň 3. Fig. 2. Demonstration of lateral LSS classification depicted on T2-weighted axial MRI images in a patient with multi-segmental involvement, the severity of nerve root compression in the lateral recess is evaluated according to Bartynski et al. [37]. Fig. 2a) Grade 1 at L3–L4 level. Fig. 2b) Grade 2 at L4–L5 level with mild compression of the left L5 nerve root (arrow). Fig. 2c) Grade 3 at L2–L3 level (predominant on the left side). ![Ukázka klasifikace laterální LSS zobrazené na transverzálních T2 vážených MR obrazech u pacienta s víceetážovým postižením, tíže komprese nervového kořene v laterálním recesu hodnocena dle Bartynski et al [37].
Obr. 2a) V etáži L3–L4 stupeň 1.
Obr. 2b) V etáži L4–L5 stupeň 2 s lehkou impresí odstupujícího kořene L5 vlevo (šipka).
Obr. 2c) V etáži L2–L3 (více vlevo) stupeň 3.
Fig. 2. Demonstration of lateral LSS classification depicted on T2-weighted axial MRI images in a patient with multi-segmental involvement, the severity of nerve root compression in the lateral recess is evaluated according to Bartynski et al. [37].
Fig. 2a) Grade 1 at L3–L4 level.
Fig. 2b) Grade 2 at L4–L5 level with mild compression of the left L5 nerve root (arrow).
Fig. 2c) Grade 3 at L2–L3 level (predominant on the left side).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/616f5781cd2c0734bcc33520d889f4cb.jpg)
Obr. 3. MR vyšetření bederní páteře pacientky s levostrannou paramediální herniací ploténky L4–L5 zachycené v T2 váženém obraze v sagitální (a) a transverzální (b) rovině. Útlak nervového kořene hodnocen dle Phirrmanna et al [38]. Hernie působí kompresi odstupujícího levostranného kořene L5, stupeň 3. Fig. 3. MRI examination of the lumbar spine in a patient with left-sided paramedial disc extrusion at L4–L5 level depicted on T2-weighted MRI scans in sagittal (a) and axial (b) plane. The compression of the nerve root is evaluated according to Phirrmann et al. [38]. The herniated disc significantly compresses the L5 nerve root; grade 3. ![MR vyšetření bederní páteře pacientky s levostrannou paramediální herniací ploténky L4–L5 zachycené v T2 váženém obraze v sagitální (a) a transverzální (b) rovině.
Útlak nervového kořene hodnocen dle Phirrmanna et al [38]. Hernie působí kompresi odstupujícího levostranného kořene L5, stupeň 3.
Fig. 3. MRI examination of the lumbar spine in a patient with left-sided paramedial disc extrusion at L4–L5 level depicted on T2-weighted MRI scans in sagittal (a) and axial (b) plane.
The compression of the nerve root is evaluated according to Phirrmann et al. [38]. The herniated disc significantly compresses the L5 nerve root; grade 3.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/4ee5d9f0a302c178c3a75455f7c2e2c1.jpg)
Obr. 4. Foraminostenóza zachycená v T1 váženém obraze MR v sagitální rovině u dvou různých pacientů, omezení foramina hodnoceno dle Lurie et al [36]. Obr. 4a) Omezení neuroforamina v etáži L4–L5 lehkého stupně (redukce prostoru neuroforamina maximálně o 1/3). Obr. 4b) Foraminostenóza v etáži L2–L3 středního stupně, mírně odtlačený nervový kořen L2 je znázorněn šipkou. Fig. 4. Foraminal stenosis depicted on a sagittal T1-weighted MRI scan in two different patients, the severity of the foraminal narrowing is graded according to Lurie et al. [36]. Fig. 4a) Mild foraminal stenosis at L4–L5 level (reduction of the foraminal area no more than 1/3 of its normal size). Fig. 4b) Moderate foraminal stenosis at L2–L3 level, the mildly displaced nerve root L2 is marked by the arrow. ![Foraminostenóza zachycená v T1 váženém obraze MR v sagitální rovině u dvou různých pacientů, omezení foramina hodnoceno dle Lurie et al [36].
Obr. 4a) Omezení neuroforamina v etáži L4–L5 lehkého stupně (redukce prostoru neuroforamina maximálně o 1/3).
Obr. 4b) Foraminostenóza v etáži L2–L3 středního stupně, mírně odtlačený nervový kořen L2 je znázorněn šipkou.
Fig. 4. Foraminal stenosis depicted on a sagittal T1-weighted MRI scan in two different patients, the severity of the foraminal narrowing is graded according to Lurie et al. [36].
Fig. 4a) Mild foraminal stenosis at L4–L5 level (reduction of the foraminal area no more than 1/3 of its normal size).
Fig. 4b) Moderate foraminal stenosis at L2–L3 level, the mildly displaced nerve root L2 is marked by the arrow.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/97fdd847c6a99038e4c31f813c23a56e.jpg)
Nové trendy radiologického hodnocení LSS
Nekorelující radiologické a klinické nálezy vedou k hledání nových metod radiologického hodnocení LSS. Vzhledem k tomu, že páteřní kanál je dynamická struktura, kde se mění rozměry v závislosti na poloze (zmenšení rozměrů při stoji a chůzi), tak se naděje vkládají do dynamického vyšetření bederní páteře pomocí MR, tedy vyšetření MR ve stoje či s axiální zátěží [40]. Další možností pro objasnění neurogenních klaudikací je zhodnocení cirkulace krve v oblasti bederního páteřního kanálu či vyšetření nervových kořenů s využitím zobrazení tenzorů difuze (Diffusion Tensor Imaging; DTI) [20]. DTI je metoda vycházející z principů difuzně váženého zobrazení (Diffusion Weighted Imaging; DWI). Technicky můžeme vyšetření DTI chápat jako určitou nadstavbu DWI přinášející však zcela nový druh informací. Využíváme zde opakovaného měření s mnoha různými směry gradientu magnetického pole. Opakovaná směrová aplikace gradientu nám umožní zhodnocení tzv. anizotropie zkoumané tkáně, která je výrazná u vysoce strukturálně uspořádaných tkání. Pro kvantifikaci můžeme využít parametr frakční anizotropie (FA), který odráží míru směrové závislosti procesu difuze ve zkoumané tkáni. Hodnoty FA se pohybují v rozmezí 0 – 1 (hodnota 1 vyjadřuje extrémní, jen teoretickou možnost zcela anizotropní difuze v jediném směru, hodnota 0 vyjadřuje zcela izotropní difuzi). Míru volné, směrově nezávislé difuzivity molekul vody ve tkáni lze kvantifikovat pomocí měření hodnoty ADC (Apparent Diffusion Coefficient) [41 – 43].
Ze získaných obrazových dat DTI je také možno provést rekonstrukci průběhu nervových drah (traktografie) a lze sledovat změny průběhu nervových kořenů (ztenčení, zakřivení a přerušení), a tím lokalizovat místo komprese [44,45].
Provedené studie prokazují, že při kompresi nervových kořenů dochází k signifikantním změnám parametrů difuze, a to ke zvýšení hodnot ADC a snížení hodnot FA [44,46 – 48]. Chronická komprese kořenů vede ke zvýšení cévní permeability, k hyperemii a edému, dále k ischemii spojené s demyelinizací a walleriánskou degenerací nervových vláken. Také dochází ke zvětšení prostoru mezi axony a fascikly. Tyto mikrostrukturální změny způsobují zvýšení volné difuze vody a změny směru difuze (nervová tkáň postižená patologickým procesem se stává více izotropní), což se odráží ve změnách difuzních parametrů [44,46,47,49,50]. Nabízí se otázka, který ze dvou kvantitativních parametrů difuze je spolehlivější při detekci komprese lumbálních kořenů; ve studiích byla prokázána vyšší senzitivita FA v porovnání s ADC [47,51].
Klinický přínos DTI v diagnostice kořenové komprese je popisován při stanovení klinické závažnosti komprese nervových kořenů a přesnější lokalizaci místa symptomatické (klinicky relevantní) komprese, čehož lze využít u víceetážových stenóz a vícečetných kompresí kořene. To může být významné při plánování případného operačního zákroku, kdy využití DTI může vést k lepšímu zacílení operace, omezení rozsahu operačního výkonu (snížení počtu operovaných etáží), a tím i k redukci komplikací [48,51,52].
Současná literatura nabízí stále jen omezené množství informací o proveditelnosti a významu DTI v diagnostice LSS. Za touto skutečností stojí pravděpodobně více faktorů, které činí provedení DTI v lumbální oblasti náročnějším, a to jak po technické stránce, tak i při vyhodnocení a interpretaci. Problém je relativně malý rozměr nervových struktur, pohybové artefakty vyplývající z dýchací aktivity pacienta a proudění likvoru a vyšší vliv magnetické susceptibility v této oblasti [45,53,54]. Do budoucna budou nutné další studie k objasnění přínosu DTI v diagnostice LSS.
Závěr
- LSS je klinicko-radiologický syndrom s komplexním vztahem mezi radiologickými nálezy a klinickou manifestací.
- V běžné populaci je častý výskyt radiologické LSS vč. asymptomatických forem, prevalence roste s věkem, není rozdíl mezi oběma pohlavími.
- Tíže radiologické stenózy nesmí být přeceňována, volba terapeutického postupu u pacientů se symptomatickou lumbální stenózou by měla vycházet z klinického obrazu.
- Na základě konsenzu expertů bylo definováno pět základních radiologických kvalitativních parametrů, které jsou doporučeny jako minimální standard při popisu nálezů u LSS v běžné klinické praxi. Stanovení těchto parametrů je jednoduché, jsou dobře reprodukovatelné a lépe vyjadřují kompresi nervových struktur ve srovnání s izolovanými kvantitativními radiologickými parametry.
- Mezi nové trendy v diagnostice LSS patří zejména využití zobrazení tenzorů difuze (DTI) pomocí MR. Přínos spočívá ve zhodnocení klinické závažnosti komprese nervového kořene a přesnější lokalizaci místa komprese.
Práce byla podpořena projektem institucionální podpory FN Brno MZ ČR – RVO (FNBr – 65269705) a fondy Lékařské fakulty MU na podporu juniorského výzkumníka (M. Keřkovský).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Blanka Adamová, Ph.D.
Neurologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: adamova.blanka@fnbrno.cz
Přijato k recenzi: 25. 2. 2017
Přijato do tisku: 22. 6. 2017
Zdroje
1. Kreiner DS, Shaffer WO, Baisden JL, et al. An evidence-based clinical guideline for the diagnosis and treatment of degenerative lumbar spinal stenosis (update). Spine J 2013;13(7):734 – 43. doi: 10.1016/ j.spinee.2012.11.059.
2. Genevay S, Atlas SJ. Lumbar spinal stenosis. BestPract Res Clin Rheumatol 2010;24(2):253 – 65. doi: 10.1016/ j.berh.2009.11.001.
3. Suri P, Rainville J, Kalichman L, et al. Does this older adult with lower extremity pain have the clinical syndrome of lumbar spinal stenosis? JAMA 2010;304(23):2628 – 36. doi: 10.1001/ jama.2010.1833.
4. Schönström N, Willén J. Imaging lumbar spinal stenosis. Radiol Clin North Am 2001;39(1):31 – 53.
5. Boden SD, Davis DO, Dina TS, et al. Abnormal magnetic-resonance scans of the lumbar spine in asymptomatic subjects. A prospective investigation. J BoneJoint Surg Am 1990;72(3):403 – 8.
6. Tong HC, Carson JT, Haig AJ, et al. Magnetic resonance imaging of the lumbar spine in asymptomatic older adults. J Back Musculoskelet Rehabil 2006;19(2 – 3):67 – 72.
7. Ishimoto Y, Yoshimura N, Muraki S, et al. Associations between radiographic lumbar spinal stenosis and clinical symptoms in the general population: the Wakayama Spine Study. Osteoarthritis Cartilage 2013;21(6): 783 – 8. doi: 10.1016/ j.joca.2013.02.656.
8. Kalichman L, Cole R, Kim DH, et al. Spinal stenosis prevalence and association with symptoms: the Framingham Study. Spine J 2009;9(7):545 – 50. doi: 10.1016/ j.spinee.2009.03.005.
9. Haig AJ, Tong HC, Yamakawa KS, et al. Spinal stenosis, back pain, or no symptoms at all? A masked study comparing radiologic and electrodiagnostic diagnoses to the clinical impression. Arch Phys Med Rehabil 2006;87(7):897 – 903.
10. Haig AJ, Geisser ME, Tong HC, et al. Electromyographic and magnetic resonance imaging to predict lumbar stenosis, low-back pain, and no back symptoms. J Bone Joint Surg Am 2007;89(2):358 – 66.
11. Geisser ME, Haig AJ, Tong HC, et al. Spinal canal size and clinical symptoms among persons diagnosed with lumbar spinal stenosis. Clin J Pain 2007;23(9):780 – 5.
12. Zeifang F, Schiltenwolf M, Abel R, et al. Gait analysis does not correlate with clinical and MR imaging parameters in patients with symptomatic lumbar spinal stenosis. BMC Musculoskelet Disord 2008;9 : 89. doi: 10.1186/ 1471-2474-9-89.
13. Goni VG, Hampannavar A, Gopinathan NR, et al. Comparison of the oswestry disability index and magnetic resonance imaging findings in lumbar canal stenosis: an observational study. Asian Spine J 2014;8(1):44 – 50. doi: 10.4184/ asj.2014.8.1.44.
14. Sirvanci M, Bhatia M, Ganiyusufoglu KA, et al. Degenerative lumbar spinal stenosis: correlation with Oswestry Disability Index and MR imaging. Eur Spine J 2008;17(5):679 – 85. doi: 10.1007/ s00586-008-0646-5.
15. Lohman CM, Tallroth K, Kettunen JA, et al. Comparison of radiologic signs and clinical symptoms of spinal stenosis. Spine 2006;31(16):1834 – 40.
16. Adamová B, Andrašinová T, Bušková J, et al. Korelují radiologické a klinické nálezy u pacientů s lumbální spinální stenózou? Cesk Slov Neurol N 2016;79/ 112(Suppl 2):2S37.
17. Kuittinen P, Sipola P, Saari T, et al. Visually assessed severity of lumbar spinal canal stenosis is paradoxically associated with leg pain and objective walking ability. BMC Musculoskelet Disord 2014;15 : 348. doi: 10.1186/ 1471-2474-15-348.
18. Kuittinen P, Sipola P, Aalto TJ, et al. Correlation of lateral stenosis in MRI with symptoms, walking capacity and EMG findings in patients with surgically confirmed lateral lumbar spinal canal stenosis. BMC Musculoskelet Disord 2014;15 : 247. doi: 10.1186/ 1471-2474-15-247.
19. Schizas C, Theumann N, Burn A, et al. Qualitative grading of severity of lumbar spinal stenosis based on the morphology of the dural sac on magnetic resonance images. Spine 2010;35(21):1919 – 24. doi: 10.1097/ BRS.0b013e3181d359bd.
20. Burgstaller JM, Schüffler PJ, Buhmann JM, et al. Is There an Association Between Pain and Magnetic Resonance Imaging Parameters in Patients With Lumbar Spinal Stenosis? Spine 2016;41(17):E1053 – 62. doi: 10.1097/ BRS.0000000000001544.
21. Alsaleh K, Ho D, Rosas-Arellano MP, et al. Radiographic assessment of degenerative lumbar spinal stenosis: is MRI superior to CT? Eur Spine J 2017;26(2):362 – 7. doi: 10.1007/ s00586-016-4724-9.
22. Ogikubo O, Forsberg L, Hansson T. The relationship between the cross-sectional area of the cauda equina and the preoperative symptoms in central lumbar spinal stenosis. Spine 2007;32(13):1423 – 8.
23. Hong JH, Lee MY, Jung SW, et al. Does spinal stenosis correlate with MRI findings and pain, psychologic factor and quality of life? Korean J Anesthesiol 2015;68(5):481 – 7. doi: 10.4097/ kjae.2015.68.5.481.
24. Kim YU, Kong YG, Lee J, et al. Clinical symptoms of lumbar spinal stenosis associated with morphological parameters on magnetic resonance images. Eur Spine J 2015;24(10):2236 – 43. doi: 10.1007/ s00586-015-4197-2.
25. Weber C, Giannadakis C, Rao V, et al. Is there an Association Between Radiological Severity of Lumbar Spinal Stenosis and Disability, Pain, or Surgical Outcome?: a Multicenter Observational Study. Spine 2016;41(2):E78 – 83. doi: 10.1097/ BRS.0000000000001166.
26. Kim HJ, Suh BG, Lee DB, et al. The influence of pain sensitivity on the symptom severity in patients with lumbar spinal stenosis. Pain Physician 2013;16(2):135 – 44.
27. Park HJ, Kim SS, Lee YJ, et al. Clinical correlation of a new practical MRI method for assessing central lumbar spinal stenosis. Br J Radiol 2013;86(1025):20120180. doi: 10.1259/ bjr.20120180.
28. Lee GY, Lee JW, Choi HS, et al. A new grading system of lumbar central canal stenosis on MRI: an easy and reliable method. Skeletal Radiol 2011;40(8):1033 – 9. doi: 10.1007/ s00256-011-1102-x.
29. Adamová B, Mechl M, Andrašinová T, et al. Radiologické hodnocení lumbální spinální stenózy a jeho klinická korelace. Cesk Slov Neurol N 2015;78(2):139 – 47.
30. Schizas C, Kulik G. Decision-making in lumbar spinal stenosis: a survey on the influence of the morphology of the dural sac. J Bone Joint Surg Br 2012;94(1):98 – 101. doi: 10.1302/ 0301-620X.94B1.27420.
31. Porter RW. Spinal stenosis and neurogenic claudication. Spine 1996;21(17):2046 – 52.
32. Andreisek G, Deyo RA, Jarvik JG, et al. Consensus conference on core radiological parameters to describe lumbar stenosis – an initiative for structured reporting. Eur Radiol 2014;24(12):3224 – 32. doi: 10.1007/ s00330-014-3346-z.
33. Mamisch N, Brumann M, Hodler J, et al. Radiologic criteria for the diagnosis of spinal stenosis: results of a Delphi survey. Radiology 2012;264(1):174 – 9. doi: 10.1148/ radiol.12111930.
34. Maus TP. Imaging of spinal stenosis: neurogenic intermittent claudication and cervical spondylotic myelopathy. Radiol Clin North Am 2012;50(4):651 – 79. doi: 10.1016/ j.rcl.2012.04.007.
35. Andreisek G, Imhof M, Wertli M,et al. A systematic review of semiquantitative and qualitative radiologic criteria for the diagnosis of lumbar spinal stenosis. AJR Am J Roentgenol 2013;201(5):W735 – 46. doi: 10.2214/ AJR.12.10163.
36. Lurie JD, Tosteson AN, Tosteson TD, et al. Reliability of readings of magnetic resonance imaging features of lumbar spinal stenosis. Spine 2008;33(14):1605 – 10. doi: 10.1097/ BRS.0b013e3181791af3.
37. Bartynski WS, Lin L. Lumbar root compression in the lateral recess: MR imaging, conventional myelography, and CT myelography comparison with surgical confirmation. AJNR Am J Neuroradiol 2003;24(3):348 – 60.
38. Pfirrmann CW, Dora C, Schmid MR, et al. MR image-based grading of lumbar nerve root compromise due to disk herniation: reliability study with surgical correlation. Radiology 2004;230(2):583 – 8.
39. Winklhofer S, Held U, Burgstaller JM, et al. Degenerative lumbar spinal canal stenosis: intra - and inter-reader agreement for magnetic resonance imaging parameters. Eur Spine J 2017;26(2):353 – 61.
40. Kolář P, Štulík J, Kynčl M. Dynamické vyšetření bederní páteře pomocí magnetické rezonance – kazuistika. Cesk Slov Neurol N 2010;73/ 106(4):438 – 42.
41. Pierpaoli C, Basser PJ. Toward a quantitative assessment of diffusion anisotropy. Magn Reson Med 1996;36(6):893 – 906.
42. Keřkovský M, Šprláková-Puková A, Kašpárek T, et al. Diffusion tensor imaging – současné možnosti MR zobrazení bílé hmoty mozku. Cesk Slov Neurol N 2010;73/ 106(2):136 – 42.
43. Keřkovský M, Šprláková-Puková A, Bednařík J, et al. Význam MR zobrazení difuze míchy v diferenciální diagnostice míšních lézí. Cesk Slov Neurol N 2013;76// 109(4):477 – 81.
44. Oikawa Y, Eguchi Y, Inoue G, et al. Diffusion tensor imaging of lumbar spinal nerve in subjects with degenerative lumbar disorders. Magn Reson Imaging 2015;33(8):956 – 61. doi: 10.1016/ j.mri.2015.05.002.
45. Eguchi Y, Ohtori S, Orita S, et al. Quantitative evaluation and visualization of lumbar foraminal nerve root entrapment by using diffusion tensor imaging: preliminary results. AJNR Am J Neuroradiol 2011;32(10):1824 – 9. doi: 10.3174/ ajnr.A2681.
46. Chuanting L, Qingzheng W, Wenfeng X, et al. 3.0T MRI tractography of lumbar nerve roots in disc herniation. Acta Radiol 2014;55(8):969 – 75. doi: 10.1177/ 0284185113508179.
47. Balbi V, Budzik JF, Duhamel A, et al. Tractography of lumbar nerve roots: initial results. Eur Radiol 2011;21(6):1153 – 9. doi: 10.1007/ s00330-010-2049-3.
48. Kanamoto H, Eguchi Y, Suzuki M, et al. The diagnosis of double-crush lesion in the L5 lumbar nerve using diffusion tensor imaging. Spine J 2016;16(3):315 – 21. doi: 10.1016/ j.spinee.2015.11.003.
49. Shi Y, Zong M, Xu X, et al. Diffusion tensor imaging with quantitative evaluation and fiber tractography of lumbar nerve roots in sciatica. Eur J Radiol 2015;84(4):690 – 5. doi: 10.1016/ j.ejrad.2015.01.006.
50. Miyagi R, Sakai T, Yamabe E, et al. Consecutive assessment of FA and ADC values of normal lumbar nerve roots from the junction of the dura mater. BMC Musculoskelet Disord 2015;16 : 156. doi: 10.1186/ s12891-015-0576-4.
51. Eguchi Y, Ohtori S, Suzuki M, et al. Discrimination between Lumbar Intraspinal Stenosis and Foraminal Stenosis using Diffusion Tensor Imaging Parameters: Preliminary Results. Asian Spine J 2016;10(2):327 – 34. doi: 10.4184/ asj.2016.10.2.327.
52. Chen HB, Wan Q, Xu QF, et al. Reducing surgical levels by paraspinal mapping and diffusion tensor imaging techniques in lumbar spinal stenosis. J Orthop Surg Res 2016;11(1):47. doi: 10.1186/ s13018-016-0382-1.
53. Facon D, Ozanne A, Fillard P, et al. MR diffusion tensor imaging and fiber tracking in spinal cord compression. AJNR Am J Neuroradiol 2005;26(6):1587 – 94.
54. Cauley KA, Filippi CG. Diffusion-tensor imaging of small nerve bundles: cranial nerves, peripheral nerves, distal spinal cord, and lumbar nerve roots – clinical applications. AJR Am J Roentgenol 2013;201(2):W326 – 35. doi: 10.2214/ AJR.12.9230.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek AtaxieČlánek EditorialČlánek Comment of Article The Effect of Different Occupational Therapy Techniques on Post-stroke PatientsČlánek Disekce všech čtyř přívodných mozkových tepen v terénu fibromuskulární dysplazie – kazuistikaČlánek Analýza dat v neurologiiČlánek Recenze knih
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2017 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Ataxie
- Editorial
- Pacient s hemiplegií má být vezen přímo do KCC
- Pacient s hemiplegií nemá být vezen přímo do KCC
- Má být pacient s hemiplegií vezen přímo do KCC?
- Kognitivní funkce u pacientů s nízkostupňovými gliomy – přehledová studie
- Klinický přínos radiologických parametrů u lumbální spinální stenózy
- Neurosonologické markery predikce kognitivní deteriorace
- Český národní registr Guillainova-Barrého syndromu
- Možné využití spánkové endoskopie pro zvýšení efektivity léčby (operační i neoperační) u pacientů s obstrukční spánkovou apnoí
- Prevalence Martin-Gruberovy anastomózy – elektrofyziologie studie
- Poranění periferních nervů při suprakondylických zlomeninách humeru u dětí
- Systematická evaluace center provádějících mechanické trombektomie u akutního mozkového infarktu v České republice za rok 2016
- Predikce úmrtnosti na neurochirurgické jednotce intenzivní péče
- Klinický pohled otorinolaryngologa a radiologa na klasifikaci zlomenin spánkové kosti
- Vliv různých technik pracovních terapií na pacienty po mozkové mrtvici
- Comment of Article The Effect of Different Occupational Therapy Techniques on Post-stroke Patients
- Disekce všech čtyř přívodných mozkových tepen v terénu fibromuskulární dysplazie – kazuistika
- Intravenózní trombolýza po zrušení účinku dabigatranu specifickým antidotem idarucizumabem
- Zkušenosti s použitím thuliového laseru RevoLix Jr při resekci glioblastomu – kazuistiky
- Doporučený postup České pneumologické a ftizeologické společnosti a České společnosti dětské pneumologie pro dlouhodobou domácí léčbu poruch expektorace pomocí přístroje CoughAssist
- Analýza dat v neurologii
- Recenze knih
- Výbor Cerebrovaskulární sekce ČNS spolupořádal v Praze European Stroke Organisation Conference
- Cena za přínos péči o cévní mozkové příhody doc. MUDr. Robertu Mikulíkovi, Ph.D., FESO
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Český národní registr Guillainova-Barrého syndromu
- Klinický pohled otorinolaryngologa a radiologa na klasifikaci zlomenin spánkové kosti
- Doporučený postup České pneumologické a ftizeologické společnosti a České společnosti dětské pneumologie pro dlouhodobou domácí léčbu poruch expektorace pomocí přístroje CoughAssist
- Poranění periferních nervů při suprakondylických zlomeninách humeru u dětí
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



