-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hodnocení rohovkové inervace pomocí konfokální mikroskopie
The Evaluation of Corneal Innervation Using Corneal Confocal Microscopy
Corneal confocal microscopy (CCM) is a novel noninvasive method enabling morphological evaluation of corneal structures including nerve fibers. These fibers are almost exclusively of A-delta and C type, i.e. small unmyelinated and poorly myelinated. CCM is thus used as a diagnostic tool for peripheral neuropathies and in particular small fiber neuropathy. The aim of this study was to introduce this method into clinical practice in the Czech Republic, to set-up appropriate normative data and to verify reproducibility of the method.
Material and methods:
A group of 71 healthy controls was examined using the CCM. The data were used to set normal values in three distinct age-related groups and compare these with CCM findings in a group of 54 patients with diabetic polyneuropathy (DPN). Fully-automated as well as expert manual analysis (by two evaluators) were used for quantification of nerve fiber densities, length and branches to verify reliability of the results.Results:
CCM evaluation was easy, well-tolerated and time-efficient in the majority of patients/controls. Age-related normal values showed very good applicability in evaluated groups of healthy individuals and DPN patients. Compared to healthy controls, DPN patients showed highly significant changes of all the evaluated CCM parameters. Results by the two evaluators of the expert manual analysis showed very good reliability, while results from the automated analysis showed significantly lower values on the majority of the CCM parameters.Conclusion:
The present study proved on a rather large cohort of healthy controls and a smaller sample of DPN patients that CCM is a easy to use, safe and reliable approach to evaluating corneal innervation. The data also highlighted the differences between automated analysis expert manual CCM analysis.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Key words:
confocal microscopy – cornea – small fiber neuropathy – diabetic neuropathies – reliability of results
Chinese summary - 摘要
激光共聚焦角膜神经支配的评价显微镜
作者:
摘要
角膜的共焦显微镜(角膜的共焦显微镜; CCM)可以实现角膜IU的无创形态学可视化检查。因为角膜神经纤维是薄或小的髓鞘 或没有髓鞘,所以CCM是一种SFN诊断方法,用于一般周围神经病变的检测。这样做的目的是为了引入临床检查的CCM神经系统的做法,在捷克共和国,设置适当的标准数据确定重复性测试。
患者和方法:
71名健康志愿者和54例糖尿病神经病患者(糖尿病神经病; DPN)进行了CCM检测。使用数据是
一套标准的三个不同年龄组。研究结果进行了自动评估和手动分析(由两个评价者独立地),以确定测试的可靠性。
结果:
CCM测试节省时间,运行稳定,并且绝大多数病人耐受性良好。年龄分层的标准数据显示
具有非常不错的人口实用性研究。与健康的CCM相比,DPN患者均已经表现出监测参数的显著变化。两名评估人员进行的手动分析也显示CCM具有很好的一致性,但监测参数的CCM值均显著下降。
结论:
本研究简单,安全和良好的证明通过角膜共焦显微镜测试角膜神经支配的可靠性,
一个包含健康对照和患者的DPN组的大样本研究表明,自动和手动评价的一致性。
关键词:
共聚焦显微镜 - 角膜 - 糖尿病神经病 - 结果的可靠性
Autoři: I. Kovalová 1,2; M. Horáková 1,2; E. Vlčková 1,2; M. Michalec 3; J. Raputová 1,2; J. Bednařík 1,2
Působiště autorů: Neurologická klinika LF MU a FN Brno 1; CEITEC – Středoevropský technologický institut, MU, Brno 2; Oční klinika LF MU a FN Brno 3
Vyšlo v časopise: Cesk Slov Neurol N 2017; 80/113(1): 49-57
Kategorie: Původní práce
doi: https://doi.org/10.14735/amcsnn201749Souhrn
Konfokální mikroskopie rohovky (Corneal Confocal Microscopy; CCM) je neinvazivní metoda morfologického vyšetření rohovky umožňující m.j. vizualizaci korneálních nervových vláken, která jsou tenká, málo myelinizovaná či nemyelizovaná. CCM je tedy diagnostická metoda neuropatie tenkých vláken, resp. obecně periferních neuropatií. Cílem práce bylo zavedení vyšetření CCM do klinické neurologické praxe v České republice, nastavení vhodných normativních dat a stanovení reprodukovatelnosti vyšetření.
Soubor a metodika:
CCM byla vyšetřena v souborech 71 zdravých dobrovolníků a 54 pacientů s diabetickou polyneuropatií (Diabetic Polyneuropathy; DPN). Ze zjištěných dat byly stanoveny normy pro tři oddělené věkové kategorie. Nálezy byly vyhodnoceny automatickou i manuální analýzou (a to nezávisle dvěma hodnotiteli) ke stanovení spolehlivosti vyšetření.Výsledky:
Vyšetření CCM bylo časově a metodicky nenáročné a bylo naprostou většinou pacientů dobře tolerováno. Stanovená věkově stratifikovaná normativní data vykazují velmi dobrou použitelnost ve sledovaných souborech pacientů. U pacientů s DPN byly prokázány signifikantní změny všech sledovaných CCM parametrů oproti zdravým kontrolám. Při hodnocení CCM snímků manuální analýzou byla prokázána velmi dobrá shoda dvou hodnotitelů. Při hodnocení automatickým softwarem však byly hodnoty všech sledovaných CCM parametrů signifikantně nižší.Závěr:
Prezentovaná studie v souhrnu prokázala jednoduchost, bezpečnost a dobrou spolehlivost vyšetření rohovkové inervace pomocí konfokální mikroskopie rohovky na poměrně rozsáhlém souboru zdravých kontrol a skupině pacientů s DPN a poukázala rovněž na rozdílnost automatického a manuálního hodnocení.Klíčová slova:
konfokální mikroskopie – rohovka – neuropatie tenkých vláken – diabetická neuropatie – spolehlivost nálezůÚvod
Konfokální mikroskopie rohovky (Corneal Confocal Microscopy, CCM) je relativně nová neinvazivní metoda morfologického vyšetření rohovky s širokým klinickým využitím [1]. Pro potřeby neurologie je přínosná zejména možnost vizualizace korneálních nervových vláken, která je podkladem v současnosti dominujícího využití CCM v diagnostice periferních neuropatií, zejména neuropatie tenkých vláken (Small Fiber Neuropathy; SFN) [2,3]. Tato indikace je založena na skutečnosti, že rohovka je nejhustěji inervovaná tkáň lidského těla (až 400× více než lidská kůže) [4]. Současně je velmi dobře dostupná a jako jediná struktura lidského těla umožňuje neinvazivní morfologické vyšetření terminálních segmentů periferního nervového systému [2,3].
Anatomie rohovky a její inervace
Rohovka se skládá z pěti základních vrstev:
- epitel,
- Bowmanova membrána (amorfní vrstva mezi epitelem a stromatem),
- stroma (lamelární vrstva složená z kolagenových fibril, proteoglykanů, keratocytů),
- Descementova membrána (mezi stromatem a endotelem, složená z kolagenových vláken a glykoproteinů),
- endotel (obr. 1) [5].
Obr. 1. Snímek mikroskopického řezu rohovkou v barvení hematoxylinem-eosinem ve zvětšení 100× s vyznačením pěti základních vrstev: 1. epitel, 2. Bowmanova membrána, 3. stroma, 4. Descemetova membrána a 5. endotel. Za poskytnutí snímku autoři děkují doc. MUDr. Miroslavě Sedláčkové, CSc., zástupkyni přednosty Ústavu histologie a embryologie, LF MU v Brně. Fig. 1. Transversal section through cornea (stained with haematoxylin and eosin, 100× magnification) showing five corneal layers: 1. epithelium, 2. Bowman´s layer, 3. corneal stroma, 4. Descemet´s membrane and 5. endothelium. The section was provided by Assoc. prof. Miroslava Sedláčková, MD, PhD from the Department of Histology and Embryology, Faculty of Medicine, Masaryk University Brno. 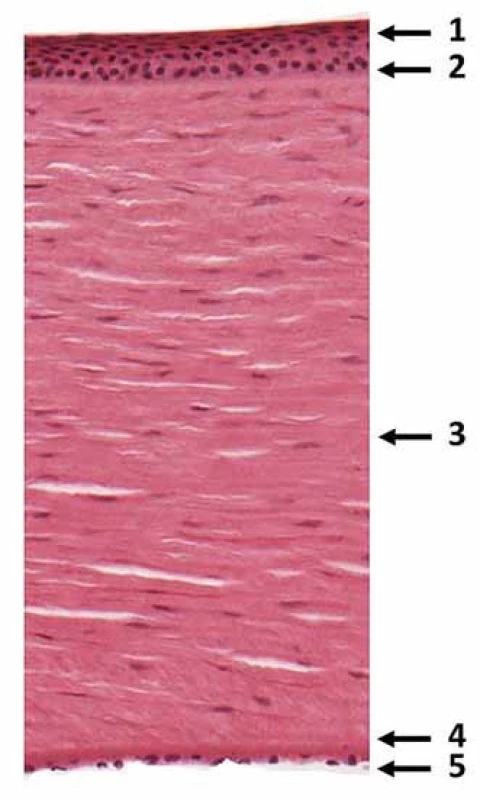
Její inervaci zabezpečuje trigeminální nerv, konkrétně jedna z jeho tří hlavních větví – n. ophthalmicus. Terminální větve toho nervu vytvářejí v rohovce tři základní nervové formace:
- subbazální plexus ležící mezi epitelem a Bowmanovou membránou,
- subepiteliální plexus mezi Bowmanovou membránou a stromatem,
- stromální nervy [5].
Vyšetření rohovkové inervace pomocí CCM je zaměřeno především na subbazální plexus, který leží z velké části v centrální oblasti rohovky a jeho vlákna jsou uložena většinou ve svislém směru, rovnoběžně vedle sebe (obr. 2, 3) a často navzájem anastomozují. V důsledku husté inervace je rohovka velmi citlivá na chemické, mechanické i termické stimuly a i nejmenší podráždění vede k sevření víček za účelem maximální ochrany oka [6,7].
Obr. 2. Schéma orientace nervových vláken subbazálního plexu rohovky s vyznačenou centrální oblastí rohovky, na kterou je cíleno vyšetření CCM. Fig. 2. Diagram of nerve fibres in subbasal plexus of cornea, the CCM examination is targeted at the central part of cornea (marked by the darker circle). 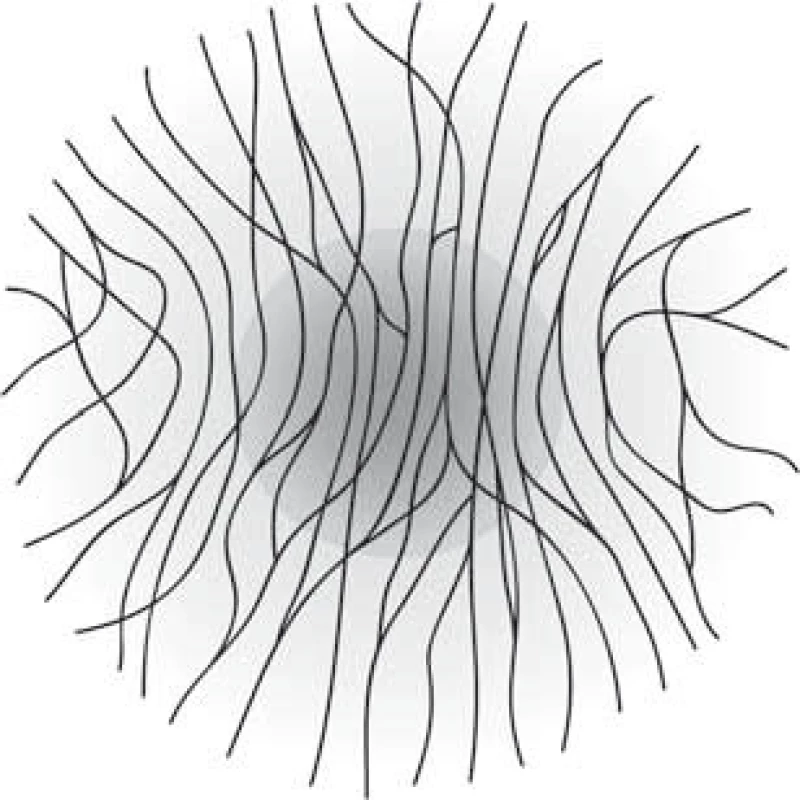
Obr. 3. CCM snímky korneálního nervového plexu z centrální části rohovky (zvětšení 700×). Obr. 3A) Snímek u zdravého dobrovolníka s patrným velkým počtem dobře identifikovatelných paralelně ležících nervových vláken s četnými anastomózami. Obr. 3B) Snímek u pacienta s DPN zřetelně vyjádřenou redukcí vyšetřovaného nervového plexu. Fig. 3. CCM image of the nerve plexus in the central part of the cornea (original magnification 700×). Fig. 3A) Image of a healthy volunteer with high density of nerve fibres and many branches. Fig. 3B) Image of a patient with DPN with pronounced reduction of fibre density and low number of branches. 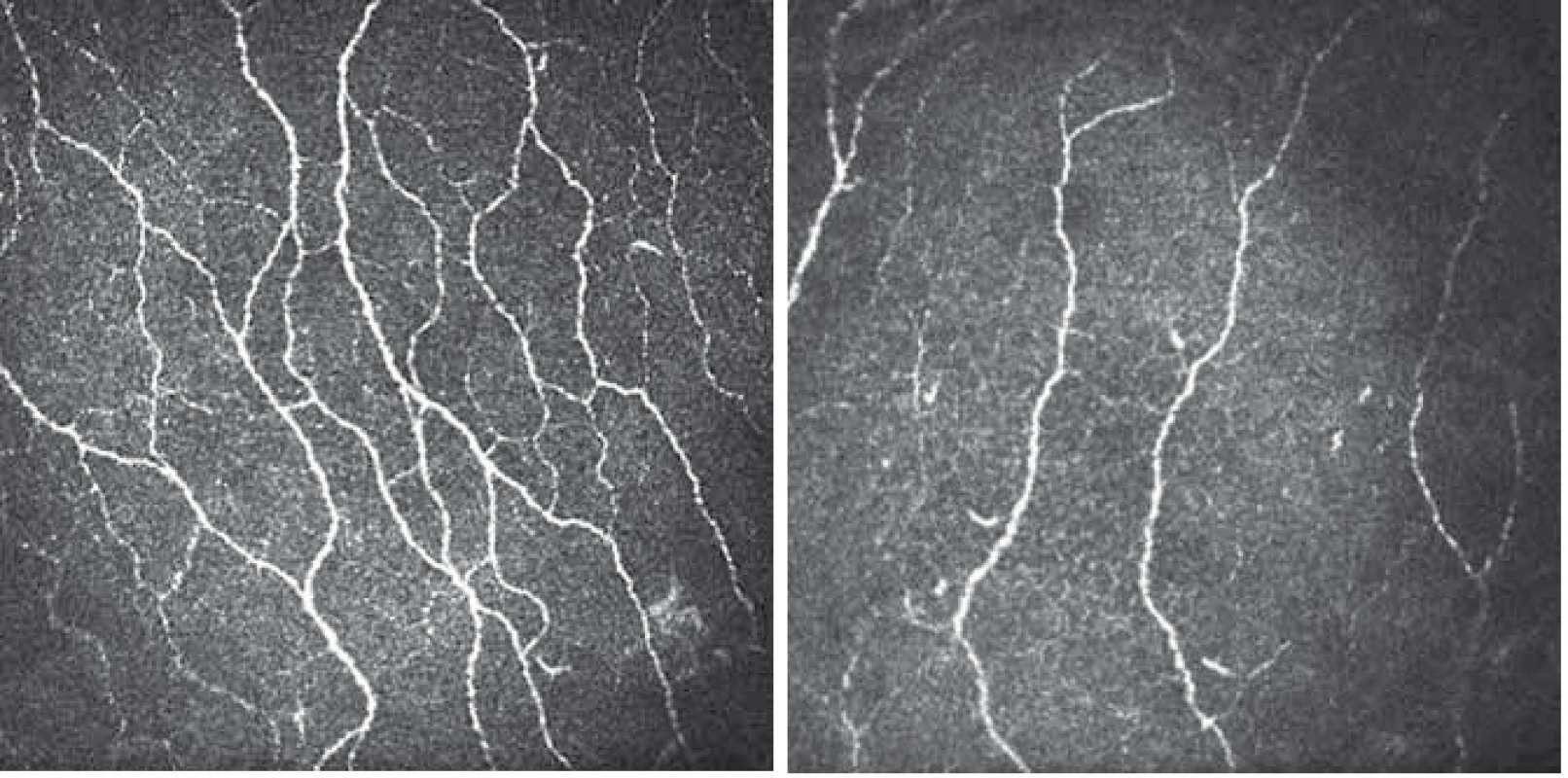
Vyšetření pomocí laserové rastrovací konfokální mikroskopie (optický princip)
Zdrojem světla v konfokálním mikroskopu je laserový paprsek, který je optikou mikroskopu zaostřen do jednoho konkrétního bodu rohovky. Stejný objektiv snímá i světlo odražené z tohoto bodu, současně ale snímá i světlo rozptýlené (z jiných bodů rohovky, a to především v menší nebo větší hloubce). Proto je v přístroji speciální konfokální clonka, která eliminuje světlo odražené z bodů mimo rovinu, do které je mikroskop právě zaostřen. Otvor v clonce je konjugovaný (con-) s ohniskem (focus) objektivu, odtud tedy název konfokální [8]. V jeden okamžik tak získáme obraz z jediného bodu (ve skutečnosti velmi malé plochy, jejíž velikost je dána rozlišením mikroskopu). Obraz celé zaostřené roviny se získává „bod po bodu“ (rastr) pomocí rozmítání laserového paprsku. Počítač registruje intenzitu světla a souřadnice a vytvoří obraz celého snímku. Ve skutečnosti je to však velmi rychlý proces a obraz je obnoven asi třikrát za sekundu. Výsledkem jsou tedy již z principu vždy ostré snímky získané v reálném čase, ve frontální rovině a především in vivo [8].
Význam hodnocení inervace rohovky pomocí CCM
Klíčovým diagnostickým přínosem konfokální mikroskopie pro neurologickou praxi je možnost neinvazivní vizualizace nervových vláken v rohovce. Nervová vlákna subbazálního plexu rohovky jsou tenká nervová vlákna typu A delta a C [5]. Úbytek a strukturální změny korneálních nervů přitom reflektují obecné postižení tenkých nervových vláken v organizmu [2,3,5,9–11]. Jedná se tedy o novou objektivní morfologickou metodu v diagnostice periferních neuropatií, zejména SFN [10–12]. Diagnostika SFN je v současné době založena především na anamnéze relevantních pozitivních senzitivních symptomů, klinickém vyšetření (v němž je prokazována často obtížně klinicky detekovatelná porucha termického a algického čití) a kvantitativním testování senzitivity (Quantitative Sensory Testing; QST), které umožňuje detailnější hodnocení percepce obou zmíněných senzitivních modalit. Klíčová diagnostická metoda (představující v současnosti zlatý standard v diagnostice SFN) je pak hodnocení intraepidermální inervace z kožní biopsie, která je však na rozdíl od CCM metodou invazivní s omezenou opakovatelností a daleko větší časovou a metodickou náročností zpracování a hodnocení nálezů [10–14]. Provedená pilotní studie přitom prokazuje obdobnou diagnostickou validitu CCM a kožní biopsie v diagnostice periferních neuropatií [10]. CCM je proto perspektivní metoda s potenciálem zjednodušit objektivní diagnostiku jinak obtížně verifikovatelného typu periferní neuropatie.
Využitelnost CCM v diagnostice různých periferně neurogenních onemocnění byla již potvrzena řadou studií. Nejčastější zkoumanou diagnostickou jednotkou je diabetická polyneuropatie (Diabetic Polyneuropathy; DPN). Konfokální mikroskopie prokazuje signifikantní redukci rohovkové inervace u pacientů s polyneuropatií při diabetes mellitus (DM) 1. i 2. typu či prediabetu a také u diabetické SFN i autonomní DPN [3,5,9]. Nálezy CCM mohou být využity dokonce jako prediktor budoucího rozvoje periferní neuropatie u pacientů s DM a slouží k identifikaci pacientů, kteří jsou z tohoto hlediska vysoce rizikoví a lze u nich zvážit zintenzivnění terapeutického přístupu k základnímu metabolickému onemocnění [15,16]. Hodnocení změn inervace rohovky při vyšetření CCM vykazuje u pacientů s DPN vysokou senzitivitu i specificitu většiny sledovaných parametrů [3]. Signifikantní morfologické změny korneální inervace byly prokázány také u pacientů se SFN při Fabryho chorobě [17] či idiopatické SFN [2], u polyneuropatie indukované chemoterapií [4] či hereditární neuropatie Charcot Marie Tooth, typ 1A [18]. Změny inervace rohovky jsou však prokazovány také u některých neurodegenerativních onemocnění, a to poněkud odlišného charakteru než v případě periferních neuropatií. Například u Parkinsonovy nemoci bylo sice zjištěno snížení hustoty nervových vláken, ale zároveň zvýšení hustoty jejich větví i celkové délky nervových vláken, což je jedinečný a klinicky determinantní nález [19]. CCM se tedy jeví jako široce využitelná, relativně jednoduchá a neinvazivní metoda rozšiřující významným způsobem spektrum diagnostických metod u pacientů s periferními neuropatiemi vč. SFN, ale i u některých dalších neurologických onemocnění.
Pro využití metody v klinické praxi je nezbytné srovnání nálezů hodnocených parametrů s normativními daty. Recentně byla publikována multicentrická studie poskytující věkově stratifikovaná normativní data pro obě pohlaví [20].
Cílem naší studie bylo zavést hodnocení rohovkové inervace pomocí CCM do klinické praxe v České republice a ověřit platnost publikovaných normativních dat pro jednotlivé CCM parametry [20] v české populaci, resp. vytvoření vlastních norem pro hodnocení této metody. Současně byla studie zaměřena na ověření spolehlivosti nálezů CCM při využití metody různými hodnotiteli a dále na srovnání nálezů manuální a automatické analýzy jednotlivých parametrů CCM.
Soubor
Inervace rohovky byla pomocí konfokální mikroskopie vyšetřena v souboru 71 zdravých dobrovolníků (tab. 1), převážně zaměstnanců Neurologické kliniky LF MU a FN Brno a jejich rodinných příslušníků. Menší část zdravých kontrol tvořili pacienti neurologické kliniky s onemocněními nepostihujícími periferní nervový systém (např. s bolestmi hlavy, lumbagem apod.). Vylučujícími kritérii pro zařazení do souboru zdravých kontrol byly:
- Známá polyneuropatie a/nebo klinický nález či anamnestické obtíže svědčící pro polyneuropatii.
- Anamnesticky zjištěné rizikové faktory potenciálně vedoucí ke vzniku periferní neuropatie (např. DM, porucha glukózové tolerance, chronický abúzus alkoholu, tyreopatie, stav po prodělané protinádorové chemoterapii).
- Dlouhodobé používání kontaktních čoček v současnosti či kdykoliv v minulosti.
- Operace či úraz oka v anamnéze.
Žádný z vyšetřených jedinců neměl známé oční onemocnění a neužíval lokální medikaci aplikovanou intraokulárně.
Za účelem vytvoření věkově stratifikovaných normativních dat byl soubor dále rozdělen do tří podskupin (do 30 let, 30–50 let a nad 50 let) (tab. 1).
Tab. 1. Demografická data vyšetřených souborů zdravých dobrovolníků a pacientů s DPN. 
Věk je vyjádřen ve formátu: medián (min.; max.). DPN – pacienti s diabetickou polyneuropatií, ZK – zdravé kontroly, M – počet mužů, Ž – počet žen. Validita metodiky v diagnostice periferních neuropatií byla ověřena srovnáním nálezů se souborem 54 pacientů s DPN s postižením silných a/nebo tenkých nervových vláken (tab. 1). Dvanáct pacientů mělo DM 1. typu a 42 pacientů DM 2. typu. Polyneuropatie byla v tomto souboru verifikována klinickým a anamnestickým vyšetřením, korelující abnormitou elektromyografického vyšetření a případně (při normálním nálezu elektromyografického vyšetření a současně relevantních pozitivních senzitivních symptomech) abnormálním nálezem intraepidermální inervace v kožní biopsii (která je zlatým standardem v diagnostice SFN). Také u těchto pacientů byla vylučujícím kritériem operace či úraz oka v anamnéze a používání kontaktních čoček aktuálně a/ nebo v minulosti. Ani v tomto souboru neměli zařazení pacienti oční onemocnění a neužívali lokální medikaci aplikovanou intraokulárně.
Metodika
Všichni zdraví dobrovolníci i pacienti s DPN zařazení do studie byli informováni o účelu vyšetření a podepsali informovaný souhlas. CCM byla vyšetřena pomocí mikroskopu Heidelberg Retina Tomograph (HRT II) v souladu s publikovanými doporučeními [2,3,20] a na základě praktického školení v metodice, které absolvovaly dvě lékařky autorského týmu (IK, MH) v Centru pro endokrinologii a diabetes na Univerzitě v Manchesteru, UK, u dr. Mitry Tavakoli.
V úvodu vyšetření byla provedena anestezie rohovky lokální aplikací oxybuprokainu (Benoxi 0,4 %, Unimed Pharma, Bratislava, Slovensko). Po znecitlivění rohovky byl z důvodu dostatečné lubrikace do každého oka aplikován viskoelastický gel (Vidisic, Dr. Gerhard Mann, Chem-pharm. Fabrik, GmbH, Berlín, Německo). Malé množství tohoto gelu bylo umístěno i na povrch čočky objektivu a ta byla následně kryta jednorázovým sterilním kloboučkem (perspex cap), který byl během vyšetření v kontaktu s vyšetřovaným okem. Vyšetřovaný byl vyzván k fixaci pevného bodu (bílé světlo) v průběhu celého vyšetření, což eliminovalo nežádoucí pohyby očí. Manuálním zaostřováním čočky objektivu pak bylo možno prohlédnout rohovku v celém rozsahu a z vrstvy obsahující subbazální plexus pořídit snímky o velikosti 384 × 384 pixelů. Následně byly z náhodně zvoleného oka vybrány tři odlišné reprezentativní snímky od sebe vzájemně vzdálených vrstev. Na vybraných snímcích byly v souladu s publikovanými doporučeními [20] hodnoceny následující parametry (obr. 3A, B):
- Hustota korneálních nervových vláken (Corneal Nerve Fiber Density; CNFD) – celkový počet hlavních nervových vláken na milimetr čtvereční snímku.
- Délka korneálních nervových vláken (Corneal Nerve Fiber Lenght; CNFL) – celková délka všech hlavních nervových vláken a větví v rámci příslušného snímku rohovky.
- Hustota větví korneálních nervových vláken (Corneal Nerve Branch Density; CNBD) – celkový počet větví vycházejících z hlavních vláken na milimetr čtvereční snímku.
- Koeficient tortuozity (Corneal Nerve Fiber Tortuosity; CNFT) – míra vinutosti korneálních nervových vláken. Tortuozita je v používaném programu CCMetrics hodnocena poměrně komplikovaným způsobem. Výpočet vychází z odchylky mezi přímou linií spojující oba konce hodnoceného nervového vlákna a skutečného průběhu tohoto vlákna. Skutečný průběh vlákna je určen matematicky za pomoci diferenciálního počtu. Každé nervové vlákno je reprezentováno jako funkce. Derivací této funkce v konkrétním bodě získáme informaci o sklonu nervového vlákna v daném bodě. Pro každý bod (pixel) je určen sklon a současně i odchylka od přímé linie. Výpočet CFFT pak vychází ze sumy všech odchylek. Jde o bezrozměrné číslo, které může nabývat hodnot od 0 do 1, kde se zvyšujícím se číslem se zvyšuje i míra vinutosti nervového vlákna. Podrobnější popis výpočtu tohoto parametru je k dispozici v původní práci autorů Kallinikos et al [21].
Každý z uvedených parametrů byl hodnocen dvěma způsoby:
- Manuálně pomocí softwaru CCMetrics (CCMetrics, MA Dabbah; Imaging Science and Biomedical Engineering, University of Manchester, Manchester, UK). Pro stanovení interindividuální variability bylo hodnocení manuálním softwarem provedeno nezávisle dvěma vyškolenými lékaři (IK, MH).
- Automaticky softwarem ACCMetrics (ACCMetrics, MA Dabbah; Imaging Science and Biomedical Engineering, University of Manchester, Manchester, UK) [22,23].
Po skončení vyšetření byl pacient požádán, aby semikvantitativně zhodnotil náročnost vyšetření a jeho nepříjemnost, a to s použitím stupnice:
1 – vyšetření nebylo vůbec nepříjemné;
2 – vyšetření bylo lehce nepříjemné;
3 – vyšetření bylo středně nepříjemné, ale absolvoval bych ho znovu;
4 – vyšetření bylo velmi nepříjemné, znovu bych ho nechtěl absolvovat;
5 – vyšetření bylo silně nepříjemné, téměř se nedalo vydržet.Statistická metodologie
Statistické zpracování bylo provedeno pomocí software SPSS 23.0.0.0 (IBM Corporation 2014). Iniciálně byla zhodnocena distribuce dat jednotlivých sledovaných parametrů, pro její ověření byly použity normal probability ploty (N-P ploty) a Kolmogorovův-Smirnovovův test. Hodnoty CNFL a CNFT vykazovaly normální rozdělení a hodnoty CNFD a CNBD vykazovaly log-normální rozdělení. Pro další statistické zpracování byly použity parametrické testy na logaritmicky transformovaných datech CNFD a CNBD a původních datech CNFL a CNFT. Před vlastní prezentací dat bylo v případě práce s logaritmicky transformovanými daty provedeno jejich zpětné převedení na základní formát a jako taková jsou data prezentována v tabulkách. Vzhledem k obtížné interpretaci hodnoty směrodatné odchylky (Standard Deviation, SD) u logaritmicky transformovaných dat není tato hodnota explicitně uvedena. Zviditelnění rozložení primárních hodnot kontinuálních dat bylo proto provedeno pomocí průměrů (x) a intervalů definovaných průměrem ± dvěma se směrodatnými odchylkami (x + 2 SD). Kategoriální data jsou znázorněna pomocí absolutních (relativních) četností. Na základě výsledků hodnoceného normativního souboru byla vytvořena normativní data na úrovni x ± 2 SD. Ke srovnání hodnocených parametrů mezi jednotlivými skupinami pacientů/zdravých kontrol byl použit nepárový t-test. Korelace jednotlivých parametrů s věkem byla hodnocena pomocí jednoduchého lineárního regresního modelu.
Pro analýzu spolehlivosti vyhodnocení snímků různými hodnotiteli a způsoby hodnocení (manuální/ automatická analýza) byl použit koeficient ICC (Intraclass Correlation Coefficient, varianta two-way random).
Výsledky
Náročnost vyšetření a potenciální komplikace
Vyšetření CCM proběhlo v naprosté většině případů zcela bez problémů. Z vyšetřených 125 pacientů/kontrol jsme závažnější komplikace zaznamenali pouze v jednom případě (0,8 %), a to v podobě reakce na použité lokální anestetikum (oxybuprokain) formou prekolapsového stavu u pacienta bez dosavadní anamnézy alergické reakce na lokálně anestetické preparáty. Aplikace anestetických kapek, která vyvolá přechodné (několik s až max. několik málo min trvající) lehce pálivé pocity v oblasti oka, byla obecně nejnepříjemnější částí vyšetření. U dvou dalších pacientů byla zaznamenána hypersenzitivní reakce na tyto lokálně anestetické kapky, která se projevila prolongovaným několikahodinovým trváním popsaných nepříjemných pocitů. Při použití semikvantitativní stupnice v rozsahu od 1 do 5 hodnotili pacienti vyšetření většinou jako nenáročné (1) nebo málo náročné (2), pro jednoho pacienta bylo vyšetření výrazně nepříjemné (4), a to právě v důsledku výše uvedené reakce na lokální anestetické kapky. Průměrná hodnota náročnosti vyšetření při hodnocení pacientem 1,56 ± 0,67, při hodnocení vyšetřujícím pak 1,14 ± 0,17.
Z hlediska vyšetřujících bylo pro zajištění kvalitní snímkové dokumentace velmi důležité zajištění maximálního komfortu pacienta během vyšetření (zejména pomocí jeho optimálního napolohování), protože i minimální nepohodlí způsobovalo velmi drobné pohyby těla a hlavy, které výrazně komplikovaly až znemožňovaly pořízení kvalitních snímků. U malé části pacientů bylo vyšetření ztíženo úzkou oční štěrbinou, ať už z důvodu anatomických nebo z důvodu neschopnosti pacienta více otevřít oko při obecně špatné toleranci očních vyšetření. Úzká oční štěrbina omezovala dostatečný kontakt oka s čočkou mikroskopu, který je nezbytný pro získání kvalitních snímků. U žádného z dobrovolníků nicméně nebylo nutné vyšetření ukončit předčasně bez získání požadovaných snímků.
Vlastní vyšetření pacienta nebylo v našem souboru náročné ani časově. Průměrné trvání vyšetření bylo 17,2 ± 4,6 min (rozsah 7–40 min v závislosti na spolupráci pacienta a jeho toleranci vyšetření), a to vč. vysvětlení podstaty vyšetření pacientovi, iniciální aplikace lokálních anestetik a viskoelastického gelu, nastavení mikroskopu, jeho zaostření na sledovanou vrstvu rohovky a pořízení snímkové dokumentace. Následné hodnocení jednoho snímku pak v závislosti na počtu nervových vláken trvá přibližně 3–8 min při manuálním hodnocení a zhruba 20 s (podle výkonu počítače) v případě využití automatického softwaru. Celkový čas potřebný pro vyhodnocení tří snímků u jednoho pacienta je tedy 10–25 min při manuální analýze a přibližně 1 min při analýze automatické.
Nálezy v souboru zdravých kontrol
Průměrné hodnoty jednotlivých parametrů v souboru zdravých kontrol jsou uvedeny v tab. 2. Žádný z hodnocených CCM parametrů nevykazoval významné rozdíly mezi muži a ženami (tab. 2), zachycen však byl mírný, ale již statisticky signifikantní pokles hodnot většiny parametrů (s výjimkou tortuozity) s věkem (tab. 2, obr. 4A, B). Z tohoto důvodu byly výsledky dále zpracovány odděleně ve třech věkově definovaných podskupinách zdravých kontrol (do 30 let, 30–50 let, nad 50 let) (tab. 1, 2), pro které byla následně stanovena i vlastní normativní data (tab. 2). V případě CNFD, CNFL a CNBD jsou v tabulce zvýrazněny dolní normální limity, a abnormitou je tedy hodnota pod úrovní uvedeného limitu. Pro CNFT je zvýrazněná hodnota naopak horním normálním limitem a abnormální jsou hodnoty přesahující uvedenou normu (tab. 2).
Tab. 2. Sumarizace nálezů jednotlivých parametrů korneální konfokální mikroskopie v souboru zdravých dobrovolníků a odvozený normální rozsah hodnot na úrovni x ± 2 SD (hodnotitel MH). 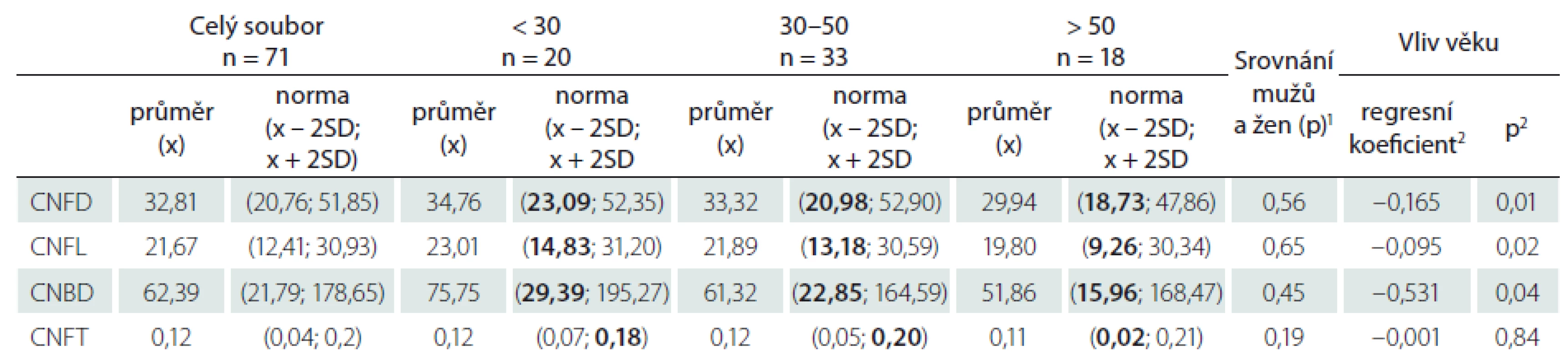
1 Srovnání hodnot mezi muži a ženami bylo provedeno nepárovým t-testem. 2 Hodnota regresního koeficientu a jeho statistické významnosti z jednoduchého lineárního modelu. Pozn. CNFD, CNFL a CNBD jsou považovány za abnormální v případě, že výsledná hodnota je pod úrovní dolního normálního limitu rozsahu hodnot příslušného parametru v normativním souboru, abnormitou CNFT je naopak hodnota nad horním normálním limitem zmíněného normálního rozsahu hodnot. Pro lepší orientaci jsou relevantní normativní data v tabulce vyznačena tučně. CNFD – hustota korneálních nervových vláken (Corneal Nerve Fiber Density), CNFL – délka korneálních nervových vláken (Corneal Nerve Fiber Lenght), CNBD – hustota větví korneálních nervových vláken (Corneal Nerve Branch Density), CNFT – koeficient vinutosti (Corneal Nerve Fiber Tortuosity), x – průměr, SD – směrodatná odchylka (Standard Deviation). Obr. 4. Bodové grafy znázorňující hodnoty CNFD (A) a CNFL (B) v závislosti na věku proložené lineární regresní přímkou, a dvěma přímkami ohraničujícími 5. a 95. percentil. Výsledky z jednoduchého lineárního regresního modelu prokazují signifikantní roční úbytek CNFD (–0,165 no./mm<sup>2</sup>) a CNFL (–0,095 mm/mm<sup>2</sup>). Fig. 4. Scatter plots showing CNFD (A) and CNFL (B) values by age with linear regression line and the 5<sup>th</sup> and 95<sup>th</sup> percentile. Linear regression analysis shows significant yearly decrease of both CNFD (–0.165 no./mm<sup>2</sup>) and CNFL (–0.095 mm/mm<sup>2</sup>). 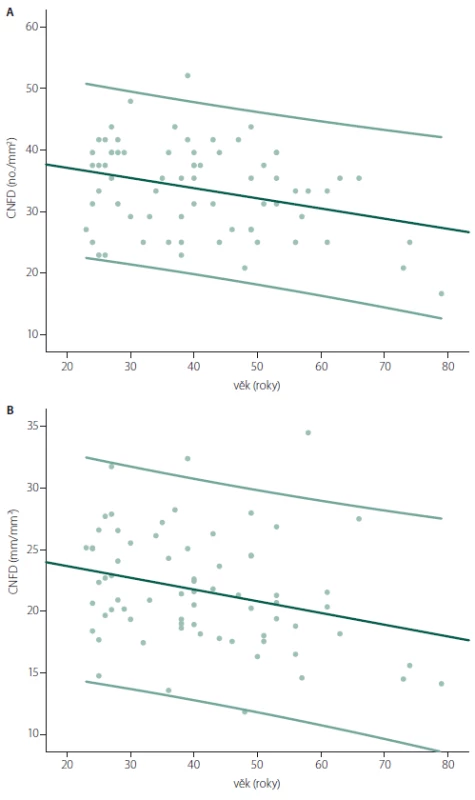
Platnost uvedených normativních dat byla dále ověřena srovnáním s publikovanou rozsáhlou multicentrickou normativní studií, jež využila manuální způsob hodnocení snímků, a to identický jako v naší studii [20]. Počet abnormit jednotlivých parametrů ve sledovaném normativním souboru při použití vlastních a dříve publikovaných normativních dat je uveden v tab. 3.
Tab. 3. Výskyt abnormit jednotlivých parametrů ve skupině zdravých dobrovolníků při použití vlastních normativních dat (viz tab. 2) a multicentrické normativní studie (Tavakoli et al, 2015) (hodnotitel MH). 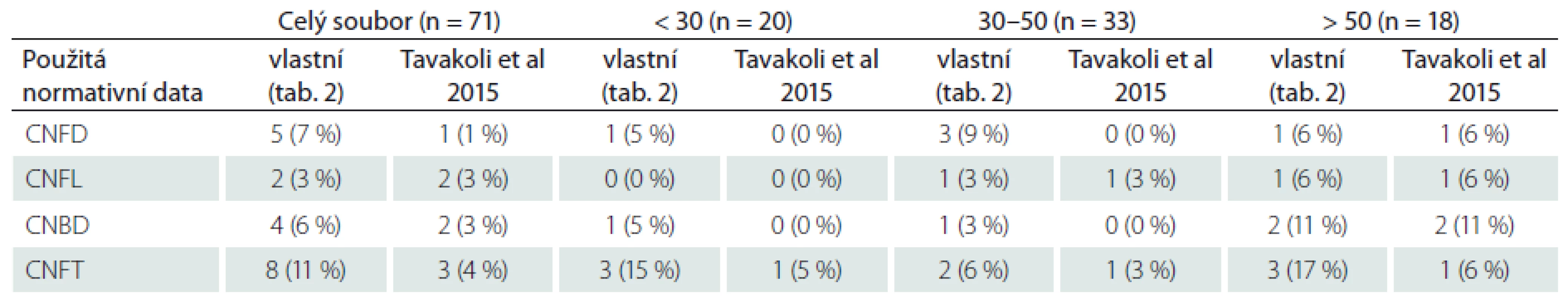
Hodnoty jsou uvedeny jako absolutní (relativní četnosti). CNFD – hustota korneálních nervových vláken (Corneal Nerve Fiber Density), CNFL – délka korneálních nervových vláken (Corneal Nerve Fiber Lenght), CNBD – hustota větví korneálních nervových vláken (Corneal Nerve Branch Density), CNFT – koeficient vinutosti (Corneal Nerve Fiber Tortuosity). Nálezy v souboru pacientů s DPN
Věkové složení souborů pacientů s DPN a zdravých kontrol bylo v naší studii odlišné. Srovnání sledovaných parametrů mezi těmito skupinami bylo proto za účelem eliminace vlivu věku provedeno odděleně v jednotlivých věkových skupinách (tab. 4). Hodnoty CNFD, CNFL a CNBD byly u pacientů s DPN ve všech věkových skupinách signifikantně nižší než v odpovídajících souborech zdravých kontrol (tab. 4). Vzestup CNFT se nám podařilo prokázat pouze v nejstarší věkové skupině (tab. 4).
Tab. 4. Průměrné hodnoty parametrů korneální konfokální mikroskopie v jednotlivých věkových skupinách pacientů s DPN a zdravých kontrol. 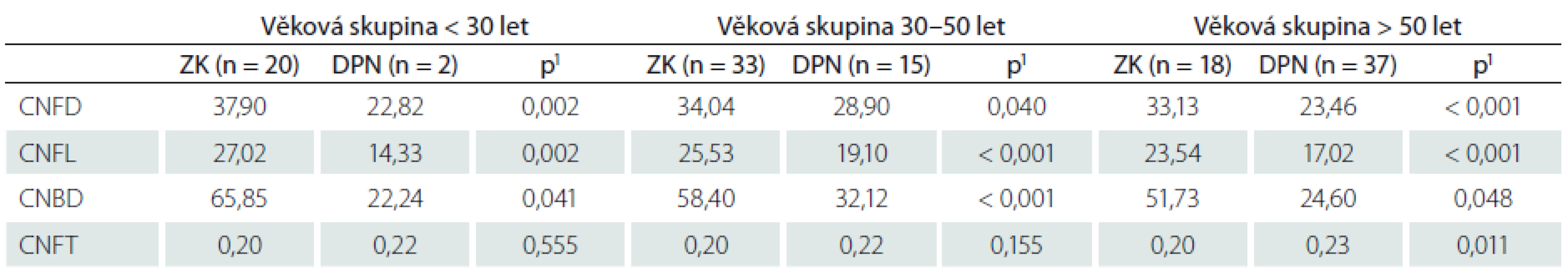
1 Srovnání hodnot jednotlivých parametrů mezi pacienty s DPN a ZK bylo provedeno nepárovým t-testem. CNFD – hustota korneálních nervových vláken (Corneal Nerve Fiber Density), CNFL – délka korneálních nervových vláken (Corneal Nerve Fiber Lenght), CNBD – hustota větví korneálních nervových vláken (Corneal Nerve Branch Density), CNFT – koeficient vinutosti (Corneal Nerve Fiber Tortuosity), ZK – zdravé kontroly, DPN – pacienti s diabetickou polyneuropatií. Spolehlivost hodnocení snímků různými hodnotiteli a srovnání s automatickou analýzou
Vyhodnocení spolehlivosti (reliability) hodnocení snímků je uvedeno v tab. 5. Spolehlivost manuálního hodnocení snímků mezi dvěma různými hodnotiteli (MH a IK) vyjádřená pomocí intra-class korelačního koeficientu vykazuje hodnoty > 0,8 pro všechny parametry kromě tortuozity. Tyto hodnoty odpovídají výborné shodě nálezů mezi hodnotiteli. Srovnání výsledků manuální a automatické analýzy naopak dobrou shodu neprokazuje (tab. 5). Při hodnocení automatickým softwarem byly všechny hodnocené parametry (CNFD, CNFL, CNBD) signifikantně nižší oproti analýze manuální (tab. 5).
Tab. 5. Srovnání nálezů jednotlivých parametrů korneální konfokální mikroskopie při manuální analýze více hodnotiteli a současně mezi manuální a automatickou analýzou. 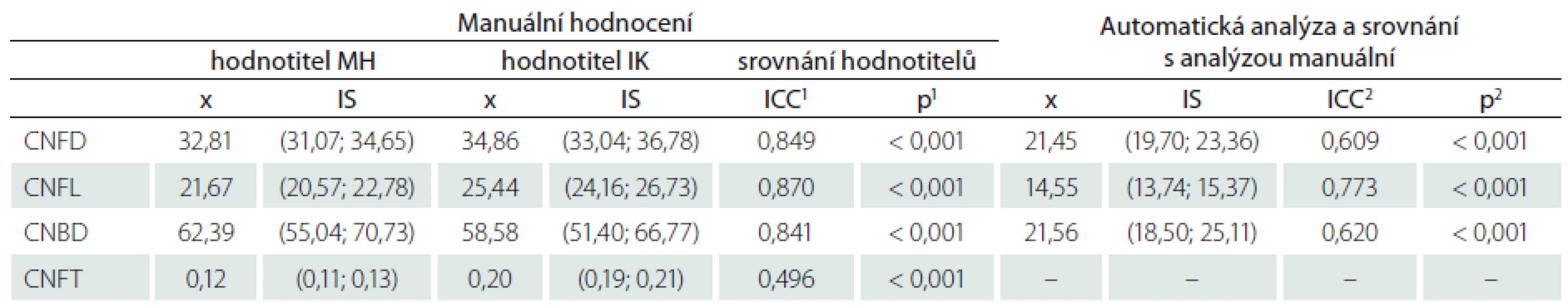
1 Srovnání nálezů jednotlivých parametrů mezi oběma hodnotiteli (MH, IK) při hodnocení manuální analýzou pomocí koeficientu ICC. 2 Srovnání nálezů jednotlivých parametrů mezi automatickou analýzou a průměrem hodnot manuální analýzy obou hodnotitelů (MH, IK). Srovnání je provedeno pomocí koefi cientu ICC. Hodnoty tortuozity nejsou uvedeny, protože nejsou při automatické analýze hodnoceny. CNFD – hustota korneálních nervových vláken (Corneal Nerve Fiber Density), CNFL – délka korneálních nervových vláken (Corneal Nerve Fiber Lenght), CNBD – hustota větví korneálních nervových vláken (Corneal Nerve Branch Density), CNFT – koeficient vinutosti (Corneal Nerve Fiber Tortuosity), x – průměr, ICC – intraclass correlation coefficient, IS – interval spolehlivosti. Diskuze
Prezentovaná studie v souhrnu prokázala jednoduchost, bezpečnost a nízkou časovou i metodickou náročnost vyšetření rohovkové inervace pomocí konfokální mikroskopie na poměrně rozsáhlém souboru zdravých kontrol a skupině pacientů s DPN. Na základě zjištěných výsledků byla vytvořena vlastní normativní data a současně byla ověřena platnost recentně publikovaných normativních dat z rozsáhlé multicentrické studie [20] pro českou populaci. U pacientů s DPN byly prokázány signifikantní změny všech sledovaných parametrů, což potvrzuje využitelnost metody jako alternativního konfirmačního testu DPN. Pro hodnocení CCM snímků lze využít manuální i automatickou analýzu. Naše studie však prokázala, že oba typy analýzy nejsou vzájemně zaměnitelné. Při manuální analýze byla prokázána velmi dobrá shoda dvou hodnotitelů ve všech sledovaných parametrech s výjimkou tortuozity. Metoda tedy vykazuje uspokojivou inter-rater reliabilitu. Naopak hodnocení automatickým softwarem vykazovalo ve srovnání s manuální analýzou signifikantně nižší hodnoty CNFD, CNFL i CNBD. Při interpretaci nálezů CCM je proto nutné zohlednit typ analýzy a volit vždy jednotný způsob hodnocení nálezů pro všechny pacienty v příslušné studii.
Naše zkušenost potvrdila uspokojivou toleranci vyšetření rohovkové inervace pomocí konfokální mikroskopie prakticky u všech vyšetřených pacientů a nízkou náročnost metodiky pro vyšetřující lékaře. Jedinou zaznamenanou komplikací byla reakce na lokální anestetikum aplikované iniciálně při vyšetření: u jednoho pacienta jsme zaznamenali celkovou reakci ve formě prekolapsového stavu, u dvou pacientů pak prolongované (několik hod trvající) nepříjemné pocity v oblasti oka charakteru pálení a řezání. Oba zmíněné typy nežádoucích účinků jsou uvedeny i v příbalovém letáku Benoxi kapek a při jejich aplikaci je třeba s podobnými reakcemi počítat, i když jsou obecně poměrně málo časté. Před vyšetřením je také vhodné se na případnou anamnézu alergických reakcí na lokální anestetika cíleně dotazovat a v případě pozitivní anamnézy vyšetření neprovádět. Indikaci k vyšetření CCM je s ohledem na používání lokálních anestetik obecně vhodné pečlivě zvažovat také u pacientů s polyvalentními alergiemi, a to i v případě, že není anamnesticky známa přímo alergie na lokálně-anestetické preparáty. Je však třeba si uvědomit, že stejný problém nastává i u alternativní konfirmační metody SFN, tedy u kožní biopsie, při které je vzorek odebírán v lokální infiltrační anestezii.
Nálezy v prezentovaném souboru zdravých kontrol jsou prakticky identické jako publikované výsledky velké multicentrické normativní studie hodnotící sledované parametry CCM na souboru 343 zdravých dobrovolníků [20], stejně jako v dříve publikovaných menších souborech zdravých kontrol [15,24,25]. Tato skutečnost potvrzuje správnost použité metodiky hodnocení jednotlivých CCM parametrů a její srovnatelnost s mezinárodním standardem. Velmi blízká uvedené studii jsou také derivovaná normativní data. Při použití obou typů norem jsme abnormitu jednotlivých parametrů zachytili jen u malé (a v obou případech velmi podobné) části normativního souboru, což umožňuje v české populaci použít oba typy normativních dat.
Identicky jako zmíněná multicentrická normativní studie prokázaly i naše výsledky určitou závislost většiny parametrů CCM na věku pacienta, i když věkově podmíněné změny byly v případě obou studií spíše mírné (tab. 2) [20]. Při hodnocení nálezů je proto vhodné zvažovat věk pacienta a používat věkově stratifikovaná normativní data, která byla z těchto důvodů vytvořena i v naší práci.
Prokázán naopak nebyl signifikantní vliv pohlaví pacientů. Tavakoli et al sice uvádí oddělené normy pro muže a ženy, přímé srovnání hodnot CCM parametrů mezi oběma pohlavími však v práci překvapivě uvedeno není a orientační srovnání hodnot v souboru mužů a žen v této práci svědčí proti významným rozdílům sledovaných parametrů mezi muži a ženami [20]. I v tomto směru tak výsledky naší studie odpovídají již publikovaným nálezům.
Hodnocení rohovkové inervace pomocí konfokální mikroskopie se v současnosti využívá především v diagnostice DPN [3,5,9]. V posledních letech byla publikována řada studií potvrzujících využitelnost metodiky v hodnocení přítomnosti a tíže periferní neuropatie u pacientů s DM 1. [3,15,26,27] i 2. typu [3,24,25]. Výhodou vyšetření je jeho neinvazivita a téměř neomezená možnost opakování testu a tedy dobrá využitelnost např. pro dlouhodobé sledování pacientů [15]. Inervace rohovky vykazuje signifikantní změny již u pacientů s recentním DM 2. typu [25] a dokonce u jedinců s prediabetickými stavy (tj. především poruchou glukózové tolerance) [28]. Metoda je však využitelná i při hodnocení neuropatie jiné než diabetické etiologie [17,18], vč. idiopatické SFN [2].
Uvedené nálezy potvrdila i naše studie, v níž byly hodnoty hustoty i celkové délky nervových vláken u pacientů s DPN signifikantně nižší ve srovnání se souborem zdravých kontrol. Soubor zahrnoval pacienty s DM 1. i 2. typu, což potvrzuje využitelnost metody v hodnocení neuropatie u pacientů s oběma typy DM. Hodnoty jednotlivých parametrů zjištěné v našem souboru pacientů s DPN odpovídají dříve publikovaným nálezům u obdobných souborů pacientů [24–28] a opět nepřímo potvrzují správnost používané metodiky.
Jedním z mála limitů metodiky je při manuálním hodnocení nálezů potřeba zkušeného a vyškoleného jedince – hodnotitele – a čas, který je nutný ke zhodnocení jednoho pacienta (cca 10–25 min). Z tohoto důvodu byl univerzitou v Manchestru vyvinut software k automatické analýze CCM (ACCMetrics), který zredukoval čas potřebný k hodnocení na několik vteřin na snímek [11,29] a snížil nutnost erudice hodnotitelů. Dosud však bylo publikováno jen minimum studií poskytujících srovnání manuální a automatické analýzy CCM parametrů [29,30]. Podobně je k dispozici pouze omezená evidence o spolehlivosti nálezů CCM při hodnocení různými hodnotiteli [31,32]. V další části studie jsme se proto pokusili zaměřit na hodnocení spolehlivosti CCM při využití více hodnotiteli a na srovnání manuální a automatické analýzy.
Hodnocení inter-rater reliability jednotlivých parametrů CCM prokázalo při manuální analýze výbornou spolehlivost nálezů všech sledovaných parametrů s výjimkou tortuozity. Výsledky velmi obdobné naší studii vč. vlastních hodnot ICC koeficientů mezi více hodnotiteli prokázali např. Hertz et al [31]. Podobně jako naše nálezy byla i v této studii nejhůře reprodukovatelným parametrem tortuozita, zatímco ostatní parametry byly z hlediska shody nálezů mezi více hodnotiteli signifikantně lepší a vzájemně srovnatelné. Jiné studie prokázaly horší reprodukovatelnost NFBD. Nejlépe reprodukovatelným parametrem je ve většině sledovaných studií (vč. naší) délka nervových vláken rohovky, případně jejich hustota – tyto dva parametry lze tedy doporučit jako nejvhodnější markery pro longitudinální sledování pacientů [32].
Intra-class korelační koeficienty pro srovnání manuální a automatické analýzy byly významně nižší ve srovnání s ICC reflektujícími spolehlivost nálezů při manuální analýze snímků více hodnotiteli. Všechny hodnocené parametry (CNFD, CNFL a CNBD) vykazovaly při hodnocení automatickou analýzou signifikantně nižší hodnoty ve srovnání s analýzou manuální. Podkladem těchto rozdílů jsou pravděpodobně především technické aspekty, jako je nižší kvalita některých snímků (např. drobné vzduchové bubliny, přítomnost linií způsobených přílišným tlakem na rohovku), díky nimž automatický software neidentifikuje správně některá nervová vlákna. Těmto problémům se však v běžné praxi nelze úplně vyhnout a pomocí manuální analýzy lze tyto snímky bez problémů hodnotit. Prakticky identické nálezy se signifikantně nižšími hodnotami CNFL při použití automatické analýzy ve srovnání s analýzou manuální byly prokázány i v dalších podobných studiích [29,30]. Tyto rozdíly jsou tedy systémové a nelze je vysvětlit event. horší kvalitou snímků v našem centru. Výsledky všech zmíněných studií vč. naší tak ukazují, že obě metody hodnocení (manuální a automatická) nejsou vzájemně zaměnitelné a není možné je v rámci jedné studie libovolně střídat. Při hodnocení je obecně nutné používat normativní data vytvořená pro příslušný typ analýzy. Pro manuální analýzu tak lze doporučit využití dat z práce autorů Tavakoli et al [20] nebo z naší studie, zatímco pro automatický software nejsou validní normativní data prozatím k dispozici [29].
Seznam použitých zkratek
CCM – konfokální mikroskopie rohovky (Corneal Confocal Microscopy)
CNBD – hustota větví korneálních nervových vláken (Corneal Nerve Branch Density)
CNFD – hustota korneálních nervových vláken (Corneal Nerve Fiber Density)
CNFL – délka korneálních nervových vláken (Corneal Nerve Fiber Lenght)
CNFT – koeficient vinutosti (Corneal Nerve Fiber Tortuosity)
DM – diabetes mellitus
DPN – diabetická polyneuropatie
ICC – intraclass correlation coefficient
SD – směrodatná odchylka (Standard Deviation)
SFN – neuropatie tenkých vláken (Small Fiber Neuropathy)Práce byla podpořena projektem institucionální podpory FN Brno MZ ČR – RVO (FNBr – 65269705) a projektem specifického výzkumu č. MUNI/A/1072/2015 z programu podpory studentských projektů na Masarykově univerzitě.
Autorky č. 1 a 2 (IK a MH) se podílely stejnou měrou na akvizici dat a přípravě manuskriptu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Eva Vlčková, Ph.D.
Neurologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: evlckova@email.cz
Přijato k recenzi: 4. 7. 2016
Přijato do tisku: 17. 8. 2016
Zdroje
1. Tavakoli M, Hossain P, Malik RA. Clinical applications of corneal confocal microscopy. Clin Ophthalmol 2008;2(2):435 – 45.
2. Tavakoli M, Marshall A, Pitceathly R, et al. Corneal confocal microscopy: a novel means to detect nerve fibre damage in idiopathic small fibre neuropathy. Exp Neurol 2010;223(1):245 – 50. doi: 10.1016/ j.expneurol.2009.08.033.
3. Tavakoli M, Quattrini C, Abbott C, et al. Corneal confocal microscopy: a novel noninvasive test to diagnose and stratify the severity of human diabetic neuropathy. Diabetes Care 2010;33(8):1792 – 7. doi: 10.2337/ dc10-0253.
4. Ferrari G, Gemignani F, Macaluso C. Chemotherapy--associated peripheral sensory neuropathy assessed using in vivo corneal confocal microscopy. Arch Neurol 2010;67(3):364 – 5. doi: 10.1001/ archneurol.2010.17.
5. Papanas N, Ziegler D. Corneal confocal microscopy: a new technique for early detection of diabetic neuropathy. Curr Diab Rep 2013;13(4):488 – 99. doi: 10.1007/ s11892-013-0390-z.
6. Guthoff RF, Zhivov A, Stachs O. In vivo confocal microscopy, an inner vision of the cornea – a major review. Clin Exp Ophthalmol 2009;37(1):100 – 17. doi: 10.1111/ j.1442-9071.2009.02016.x.
7. Müller LJ, Pels L, Vrensen GF. Ultrastructural organization of human corneal nerves. Invest Ophthalmol Vis Sci 1996;37(4):476 – 88.
8. Pawley JB, Masters BR. Handbook of biological confocal microscopy. Optical Engineering 1996;35(9):2765 – 6.
9. Papanas N, Ziegler D. Corneal confocal microscopy: recent progress in the evaluation of diabetic neuropathy. J Diabetes Investig 2015;6(4):381 – 9. doi: 10.1111/ jdi.12335.
10. Chen X, Graham J, Dabbah MA, et al. Small nerve fiber quantification in the diagnosis of diabetic sensorimotor polyneuropathy: comparing corneal confocal microscopy with intraepidermal nerve fiber density. Diabetes Care 2015;38(6):1138 – 44. doi: 10.2337/ dc14-2422.
11. Petropoulos IN, Alam U, Fadavi H, et al. Rapid automated diagnosis of diabetic peripheral neuropathy with in vivo corneal confocal microscopy. Invest Ophthalmol Vis Sci 2014;55(4):2071 – 8. doi: 10.1167/ iovs.13-13787.
12. Lacomis D. Small-fiber neuropathy. Muscle Nerve 2002;26(2):173 – 88.
13. Buršová Š, Vlčková E, Hnojčíková M, et al. Vyšetření hustoty intraepidermálních nervových vláken z kožní biopsie – normativní data. Cesk Slov Neurol N 2012;75/ 108(4):455 – 9.
14. Vlckova-Moravcova E, Bednarik J, Dusek L, et al. Diagnostic validity of epidermal nerve fiber densities in painful sensory neuropathies. Muscle Nerve 2008;37(1):50 – 60.
15. Pritchard N, Edwards K, Dehghani C, et al. Longitudinal assessment of neuropathy in type 1 diabetes using novel ophthalmic markers (LANDMark): study design and baseline characteristics. Diabetes Res Clin Pract 2014;104(2):248 – 56. doi: 10.1016/ j.diabres.2014.02.011.
16. Lovblom LE, Halpern EM, Wu T, et al. In vivo corneal confocal microscopy and prediction of future-incident neuropathy in type 1 diabetes: a preliminary longitudinal analysis. Can J Diabetes 2015;39(5):390 – 7. doi: 10.1016/ j.jcjd.2015.02.006.
17. Tavakoli M, Marshall A, Thompson L, et al. Corneal confocal microscopy: a novel noninvasive means to diagnose neuropathy in patients with Fabry disease. Muscle Nerve 2009;40(6):976 – 84. doi: 10.1002/ mus.21383.
18. Tavakoli M, Marshall A, Banka S, et al. Corneal confocal microscopy detects small-fiber neuropathy in Charcot-Marie-Tooth disease type 1A patients. Muscle Nerve 2012;46(5):698 – 704. doi: 10.1002/ mus.23377.
19. Kass-Iliyya L, Javed S, Gosal D, et al. Small fiber neuropathy in Parkinson‘s disease: a clinical, pathological and corneal confocal microscopy study. Parkinsonism Relat Disord 2015;21(12):1454 – 60. doi: 10.1016/ j.parkreldis.2015.10.019.
20. Tavakoli M, Ferdousi M, Petropoulos IN, et al. Normative values for corneal nerve morphology assessed using corneal confocal microscopy: a multinational normative data set. Diabetes Care 2015;38(5):838 – 43. doi: 10.2337/ dc14-2311.
21. Kallinikos P, Berhanu M, O‘Donnell C, et al. Corneal nerve tortuosity in diabetic patients with neuropathy. Invest Ophthalmol Vis Sci 2004;45(2):418 – 22.
22. Dabbah MA, Graham J, Petropoulos I, et al. Dual-model automatic detection of nerve-fibres in corneal confocal microscopy images. Med Image Comput Comput Assist Interv 2010;13(1):300 – 7.
23. Dabbah MA, Graham J, Petropoulos IN, et al. Automatic analysis of diabetic peripheral neuropathy using multi-scale quantitative morphology of nerve fibres in corneal confocal microscopy imaging. Med Image Anal 2011;15(5):738 – 47. doi: 10.1016/ j.media.2011.05.016.
24. Nitoda E, Kallinikos P, Pallikaris A, et al. Correlation of diabetic retinopathy and corneal neuropathy using confocal microscopy. Curr Eye Res 2012;37(10):898 – 906. doi: 10.3109/ 02713683.2012.683507.
25. Ziegler D, Papanas N, Zhivov A, et al. Early detection of nerve fiber loss by corneal confocal microscopy and skin biopsy in recently diagnosed type 2 diabetes. Diabetes 2014;63(7):2454 – 63. doi: 10.2337/ db13-1819.
26. Ahmed A, Bril V, Orszag A, et al. Detection of diabetic sensorimotor polyneuropathy by corneal confocal microscopy in type 1 diabetes: a concurrent validity study. Diabetes Care 2012;35(4):821 – 8. doi: 10.2337/ dc11-1396.
27. Halpern EM, Lovblom LE, Orlov S, et al. The impact of common variation in the definition of diabetic sensorimotor polyneuropathy on the validity of corneal in vivo confocal microscopy in patients with type 1 diabetes: a brief report. J Diabetes Complicat 2012;27(3):240 – 2. doi: 10.1016/ j.jdiacomp.2012.10.011.
28. Asghar O, Petropoulos IN, Alam U, et al. Corneal confocal microscopy detects neuropathy in subjects with impaired glucose tolerance. Diabetes Care 2014;37(9):2643 – 6. doi: 10.2337/ dc14-0279.
29. Ostrovski I, Lovblom LE, Farooqi MA, et al. Reproducibility of in vivo corneal confocal microscopy using an automated analysis program for detection of diabetic sensorimotor polyneuropathy. PLoS One 2015;10(11):e0142309. doi: 10.1371/ journal.pone.0142309.
30. Pacaud D, Romanchuk KG, Tavakoli M, et al. The reliability and reproducibility of corneal confocal microscopy in children. Invest Ophthalmol Vis Sci 2015;56(9):5636 – 40. doi: 10.1167/ iovs.15-16995.
31. Hertz P, Bril V, Orszag A, et al. Reproducibility of in vivo corneal confocal microscopy as a novel screening test for early diabetic sensorimotor polyneuropathy. Diabet Med 2011;28(10):1253 – 60. doi: 10.1111/ j.1464-5491.2011.03299.x.
32. Petropoulos IN, Manzoor T, Morgan P, et al. Repeatability of in vivo corneal confocal microscopy to quantify corneal nerve morphology. Cornea 2013;32(5):e83 – 9. doi: 10.1097/ ICO.0b013e3182749419.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2017 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Úskalí diagnostiky atypické formy kongenitální svalové dystrofie – parciálního deficitu merosinu – kazuistiky
- Endoskopická exstirpace koloidní cysty III. mozkové komory
-
Analýza dat v neurologii
LXI. Závěrečné příklady k analýzám trendů v kontingenčních tabulkách -
Zpráva o činnosti Specializační oborové rady
Neurologie v roce 2016 - Zemřel prof. MUDr. Stanislav Němeček, DrSc.
- Životné jubileum prof. MUDr. Pavla Traubnera, PhD.
- Prof. MUDr. Evžen Růžička, DrSc., FCMA, FEAN slaví 60 let
- Zpráva z výročního kongresu České neurochirurgické společnosti
- Zpráva o 9. mikrovaskulárním workshopu
- Je třeba léčit motorické tiky
- Není třeba léčit motorické tiky
-
Komentář ke kontroverzím
Je třeba léčit motorické tiky? - Kmenové buňky v léčbě amyotrofické laterální sklerózy – přehled současných klinických zkušeností
- Editorial
- Genetika atypického parkinsonizmu
- Současný pohled na kontraindikace a komplikace elektromyografie
- Hodnocení rohovkové inervace pomocí konfokální mikroskopie
- Diabetická retinopatie a změny nervových vláken hodnocené konfokální mikroskopií rohovky
- Validace dotazníku kvality života pro pacienty s myastenií – česká verze MG-QOL15
- Periodické pohyby končetinami ve spánku jsou závažnější u narkolepsie s kataplexií než u narkolepsie bez kataplexie
- Vztah časných metabolických změn mozku a vybraných vstupních parametrů u pacientů posubarachnoidálním krvácení z prasklého aneuryzmatu
- Transkraniální sonografie – možnosti zobrazení intrakraniálních struktur v B obraze
- Změna mikrobiologickýho vzorku u pacientů s potvrzenou bakteriální meningitidou po postkraniotomiální operaci
- Základní neurologické vyšetření – nastal čas pro změny?
- Základní neurologické vyšetření – nastal čas pro změny?
- Základní neurologické vyšetření – nastal čas pro změny?
- Neurologický a MR skríning pacientů s Crohnovou chorobou může zvýšit bezpečnost dlouhodobé terapie anti-TNF-α
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Není třeba léčit motorické tiky
- Současný pohled na kontraindikace a komplikace elektromyografie
- Základní neurologické vyšetření – nastal čas pro změny?
- Endoskopická exstirpace koloidní cysty III. mozkové komory
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



