-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nová éra endovaskulární terapie v léčbě akutních iktů
The New Era of Endovascular Therapy in the Treatment of Acute Stroke
The endovascular therapy (EVT) is the most efficacious treatment for recanalisation of large vessel artery occlusion. Recently published prospective randomized controlled trials (RCT) demonstrated better outcomes with combined EVT and intravenous thrombolysis (IVT) versus IVT alone in the treatment of proximal arterial occlusion in the anterior cerebral circulation. In this article seven of these RCT studies published in 2014 - 2015 are reviewed. In the latter part of the article, the factors influencing final clinical outcome are discussed: age, comorbidities, hyperglycemia on admission, signs of early ischemia as evaluaed by Alberta Stroke Program Early CT Score (ASPECTS), absence of collateral supply, time before recanalisation occurs and application general anesthesia. The careful selection of patients indicated for EVT is of utmost importance for the succes of therapy.
Key words:
acute ischemic stroke – endovascular therapy – mechanical thrombectomy – stent-retriever
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: M. Tinková; P. Malý
Působiště autorů: Komplexní cerebrovaskulární centrum, Neurologické oddělení, ÚVN – VFN Praha
Vyšlo v časopise: Cesk Slov Neurol N 2016; 79/112(2): 152-159
Kategorie: Přehledný referát
Souhrn
Endovaskulární terapie (EVT) je nejúčinnější metoda léčby akutního uzávěru velké tepny (arteria carotis interna, arteria cerebri media, arteria basilaris). Recentně publikované prospektivní randomizované kontrolované studie porovnávající kombinovanou EVT a medikamentózní léčbu (intravenózní trombolýzu; IVT) prokázaly superioritu kombinované EVT a IVT oproti samotné IVT v terapii akutních ischemických příhod v karotickém povodí. Cílem naší práce je podat přehled sedmi studií publikovaných v letech 2014 – 2015. V druhé části pojednáváme o faktorech, které ovlivňují výsledný klinický stav: věk, komorbidity, hyperglykemie při příjmu, známky časné ischemie na CT hodnocené pomocí Alberta Stroke Program Early CT Score (ASPECTS), absence kolaterálního zásobení, doba do dosažení rekanalizace a použití celkové anestezie. Úspěch EVT závisí na správném výběru vhodných pacientů.
Klíčová slova:
akutní ischemická cévní mozková příhoda – endovaskulární léčba – mechanická trombektomie – stent-retrieverÚvod
Standardní léčba u akutní ischemické cévní mozkové příhody (CMP) je intravenózní trombolýza (IVT) tkáňovým aktivátorem plazminogenu (t-PA) do 4,5 hod od vzniku symptomů. Endovaskulární terapie (EVT) (intraarteriální trombolýza – selektivní podání trombolytika do uzavřené tepny, mechanická trombektomie – odstranění trombu pomocí speciálních extrakčních zařízení, emergentní stenting krkavice) patřila dlouhou dobu k experimentálním metodám. S rozvojem endovaskulárních technik a vysokou úspěšností léčby neurointervenčními radiology došlo v minulých letech k nárůstu intraarteriálních výkonů. Randomizované studie publikované v roce 2013 – 2014 neprokázaly benefit EVT oproti klasické IVT při léčbě akutních iktů. Byly to studie: Mechanical Retrieval and Recanalisation of Stroke Clots Using Embolectomy (MR RESCUE) [1], The Interventional Management of Stroke Trial III (IMS III) [2] a Randomized Controlled Trial on Intra-Arterial vs. Intravenous Thrombolysis in Acute Ischemic Stroke (SYNTHESIS Expansion) [3]. Následně byl design těchto studií podroben kritice [4,5]. Za nedostatek bylo považováno dlouhé časové období, po které probíhal nábor pacientů (v MR RESCUE 2006 – 2012), dlouhá doba od provedení zobrazovacích metod do punkce třísla (i 120 min v MR RESCUE), použití starší generace extrakčních zařízení, nevhodný výběr pacientů – s rozsáhlými ischemickými změnami na vstupním CT – v IMS III mělo 42,4 % pacientů Alberta Stroke Program Early CT score (ASPECTS) 7 a méně – a dlouhá doba od vzniku iktu do začátku intraarteriální léčby [6,7].
Průlomovým okamžikem v éře endovaskulární terapie akutních iktů se stalo zveřejnění předběžných výsledků studie Multicenter Randomized Clinical Trial of Endovascular Treatment of Acute Ischemic Stroke in Netherlands (MR CLEAN) v Istanbulu (9th World Stroke Conference) v říjnu 2014. Tato prospektivní randomizovaná studie byla realizována od prosince 2010 do března 2014 v 17 holandských iktových centrech a zahrnovala 500 pacientů [8,9]. Ukázala nezpochybnitelnou superioritu endovaskulárního postupu, výsledný dobrý klinický stav (mRS 0 – 2 po 90 dnech od vzniku iktu) ve skupině pacientů léčených pouze IVT byl pouze v 19,1 %, při kombinované IVT a EVT ve 32,6 %.
Na International Stroke Conference (ISC) v Nashvillu, Tennessee, konané v únoru 2015 byly prezentovány výsledky dalších tří studií: Endovascular Treatment for Small Core and Anterior Circulation Proximal Occlusion with Emphasis on minimizing CT to Recanalisation Times (ESCAPE), autoři Goyal et al [10], Solitaire With the Intention For Thrombectomy as PRimary Treatment for Acute Ischemic Stroke (SWIFT-PRIME) [11] a Extending the Time for Thrombolysis in Emergency Neurological Deficits with Intra-Arterial therapy (EXTEND-IA), autoři Campbell et al [12] kladně hodnotící časnou endovaskulární léčbu. Tyto práce prokázaly ještě větší procento dobrého výsledného klinického stavu mRS 0 – 2 u pacientů léčených kombinovanou IVT a EVT, ve studii EXTEND-IA v 71 %. Podmínkou úspěchu ve zmíněných studiích bylo zkrácení času od nástupu symptomů k intervenčnímu výkonu, vhodný výběr pacientů a použití nejnovější technologie.
Na European Stroke Organisation (ESO)Conference, konané 17. – 19. dubna 2015 v Glasgow, byly prezentovány další tři studie: Randomized Trial of Revascularisation with Solitaire FR Device versus Best Medical Treatment of Acute Stroke Due to Anterior Circulation Large Vessel Occlusion (REVASCAT) [13], THRombectomie des Artéres CErébrales (THRACE) [14], The Randomized, Concurrent Trial to Assess the Penumbra System in the Treatment of Acute Stroke (THERAPY) [15]. Uvedených prvních pět studií prokázalo superioritu kombinované EVT a IVT léčby oproti samotné IVT (THERAPY byla předčasně ukončena, prokázala nesignifikantně lepší výsledky v intervenční skupině [16], v THRACE nebyla použita moderní generace stent-retrieverů.
Rok 2015 se stává zlomovým okamžikem, od kterého se endovaskulární léčba u akutních iktů mění z experimentální na doporučenou. Základní otázkou zůstává, kdo je vhodným kandidátem pro EVT.
Přehled jednotlivých studií
Analyzovány jsou následující studie: MR CLEAN, ESCAPE, EXTEND-IA, SWIFT PRIME, REVASCAT, THERAPY a THRACE. V tab. 1 jsou uvedeny následující parametry: časové rozmezí, po které probíhaly jednotlivé studie, počet pacientů léčených IVT a kombinovanou IVT a EVT, věk (medián), vstupní tíže neurologického deficitu vyjádřená National Institutes of Health Stroke Scale (NIHSS), Alberta Stroke Program Early CT Score (ASPECTS), užité zobrazovací metody, čas od vzniku symptomů do punkce třísla, od punkce třísla do rekanalizace, stupeň výsledné rekanalizace Thrombolysis in Cerebral Infarction (TICI), výskyt symptomatického intrakraniálního krvácení (sICH) a výsledné mRS 0 – 2 hodnocené po 90 dnech od vzniku iktu. Údaje uvedené u studií THERAPY a THRACE nejsou kompletní, vycházejí z prezentací na ESO Conference v Glasgow 2015.
Tab. 1. Randomizované studie MR CLEAN, ESCAPE, EXTEND-IA, SWIFT PRIME, REVASCAT, THERAPY a THRACE – srovnání výsledků léčby samotné intravenózní trombolýzy (IVT) a kombinované IVT a endovaskulární léčby (EVT). 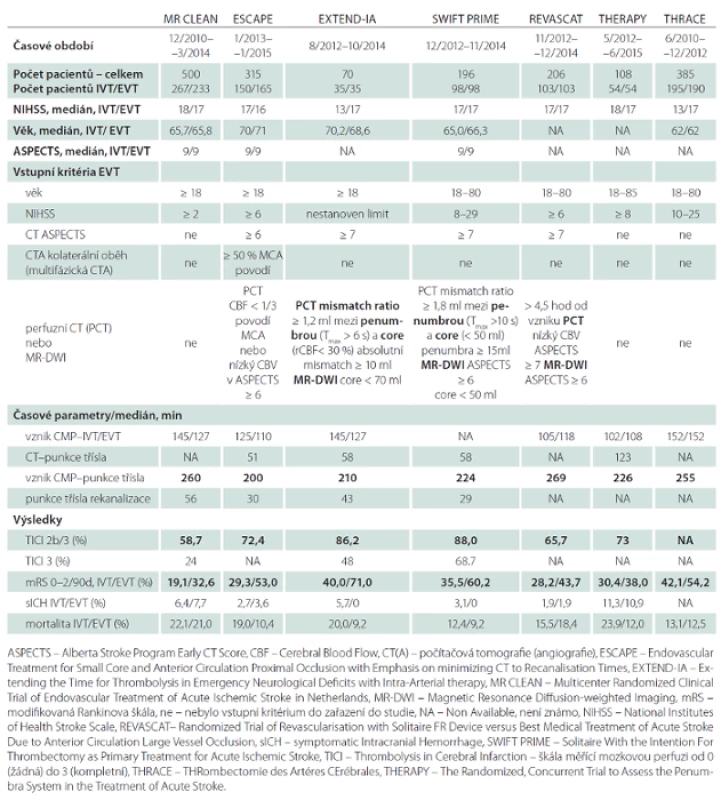
Jednotlivé studie byly srovnatelné tíží neurologického postižení při příjmu (medián NIHSS byl 17), lokalizací uzávěru tepny (většinou intrakraniální úsek ACI nebo M1 segment arteria cerebri media) i v procentu podání IVT před intervencí (68 – 100 %).
Studie MR CLEAN zařazovala pacienty i s velmi lehkým vstupním neurologickým deficitem (NIHSS ≥ 2). V ostatních studiích bylo vstupní NIHSS vyšší (ESCAPE ≥ 5, SWIFT PRIME 8 – 29, REVASCAT ≥ 6, THERAPY ≥ 8, THRACE 10 – 25). MR CLEAN neposuzovala rozsah vstupní ischemie metodou ASPECTS, podmínkou zařazení do studie bylo pouze vyloučení hemoragie na nativním CT mozku. Výsledné mRS 0 – 2 hodnocené po 90 dnech ve skupině pacientů léčených kombinovanou IVT a EVT 32,6 %, v kontrolní skupině pacientů léčených pouze IVT 19,1 % (OR 2,05; 95% CI 1,36 – 3,09). Mezi skupinami nebyl rozdíl v mortalitě či v četnosti výskytu intracerebrální hemoragie. Ve studii bylo zařazeno 16 % pacientů starších 80 let a i v této podskupině byl prokázán pozitivní efekt EVT.
Na studii ESCAPE participovalo 22 center (11 z Kanady, šest z USA, tři z Koreje, jedno z Anglie, jedno z Irska) a celkem zahrnovala 315 pacientů. Podmínkou zařazení k intervenci byl dobrý kolaterální oběh na multifázovém CT angiografickém vyšetření (přítomnost kolaterál na postižené straně v povodí arteria cerebri media ≥ 50 % ve srovnání s kontralaterální hemisférou) a ASPECTS 6 – 10. Ireverzibilně poškozená mozková tkáň (core) byla hodnocena na perfuzním CT jako oblasti relativně sníženého cerebral blood flow (CBF) pod 30 %. Důraz byl kladen na rychlost provedení výkonu – požadovaná doba od CT do zahájení výkonu byla 60 min, od CT do rekanalizace 90 min. Vylučovacím kritériem byla závažná hypoperfuze na perfuzním CT, tj. snížený Cerebral Blood Volume (CBV) ASPECTS < 6 v povodí arteria cerebri media. Oproti MR CLEAN byly výsledky výrazně lepší, výsledné mRS 0 – 2 v intervenční větvi bylo 53,0 %, v kontrolní skupině 29,3 % (OR 2,73; 95% CI 1,71 – 4,37). Medián času od CT k reperfuzi byl 84 min. Patrné je i nízké procento symptomatických krvácení (sICH) (3,6 % při EVT : 2,7 % v kontrolní skupině) a snížení mortality v endovaskulární skupině (10,4 vs. 19,0 % v kontrolní skupině). ESCAPE jako jediná studie zařazovala pacienty do 12 hod od vzniku příznaků, předpokladem byla přítomnost potenciálně zachránitelné tkáně – penumbry – na zobrazovacích metodách. Celková anestezie byla použita pouze v 9 % (ve studii MR CLEAN v 38 %).
Nejvýraznější procento dobrého výsledného klinického stavu pacientů léčených kombinovanou IVT a EVT bylo ve studii EXTEND-IA: 71,4 vs. 40,0 % v kontrolní skupině (OR 3,75; 95% CI 1,38 – 10,17). Studie EXTEND-IA se zúčastnilo 10 center, devět z Austrálie, jedno z Nového Zélandu. Byla předčasně zastavena po zahrnutí 70 pacientů, neboť se prokázal jednoznačný benefit endovaskulární léčby (a rovněž už byly známy výsledky MR CLEAN). V souboru pacientů léčených kombinovanou IVT a EVT došlo po třech dnech od vzniku symptomů ke zlepšení (poklesu NIHSS > 9) u 80 % pacientů (vs. 37 % v kontrolní skupině léčené pouze IVT). Autoři použili při výběru vhodných pacientů perfuzní CT mozku (penumbra definována jako zpoždění v maximální náplni (Tmax) více než 6 s a oblast core (nekróza) jako krevní průtok (Cerebral Blood Flow; CBF) méně než 30 % oproti normální tkáni.
Studie SWIFT PRIME je třetí studie s velmi dobrými výsledky (mRS 0 – 2 : 60,2 vs. 33,7 % v kontrolní skupině (OR 2,98; 95% CI 1,66 – 5,33). Rovněž byla předčasně zastavena pro pozitivní efekt EVT. Podmínkou do zařazení byl dobrý kolaterální oběh a nález malé oblasti core na vstupním CT nebo diffusion-weighted (DWI) MR vyšetření. Bylo dosaženo vysokého stupně rekanalizace TICI 2b – 3 : 88,0 %. EXTEND-IA a SWIFT PRIME byly jediné studie, u kterých byla IVT podána všem pacientům.
Studie REVASCAT probíhala ve čtyřech centrech v Katalánsku ve Španělsku. Výsledky byly rovněž lepší ve srovnání s MR CLEAN, nápadné je nízké procento sICH (1,9 vs. 1,9 %) v obou sledovaných skupinách. Benefit EVT : IVT byl 43,7 : 28,2 % (OR 1,98; 95% CI 1,11 – 3,53). Ze srovnávaných studií měli Španělé nejméně sICH, což však nekoreluje s výslednou mortalitou (tab. 1).
Studie THERAPY byla realizována ve třech centrech USA a jako jediná hodnotila délku sraženiny. Předpokladem zařazení do souboru byla její minimální délka 8 mm. Požadovaná doba od vzniku CMP do začátku intervence byla do 4,5 hod. Benefit EVT : IVT byl 38,0 : 30,4 % (OR 2,28; 95% CI 1,05 – 4,96).
Studie THRACE z 26 francouzských center se nevyznačovala specifickými vstupními kritérii. Intervenční léčba musela být zahájena do 5 hod od vzniku symptomů a ukončena do 6 hod. Benefit EVT : IVT byl 54,2 : 42,1 %.
K extrakci trombu byly použity moderní stent-retrievery – Solitaire Flow Restoration (FR;ev3,irvine, California, USA) v 82,6 % (MR CLEAN), 86 % (ESCAPE), ve 100 % (EXTEND-IA, SWIFT PRIME, REVASCAT). V THERAPY bylo použito zařízení Penumbra system. Relativně nízké procento úspěšných rekanalizací TICI 2b – 3 je v MR CLEAN (59 %).
Ve studiích EXTEND-IA, ESCAPE, SWIFT PRIME byly k výběru vhodných pacientů použity sofistikované zobrazovací metody. To je důvod tak dobrých výsledků ve srovnání s MR CLEAN.
Volba anestezie (intravenózní sedace vs. celková narkóza) byla v jednotlivých studiích shodně ponechána na rozhodnutí intervenčního radiologa. Zdůrazněna byla preference výkonů v lokální anestezii.
Diskuze
Podstatou léčby ischemické CMP je rekanalizace okludované cévy a záchrana ischemií postižené, ale dosud viabilní mozkové tkáně, tzv. penumbry [17 – 24]. Intravenózní nebo intraarteriální léčba, která vede k rekanalizaci do již ireverzibilně poškozené mozkové tkáně, je riziková. Může dojít ke vzniku edému mozku nebo k symptomatickému krvácení, tzv. reperfusion injury [25 – 28], a to i v případě úspěšné rekanalizace [29]. Studie posledních let a užití moderní generace stent retrieverů ukazují na úspěšné procento výsledných rekanalizací, tj. 80 – 95 % (graf 1) [28]. Uspokojivé výsledky stran dosažení rekanalizace nejdou ruku v ruce se zlepšením klinického nálezu [2,30 – 38]. V některých případech naopak dochází k progresi neurologického stavu a ke vzniku intracerebrálního krvácení s fatálním koncem [39]. Cílem léčby CMP není pouze snížení mortality, ale zejména zachování soběstačnosti pacienta [40]. Za úspěšné vyléčení je považována hodnota modifikované Rankinovy škály (mRS) 0 – 2. Termínem „marná rekanalizace“ (futile recanalisation) jsou označovány případy, kdy i přes dosažený příznivý angiografický nález nedojde ke zlepšení klinického nálezu, tj. výsledné mRS dosahuje 3 – 6 bodů [20,31,41]. Výsledný dobrý klinický stav mRS 0 – 2 dosahujeme zhruba u poloviny úspěšně rekanalizovaných pacientů [42].
Graf 1. Výsledný dobrý klinický stav podle modifi kované Rankinovy škály (mRS) 0–2 (%) ve studiích MR RESCUE, IMS 3, MR CLEAN, ESCAPE, REVASCAT, EXTEND-IA, SWIFT PRIME souvisí se stupněm dosažené rekanalizace Thrombolysis in Cerebral Infarction (TICI) 2b–3 (%). 
TICI 3 – kompletní rekanalizace. Uvedené prospektivní randomizované studie ukazují, že širší vstupní kritéria a menší důraz na použití multimodálních zobrazovacích technik (CT, DWI) vedou k horším výsledkům vč. vyšší mortality [43].
Základem úspěchu EVT je výběr vhodných pacientů, kteří budou z tohoto typu léčby profitovat. To zahrnuje rychlé zhodnocení nejen aktuálního stavu pacienta, ale i jeho komorbidit. Před indikací k výkonu je třeba komplexně posoudit věk pacienta, tíži neurologického nálezu, lokalizaci uzávěru, rozsah kolaterálního zásobení a ischemických změn, předpokládanou dobu do dosažení rekanalizace.
- Vyšší věk je jednoznačně rizikovým faktorem intraarteriální rekanalizace [34,44 – 48]. Horší výsledky u starších pacientů souvisejí s komorbiditami – srdeční selhávání, nízká ejekční frakce, pneumonie, horší tolerance celkové narkózy. U pacientů starších 75 let je nutné EVT pečlivě zvažovat v souvislosti s radiologickým nálezem, nicméně samotný vyšší věk není kontraindikací intraarteriální léčby (IAT). Autoři Almekhlafi et al [49] k predikci výsledku používají index, kdy sčítají věk + NIHSS. Je-li součet do 100, je pravděpodobnost dobrého výsledku v 61 %, pokud je vyšší, tak pouze 27 %.
- 2. Tíže neurologického deficitu. NIHSS ≥ 25 je prediktorem špatného výsledku po intravenózní [50] i intraarteriální trombolýze [51 – 54]. Tito pacienti mají vyšší riziko sICH [55 – 58]. Nicméně je třeba mít na paměti, že NIHSS při příjmu v sobě odráží nejen oblast infarktu (core), ale také oblast zachránitelné penumbry [38]. Studie MR CLEAN zahrnovala pacienty i s relativně lehkým vstupním neurologickým deficitem, tj . NIHSS ≥ 2 na rozdíl od např. THRACE se vstupním NIHSS 10 – 25, nicméně všechny studie byly srovnatelné mediánem tíže neurologického postižení (NIHSS 17).
- Komorbidity – fibrilace síní, městnavé srdeční selhávání, diabetes mellitus [22]. Tyto parametry nebyly ve výše uvedených studiích sledovány.
- Premorbidní disabilita. Těžce fyzicky nebo kognitivně postižení pacienti nejsou vhodní k IAT léčbě [22,47]. Podmínkou zařazení do studií SWIFT PRIME, REVASCAT a THERAPY bylo premorbidní mRS 0 – 1, ve studii ESCAPE Barthel index > 90.
- Hyperglykemie při příjmu je spojena s nepříznivým klinickým výsledkem [49,59 – 61] u pacientů léčených IVT nebo kombinovanou IVT/ IAT [62]. Hyperglykemie > 22,2 mmol/ l byla vylučovacím kritériem ve studii MR CLEAN, > 400 mg/ dl ve studii SWIFT PRIME, > 300 mg/ dl ve studii THERAPY.
- Lokalizace cévní okluze. Proximální uzávěry arteria carotis interna jsou obvykle spojeny s těžkým neurologickým deficitem a vysokou mortalitou (16 – 55 %) i morbiditou (40 – 69 %) [53]. Při proximálněji uloženém uzávěru ACI je ischemií postižena rozsáhlejší oblast mozku, což souvisí s horší prognózou a rizikem hemoragické transformace. Pacienti s extrakraniální akutní okluzí ACI jsou zvláště rizikoví z hlediska vývoje symptomatického intrakraniálního krvácení, které je v této souvislosti chápáno jako reperfuzní krvácení [63]. Ve studii SWIFT PRIME na rozdíl od ostatních studií byli vstupně vyřazeni všichni pacienti s extrakraniálními uzávěry ACI. Kromě lokalizace uzávěru je důležitým parametrem i velikost a složení krevní sraženiny, tzv. clot burden [64]. Uzávěry ≥ 10 mm jsou spojeny s nižší rekanalizací a větším procentem komplikací, jako je např. distální embolizace [65].
- Rozsah časných ischemických změn – pro hodnocení je třeba použít ASPECT skóre (www.aspectsinstroke.com), které má vysokou senzitivitu a specifitu jak pro predikci dobrého klinického výsledku, tak pro riziko sICH [66]. Vyšší hodnoty ASPECTS (8 – 10) jsou spojeny s větším benefitem léčby rtPA a nižší mortalitou [67]. Jedná-li se o „extrémně časné“ ischemické změny, tj. jsou-li přítomny do 90 min od vzniku iktu a jsou-li vyjádřeny ASPECTS hodnotami ≤ 7 představují vysoké riziko vzniku parenchymového hematomu [68]. Nepříznivým prognostickým faktorem je rovněž pokles hodnot ASPECTS při kontrolním CT vyšetření prováděném např. po překladu pacienta do komplexních center nebo po IVT [69]. Studie zahrnující do vstupních kritérií ASPECTS ≥ 7 (ESCAPE, EXTEND-IA, SWIFT PRIME, REVASCAT) měly výrazně vyšší procento výsledného dobrého klinického stavu.
- Posouzení rozsahu ireverzibilně postižené mozkové tkáně a penumbry – užití multimodálních zobrazovacích metod umožňuje klást větší důraz na přítomnost penumbry a malého infarktu oproti fixovanému času. Autoři Wisco et al [6] vycházejí při výběru pacientů vhodných k endovaskulární léčbě z hyperakutního MR protokolu, kdy považují za indikované pacienty s DWI lézí < 70 ml. Ke shodnému závěru došli i autoři González et al 2013 [70], Yoo et al [71]. Alternativně lze před indikací k endovaskulárnímu zákroku použít i perfuzní CT. Doposud není konsenzus na hodnocení jednotlivých parametrů perfuze. Nicméně existuje shoda a doporučení na provedení perfuzního CT v určitých indikacích při rozhodování o léčebném postupu [72 – 79]. Autoři Krajina et al [80] ve své práci týkající se rekanalizace akutních uzávěrů mozkových tepen pomocí retrahovatelného stentu dávají velmi dobrý klinický výsledek souboru do souvislosti s krátkou dobou do léčby, nižším NIHSS a důslednou selekcí nemocných dle přítomnosti polostínu na perfuzním CT. Reperfuze oblastí s velmi nízkým CBV je riziková z hlediska vzniku parenchymového krvácení po IVT i IAT [27]. Ve studiích EXTEND-IA, ESCAPE, SWIFT PRIME a REVASCAT bylo při výběru vhodných pacientů k EVT použito perfuzní CT nebo MR-DWI vyšetření. V historii endovaskulární léčby tak byla poprvé definována skupina pacientů, která může z EVT nejvíce profitovat. Uvedené studie dosáhly lepší výsledné mRS ve srovnání s MR CLEAN. Na druhé straně tento postup vedl k vyloučení pacientů, kteří by možná také dopadli dobře.
- Kolaterální cirkulace – dobrá kolaterální cirkulace je jedním ze zásadních prediktorů úspěchu výsledné léčby [81 – 87]. V případě akutního cévního uzávěru udržuje dobrý kolaterální oběh tkáň viabilní do doby než dojde k rekanalizaci. Pacienti s dobrým kolaterálním zásobením lépe reagují na endovaskulární léčbu a mají menší riziko hemoragických komplikací. Špatný kolaterální oběh je prediktorem špatného klinického výsledku, nezávisle na dosažené rekanalizaci [39,88]. V případě akutní cévní okluze takto dochází k ireverzibilním ischemickým změnám v průběhu minut. CT angiografie (CTA) mozkových tepen umožňuje rychlé zhodnocení intra - a extrakraniálního cévního zásobení. Autoři Souza et al [89] vytvořili pětistupňový systém hodnocení kolaterál z CTA maximum intensity projection (MIP) zobrazení. Termín „malignant CTA collateral profile“ je vyhrazen pro pacienty s absencí kolaterálního oběhu (score 0). Tito pacienti mají 95% pravděpodobnost špatného výsledného mRS 3 – 6 po třech měsících (p = 0,007). Zdrojové CTA snímky umožňují oproti nativnímu CT vyšetření lepší posouzení rozsahu objemu hypoperfundované tkáně a mohou pomoci v triáži pacientů vhodných k endovaskulární léčbě. Ve studii ESCAPE byl dobrý kolaterální oběh na multifázovém CTA (přítomnost kolaterál na postižené straně v povodí arteria cerebri media ≥ 50 % ve srovnání s kontralaterální hemisférou) podmínkou zařazení do studie.
- Doba do dosažení rekanalizace je zásadní prognostický faktor. Opožděná revaskularizace minimalizuje benefit a zvyšuje riziko trombolytické terapie. Zkrácení této doby se jeví důležitější než rekanalizace sama [31,63,90]. Cílem akutní revaskularizace není jen otevřít okludovanou cévu, ale otevřít ji rychle. Opačně platí, že k reperfuzi může dojít i při absenci rekanalizace v důsledku retrográdní kolaterální cirkulace. Ultrakrátký čas od zobrazení do reperfuze dokumentují autoři Almekhlafi z univerzity v Calgary [91]. V souboru 11 pacientů s NIHSS 11 byla tato doba 60 min. Prodlužování výkonu mechanické trombektomie nad 60 min vede k navýšení finančních nákladů, aniž se zlepší výsledné mRS [92]. V tab. 1 jsou uvedeny časy od vzniku příznaků, CT vyšetření a punkce třísla do rekanalizace. Krátké časy ve studiích ESCAPE, EXTEND-IA a SWIFT PRIME korelují s výsledným dobrým klinickým stavem.
- Volba vhodné anestezie – preferována je analgosedace [93 – 94], např. opakovanými dávkami midazolamu a propofolu [95]. V případě podání celkové anestezie je důležité zabránit náhlým poklesům krevního tlaku, tj. pod 140 mm Hg systolického TK [96] do doby rekanalizace. Třetí možností preferovanou některými zkušeným intervenčními radiology je výkon při plném vědomí, za plné spolupráce pacienta (doc. MU Dr. František Charvát, Ph.D).
- Přítomnost rozsáhlých gliových změn – leukoaraiózy – na vstupním CT vyšetření je nepříznivým prognostickým faktorem [97 – 100]. Tento parametr nebyl v jednotlivých studiích posuzován.
Základem úspěchu endovaskulární léčby je výběr vhodných pacientů. Nutný je individuální přístup na základě komplexního posouzení všech uvedených faktorů. U pacientů s rozsáhlým infarktem, relativně malou oblastí penumbry a špatným kolaterálním zásobením může akutní rekanalizace vést k rozsáhlému parenchymovému krvácení s fatálními následky, a to i v případě, že je dosaženo angiograficky ideálního nálezu. Perfuzní zobrazovací techniky byly využity k výběru vhodných pacientů k EVT v randomizované studii EXTEND-IA, která kromě benefitu endovaskulární léčby prokázala i lepší výsledné mRS 0 – 2 (71 vs. 40 %) oproti např. MR CLEAN (33 vs. 19 %). V případě perfuzního vyšetření, je-li oblast sníženého CBV > 1/ 3 povodí ACM a je-li nedostatečné leptomeningeální kolaterální zásobení, tak i při dosažení rekanalizace TICI 3 se bude pravděpodobně jednat o „marnou“ rekanalizaci [35,101].
V červnu 2015 byla zveřejněna nová doporučení pro indikaci k EVT [102]:
2015 AHA/ ASA Focused Update of the 2013 Guidelines for the Early Management of Patients With Acute Ischemic Stroke Regarding Endovascular Treatment
Doporučení (třída I, úroveň A):
- mRS 0 – 1 před vznikem iktu;
- podání IVT do 4,5 hod od začátku příznaků;
- příčinná okluze intrakraniální ICA nebo proximálního úseku (M1) arteria cerebri media, arteria basilaris;
- NIHSS ≥ 6;
- ASPECT skóre ≥ 6;
- zahájení léčby (punkce třísla) do 6 hod od vzniku obtíží (výjimkou je uzávěr arteria basilaris).
Další doporučení (třída II b, úroveň C):
- při zahájení EVT po více jak 6 hod od vzniku symptomů je výsledek nejistý;
- EVT může být přínosem i u pečlivě vybraných pacientů s okluzí M2 nebo M3 úseku MCA, mladších 18 let, s mRS >1, ASPECT skóre < 6, NIHSS < 6, u kterých je léčba zahájena do 6 hod od vzniku příznaků.
Doporučení Cerebrovaskulární sekce (CVS) České neurologické společnosti (ČNS) J.E.P. pro mechanickou trombektomii v přední mozkové cirkulaci byla zveřejněna na XII. cerebrovaskulárním semináři konaném 11. – 12. 9. 2015 v Táboře.
Odlišností proti AHA/ ASA guidelines (třída I, úroveň A) při vzniku příznaků do 6 hod je vstupní NIHSS ≥ 2 při CTA prokázaném uzávěru intrakraniální ACI nebo proximálního úseku ACM. Premorbidní mRS ≥ 2 je relativní kontraindikací.
Mechanická trombektomie může být prospěšná u přísně selektovaných pacientů s uzávěrem intrakraniální mozkové tepny i po 6 hod při splnění těchto podmínek:
- NIHSS ≥ 2,
- ASPECTS ≥ 6 (MR-DWI ≥ 5),
- kolaterály ≥ 50 % teritoria ACM
nebo:
- NIHSS ≥ 2,
- ASPECTS ≥ 6 (MR-DWI ≥ 5),
- přítomnost penumbry na perfuzním CT nebo MR.
Použití celkové anestezie (CA) při mechanické trombektomii je nezávislým prediktorem špatného klinického výsledku a závažných komplikací. CA může významně zpozdit zahájení výkonu, způsobit významný pokles TK, což má negativní vliv na kolaterální cirkulaci při akutním uzávěru mozkové tepny. Použití CA je doporučeno:
- u pacientů v respirační insuficienci nebo s rizikem aspirace (bulbární syndrom, poruchy polykání),
- u pacientů s velmi těžkým neurologickým deficitem s poruchou dýchání při uzávěru arteria basilaris,
- u velmi neklidných a nespolupracujících pacientů (podrobněji na www.cmp.cz).
Závěr
EVT je efektivní a bezpečná metoda při léčbě akutních ischemických iktů, podstatný je výběr vhodných pacientů s identifikovanou proximální okluzí cévy. Do budoucna je třeba zlepšit management při transportu pacientů do komplexních center, zajistit preferenční prostup pro tyto pacienty na urgentním příjmu a minimalizovat časové ztráty od provedení CTA do začátku výkonu ze strany neurointervenčních radiologů.
Krátká doba od vzniku iktu do dosažení rekanalizace uzávěru mozkové tepny je zásadní prediktor dobrého výsledného klinického stavu po mechanické trombektomii.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Marie Tinková, Cert. MDT
Neurologické oddělení
ÚVN – VFN Praha
U Vojenské nemocnice 1200
169 02 Praha 6
e-mail: marie.tinkova@uvn.cz
Přijato k recenzi: 5. 10. 2015
Přijato do tisku: 13. 12. 2015
Zdroje
1. Kidwell CH, Jahan R, Gornbeins J, et al. A trial of imaging selection and endovascular treatment for ischemic stroke. N Engl J Med 2013;368(10):914 – 23. doi: 10.1056/ NEJMoa1212793.
2. Broderick JP, Palesh YY, Demchuk AM, et al. Endovascular therapy after intravenous t-PA versus t-PA alone for stroke. N Eng J Med 2013;368(10):893 – 6. doi: 10.1056/ NEJMoa1214300.
3. Ciccone A, Valvassori L. Endovascular treatment for acute ischemic stroke. N Engl J Med 2013;368(25):2433 – 4.
4. Fargen KM, Neal D, Fiorella DJ, et al. A meta-analysis of prospective randomized controlled trial evaluating endovascula terapies for acute ischemic stroke. J Neurointerv Surg 2015;7(2):84 – 9. doi: 10.1136/ neurintsurg-2014-011543.
5. Canavero I, Cavallini A, Denaro F, et al. Reperfusion strategies for acute ischaemic stroke from past to present. An overview towards future pespectives. EMJ Neurol 2015;3(1):75 – 81.
6. Wisco D, Chino K, Saqqur M, et al. Addition of hyperacute MRI aids in patient selection, decreasing the use o endovascular stoke therapy. Stroke 2014,45(2):467 – 72. doi: 10.1161/ STROKEAHA.113.003880.
7. Chimowitz MI. Game changer for endovascular treatment of acute ischemic stroke? J Neurointerv Surg 2014;6(4):252 – 3. doi: 10.1136/ neurintsurg-2014-011187.
8. Berkhemer OA, Puck SS, Beumer D, et al. A randomized trial of intraarterial treatment for acute ischemic stroke. N Eng J Med 2015;372(1):11 – 20. doi: 10.1056/ NEJMoa1411587.
9. Fiorella DJ, Fargen KM, Mocco J, et al. Thrombectomy for acute ischemic stroke: an evidence-based treatment. J Neurointerv Surg 2015;7(5):314 – 6. doi: 10.1136/ neurintsurg-2015-011707.
10. Demchuk AM, Goyal M, Menon BK, et al. Endovascular treatment for small core and anterior circulation proximal occlusion with emphasis on minimizing CT to recanalisation times (ESCAPE) trial metodology. Int J Stroke 2015;10(3):429 – 38. doi: 10.1111/ ijs.12424.
11. Saver JL, Goyal M, Bonafe A, et al. Solitaire TM with the intention as primary endovascular treatment for acute ischemic stroke (SWIFT PRIME) trial: protocol for a randomized, controlled, multicenter study comparing the Solitaire revascularisation device with IV tPA with IV tPA alone in acute ischemic stroke. Int J Stroke 2015;10(3):439 – 48. doi: 10.1111/ ijs.12459.
12. Campbell BC, Mitchell PJ, Kleinig TJ, et al. Endovascular therapy for ischemic stroke with perfusion-imaging selection. N Engl J Med 2015;372(11):1009 – 18. doi: 10.1056/ NEJMoa1414792.
13. Molina CA, Chamorro A, Rovia A et al. REVASCAT: a randomized trial of revascularisation with solitaire FR device vs. best medical therapy in the treatment of acute stroke due to anterior ciculation large vessel occlusion presenting within eight-hours of symptom onset. Int J Stroke 2015;10(4):619 – 26. doi: 10.1111/ ijs.12157.
14. Bracard S, Investigators T. The contribution of intra-arterial thrombectomy in acute ischemic stroke patients treated with intravenous thrombolysis. European Stroke Organisation Conference 2015. Glasgow, UK.
15. Mocco J, Khatri P, Zaidat O. The THERAPY trial: the randomized, concurrent controlled trial to assess the Penumbra Systems’safety and effectiveness in the treatment of acute stroke. European Stroke organisaton Conference 2015. Glasgow, UK.
16. Ding D. Endovascular mechanical thrombectomy for acute ischemic stroke: a new standard of care. J Stroke 2015;17(2):123 – 6. doi: 10.5853/ jos.2015.17.2.123.
17. Anastasian ZH. Anaesthetic management of the patient with acute ischaemic stroke. Br J Anaesth 2014;113(Suppl 2):ii9 – 16. doi: 10.1093/ bja/ aeu372.
18. Hussein HM, Georgiadis AL, Vazquez , et al. Occurence and predictors of futile recanalisation following endovascular treatment among patients with acute ischemic stroke. AJNR 2010;31(3):454 – 8. doi: 10.3174/ ajnr.A2006.
19. Davis MJ, Menon BK, Baghirzada LB, et al. Anesthetic management and outcome in patients during endovascular therapy fo acute stroke. Anesthesiology 2012;116(2):396 – 405. doi: 10.1097/ ALN.0b013e318242a5d2.
20. Chen M. Cost-effectivenes of endovascular therapy for acute ischemii stroke. Neurology 2012;79(Suppl 1): S16 – 21.
21. Lansberg MG, Straka M, Kemp S, et al. MRI profile and response to endovascular reperfusion after stroke (DEFUSE 2): a prospective cohort study. Lancet Neurol 2012;11(10): 860 – 7. doi: 10.1016/ S1474-4422(12)70203-X.
22. Lund CG, Aamodt AH, Russell D. Patient selection for intra-arterial cerebral revascularisation in acute ischemic stroke. Acta Neurol Scand 2013;127(Suppl 1):65 – 8.
23. Manning NW, Cambell BC, Oxley TJ, et al. Acute ischemic stroke. Time, penumbra and reperfusion. Stroke 2014;45(2):640 – 4. doi: 10.1161/ STROKEAHA.113.003798.
24. Sanelli PC, Sykes JB, Ford AL, et al. Imaging and treatment of patients with acute stroke: an evidence-based review. AJNR AM J Neuroradiol 2014;35(6):1045 – 51. doi: 10.3174/ ajnr.A3518.
25. Leifer D, Bravata DM, Connors JJ, et al. Metrics for measuring quality of care in comprehensive stroke centers: detailed follow-up to Brain Attacks Coalition comprehensive stroke center recommendations. Stroke 2011;42(3):849 – 77. doi: 10.1161/ STR.0b013e318208eb99.
26. Mlynash M, Lansberg MG, De Silva DA, et al. Refining the definition of the malignant profile. Insights from the DEFUSE-EPITHET pooled data set. Stroke 2011;42(5):1270 – 5. doi: 10.1161/ STROKEAHA.110.601609.
27. Mishra NK, Christensen S, Wouters A, et al. Reperfusion of very low cerebral blood volume lesion predicts parenchymal hematoma after endovascular therapy. Stroke 2015;46(5):1245 – 9. doi: 10.1161/ STROKEAHA.114.008171.
28. Mokin M, Levy EI. Guest editorial: endovascular treatment of acute ischemic stroke: what’s next? Neurosurgery 2015;76(3):235 – 8. doi: 10.1227/ NEU.0000000000000647.
29. Balami JS, Sutherland BA, Edmunds LD, et al. A systematic review and meta-analysis of randomized controlled trials of endovascular thrombectomy compared with best medical treatment for acute ischemic stroke. Int J Stroke 2015;10(8):1168 – 78. doi: 10.1111/ ijs.12618.
30. Balucani C, Grotta JC. Selecting stroke patients for intra-arterial therapy. Neurology 2012;78(10):755 – 61. doi: 10.1212/ WNL.0b013e318248e558.
31. Becktepe JS, You SJ, Berkefeld J, et al. Clinical outcome after mechanical recanalisation as mono - or adjunctive therapy in acute stroke: importance of time to recanalisation. Cerebrovasc Dis 2011;32(3):211 – 8. doi: 10.1159/ 000328814.
32. Brinjikji W, Rainstein AA, Kallmes DK, et al. Patient outcomes with endovascular embolectomy therapy for acute ischemic stroke. Stroke 2011;42(6):1648 – 52. doi: 10.1161/ STROKEAHA.110.607952.
33. Flint AC, Kamel H, Rao VA, et al. Validation of the totaled health risks in vascular events (THRIVE) score for outcome prediction in endovascular stroke treatment. Int J Stroke 2014; 9(1):32 – 9. doi: 10.1111/ j.1747-4949.2012.00872.x.
34. Nam J, Jing H, O’Reilly D. Intra-arterial thrombolysis vs. standard treatment or intravenous thrombolysis in adults with acute ischemic stroke: a systematic review and meta-analysis. Int J Stroke 2015;10(1):13 – 22. doi: 10.1111/ j.1747-4949.2012.00914.x.
35. Rai AT, Raghuram K, Domico J, et al. Pre-intervention triage incorporating perfusion imaging improves outcomes in patients undergoing endovascular stroke therapy: a comparison with the device trials. J Neurointervent Surg 2012;5(2):121 – 7. doi: 10.1136/ neurintsurg-2011-010189.
36. Ribo M, Flores A, Rubiera M, et al. Extending the time window for endovascular procedures according to collateral pial circulation. Stroke 2011;42(12):3465 – 9. doi: 10.1161/ STROKEAHA.111.623827.
37. Rubiera M, Ribo M, Pagola J, et al. Bridging intravenous-intra-arterial rescue strategy increases recanalisation and the likelihood of a good outcome in nonresponder intravenous tissue plasminogen activator-treated patients. Stroke 2011;42(4):993 – 7. doi: 10.1161/ STROKEAHA.110.597104.
38. Turk AS, Frei D, Fiorella D, et al. ADAPT FAST study: a direct aspiration first pass technique for acute stroke thrombectomy. J Neurointerv Surg 2014;6(4):260 – 4. doi: 10.1136/ neurintsurg-2014-011125.
39. Bang OY, Saver JL, Kim SJ, et al. Collateral flow predicts response to endovascular therapy for acute ischemic stroke. Stroke 2011;42(3):693 – 9. doi: 10.1161/ STROKEAHA.110.595256.
40. Goldemund D, Mikulík R, Reif M. Trombolytická terapie mozkového infarktu. Kardiol Rev 2008;10(4):168 – 76.
41. Molina CA. Futile recanalisation in mechanical embolectomy trials. A call to improve selection of patients for revascularisation. Stroke 2010;41(5):842 – 3. doi: 10.1161/ STROKEAHA.110.580266.
42. Woo HH, Arthur AS, Mocco J, et al. MR CLEAN: past the tipping point of clinical equipoise. J Neurosurg 2015;123(1):101 – 2. doi: 10.3171/ 2015.2.JNS15284.
43. Hacke W. The results of the recent thrombectomy trias may influence stroke care delivery: are you ready? Int J Stroke 2015;10(5):646 – 50. doi: 10.1111/ ijs.12541.
44. Abou-Chebl A. Endovascular treatment of acute ischemic stroke may be safely peformed with no time window limit in appropriately selected patients. Stroke 2010;41(9):1996 – 2000. doi: 10.1161/ STROKEAHA.110.578997.
45. Zeevi N, Kuchel GA, Lee NS, et al. Interventional stroke therapies in the elderly: are we helping? AJNR Am J Neuroradiol 2012;33(4):638 – 42. doi: 10.3174/ ajnr.A2845.
46. Chandra RV, Leslie-Mazwi TM, Oh DC, et al. Elderly patients are at higher risk for poor outcomes after intra-arterial therapy. Stroke 2012;43(9):2356 – 61. doi: 10.1161/ STROKEAHA.112.650713.
47. Zaidi SF, Anghaebrahim A, Urra X, et al. Final infarct voume is a stronger predictor of outcome than recanalisation in patiens with proximal middle cerebral artery occlusion treated with endovascular therapy. Stroke 2012;43(12):3238 – 44. doi: 10.1161/ STROKEAHA.112.671594.
48. Ghobrial GM, Chalouhi N, Rivers L, et al. Multimodal endovascular management of acute ischemic stroke in patients over 75 years old is safe and effective. J Neurointervent Surg 2013;5(Suppl 1):i33 – 37. doi: 10.1136/ neurintsurg-2012-010422.
49. Saposnik G, Fang J, Kapral MK, et al. The iScore predicts effectiveness of thrombolytic therapy for acute ischemic stroke. Stroke 2012;43(5):1315 – 22. doi: 10.1161/ STROKEAHA.111.646265.
50. Václavík D, Mikulík R, Kadlecová P, et al. Prediktory symptomatického intracerebrálního krvácení po systémové trombolýze mozkového infarktu. Cesk Slov Neurol N 2012;75/ 108(6):715 – 20.
51. Choi JY, Kim EJ, Lee SE, et al. Conventional enhancement CT: a valuable tool for evaluating pial collateral flow in acute ischemic stroke. Cerebrovasc Dis 2011;31(4):346 – 52. doi: 10.1159/ 000322602.
52. Vora NA, Shook SJ, Schumacher HCh, et al. A 5-item scale to predict stroke outcome after cortical middle cerebral artery territory infarction. Stroke 2011;42(3):645 – 9. doi: 10.1161/ STROKEAHA.110.596312.
53. Šaňák D, Herzig R, Horák D, et al. Predictors of good clinical outcome in acute stroke patients treated with inravenous thrombolysis. Acta Neurol Scand 2011;123(5):339 – 44. doi: 10.1111/ j.1600-0404.2010.01401.x.
54. Castano C, Dorado L, Guerrero CH, et al. Mechanical thrombecotmy with the Solitaire AB Device in large artery occlusions of the anterior circulation. Stroke 2010;41(8):1836 – 40. doi: 10.1161/ STROKEAHA.110.584904.
55. Singer OC, Berkefeld J, Lorenz MW, et al. Risk of symptomatic intracerebral hemorrhage in patients treated with intra-arterial thrombolysis. Cerebrovasc Dis 2009,27(4):368 – 74. doi: 10.1159/ 000202427.
56. Cucchiara B, Kasner SE, Tanne D, et al. Factors associated with intracerebral hemorrhage after thrombolytic therapy for ischemic stroke. Stroke 2009;40(9):3067 – 72. doi: 10.1161/ STROKEAHA.109.554 386.
57. Khatri P, Wechsler LR, Broderisk JP. Intracranial hemorrhage associated with revascularisation therapies. Stroke 2007;38(2):431 – 40.
58. Strbian D, Engelter S, Michel P, et al. Symptomaic intracranial hemorrhage after stroke thrombolysis: The SEDAN Score. Ann Neurol 2012;71(5):634 – 41. doi: 10.1002/ ana.23546.
59. Kreisel SH, Berschin UM, Hammes HP, et al. Pragmatic management of hyperglycaemia in acute ischamic stroke: safety and feasibility of intensiv intravenous insulin treatment. Cerebrovasc Dis 2009;27(2):167 – 75. doi: 10.1159/ 000185608.
60. Alawneh JA, Mustafa RR, Baron JC. Hemodynamic factors and perfusion abnormalities in early neurological deterioration. Stroke 2009;40(6):e443 – 50. doi: 10.1161/ STROKEAHA.108.532465.
61. Paciaroni M, Agnelli G, Corea F, et al. Early hemorrhagic transformation of brain infarction: rate, predictive factors, and influence on clinical outcome. Stroke 2008;39(8):2249 – 56. doi: 10.1161/ STROKEAHA.107.510321.
62. Jain AR, Jain M, Kanthala AR, et al. Association of CT perfusion parameters with hemorrhagic transformation in acute ischemic stroke. AJNR Am J Neuroradiol 2013;34(10): 1895 – 900. doi: 10.3174/ ajnr.A3502.
63. Rha JH, Saver JL. The impact of recanalisation on ischemic stroke outcome. Stroke 2007,38(3):967 – 73.
64. Tan IY, Demchuk AM, Hopyan J, et al. CT angiography clot burden score and collateral score: correlation with clinical and radiologic outcomes in acute middle cerebral artery infarct. AJNR Am J Neuroradiol 2009;30(3):525 – 31. doi: 10.3174/ ajnr.A1408.
65. Frolich AM, Schrader D, Klotz E, et al. 4D CT Angiography more closely defines intracranial thrombus burden than singlephase CT Angiography. AJNR Am J Neuroradiol 2013;34(10):1908 – 13. doi: 10.3174/ ajnr.A3533.
66. Psychogios MN, Schramm P, Frolich AM, et al. Alberta Stroke Program Early CT Scale evaluation of multimodal computed tomography in predicting clinical outcomes of stroke patients treated with aspiration thrombectomy. Stroke 2013;44(8):2188 – 93. doi: 10.1161/ STROKEAHA.113.001068.
67. Demchuk AM, Hill MD, Barber PA, et al. Importance of early ischemic CT changes using ASPECTS in NINDS rtPA stroke study. Stroke 2005;36(10):2110 – 5.
68. Okazaki S, Moriwaki H, Minematsu K, et al. Extremely early computed tomography signs in hyperacute ischemic stroke as a predictor of parenchymal hematoma. Cerebrovasc Dis 2008;25(3):241 – 6. doi: 10.1159/ 000113862.
69. Sun CH, Connelly K, Nogueira RG, et al. ASPECTS decay during interfacility transfer predicts patient outcomes in endovascular reperfusion for ischemic stroke: a unique assessment of dynamic physiologic change over time. J Neuroinerv Surg 2015;7(1):22 – 6. doi: 10.1136/ neurintsurg-2013-011048.
70. González RG, Copen WA, Schaefer PW, et al. The Massachusetts general hospital acute stroke imaging algorithm: experience and evidence based approach. J Neurointerv Surg 2013;5(Suppl 1):i7 – 12. doi: 10.1136/ neurintsurg-2013-010715.
71. Yoo AJ, Barak ER, Copen WA, et al. Combining acute diffusion-weighted imaging and mean transit time lesion volumes with National Institutes of Health StrokeScale score improves the prediction of acute stroke outcome. Stroke 2010,41(8):1728 – 35. doi: 10.1161/ STROKEAHA.110.582874.
72. Campbell BC, Yassi N, Ma H, et al. Imaging selection in ischemic stroke: feasibility of automated CT perfusion anylysis. Int j Stroke 2015;10(1):51 – 4. doi: 10.1111/ ijs.12381.
73. Gory B, Riva R, Derex L, et al. Value of perfusion CT-guided recanalisation therapy in acute ischemic stroke patients. Cerebrovasc Dis 2014;37(5):389 – 90. doi: 10.1159/ 000362923.
74. Hom J, Dankbaar JW, Soarez BP, et al. Blood-brain barrier permeability asessed by perfusion CT predicts symptomatic hemorrhagic transformation and malignant edema in acute ischemic stroke. AJNR Am J Neuroradiol 2011;32(1):41 – 8. doi: 10.3174/ ajnr.A2244.
75. Jackson D, Earnshaw SR, Farkouh R, et al. Cost-effectiveness of CT Perfusion for selecting patients for intravenous thrombolysis: a US hospital perspective. AJNR Am J Neuroradiol 2010;31(9):1669 – 774. doi: 10.3174/ ajnr.A2138.
76. Gasparotti R, Grassi M, Mardighian D, et al. Perfusion CT in patients with acute ischemic stroke treated with intra-arterial thrombolysis: predictive value of infarct core size on clinical outcome. AJNR Am J Neuroradiol 2009;30(4):722 – 7. doi: 10.3174/ ajnr.A1439.
77. Prabhakaran S, Soltanolkotab M, Honarmand AR, et al. Perfusion-based selection for endovascular reperfusion therapy in anterior circulation acute ischemic stroke. AJNR Am J Neuroradiol 2014;35(7):1303 – 8. doi: 10.3174/ ajnr.A3889.
78. Román LS, Obach V, Blasco J, et al. Single-Cnter expereince of cerebral artery thrombectomy using the TREVO Device in 60 patients with acute ischemic stroke. Stroke 2012;43(6):1657 – 9. doi: 10.1161/ STROKEAHA.111.640011.
79. Zhu G, Michel P, Jovin T, et al. Prediction of recanalisation in acute stroke patients receiving intravenous and endovascular revascularisation therapy. Int J Stroke 2015;10(1):28 – 36. doi: 10.1111/ ijs.12312.
80. Krajina A, Chovanec V, Krajíčková D, et al. Rekanalizace akutních uzávěrů mozkových tepen pomocí retrahovatelného stentu. Cesk Slov Neurol N 2012;75/ 108(1):75 – 9.
81. Bang OY, Saver JL, Kim SJ, et al. Collateral flow averts hemorrhagic transformation after endovascular therapy for acute ischemic stroke. Stroke 2011;42(8): 2235 – 9. doi: 10.1161/ STROKEAHA.110.604603.
82. Angermaier A, Langner S, Kirsch M, et al. CT-Angiographic collateralisation predicts final infarct volume after intra-arterial thrombolysis for acute anterior circulation ischemic stroke. Cerebrovasc Dis 2011;31(2):177 – 84. doi: 10.1159/ 000321868.
83. Menon BK, Smith EE, Modi J, et al. Regional leptomeningeal score on CT Angiography predicts clinical and imaging outcomes in patients with acute anterior circulation occlusions. AJNR Am J Neuroradiol 2011;32(9):1640 – 5. doi: 10.3174/ ajnr.A2564.
84. Nambiar V, Sohn SI, Almekhlafi NA, et al. CTA collateral status and response to recanalisation in patients with acute ischemic stroke. AJNR Am J Neuroradiol 2014;35(5): 884 – 90. doi: 10.3174/ ajnr.A3817.
85. Miteff F, Levi CR, Bateman GA, et al. Tde independent predictive utility of computed tomography angiographic collateral status in acute ischaemic stroke. Brain 2009;132(8):2231 – 8. doi: 10.1093/ brain/ awp155.
86. Tan IY, Demchuk AM, Hopyan J, et al. CT angiography clot burden score and collateral score: correlation with clinical and radiologic outcomes in acute middle cerebral artery infarct. AJNR Am J Neuroradiol 2009;30(3):525 – 31. doi: 10.3174/ ajnr.A1408.
87. Volný O, Mikulík R. Kolaterální cirkulace mozku – potenciální cíl terapie mozkových infarktů. Cesk Slov Neurol N 2013;76/ 109(3):307 – 14.
88. Elijovich L, Goyal N, Mainali S, et al. CTA collateral score predicts infarct volume and clinical outcome after endovascular therapy for acute ischemic stroke: a retrospective chart review. J Neurointerv Surg. In press 2016.
89. Souza LC, Yoo AJ, Chaudhry ZA, et al. Malignant CTA collateral profile is highly specific for large admission DWI infarct core and poor outcome in acute stroke. AJNR Am J Neuroradiol 2012;33(7):1331 – 6. doi: 10.3174/ ajnr.A2985.
90. Mazighi M, Serfaty JM, Labreuche J, et al. Comparison of intravenous alteplase with a combined intravenous-endovascular approach in patiens with stroke and confirmed arterial occlusion (RECANALISE Study): a prospective cohort study. Lancet Neurol 2009;8(9):802 – 9. doi: 10.1016/ S1474-4422(09)70182-6.
91. Almekhlafi MA, Eesa M, Menon BK, et al. Ultrashort imaging to reperfusion time interval arrests core expansion in endovascular therapy for acute ischemic stroke. J Neurointerv Surg 2013;5(Suppl 1):i58 – 61. doi: 10.1136/ neurintsurg-2012-010486.
92. Spiotta AM, Vargas J, Turner R, et al. The golden hour of stroke intervention: effect of thrombectomy procedural time in acute ischemic stroke on outcome. J Neurointerv Surg 2014;6(7):511 – 6. doi: 10.1136/ neurintsurg-2013-010726.
93. Abou Chebl A, Lin R, Hussain MS, et al. Conscious sedation verusu general anesthesia during endovascular therapy for acute anterior circulation stroke. Stroke 2010;41(6):1175 – 9. doi: 10.1161/ STROKEAHA.109.574129.
94. van der Berg LA, Koelman DL, Berkhemer OA, et al. Type of anesthesia an differences in clinical outcome after intra-arterial treatment for acute ischemic stroke. Stroke 2015;46(5):1257 – 62. doi: 10.1161/ STROKEAHA.115.008699.
95. Školoudík D, Kuliha M, Jonszta T, et al. Endovaskulární léčba ischemické cévní mozkové příhody. Cesk Slov Neurol N 2012;75/ 108(6):669 – 83.
96. Krajina A, Krajíčková D. Role neuroradiologa v léčbě ischemických cévních mozkových příhod. Ces Radiol 2015;69(2):87 – 92.
97. Henninger N, Lin E, Haussen DC, et al. Leukoaraiosis and sex predicts the hyperacute ischemic core volume. Stroke 2013;44(1):61 – 7. doi: 10.1161/ STROKEAHA.112.679084.
98. Henninger N, Khan MA, Zhang J, et al. Leukoaraiosis predicts cortical infarct volume after distal middle cerebral artery occlusion. Stroke 2014;45(3):689 – 95. doi: 10.1161/ STROKEAHA.113.002855.
99. Mono ML, Romagna L, Jung S, et al. Intra-arterial thrombolysis for acute ischemic stroke in octogenarians. Cerebrovasc Dis 2012;33(2):116 – 22. doi: 10.1159/ 000333429.
100. Palumbo V, Boulanger JM, Hill MD, et al. Leukoaraiosis and intracerebral hemorrhage after thrombolysis in acute stroke. Neurology 2007;68(13):1020 – 4.
101. Hassan AE, Chaudhry SA, Miley JT, et al. Microcatheter to recanalisation (procedure time) predicts outcomes in endovascular treatment in patients with acute ischemic stroke: when do we stop? AJNR Am J Neuroradiol 2013;34(2):354 – 9. doi: 10.3174/ ajnr.A3202.
102. Hughes S. New AHA/ ASA Guideline Recommends Endovascular Stroke Therapy. Available from URL: http:/ / www.medscape.com/ viewarticle/ 847211.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Neobvyklé endovaskulární řešení trombózy mozkových splavů použitím aspiračního systému – kazuistikaČlánek Recenze knihČlánek Vzpomínky neurologaČlánek Robotická rehabilitace chůzeČlánek Výsledky studií srovnávajících efekt angioplastik a endarterektomií v léčbě karotických stenózČlánek Webové okénko
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2016 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Gliomy limbického a paralimbického systému, technika a výsledky resekcí
- Před trombektomií JE třeba provést IVT
- Před trombektomií NENÍ třeba vždy provést IVT
- Trombektómia „s“, alebo „bez“ systémovej trombolýzy
- Nová éra endovaskulární terapie v léčbě akutních iktů
- Nanočástice jako nosiče léků přes hematoencefalickou bariéru – naděje pro léčbu neurodegenerativních onemocnění v budoucnosti?
- Robotická rehabilitace chůze
- Výsledky studií srovnávajících efekt angioplastik a endarterektomií v léčbě karotických stenóz
- Management tranzitorní ischemické ataky a minor stroke
- Autonomní dysfunkce a její diagnostika u roztroušené sklerózy
- Kognice a hemodynamika po karotické endarterektomii pro asymptomatickou stenózu
- Klinická rekognícia spinálneho lipómu a chirurgické riešenie vlastného súboru
- Využití CT perfuze a multifázické CT angiografie v predikci rozvoje maligního mozkového edému u pacientů s akutním mozkovým infarktem
- Neobvyklé endovaskulární řešení trombózy mozkových splavů použitím aspiračního systému – kazuistika
- Ramsay-Huntov syndróm – vzácna manifestácia pomerne častého ochorenia
- Neurosarkoidóza u muže středního věku – kazuistika
- Doporučení pro rekanalizační léčbu akutního mozkového infarktu – verze 2016
- Webové okénko
-
Analýza dat v neurologii LVI.
Koncept atributivního rizika v analýze populačních studií – III. Preventabilní frakce - Recenze knih
- Přinášejí kontrastní látky s gadoliniovým základem nová rizika?
- Vzpomínky neurologa
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Ramsay-Huntov syndróm – vzácna manifestácia pomerne častého ochorenia
- Management tranzitorní ischemické ataky a minor stroke
- Neurosarkoidóza u muže středního věku – kazuistika
- Autonomní dysfunkce a její diagnostika u roztroušené sklerózy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



