-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Využití CT perfuze a multifázické CT angiografie v predikci rozvoje maligního mozkového edému u pacientů s akutním mozkovým infarktem
CT Perfusion and Multiphase CT Angiography in Malignant Brain Edema Prediction in Patients with Acute Ischemic Stroke
We explore the predictive value of CT perfusion parameters (permeability surface area, cerebral blood flow, cerebral blood volume) and multiphase CT angiography (clot localization, leptomeningeal collaterals and dural sinuses morphology) in the development of malignant brain oedema in patients with acute proximal occlusion of the middle cerebral artery. Patients from the multicentre prospective study PROVE-IT (Precise and Rapid assessment of collaterals using multi-phase CTA in the triage of patients with acute ischemic stroke for IV or IA Therapy; n = 200) were analysed. Primary outcome was evaluated by midline shift ≥ 5 mm on a follow-up CT/MRI. A CBV threshold of 1.76 ml/100 g had the highest sensitivity and specificity of for the midline shift. There was no significant difference between the two groups in analysed CT perfusion parameters calculated for the entire ischemic region.
Key words:
acute ischemic stroke – brain oedema – CT perfusion – CTA angiography – dural sinuses
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: O. Volný 1,2; P. Cimflová 1,3; C. D. D’esterre 4
Působiště autorů: ICRC – Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně 1; I. neurologická klinika LF MU a FN u sv. Anny v Brně 2; Klinika zobrazovacích metod LF MU a FN u sv. Anny v Brně 3; Calgary Stroke Program, Department of Clinical Neurosciences, Hotchkiss Brain Institute, University of Calgary, Canada 4
Vyšlo v časopise: Cesk Slov Neurol N 2016; 79/112(2): 213-217
Kategorie: Krátké sdělení
doi: https://doi.org/10.14735/amcsnn2016213Podpořeno z Evropského regionálního rozvojového fondu – Projekt FNUSA- ICRC (CZ.1.05/ 1.1.00/ 02.0123), Evropského sociálního fondu a státního rozpočtu České republiky.
Rádi bychom vyjádřili poděkování dr. Bijoy Menon MD MSc. (Hotchkiss Brain Institute, University of Calgary, Canada) a prof. Ting Lee PhD (Imaging Research Labs, Robarts Research Institute, Ontario, Canada) za poskytnutí přístupu k databázi pacientů, za cenné rady, vedení a pomoc při zpracování perfuzních dat, a doc. MU Dr. Robertovi Mikulíkovi, Ph.D., za cenné rady a odborné vedení.Souhrn
Tato pilotní studie je zaměřena na parametry CT perfuze (cerebral blood flow, cerebral blood volume a permeability surface area) a multifázické CT angiografie (lokalizace trombu, stav leptomeningeálních kolaterál a morfologii durálních splavů) v predikci rozvoje maligního mozkového edému u pacientů s akutním uzávěrem v přední mozkové cirkulaci. Analyzováni byli pacienti z prospektivní multicentrické studie PROVE-IT (Precise and Rapid assessment of collaterals using multiphase CTA in the triage of patients with acute ischemic stroke for IV or IA Therapy; n = 200). Sledovaným cílovým parametrem vývoje edému byl posun středočárových struktur na kontrolním CT/ MR po 24 – 32 hod. Do analýzy bylo zahrnuto pět pacientů s posunem ≥ 5 mm a pět kontrol, byly srovnány demografické i radiologické údaje. Nejvyšší senzitivita a specificita pro rozvoj klinicky závažného středočárového posunu byla pro CBV < 1,76 ml/ min/ 100 g pro ischemické teritorium. Hodnocení perfuzních parametrů v kompletním teritoriu ischemie neprokázalo signifikantní rozdíl.
Klíčová slova:
akutní mozkový infarkt – mozkový edém – CT perfuze – CT angiografie – žilní splavyÚvod
Incidence maligního mozkového edému (ME) po akutním mozkovém infarktu v přední mozkové cirkulaci se pohybuje mezi 3 a 10 %. Tato komplikace ovlivňuje morbiditu a mortalitu pacientů [1]. V klinické praxi i nadále chybí časný a validní prediktor rozvoje ME, který by napomohl v identifikaci a stratifikaci pacientů, jež by profitovali z včasné event. ultravčasné hemikraniektomie provedené před výrazným nárůstem intrakraniálního tlaku a rozvojem posunu středočárových struktur [2,3].
Dosud provedené studie zaměřené na využití CT perfuze nepřinesly jednoznačný ukazatel predikující rozvoj ME. Metodologicky byly zaměřeny na studium různých parametrů: permeabilita hematoencefalické bariéry [4,5], úroveň poklesu mozkového průtoku (Cerebral Blood Flow; CBF) [6,7] anebo na studium rezervní kapacity intrakraniálního prostoru [8].
V této pilotní studii jsme se zaměřili na hodnocení parametrů vstupní CT perfuze a rozvoje maligního ME u pacientů zařazených do prospektivní studie PROVE-IT (Precise and Rapid assessment of collaterals using multi-phase CTA in the triage of patients with acute ischemic stroke for IV or IA Therapy, Calgary, Canada).
Metodologie
Do analýzy byli zahrnuti všichni pacienti ze studie PROVE-IT s prokázaným terminálním uzávěrem arteria carotis interna (ACI) ± proximálním uzávěrem arteria cerebri media (ACM). Studie je registrována na ClinicalTrials.gov pod registračním číslem NCT02184936. V této skupině (n = 200) byli identifikováni pacienti s přesunem středočárových struktur ≥ 5 mm dle kontrolního CT/ MR mozku provedeném s odstupem 24 – 32 hod. Následně byli s těmito pacienty spárováni pacienti s obdobně závažným vstupním neurologickým deficitem hodnoceným dle škály National Institute of Health Stroke Scale (NIHSS) a objemově odpovídajícím akutním ischemickým postižením mozkové tkáně (objem infarktu, ml) dle kontrolního zobrazení, u kterých však nedošlo k signifikantnímu přesunu středočárových struktur. V rámci standardního protokolu zobrazení byla provedena multifázická CT angiografie a CT perfuze (64-slice Lightspeed, General Electric Healthcare, Waukesha, WI, USA). Výhodou multifázické CT angiografie je, že umožňuje dynamické zobrazení mozkové cirkulace a detailní zobrazení leptomeningeálních kolaterál. Přínosem je zobrazení mozkové cirkulace ve třech fázích, které výrazně snižuje pravděpodobnost podhodnocení morfologie leptomeningeální cirkulace, jak tomu může být u tzv. jednofázových CTA protokolů využívaných jako standardu zobrazení, a umožňuje též detailní zobrazení žilního odtoku cestou splavů tvrdé pleny mozkové (obr. 1). Na vstupní CT angiografii byly konsenzem autorů (O. V. a P. C.) hodnoceny údaje o lokalizaci uzávěru v přední mozkové cirkulaci, stav leptomeningeálních kolaterál (dle regionálního skóre) [9] a byla hodnocena přítomnost ipsilaterální hypoplazie splavů tvrdé pleny mozkové (od confluens sinuum po bulbus superior venae jugularis internae: za hypoplazii bylo považováno, pokud kontrastní náplň splavů odpovídala < 50 % ve srovnání s kontralaterální stranou). Parametry vstupní CT perfuze: permeabilita endotelu – permeability surface area; PS, CBF a CBV, byly vypočítány pomocí komerčně dostupného softwaru (CT Perfusion 4D a CT Perfusion 5, General Electric Healthcare, Waukesha, WI, USA) tzv. delay-insenzitivní dekonvoluční metodou pro kompletní ischemické teritorium a pro zrcadlově odpovídající oblasti mozku (obr. 2). PS byla kalkulována pomocí tzv. adiabatické aproximace [10]. Dosažená reperfuze byla hodnocena angiograficky u pacientů, kteří podstoupili mechanickou rekanalizaci (skóre Thrombolysis In Cerebral Infarction; TICI). U pacientů léčených intravenózní trombolýzou (IV tPA) byla rekanalizace posouzena dle kontrolní CT angiografie provedené do 24 – 32 hod. Posun středočárových struktur na úrovni septum pellucidum a morfologie splavů dle Maximum Intensity Projections (MIP) rekonstrukcí ve třech základních rovinách byly hodnoceny na základě konsenzu (O. V., B. K. M.). Statistická analýza byla provedena v software Stata/ SE 12.1 (StataCorp LP).
Obr. 1. Schéma průběhu skenování pomocí multifázické CT angiografi e (Calgary Stroke Program protokol). Fig. 1. Diagram of scanning using multiphase CT angiography (Calgary Stroke Program protocol). 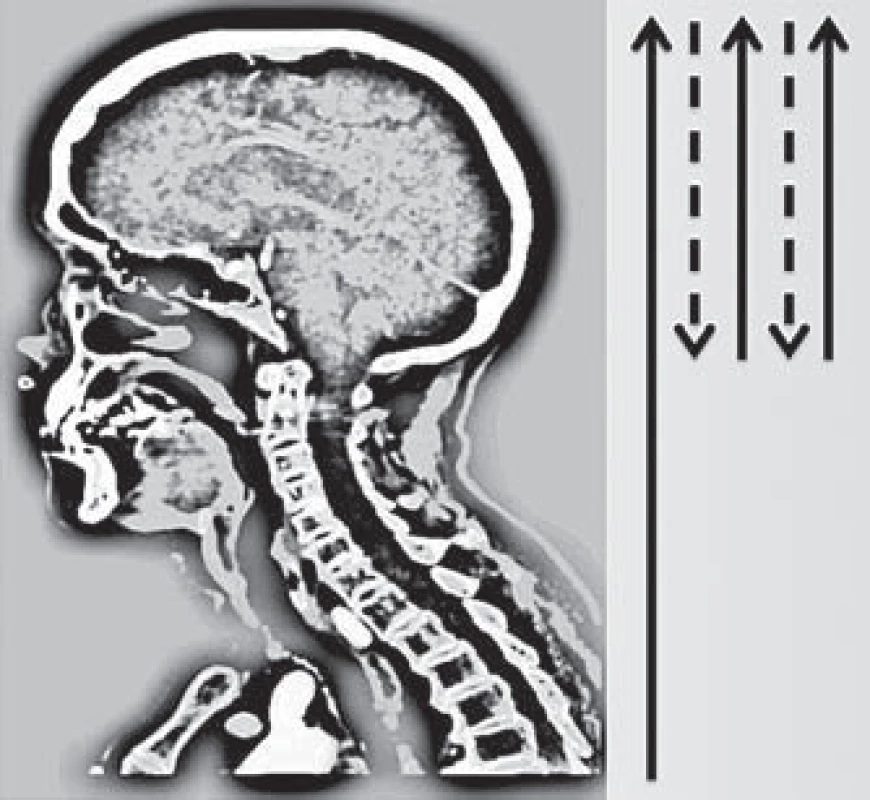
Obr. 2. Vstupní analýza CT perfuze, multifázická CTA a kontrolní CT mozku u pacienta bez a s rozvojem posunu středočárových struktur (midline shift). Fig. 2. Admission CT perfusion analysis, multiphase CTA and control brain CT in patient without and with signifi cant midline shift. 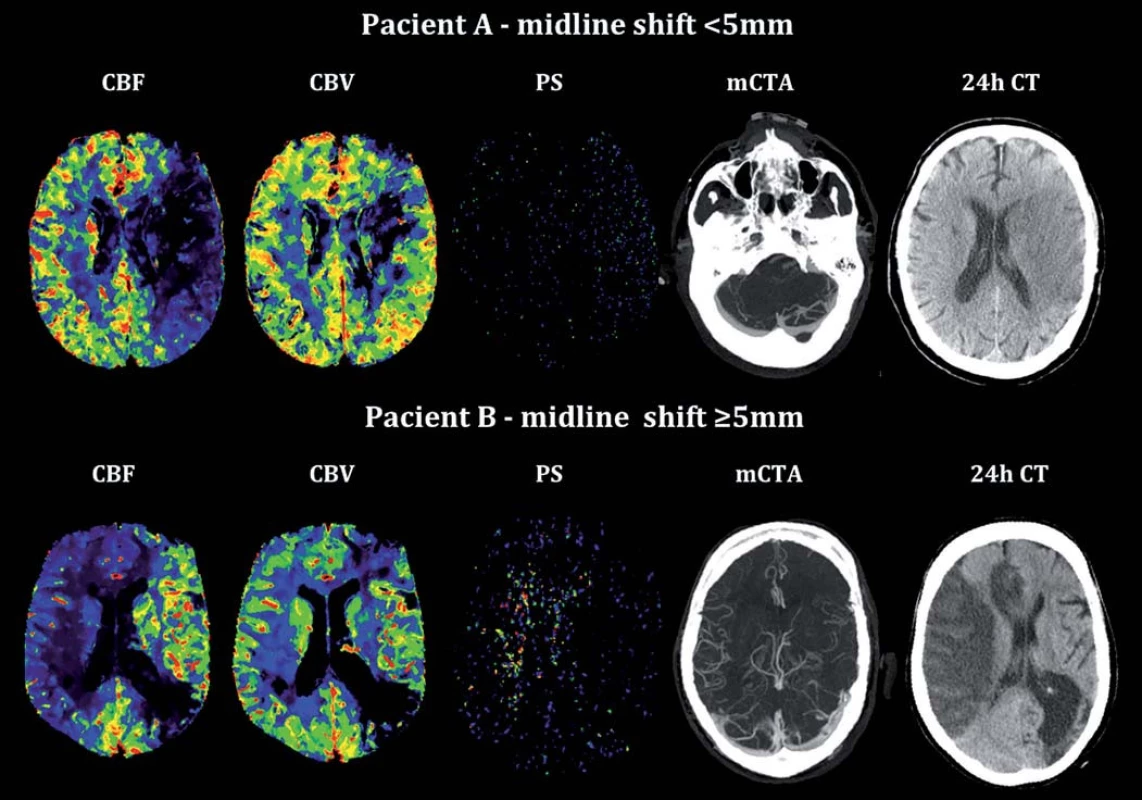
Pacient A – ischemie v povodí levé ACM, na kontrolním nativním CT za 24 hod bez rozvoje přesunu středočárových struktur (< 5 mm), symetricky utvářené splavy tvrdé pleny mozkové dle CTA. Průměr CBF ischemické oblasti 7,11 ± 7,09 ml/min/100 g, průměr CBV 2,01 ± 1,48 ml/100 g, průměr PS 1,43 ± 0,5 ml/min/100 g. Pacient B – ischemie v povodí pravé ACM, na kontrolním nativním CT za 24 hod patrný přesun středočarových struktur (≥ 5 mm), dle CTA přítomna výrazná hypoplazie ipsilaterálních splavů tvrdé pleny mozkové. Průměr CBF ischemické oblasti 4,57 ± 4,99 ml/min/100 g, průměr CBV 1,71 ± 0,93 ml/100 g, průměr PS pro oblast ischemie 3,0 ± 1,68 ml/min/100 g. Výsledky
Z 200 pacientů zařazených do studie k 1. 9. 2014 byl přesun středočárových struktur ≥ 5 mm přítomen u sedmi pacientů (3,5 %). Dva pacienti byli vyloučeni pro přítomnost artefaktů z pohybu znemožňující analýzu perfuzních dat. Průměrný věk ve skupině se středočárovým posunem ≥ 5 mm byl 61 let (směrodatná odchylka, SD ± 14), v kontrolní skupině 78 let (SD ± 11). Mezi oběma skupinami nebyl signifikantní rozdíl ve sledovaných rizikových faktorech (hypertenze, diabetes mellitus, dyslipidemie, fibrilace síní či postižení koronárních tepen; tab. 1). Šest pacientů bylo léčeno intravenózní trombolýzou (u žádného z těchto pacientů nedošlo k rekanalizaci dle kontrolní CTA). Čtyři pacienti podstoupili mechanickou rekanalizaci (s výslednou reperfuzí TICI 2b/ 3 u všech pacientů, čas od vzniku příznaků do rekanalizace se pohyboval od 310 do 403 min). Posun středočárových struktur ≥ 5 mm se rozvinul u tří pacientů léčených mechanickou rekanalizací (p = 0,03) a u dvou pacientů léčených intravenózní trombolýzou. Hypoplazie splavů tvrdé pleny mozkové na straně infarktu byla identifikována u tří z pěti pacientů (60 %) s posunem ≥ 5 mm, v kontrolní skupině byly žilní splavy u všech pacientů symetricky utvářené (p = 0,02). Mezi oběma skupinami nebyl prokázán signifikantní rozdíl v průměrných hodnotách CBF, CBV a PS v ischemické a kontralaterální oblasti (tab. 2). Nejvyšší senzitivita a specificita pro predikci rozvoje posunu středočárových struktur byla zjištěna pro hodnoty CBV < 1,76 ml/min/100 g (95% konfidenční interval (95% CI) senzitivity: 94–100 % a 95% CI specificity: 74–88 %).
Tab. 1. Základní demografické údaje a sledované parametry zobrazovacích metod – ve skupině s posunem středočárových struktur (midline shift) < 5 mm a ≥ 5 mm. 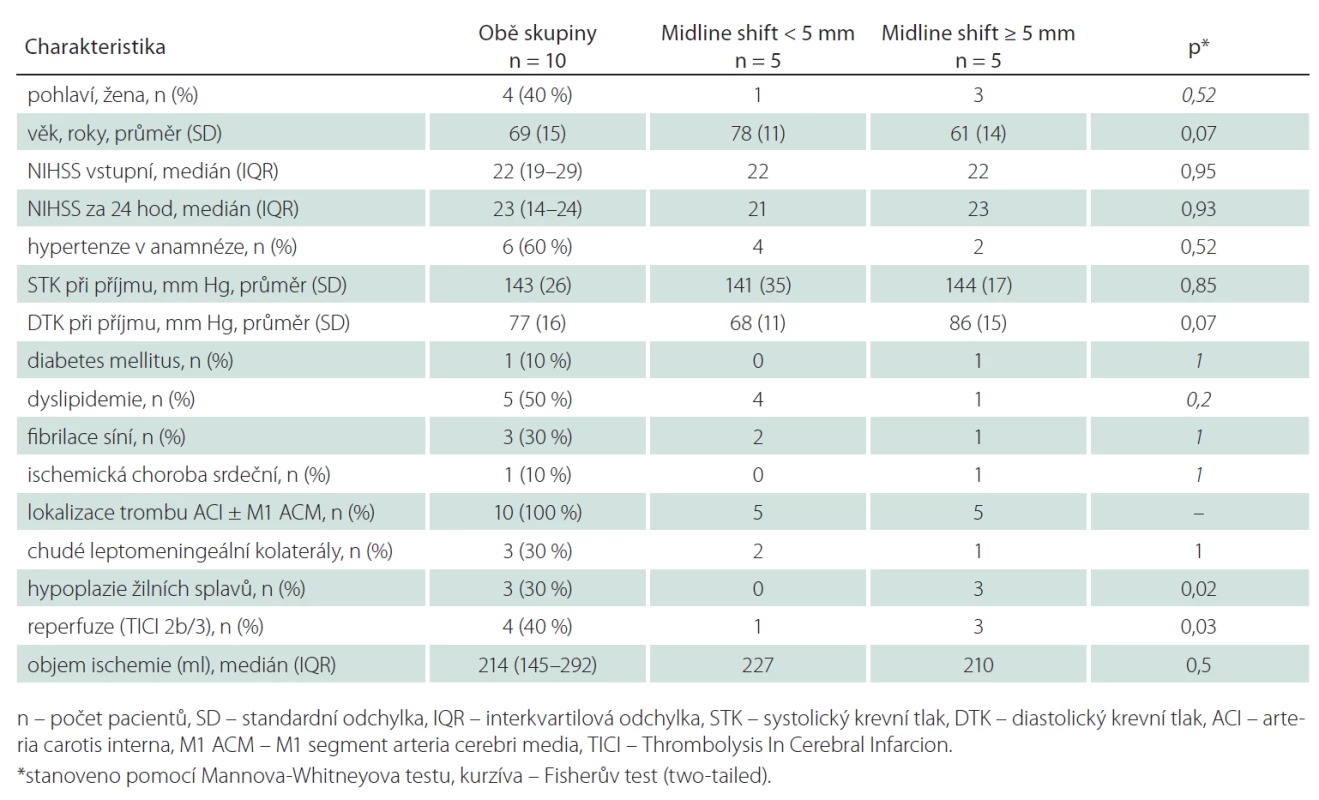
Tab. 2. Srovnání CT perfuzních parametrů ve skupině s posunem středočárových struktur (midline shift) < 5 mm a ≥ 5 mm pro kompletní teritorium ischemie. 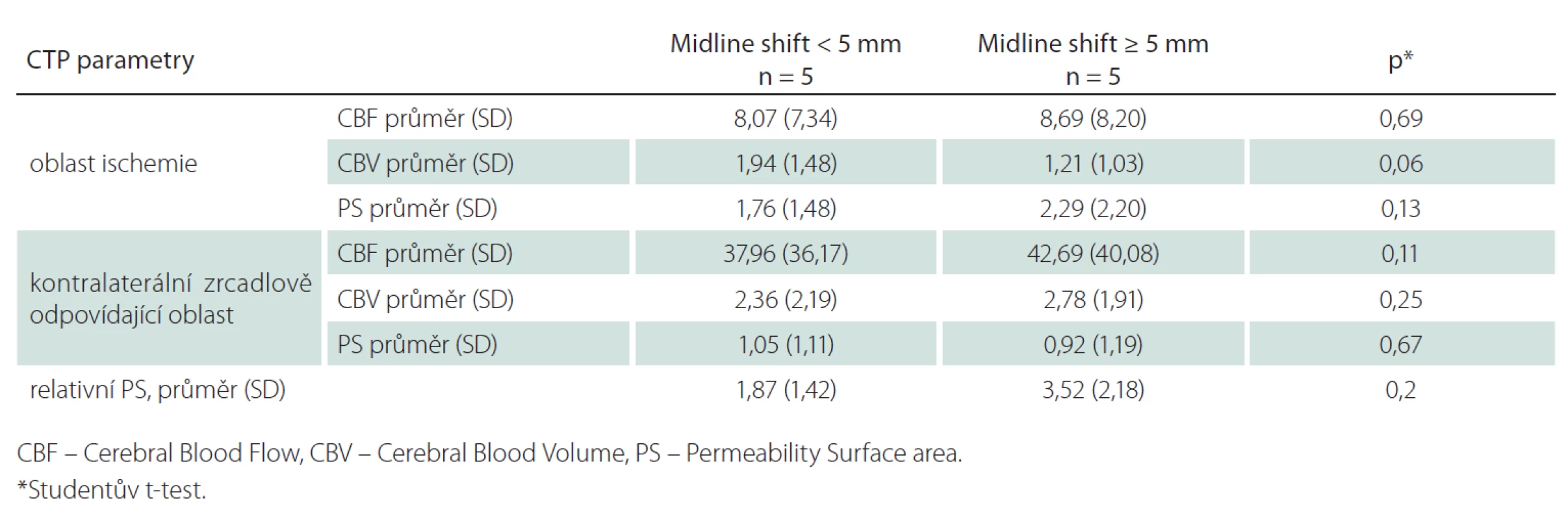
Diskuze
Většina dosud provedených studií zaměřených na predikci rozvoje maligního ME s využitím CT perfuze byla limitována nízkým počtem pacientů a retrospektivním designem. Analýze permeability hematoencefalické bariéry ve vztahu k malignímu ME byly věnovány pouze dvě retrospektivní studie (počet pacientů s ME: 3 resp. 12), které pro hodnocení permeability na rozdíl od naší analýzy využívaly tzv. Patlak model, resp. jeho modifikace pomocí komerčně dostupných software (Brain Perfusion Philips, Syngo Neuro PCT Siemens). Studie se rovněž lišily v přístupu k akvizici dat k perfuzní analýze (Hom et al využívali tzv. delayed acquisition, naopak Bektas et al tzv. first-pass data, která jsou zatížena vyšším rizikem zkreslení dat o permeabilitě hematoencefalické bariéry), což mj. ovlivňuje i srovnání s již publikovanými daty [4,5]. Pro analýzu permeability hematoencefalické bariéry je doporučeno hodnotit data získaná v pozdní fázi first acquisition anebo pomocí tzv. delayed acquisition [11].
Jiný parametr, který byl ve vztahu k rozvoji maligního ME sledován, byla tzv. rezervní kapacita intrakraniálního likvorového prostoru (hodnocená jako poměr CBV ischemického teritoria a kalkulovaného objemu zevních likvorových prostor). Přitom vyšší pravděpodobnost rozvoje ME byla prokázána u mladších pacientů, což koreluje s omezenou kapacitou zevních likvorových prostor u těchto pacientů, u kterých není přítomna atrofie [8,12]. Prospektivní perfuzní studie věnující se predikci maligního ME byly zaměřeny především na hodnocení vstupní hodnoty CBF pro ischemické teritorium [6,7]. Jedna z nich byla zaměřena na analýzu map CBF z C-flumazenil PET-CT. Nicméně tato metoda je čistě experimentální a není součástí zobrazovacích protokolů akutního mozkového infarktu.
Ačkoliv v naší pilotní studii nebyl prokázán signifikantní rozdíl mezi průměrnými hodnotami sledovaných parametrů CT perfuze, u parametrů CBV a permeability surface area byl prokázán statistický trend. Rozdíl našich výsledků v porovnání s již publikovanými pracemi může souviset s rozdílným algoritmem výpočtu jednotlivých perfuzních parametrů pomocí moderního software pro hodnocení CT perfuze (CT perfusion 5).
Dalším radiologickým parametrem, na který jsme se zaměřili byla morfologie splavů tvrdé pleny mozkové na straně mozkového infarktu. Klinicky i radiologicky zajímavým zjištěním je skutečnost, že s rozvojem ME může nepřímo souviset jejich hypoplazie. V jedné retrospektivní studii (zahrnuto 14 pacientů) bylo prokázáno, že ipsilaterální hypoplazie splavů tvrdé pleny mozkové je spojena s vyšším rizikem rozvoje posunu středočárových struktur a s rozvojem ME [13]. V této práci byly posuzovány i možné patofyziologické souvislosti (mj. narušení hydrostatického gradientu z mozkové tkáně do žilního systému mozku a následně narušení resorpce intersticiální tekutiny a zpomalení cirkulace likvoru). Tři z pěti pacientů v naší kohortě, kteří vyvinuli signifikantní posun středočárových struktur a u kterých se objevily příznaky deteriorace neurologického stavu následkem maligního ME, měli dle venózní fáze multifázické CT angiografie patrnou nápadnou hypoplazii žilní drenáže od confluens sinuum po bulbus superior venae jugularis internae.
Randomizovaná data o přínosu CT perfuze v diagnostice akutního mozkového infarktu jsou limitována na výsledky dvou pozitivních intervenčních studií EXTEND-IA a SWIFT PRIME publikovaných v roce 2015, ve kterých v rámci selekce pacientů pro mechanickou rekanalizaci byly automatickou analýzou hodnoceny ireverzibilní a reverzibilní ischemické změny (tzv. core – jádro a viabilní penumbra, definované jako relativní CBF pod 30 %, resp. Time to Maximum; Tmax nad 6 s) [14,15]. Analýza permeability surface area či jiná metoda hodnocení poškození hematoencefalické bariéry nebyly v rámci těchto studií provedeny.
Současně platnými guidelines je v rámci akutního neurozobrazení doporučeno provedení CT a CT angiografie nebo MR a MR angiografie. Pokročilé metody zobrazení, kam spadá i CT perfuze, jsou doporučeny u pacientů v terapeutickém okně mechanické trombektomie do 6 hod u pacientů s ischemickými změnami hodnocenými dle skóre Alberta Stroke Program Early CT (ASPECTS) pod 6, resp. u pacientů po 6 hod od vzniku příznaků s prokázaným uzávěrem velké tepny [16]. U těchto pacientů by kromě hodnocení CBV, CBF a Tmax bylo přínosné i standardizované hodnocení permeability surface area jako ukazatele poškození hematoencefalické bariéry a rizika reperfuzního poškození před plánovanou mechanickou trombektomií.
V rámci limitací naší studie si jsme vědomi nízkého počtu pacientů zařazených do statistické analýzy. Nicméně charakter této studie byl pilotní a ve srovnání s předchozími studiemi byla studována a analyzována přesně definovaná kohorta pacientů z prospektivní studie. Pro analýzu CT perfuzních parametrů byl využit nejmodernější a validizovaný software CT perfusion 5. Abychom měli možnost provést srovnání s předchozími studiemi zaměřenými na predikci rozvoje ME u pacientů s akutním mozkovým infarktem v přední mozkové cirkulaci, byly i v naší pilotní analýze hodnoceny perfuzní parametry pro celou oblast detekované ischemie. Nicméně pro posouzení prediktivní hodnoty CT perfuze v rozvoji maligního mozkového edému považujeme za nezbytné standardizované hodnocení dat u větší kohorty pacientů a také analýzu CT perfuzních parametrů v konkrétních ROI ischemického teritoria.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Ondřej Volný
I. neurologická klinika
FN u sv. Anny v Brně
Pekařská 53
656 91 Brno
e-mail: 214565@mail.muni.cz
Přijato k recenzi: 27. 10. 2015
Přijato do tisku: 15. 12. 2015
Zdroje
1. Gupta R, Connolly ES, Mayer S, et al. Hemicraniectomy for massive middle cerebral artery territory infarction: a systematic review. Stroke 2004;35(2):539 – 43.
2. Cho DY, Chen TC, Lee HC. Ultra-early decompressive craniectomy for malignant middle cerebral artery infarction. Surg Neurol 2003;60(3):227 – 32.
3. Vahedi K, Hofmeijer J, Juettler E, et al. Early decompressive surgery in malignant infarction of the middle cerebral artery: a pooled analysis of three randomized controlled trials. Lancet Neurol 2007;6(3):215 – 22.
4. Bektas H, Wu TC, Kasam M, et al. Increased blood-brain barrier permeability on perfusion CT might predict 1. Stroke 2010;41(11):2539 – 54. doi: 10.1161/ STROKEAHA.110.591362.
5. Hom J, Dankbaar JW, Soares BP, et al. Blood-brain barrier permeability assessed by perfusion CT predicts symptomatic hemorrhagic transformation and malignant edema in acute ischemic stroke. Am J Neuroradiol 2011;32(1):41 – 8. doi: 10.3174/ ajnr.A2244.
6. Dittrich R, Kloska SP, Fischer T, et al. Accuracy of perfusion-CT in predicting malignant middle cerebral artery brain infarction. J Neurol 2008;255(6):896 – 902. doi: 10.1007/ s00415-008-0802-1.
7. Dohmen C, Galldiks N, Bosche B, et al. The severity of ischemia determines and predicts malignant brain edema in patients with large middle cerebral artery infarction. Cerebrovasc Dis 2012;33(1):1 – 7. doi: 10.1159/ 000330648.
8. Minnerup J, Wersching H, Ringelstein EB, et al. Prediction of malignant middle cerebral artery infarction using computed tomography-based intracranial volume reserve measurements. Stroke 2011;42(12):3403 – 9. doi: 10.1161/ STROKEAHA.111.619734.
9. Menon BK, d’Esterre CD, Qazi EM, et al. Multiphase CT angiography: a new tool for the imaging triage of patients with acute ischemic stroke. Radiology 2015;275 : 510 – 20. doi: 10.1148/ radiol.15142256.
10. Lawrence KS, Lee TY. An adiabatic approximation to the tissue homogeneity model for water exchange in the brain: II. experimental validation. J Cereb Blood Flow Metab 1998;18(12):1378 – 85.
11. Nguyen GT, Coulthard A, Wong A, et al. Measurement of blood-brain barrier permeability in acute ischemic stroke using standard first-pass perfusion CT data. NeuroImage Clin 2013;2 : 658 – 62. doi: 10.1016/ j.nicl.2013.04.004.
12. Elahy M, Jackaman C, Mamo JC, et al. Blood-brain barrier dysfunction developed during normal aging is associated with inflammation and loss of tight junctions but not with leukocyte recruitment. Immun Ageing 2015;12 : 2. doi: 10.1186/ s12979-015-0029-9.
13. Yu W, Rives J, Welch B, et al. Hypoplasia or occlusion of the ipsilateral cranial venous drainage is associated with early fatal edema of middle cerebral artery infarction. Stroke 2009;40(12):3736 – 9. doi: 10.1161/ STROKEAHA.109.563080.
14. Saver JL, Goyal M, Bonafe A, et al. Stent-retriever thrombectomy after intravenous t-PA vs. t-PA alone in stroke. N Engl J Med 2015;372(24):2285 – 95. doi: 10.1056/ NEJMoa1415061.
15. Campbell BC, Mitchell PJ, Kleinig TJ, et al. Endovascular therapy for ischemic stroke with perfusion-imaging selection. N Engl J Med 2015;372(11):1009 – 18. doi: 10.1056/ NEJMoa1414792.
16. Powers WJ, Derdeyn CP, Biller J, et al. 2015 AHA/ ASA focused update of the 2013 guidelines for the early management of patients with acute ischemic stroke regarding endovascular treatment. Stroke 2015;46(10):3020 – 35. doi: 10.1161/ STR.0000000000000074.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Robotická rehabilitace chůzeČlánek Výsledky studií srovnávajících efekt angioplastik a endarterektomií v léčbě karotických stenózČlánek Neobvyklé endovaskulární řešení trombózy mozkových splavů použitím aspiračního systému – kazuistikaČlánek Recenze knihČlánek Vzpomínky neurologaČlánek Webové okénko
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2016 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Gliomy limbického a paralimbického systému, technika a výsledky resekcí
- Před trombektomií JE třeba provést IVT
- Před trombektomií NENÍ třeba vždy provést IVT
- Trombektómia „s“, alebo „bez“ systémovej trombolýzy
- Nová éra endovaskulární terapie v léčbě akutních iktů
- Nanočástice jako nosiče léků přes hematoencefalickou bariéru – naděje pro léčbu neurodegenerativních onemocnění v budoucnosti?
- Robotická rehabilitace chůze
- Výsledky studií srovnávajících efekt angioplastik a endarterektomií v léčbě karotických stenóz
- Management tranzitorní ischemické ataky a minor stroke
- Autonomní dysfunkce a její diagnostika u roztroušené sklerózy
- Kognice a hemodynamika po karotické endarterektomii pro asymptomatickou stenózu
- Klinická rekognícia spinálneho lipómu a chirurgické riešenie vlastného súboru
- Využití CT perfuze a multifázické CT angiografie v predikci rozvoje maligního mozkového edému u pacientů s akutním mozkovým infarktem
- Neobvyklé endovaskulární řešení trombózy mozkových splavů použitím aspiračního systému – kazuistika
- Ramsay-Huntov syndróm – vzácna manifestácia pomerne častého ochorenia
- Neurosarkoidóza u muže středního věku – kazuistika
- Doporučení pro rekanalizační léčbu akutního mozkového infarktu – verze 2016
- Webové okénko
-
Analýza dat v neurologii LVI.
Koncept atributivního rizika v analýze populačních studií – III. Preventabilní frakce - Recenze knih
- Přinášejí kontrastní látky s gadoliniovým základem nová rizika?
- Vzpomínky neurologa
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Ramsay-Huntov syndróm – vzácna manifestácia pomerne častého ochorenia
- Management tranzitorní ischemické ataky a minor stroke
- Neurosarkoidóza u muže středního věku – kazuistika
- Autonomní dysfunkce a její diagnostika u roztroušené sklerózy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



