-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Delirium u kriticky nemocných – prospektivní studie
Delirium in Intensive Care Patients – a Prospective Study
Introduction:
Delirium, as a manifestation of acute brain dysfunction, is a frequent complication in critical care patients. Any critical disorder is an independent risk factor for development of delirium. The prevalence of delirium in critically ill patients has been reported between 11 and 87%. Delirium is under-diagnosed even though it significantly worsens patient prognosis. The aim of our study was to support regular use of the Confusion Assessment Method for the Intensive Care Unit (CAM-ICU), in order to facilitate early diagnostics, prevention and treatment of delirium.Method:
A prospective study of the incidence of delirium as well as risk factors for its development in patients admitted to six-bed ICU from February to June 2014. All patients were assessed for predisposing and precipitating risk factors using the Czech version of CAM-ICU. Fisher’s Exact Test and Wilcoxon Rank-Sum were performed with the significance level of 0.05.Results:
Delirium was diagnosed in 125 of the overall group of 142 patients. Seventeen patients were excluded from the study as they could not be assessed (16 due to prolonged coma, one due to language barrier). The incidence of delirium reached 31.2%. Within the study group consisting of surgical, medical and trauma patients with the median APACHE II score of 12, medical and trauma patients were more likely to develop delirium than surgical ones. Development of delirium was associated with the severity of the disease (APACHE II score), use of sedatives, analgesics and vasopressors. Delirious patients stayed longer at the ICU and they showed higher need for artificial ventilation.Key words:
delirium – diagnostic tests – intensive care units – predisposing risk factors – precipitating risk factors – prevention
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: M. Káňová 1–3; M. Burda 4; J. Povová 1; J. Neiser 2,3
Působiště autorů: Ústav epidemiologie a ochrany veřejného zdraví, LF OU v Ostravě 1; Klinika anesteziologie, resuscitace a intenzivní medicíny LF OU a FN Ostrava 2; Katedra intenzivní medicíny a forenzních oborů, LF OU v Ostravě 3; Centrum excelence IT4Innovations, Ústav pro výzkum a aplikace fuzzy modelování, OU v Ostravě 4
Vyšlo v časopise: Cesk Slov Neurol N 2015; 78/111(6): 662-667
Kategorie: Původní práce
Souhrn
Úvod:
Delirium jako projev mozkové dysfunkce je častá komplikace u kriticky nemocných. Kritické onemocnění představuje nezávislý rizikový faktor pro výskyt delirantních stavů. Prevalence deliria se u kriticky nemocných pohybuje mezi 11 a 87 %. Delirium je poddiagnostikováno, ačkoli významně zhoršuje prognózu. Cílem naší práce je podpořit zavedení skríningového testu deliria CAM‑ICU (The Confusion Assessment Method for the Intensive Care Unit) do běžné praxe a tím umožnit jeho včasnou diagnostiku, prevenci a léčbu.>Metody:
Prospektivní hodnocení incidence deliria a rizikových faktorů jeho rozvoje u pacientů přijatých na šestilůžkovou JIP v období únor až červen 2014. Delirium bylo vyšetřováno metodou CAM‑ICU. Použili jsme českou verzi testu brněnské skupiny autorů. U všech pacientů jsme hodnotili rizikové faktory (preexistující a precipitující). Ke zhodnocení jsme použili Fisherův exaktní test (u kategoriálních znaků) a dvouvýběrový Wilcoxonův pořadový test (u numerických znaků). U všech testů byla použita hladina významnosti p = 0,05.Závěr:
Ze 142 pacientů bylo delirium hodnotitelné u 125 pacientů. Pro nemožnost vyšetření deliria CAM‑ICU testem vzhledem k perzistujícímu kómatu a jednou pro jazykovou bariéru bylo vyloučeno 17 pacientů. Incidence deliria dosáhla 31,2 %. Šlo o smíšenou populaci pacientů traumatologických, chirurgických a interních s mediánem APACHE II (Acute Physiology And Chronic Health Evaluation) rovným 12. Vyšší riziko rozvoje deliria je u pacientů s primárně interním onemocněním a po traumatu ve srovnání s pacienty chirurgickými. Výskyt deliria ovlivňuje tíha onemocnění (APACHE II), užití analgosedace, vazopresorů. Delirantní pacienti pobývali na JIP déle, rovněž potřeba umělé plicní ventilace byla vyšší.Klíčová slova:
delirium – diagnostické testy – jednotka intenzivní péče – rizikové faktory preexistující – rizikové faktory precipitující – preventivní přístupÚvod
Delirium je manifestace akutní mozkové dysfunkce, pro kterou je charakteristická alterace stavu vědomí s poruchou kognitivních funkcí. Delirium je definováno americkou psychiatrickou asociací (APA) v Diagnostic and Statistical Manual of Mental Disorders (DSM ‑ IV ‑ TR) jako porucha vědomí a kognitivních funkcí, která se rozvíjí v krátkém časovém intervalu hodin až dnů. Charakteristické jsou porucha vědomí se sníženou schopností soustředění, udržení a přenesení pozornosti. Dále změny kognitivních funkcí (dezorientace, poruchy paměti, neschopnost se vyjadřovat, percepční poruchy). Typický je rozvoj v krátkém čase s undulující charakteristikou v průběhu dne. Rozvoj deliria má spojitost s fyzickým stavem, probíhajícím onemocněním [1]. Jeho prevalence je u kriticky nemocných vysoká pro přítomnost řady rizikových faktorů. Pohybuje se od 11 do 87 % převážně v závislosti na tíži onemocnění (Acute Physiology And Chronic Health Evaluation; APACHE II) a potřebě umělé plicní ventilace (UPV). Skórovací systém APACHE II klasifikuje závažnost onemocnění na základě 12 laboratorních hodnot jednotlivých orgánových funkcí, věku pacienta, a zda byl pacient přijat po urgentním nebo elektivním operačním výkonu. Každá proměnná je ohodnocena dle závažnosti body 0 – 4 (rektální teplota, střední arteriální tlak, pulz, dechová frekvence, oxygenační index, arteriální pH, natrium, kalium v séru, kreatinin, hematokrit, leukocyty a Glasgow Coma Scale) a umožní tak predikovat mortalitu. Delirium představuje orgánové selhání centrálního nervového systému (CNS), a proto nepřekvapuje spojitost mezi výskytem delirantního stavu a rozvojem multiorgánové dysfunkce (MODS) vyjádřené vyšším APACHE II.
Delirium je v praxi opomíjeno, ačkoli je to stav značně zhoršující prognózu. Je prediktorem delší hospitalizace a také 2,5× navyšuje krátkodobou a 3,2× dlouhodobou mortalitu. Navíc je delirium spojeno s možným dlouhodobým kognitivním postižením [2 – 8].
Rozeznáváme tři typy deliria: hyperaktivní, hypoaktivní a smíšené. Právě vysoký výskyt hypoaktivní formy deliria označované za „tiché delirium“ je odpovědné za poddiagnostikování delirií. Pacient se nijak neprojevuje, nevyžaduje pozornost ošetřujícího personálu, často jej zaměníme za „špatnou náladu“, depresi pacienta. Zde stoprocentně platí, že kdo nehledá, nenajde. Pro hypoaktivní delirium je charakteristická apatie, omezená spolupráce, zpomalená aktivita, snížená rychlost a množství komunikace. Na druhé straně stojí hyperaktivní delirium. To se projevuje agitovaností, emoční labilitou, slovní i celkovou agresivitou ohrožující ošetřující personál i sebe nechtěnými extubacemi, snahou si odstranit vstupy, katétry, konstruktivním neklidem. Tito pacienti mívají halucinace, „noční můry, strachy“. Smíšené delirium mění v průběhu doby oba obrazy [9 – 11].
Patofyziologie deliria je dána řadou neurochemických procesů, na jejichž rozvoji se spolupodílí množství rizikových faktorů. Delirium se vyvíjí v součinnosti preexistujících faktorů určujících vulnerabilitu CNS daného jedince (předchozí kognitivní funkce, věk, komorbidita) a precipitujících faktorů zahrnujících faktory nynějšího onemocnění a faktory prostředí (trauma, systémová zánětlivá odpověď SIRS/ sepse, terapie, lékové interakce, izolace a užití omezujících prostředků). Ačkoli některé rizikové faktory nejsou ovlivnitelné (věk, předchozí výskyt demence, komorbidity, CNS onemocnění), jiné jsou modifikovatelné plně nebo alespoň částečně (bolest, instrumentace, dehydratace a vzestup katabolitů, biochemické abnormality, infekce, porucha oxygenace, medikace a lékové interakce, trvání a typ anestezie, krevní ztráty, malnutrice). Dvě dominantní hypotézy vysvětlují rozvoj delirií snížením cholinergní aktivity a neuroinflamatorní hypotézou imbalancí pro ‑ a protizánětlivě působících cytokinů. Z dalších hypotéz je to porucha oxidativního metabolizmu, neurotransmiterová dysbalance a dysfunkce mediátorů jiných než acetylcholin (dopaminu, noradrenalinu, serotoninu, glutamátu, kyseliny gama‑aminomáselné GABA), porucha permeability hematoencefalické bariéry [12 – 15].
Současný přístup v terapii delirantních stavů se posunuje k jeho prevenci. Pro tento přístup je zásadní znalost rizikových faktorů pacienta, která umožní stratifikaci rizika rozvoje deliria. Každý další rizikový faktor exponenciálně zvyšuje riziko rozvoje delirantního stavu. Delirium je nejen vysoce predikovatelné, ale naštěstí i preventabilní. Zvláště faktory precipitující jsou dobře ovlivnitelné vhodnou prevencí. Udává se, že až třetině případů delirií lze prevencí předejít [12,16,17].
ABCDE preventivní přístup je balíček doporučení péče o uměle ventilované pacienty zlepšující jejich outcome. Awakening (A) – minimalizace sedace; spontaneous breathing (B) – snaha o spontánní ventilaci; choice of sedation (C) – výběr sedativa: jsou tři základní kroky zkracující dobu UPV, dobu hospitalizace a snižující mortalitu [18 – 20]. Denní „prázdniny od sedace“ jsou bezpečné, nezvyšují přítomnost posttraumatického stresu. Co se týče volby sedativ, stále více prací prokazuje delirantní efekt benzodiazepinů (GABA agonisté), opioidů i propofolu. Vhodnými sedativy se jeví α ‑ 2 agonisté. Jejich sedativní a analgetický efekt bez respirační deprese je dán agonistickým účinkem na receptory v locus coeruleus a míše. Zvláště dexmedetomidin ve srovnání s jinými sedativy zvyšuje počet dnů bez deliria a kómatu, jak prokazuje analýza skupiny septických pacientů studie MENDS [21]. Delirium monitoring and treatment (D) jako monitorace deliria a terapie je rozhodující krok v úspěšném managementu delirantních pacientů. CAM‑ICU je skríningový test umožňující diagnostiku delirií i u pacientů intubovaných, s podporou UPV. Námi používaná česká verze testu CAM‑ICU.cz je metoda s vysokou senzitivitou 97,3 % a specificitou 93 % [22]. Brzká diagnostika delirantního stavu a identifikace rizikových faktorů umožní včasnou minimalizaci jejich vlivu. Nedílnou součástí balíčku je early mobilization and exercise (E), tedy časná mobilizace pacientů. V současnosti je jednoznačně doporučována monitorace delirií. Pokud jde o terapii, zde tak jednoznačná doporučení nejsou. Jako potenciální léky se zkrácením doby trvání deliria se jeví antipsychotika druhé generace. Ale zatím není dostatek důkazů pro jejich užití, chybí studie s rozdělením pacientů dle jednotlivých typů delirií [22 – 27].
Soubor a metodika
Prospektivní hodnocení incidence deliria a rizikových faktorů jeho rozvoje u pacientů přijatých na multidisciplinární lůžkovou JIP v období únor až červen 2014. Šlo o 142 pacientů, z nichž 17 bylo vyloučeno pro nemožnost vyšetření deliria (16× perzistující kóma, 1x jazyková bariéra; schéma 1). Delirium bylo vyšetřováno denně lékařem u 125 pacientů po celou dobu hospitalizace.
Diagnostika delirií pomocí testu CAM‑ICU se provádí ve dvou krocích. V první fázi se hodnotí stav vědomí pomocí 10stupňové škály Richmond Agitation Sedation Scale (RASS). U pacientů v hluboké sedaci nereagující na fyzickou stimulaci (RASS – 5, – 4) další diagnostika není možná. U pacientů s RASS ≥ – 3, tedy reagujícího na slovní výzvu, lze pokračovat v diagnostice delirií pomocí CAM‑ICU testu. Tento test hodnotí čtyři hlavní znaky deliria: fluktuující úroveň vědomí, poruchu pozornosti, úroveň vědomí jinou než RASS 0 (tedy bdělý, klidný pacient) a dezorganizaci myšlení. Při pozitivitě 3 ze 4 znaků je pacient delirantní, tedy CAM+ [22,28,29]. CAM – označujeme v našem souboru pacienty bez deliria, CAM0 znamená pacienty s poruchou vědomí (RASS – 5, – 4) a tudíž testem nehodnotitelné (tab. 1).
Tab. 1. Počty pacientů zařazených do studie, tříděno podle typu deliria. 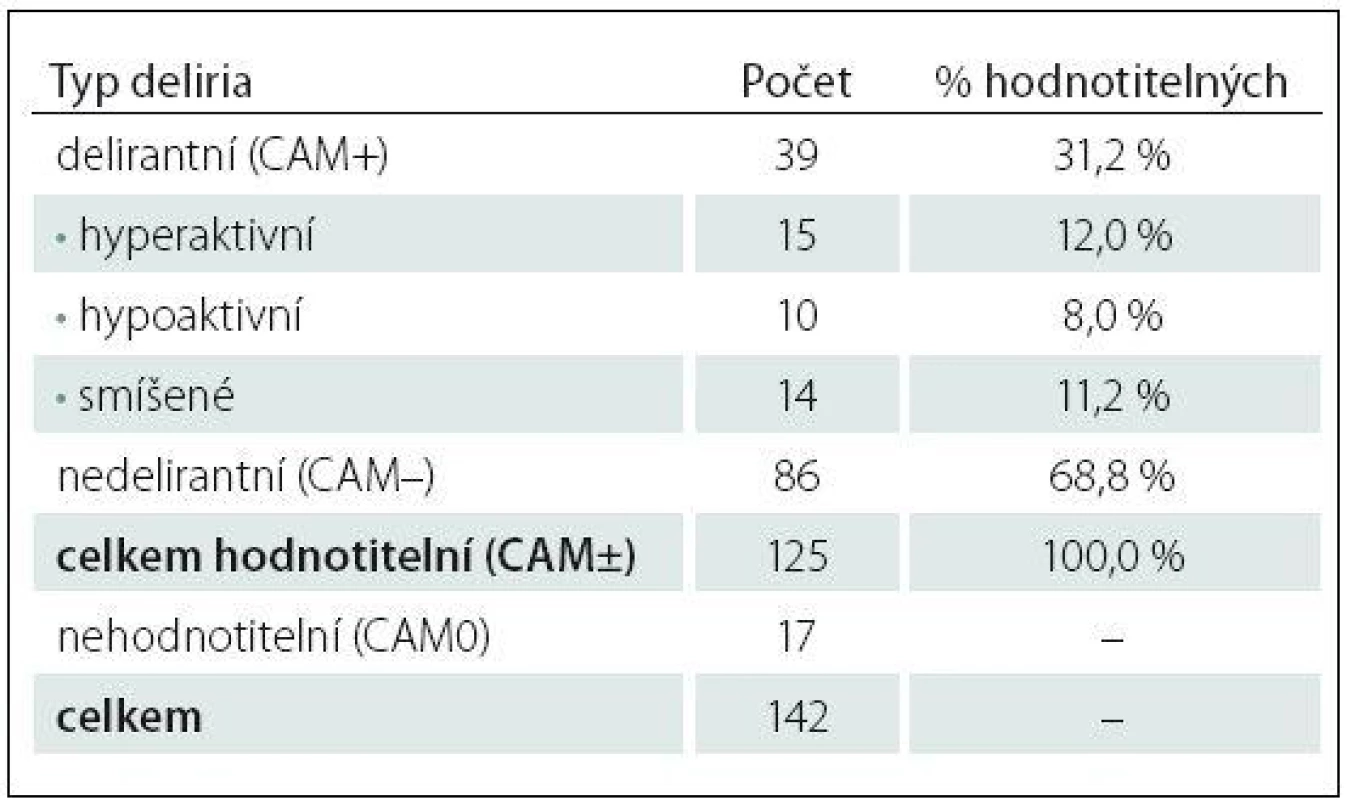
Tab. 2 popisuje základní charakteristiky souboru.
Tab. 2. Základní charakteristiky souboru, tříděno podle výskytu deliria. 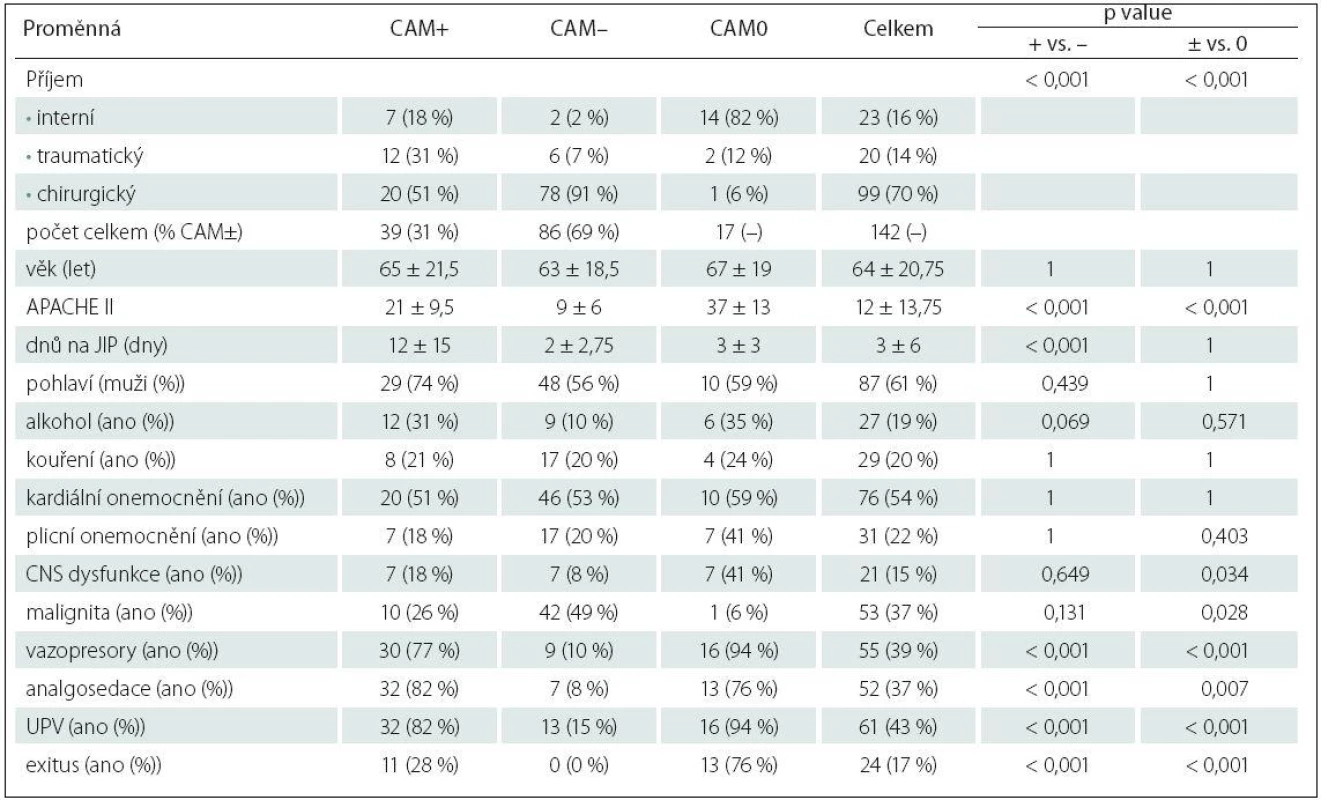
Předposlední sloupec udává p value testu srovnávajícího delirantní (CAM+) a nedelirantní (CAM–) pacienty podle proměnné na daném řádku; poslední sloupec udává p value testu srovnávajícího odnotitelné pacienty (CAM+ nebo CAM–) s nehodnotitelnými (CAM0). Numerické proměnné mají vyčíslen medián ± mezikvartilové rozpětí a byly testovány Wilcoxonovým testem. Kategoriální proměnné mají vyčíslen absolutní a relativní (%) počet a jsou testovány pomocí Fisherova exaktního testu. UPV – umělá plicní ventilace. Celkový věkový medián byl 64 let + interkvartilové rozpětí 20,75 let, z toho u delirantních (CAM+) pacientů 65 + 21,5, u nedelirantních (CAM–) pacientů 63 + 18,5 a u nehodnotitelných (CAM0) 67 + 19 let. Dle typu příjmu jsme rozdělili pacienty do tří kategorií. U chirurgických pacientů jde o pacienty po rozsáhlých operačních výkonech převážně pro onkologická onemocnění. Nejčastěji jsou na naši JIP přijímáni pacienti po doudenohemipankreatektomiích, resekcích střev, pneumonektomiích a lobektomiích,radikálních cystektomiích a radikálních prostatektomiích. Menší část pak tvoří pacienti po totálních endoprotézách kolene a kyčle. Ve skupině interních pacientů jde zvláště o SIRS/ septické pacienty s rozvojem MODS, pacienty s těžkými pneumoniemi vyžadujícími UPV, s rozvojem syndromu akutní respirační tísně (Acute Respiratory Distress Syndrom; ARDS). Ve skupině traumatický příjem se jedná o pacienty polytraumatizované.
V celém souboru 142 kriticky nemocných bylo 99 chirurgických pacientů (69,7 %), 23 interních pacientů (16,2 %) a 20 traumatických nemocných (14,1 %). Převážnou část tvořili muži (61,2 %), 87 mužů a 55 žen. V souboru hodnotitelných 125 kriticky nemocných bylo 78,4 % chirurgických pacientů (98 pacientů), 14,4 % traumatologických (18 pacientů) a jen 7,2 % interních nemocných (devět pacientů). U CAM0 nehodnotitelných bylo největší zastoupení interních nemocných, ze 17 jich bylo 14 a jen dva traumatologičtí a jeden chirurgický pacient.
U všech pacientů jsme hodnotili preexistující a precipitující rizikové faktory:
- Preexistující, minimálně ovlivnitelné prevencí: věk, pohlaví, kouření, alkohol, CNS dysfunkce a predisponující kognitivní porucha, kardiální, plicní onemocnění a malignita.
- Precipitující, lépe ovlivnitelné prevencí: charakteristika příjmu (chirurgický, traumatologický, interní), tíže onemocnění (APACHE II), délka pobytu na JIP, užití analgosedace, vazopresorů, UPV a její trvání.
Pro zjištění preexistující demence, kouření, chronického užívání alkoholu, kardiálního, plicního onemocnění a malignity byla použita anamnestická data z příjmové zprávy. V případě chybějících dat (pacienti přijímání v bezvědomí) byla následně data doplněna rodinou a z lékařských zpráv. Pacienti i jejich rodiny však často neuvádějí skutečnou spotřebu cigaret a alkoholu. Přítomnost CNS dysfunkce byla hodnocena jako pozitivní u pacientů se sluchovým či zrakovým postižením, u stavů přijímaných po kardiopulmonální resuscitaci (KPCR) a u kraniotraumat a dále u pacientů s predisponující kognitivní poruchou, byl‑li v lékařské dokumentaci záznam o demenci pacienta. APACHE II hodnotíme u každého pacienta do 24 hod po přijetí na JIP. Dále jsme zaznamenali u delirantních pacientů délku trvání deliria a jeho typ (hyperaktivní, hypoaktivní, smíšený).
Ke zhodnocení vlivu jednotlivých rizikových faktorů na výskyt deliria jsme použili Fisherův exaktní test (u kategoriálních znaků) a dvouvýběrový Wilcoxonův pořadový test (u numerických znaků). U všech testů byla použita hladina významnosti p value ≤ 0,05. Výsledné p value provedených statistických testů byly adjustovány pro mnohonásobné testování pomocí Holmovy ‑ Bonferroniho metody [30].
Pro evaluaci současného vlivu více faktorů byla použita logistická regrese. Model logistické regrese byl vytvořen metodou postupného přidávání faktorů. Začíná se od prázdného modelu s nula faktory. V jednotlivých krocích se do modelu přidává takový faktor, aby výsledný model vykazoval co nejnižší hodnotu Akaikeho informačního kritéria (Akaike Information Criterion; AIC). Postup přidávání faktorů do modelu končí v okamžiku, kdy je dosaženo minima AIC (tj. přidáním dalšího faktoru by se naopak AIC modelu zvýšilo). AIC měří relativní kvalitu statistického modelu pro daná data. Bere v úvahu věrohodnostní funkci modelu současně s počtem parametrů modelu. Nižší hodnota AIC znamená lepší model.
Veškeré statistické analýzy byly provedeny v softwaru R verze 3.1.2.
Cílem naší práce bylo rozebrat rizikové faktory rozvoje deliria a zjistit možnost prevence rozvoje delirantního stavu u kriticky nemocných na JIP. Přístup k delirantním pacientům se posunuje od farmakologické terapie k prevenci. A právě pro možnost prevence jsme rozdělili rizikové faktory na preexistující – spojené s charakteristikami a chronickými onemocněními pacientů s omezenou možností prevence, a precipitující, které se vztahují k akutnímu onemocnění a u řady z nich je prevence možná [12,17].
Výsledky
V období únor až červen 2014 bylo 142 kriticky nemocných na JIP vyšetřováno na výskyt deliria a přítomnost rizikových faktorů jeho rozvoje. Skríningovým testem CAM‑ICU.cz nebylo vyšetřitelných 17 pacientů, v 16 případech pro perzistující kóma (RASS – 5, – 4).
Incidence delirií v souboru 125 vyšetřitelných pacientů během daného období dosáhla 31,2 %, 39 CAM+ pacientů. Nedelirantních CAM negativních bylo 86 pacientů. Z 39 delirantních pacientů bylo 29 mužů, což činí 74,4 %. Hyperaktivním typem deliria trpělo 15 CAM+ pacientů, 14 deliriem smíšeným, u 10 pacientů se rozvinulo hypoaktivní delirium.
Z rizikových faktorů byly statisticky významné (p value ≤ 0,05; tab. 2): tíha onemocnění (APACHE II skóre s mediánem 21 u CAM+ pacientů, 9 u CAM – pacientů), délka pobytu na JIP (medián 12 dnů u CAM+ oproti 2 dnům u CAM – pacientů), potřeba UPV (ventilovaných bylo 45 CAM hodnotitelných pacientů, z 39 delirantních CAM+ bylo uměle plicně ventilováno 32 pacientů, tedy 82 % z AM+ a z nedelirantních bylo ventilováno pouhých 15 %, tj. 13 pacientů z 86 CAM – pacientů), užití analgosedace (analgosedace byla užita u 32 pacientů z 39 delirantních, tj. u 82 % z CAM+, a jen u sedmi nedelirantních, tj. u 8 % z CAM–), vazopresorů (byly podávány u 39 pacientů, z toho delirantních pacientů potřebovalo vazopresory 30, tj. 77 % z CAM+, ve srovnání s jejich podporou u pouhých devíti nedelirantních pacientů, tj. 10 % z CAM–) a typ příjmu (s vyšším rizikem rozvoje deliria u interních a traumatických pacientů ve srovnání s pacienty chirurickými). Všechny tyto rizikové faktory jsou vysoce signifikantní (p value < 0,001) a jde o precipitující rizikové faktory vztahující se k akutnímu onemocnění. Statisticky méně významným rizikovým faktorem pro rozvoj deliria je anamnéza užívání alkoholu s p value = 0,069. Zdůrazňujeme, že jde jen o anamnestické údaje. CNS dysfunkce překvapivě dosáhla po adjustaci p value = 0,649, tedy výsledek naprosto nevýznamný. Do této kategorie jsme v naší studii řadili kromě pacientů s preexistující demencí i pacienty se sluchovým a zrakovým postižením, depresivními poruchami, stp. centrálních mozkových příhodách (CMP), kardiopulmonálních resuscitacích, kraniotraumatech. Malignita s p value 0,13 také neprokázala riziko rozvoje deliria, maligních pacientů bylo 10 ze skupiny 39 delirantních pacientů (26 %), ve skupině 86 nedelirantních pacientů bylo pacientů s malignitou 42 (49 %).
Rovněž jsme sledovali úmrtí ve všech skupinách kriticky nemocných. V našem souboru exitovali pouze delirantní pacienti (zemřelo 11 z 39 delirantních, tj. 28 % z CAM+) a nevyšetřitelní pacienti (zemřelo 13 ze 17 nehodnotitelných pacientů, tj. 75,5 % z CAM0).
Kroková logistická regrese řízená AIC kritériem vybrala do modelu vysvětlujícího rozdíl mezi delirantními (CAM+) a nedelirantními (CAM–) pacienty jako významný rizikový faktor: dny na JIP, analgosedaci (p value < 0,05). Další rizikové faktory, ačkoliv těsně nevýznamné, jsou věk 65+ (p value = 0,058), APACHE II (p value = 0,068) a kouření (p value = 0,089). Rozborem rizikových faktorů směrem k nevyšetřitelnosti pacientů, setrvávajícímu kómatu jsme zjistili jako statisticky významné s p value ≤ 0,05: vazopresory (ve skupině CAM0 jejich užití bylo u 94 %, kdežto jen u 31 % ve vyšetřitelné skupině), UPV (u 94 % pacientů nevyšetřitelných proti 36 % vyšetřitelných pacientů), analgosedace (užitá u 76 % CAM0, oproti 31 % ve vyšetřitelné skupině). Zde se jako statisticky významný faktor pro setrvávající poruchu vědomí a tedy nevyšetřitelnost pacientů projevila CNS dysfunkce s p value 0,034. Malignita s p value 0,028 je také statisticky významný faktor, paradoxně s vyšším zastoupením u vyšetřitelné skupiny (42 %, 52 pacientů), kdežto ze 17 nevyšetřitelných pacientů trpěl maligním onemocněním jen jeden pacient (6 %) (tab. 2, 3).
Tab. 3. Charakteristika logistického regresního modelu vysvětlujícího rizikové faktory deliria (CAM+ vs. CAM–). 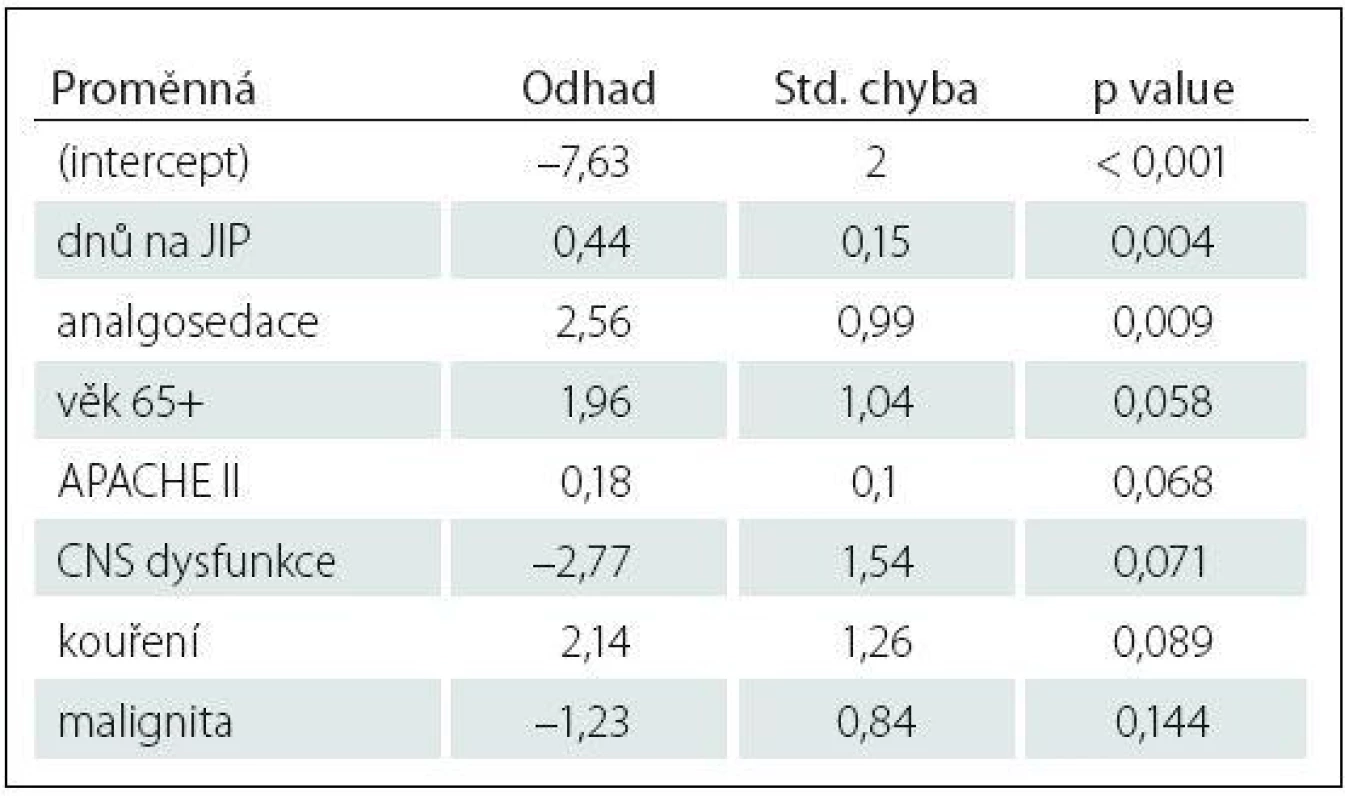
Std. – směrodatná odchylka. Logistická regrese vysvětlující rozdíl mezi vyšetřitelnými (CAM+ nebo CAM–) a nevyšetřitelnými (CAM0) pacienty vybrala jako statisticky významný parametr pouze APACHE II s p value 0,003 (tab. 4).
Tab. 4. Charakteristika logistického regresního modelu vysvětlujícího vyšetřitelnost deliria (CAM± vs. CAM0). 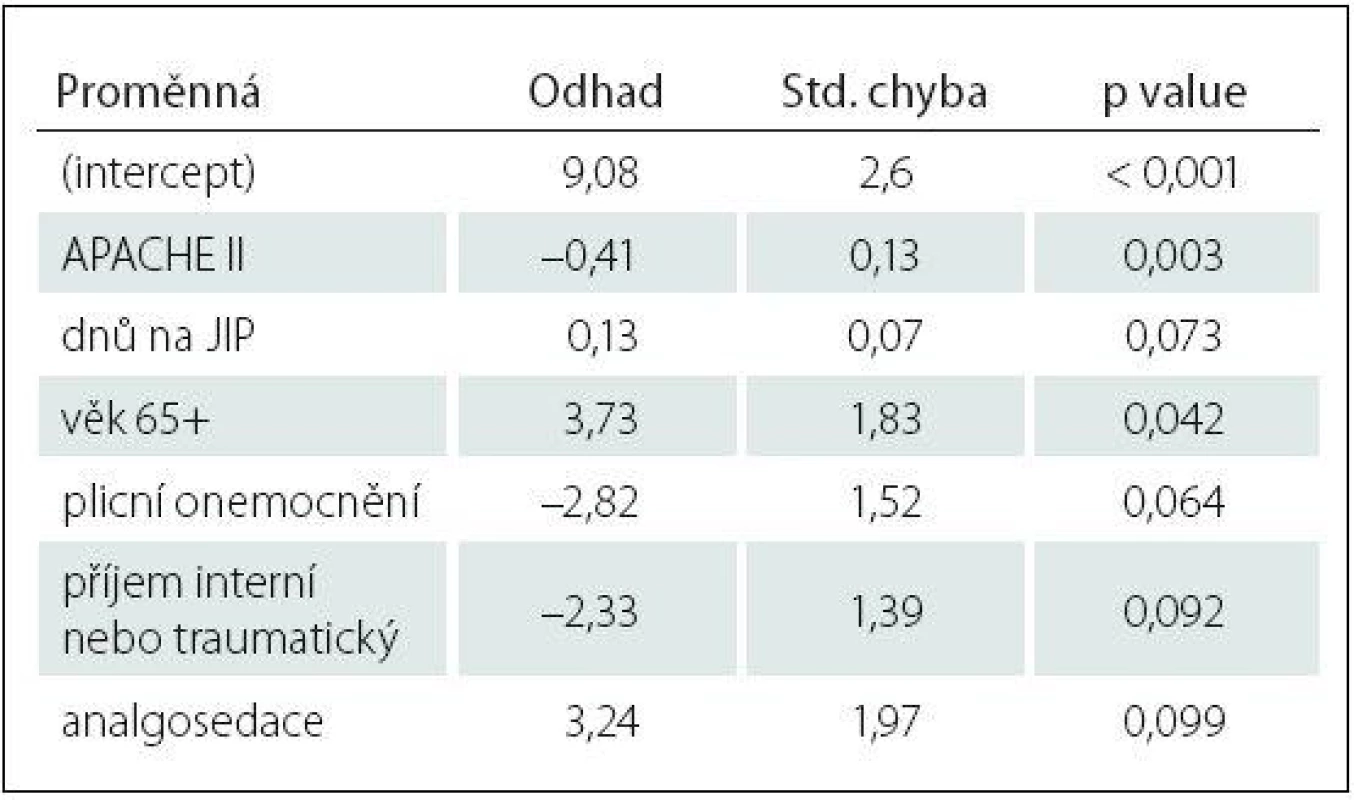
Std. – směrodatná odchylka. Diskuze
Incidence delirií na multidisciplinární JIP 31,2 % je incidence výrazně nižší, než uvádějí mnohé práce [2 – 4]. Vysvětlením může být profil vyšetřitelných pacientů, kdy v daném období převažovali pacienti chirurgičtí (78,4 %), u nichž k rozvoji deliria došlo v pouhých 20 % případů. Výrazně vyšší incidence delirií bývá popisována u interních pacientů a i v našem souboru, ve kterém interní pacienti tvořili jen 7,2 % vyšetřitelných pacientů, bylo CAM+ 70 % [12]. Dalším faktorem, který také mohl ovlivnit incidenci delirií v našem souboru pacientů, je důraz na multikomponentní preventivní strategii [16]. V přístupu k našim pacientům se snažíme o jejich časnou reorientaci, kognitivní stimulaci, brzkou mobilizaci. Tyto postupy jsou ekonomicky (personálně) náročné, ale existuje několik studií, které prokazují pozitivní vliv dostatku personálu na průběh hospitalizace na JIP [16 – 20]. Samozřejmostí je adekvátní hydratace, analgetizace (s preferencí epidurální analgezie, zvláště u chirurgických pacientů, kde to operovaná oblast dovolí). Využití regionálních anesteziologických technik, bez použití celkových anestetik navíc s analgetickou složkou bez nutnosti intravenózního podání opioidů, může mít rovněž podíl na nízké incidenci deliria u chirurgických pacientů. Naše studie na tuto oblast ovšem nebyla zaměřena. Incidence delirií může být u některých prací využívajících k diagnostice test CAM‑ICU nadhodnocena [17,29], neboť sedace může ovlivnit výkon ve všech krocích tohoto testu. Zvláště znak 3, RASS jiné než 0, a tedy pozitivita testu v tomto bodě může být způsobena sedací. A jistá míra analgosedace (u stabilních pacientů nejčastěji ordinována k RASS 2 – 4) k toleranci intervencí, orotracheální kanyly, UPV a k vyloučení bolesti, sympatikotonie je u velké většiny našich pacientů nutná. Proto je důležité aplikovat analgosedaci k určitému cíli s užitím sedativní škály zabraňující oversedaci pacientů a samozřejmě pečlivé a opakované vyšetřování kognitivních funkcí.
Z rizikových faktorů se překvapivě věk 65+ u kriticky nemocných neprojevil jako rizikový faktor rozvoje deliria, na rozdíl od populace starších pacientů interních a chirurgických oddělení [31]. Nicméně stejně věk jako rizikový faktor rozvoje deliria u kriticky nemocných neprokázaly další práce, kde i incidence delirií je obdobná našemu souboru pacientů a činí kolem 30 % [12,17]. Obě tyto studie zhodnotily přes 1 300 kriticky nemocných a podobně prokázaly jako rizikový faktor rozvoje deliria závažnost stavu (APACHE II), užití analgosedace, ale i alkohol. Ten v našem případě nevyšel statisticky významně (p value 0,08), stejně i kouření (p value 1,0). U obou modalit šlo pouze o anamnestická data.
CNS dysfunkce překvapivě dosáhla výsledek naprosto statisticky nevýznamný (p value 0,649). To může být dáno souborem pacientů, když do této kategorie neřadíme jen pacienty s preexistující demencí, ale pro malý počet anamnesticky uvedených demencí pro možnost statistického zhodnocení sem řadíme i pacienty po kraniotraumatech, CMP, po resuscitacích a se sluchovým a zrakovým postižením. Z organizačních důvodů a vzhledem ke stavu vědomí nelze u všech kriticky nemocných přijímaných na JIP provést test demence MMSE (Mini‑Mental State Examination). Ve vztahu k nevyšetřitelnosti CAM‑ICU testem, CNS dysfunkce přispívá k protrahované poruše vědomí (p value 0,034).
Zvláštní je spíše ochranný vliv malignity na rozvoj delirantního stavu (26 % z CAM+ trpělo maligním onemocněním ve srovnání s 49 % CAM–). Podobný korelát vlivu malignity na rozvoj deliria jsme zatím v jiných studiích nenalezli. V našem souboru pacientů jde o chirurgicky řešená maligní onemocnění bez stratifikace dle stagingu.
Souvislost mezi dny pobytu na JIP, potřebou analgosedace, vazopresorů a UPV ukazuje na závažný medicínský i ekonomický dopad rozvoje deliria na prodloužení pobytu na JIP. Navíc je rozvoj deliria jakýmsi „kanárkem“ (rizikovým markerem) zhoršení stavu a možného úmrtí, kdy v našem souboru došlo k úmrtí pouze ve skupině delirantních a nevyšetřitelných pacientů.
Závěr
Delirium značně zhoršuje prognózu, prodlužuje a zvyšuje náklady na hospitalizaci, vede k četnějším reintubacím, 2,5× zvyšuje mortalitu krátkodobou a 3,2× zvyšuje mortalitu šestiměsíční, představuje riziko dlouhodobé kognitivní poruchy. Přesto až třetině případů lze předejít vhodnou prevencí. V naší práci jsme rozebrali rizikové faktory. Některé z nich, zvláště ty precipitující spojené s akutním onemocněním, umožňují včasnou prevenci. A právě tímto směrem, s důrazem na prevenci, se ubírá současný přístup k deliriím.
Postup dle ABCDE balíčku zahrnuje snahu o co nejkratší sedaci, snahu o spontánní ventilaci. Je‑li třeba sedativní medikace k lepší toleranci různých diagnostických a terapeutických postupů, snažíme se omezit spotřebu benzodiazepinů. Diagnostika deliria a jeho včasné rozpoznání umožní terapii v první řadě s postupy nefarmakologickými, zahrnující opakovanou reorientaci pacientů, vrácení naslouchadel, brýlí, slovní uklidňování. Samozřejmostí je dostatečná hydratace, nutriční podpora, úprava vnitřního prostředí. U všech pacientů se snažíme o včasnou mobilizaci a rehabilitaci. V samotné terapii se užívá druhá generace antipsychotik a α ‑ 2 agonisté. Delirium je velký problém a současně velká výzva pro intenzivisty.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 8. 6. 2015
Přijato do tisku: 14. 10. 2015
MUDr. Marcela Káňová
Klinika anesteziologie, resuscitace a intenzivní medicíny
LF OU v Ostravě
17. listopadu 1790
708 52 Ostrava
e-mail: marcela.kanova@fno.cz
Zdroje
1. American Psychiatric Association. Diagnostic and statistical manual of mental disorders. 4th ed., text revision. Washington, DC: American Psychiatric Association 2000.
2. Girard TD, Pandharipande PP, Ely EW. Delirium in the intensive care unit. Crit Care 2008; 12 (Suppl 3): S3. doi: 10.1186/ cc6149.
3.Cavallazzi R, Saad M, Marik PE. Delirium in the ICU:an overview. Ann Intensive Care 2012; 2(1): 49. doi: 10.1186/ 2110 ‑ 5820 ‑ 2 ‑ 49.
4. Pun BT, Ely EW. The importance of diagnosing and managing ICU delirium. Chest 2007; 132(2): 624 – 636.
5. Shehabi Y, Riker R, Bokesch PM, Wisemandle W, Shintani A, Ely EW. Delirium duration and mortality in lightly sedated, mechanically ventilated intensive care patients. Crit Care Med 2010; 38(12): 2311 – 2318. doi: 10.1097/ CCM.0b013e3181f85759.
6. Ely EW, Gautam S, Margolin R, Francis J, May L, Speroff T et al. The impact of delirium in the intensive care unit on hospital length of stay. Intensive Care Med 2001; 27(12): 1892 – 1900.
7. Ely EW, Shintani A, Truman B, Speroff T, Gordon SM, Harrell FE et al. Delirium as a predictor of mortality in mechanically ventilated patients in the intensive care unit. JAMA 2004; 291(14): 1753 – 1762.
8. Girard TD, Jackson JC, Pandharipande PP, Pun BT, Thompson JL, Shintani AK et al. Delirium as a predictor of long‑term cognitive impairment in survivors of critical illness. Crit Care Med 2010; 38(7): 1513 – 1520. doi: 10.1097/ CCM.0b013e3181e47be1.
9. Meagher DJ, Trzepacz PT. Motoric subtypes of delirium. Semin Clin Neuropsychiatry 2000; 5(2): 75 – 85.
10. Meagher DJ, Moran M, Raju B, Leonard M, Donnelly S, Saunders J et al. A new data‑based motor subtypes schema for delirium. J Neuropsychiatry Clin Neurosci 2008; 20(2): 185 – 193. doi: 10.1176/ appi.neuropsych.20.2.185.
11. Peterson JF, Pun BT, Dittus RS, Thomason JW, Jackson JC, Shintani AK et al. Delirium and its motoric subtypes: a study of 614 critically ill patients. J Am Geriatr Soc 2006; 54(3): 479 – 484.
12. Van Rompaey B, Elseviers M, Schuurmans MJ, Shortridge ‑ Baggett LM, Truijen S, Bossaert L. Risk factors for delirium in intensive care patients: a prospective cohort study. Crit Care 2009; 13(3): R77. doi: 10.1186/ cc7892.
13. Cerejeira J, Firmino H, Vaz ‑ Serra A, Mukaetova ‑ Ladinska EB. The neuroinflammatory hypothesis of delirium. Acta Neuropathol 2010; 119(6): 737 – 754. doi: 10.1007/ s00401 ‑ 010 ‑ 0674 ‑ 1.
14. Cerejeira J, Nogueira V, Luis P, Vaz ‑ Serra A, Mukaetova ‑ Ladinska EB. The cholinergic system and inflammation: common pathways in delirium pathophysiology. J Am Geriatr Soc 2012; 60(4): 669 – 675. doi: 10.1111/ j.1532 ‑ 5415.2011.03883.x.
15. Pustavoitau A, Stevens RD. Mechanisms of neurologic failure in critical illness. Crit Care Clin 2008; 24(1): 1 – 24. doi: 10.1016/ j.ccc.2007.11.004.
16. Inouye SK, Bogardus ST, Charpentier PA, Leo ‑ Summers L, Acampora D, Holford TR et al. A multicomponent intervention to prevent delirium in hospitalized older patients. N Engl J Med 1999; 340(9): 669 – 676.
17. Ouimet S, Kavanagh BP, Gottfried SB, Skrobik Y. Incidence, risk factors and consequences of ICU delirium. Intensive Care Med 2007; 33(1): 66 – 73.
18. Morandi A, Brummel NE, Ely EW. Sedation, delirium and mechanical ventilation: the „ABCDE“ approach. Curr Opin Crit Care 2011; 17(1): 43 – 49. doi: 10.1097/ MCC.0b013e3283427243.
19. Kress JP, Pohlman AS, O’Connor MF, Hall JB. Daily interruption of sedative infusions in critically ill patients undergoing mechanical ventilation. N Engl J Med 2000; 342(20): 1471 – 1477.
20. Girard TD, Kress JP, Fuchs BD, Thomason JW, Schweickert WD, Pun BT et al. Efficacy and safety of a paired sedation and ventilator weaning protocol for mechanically ventilated patients in intensive care (Awakening and Breathing Controlled trial): a randomized controlled trial. Lancet 2008; 371(9607): 126 – 134. doi: 10.1016/ S0140 ‑ 6736(08)60105 ‑ 1.
21. Pandharipande PP, Sanders RD, Girard TD, McGrane S, Thompson JL, Shintani AK et al. Effect of dexmedetomidine versus lorazepam on outcome in patients with sepsis: an a priori ‑ designed analysis of the MENDS randomized controlled trial. Crit Care 2010; 14(2): R38. doi: 10.1186/ cc8916.
22. Mitášová A, Bednařík J, Košťálová M, Michalčáková R, Ježková M, Kašpárek T et al. Standardizace české verze The Confusion Assessment Method for the Intensive Care Unit (CAM-ICU.cz). Cesk Slov Neurol N 2010; 73/ 106(3): 258 – 266.
23. Girard TD, Pandharipande PP, Carson SS, Schmidt GA, Wright PE, Canonico AE et al. Feasibility, efficacy, and safety of antipsychotics for intensive care unit delirium: the MIND randomized, placebo ‑ controlled trial. Crit Care Med 2010; 38(2): 428 – 437.
24. Devlin JW, Roberts RJ, Fong JJ, Skrobik Y, Riker R, Hill NS et al. Efficacy and safety of quetiapine in critically ill patients with delirium: a prospective, multicenter, randomized, double ‑ blind, placebo ‑ controlled pilot study. Crit Care Med 2010; 38(2): 419 – 427. doi: 10.1097/ CCM.0b013e3181b9e302.
25. Van Eijk MM, Roes KC, Honing ML, Kuiper MA, Karakus A, van der Jagt M et al. Effect of rivastigmine as an adjunct to usual care with haloperidol on duration of delirium and mortality in critically ill patients: a multicentre, double‑blind, placebo ‑ controlled, randomized trial. Lancet 2010; 376(9755): 1829 – 1837. doi: 10.1016/ S0140 ‑ 6736(10)61855 ‑ 7.
26. Skrobik YK, Bergeron N, Dumont M, Gottfried SB. Olanzapine vs. haloperidol: treating delirium in a critical care setting. Intensive Care Med 2004; 30(3): 444 – 449.
27. Bathula M, Gonzales JP. The pharmacologic treatment of intensive care unit delirium: a systematic review. Ann Pharmacother 2013; 47(9): 1168 – 1174. doi: 10.1177/ 1060028013500466.
28. Devlin JW, Fong JJ, Fraser GL, Riker R. Delirium assess-ment in the critically ill. Intensive Care Med 2007; 33(6): 929 – 940.
29. Haenggi M, Blum S, Brechbuehl R, Brunello A, Jakob SM, Takala J. Effect of sedation level on the prevalence of delirium when assessed with CAM‑ICU and ICDSC. Intensive Care Med 2013; 39(12): 2171 – 2179. doi: 10.1007/ s00134 ‑ 013 ‑ 3034 ‑ 5.
30. Holm S. A simple sequentially rejective multiple test procedure. Scand J Statist 1979; 6(2): 65 – 70.
31. Schor JD, Levkoff SE, Lipsitz LA, Reilly CH, Cleary PD, Rowe JW et al. Risk factors for delirium in hospitalized elderly. JAMA 1992; 267(6): 827 – 831.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2015 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Nádory očnice
- Překrývání neurodegenerativních demencí
- Současný pohled na imunopatogenezi myasthenia gravis
- Roztroušená skleróza, neplodnost a její léčba
- Delirium u kriticky nemocných – prospektivní studie
- Poruchy srdečního rytmu u mladých pacientů s kryptogenní ischemickou cévní mozkovou příhodou
- Mobilita medianu před dekompresí karpálního tunelu a po ní
- Měření úrovně emočního uvědomění – pilotní studie ověřující základní psychometrické vlastnosti české verze Škály úrovně emočního uvědomění LEAS
-
Komentář k článku autorů Světlák et al.
Měření úrovně emočního uvědomění – pilotní studie ověřující základní psychometrické vlastnosti české verze Škály úrovně emočního uvědomění LEAS - Psychometrické vlastnosti české verze Epworthské škály spavosti
- Naše zkušenosti s chirurgickou léčbou tumorů periferních nervů
-
Komentář k článku autorů Sova et al.
Naše zkušenosti s chirurgickou léčbou tumorů periferních nervů - Kraniocervikální pneumatizace provázená neurologickou symptomatikou – kazuistika
- Časná rotace intratékální baklofenové pumpy – kazuistika
- Familiární amyloidová polyneuropatie – kazuistika
-
Komentář k článku autorů Pika et al.
Familiární amyloidová polyneuropatie – kazuistika - Webové okénko
-
Analýza dat v neurologii
LIV. Koncept atributivního rizika v analýze populačních studií – I. Aplikace v různých typech studií -
Péče o pacienty s dysfagií po cévní mozkové příhodě
Standard léčebného plánu - Novinky ze světa NOAK – „Dienerovo pravidlo 1- 3- 6- 12“ a první antidotum s potvrzeným účinkem
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nádory očnice
-
Péče o pacienty s dysfagií po cévní mozkové příhodě
Standard léčebného plánu - Novinky ze světa NOAK – „Dienerovo pravidlo 1- 3- 6- 12“ a první antidotum s potvrzeným účinkem
- Psychometrické vlastnosti české verze Epworthské škály spavosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




