-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Snížená denzita kostního minerálu u žen s roztroušenou sklerózou
Reduced Bone Mineral Density in Women with Multiple Sclerosis
Aim:
The aim of this study was to compare the bone mineral density (BMD) and muscle mass in women with multiple sclerosis (MS) in an outpatient setting and control subjects, and to examine the effect of motor disability, muscle mass and/or glucocorticoids (GC) use on BMD.Methods:
Body composition and BMD were measured by dual-energy X-ray absorptiometry in 250 MS women (153 premenopausal and 97 postmenopausal women) with EDSS (Expanded Disability Status Scale) ≤ 6.5 treated in an outpatient setting and in 193 controls.Results:
Compared to controls, patients had significantly lower values for total body bone mineral content and BMD at all measured sites except for the distal radius. Patients with MS had significantly lower amount of total muscle mass as well as total leg muscle mass when compared to the control group. The EDSS score was negatively associated with BMD at the proximal femur in both premenopausal and postmenopausal women, while the deficit of total body muscle mass was significantly associated with a loss of BMD at the lumbar spine and whole body BMD in premenopausal women only. GC treatment was negatively associated with BMD at the lumbar spine in premenopausal women.Conclusion:
The total body muscle mass was an important predictive factor for the total body BMD and the lumbar spine BMD in premenopausal women with MS. Further prospective studies are required to verify the protective effect of muscle mass on BMD in patients with MS and to assess the role of systemic factors modulating the bone-muscle relationship (e.g. vitamin D or estrogen deficiency).Key words:
body composition – bone mineral density – multiple sclerosis – glucocorticoids
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: M. Týblová 1; doc. MUDr. Vít Zikán, Ph.D. 2; M. Luchavová 2; E. Havrdová 1; I. Raška Jr 2; D. Michalská 2; A. A. Kuběna 3
Působiště autorů: Neurologická klinika 1. LF UK a VFN v Praze 1; III. interní klinika 1. LF UK a VFN v Praze 2; Katedra sociální a klinické farmacie, Farmaceutická fakulta UK v Hradci Králové 3
Vyšlo v časopise: Cesk Slov Neurol N 2013; 76/109(1): 35-44
Kategorie: Původní práce
Souhrn
Cíl:
Cílem studie bylo porovnat kostní denzitu (BMD) a svalovou hmotu mezi ženami s roztroušenou sklerózou (RS) a kontrolní skupinou a posoudit vliv motorického postižení, svalové hmoty a/nebo léčby glukokortikoidy (GK) na BMD.Metody:
Měření kostní a svalové hmoty bylo provedeno pomocí dvouenergiové rentgenové absorpciometrie u 250 pacientek s RS (153 žen před menopauzou a 97 po menopauze) s EDSS (Expanded Disability Status Scale) ≤ 6,5 a u 193 zdravých kontrol.Výsledky:
Ve srovnání s kontrolní skupinou měly pacientky významně nižší celotělový obsah kostního minerálu a BMD ve všech měřených oblastech skeletu s výjimkou distální 1/3 radia. Osteopenie byla zjištěna u 59,3 % a osteoporóza u 8,8 % žen před menopauzou. U pacientek jsme zjistili signifikantně nižší množství svalové hmoty (celotělově i v oblasti dolních končetin) ve srovnání s kontrolní skupinou. EDSS skóre bylo spojeno s úbytkem BMD v proximálním femuru u pacientek před menopauzou i po menopauze, zatímco deficit celotělové svalové hmoty významně asocioval s úbytkem BMD v bederní páteři i celotělově pouze u premenopauzálních žen. Rovněž léčba GK predikovala pokles BMD v bederní páteři u žen před menopauzou.Závěr:
U premenopauzálních žen s RS je celotělová svalová hmota významným predikčním faktorem BMD osového skeletu i celotělové BMD. Ověření protektivního vlivu svalové hmoty na BMD a objasnění významu systémových faktorů (např. nedostatku vitaminu D nebo estrogenů), které modulují vztah mezi kostní a svalovou tkání, vyžaduje další prospektivní studie.Klíčová slova:
tělesné složení – kostní denzita – roztroušená skleróza – glukokortikoidyÚvod
Roztroušená skleróza (RS) je chronické zánětlivé onemocnění centrálního nervového systému (CNS), v jehož patogenezi se uplatňuje jak autoimunitní zánět vedoucí k demyelinizaci, tak neurodegenerace. Vznikají rozmanité klinické příznaky, např. porucha zraku, rovnováhy a sfinkterů, kognitivní deficit, poruchy čití a hybnosti s postupným rozvojem poruchy chůze a imobilizace [1]. Omezená schopnost pohybu vede ke ztrátě svalové síly a hmoty, snižuje mechanické zatížení skeletu a navozuje nerovnováhu v kostní remodelaci s následným rozvojem osteoporózy a zlomenin [2]. Osteoporóza se vyskytuje u pacientů s RS častěji než ve zdravé populaci [3–9]. Progredující porucha hybnosti je pravděpodobně hlavní faktor ovlivňující denzitu kostního minerálu (BMD) a riziko fraktur u pacientů s RS [10,11]. K vyšší prevalenci zlomenin u pacientů s RS přispívá i zvýšené riziko pádů v důsledku poruchy rovnováhy a ztráty svalové síly [12–14]. Pro hodnocení motorického deficitu, zejména schopnosti chůze, se u pacientů s RS standardně užívá Kurtzkeho rozšířená stupnice stavu disability (EDSS, Expanded Disability Status Scale) [15]. Bylo zjištěno, že EDSS negativně koreluje s BMD, zejména v oblasti proximálního femuru [6,8,16–19]. Kromě motorického deficitu a snížení denní fyzické aktivity může k úbytku BMD přispívat i nedostatek vitaminu D [20], dlouhodobá léčba glukokortikoidy (GK) [17,21], deficit estrogenů [22] a další faktory [23]. Fyzická inaktivita a dlouhodobá léčba GK může ovlivňovat i tělesné složení, zvláště svaly, a tak dále přispívat k úbytku kostní hmoty. Studie, které hodnotily tělesné složení u pacientů s RS ve srovnání se zdravými osobami, dokumentovaly významnou asociaci mezi beztukovou (svalovou) tělesnou hmotou a BMD u imobilních pacientů s výrazným motorickým deficitem (EDSS ≥ 7,0), ale nikoli u chodících nemocných s lehčím motorickým postižením [21,24–26]. Vliv svalové hmoty na skelet zatím nebyl u pacientů s RS dostatečně objasněn a chybí studie, které by hodnotily vliv menopauzy a/nebo dlouhodobé léčby GK na kostní a svalovou tkáň u žen s RS. Cílem práce bylo porovnat kostní a svalovou hmotu mezi ženami s RS a zdravými kontrolami a objasnit vzájemné vztahy mezi BMD, svalovou hmotou, podávanými GK a motorickým postižením u žen s RS před menopauzou a po ní.
Metodika
Do studie bylo zařazeno celkem 250 pacientek s RS (153 premenopauzálních a 97 postmenopauzálních) s EDSS skóre ≤ 6,5 a 193 kontrolních zdravých žen (131 premenopauzálních a 62 postmenopauzálních). Pacientky byly vybrány z databáze Centra pro léčbu roztroušené sklerózy Všeobecné fakultní nemocnice (VFN) v Praze. Kontrolní skupina žen byla vybrána z preventivních programů v Osteocentru VFN v Praze. Od všech osob zařazených do studie byla získána anamnéza zaměřená na rizikové faktory osteoporózy a zlomenin. Obě skupiny byly indoevropského původu. Popisné charakteristiky pacientek s RS a zdravých kontrol jsou uvedeny v tab. 1.
Tab. 1. Základní charakteristika souboru pacientek s roztroušenou sklerózou (RS) a kontrolní skupiny zdravých žen. 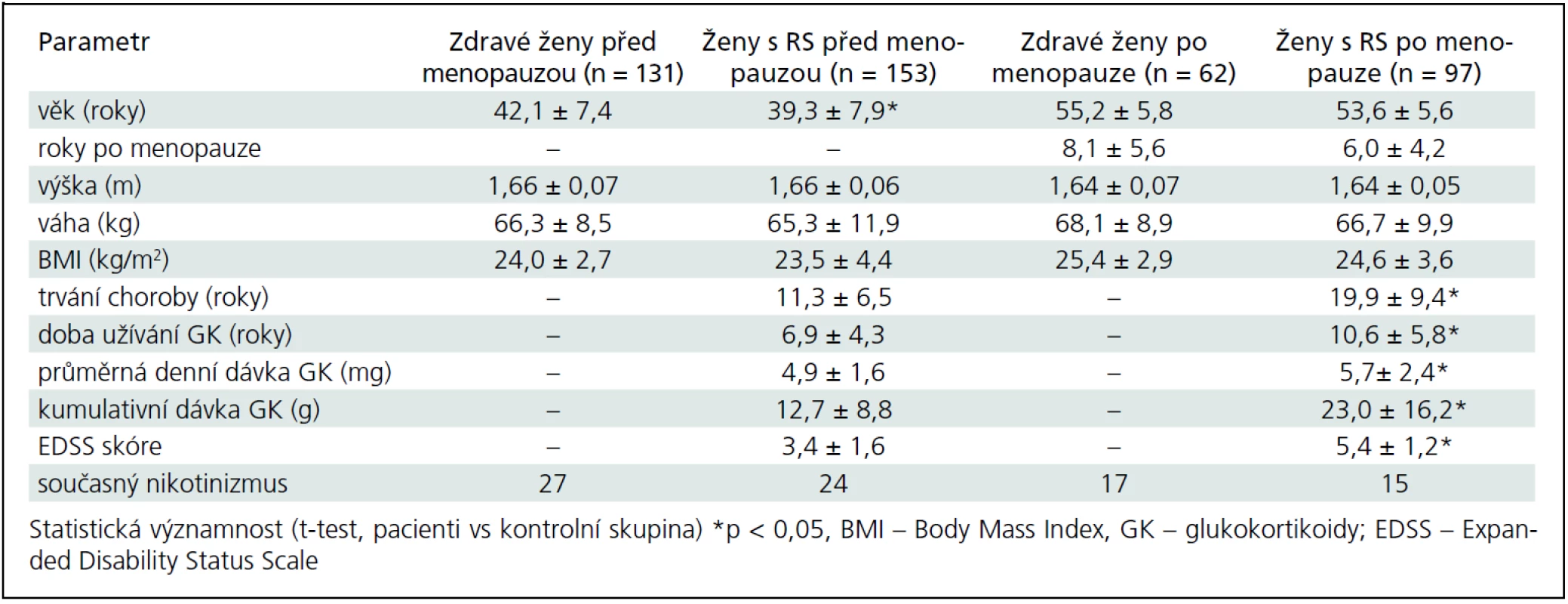
Klinické vyšetření
Pacientky byly neurologicky vyšetřeny a tento objektivní nález byl hodnocen Kurtzkeho EDSS. Do studie byly zařazeny ženy se zachovalou schopností chůze, jejich EDSS skóre tedy bylo ≤ 6,5 (průměr 4,4 ± 1,8). U EDSS ≤ 3,5 není omezení v chůzi a hodnocen je hlavně neurologický deficit, EDSS od 4 do 5,5 je definováno jako chůze bez asistence, ale s limitací vzdálenosti na 100–500 m, přičemž EDSS 4 je omezení na vzdálenost 500 m a maximální délka chůze u EDSS 5,5 je 100 m. Pacienti s hodnotami EDSS 6,0 a 6,5 potřebují oporu jednostrannou (při EDSS 6,0 a délka chůze je alespoň 100 m) nebo bilaterální (při EDSS 6,5 a délka chůze je alespoň 20 m). Nemocné s EDSS ≥ 7, které nejsou schopny samostatné chůze, nebyly do studie zařazeny. Všechny pacientky byly dlouhodobě léčeny nízkou perorální (p.o.) dávkou GK. U všech pacientek byla navíc podávána pulzní léčba GK v suprafyziologických dávkách v případě akutní exacerbace onemocnění (intravenózně 1 g metylprednizolonu denně po dobu 3–5 dnů, případně s navazující p.o. léčbou vyššími dávkami GK v sestupné dávce po dobu 3–4 týdnů v závislosti na závažnosti exacerbace). Vylučovacím kritériem pro pacientky i kontrolní skupinu žen bylo jiné chronické onemocnění než RS s vlivem na kostní metabolizmus nebo již dříve zjištěná osteoporóza a užívání léků ovlivňujících kostní metabolizmus (s výjimkou GK u pacientek s RS a substituční dávky cholekalciferolu do 2 000 IU denně), jako jsou aminobisfosfonáty, raloxifen, stroncium ranelát, deriváty parathormonu, fluorid nebo tiazidová diuretika. Pacientky nebo kontrolní osoby s nikotinizmem či s pozitivní rodinnou anamnézou z hlediska výskytu osteoporózy v 1. linii příbuzných nebyly ze studie vyřazeny. Zařazení do studie bylo podmíněno podepsáním informovaného souhlasu. Studie byla schválena etickou komisí VFN v Praze a je v souladu s právními předpisy a etickými zásadami pro lékařský výzkum za účasti lidských subjektů podle Světové lékařské asociace (Helsinské deklarace).
Antropometrické měření
Tělesná výška byla získána pomocí stadiometru. Tělesná hmotnost byla měřena pomocí kalibrované digitální váhy bez bot a v lehkém spodním oblečení.
Kostní denzitometrie
Denzita kostního minerálu (BMD, Bone Mineral Density) byla měřena celotělově a v oblasti bederní páteře (L1–L4), celkového proximálního femuru, krčku femuru a v distální 1/3 radia pomocí dvouenergiové rentgenové absorpciometrie (DXA; denzitometr QDR 4500, Hologic Inc, Waltham, MA, USA, software v. APEX 3,0). Pacientky i kontrolní skupina byly měřeny na stejném denzitometru. Krátkodobá přesnost měření in vivo bederní páteře (L1–L4), celkového proximálního femuru, krčku femuru, celotělové BMD a distální 1/3 radia byla 0,7 %, 0,9 %, 1,9 %, 1,2 % a 2,1 %. Dlouhodobá přesnost měření in vitro byla 0,32 %. Celotělový obsah kostního minerálu (BMC, Bone Mineral Content) a další parametry tělesného složení byly odečteny z celotělového měření. Variační koeficienty tukové a svalové hmoty byly 1,9 % a 2,6 %. Referenční databáze NHANES III byla užita pro výpočet T skóre [27]. Podle kritérií stanovených Světovou zdravotnickou organizací byla diagnostikována osteopenie v případě, že BMD bederní páteře anebo proximálního femuru (celkový proximální femur nebo krček femuru) byla snížena v rozmezí mezi –1 až –2,5 směrodatné odchylky (–2,5 > T skóre < –1,0) proti průměru u mladé zdravé populace. Osteoporóza byla diagnostikována v případě snížení BMD alespoň o 2,5 směrodatné odchylky (T skóre ≤ –2,5) proti průměru u mladé zdravé populace. Databáze NHANES III byla užita také k výpočtu Z skóre celkového proximálního femuru. Například, Z skóre –1 znamená, že hodnota BMD proximálního femuru je snížena o jednu směrodatnou odchylku proti průměru u stejně starých zdravých osob stejného pohlaví.
Laboratorní vyšetření
V podskupině pacientek s osteoporózou nebo s osteopenií a u části zdravých žen byly stanoveny koncentrace 25-hydroxyvitaminu D (25-OH vitaminu D) v séru pomocí automatického analyzátoru LIAISON® (25-OH Vitamin D Total assay, DiaSorin Inc., USA). Za normální koncentrace 25-OH vitamin D byly považovány hodnoty > 30 ng/ml. Koncentrace 25-OH vitamin D < 10 ng/ml byly hodnoceny jako těžký nedostatek vitaminu D a koncentrace mezi 10 a 30 ng/ml jako středně těžký nedostatek. Koncentrace intaktního parathormonu v plazmě (iPTH) a koncentrace biochemických ukazatelů kostní remodelace v séru – C terminálního telopeptidu kolagenu typu I (βCTX) a N terminálního propeptidu prokolagenu typu I (PINP) – byly stanoveny na automatickém analyzátoru pomocí imunoanalýzy založené na elektrochemiluminiscenci (analyzátor Cobas, Roche Diagnostics, Německo). Odběry byly provedeny vždy nalačno (mezi 7. a 10. hod ranní) a v letních měsících (červen až říjen).
Statistické zpracování dat
Případné rozdíly mezi pacienty a kontrolní skupinou v distribuci základních vstupních parametrů (věk, výška, hmotnost, BMI) jsme otestovali s pomocí Kolmogorov-Smirnov testu. Multivariační model (Multivariate GLM, General Linear Model) s bootstrap modifikací byl užit pro ověření vztahů mezi BMD, BMC a svalovou hmotou a dalšími sledovanými parametry. V modelu jsme nejprve u všech žen (pacientky i kontrolní skupina) zhodnotili vztahy mezi indexem tělesné hmotnosti (BMI) a množstvím beztukové (svalové) tělesné hmoty (jak celotělové, tak v oblasti obou dolních končetin) a sledovanými kostními parametry. Zvlášť jsme také hodnotili samotné neurologické parametry u pacientek s RS ve vztahu ke kostní hmotě (věk, EDSS skóre, doba trvání onemocnění, doba trvání léčby GK, denní dávka GK a celková kumulativní dávka GK). Do finálního modelu (Multivariate GLM s bootstrap modifikací) byly zahrnuty parametry, které byly signifikantní v předchozích modelech ve vztahu ke kostní hmotě. Pro odhad podílu vysvětlené variability byla užita GLM s vyhodnocením závislosti mezi sledovanými parametry podle Cohena (η2) [28]. Podle této konvence znamená práh η2 > 0,137 silný efekt, práh v rozmezí 0,137 > η2 > 0,0588 střední efekt a práh v rozmezí 0,0588 > η2 > 0,0099 slabý efekt. Veškeré analýzy byly provedeny pomocí programu PASW pro Windows, v. 18.0 (SPSS Inc, Chicago, IL, USA).
Autoři prohlašují, že studie na lidských subjektech popsaná v manuskriptu byla provedena v souladu s etickými standardy příslušné komise (institucionální a národní) odpovědné za provádění klinických studií a Helsinskou deklarací z roku 1975, revidovanou v r. 2000.
Výsledky
Základní charakteristiky pacientek a kontrolní skupiny u premenopauzálních a postmenopauzálních žen jsou uvedeny v tab. 1. Do studie jsme zařadili 250 pacientek (153 premenopauzálních a 97 postmenopauzálních žen) s EDDS skóre ≤ 6,5 a 193 zdravých kontrol (131 premenopauzálních a 62 postmenopauzálních žen). Ve srovnání s kontrolní skupinou byla skupina premenopauzálních pacientek mladší (o 2,8 roku), ale skupiny se významně nelišily ve výšce, hmotnosti nebo BMI (tab. 1). Sledované parametry tělesného složení, BMD a rozdíly mezi skupinami jsou uvedeny v tab. 2. Průměrné koncentrace sledovaných biochemických parametrů zachycuje tab. 3.
Tab. 2. Výsledky srovnání sledovaných parametrů kostní a svalové tkáně mezi nemocnými s roztroušenou sklerózou (RS) a kontrolní skupinou zdravých žen před menopauzou a po menopauze. 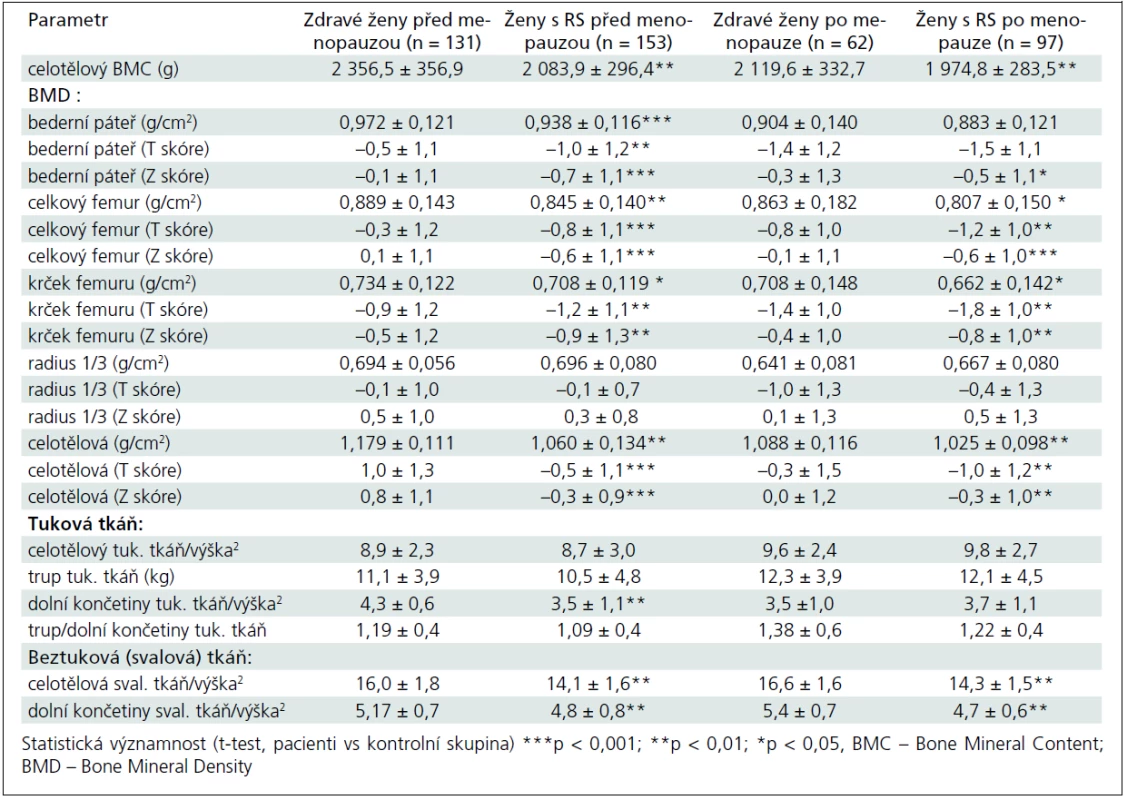
Tab. 3. Měřené biochemické parametry kostního metabolizmu u pacientek s roztroušenou sklerózou (RS) a u kontrolní skupiny zdravých žen. 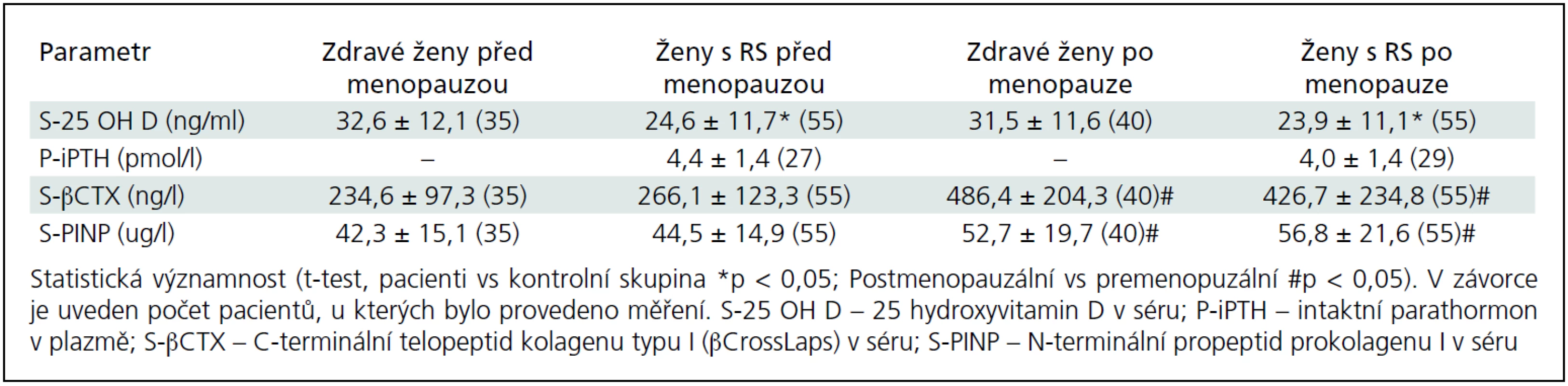
Celotělový obsah kostního minerálu a BMD
Celotělová kostní denzita (BMD vyjádřená v g/cm2 a pomocí T - a Z skóre) i celotělový obsah kostního minerálu (BMC v g) byly u pacientek s RS významně nižší ve srovnání s kontrolní skupinou žen (tab. 2). Ve srovnání s kontrolní skupinou jsme zjistili statisticky významně sníženou BMD v bederní páteři u premenopauzálních (p < 0,05), ale nikoliv u postmenopauzálních žen (při hodnocení absolutních hodnot BMD) (tab. 2). BMD v celkovém proximálním femuru byla snížena u premenopauzálních i postmenopauzálních žen (p < 0,05) a v krčku femuru jen u premenopauzálních žen (p < 0,05). Kostní denzita v oblasti 1/3 radia se statisticky významně nelišila od kontrolní skupiny ani u premenopauzálních, ani u postmenopauzálních žen (tab. 2). Při hodnocení BMD pacientek s RS podle T skóre v oblasti bederní páteře (L1–L4) a proximálního femuru byla zjištěna osteoporóza (T skóre ≤ –2,5) u 12 (8,8 %) premenopauzálních a u 28 (29,5 %) postmenopauzálních pacientek. Osteopenie (–2,5 < T skóre < –1) byla zjištěna u 80 (59,3%) premenopauzálních a u 54 (56,8%) postmenopauzálních pacientek. Srovnání obou skupin pacientek podle T skóre znázorňuje graf 1.
Graf 1. Procentuální zastoupení žen s RS (před menopauzou a po menopauze) splňujících kritéria Světové zdravotnické organizace (WHO) pro osteopenii (světlé sloupce) a pro osteoporózu (tmavé sloupce). 
Osteoporotické zlomeniny byly zjištěny u pěti premenopauzálních pacientek (dvě prodělaly zlomeninu obratlového těla, jedna zlomeninu humeru, jedna zlomeninu zápěstí a jedna opakované fraktury žeber) a u 14 postmenopauzálních pacientek (osm z nich prodělalo zlomeninu obratlového těla, dvě frakturu humeru, dvě zlomeninu zápěstí, jedna opakované zlomeniny žeber a jedna frakturu krčku femuru). U většiny pacientek s prodělanou osteoporotickou zlomeninou (devět postmenopauzálních a tři premenopauzální) byla BMD v pásmu osteoporózy, u pěti postmenopauzálních a dvou premenopauzálních pacientek byla zjištěna osteopenie.
Parametry tělesného složení (body composition)
Pacientky s RS měly ve srovnání s kontrolní skupinou významně snížené množství beztukové tělesné hmoty, a to jak celotělově (u premenopauzálních o 1,9 ± 0,2 kg/m2, p < 0,01; u postmenopauzálních o 2,3 ± 0,1 kg/m2, p < 0,01), tak v oblasti dolních končetin (u premenopauzálních o 0,37 ± 0,1 kg/m2, p < 0,01; u postmenopauzálních o 0,7 ± 0,1 kg/m2, p < 0,01) (tab. 2). U premenopauzálních žen jsme nezjistili významné rozdíly mezi RS a kontrolní skupinou v celkovém množství tukové tkáně vyjádřené v absolutních hodnotách (kg/m2) nebo jako poměr tuku v oblasti trupu a končetin (trup/dolní končetiny). Množství tukové tkáně v oblasti dolních končetin (kg/ m2) bylo ale nižší u premenopauzálních žen s RS (tab. 2).
Vzájemné vztahy mezi kostní tkání a tělesným složením
Při hodnocení (multivariate GLM s bootstrap modifikací) samotných parametrů tělesného složení spolu s BMI u pacientů i u kontrolní skupiny jsme zjistili významnou pozitivní asociaci mezi BMI a celotělovým BMC, celotělovou BMD a BMD v oblasti bederní páteře. U pacientek s RS jsme zjistili významnou pozitivní asociaci mezi celotělovým množstvím svalové hmoty a celotělovým BMC, celotělovou BMD a regionální BMD v bederní páteři a v celkovém proximálním femuru. U kontrolní skupiny byla zjištěna významná asociace mezi celotělovým množstvím svalové hmoty a BMD v bederní páteři. BMD v oblasti celkového proximálního femuru a také celotělový BMC na rozdíl od pacientů s RS pozitivně asociovaly se svalovou hmotou v oblasti dolních končetin. Hodnocení samotných neurologických parametrů u pacientek s RS ve vztahu ke kostní hmotě ukázalo významné negativní asociace mezi EDSS skóre a BMD ve všech měřených oblastech a celotělovým BMC u premenopauzálních žen, ale nikoliv u postmenopauzálních žen. U premenopauzálních žen jsme zjistili negativní asociaci mezi kumulativní dávkou GK a BMD v bederní páteři a v krčku femuru. U žen po menopauze celková doba léčby GK negativně asociovala s BMD v bederní páteři.
Do konečného modelu (multivariate GLM s bootstrap modifikací) u pacientek s RS bylo zahrnuto celkem sedm parametrů, které byly významné v jednotlivých regresních modelech ve vztahu ke kostní hmotě: věk, BMI, svalová hmota (celotělová a v oblasti dolních končetin), EDSS skóre, doba léčby GK a kumulativní dávka GK. BMI predikoval celotělovou BMD v celé skupině pacientek (p = 0,036; η2 = 0,053), ale nikoliv celotělový BMC nebo regionální BMD. Celotělová svalová hmota predikovala jak celotělový BMC (p = 0,014; η2 = 0,050), tak celotělovou BMD (p = 0,005; η2 = 0,047) a rovněž BMD v bederní páteři (p = 0,011; η2 = 0,048) u premenopauzálních pacientek, ale nikoliv u postmenopauzálních. Vztahy mezi celotělovou svalovou hmotou a BMD v bederní páteři u zdravých žen a u žen s RS před menopauzou a po menopauze znázorňuje graf 2.
Graf 2. Vztah mezi celotělovou svalovou (beztukovou) hmotou a BMD v bederní páteři u pacientek s RS (a) a u zdravých kontrol (b). Prázdné body označují ženy po menopauze, plné body ženy před menopauzou. 
Kurtzkeho EDSS skóre negativně asociovalo s BMD v oblasti celkového proximálního femuru u premenopauzálních (p = 0,002) i u postmenopauzálních žen (p = 0,013; η2 = 0,121) a v oblasti krčku femuru pouze u postmenopauzálních žen (p = 0, 011; η2 = 0,068). Vztahy mezi BMD (T - a Z skóre) a EDSS jsou zakresleny v grafu 3 pro oblast celkového proximálního femuru (graf 3a, b) a krčku femuru (graf 3c, d).
Graf 3. a, b) Vztah mezi BMD v oblasti celkového proximálního femuru (T skóre) a EDSS skóre (graf 3a) (statistická významnost a η<sup>2</sup> – multivariate GLM) a srovnání BMD v oblasti celkového proximálního femuru (Z skóre, průměr ± SEM) podle EDSS skóre u pacientek s RS (graf 3b) (statistická významnost – ANOVA). Prázdné body nebo sloupce označují pacientky po menopauze, plné body nebo sloupce pacientky před menopauzou. 
Graf 3 c, d) Vztah mezi BMD v oblasti krčku femuru (T skóre) a EDSS skóre (graf 3c) (statistická významnost a η<sup>2</sup> – multivariate GLM) a srovnání BMD v oblasti krčku femuru (Z skóre, průměr ± SEM) podle EDSS skóre u pacientek s RS (graf 3d) (statistická významnost – ANOVA). Prázdné body nebo sloupce označují pacientky po menopauze, plné body nebo sloupce pacientky před menopauzou. 
Kumulativní dávka GK negativně asociovala s BMD u premenopauzálních žen v bederní páteři (p = 0,037) a v oblasti krčku femuru (p = 0,031), ale prediktivní výpověď byla slabá (η2 = 0,021). Vztah mezi BMD v páteři a kumulativní dávkou GK znázorňuje graf 4.
Graf 4. Vztah mezi BMD (Bone Mineral Density v g/cm<sup>2</sup>) v bederní páteři (LS, plné body) a v krčku femuru (FN, prázdné body) a kumulativní dávkou glukokortikoidů (v mg) u premenopauzálních žen s RS. 
Laboratorní parametry
Koncentrace biochemických markerů kostní remodelace a 25-OH vitaminu D byly zhodnoceny v podskupině 110 pacientek (44 % pacientek) s osteoporózou nebo s osteopenií a u 75 zdravých žen (38,9 % žen) (tab. 3). Biochemické markery kostní remodelace βCTX i PINP se významně nelišily mezi pacientkami a zdravými ženami, ale významně vyšší koncentrace βCTX i PINP jsme zaznamenali u žen po menopauze, jak u pacientek s RS, tak u kontrolní skupiny žen (tab. 3). U pacientek s RS jsme potvrdili signifikantní pozitivní korelaci mezi PINP a βCTX (r2 = 0,559; p < 0,001), ale nezjistili jsme žádný vztah k hladinám 25-OH vitaminu D, iPTH nebo hodnotám BMD. Nedostatek vitaminu D byl zjištěn v pásmu těžkého nedostatku (< 10 ng/ml) u 8,2 % pacientek (u 5 premenopauzálních a 4 postmenopauzálních) a v pásmu středně těžkého nedostatku (10–30 ng/ml) u 70 % pacientek (u 39 premenopauzálních a 38 postmenopauzálních). U zdravých žen jsme těžký nedostatek vitaminu D zjistili u 2,5 % postmenopauzálních žen (1 ze 40) a středně těžký nedostatek u 57,5 % postmenopauzálních žen (23 ze 40 žen) a u 42,9 % premenopauzálních žen (15 z 35 žen). U pacientek s RS jsme potvrdili signifikantní negativní korelaci mezi 25-OH vitaminem D a iPTH (r2 = 0,188; p < 0,001). Nebyly zjištěny žádné vztahy mezi měřenými laboratorními ukazateli a BMD nebo parametry tělesného složení.
Diskuze
Výsledky studie u populace českých pacientek s RS svědčí o významně snížené BMD ve srovnání se zdravými ženami. I ve skupině relativně mladých premenopauzálních žen (průměrný věk 39,3 ± 7,9 let; průměrné EDSS 3,4 ± 1,6) byla zjištěna osteopenie u 59,3 % a osteoporóza u 8,8 % pacientek. Tyto výsledky jsou v souladu s předchozími studiemi, které dokumentovaly sníženou BMD zejména v oblasti proximálního femuru i u chodících pacientů s RS [19,23,25,45], byť nižší BMD nebyla zjištěna ve všech studiích, které hodnotily pacienty převážně s nižším stupněm motorického postižení [20,25].
Potvrdili jsme, že Kurtzkeho EDSS skóre významně predikovalo BMD v oblasti celkového proximálního femuru u premenopauzálních i postmenopauzálních žen s RS. BMD v oblasti celkového proximálního femuru i krčku femuru klesala v závislosti na rostoucím stupni motorického postižení, kdy významný pokles BMD byl zřejmý již u pacientů s EDSS skóre v rozmezí mezi 3,5 a 5,5 ve srovnání s pacienty s EDSS ≤ 3,5, tedy s těmi, kteří ve vzdálenosti, kterou ujdou, nejsou výrazně omezeni (graf 3b, d). Tyto výsledky jsou v souladu s předchozími studiemi, jež dokumentovaly významnou negativní korelaci mezi EDSS a celotělovým množstvím kostního minerálu (BMC) [21] nebo BMD v oblasti proximálního femuru [8,17–19]. K lokalizovanému úbytku BMD v oblasti proximálního femuru dochází také u pacientů s centrální míšní lézí [29,30] nebo u pacientů po cévní mozkové příhodě [31]. Větší ztráta BMD v proximálním femuru než v oblasti osového skeletu odpovídá nižšímu zatížení dolních končetin na rozdíl od páteře, na kterou působí relativně větší síly při pohybech trupem a horními končetinami i u méně pohyblivých pacientů. V souhlase s tímto typem ztráty BMD jsme u pacientek s RS nezaznamenali úbytek BMD v distálním úseku předloktí (1/3 radia) ve srovnání s kontrolní skupinou. EDDS skóre v multivariačním modelu rovněž nevysvětlilo ztrátu BMD v oblasti bederní páteře a celotělové BMD.
Novým poznatkem naší studie bylo zjištění, že k úbytku BMD u premenopauzálních žen s RS přispívá významně také tělesné složení, resp. ztráta beztukové (svalové) tělesné hmoty. U premenopauzálních pacientek, ale nikoliv u postmenopauzálních, jsme prokázali signifikantní pozitivní asociaci mezi celotělovým množstvím svalové hmoty a BMD v oblasti bederní páteře, celotělovou BMD a celotělovým BMC. Autoři Formica et al již dříve dokumentovali významnou pozitivní asociaci mezi celotělovým množstvím svalové hmoty a celotělovým BMC, ale na rozdíl od naší práce pouze u pacientek s EDSS ≥ 7,0, nikoliv u mobilních žen s nižším EDSS skóre [21]. Významný vztah mezi celotělovou svalovou hmotou a BMC v oblasti proximálního femuru dokumentovali u menšího souboru 29 pacientek s RS Mojtahedi et al [25]. V naší studii u premenopauzálních žen s RS ztráta BMD v oblasti proximálního femuru významně korelovala se ztrátou svalové hmoty v oblasti dolních končetin (r = 0,573; p < 0,001). V multivariačním modelu jsme ale nepotvrdili prediktivní hodnotu svalové hmoty dolních končetin ve vztahu k BMD. Pravděpodobně proto, že do studie byly zařazeny i pacientky s lehčím stupněm motorického postižení. Také Sioka et al, kteří dokumentovali úbytek svalové hmoty dolních končetin u ambulantních žen s RS s lehkým stupněm motorického postižení (průměrné EDSS 2,3), nezjistili žádný vztah mezi svalovou hmotou dolních končetin a kostní hmotou [26].
Odlišný vztah mezi kostní a svalovou hmotou u premenopauzálních žen ve srovnání s postmenopauzálními ženami by mohl být způsoben některými systémovými faktory, např. deficitem estrogenů. Na buněčné úrovni mechanický stimul aktivuje estrogenní receptory alfa (ERα), které jsou klíčové pro regulaci kostní remodelace a udržení integrity skeletu. Bylo zjištěno, že snížení počtu receptorů ERα po menopauze významně snižuje schopnost skeletu indukovat osteoanabolickou odpověď po mechanické zátěži [32]. Tyto poznatky jsou v souladu s rozdílným působením cvičení na skelet u starších žen ve srovnání s mladšími ženami. Také silnější asociace mezi svalovou a kostní hmotou u mužů ve srovnání s ženami po menopauze svědčí o významu pohlavních hormonů v modulaci vnímavosti skeletu vůči zatížení [33]. Nedostatek estrogenů tedy přispívá k rychlejšímu úbytku BMD u žen po menopauze nejen urychlením resorpce kosti, ale také snížením citlivosti skeletu k biomechanické zátěži. Jelikož jsme nehodnotili koncentrace estradiolu, nemůžeme vyloučit, že se nižší koncentrace estradiolu neuplatňují i u některých žen před menopauzou. Wei et al dokumentovali nízké hladiny estradiolu až u 25 % pacientek s RS před menopauzou [22]. Vztah mezi kostní a svalovou hmotou mohou u pacientů s RS modulovat i další faktory, např. léčba GK, která má na obě tyto tkáně katabolické účinky [34,35] nebo deficit vitaminu D. Také samotná svalová hmota nepůsobí na skelet pouze biomechanicky [36], ale i produkcí růstových faktorů [37,38]. Objasnění vlivu systémových faktorů, které modulují vztahy mezi kostní a svalovou hmotou, zvláště u pacientů s motorickým deficitem, vyžaduje další studie.
Potvrdili jsme, že k úbytku BMD u premenopauzálních žen s RS přispívá také dlouhodobá léčba GK. Kumulativní dávka GK u žen před menopauzou významně negativně asociovala s BMD v bederní páteři a v krčku femuru, byť prediktivní výpověď byla slabá (η2 = 0,021). U žen po menopauze jsme žádnou asociaci mezi užíváním GK a BMD nezjistili. Je pravděpodobné, že nedostatek estrogenů po menopauze, který výrazně akceleruje ztrátu BMD zejména v metabolicky aktivnější trámčité kosti, má silnější vliv na BMD v oblasti osového skeletu než samotná léčba GK. Negativní působení GK na skelet také významně moduluje svalová hmota. Bylo zjištěno, že u pacientů s RS s nižším stupněm motorického postižení léčených kontinuálně nízkými dávkami prednizolonu po dobu 6,2 roku (průměr dávka prednizolonu 7,3 mg/den) neměla léčba GK (trváním léčby, denní nebo kumulativní dávka GK) významný vliv na BMD [39]. U pacientů s vyšším stupněm motorického postižení ale léčba GK pravděpodobně přispívá k úbytku svalové i kostní hmoty [21]. Z dostupných studií vyplývá, že kontinuální dlouhodobá léčba GK má větší negativní důsledky pro skelet než intermitentní léčba vysokými dávkami GK, jež se u pacientů s RS užívá v léčbě akutních exacerbací onemocnění. Publikované prospektivní studie, ve kterých pacienti s RS dostávali opakovaně i.v. pulzy metylprednizolonu, neprokázaly významný úbytek BMD během 6 nebo 12 měsíců léčby [40,41]. Také u pacientů s revmatoidní artritidou neměla pulzní léčba metylprednizolonem (celkem 76 dní) během 12 měsíců s kumulativní dávkou 18,9 g signifikantní vliv na BMD, zatímco u pacientů, kteří užívali perorální denní metylprednizolon s kumulativní dávkou 3,06 g, byla prokázána významná ztráta BMD v bederní páteři i v proximálním femuru [42]. Byť pulzní léčba GK hluboce potlačuje kostní novotvorbu a zvyšuje přechodně kostní resorpci, tak po ukončení i.v. léčby GK dochází k významnému vzestupu ukazatelů kostní novotvorby, což svědčí pro reparační osteoanabolický účinek [40]. Absence negativních účinků pulzní léčby GK na BMD ale nemusí znamenat nižší riziko zlomenin, jelikož zlomeniny se vyskytují u dlouhodobých uživatelů GK ve vyšším pásmu BMD než u pacientů, kteří GK neužívají [43]. Přitom již nízké dávky prednizolonu (mezi 2,5–5 mg/den) jsou v epidemiologických studiích spojovány se zvýšeným rizikem zlomenin [44]. Samotné měření BMD totiž nehodnotí kvalitu kosti, kterou GK významně porušují. V našem souboru jsme osteoporotické zlomeniny zaznamenali celkem u 19 pacientek s RS (u 14 postmenopauzálních a 5 premenopauzálních), z toho u 7 pacientek byla BMD v pásmu osteopenie a u 12 pacientek v pásmu osteoporózy. U pacientů s RS by posouzení zlomenin mělo být součástí rutinního vyšetření, jelikož prodělaná osteoporotická zlomenina (zlomenina po nepřiměřeně malé zátěži, např. po pádu z výšky stojícího člověka) je ukazatelem porušené kvality kosti a významným rizikovým faktorem dalších fraktur, který nezávisí na hodnotě BMD.
Stav kostní hmoty mohou u pacientek s RS významně ovlivňovat i další faktory, jež jsme v naší práci nehodnotili. K časnému úbytku BMD nejen v proximálním femuru, ale i v bederní páteři přispívají u pacientů s RS i jiné faktory [45], o čemž svědčí i recentní výsledky autorů Moen et al, kteří zjistili vyšší výskyt osteopenie i u pacientů s minimálním motorickým postižením (medián EDSS 1,0) [23]. Kromě již zmíněného deficitu estrogenů může být významný také nedostatek vitaminu D, který společně s nižším příjmem vápníku vede k rozvoji sekundární hyperparatyreózy. Deficit vitaminu D zhoršuje i metabolizmus svalové hmoty a přispívá k vyššímu riziku pádů. Ve sledovaném souboru jsme zhodnotili koncentrace 25-OH vitamin D v podskupině pacientů s osteoporózou nebo s osteopenií (celkem u 110 pacientů) a u 75 zdravých žen. Těžký nedostatek vitaminu D (25-OH vitamin D < 10 ng/ml) byl zjištěn u 8,2 % pacientek (ve srovnání s 2,5 % zdravých žen) a středně těžký nedostatek (10–30 ng/ml) u 70 % pacientek (ve srovnání s 50,7 % zdravých žen). Tyto výsledky jsou v souladu s odhadovanou prevalencí nedostatku vitaminu D jak v obecné populaci, která se podle různých průzkumů pohybuje mezi 50 a 80 % [46,47], tak u pacientů s RS [48]. Větší populační studie u pacientů s RS ale zatím v ČR nebyly publikovány. Definice nedostatku vitaminu D při koncentraci 25-OH vitaminu D <30 ng/ml je v souladu se současným doporučením Mezinárodní nadace pro osteoporózu (IOF), která definuje optimální koncentraci 25-OH vitaminu D pro snížení rizika pádů a zlomenin nad 30 ng/ml. Naše výsledky potvrdily významnou negativní korelaci mezi koncentracemi 25-OH vitaminu D a iPTH i u premenopauzálních pacientek s RS. Je tedy pravděpodobné, že sekundární hyperparatyreóza může přispívat k časnému úbytku BMD i u mladších osob s RS, byť jsme v našem souboru nezjistili žádný vztah mezi koncentraci 25-OH vitamin D nebo iPTH a BMD. Naše výsledky neopravňují vzhledem k průřezovému charakteru studie k doporučení pro suplementaci vitaminem D u všech pacientů s RS, ale upozorňují na velmi častý nedostatek vitaminu D u této rizikové populace a zdůrazňují potřebu větších prospektivních studií, které by sledovaly účinnost a bezpečnost suplementace vitaminem D.
Mezi nedostatky naší práce patří kromě již zmiňovaného průřezového charakteru studie také nepřítomnost laboratorních parametrů hodnotících hormonální stav pacientů, zejména deficit estradiolu. Další omezení studie je dané retrospektivním výběrem pacientů do kontrolní skupiny, kdy nelze vyloučit bias při výběru pacientů. Studie ale svým počtem vyšetřených pacientů přesahuje většinu dosud publikovaných prací a upozorňuje na problematiku osteoporózy u pacientů s RS a potřebu longitudinálního sledování stavu skeletu u této rizikové populace. Některé limitace naší práce vyplývají i z metodiky měření svalové a kostní tkáně pomocí dvouenergiové rentgenové absorpciometrie (DXA). Výsledky DXA jsou vztaženy na plochu vyšetřované oblasti (g/cm2), nikoli na objem vyšetřované tkáně (g/cm3). Je tedy pravděpodobné, že přesnější metodiky, např. CT nebo MR, by mohly lépe zachytit i regionální rozdíly v úbytku svalové a kostní hmoty. Výhodou DXA je ale velmi nízká radiační zátěž pro pacienta a vysoká reprodukovatelnost a přesnost měření. Další prospektivní studie jsou nezbytné pro ověření DXA metodiky pro sledování změn tělesného složení během intervenčních preventivních nebo léčebných programů. U pacientů s lehčím stupněm motorického deficitu by zajímavé výsledky mohlo přinést i přesnější měření svalové síly dolních končetin (nejen orientační hodnocení v rámci EDSS).
Stav skeletu není u pacientů s RS v současné době rutinně vyšetřován a RS není zvažována jako rizikový faktor v současných doporučených postupech pro prevenci a léčbu osteoporózy. Včasná prevence úbytku BMD u pacientů s RS přitom může zabránit rozvoji osteoporózy a zlomeninám, které jsou u pacientů s RS zvláště závažné, jelikož mají za následek další snížení mobility a kvality života a dále prohlubují závislost postižených osob na dopomoci. Výsledky naší práce u českých pacientek s RS prokázaly významný úbytek kostní i svalové hmoty již u premenopauzálních žen ve srovnání se zdravými ženami. Studie potvrdila, že progresivní ztráta motorické aktivity patří mezi hlavní rizikové faktory úbytku kostní hmoty, zejména v oblasti proximálního femuru u premenopauzálních i postmenopauzálních žen s RS. Výsledky studie také ukázaly vysoký podíl nedostatku vitaminu D u pacientek i u zdravých kontrol, který může přispívat k úbytku BMD a ztrátě svalové síly. Prokázali jsme, že u premenopauzálních žen je významným predikčním faktorem BMD i celotělová svalová hmota. Ztráta svalové hmoty u premenopauzálních žen s RS (ale nikoliv u postmenopauzálních žen) významně asociovala s úbytkem celotělového BMC a celotělové BMD a rovněž se ztrátou BMD v bederní páteři. Zjištění, že svalová hmota je nezávislý predikční faktor BMD i u mobilních premenopauzálních žen s RS, má významné klinické důsledky i pro tvorbu vhodných preventivních programů, které by měly začínat časně již u premenopauzálních žen s nižším stupněm motorického deficitu. Předchozí studie u populací bez RS dokumentovaly, že pravidelná fyzická zátěž může zvýšit množství svalové hmoty a zlepšit BMD v oblasti krčku femuru u mladých i u starších lidí [49]. Krátkodobé cvičební programy u pacientů s RS vedly ke zlepšení svalové hmoty a chůze [50,51], ale zatím nebyly současně studovány i účinky cvičení na BMD. Ověření protektivního vlivu svalové hmoty na BMD u pacientů s RS a rovněž objasnění významu systémových faktorů např. nedostatku vitaminu D, který přispívá také ke ztrátě svalové síly, nebo estrogenů, jež modulují vztah mezi kostní a svalovou tkání, vyžaduje další prospektivní studie.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Děkujeme paní Janě Křenkové a Markétě Urbánkové za vynikající technickou podporu. Tato práce byla podpořena IGA MZČR NS č. 10564-3 a MSMT 0021620806.
M. Týblová1, V. Zikán2, M. Luchavová2, E. Havrdová1,
I. Raška jr2, D. Michalská2, A. A. Kuběna3
1 Neurologická klinika 1. LF UK a VFN v Praze
2 III. interní klinika 1. LF UK a VFN v Praze
3 Katedra sociální a klinické farmacie, Farmaceutická fakulta UK v Hradci Králové
MUDr. Vít Zikán, Ph.D.
III. interní klinika 1. LF UK a VFN
U Nemocnice 1
128 08 Praha 2
e-mail: vit.zikan@vfn.cz
Přijato k recenzi: 2. 1. 2012
Přijato do tisku: 17. 5. 2012
Zdroje
1. Compston A, Coles A. Multiple sclerosis. Lancet 2008; 372(9648): 1502–1517.
2. Hughes JM, Petit MA. Biological underpinnings of Frost‘s mechanostat thresholds: the important role of osteocytes. J Musculoskelet Neuronal Interact 2010; 10(2): 128–135.
3. Sibley WA, Bamford CR, Clark K, Smith MS, Laguna JF. A prospective study of physical trauma and multiple sclerosis. J Neurol Neurosurg Psychiatry 1991; 54(7): 584–589.
4. Troiano RA, Jotkowitz A, Cook SD, Bansil S, Zito G. Rate and types of fractures in corticosteroid-treated multiple sclerosis patients. Neurology 1992; 42(7): 1389–1391.
5. Nieves J, Cosman F, Herbert J, Shen V, Lindsay R. High prevalence of vitamin D deficiency and reduced bone mass in multiple sclerosis. Neurology 1994; 44(9): 1687–1692.
6. Cosman F, Nieves J, Herbert J, Shen V, Lindsay R. High-dose glucocorticoids in multiple sclerosis patients exert direct effects on the kidney and skeleton. J Bone Miner Res 1994; 9(7): 1097–1105.
7. Cosman F, Nieves J, Komar L, Ferrer G, Herbert J, Formica C et al. Fracture history and bone loss in patients with MS. Neurology 1998; 51(4): 1161–1165.
8. Weinstock-Guttman B, Gallagher E, Baier M, Green L, Feichter J, Patrick K et al. Risk of bone loss in men with multiple sclerosis. Mult Scler 2004; 10(2): 170–175.
9. Logan WC jr, Sloane R, Lyles KW, Goldstein B, Hoenig HM. Incidence of fractures in a cohort of veterans with chronic multiple sclerosis or traumatic spinal cord injury. Arch Phys Med Rehabil 2008; 89(2): 237–243.
10. Marrie RA, Cutter G, Tyry T, Vollmer T. A cross-sectional study of bone health in multiple sclerosis. Neurology 2009; 73(17):1394–1398.
11. Havrdová E, Týblová M, Štěpán J, Horáková D, Tichá V, Nováková I et al. Výskyt osteoporózy u pacientů s roztroušenou sklerózou v závislosti na míře kortikoterapie a stupni hybného postižení. Cesk Slov Neurol N 2004; 67/100(4): 234–240.
12. Nilsagard Y, Lundholm C, Denison E, Gunnarsson LG. Predicting accidental falls in people with multiple sclerosis – a longitudinal study. Clin Rehabil 2009; 23(3): 259–269.
13. Peterson EW, Cho CC, von Koch L, Finlayson ML. Injurious falls among middle aged and older adults with multiple sclerosis. Arch Phys Med Rehabil 2008; 89(6): 1031–1037.
14. Finlayson ML, Peterson EW, Cho CC. Risk factors for falling among people aged 45 to 90 years with multiple sclerosis. Arch Phys Med Rehabil 2006; 87(9): 1274–1279.
15. Kurtzke JF. Rating neurologic impairment in multiple sclerosis: an expanded disability status scale (EDSS). Neurology 1983; 33(11): 1444–1452.
16. Schwid SR, Goodman AD, Edward PJ, McDermott MP, Mattson DH. Sporadic corticosteroid pulses and osteoporosis in multiple sclerosis. Arch Neurol 1996; 53(8): 753–757.
17. Ozgocmen S, Bulut S, Ilhan N, Gulkesen A, Ardicoglu O, Ozkan Y. Vitamin D deficiency and reduced bone mineral density in multiple sclerosis: effect of ambulatory status and functional capacity. J Bone Miner Metab 2005; 23(4): 309–313.
18. Hotermans C, Dive D, Rinkin, Leroy M, Malaise M, Moonen G et al. Hip bone mineral density is correlated with EDSS in patients with multiple sclerosis. J Neurol 2006; 253: ii126 Abstract.
19. Terzi T, Terzi M, Tander B, Cantürk F, Onar M. Changes in bone mineral density and bone metabolism markers in premenopausal women with multiple sclerosis and the relationship to clinical variables. J Clin Neurosci 2010; 17(10): 1260–1264.
20. van der Mei IA, Ponsonby AL, Dwyer T, Blizzard L, Taylor BV, Kilpatrick T et al. Vitamin D levels in people with multiple sclerosis and community controls in Tasmania, Australia. J Neurol 2007; 254(5): 581–590.
21. Formica CA, Cosman F, Nieves J, Herbert J, Lindsay R. Reduced bone mass and fat-free mass in women with multiple sclerosis: effects of ambulatory status and glucocorticoid use. Calcif Tissue Int 1997; 61(2): 129–133.
22. Wei T, Lightman SL. The neuroendocrine axis in patients with multiple sclerosis. Brain 1997; 120(Pt 6): 1067–1076.
23. Moen SM, Celius EG, Sandvik L, Nordsletten L, Eriksen EF, Holmøy T. Low bone mass in newly diagnosed multiple sclerosis and clinically isolated syndrome. Neurology 2011; 77(2): 151–157.
24. Lambert CP, Lee Archer R, Evans WJ. Body composition in ambulatory women with multiple sclerosis. Arch Phys Med Rehabil 2002; 83(11): 1559–1561.
25. Mojtahedi MC, Snook EM, Motl RW, Evans EM. Bone health in ambulatory individuals with multiple sclerosis: impact of physical activity, glucocorticoid use, and body composition. J Rehabil Res Dev 2008; 45(6): 851–861.
26. Sioka C, Fotopoulos A, Georgiou A, Papakonstantinou S, Pelidou SH, Kyritsis AP et al. Body composition in ambulatory patients with multiple sclerosis. J Clin Densitom 2011; 14(4): 465–470.
27. Kanis JA, Glüer CC. An update on the diagnosis and assessment of osteoporosis with densitometry. Committee of Scientific Advisors, International Osteoporosis Foundation. Osteoporos Int 2000; 11(3): 192–202.
28. Cohen J. Statistical power analysis for the behavioral sciences. 2nd ed. Hillsdale, NJ: Lawrence Erlbaum Associates 1988.
29. Jiang SD, Dai LY, Jiang LS. Osteoporosis after spinal cord injury. Osteoporos Int 2006; 17(2): 180–192.
30. Slade JM, Bickel CS, Modlesky CM, Majumdar S, Dudley GA. Trabecular bone is more deteriorated in spinal cord injured versus estrogen-free postmenopausal women. Osteoporos Int 2005; 16(3): 263–272.
31. Jørgensen L, Jacobsen BK, Wilsgaard T, Magnus JH. Walking after stroke: does it matter? Changes in bone mineral density within the first 12 months after stroke. A longitudinal study. Osteoporos Int 2000; 11(5): 381–387.
32. Lee KC, Lanyon LE. Mechanical loading influences bone mass through estrogen receptor alpha. Exerc Sport Sci Rev 2004; 32(2): 64–68.
33. Taaffe DR, Cauley JA, Danielson M, Nevitt MC, Lang TF, Bauer DC et al. Race and sex effects on the association between muscle strength, soft tissue, and bone mineral density in healthy elders: the health, aging, and body composition study. J Bone Miner Res 2001; 16(7): 1343–1352.
34. Marone JR, Falduto MT, Essig DA, Hickson RC. Effects of glucocorticoids and endurance training on cytochrome oxidase expression in skeletal muscle. J Appl Physiol 1994; 77(4): 1685–1690.
35. Lobo MJ, Remesar X, Alemany M. Effect of chronic intravenous injection of steroid hormones on body weight and composition of female rats. Biochem Mol Biol Int 1993; 29(2): 349–358.
36. Schwarz P. Physical activity and bone strength. Scand J Med Sci Sports 2004; 14 : 1.
37. Lemmey AB, Glassford J, Flick-Smith HC, Holly JM, Pell JM. Differential regulation of tissue insulin-like growth factor-binding protein (IGFBP)-3, IGF-I and IGF type 1 receptor mRNA levels, and serum IGF-I and IGFBP concentrations by growth hormone and IGF-I. J Endocrinol 1997; 154(2): 319–328.
38. Karasik D, Kiel DP. Evidence for pleiotropic factors in genetics of the musculoskeletal system. Bone 2010; 46(5): 1226–1237.
39. Stepan JJ, Havrdova E, Tyblova M, Horakova D, Ticha V, Novakova I et al. Markers of bone remodeling predict rate of bone loss in multiple sclerosis patients treated with low dose glucocorticoids. Clin Chim Acta 2004; 348(1–2): 147–154.
40. Dovio A, Perazzolo L, Osella G, Ventura M, Termine A, Milano E et al. Immediate fall of bone formation and transient increase of bone resorption in the course of high-dose, short-term glucocorticoid therapy in young patients with multiple sclerosis. J Clin Endocrinol Metab 2004; 89(10): 4923–4928.
41. Then Bergh F, Kümpfel T, Schumann E, Held U, Schwan M, Blazevic M et al. Monthly intravenous methylprednisolone in relapsing-remitting multiple sclerosis – reduction of enhancing lesions, T2 lesion volume and plasma prolactin concentrations. BMC Neurol 2006; 6 : 19.
42. Frediani B, Falsetti P, Bisogno S, Baldi F, Acciai C, Filippou G et al. Effects of high dose methylprednisolone pulse therapy on bone mass and biochemical markers of bone metabolism in patients with active rheumatoid arthritis: a 12-month randomized prospective controlled study. J Rheumatol 2004; 31(6): 1083–1087.
43. Van Staa TP, Laan RF, Barton IP, Cohen S, Reid DM, Cooper C. Bone density threshold and other predictors of vertebral fracture in patients receiving oral glucocorticoid therapy. Arthritis Rheum 2003; 48(11): 3224–3229.
44. Van Staa TP, Leufkens HG, Abenhaim L, Zhang B, Cooper C. Oral corticosteroids and fracture risk: relationship to daily and cumulative doses. Rheumatology (Oxford) 2000; 39(12): 1383–1389.
45. Steffensen LH, Mellgren SI, Kampman MT. Predictors and prevalence of low bone mineral density in fully ambulatory persons with multiple sclerosis. J Neurol 2010; 257(3): 410–418.
46. Holick MF, Siris ES, Binkley N, Beard MK, Khan A, Katzer JT et al. Prevalence of Vitamin D inadequacy among postmenopausal North American women receiving osteoporosis therapy. J Clin Endocrinol Metab 2005; 90(6): 3215–3224.
47. Ginde AA, Liu MC, Camargo CA Jr. Demographic differences and trends of vitamin D insufficiency in the US population, 1988–2004. Arch Intern Med 2009; 169(6): 626–632.
48. Yildiz M, Tettenborn B, Putzki N. Vitamin D levels in Swiss multiple sclerosis patients. Swiss Med Wkly 2011; 141: w13192.
49. Ryan AS, Ivey FM, Hurlbut DE, Martel GF, Lemmer JT, Sorkin JD et al. Regional bone mineral density after resistive training in young and older men and women. Scand J Med Sci Sports 2004; 14(1): 16–23.
50. Dalgas U, Stenager E, Jakobsen J, Petersen T, Hansen HJ, Knudsen C et al. Resistance training improves muscle strength and functional capacity in multiple sclerosis. Neurology 2009; 73(18): 1478–1484.
51. Snook EM, Motl RW. Effect of exercise training on walking mobility in multiple sclerosis: a meta-analysis. Neurorehabil Neural Repair 2009; 23(2): 108–116.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2013 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Tetanus – staronová diagnóza? Kazuistika
- VII. sympozium o léčbě bolesti s mezinárodní účastí
- Gliom vyššího stupně kaudální oblasti míchy imitující myelitidu – kazuistika
- Může souviset úzký páteřní kanál s tvorbou granulomu na konci katétru uloženém v intratékálním prostoru? Kazuistika
- Webové okénko
- Analýza dat v neurologii: XXXVII. Statistické testy srovnávající odhady poměru šancí a relativního rizika
- 1. cena časopisu ČESKÁ A SLOVENSKÁ NEUROLOGIE A NEUROCHIRURGIE
- Pripomienky k neurogénnemu tetanickému syndrómu a simultánnym stavom zvýšenej neuromuskulárnej excitability
- Navrátil L. et al – Neurochirurgie. 1st ed. Praha: Karolinum 2012, 166 stran.
- doc. MUDr. Vilibald Vladyka, CSc., devadesátiletý
- 16. JEDLIČKOVY DNY
- Národní registr cévních mozkových příhod (registr IKTA) – je potřebný?
- Proměnlivá tvář parkinsonské neurodegenerace
- Snížená denzita kostního minerálu u žen s roztroušenou sklerózou
- Mapování mozkové aktivity pomocí funkční magnetické rezonance během plnění močového měchýře
- Vztah deprese a rozeznávání emocí z výrazu tváře u pacientů s mírnou kognitivní poruchou
- Časná chirurgická léčba spontánního intracerebrálního krvácení
- 27. český a slovenský neurologický sjezd a Dunajské symposium 2013
- Častý výskyt lymeské neuroboreliózy u dětí v České republice
- VI. NEUROMUSKULÁRNY KONGRES S MEDZINÁRODNOU ÚČASŤOU
- Použití botulotoxinu v neurologii
- Hydrocefalus jako komplikace subarachnoidálního krvácení
- Bezpečnost a účinnost nového schématu dávkování trombolýzy – pilotní studie
- Atlantookcipitální dislokace – soubor šesti pacientů a přehled problematiky
- Použití transcerebelárního přístupu s obrácenou montáží stereotaktického rámu pro biopsii lézí zadní jámy lební
- Kvalita života u pacientů s demencí
- Posttraumatická transdurální herniace míchy – kazuistika
- X. Afaziologické sympozium
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Použití botulotoxinu v neurologii
- Pripomienky k neurogénnemu tetanickému syndrómu a simultánnym stavom zvýšenej neuromuskulárnej excitability
- Častý výskyt lymeské neuroboreliózy u dětí v České republice
- Tetanus – staronová diagnóza? Kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



