-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vztah deprese a rozeznávání emocí z výrazu tváře u pacientů s mírnou kognitivní poruchou
An Association between Depression and Emotion Recognition from the Facial Expression in Mild Cognitive Impairment
Objective:
Neuropsychiatric disorders are frequent in mild cognitive impairment (MCI) as indicated by cross-sectional studies. Depression is the most frequent disorder in MCI patients and its presence increases the risk of conversion into Alzheimer’s disease. Two systems are responsible for neuropsychiatric disorders: the limbic system and fronto-subcortical connections. The structures involved in these systems are also responsible for emotion processing.Aim:
The aim of the study was to establish whether MCI patients have a deficit in emotion recognition and whether they have more severe depression than a control group and to assess the relationship between severity of depression and the ability to recognize emotions from facial expression.Patients and methods:
The study included 34 MCI patients and 23 controls. All subjects underwent routine neuropsychological testing (focused on memory, attention and speed of processing, executive, visuospatial and language functions). Emotional agnosia was examined by Facial Emotion Recognition Test and depression was assessed by geriatric depression scale.Results:
MCI group performed worse than controls on recognition of facial emotions (p < 0.05), and this group was also significantly more depressive than controls (p < 0.05). No significant correlation was found between severity of depression and total emotion recognition (r = 0.15, p = 0.28). Severity of depression correlated with inability to recognize happiness (p < 0.05, r = –0.32).Conclusion:
The ability to recognize emotions from facial expression is impaired in MCI patients and severity of depression contributes to inability of MCI patients to recognize happiness.Key words:
depression – facial expression – recognition of emotions – mild cognitive impairment – Alzheimer disease
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: A. Kadlecová 1,2; J. Laczó 1,2; M. Vyhnálek 1,2; K. Sheardová 3; D. Hořínek 2,4; J. Amlerová 1; D. Hudeček 2; J. Hort 1,2
Působiště autorů: Kognitivní centrum, 2. LF UK a FN v Motole, Praha 1; ICRC, FN u sv. Anny v Brně 2; I. neurologická klinika LF MU a ICRC, FN u sv. Anny, Brno 3; Neurochirurgická klinika 1. LF UK a ÚVN Praha 4
Vyšlo v časopise: Cesk Slov Neurol N 2013; 76/109(1): 52-55
Kategorie: Původní práce
Souhrn
Úvod:
Poruchy chování u pacientů s rozvinutou Alzheimerovou chorobou (ACH) byly popsány v řadě studií. U pacientů s mírnou kognitivní poruchou (MCI) je nejčastěji pozorovanou neuropsychiatrickou poruchou deprese, jejíž přítomnost zvyšuje riziko konverze MCI do demence. Pro vznik neuropsychiatrických poruch je důležitý limbický a fronto-subkortikální okruh mozku. Struktury zapojené v těchto okruzích se rovněž podílejí na zpracování emocí.Cíl studie:
Zjistit, zda pacienti s MCI mají poruchu rozeznávání emocí, zda jsou depresivnější než kontrolní skupina a zda existuje vztah mezi poškozením rozeznávání emocí z výrazu tváře a mírou depresivity u těchto pacientů.Metodika:
Třicet čtyři pacientů s MCI a 23 kontrol bylo vyšetřeno standardní neuropsychologickou baterií (zaměřenou na paměť, exekutivní, vizuospaciální a jazykové funkce), geriatrickou škálou deprese a Facial Emotion Recognition testem k rozeznání emoční agnózie (testované emoce: radost, hněv, strach, smutek, znechucení a údiv).Výsledky:
Pacienti s MCI hůře rozeznávali emoce z výrazu tváře v porovnání s kontrolní skupinou (p < 0,05) a zároveň tato skupina byla signifikantně depresivnější než kontroly (p < 0,05). Mezi výsledkem v rozeznávání emocí jako celku a mírou depresivity korelace nalezena nebyla (r = 0,15; p = 0,28). Při rozboru jednotlivých emocí však deprese negativně korelovala s rozeznáváním radosti (r = –0,32; p < 0,05).Závěr:
Pacienti s MCI mají poruchu rozeznávání emocí z výrazu tváře a jsou depresivnější než kontroly. Úroveň deprese měla vliv pouze na rozeznávání radosti.Klíčová slova:
míra depresivity – výraz tváře – rozeznávání emocí – mírná kognitivní porucha – Alzheimerova chorobaÚvod
Deprese je nejčastěji pozorovanou neuropsychiatrickou poruchou u pacientů s mírnou kognitivní poruchou (MCI) a její přítomnost zvyšuje riziko konverze MCI do Alzheimerovy choroby (ACH) až dvojnásobně [1,2]. I když je deprese častým neuropsychiatrickým symptomem u pacientů s demencí nejrůznější etiologie, není vzájemný vztah demence a deprese jednoznačně vysvětlen. Dle recentní literatury se zvažuje více hypotéz: deprese jako prodromální příznak ACH, v koincidenci s ACH, kdy přítomnost deprese u subjektu jenom dříve demaskuje již začínající demenci, a konečně deprese jako faktor urychlující neurodegenerativní procesy v mozku při ACH [3]. Deprese je spojena s vyšší hladinou kortizolu, který se může podílet na poškození hipokampu a některé studie poukazují na vyšší depozita amyloidových plak u depresivních pacientů [4]. Je známo, že deprese velmi často předchází demenci o 3–7 let, což by svědčilo, že je spíše nezávislým rizikovým faktorem [5,6]. Dle předchozích studií je u pacientů s amnestickým subtypem MCI, kteří mají větší pravděpodobnost konverze do demence na podkladě ACH, zaznamenána porucha rozeznávání emocí z výrazu tváře [7–9].
Rozeznávání emocí z výrazu tváře je komplexní děj, na němž má podíl velké množství struktur korových i podkorových. Pomocí neurozobrazovacích metod bylo potvrzeno zapojení okcipito-temporální kůry, parietálního, orbito-frontálního a insulárního kortexu, gyrus fusiformis, cingulární a prefrontální oblasti, amygdaly a bazálních ganglií [10–14].
Vztah deprese a poruchy rozeznávání emocí byl již dříve dobře popsán u pacientů s těžkou depresí [15]. Neuroanatomický korelát deprese byl nejlépe prozkoumán u pacientů s těžkou depresivní poruchou, kde podle neurozobrazovacích studií dochází k poškození limbických okruhů, které odpovídají také za rozeznávání emocí. Tyto výsledky naznačují, že významnou roli zde hraje úbytek šedé hmoty hipokampů [16], ale také poškození amygdaly [17], prokazatelné až šest let před rozvojem demence [18].
Cíl studie
Cílem studie bylo zjistit, zda:
- jsou pacienti s MCI depresivnější a hůře rozeznávají emoce;
- existuje vztah mezi poškozením rozeznávání emocí z výrazu tváře a depresí u pacientů s MCI, popřípadě zda poškození rozeznávání emocí a deprese mají vztah k míře postižení exekutivních funkcí.
Metodika
Soubor
Subjekty byly vybrány z pacientů navštěvujících Kognitivní centrum při Neurologické klinice 2. lékařské fakulty Univerzity Karlovy a FN v Motole. Kontrolní skupina byla rekrutována z rodinných příslušníků a frekventantů univerzity třetího věku. Všichni pacienti i kontroly podstoupili neurologické vyšetření, neuropsychologické vyšetření, rutinní krevní testy a vyšetření mozku magnetickou rezonancí. Pacienti s MCI splňovali Petersenova diagnostická kritéria [19] – vykazovali poškození (o 1,5 směrodatné odchylky) v nejméně jedné kognitivní doméně. Celkově bylo vyšetřeno 34 pacientů (15 mužů, 19 žen) s MCI a 23 kontrol (8 mužů, 15 žen) (tab. 2). Ze souboru byli vyloučeni pacienti s vaskulární demencí (Hachinského skóre < 4 a změny na MR dle Fazekasovy stupnice [20] větší než 1), a anamnézou neurologického či psychiatrického postižení. Všichni vyšetřovaní podepsali informovaný souhlas. Protokol studie byl schválen etickou komisí FN v Motole.
Autoři prohlašují, že studie na lidských subjektech popsaná v manuskriptu byla provedena v souladu s etickými standardy příslušné komise (institucionální a národní) odpovědné za provádění klinických studií a Helsinskou deklarací z roku 1975, revidovanou v r. 2000.
Neuropsychologická baterie
Všichni pacienti podstoupili vyšetření standardní neuropsychologickou baterií testů, rutinně používanou na neurologické klinice, která je odvozená od Unified Data Set [21], vyšetřující tyto kognitivní domény: paměť, exekutivní, vizuospaciální a jazykové funkce (tab. 1).
Tab. 2. Výsledky testů kognitivních funkcí u kontrol a MCI – vždy uveden průměr ± SD. 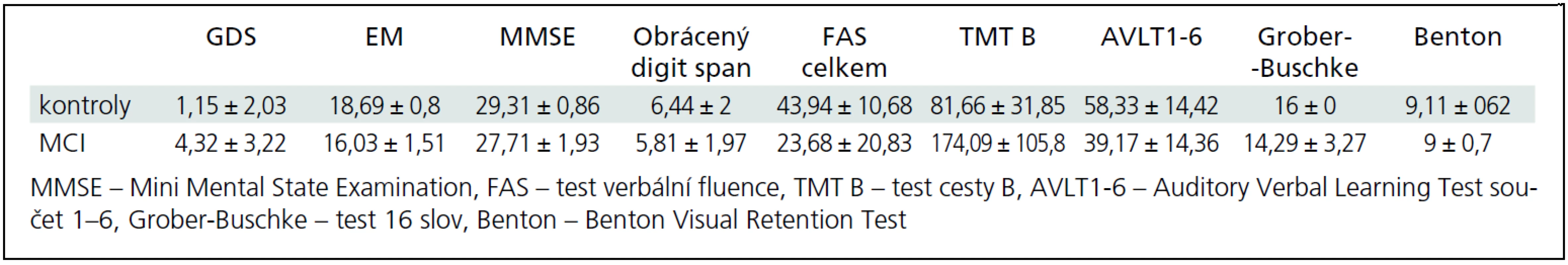
Testy a škály byly administrovány jedním psychologem a jedním studentem psychologie vyššího ročníku, specializujícími se na vyšetřování neuropsychologie u pacientů kognitivního centra. Zaškolení probíhalo formou prezentace neuropsychologických baterií, poté administrátor 5krát vyšetřoval pod dohledem a 8krát samostatně s možností konzultace během vyšetření a interpretace výsledků. Při následném kontrolním vyšetření pod dohledem se vyšetřující kvalifikoval.
Míra depresivity byla hodnocena pomocí Geriatrické škály deprese (GDS) – 15otázková verze [22].
Na hodnocení rozpoznání emocí z výrazu tváře byl použit test dle Ekmana a Friesena [23], který obsahuje 24 černobílých fotografií tváří (rozměr 15 × 17 cm), vyjadřujících šest základních emocí – radost, hněv, strach, smutek, překvapení a znechucení (obr. 1). Každá emoce byla zastoupena čtyřmi fotografiemi. Fotografie byly pacientům ukazovány ve fixním pořadí, při každé z nich byl pacient vyzván, aby vybral se seznamu šesti emocí, které byly vždy pod každou fotografií, jenom v jiném náhodném pořadí, vypsány, tu emoci, jež nejlépe vystihuje fotografii.
Obr. 1. Obr. 1. Ekman a Friesen [23]. Obr. 1a) Zleva doprava: hněv, překvapení, radost. Obr. 1b) Zleva doprava: smutek, strach, znechucení. ![Obr. 1. Ekman a Friesen [23].
Obr. 1a) Zleva doprava: hněv, překvapení, radost.
Obr. 1b) Zleva doprava: smutek, strach, znechucení.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/6921bfd13a871e3e1c28fea2c8a5716c.jpg)
Pacienti absolvovali výše zmíněná vyšetření během jednoho sezení v tomto pořadí: GDS, neuropsychologická baterie, test rozeznávání emocí z výrazu tváře.
Statistická analýza
K porovnání GDS skóre a skóre rozeznávání emocí mezi kontrolní a MCI skupinou byl vzhledem k tomu, že obě skupiny si odpovídaly věkem a že se jednalo o neparametrická data, použit Mann--Whitneyův test. Korelace byly provedeny pomocí Spearmanova korelačního koeficientu. Souhrnný výkon v testech exekutivních funkcí (test verbální fluence, test cesty verze B a obrácený digit span) jsme vyjádřili pomocí kompozitního Z skóre.
Výsledky
Pacienti s MCI dosahovali v testu rozeznávání emocí z výrazu tváře horších výsledků než kontroly (p < 0,05) a tato skupina byla rovněž signifikantně depresivnější než kontrolní skupina (p < 0,05). Při analýze výsledků pacientů s MCI nebyl nalezen signifikantní vztah mezi mírou depresivity a schopností rozeznávat emoce z výrazu tváře (r = 0,16; p = 0,372), nicméně při analýze zaměřené na jednotlivé emoce jsme zjistili signifikantně negativní korelaci mezi mírou depresivity a schopností rozeznávat radost (r = –0,34; p < 0,05).
Nalezli jsme signifikantní korelaci exekutivních funkcí s celkovým skóre rozeznávání emocí (r = 0,39; p = 0,005). Míra postižení exekutivních funkcí vyjádřená pomocí Z skóre, nekorelovala s mírou depresivity (r = –0,22; p = 0,126) ani s rozeznáváním radosti (r = 0,26; p = 0,068). S ostatními kognitivními funkcemi míra depresivity ani schopnost rozeznávat emoce nekorelovaly.
Skupina MCI byla v testech kognitivních funkcí horší než kontroly (tab. 1).
Diskuze
Výsledky naší studie potvrzují, že pacienti s MCI jsou signifikantně depresivnější než normální populace a zároveň hůře rozpoznávají emoce z výrazu tváře. Tyto výsledky podporují nálezy z předchozích studií, které ale posuzovaly výskyt deprese a schopnost rozeznávat emoce odděleně [7–9].
Práce, které zkoumaly postižení rozeznávání emocí z výrazu tváře u pacientů s MCI, ukazují, že u těchto pacientů většinou dochází k poškození rozeznávání negativních emocí [24]. V recentní práci Weisse et al, která sledovala schopnost rozeznávání emocí a výskyt deprese u pacientů s MCI [8], korelace celkového skóre v testu rozeznávání emocí z tváře s depresí nalezena nebyla. Podobného výsledku jsme dosáhli v naší studii, s tím rozdílem, že schopnost rozeznat radost z výrazu tváře souvisela s mírou depresivity. Podobně je tomu u pacientů s těžkou (endogenní) depresivní poruchou, kde podle funkčních neurozobrazovacích metod pacienti vykazují zvýšenou neurální aktivitu v reakci na smutné tváře a sníženou v reakci na šťastné tváře v amygdale a striatu [25].
Výsledky prací, jež se snažily specifikovat anatomický korelát deprese u ACH, naznačují, že neuropsychiatrické poruchy by mohly být důsledkem kortikálního postižení [26,27]. Dále zde mohou hrát významnou roli rovněž poruchy mediátorových systémů. Byl popsán pokles počtu buněk v locus coeruleus s doprovodnou redukcí noradrenalinu v kůře [28] a rovněž snížené zpětné vychytávání serotoninu [29]. Ovlivnění serotoninergního systému v mozku například podáváním serotonin reuptake inhibitorů (SSRI) způsobuje u myší i lidí redukci amyloidové nálože [30]. Stejně tak SSRI podávané pacientům s depresí bránilo úbytku šedé hmoty hipokampů proti neléčeným depresivním pacientům [31]. Jednou z recentních hypotéz je, že deprese a s ní vázaná stresová reakce zprostředkovaná glukokortikoidní hypersekrecí, doprovázená zvýšenou expresí jejich receptorů v hipokampu, by mohla potencovat či spouštět neurodegenerativní změny [32].
Vysvětlením pro naše výsledky může být skutečnost, že deprese pravděpodobně ovlivňuje vnímání radosti. Kandel udává, že emoční ladění, fyzikální podmínky i stav vědomí ovlivňují ukládání i vybavování paměťové stopy, případně strategie při tom použité [33]. Stav, že je nově získaná informace vybavena pouze za situace, kdy je subjekt podroben stejným senzorickým a fyziologickým podmínkám jako při jejím ukládání, se označuje jako state depending learning [34].
Schopnost rozeznat radost se u našich pacientů utvořila jako nedeklarativní paměťová stopa v minulosti a velmi pravděpodobně byla doprovázena pozitivním emočním laděním. Zjištěná depresivita v době, kdy byli pacienti testováni, však přináší jinou, téměř protichůdnou situaci, a tyto odlišné podmínky tak mohly hypoteticky rozpoznání radosti ovlivnit.
Naše výsledky potvrzují, že schopnost rozeznat emoce z výrazu tváře je narušena již ve stadiu MCI, což může ovlivňovat sociální integraci a kvalitu života pacientů i jejich pečujících osob. V případě současného výskytu deprese může být postiženo zejména vnímání radosti. Bylo by zajímavé zjistit, zda terapeutickým ovlivněním depresivity u této skupiny pacientů nedojde ke zlepšení rozpoznávání emocí z výrazu tváře, a tím i k zlepšení sociálního komfortu pacienta. Tuto možnost potvrzují výsledky z práce Sheline et al, kde terapie antidepresivy ovlivňovala aktivitu amygdaly [31].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Děkujeme za finanční podporu grantu GAUK 98509, IGA NT 11225-4, a projektu FNUSA-ICRC (no. CZ.1.05/1.1.00/02.0123) z Evropského fondu regionálního rozvoje.
A. Kadlecová1,2, J. Laczó1,2, M. Vyhnálek1,2, K. Sheardová3,
D. Hořínek2,4, J. Amlerová1, D. Hudeček2, J. Hort1,2
1 Kognitivní centrum, 2. LF UK a FN v Motole, Praha
2 ICRC, FN u sv. Anny v Brně
3 I. neurologická klinika LF MU a ICRC, FN u sv. Anny, Brno
4 Neurochirurgická klinika 1. LF UK a ÚVN Praha
MUDr. Alexandra Kadlecová
Neurologická klinika dospělých
2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
e-mail: yooma@seznam.cz
Přijato k recenzi: 24. 5. 2012
Přijato do tisku: 23. 8. 2012
Zdroje
1. Lyketsos CG, Lopez O, Jones B, Fitzpatrick AL, Breitner J, DeKosky S. Prevalence of neuropsychiatric symptoms in dementia and mild cognitive impairment: results from the cardiovascular health study. JAMA 2002; 288(12): 1475–1483.
2. Gabryelewicz T, Styczynska M, Luczywek E, Barczak A, Pfeffer A, Androsiuk W et al. The rate of conversion of mild cognitive impairment to dementia: predictive role of depression. Int J Geriatr Psychiatry 2007; 22(6): 563–567.
3. Dotson VM, Beydoun MA, Zonderman AB. Recurrent depressive symptoms and the incidence of dementia and mild cognitive impairment. Neurology 2010; 75(1): 27–34.
4. Butters MA, Aizenstein HJ, Hayashi KM, Meltzer CC, Seaman J, Reynolds CF jr et al. Three-dimensional surface mapping of the caudate nucleus in late-life depression. J Geriatr Psychiatry 2009; 17(1): 4–12.
5. Ownby RL, Crocco E, Acevedo A, John V, Loewenstein D. Depression and risk for Alzheimer disease: systematic review, meta-analysis, and metaregression analysis. Arch Gen Psychiatry 2006; 63(5): 530–538.
6. Wilson RS, Barnes LL, Mendes de Leon CF, Aggarwal NT, Schneider JS, Bach J et al. Depressive symptoms, cognitive decline, and risk of AD in older persons. Neurology 2002; 59(3): 364–770.
7. Teng E, Lu PH, Cummings JL. Deficits in facial emotion processing in mild cognitive impairment. Am J Geriatr Psychiatry 2007; 23(4): 271–279.
8. Weiss EM, Kohler CG, Vonbank J, Stadelmann E, Kemmler G, Hinterhuber H et al. Impairment in emotion recognition abilities in patients with mild cognitive impairment, early and moderate Alzheimer disease compared with healthy comparison subjects. Am J Geriatr Psychiatry 2008; 16(12): 974–980.
9. Varjassyová A, Hořínek D, Andel R, Laczó J, Sheardová K, Magerová H et al. Recognition of facial emotional expression in amnestic mild cognitive impairment. J Alz Dis 2013; 33(1): 273–280.
10. Adolphs R, Tranel D, Damasio H, Damasio A. Impaired recognition of emotion in facial expressions following bilateral damage to the human amygdala. Nature 1994; 372(6507): 669–672.
11. Adolphs R. The neurobiology of social cognition. Curr Opin Neurobiol 2001; 11(2): 231–239.
12. Craik FIM, Moroz TM, Moscovitch M, Stuss DT, Wincour G, Tulving E et al. In search of the self: a positron emission tomography study. Psychol Sci 1999; 10 : 26–34.
13. Sowell ER, Peterson BS, Thompson PM, Welcome SE, Henkenius AL, Toga AW: Mapping cortical change across the human life span. Nat Neurosci 2003; 6 : 309–315.
14. Jack CR jr, Petersen RC, Xu YC, Waring SC, Obrien PC, Tangalos EG et al. Medial temporal atrophy on MRI in normal aging and very mild Alzheimer’s disease. Neurology 1997; 49(3): 786–794.
15. Bourke C, Douglas K, Porter R. Processing of facial emotion expression in major depression: a review. Aust N Z J Psychiatry 2010; 44(8): 681–96.
16. Sheline YI , Gado MH, Kraemer HC. Untreated depression and hippocampal volume loss. Am J Psychiatry 2003; 160(8): 1516–1518.
17. Cerullo MA, Fleck DE, Eliassen JC, Smith MS, Delbello MP, Adler CM et al. A longitudinal functional connectivity analysis of the amygdala in bipolar I disorder across mood states. Bipolar Disord 2012; 14(2): 175–184.
18. den Heijer T, Geerlings MI, Hoebeek FE, Hofman A, Koudstaal PJ, Breteler MM. Use of hippocampal and amygdalar volumes on magnetic resonance imaging to predict dementia in cognitively intact elderly people. Arch Gen Psychiatry 2006; 63(1): 57–62.
19. Petersen RC, Doody R, Kurz A, Mohs RC, Morris JC, Rabins PV et al. Current concepts in mild cognitive impairment. Arch Neurol 2001; 58(12): 1985–1992.
20. Schmidt R, Schmidt H, Fazekas F. Vascular risk factors in dementia. J Neurol 2000; 247(2): 81–87.
21. Maruta C, Guerreiro M, de Mendonça A, Hort J, Scheltens P. The use of neuropsychological tests across Europe: the need for a consensus in the use of assessment tools for dementia. Eur J Neurol 2011; 18(2): 279–285.
22. Grober E, Buschke H. Genuine memory deficits in dementia. Dev Neuropsychol 1987; 3 : 13–36.
23. Ekman P, Friesen WV. Pictures of Facial Affect. Palo Alto: Consulting Psychologists Press 1976.
24. McCade D, Sabate G, Naismith SL. Review of emotion recognition in mild cognitive impairment. Dement Geriatr Cogn Disord 2011; 32(4): 257–266.
25. Leppänen JM. Mood disorders, Emotional information processing in mood disorders: a review of behavioral and neuroimaging findings. Curr Opin Psychiatry 2006; 19(1): 34–39.
26. Holthoff VA, Beuthien-Baumann B, Kalbe E, Lüdecke S, Lenz O, Zündorf G et al. Regional cerebrál metabolism in early Alzheimer‘s disease with clinically significant apathy or depression. Biol Psychiatry 2005; 57(4): 412–421.
27. Hirono N, Mori E, Ishii K, Ikejiri Y, Imamura T, Shimomura T et al. Frontal lobe hypometabolism and depression in Alzheimer‘s disease. Neurology 1998; 50(2): 380–383.
28. Zubenko GS. Biological correlates of clinical heterogeneity in primary dementia. Neuropsychopharmacology 1992; 6(2): 77–93.
29. Chen CP, Alder JT, Bowen DM, Esiri MM, McDonald B, Hope T et al. Presynaptic serotonergic markers in community-acquired cases of Alzheimer‘s disease: correlations with depression and neuroleptic medication. J Neurochem 1996; 66(4): 1592–1598.
30. Cirrito JR. Serotonin signaling is associated with lower amyloid-β levels and plaques in transgenic mice and humus. PNAS 2011; 108(36): 14968–14973.
31. Sheline YI , Barch DM, Donnelly JM, Ollinger JM, Snyder AY, Mintun MA. Increased amygdala response to masked emotional faces in depressed subjects resolves with antidepressant treatment: an fMRI study. Biol Psychiatry 2001; 50(9): 651–658.
32. Leonard BE. Inflammation, depression and dementia: are they connected? Neurochem Res 2007; 32(10): 1749–1756.
33. Squire LR, Kandel ER. Memory: From Mind to Molecules. New York: Scientific American Library 2003.
34. Shulz DE, Sosnik R, Ego V, Haidarliu S, Ahissar E. A neuronal analogue of state-dependent learning. Nature 2000; 403(6769): 549–553.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2013 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Tetanus – staronová diagnóza? Kazuistika
- VII. sympozium o léčbě bolesti s mezinárodní účastí
- Gliom vyššího stupně kaudální oblasti míchy imitující myelitidu – kazuistika
- Může souviset úzký páteřní kanál s tvorbou granulomu na konci katétru uloženém v intratékálním prostoru? Kazuistika
- Webové okénko
- Analýza dat v neurologii: XXXVII. Statistické testy srovnávající odhady poměru šancí a relativního rizika
- 1. cena časopisu ČESKÁ A SLOVENSKÁ NEUROLOGIE A NEUROCHIRURGIE
- Pripomienky k neurogénnemu tetanickému syndrómu a simultánnym stavom zvýšenej neuromuskulárnej excitability
- Navrátil L. et al – Neurochirurgie. 1st ed. Praha: Karolinum 2012, 166 stran.
- doc. MUDr. Vilibald Vladyka, CSc., devadesátiletý
- 16. JEDLIČKOVY DNY
- Národní registr cévních mozkových příhod (registr IKTA) – je potřebný?
- Proměnlivá tvář parkinsonské neurodegenerace
- Snížená denzita kostního minerálu u žen s roztroušenou sklerózou
- Mapování mozkové aktivity pomocí funkční magnetické rezonance během plnění močového měchýře
- Vztah deprese a rozeznávání emocí z výrazu tváře u pacientů s mírnou kognitivní poruchou
- Časná chirurgická léčba spontánního intracerebrálního krvácení
- 27. český a slovenský neurologický sjezd a Dunajské symposium 2013
- Častý výskyt lymeské neuroboreliózy u dětí v České republice
- VI. NEUROMUSKULÁRNY KONGRES S MEDZINÁRODNOU ÚČASŤOU
- Použití botulotoxinu v neurologii
- Hydrocefalus jako komplikace subarachnoidálního krvácení
- Bezpečnost a účinnost nového schématu dávkování trombolýzy – pilotní studie
- Atlantookcipitální dislokace – soubor šesti pacientů a přehled problematiky
- Použití transcerebelárního přístupu s obrácenou montáží stereotaktického rámu pro biopsii lézí zadní jámy lební
- Kvalita života u pacientů s demencí
- Posttraumatická transdurální herniace míchy – kazuistika
- X. Afaziologické sympozium
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Použití botulotoxinu v neurologii
- Pripomienky k neurogénnemu tetanickému syndrómu a simultánnym stavom zvýšenej neuromuskulárnej excitability
- Častý výskyt lymeské neuroboreliózy u dětí v České republice
- Tetanus – staronová diagnóza? Kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




