-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Kortikální patologie u roztroušené sklerózy – morfologické, imunopatologické a klinické souvislosti
Cortical Pathology in Multiple Sclerosis – Morphology, Immunopathology and Clinical Context
The early pathological changes in multiple sclerosis suggest that the morphological and functional changes in the cerebral cortex and subcortical gray matter may precede pathological changes in the white matter of the brain. Modern investigational methods allow histopathological analysis of the pathological changes that lead to the early demyelination and atrophy. New imaging techniques (T2-weighted turbo spin-echo, double inversion recovery MRI – DIR-MRI) or phase-sensitive inversion recovery (PSIR-MRI) allow more detailed detection of cortical pathology. Cortical and subcortical pathology clinically correlates with cognitive disorders, depression, epilepsy and fatigue, compared to white matter changes that correlate with impaired motor skills. In the future, new techniques may allow MRI to further speed up the diagnosis and early treatment.
Key words:
multiple sclerosis – cortical grey matter – subcortical grey matter – cortical lesion – atrophy – magnetic resonance imaging
Autoři: J. Piťha 1,2; M. Vachová 1; E. Havrdová 2
Působiště autorů: MS centrum při neurologickém oddělení, Krajská zdravotní, a. s. – Nemocnice Teplice o. z. 1; Neurologická klinika 1. LF UK a VFN v Praze 2
Vyšlo v časopise: Cesk Slov Neurol N 2012; 75/108(6): 684-688
Kategorie: Přehledný referát
Souhrn
V rámci časných patologických změn u roztroušené sklerózy je zřejmé, že morfologické a funkční změny v oblasti mozkové kůry a podkorové šedi mohou předcházet patologickým změnám v bílé hmotě mozku. Morfologické nálezy se zavedením moderních histopatologických metod umožnily analýzu patologických změn, které vedou již v časných fázích k demyelinizaci a atrofii. Nové zobrazovací techniky, např. trojdimenzionální T1 vážené gradient echo sekvence, T2 vážené turbo spin echo, „Double Inversion Recovery“ (DIR) nebo „Phase-Sensitive Inversion Recovery“ MR, umožnily podrobnější detekci kortikální patologie. Klinickými koreláty korové a podkorové patologie jsou kognitivní poruchy, deprese, epilepsie a únava, oproti změnám v bílé hmotě, které souvisejí s poruchami motoriky. Nové techniky magnetické rezonance mohou v budoucnu umožnit další urychlení diagnostiky a včasné zahájení léčby.
Klíčová slova:
roztroušená skleróza – mozková kůra – podkorová šeď – kortikální léze – atrofie – magnetická rezonanceÚvod
Vžitou představou patologických a morfologických změn u roztroušené sklerózy (RS) jsou zánětlivé demyelinizační léze v oblasti bílé hmoty mozku a míchy [1]. Tyto léze jsou roztroušeny v čase a prostoru a o jejich průkaz na magnetické rezonanci mozku, event. míchy se opírají i diagnostická kritéria. Kromě zánětlivých změn je možné pozorovat i neurodegenerativní pochody vedoucí k neuroaxonální ztrátě v oblasti bílé hmoty. Navíc jsou prokazatelné i patologické pochody v normálně vypadající bílé hmoty, které jsou klasickými zobrazovacími metodami nepostižitelné [2].
V posledních letech se obrací pozornost k patologickým změnám mozkové kůry a podkorové šedi. Je zajímavé, že demyelinizace v oblasti korové šedi byla popisována již před více než 100 lety, ale pak upadla v zapomnění [3]. Přispěly k tomu jednak technické obtíže s průkazem těchto lézí v standardním histochemickém barvení a zejména nízká senzitivita zobrazovacích metod. Detekce patologických změn v mozkové kůře při konvenčním vyšetření v T2 vážných obrazech na magnetické rezonanci (MR) je obtížná vzhledem k nízké denzitě myelinu v kortexu a obtížnému rozpoznání rozdílu mezi normální korovou šedí a demyelinizacemi v mozkové kůře. Navíc jsou kortikální léze objemově malé a denzita mozkomíšního moku mezi mozkovými závity může ještě detekci snižovat [4,5]. S rutinním zavedením FLAIR sekvencí se senzitivita vyšetření kortikálních lézí podstatně zvýšila (obr. 1, 2). Prevalence korových demyelinizací je však v sekčních a bioptických nálezech daleko vyšší než jejich detekce při MR [6].
Obr. 1, 2. Kortikální demyelinizační leze na MR v sekvenci FLAIR (Philips (1,5 T) u 32leté pacientky s RR-RS po devíti letech onemocnění (MR dokumentace zapůjčena s laskavým svolením prof. MUDr. Zdeňka Seidla, CSc., MR odd. Radiodiagnostické kliniky 1. LF UK a VFN). 
Je patrné, že k atrofii korové šedi dochází rychleji než v bílé hmotě a že míra kortikální atrofie je nezávislá na atrofii bílé hmoty. Kortikální atrofie koreluje s klinickou progresí lépe než atrofie bílé hmoty mozku [7–9]. Tyto nálezy podporují tezi, že kortikální poškození může lépe vysvětlit příznaky kognitivní poruchy spojené s RS, zatímco léze v oblasti bílé hmoty korelují více s motorickým deficitem [10]. Není patrná závislost mezi objemem demyelinizací bílé hmoty a kortikálním postižením (měřeno zobrazovacími metodami), což naznačuje, že oba patologické procesy mohou do určité míry probíhat nezávisle na sobě [11,12].
Histopatologické nálezy
Korové léze jsou klasifikovány diferencovaně [13,14]. Všechny se shodují v průkazu tří typů lézí: typ I navazuje na juxtakortikální léze, typ II je výhradně kortikální a III. typ se šíří z pia mater do povrchových korových vrstev – typ subpiální (obr. 3) [15]. Zajímavé je, že v kortikálních lézích u stejného subjektu nejsou detekovatelné plazmatické bílkoviny, což svědčí o tom, že kortikální demyelinizace u progresivní RS není spojena s významnější poruchou HEB [16].
Obr. 1. Typy kortikálních lézí. Typ I navazuje na juxtakortikální léze v BH, typ II výhradně kortikální a III. typ subpiální. Podle [15]. ![Typy kortikálních lézí. Typ I navazuje na juxtakortikální léze v BH, typ II výhradně kortikální a III. typ subpiální. Podle [15].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/2c0aa1ebbfe03f01986b1a3c505dc401.jpg)
Zatímco zánětlivá ložiska v bílé hmotě jsou bohatě celulizovaná (T buňky, B buňky, dendritické buňky, mikroglie a makrofágy), léze korové, zejména u progresivní RS, obsahují mnohem méně zánětlivých elementů. Aktivní korová demyelinizace je provázena přítomností degradačních produktů myelinu v makrofázích či mikroglii. Difuzní infiltráty, které jsou patrné u inaktivních demyelinizací, se obvykle neliší od oblastí mozkové kůry, jež nejsou poškozeny [12–14]. Mírnější zánětlivé změny, které jsou variabilní, závisejí na typu lézí. Tak např. I. typ je charakterizován větším množstvím zánětlivých buněk než léze u téhož jedince, které jsou intrakortikální [17]. Pomocí DNA analýzy je genová exprese imunoglobulinů snížena u vzorků tkáně pocházející z kortexu pacientů s RS, na druhé straně je častým nálezem aktivita B lymfocytů, přítomných na meningách, jejichž produkce je ale velmi variabilní [18]. Ačkoliv většina prací zdůrazňuje u korových lézí nízký stupeň zánětu, jiné, zejména recentní, studie prokazují evidentní známky zánětu při vyšetření mozkovou biopsií v časných fázích RS [19,20]. Lymfocyty byly přítomny výhradně v parenchymu a perivaskulárních prostorách. Tyto infiltráty obsahovaly T buňky, B buňky a protilátky produkované plazmatickými buňkami. Převažovaly CD4 + T buňky oproti CD8 + T lymfocytům. Meningeální zánět byl pozorován v blízkosti korových infiltrátů. Zajímavé je, že v raných stadiích RS nejsou někdy nálezy demyelinizace bílé hmoty pomocí MR patrné. To naznačuje, že kortikální poškození může předcházet poškození tkáně v bílé hmotě.
Jak již bylo uvedeno, ložiska kortikální demyelinizace jsou často infiltrována B lymfocyty. Ty pocházejí z lymfatických folikulů na meningách organizovaných v germinativních centrech [21]. Zde dochází ke klonální expanzi antigenem aktivovaných B lymfocytů, maturaci a diferenciaci na paměťové B buňky a plazmocyty. Folikulární dendritické buňky zde prezentují antigen a produkují chemokiny aktivující B buňky, např. CXCL13 [22]. Výskyt folikulární hyperplazie s germinativními centry v thymu je typická např. u mladých pacientů s myasthenia gravis [23]. Ektopická centra se často vyskytují ve tkáních pacientů s revmatoidní artritidou, Sjogrenovým syndromem, Crohnovou nemocí, Hashimotovou tyreoiditidou a u některých solidních tumorů [24,25]. Tyto struktury jsou považovány za zdroj autoreaktivních B buněk a protilátek a podílejí se na udržování autoimunitní reakce, i když je tuto tezi nutné potvrdit dalšími studiemi. Meningeální B buňky akumulované v germinativních centrech jsou průkazné cca u poloviny pacientů s progresivní RS [21], ale v jiné studii stejných autorů u primárně progresivní formy RS byl tento nález ojedinělý [26]. Jiná práce uvádí, že meningeální patologie souvisí spíše s aktivitou onemocnění [27]. Velmi málo údajů je od pacientů s relaps-remitentní formou RS (RR-RS). Je to pochopitelné, protože bioptických vzorků je velmi málo. Zvýšený počet a rozsah kortikálních lézí koreluje s přítomností meningeálních folikulů, stejně jako převaha tzv. subpiálních lézí (typ III). Folikuly se nejčastěji nacházejí v blízkosti těchto lézí. Lze předpokládat, že tvorba lymfatických folikulů souvisí s poškozením kortikální tkáně nebo v něm hraje roli. Přítomnost folikulů také koreluje s růstem kortikální atrofie a ztrátou neuronů, astrocytů a oligodendrocytů [26].
Kontroverzní jsou názory na aktivaci B buněk v souvislosti s infekcí EBV. Někteří autoři potvrdili EBV+ B lymfocyty na meningách, jiní tyto nálezy zpochybnili [28,29]. Ať je to jakkoliv, role B lymfocytů v patologii kortikálních lézí je evidentní, což dokládá i pozitivní odpověď na terapii monoklonálními protilátkami namířenými proti povrchovým antigenům B buněk [30].
Zobrazovací metody
Vyšetření konvenčními MR technikami (T1W sekvence s použitím speciálního software) může být dostačující ke zjištění korové atrofie [31]. Ta je však patrná až při určitém stupni progrese choroby. Volumometrická analýza umožňuje stanovením mozkové parenchymální frakce určit stupeň atrofie, z důvodu vysokých nároků na přesnost měření je však nutné použít tenčí řezy. Stupeň atrofie určuje jak mozková parenchymální frakce (BPF), tak i procentuální úbytek mozkové tkáně. Hlavní přínos BPF je porovnatelnost již na počátku měření. U pacientů s RS byla nalezena korová atrofie už v časných fázích choroby, nezávisle na typu onemocnění [32–35]. V longitudinální studii bylo prezentováno, že u pacientů se stabilním klinicky izolovaným syndromem (CIS) se mozková atrofie v čase neměnila, ale u progresivních forem onemocnění postupně narůstala. V této studii bylo sledováno sedm pacientů s CIS, 36 nemocných s relaps-remitující RS (RR-RS), 27 pacientů se sekundárně progredující RS (SP-RS) a 17 zdravých kontrol. V porovnání s kontrolami byla atrofie šedé hmoty 3,4krát větší u pacientů s klinicky CIS, konvertujícího do RR-RS, u nemocných s SP-RS byla větší 14krát. Oproti tomu atrofie bílé hmoty byla konstantní ve všech fázích nemoci [36]. Atrofie sítnice měřená optickou koherenční tomografií velmi dobře koreluje s mozkovou atrofií a může být jejím prediktivním ukazatelem [37].
Ačkoliv průkaz korových lézí se významně zvýšil zavedením moderních histopatologických metod, při použití konvenční MR je jejich detekce jen velmi obtížná. Geurts et al studovali postmortálně u devíti případů chronické RS 49 vzorků mozku. Tkáňové řezy byly vyšetřeny porovnáním T2 váženého obrazu s 3D FLAIR sekvencemi. Léze byly označeny pomocí imunohistochemického stanovení bazického myeloproteinu a klasifikovány jako intrakortikální, smíšené, postihující subkortikální šeď, nebo BH. Vyšetřující neznali navzájem histopatologické a MR nálezy. Imunohistochemicky bylo prokázáno 70 lézí BH, osm lézí v oblasti podkorové šedi, 27 smíšených, a 63 čistě kortikálních. Na MR (T2SE) však bylo identifikováno pouze 3 % lézí intrakortikálně a při zobrazení FLAIR v 5 %. Smíšené léze byly prokazatelné na T2SE a 3D FLAIR (22, resp. 41 %). T2SE zobrazení ukázala 13 % lézí podkorových oproti 38 % na 3D FLAIR. 63 % lézí BH bylo zobrazeno na T2SE, na 3D FLAIR v 71 % [38]. Podobná studie byla publikována v letošním roce. Senzitivita post mortem verifikovaných korových lézí byla u 3D DIR 18 %, což je 1,6krát více než u 3D FLAIR sekvencí. Specificita byla 90 % [39].
U pacientů s RS se k průkazu kortikálních lézí ukázaly mnohem senzitivnější MR studie, používající kvantitativní techniky, zaměřené na „normálně vypadající“ mozkovou kůru [31]. Již počátkem 90. let minulého století byla zavedena do klinické praxe „Double Inversion Recovery“ (DIR), která umožnila větší rozlišení mezi bílou hmotou a mozkovou kůrou potlačením signálu bílé hmoty a likvoru (obr. 4) [40]. Teprve o 20 let později byla tato technika obohacena o 3D sekvence a umožnila zvýšení detekce korové patologie [41]. Klinicky relevantní abnormality v oblasti korové a podkorové šedi byly popsány i u zobrazení magnetizačním transferem (MTI), T1 relaxometrií, MR difuzí a protonovou magnetickou spektroskopii (MRS) [42].
Obr. 2. Sekvence DIR s patrnou lézí v oblasti bílé hmoty (MR dokumentace zapůjčena s laskavým svolením prof. MUDr. Zdeňka Seidla, CSc., MR odd. Radiodiagnostické kliniky 1. LF UK a VFN). 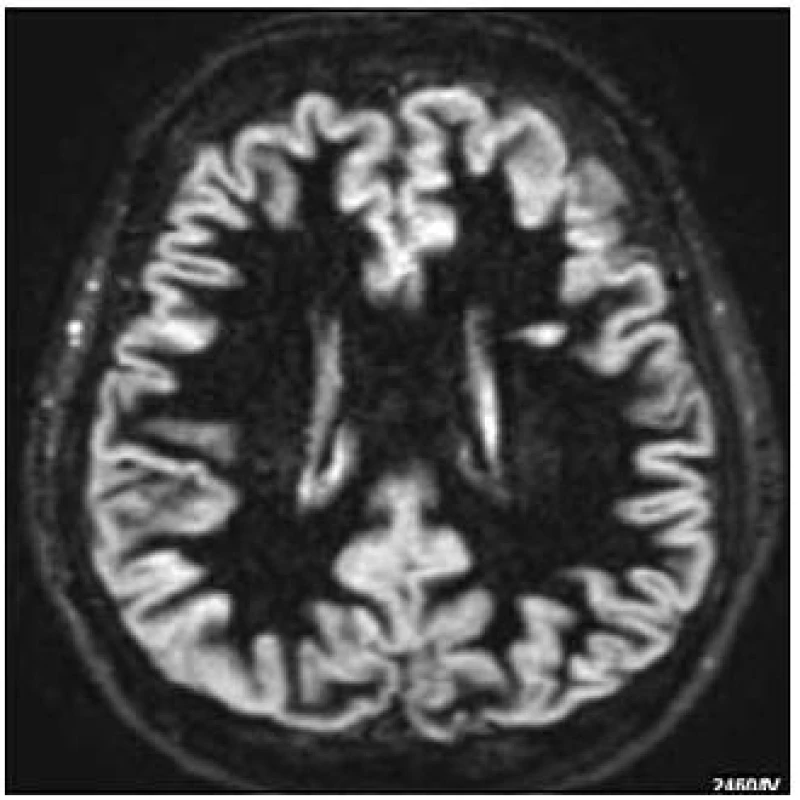
Longitudinální studie s pomocí DIR prokázaly, že léze v oblasti mozkové kůry jsou přítomny již v raných fázích onemocnění. Studie dále specifikovaly, že tyto léze jsou častější v sekundárně progresivní fázi RS, jsou častější u mužů a u pacientů s nálezem oligoklonálních pásů v likvoru [43–45]. Další zvýšení senzitivity detekce těchto lézí (t.č. spíše v experimentu) by mohlo přinést „ultra high-field“ MR v kombinaci s vyšetřením MR přístrojem o síle 7 Tesla [46]. V ČR, stejně jako ve světě jsou nejrozšířenější přístroje 1,5 T, kde u sekvence DIR jsou četné artefakty a nízký poměr signál-šum.
Původní nadšení z možnosti detekce kortikálních lézí pomocí sekvence DIR bylo vystřídáno realistickým pohledem na současné diagnostické možnosti. DIR je dosud vyhrazena pro výzkumné účely a v nejbližší době nelze očekávat její zavedení do rutinní praxe [47]. Detekce korových lézí je stále jen špičkou ledovce kortikální patologie u pacientů s RS [48]. Současné poznatky svědčí o tom, že srovnání dat jednotlivých studií je problematické. Zvýšení konzistence a sjednocení metodiky může zlepšit výtěžnost vyšetření [49].
MR ukázala, že demyelinizační léze je možné nalézt i v podkorových strukturách, jako jsou thalamus, hipokampus, nucleus caudatus, putamen, palidum, klaustrum, amygdala, hypothalamus a substancia nigra [42]. Řada prací prokázala atrofii thalamu u různých typů RS, dokonce u pacientů s CIS. Zajímavé je, že redukce objemu thalamu je větší u pacientů s RR fází onemocnění než u sekundární progrese. Longitudinální studie prokázaly, že u RR-RS se thalamická atrofie objevuje dříve než atrofie korová [50,51]. Recentní práce u většího počtu pacientů ukázala signifikantně větší atrofii podkorové šedi oproti mozkové kůře [52].
Predilekční lokalizací pro demyelinizaci podkorové šedi je hipokampus, přičemž strukturální změny s atrofií byly nalezeny u RR-RS v cornu amonis [53,54]. Řada abnormit byla nalezena při funkční MR (fMR). Např. u pacientů s atrofií hipokampu byly nalezeny funkční poruchy vedení vzruchů mezi hipokampem a gyrus cingulus anterior, thalamem a prefrontálním kortexem [55].
Korelace s klinickým nálezem
Jedním z časných klinických příznaků u RS je kognitivní porucha odpovídající kortikální atrofii. Poruchy kognitivních funkcí postihuje více než 40 % pacientů ve všech klinických fázích onemocnění [56]. Nejvíce bývají postiženy pozornost, recentní a dlouhodobá paměť, exekutivní funkce a vizuospaciální schopnosti [57]. Stupeň atrofie šedé hmoty koreluje s klinickými parametry lépe než postižení bílé hmoty [58,59]. Kognitivní deficit, jako jsou porucha paměti, nižší stupeň rychlosti zpracování informací a deficit pozornosti, vysvětlují lépe kortikální léze než léze subkortikální [59]. Izolovaná atrofie má významnou prediktivní hodnotu, protože pacienti s CIS dříve konvertují do klinicky definitivní RS [60].
U nemocných s kortikální patologií je pozorován častější výskyt depresivních poruch [61]. V tříleté longitudinální studii měli pacienti s epilepsií větší objem a počet korových lézí než pacienti bez záchvatů [62]. Onemocnění modifikující léky signifikantně snižují rozvoj nových lézí a progresi korové atrofie v porovnání s neléčenými pacienty. Výraznější efekt má subkutánně podávaný IFN beta-1a než IFN podávaný intramuskulárně nebo glatiramer acetát [63].
Atrofie thalamu byla spojena s kognitivní poruchou a únavou [64,65]. Snížený objem hipokampu koreluje nejen s poruchou kognitivních funkcí, ale i s depresivní symptomatologií [66].
Závěr
Významný pokrok histopatologických a zejména zobrazovacích technik přinesl nové poznatky o patologii mozkové kůry a podkorové šedi u nemocných s RS. Patologické změny jsou přítomny ve všech stadiích choroby, výrazněji v progresivních fázích nemoci. Důležitý se jeví poznatek, že korové patologické změny se mohou vyskytovat již v časných fázích nemoci a že dokonce mohou předcházet změnám v bílé hmotě. Ačkoliv jsou morfologické změny méně specifické, atrofie mozkové kůry silně koreluje s kognitivním deficitem, o něco méně pak s disabilitou. Korové patologické změny se objevují již v časných fázích onemocnění, kdy nemusí být výraznější postižení bílé hmoty. Kortikální léze jsou konvečními metodami MR obtížně detekovatelné, ale nové zobrazovací techniky, zejména DIR, vedou ke zlepšení rozpoznání těchto lézí. Atrofie thalamu a hipokampu významně koreluje. V současné době nejsou k dispozici jednotná kritéria pro sjednocení vyšetřovacích protokolů. DIR a další nové MR techniky jsou t.č. využívány výhradně pro výzkumné účely. Atrofie thalamu a hipokampu významně koreluje zejména s neuropsychologickými parametry. Lze si jen přát, aby došlo v co nejbližší době k možnosti přenést teoretické poznatky do klinické praxe.
MUDr. Jiří Piťha
MS centrum při neurologickém oddělení
Krajská zdravotní, a.s. – Nemocnice Teplice o.z.
Duchcovská 53
415 29 Teplice
e-mail: pithaj@seznam.cz
Přijato k recenzi: 3. 1. 2012
Přijato do tisku: 2. 5. 2012
Vzniklo za podpory VZ MŠM 0021620849 a PRVOUK-P26/LF1/4.
Zdroje
1. Noseworthy JH, Lucchinetti C, Rodriguez M, Weinshenker BG. Multiple sclerosis. N Engl J Med 2000; 343(13): 938–952.
2. Moll NM, Rietsch AM, Thomas S, Ransohoff AJ, Lee JC, Fox R et al. Multiple sclerosis normal-appearing white matter: pathology-imaging correlations. Ann Neurol 2011; 70(5): 764–773.
3. Dawson JW. The Histology of Multiple Sclerosis. Trans R Soc Edinburgh 1916; 50 : 517–740.
4. Kidd D, Barkhof F, McConnell R, Algra PR, Allen IV, Revesz T. Cortical lesions in multiple sclerosis. Brain 1999; 122 (Pt 1): 17–26.
5. Newcombe J, Hawkins CP, Henderson CL, Patel HA, Woodroofe MN, Hayes GM et al. Histopathology of multiple sclerosis lesions detected by magnetic resonance imaging in unfixed postmortem central nervous system tissue. Brain 1991; 114 (Pt 2): 1013–1023.
6. Boggild MD, Williams R, Haq N, Hawkins C. Cortical plaques visualised by fluid-attenuated inversion recovery imaging in relapsing multiple sclerosis. Neuroradiology 1996; 38 (Suppl 1): S10–S13.
7. Fisniku LK, Chard DT, Jackson JS, Anderson VM, Altmann DR, Miszkiel KA et al. Gray matter atrophy is related to long-term disability in multiple sclerosis. Ann Neurol 2008; 64(3): 247–254.
8. Fisher E, Lee JC, Nakamura K, Rudick RA. Gray matter atrophy in multiple sclerosis: a longitudinal study. Ann Neurol 2008; 64(3): 255–265.
9. Rudick RA, Lee JC, Nakamura K, Fisher E. Gray matter atrophy correlates with MS disability progression measured with MSFC but not EDSS. J Neurol Sci 2009; 282(1–2): 106–111.
10. Papadopoulos D, Dukes S, Patel R, Nicholas R, Vora A, Reynolds R. Substantial archaeocortical atrophy and neuronal loss in multiple sclerosis. Brain Pathol 2009; 19(2): 238–253.
11. Bö L, Geurts JJ, van der Valk P, Polman C, Barkhof F. Lack of correlation between cortical demyelination and white matter pathologic changes in multiple sclerosis. Arch Neurol 2007; 64(1): 76–80.
12. Kutzelnigg A, Lucchinetti CF, Stadelmann C, Brück W, Rauschka H, Bergmann M et al. Cortical demyelination and diffuse white matter injury in multiple sclerosis. Brain 2005; 128 (Pt 11): 2705–2712.
13. Bö L, Vedeler CA, Nyland HI, Trapp BD, Mörk SJ. Subpial demyelination in the cerebral cortex of multiple sclerosis patients. J Neuropathol Exp Neurol 2003; 62(7): 723–732.
14. Peterson JW, Bö L, Mörk S, Chang A, Trapp BD. Transected neurites, apoptotic neurons, and reduced inflammation in cortical multiple sclerosis lesions. Ann Neurol 2001; 50(3): 389–400.
15. Calabrese M, Filippi M, Gallo P. Cortical lesions in multiple sclerosis. Nat Rev Neurol 2010; 6(8): 438–444.
16. van Horssen J, Brink BP, de Vries HE, van der Valk P, Bö L. The blood-brain barrier in cortical multiple sclerosis lesions. J Neuropathol Exp Neurol 2007; 66(4): 321–328.
17. Vercellino M, Masera S, Lorenzatti M, Condello C, Merola A, Mattioda A et al. Demyelination, inflammation, and neurodegeneration in multiple sclerosis deep gray matter. J Neuropathol Exp Neurol 2009; 68(5): 489–502.
18. Torkildsen O, Stansberg C, Angelskår SM, Kooi EJ, Geurts JJ, van der Valk P et al. Upregulation of immunoglobulin-related genes in cortical sections from multiple sclerosis patients. Brain Pathol 2010; 20(4): 720–729.
19. Popescu BF, Bunyan RF, Parisi JE, Ransohoff RM, Lucchinetti CF. A case of multiple sclerosis presenting with inflammatory cortical demyelination. Neurology 2011; 76(20): 1705–1710.
20. Lucchinetti CF, Popescu BF, Bunyan RF, Moll NM, Roemer SF, Lassmann H et al. Inflammatory cortical demyelination in early multiple sclerosis. N Engl J Med 2011; 365(23): 2188–2197.
21. Magliozzi R, Howell O, Vora A, Serafini B, Nicholas R, Puopolo et al. Meningeal B-cell follicles in secondary progressive multiple sclerosis associate with early onset of disease and severe cortical pathology. Brain 2007; 130 (Pt 4): 1089–1104.
22. Howell OW, Reeves CA, Nicholas R, Carassiti D, Radotra B, Gentleman SM et al. Meningeal inflammation is widespread and linked to cortical pathology in multiple sclerosis. Brain 2011; 134 (Pt 9): 2755–2771.
23. Le Panse R, Bismuth J, Cizeron-Clairac G, Weiss JM, Cufi P, Dartevelle P et al. Thymic remodeling associated with hyperplasia in myasthenia gravis. Autoimmunity 2010; 43(5–6): 401–412.
24. Weyland CM, Kurtin PJ, Goronzy JJ. Ectopic lymphoid organogenesis: a fast track for autoimmunity. Am J Pathol 2001; 159(3): 787–793.
25. Aloisi F, Pujol-Borrell R. Lymphoid neogenesis in chronic inflammatory diseases. Nat Rev Immunol 2006; 6(3): 205–217.
26. Magliozzi R, Howell OW, Reeves C, Roncaroli F, Nicholas R, Serafini B et al. A Gradient of neuronal loss and meningeal inflammation in multiple sclerosis. Ann Neurol 2010; 68(4): 477–493.
27. Frischer JM, Bramow S, Dal-Bianco A, Lucchinetti CF, Rauschka H, Schmidbauer M et al. The relation between inflammation and neurodegeneration in multiple sclerosis brains. Brain 2009; 132 (Pt 5): 1175–1189.
28. Serafini B, Rosicarelli B, Franciotta D, Magliozzi R, Reynolds R, Cinque P et al. Dysregulated Epstein--Barr virus infection in the multiple sclerosis brain. J Exp Med 2007; 204(12): 2899–2912.
29. Sargsyan SA, Owens GP, Gilden DH, Bennett JL, Shearer AJ, Ritchie AM et al. Absence of Epstein-Barr virus in the brain and CSF of patients with multiple sclerosis. Neurology 2010; 74(14): 1127–1135.
30. He D, Zhou H, Han W, Zhang S. Rituximab for relapsing-remitting multiple sclerosis. Cochrane Database Syst Rev 2011; 12: CD009130.
31. Miller DH, Barkhof F, Frank JA, Parker GJ, Thompson AJ. Measurement of atrophy in multiple sclerosis: pathological basis, methodological aspects and clinical relevance. Brain 2002; 125 (Pt 8): 1676–1695.
32. Calabrese M, Atzori M, Bernardi V, Morra A, Romualdi C, Rinaldi L et al. Cortical atrophy is relevant in multiple sclerosis at clinical onset. J Neurol 2007; 254(9): 1212–1220.
33. Sastre-Garriga J, Ingle GT, Chard DT, Cercignani M, Ramió-Torrentà L, Miller DH et al. Grey and white matter volume changes in early primary progressive multiple sclerosis: a longitudinal study. Brain 2005; 128 (Pt 6): 1454–1460.
34. Roosendaal SD, Bendfeldt K, Vrenken H, Polman CH, Borgwardt S, Radue EW et al. Grey matter volume in a large cohort of MS patients: relation to MRI parameters and disability. Mult Scler 2011; 17(9): 1098–1106.
35. Dalton CM, Chard DT, Davies GR, Miszkiel KA, Altmann DR, Fernando K et al. Early development of multiple sclerosis is associated with progressive grey matter atrophy in patients presenting with clinically isolated syndromes. Brain 2004; 127 (Pt 5): 1101–1107.
36. Fisher E, Lee JC, Nakamura K, Rudick RA. Gray matter atrophy in multiple sclerosis: a longitudinal study. Ann Neurol 2008; 64(3): 255–265.
37. Frohman EM, Dwyer MG, Frohman T, Cox JL, Salter A, Greenberg BM et al. Relationship of optic nerve and brain conventional and non-conventional MRI measures and retinal nerve fiber layer thickness, as assessed by OCT and GDx: a pilot study. J Neurol Sci 2009; 282(1–2): 96–105.
38. Geurts JJ, Bö L, Pouwels PJ, Castelijns JA, Polman CH, Barkhof F. Cortical lesions in multiple sclerosis: combined postmortem MR imaging and histopathology. AJNR Am J Neuroradiol 2005; 26(3): 572–577.
39. Seewann A, Kooi EJ, Roosendaal SD, Pouwels PJ, Wattjes MP, van der Valk P et al. Postmortem verification of MS cortical lesion detection with 3D DIR. Neurology 2012; 78(5): 302–308.
40. Redpath TW, Smith FW. Technical note: use of a double inversion recovery pulse sequence to image selectively grey or white brain matter. Br J Radiol 1994; 67(804): 1258–1263.
41. Simon B, Schmidt S, Lukas C, Gieseke J, Träber F, Knol DL et al. Improved in vivo detection of cortical lesions in multiple sclerosis using double inversion recovery MR imaging at 3 Tesla. Eur Radiol 2010; 20(7): 1675–1683.
42. Hulst HE, Geurts JJ. Gray matter imaging in multiple sclerosis: what have we learned? BCM Neurol 2011; 11 : 153.
43. Calabrese M, Filippi M, Rovaris M, Bernardi V, Atzori M, Mattisi I et al. Evidence for relative cortical sparing in benign multiple sclerosis: a longitudinal magnetic resonance imaging study. Mult Scler 2009; 15(1): 36–41.
44. Calabrese M, Rocca MA, Atzori M, Mattisi I, Favaretto A, Perini P et al. A 3-year magnetic resonance imaging study of cortical lesions in relapse-onset multiple sclerosis. Ann Neurol 2010; 67(3): 376–383.
45. Calabrese M, De Stefano N, Atzori M, Bernardi V, Mattisi I, Barachino L et al. Detection of cortical inflammatory lesions by double inversion recovery magnetic resonance imaging in patients with multiple sclerosis. Arch Neurol 2007; 64(10): 1416–1422.
46. Metcalf M, Xu D, Okuda DT, Carvajal L, Srinivasan R, Kelley DA et al. High-resolution phased-array MRI of the human brain at 7 tesla: initial experience in multiple sclerosis patients. J Neuroimaging 2010; 20(2): 141–147.
47. Ciccarelly O, Chen JT. MS cortical lesions on double inversion recovery MRI: few but true. Neurology 2012; 78(5): 296–297.
48. Seewann A, Vrenken H, Kooi EJ, van der Valk P, Knol DL, Polman CH et al. Imaging the tip of the iceberg: visualization of cortical lesions in multiple sclerosis. Mult Scler 2011; 17(10): 1202–1210.
49. Geurts JJ, Roosendaal SD, Calabrese M, Circcarelli O, Agosta F, Chard DT et al. Consensus recommendations for MS cortical lesion scoring using double inversion recovery MRI. Neurology 2011; 76(5): 418–424.
50. Ramasamy DP, Benedict RH, Cox JL, Fritz D, Abdelrahman N, Hussein S et al. Extent of cerebellum, subcortical and cortical atrophy in patients with MS: a case-control study. J Neurol Sci 2009; 282(1–2): 47–54.
51. Rocca MA, Mesaros S, Pagani E, Sormani MP, Comi G, Filippi M. Thalamic damage and long-term progression of disability in multiple sclerosis. Radiology 2010; 257(2): 463–469.
52. Bergsland N, Horakova D, Dwyer MG, Dolezal O, Seidl ZK, Vaneckova M et al. Subcortical and cortical gray matter atrophy in a large sample of patients with clinically isolated syndrome and early relapsing-remitting multiple sclerosis. AJNR Am J Neuroradiol 2012; 33(8): 1573–1578.
53. Geurts JJ, Bö L, Roosendaal SD, Hazes T, Daniëls R, Barkhof F et al. Extensive hippocampal demyelination in multiple sclerosis. J Neuropathol Exp Neurol 2007; 66(9): 819–827.
54. Sicotte NL, Kern KC, Giesser BS, Arshanapalli A, Schultz A, Montag M et al. Regional hippocampal atrophy in multiple sclerosis. Brain 2008; 131 (Pt 4): 1134–1141.
55. Roosendaal SD, Hulst HE, Vrenken H, Feenstra HE, Castelijns JA, Pouwels PJ et al. Structural and functional hippocampal changes in multiple sclerosis patients with intact memory function. Radiology 2010; 255(2): 595–604.
56. Patti F. Cognitive impairment in multiple sclerosis. Mult Scler 2009; 15(1): 2–8.
57. Chiaravalloti ND, DeLuca J. Cognitive impairment in multiple sclerosis. Lancet Neurol 2008; 7(12): 1139–1151.
58. Tedeschi G, Lavorgna L, Russo P, Prinster A, Dinacci D, Savettieri G et al. Brain atrophy and lesion load in a large population of patients with multiple sclerosis. Neurology 2005; 65(2): 280–285.
59. Calabrese M, Rinaldi F, Grossi P, Gallo P. Cortical pathology and cognitive impairment in multiple sclerosis. Expert Rev Neurother 2011; 11(3): 425–432.
60. Calabrese M, Rinaldi F, Mattisi I, Bernardi V, Favaretto A, Perini P et al. The predictive value of gray matter atrophy in clinically isolated syndromes. Neurology 2011; 77(3): 257–263.
61. Feinstein A, Roy P, Lobaugh N, Feinstein K, O’Connor P, Black S. Structural brain abnormalities in multiple sclerosis patients with major depression. Neurology 2004; 62(4): 586–590.
62. Calabrese M, Grossi P, Favaretto A, Romualdi C, Atzori M, Rinaldi F et al. Cortical pathology in multiple sclerosis patients with epilepsy: a 3 year longitudinal study. J Neurol Neurosurg Psychiatry 2012; 83(1): 49–54.
63. Calabrese M, Bernardi V, Atzori M, Mattisi I, Favaretto A, Rinaldi F et al. Effect of disease-modifying drugs on cortical lesions and atrophy in relapsing-remitting multiple sclerosis. Mult Scler 2012; 18(4): 418–424.
64. Houtchens MK, Benedict RH, Killiany R, Sharma J, Jaisani Z, Singh B et al Thalamic atrophy and cognition in multiple sclerosis. Neurology 2007; 69(12): 1213–1223.
65. Calabrese M, Rinaldi F, Grossi P, Mattisi I, Bernardi V, Favaretto A et al. Basal ganglia and frontal/parietal cortical atrophy is associated with fatigue in relapsing-remitting multiple sclerosis. Mult Scler 2010; 16(10): 1220–1228.
66. Kiy G, Lehmann P, Hahn HK, Eling P, Kastrup A, Hildebrandt H. Decreased hippocampal volume, indirectly measured, is associated with depressive symptoms and consolidation deficits in multiple sclerosis. Mult Scler 2011; 17(9): 1088–1097.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek CENS Praha 2012Článek Prediktory symptomatického intracerebrálního krvácení po systémové trombolýze mozkového infarktuČlánek Rekurentní analýza variability srdeční frekvence v časné diagnostice diabetické autonomní neuropatieČlánek Měření atrofie corpus callosum a porovnání s ostatními metodami monitorace roztroušené sklerózyČlánek Kongenitální myastenie jako příčina respiračního selhání u dvou kojenců a batolete – kazuistikyČlánek Webové okénkoČlánek Analýza dat v neurologii: XXXVI. Hodnocení statistické významnosti poměru šancí a relativního rizikaČlánek Pít, či nepít?Článek Spinální kongres
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2012 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Endovaskulární léčba ischemické cévní mozkové příhody
- Kortikální patologie u roztroušené sklerózy – morfologické, imunopatologické a klinické souvislosti
- Fázový model neurorehabilitace
- Vztah vaskulárních rizikových faktorů a Alzheimerovy choroby
- Epidemie roztroušené sklerózy ve světě?
- Laboratorní preparace drah z mediálního pohledu na mozkovou hemisféru
- Prediktory symptomatického intracerebrálního krvácení po systémové trombolýze mozkového infarktu
- Rekurentní analýza variability srdeční frekvence v časné diagnostice diabetické autonomní neuropatie
- Molekulárně genetická analýza tkáně plodu rodiny postižené myotonickou dystrofií
- Opakovaná víceetážová aplikace botulinum toxinu A dlouhodobě zabraňuje zhoršení chůze u dětí s dětskou mozkovou obrnou
- Měření atrofie corpus callosum a porovnání s ostatními metodami monitorace roztroušené sklerózy
- Výskyt epileptického záchvatu pri intraoperatívnej stimulácii mozgu – naše skúsenosti
- Papilární nádor pineální oblasti u dítěte – kazuistika
- Kongenitální myastenie jako příčina respiračního selhání u dvou kojenců a batolete – kazuistiky
- Webové okénko
- Analýza dat v neurologii: XXXVI. Hodnocení statistické významnosti poměru šancí a relativního rizika
- CENS Praha 2012
- Prof. MUDr. Zdeněk Lukáš, CSc. (1934–2012)
- Pít, či nepít?
- Spinální kongres
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Epidemie roztroušené sklerózy ve světě?
- Spinální kongres
- Kortikální patologie u roztroušené sklerózy – morfologické, imunopatologické a klinické souvislosti
- Fázový model neurorehabilitace
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



