-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Diagnostické možnosti zobrazovacích metod v hodnocení morfologického korelátu kognitivních změn u pacientů s roztroušenou sklerózou
Imaging Techniques to Evaluate Morphological Correlates of Cognitive Dysfunction in Multiple Sclerosis Patients
Cognitive dysfunction in patients with multiple sclerosis is quite common and has a great impact on the quality of patient’s social and professional life. High frequency and severity of these symptoms encourage objectivization of their morphological correlates. Besides the conventional magnetic resonance imaging techniques, commonly used for the disease diagnostics and activity monitoring, alternative procedures, such as magnetization transfer imaging, functional magnetic resonance, MR spectroscopy or diffusion tensor imaging, are also available. The use of the majority of these techniques is currently rather experimental and their practical application is under intensive investigation.
Key words:
multiple sclerosis – cognitive dysfunction – magnetic resonance – magnetization transfer – functional magnetic resonance – diffusion tensor imaging – spectroscopy – positron emission tomography
Autoři: I. Obhlídalová 1; M. Keřkovský2ihash2ihash4 ,3 ,3 ,3
Působiště autorů: Neurologická klinika LF MU a FN Brno 1; Radiologická klinika LF MU a FN Brno 2; CEITEC – Středoevropský technologický institut, MU, Brno 3
Vyšlo v časopise: Cesk Slov Neurol N 2012; 75/108(2): 170-178
Kategorie: Přehledný referát
Souhrn
Kognitivní dysfunkce jsou u pacientů s roztroušenou sklerózou časté a ovlivňují jejich kvalitu života, včetně pracovního uplatnění. Vysoká frekvence a závažnost těchto symptomů vedla ke snaze o objektivizaci jejich morfologického korelátu. Kromě konvenčních technik magnetické rezonance (MR) běžně používaných k diagnostice a monitorování průběhu choroby se uplatnily i techniky nekonvenční, např. magnetizační transfer, funkční magnetická rezonance, spektroskopie či zobrazení tenzorů difuze. Většina těchto metod je zatím využívána pouze experimentálně a jejich praktický přínos je předmětem intenzivního výzkumu.
Klíčová slova:
roztroušená skleróza – kognitivní deficit – magnetická rezonance – magnetizační transfer – funkční magnetická rezonance – zobrazení tenzorů difuze – spektroskopie – pozitronová emisní tomografieÚvod
Problematika neuropsychologických změn u pacientů s roztroušenou sklerózou (RS) je v posledních letech velmi často diskutovaným tématem. Dlouhou dobu byly přisuzovány pouze projevům pozdních stadií RS. Hlavní důraz při hodnocení funkčního stavu pacienta byl kladen na poruchy hybnosti, především chůze, bez ohledu na přítomnost deprese či poruch pozornosti, které často subjektivně tíží pacienta více a zhoršují jeho kvalitu života. Při hlubším a podrobnějším vyšetření můžeme odhalit poruchy v oblasti paměti, pozornosti, inteligence, vizuoprostorové orientace či rozhodovacích schopností i u pacientů bez hybného postižení. Mnoho studií prokázalo, že tyto změny jsou přítomny již u pacientů s recentně diagnostikovanou RS nebo dokonce i u pacientů s klinickým izolovaným syndromem (CIS), kde je kognitivní deficit popisován až v 5 % [1].
V průběhu let bylo vyvinuto nespočet neuropsychologických škál úzce zaměřených na jednotlivé aspekty kognice či na přítomnost deprese. K hodnocení kognitivního deficitu u RS patří mezi nejčastěji používaný test PASAT (Paced Auditory Serial Addition Test) hodnotící rychlost zpracování sluchových informací, flexibitu a tenacitu pozornosti, COWAT (Controlled Oral Word Association Test) využívaný k vyšetření verbální fluence a SDMT (Symbol Digit Modalities Test) testující psychomotorické tempo a pracovní paměť. Běžný ambulantní styk neurologa s pacientem ale kompletní neuropsychologické vyšetření svou časovou ani odbornou náročností nedovoluje. To vedlo k vytvoření několika krátkých, na provedení nenáročných baterií testů zaměřujících se na oblasti kognice nejčastěji postižené u pacientů s RS. Je to například Brief Repeatable Battery of Neuropsychological Tests in MS (BRB-N), Multiple Sclerosis Neuropsychological Screening Questionare (MSNQ) nebo Minimal Assessment of Cognitive Function in Multiple Sclerosis (MACFIMS), které jsou velmi spolehlivé, snadno reprodukovatelné [2], a tedy dobře využitelné v běžné ambulantní praxi. Nenahrazují samozřejmě kompletní neuropsychologické vyšetření, ale mohou napomoci včasnému záchytu pacientů s kognitivním deficitem. Česká validace dotazníků ovšem neexistuje. Pro objasnění patofyziologie a případně i predikci rozvoje těchto poruch má podstatný význam nalezení vhodných strukturálních korelátů pomocí zobrazovacích metod, a tato oblast je proto aktuálně předmětem intenzivního výzkumu.
Kognitivní deficit u RS
Porucha kognitivních funkcí vzniká u přibližně 43–65 % pacientů s RS [3]. V patogenezi kognitivní dysfunkce u RS hraje velkou roli postižení bílé hmoty, čímž se toto onemocnění zásadně liší od kortikálních demencí např. Alzheimerova typu. Tato skutečnost také podmiňuje obtížnou predikovatelnost průběhu a vývoje kognitivního deficitu u pacientů s RS. Zatímco u demencí kortikálních následuje kognitivní deficit určitý vzorec daný postižením jednotlivých korových center, u RS je distribuce demyelinizačních lézí náhodná. Vývoj neuropsychologických symptomů je tedy u pacientů s RS velmi individuální, nezávislý na délce onemocnění či hybném postižení [4,5]. Někteří autoři předpokládali, že kognitivní deficit u RS je formou subkortikální demence vzniklé na podkladě přerušení kortiko-subkortikálních okruhů spojujících kůru frontálních laloků s thalamem a bazálními ganglii [6,7]. Podle Beattyho studie [8] mělo průběh typický pro subkortikální demenci pouhých 12 % pacientů. Jiný model předpokládá vznik kognitivní dysfunkce na podkladě postižení bílé hmoty přerušením intra - a interhemisferické komunikace. Tuto hypotézu podporuje i skutečnost, že iniciálně bývají poškozeny funkce vyžadující integraci více mozkových center, jako např. vizuální a verbální paměť, exekutivní funkce a pozornost [9–11], zatímco specifické funkce, jako vizuoprostorová orientace a jazykové dovednosti, podmíněné dominantně intaktní funkcí jednoho specifického korového centra, zůstávají dlouho ušetřeny [12].
Zobrazovací metody a kognitivní deficit u RS
Klíčovou zobrazovací metodou využívanou při hodnocení korelátu neuropsychologických změn u RS je magnetická rezonance (MR). Její nespornou výhodou je snadná dostupnost vyšetření, vysoká senzitivita, možnost opakování vyšetření bez rizika pro pacienta, a tím i možnost použití v longitudinálním sledování [13]. Vyšetření pomocí konvenční MR má ale svá omezení, a to především možnost hodnocení pouze viditelných demyelinizačních změn, zatímco ty lidským okem nerozlišitelné, neboli takzvaná „normálně vypadající mozková tkáň“ (Normal Apparent Brain Tissue, NABT), zůstávají opomíjeny. Další limitace vyplývá z nemožnosti rozeznat léze způsobené demyelinizací při RS a demyelinizací při jiných onemocněních, např. u dalších autoimunitních zánětlivých chorob nebo změn v rámci cerebrovaskulárních chorob (obr. 1, 2) [14–16].
Obr. 1. T2 TSE, ložisko v zadní jámě lební v typické oblasti pravého mozečkového pedunklu. 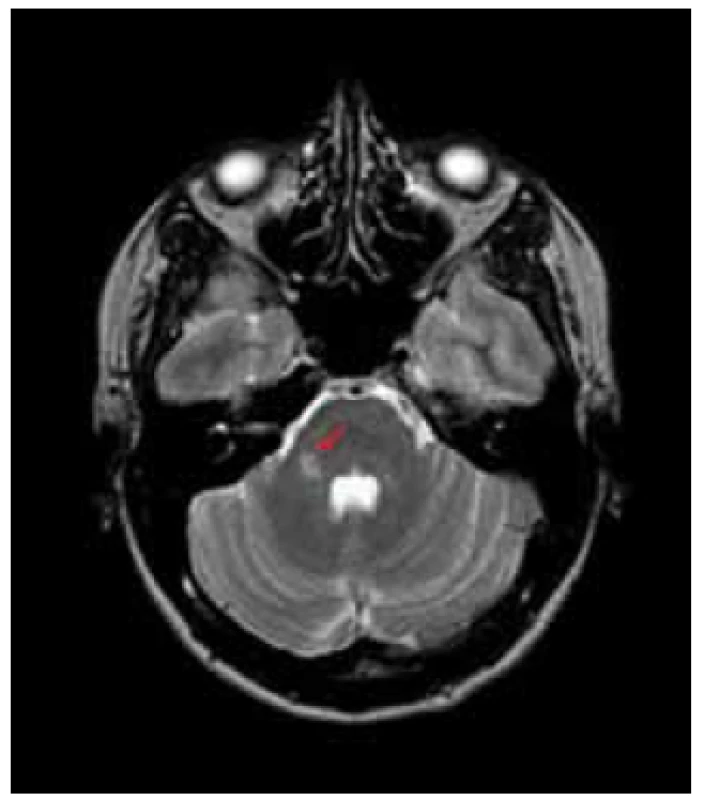
Obr. 2. T2 TSE, ložiska frontálně periventrikulárně, jedno objemnější až tumoriformního vzhledu. 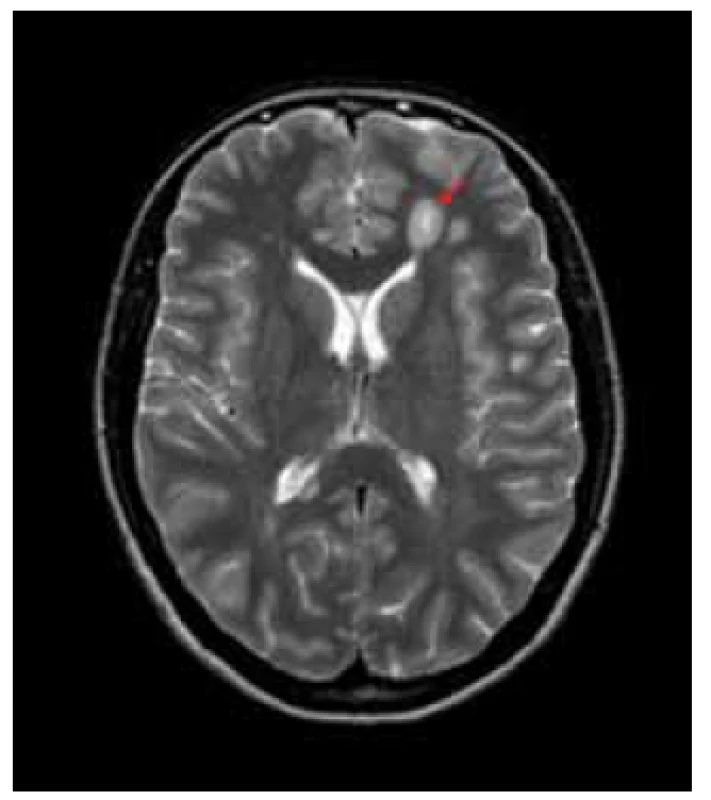
Zacílení zobrazovacích metod použitých ve studiích zaměřených na mozkové struktury potenciálně odpovědné za vznik neuropsychologických symptomů se dá rozdělit do tří hlavních skupin: hodnocení ložiskových lézí RS v bílé a šedé hmotě mozkové, hodnocení atrofie mozkové a hodnocení normálně vypadající mozkové tkáně.
1. Hodnocení lézí RS v bílé a šedé hmotě mozkové
Hodnocení lézí v bílé a šedé hmotě mozkové pomocí MR je jednou z nejčastěji využívaných metod při hledání MR korelátu neuropsychologických změn. Při stanovení velikosti lézí, případně jejich celkového objemu, jsou využívány dva způsoby detekce, a to zcela automatizovaný a manuální, případně jejich kombinace (obr. 3) [17]. Jejich srovnání v oblasti přesnosti, časové náročnosti a variabilitě bylo věnováno několik studií [18–20]. Rozsah postižení bílé hmoty velmi dobře koreluje se sníženým výkonem v neuropsychologických testech, zaměřených především na exekutivní funkce a pozornost, a to dokonce lépe než s fyzickým postižením [21,22]. Výsledný celkový objem lézí se zdá být velmi dobrým prediktorem kognitivní dysfunkce u pacientů s EDSS (Expanded Disability Status Scale) nad 3,5 [23]. Signifikantně koreluje s mnoha subtypy kognitivních deficitů, např. s verbální a nonverbální pamětí a jazykovými dovednostmi. Zvláštní pozornost je věnována tzv. black holes, neboli hypointenzitním lézím bílé hmoty detekovaným na T1 vážených spin echových MR obrazech. Tyto léze odpovídají oblastem mozku, kde došlo k nevratné ztrátě nervové tkáně. Jejich objem je velmi dobrým korelátem celkové disability a nárůst jejich objemu značí progresi choroby [24,25]. Výsledky studií zaměřených na kognici a celkový objem T1 lézí jsou ale různé [26,27].
Obr. 3. FLAIR VISTA, vícečetná periventrikulární ložiska. 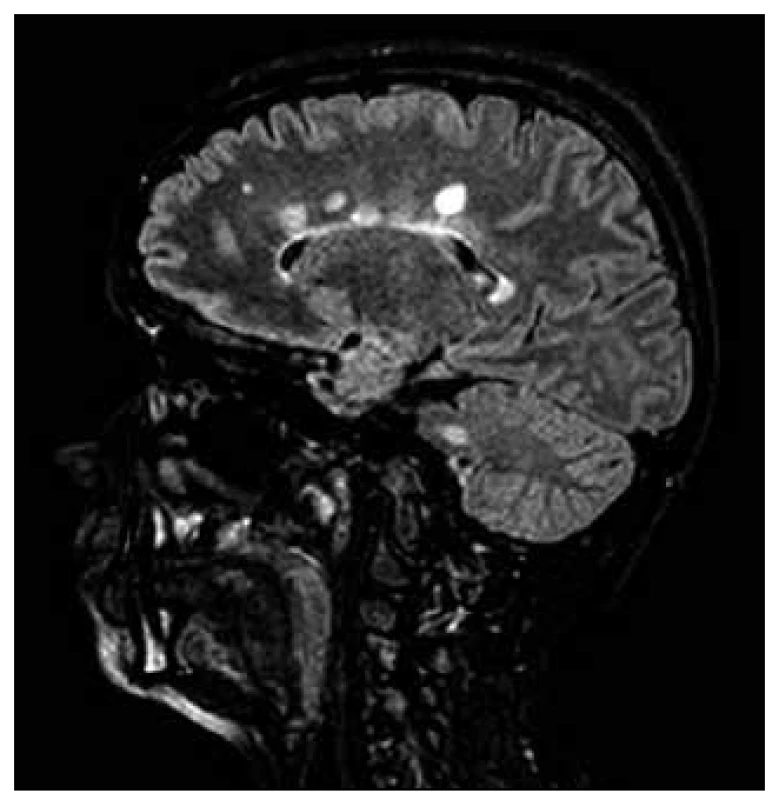
Další možností využití konvenční MR je měření velikosti a objemu mozkových lézí v konkrétních oblastech mozku. Jednou z nejčastěji studovaných oblastí je corpus callosum, které hraje roli anatomické spojky mezi hemisférami, a je tedy významné pro již zmiňovanou konektivitu mozku. S postižením corpus callosum nejvíce souvisí zpomalení psychomotorického tempa a obtíže při strukturovaném řešení problémů [28]. Poruchy verbální fluence jsou asociovány s poškozením přední části kalózního tělesa [29]. Podobnou roli jako corpus callosum má periventrikulární oblast. Léze v této oblasti ale často splývají a jejich přesná anatomická lokalizace bývá obtížná. Postižení frontálních laloků se jeví jako dobrý prediktor zhoršení exekutivních funkcí [21], abstraktního řešení problémů, pracovní paměti a verbální fluence [22], postižení levé parietookcipitální oblasti koreluje s poruchami verbálního učení a zrakově konstrukčních dovedností [30]. Některé studie však souvislost mezi rozsahem postižení mozku, lokalizací mozkových lézí a tíží kognitivního deficitu neprokázaly [31].
RS byla považována především za chorobu bílé hmoty mozkové. Brownell a Hughes [32] však popsali, že 26 % demyelinizačních lézí vzniká mimo bílou hmotu, a to v 17 % v juxtakortikální bílé hmotě, v 4 % v centrální šedé hmotě a v 5 % přímo v kortexu. I další studie potvrdila vznik kortikálních lézí především v oblasti kortiko-subkortikální junkce [33,34]. Tyto léze jsou obtížně detekovatelné na konvenčních spinechových MR sekvencích, což je způsobeno větší buněčnou hustotou, která nedovoluje vzniku mezibuněčného edému, jako je tomu v lézích v bílé hmotě. Tím se stávají pro klasické spinové echo v T1, T2 nebo PD vážení neviditelnými. Ve FLAIR (FLuid Attenuated Inversion Recovery) sekvencích je potlačen rušivý signál vody obsažené v mozkomíšním moku pomocí zařazení inverzního prepulzu. Tato metoda proto výrazně zlepšila detekci periventrikulárních a kortikálních lézí (obr. 4, 5) [35–37].
Obr. 4. FLAIR VISTA, subkortikální ložisko. 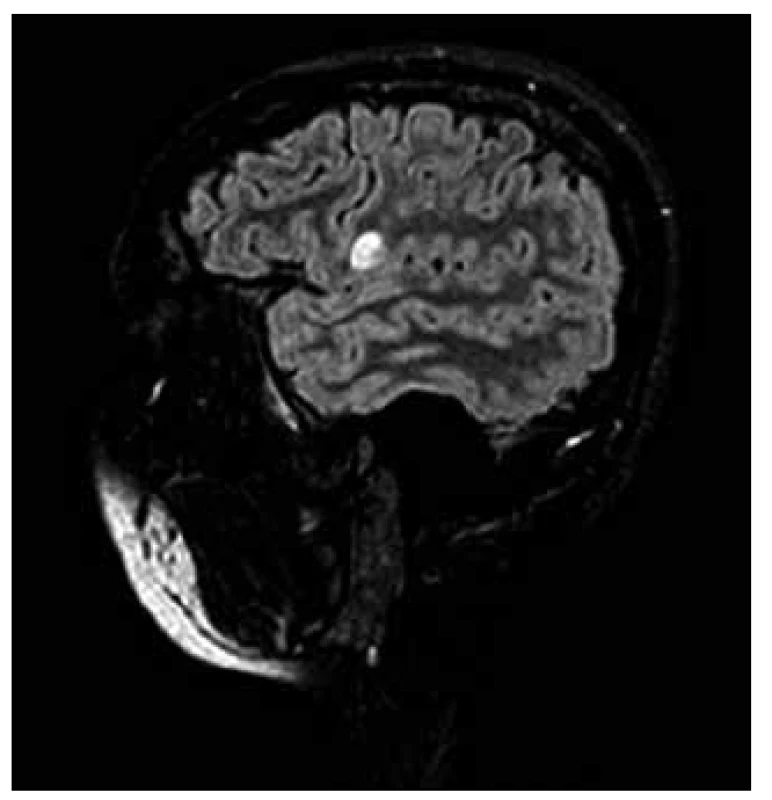
Obr. 5. Červeně označená léze roztroušené sklerózy v různých MR sekvencích a jejich hodnocení pomocí programu SepINRIA (SepINRIA je volně dostupný software určený k analýze MR mozku pacientů s roztroušenou sklerózou s možností 2D a 3D zobrazení, kvantitativního manuálního či automatického hodnocení objemu a počtu lézí) [20]. ![Červeně označená léze roztroušené sklerózy v různých MR sekvencích a jejich hodnocení pomocí programu SepINRIA (SepINRIA je volně dostupný software určený k analýze MR mozku pacientů s roztroušenou sklerózou s možností 2D a 3D zobrazení, kvantitativního manuálního či automatického hodnocení objemu a počtu lézí) [20].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/bcb16066ec7c3511ea05d10686f35c54.png)
V některých studiích bylo využito pokročilých MR technik jako je „Double Inversion Recovery“ (DIR) [38,39] nebo ještě přesnější techniky kombinující DIR s T1 váženými „Phase-Sensitive Inversion Recovery“ (PSIR) sekvencemi [40]. Ty umožnily dokonalejší zobrazení hranice mezi šedou a bílou hmotou, a tím odlišení lézí intrakortikálních, juxtakortikálních a lézí smíšených (white-gray matter lesions). Kortikální léze detekovatelné pomocí těchto pokročilých MR technik jsou pak podle některých studií velmi dobrým prediktorem kognitivního deficitu [41–43].
Pro bližší studium mikrostruktury kortikálních lézí lze využít zobrazování tenzorů difuze (Diffusion Tensor Imaging) (viz dále) [44]. Velmi zajímavým zjištěním v této studii byl nález vzrůstající frakční anizotropie přímo v lézích šedé hmoty, což je jev přesně opačný, než ke kterému dochází v lézích hmoty bílé. Tento jev se dá vysvětlit ztrátou neuritů, axonů, dendritických zakončení a glií, což zvyšuje koherenci tkáně.
Je pravděpodobné, že velké množství kortikálních a subkortikálních lézí je odpovědných za kognitivní deficit, přesto se však výsledky studií liší. Pravé korové příznaky u RS jsou vzácné, popsáno bylo několik kazuistik [45–47].
2. Hodnocení atrofie mozkové
Míra atrofie mozkové se jeví jako velmi dobrý korelát kognitivního deficitu. Ačkoli jde o vyšetření velmi nespecifické, jeho výhodou je schopnost měřit úbytek mozkové tkáně bez ohledu na to, zda jsou to změny v již detekovatelných lézích či v normálně vypadající mozkové tkáni. Atrofie mozku je tudíž globálním markerem patologických změn probíhajících při RS. Jejich podkladem je poškození myelinu, axonální ztráta při zánětu přímo v lézích následovaná Wallerovou degenerací a postinflamatorní neurodegenerací v souvisejících mozkových drahách [48]. Bylo prokázáno, že celková atrofie mozku ani atrofie kortikální není projevem pouze pozdních stadií RS, ale bývá přítomna již v časných stadiích onemocnění [49,50]. Úbytek mozkové tkáně koreluje s rozvojem kognitivního deficitu více než nárůst celkového objemu lézí [51]. Tato zjištění jen potvrzují již známý fakt, že k patologickým dějům včetně axonální ztráty dochází i mimo demyelinizační léze. K měření mozkové atrofie lze využít některých volně dostupných softwarů (obr. 6) [52].
Obr. 6. Měření mozkové atrofie pomocí programu SIENA. 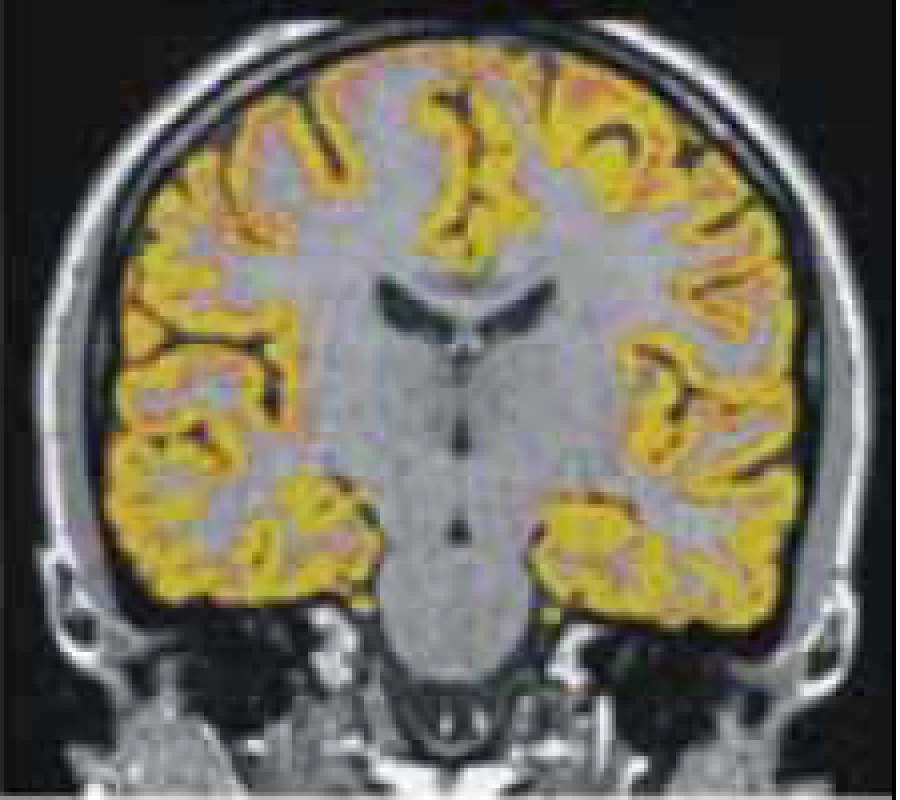
Obr. 6a) Oranžově maska celého mozku (šedá hmota + bílá hmota + likvorové cesty), modře vnitřní ohraničení kalvy. Obr. 6b) Koregistrace se standardizovaným mozkem pomocí vnitřního povrchu kalvy. Výpočet tzv. scaling faktoru, který umožňuje vztáhnout velikost objemu získaných segmentací mozku (C + D) k rozměrům kalvy a vypočítat normalizované objemy, tím i míru jejich atrofie. Obr. 6c) Výpočet objemu parenchymu (šedá hmota + bílá hmota). Obr. 6d) Objem periferní šedé hmoty [52]. Souvislost mezi tíží kognitivního deficitu a rozšířením sulků či šíří komor byla srovnávána na CT [53], pomocí transkraniální sonografie [54] či MR [55]. Výsledky publikovaných studií jsou však nejednoznačné. S pomocí MR vyšetření byl jako dobrý korelát kognitivního deficitu vyhodnocen úbytek pouze bílé hmoty, bez signifikantních změn objemu hmoty šedé [56]. Jiné studie však prokazují výsledky opačné [57].
Další studie se zaměřují na možnost nalezení jednoduše vyšetřitelných indexů odrážejících mozkovou atrofii konkrétních mozkových struktur, relevantních ve vztahu k neuropsychologickým funkcím. Měřen byl například poměr vzdálenosti nuclei caudati k šíři mozku ve stejném místě („bicaudate ratio“). Nárůst tohoto poměru odpovídá atrofii hluboké frontální subkortikální bílé hmoty a koreluje s tíží kognitivního deficitu, konkrétně se zpomalením psychomotorického tempa, lépe než celková atrofie [58]. Jako další slibný parametr se jeví šíře třetí komory odrážející míru atrofie thalamu, který hraje velmi důležitou roli v interkonektivitě mozku jako relé pro kortikální a subkortikální dráhy [59].
Kromě celkové atrofie kortexu bylo v několika studiích popsáno tzv. fokální ztenčení kortexu („cortical thinning“) [60]. Oblasti ztenčení byly nejčastěji pozorovány ve frontálním a temporálním kortexu, a to i u kognitivně intaktních pacientů. U pacientů s kognitivním deficitem se ztenčení zdá být spíše generalizované [61].
3. Hodnocení normálně vypadající mozkové hmoty
Z mnoha studií používajících nekonvenční MR techniky vyplývá, že hodnocení demyelinizačních okem viditelných lézí nepodává kompletní obraz o rozsahu mozkového postižení při RS [62]. Nové MR metody jsou schopny odhalit mikroskopické změny v normálně vypadající mozkové tkáni (NABT), a to jak v bílé (NAWM), tak i šedé hmotě (NAGM) mozkové, která se jeví na konvenční MR jako intaktní [63,64].
T1 a T2 relaxační časy
Prodloužené T1 a T2 relaxační časy byly u pacientů s RS zaznamenány v demyelinizačních lézích, ale i v normálně vypadající mozkové tkáni [65,66]. U pacientů s CIS byly hodnoty přibližně mezi hodnotami pacientů s RS a zdravých kontrol [67]. Pouze jedna studie byla věnována T1 relaxometrii a kognitivnímu deficitu u RS. Tato studie prokázala prodloužení T1 relaxačního času frontální NAWM u pacientů s poruchami vizuální paměti, abstraktního myšlení a pojmenování [68]. Nedostatek zájmu o tuto oblast lze vysvětlit mohutným rozvojem nových modernějších zobrazovacích metod.
Magnetizační transfer (MTI)
Při konvenčním MR vyšetření je kontrast mezi jednotlivými tkáněmi dán různým poměrem vázaných a volných molekul vody, konkrétně protonů vodíku v ní obsažených. Tento poměr určuje délku jejich T1 a T2 relaxačních časů. Viditelné jsou pouze volné protony, kterých je asi 80 %. Zbylých 20 % je vázáno na makromolekulární struktury, jako proteiny nebo lipidy membrán. Jejich relaxační časy jsou velmi krátké, na konvenčním MR nezachytitelné. Metoda magnetizačního transferu využívá magnetických interakcí, resp. přenosu magnetizace mezi protony obsaženými v molekulách volné vody a vody vázané v makromolekulárních strukturách. V případě vyšetření MTI je aplikován radiofrekvenční impulz působící saturaci protonů vázaných v molekulách vody makromolekul, která je přenesena na protony obsažených v molekulách volné vody, což ve výsledku vede k redukci jejich magnetizace. Tím dojde k poklesu intenzity signálu, který je dán mírou magnetizačního transferu mezi protony volné a vázané vody. Tohoto jevu lze s úspěchem využít ve tkáních s obsahem makromolekulárních struktur, jakou je např. myelin. V mozkové tkáni pacienta s RS je poměr volné a vázané vody narušen, a to nejen v místě demyelinizačních lézí, ale i v normálně vypadající mozkové tkáni. Důvodem je pravděpodobně edém, zánětlivá infiltrace, astrocytární hyperplázie a abnormality myelinu. Výslednou hodnotou MTI vyšetření je poměr magnetizačního transferu (Magnetization Transfer Ratio, MTR), který se s poškozením struktury tkáně snižuje.
Publikované studie prokazují, že průměrný MTR měřený v demyelinizačních lézích koreluje s fyzickou disabilitou lépe než objem lézí detekovaných na T2 vážených obrazech [69]. Rovaris et al [26] vyšetřovali pacienty s kognitivním deficitem a poruchami paměti. Tito jedinci měli signifikantně vyšší celkový objem lézí a nižší průměrný MTR v lézích než pacienti bez poruch kognice. Z hodnot MTR lze také vytvořit celkový obraz postižení mozkové tkáně, takzvané MTR histogramy, které rovněž velmi dobře korelují s výkonem v neuropsychologických testech [70]. Z histogramů publikovaných Filippim et al [71] vyplývá, že u pacientů s prokázaným kognitivním deficitem je MTR významně nižší ve frontálním laloku a v subkortikální bílé hmotě, zatímco MTR mozečku nevykazuje statisticky významný rozdíl oproti pacientům kognitivně intaktním. MTR je u pacientů s poruchami kognitivních funkcí u RS sníženo i v normálně vypadající bílé hmotě [63,72], kde byl prokázán signifikantně nižší průměrný MRT oproti pacientům bez postižení kognice [73,74]. V longitudinální, sedm let trvající studii bylo popsáno významné zhoršení paměťových funkcí korelující s výrazným difuzním poklesem MTR v NABT [75]. Kombinací vyšetření MTI normálně vypadající mozkové tkáně a funkční magnetickou rezonancí (fMR) byli vyšetřeni pacienti s CIS. Jejich zhoršený výkon v testu PASAT (Paced Auditory Serial Addition Test) dobře koreloval se sníženým MTR v NAWM. U stejných pacientů byla pomocí fMR prokázána zvýšená regionální aktivace mozku v Broadmanových areách 45 oboustranně a 44 vpravo, což odpovídá kompenzační schopnosti mozku v časných stadiích RS [76].
Difuzí vážené obrazy (DWI) a zobrazování tenzorů difuze (DTI)
DWI/DTI je v současnosti jedna z nejmodernějších zobrazovacích metod. Její princip spočívá v zobrazení difuze molekul vody ve tkáni mozku. Intaktní nervová tkáň (především bílá hmota) je díky lipidové struktuře myelinových obalů pro vodu velmi anizotropním prostředím. Volný pohyb protonů (molekul vody) je usměrňován strukturou myelinových pochev a není umožněn všemi směry. Z vyšetření DTI získáváme dva parametry, Apparent Diffusion Coeffi-cient (ADC) a frakční anizotropii (FA). ADC vyjadřuje celkovou difuzivitu vody ve tkáni. Frakční anizotropie reflektuje organizaci a integritu tkáně a s poškozením myelinu či axonů klesá [77]. Tyto hodnoty lze měřit přímo v demyelinizačních lézích či v NABT, a to buď v předem určených oblastech zájmu (ROI, Region Of Interest), kdy však metoda vykazuje pouze nízkou senzitivitu [78], nebo souhrnně v celé mozkové tkáni, vytvářením tzv. FA či ADC map. Druhá ze zmiňovaných možností je „voxel-based“ porovnávání hodnot FA či ADC map celého mozku [79,80]. Touto metodou ale nelze zajistit stoprocentní koregistraci dat, tedy to, že budeme srovnávat mezi subjekty přesně tutéž oblast mozku či traktu [81,82]. Smith et al [83] představili metodu Tract-Based Spatial Statistics (TBSS), která umožňuje perfektní koregistraci FA dat jednotlivých subjektů jejich projekcí do tzv. FA skeletonu, jenž představuje průměrný obraz „páteře“ hlavních traktů bílé hmoty u zkoumané skupiny. Tím se významně snížila interindividuální variabilita dat pozorovaná v FA histogramech mezi zdravými dobrovolníky (obr. 7) [80,84].
Obr. 7. Tract Based Spatial Statistics (TBSS): skupinové zhodnocení rozdílu v různých parametrech odvozených z DTI, např. frakční anizotropie (FA). Zeleně zobrazen průměrný skeleton traktů, který slouží k prostorové koregistraci dat, žlutočervenou škálou znázorněny nadprahové statistické hodnoty vyjadřující pokles FA u pacientů v porovnání se zdravými dobrovolníky [84]. ![Tract Based Spatial Statistics (TBSS): skupinové zhodnocení rozdílu v různých parametrech odvozených z DTI, např. frakční anizotropie (FA). Zeleně zobrazen průměrný skeleton traktů, který slouží k prostorové koregistraci dat, žlutočervenou škálou znázorněny nadprahové statistické hodnoty vyjadřující pokles FA u pacientů v porovnání se zdravými dobrovolníky [84].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b3159e9dc7b6342b1bec5502b41ec587.png)
Rovaris et al [85] provedli podrobné neuropsychologické vyšetření u skupiny pacientů s RS. Dále byl vyhodnocen objem T1 a T2 lézí, objem celého mozku, FA a ADC z lézí a FA histogramy z NABT, NAWM a NAGM. Žádný z neuropsychologických testů nekoreloval s objemem mozku, FA lézí a z celkové mozkové tkáně. Málo významná korelace byla nalezena mezi třemi kognitivními testy (Symbol digit modalities test, Verbal fluency test, Spatial recall test) a objemem T1 a T2 lézí, FA z NABT, NAWM a NAGM. Signifikantní změny byly popsány na DWI u pacientů s porušenou sluchovou, verbální, zrakovou, pracovní pamětí a zpomaleným psychomotorickým tempem [86]. Roosendaal et al [87] využili metodu TBSS. Snížené psychomotorické tempo bylo asociováno se signifikantně nižšími FA hodnotami v corpus callosum, které překvapivě nebylo výrazněji postiženo viditelnými demyelinizačními lézemi na proton-denzitních vážených obrazech. Významná redukce FA byla demonstrována při vyšetření PASAT ve spleniu, zadním cingulu a v bílé hmotě levé Brodmanovy arey 40, která pravděpodobně odpovídá sluchové dráze. Tyto změny by mohly odpovídat porušené sluchové pracovní paměti. U poruch verbálního učení a znovuvybavení bylo popsáno postižení levé perisylvické bílé hmoty [88].
Funkční magnetická rezonance
Funkční magnetická rezonance (fMR) je schopna zobrazit aktivaci kortikálních oblastí v závislosti na změně poměru paramagnetického deoxyhemoglobinu a diamagnetického oxyhemoglobinu, ke kterému dochází především v důsledku nárůstu perfuze. Hyperperfuze provází aktivaci neuronálních populací a odráží vyšší metabolické nároky tkáně („neurovascular coupling“). fMR má velmi dobré prostorové (ve srovnání s EEG a PET) a dostatečné časové rozlišení (horší než EEG), díky němuž je možné demonstrovat aktuální zapojení mozkových center při zpracovávání konkrétního úkolu. Při RS, podobně jako u pacientů po prodělané mozkové příhodě [89] či s mozkovými tumory [90], dochází k zapojování nových oblastí kortexu jako důkazu schopnosti reorganizace a kompenzace mozkového poškození. Tato schopnost byla popsána u motorických drah pacientů s RS [91,92] nebo u pacientů po prodělané jednostranné optické neuritidě, u kterých došlo na postižené straně spolu s aktivací okcipitálního zrakového kortexu k zapojení inzuly, laterální temporální a zadní parietální kůry [93].
Plasticita mozku hraje svou roli i v oblasti kognitivních funkcí. Velmi podrobný přehled o zapojení jednotlivých oblastí mozku při vyšetřování paměti, pozornosti či jazykových dovedností za použití fMR a PET u zdravých dospělých poskytly studie Cabezy et al [94,95]. U pacientů s RS bylo pozorováno, že při řešení zadaných úkolů, např. při řešení PVSAT (Paced Visual Serial Addition Test) [96] mají jiný vzorec zapojení mozkových center a zapojují více mozkových oblastí. Překvapivě byl tento jev pozorován i u pacientů s CIS a velmi krátkým trváním od první ataky, v průměru sedm měsíců. I tito pacienti vykazovali při vyšetření PVSAT extenzivní aktivaci mozkových center s odlišnou topologií v jejich zapojování [97]. Jejich výkon v PVSAT se ale ve srovnání se zdravými dobrovolníky nelišil. Aktivace dalších mozkových center u pacientů s RS je pravděpodobně mechanizmem, který dovoluje kompenzovat vliv choroby na kognitivní funkce. Další důkaz o tom podali Mainero et al [98]. Pacienti s lepším výkonem při vyšetřování tenacity pozornosti, psychomotorického tempa a paměti pomocí PASAT (Paced Audio Serial Addition Test) vykazovali větší korovou aktivaci než pacienti s výkonem horším. Studie zaměřené na poruchy pracovní paměti ukázaly velmi podobné výsledky jako studie využívající PASAT [99,100]. Schopnost kompenzovat poškození některých funkcí ale není trvalá. S rozsáhlejším mozkovým postižením, potažmo s větší fyzickou disabilitou, plasticita mozku mizí [101]. Lazeron et al [102] vyšetřovali exekutivní funkce u středně těžce fyzicky postižených pacientů. Jejich výsledky byly signifikantně horší oproti kontrolám. Funkční MR u nich neprokázala zapojení nových korových oblastí.
MR spektroskopie
MR spektroskopie je metoda umožňující měřit množství různých metabolitů v tkáních. Je založena na drobných odchylkách rezonančních frekvencí atomů vodíku, které ovlivňuje chemická struktura jejich okolí – tzv. chemický posun. Při hodnocení mozkového parenchymu zjišťujeme zastoupení jednotlivých rezonančních frekvencí (spektrum) v oblasti zájmu a na základě jejich chemického posunu určujeme přítomnost a vzájemné poměry jednotlivých metabolitů. Lze spočítat i jejich absolutní koncentrace. Příkladem významného metabolitu je N-acetyl aspartát (NAA). Tato aminokyselina je přítomna téměř výhradně v neuronech. Při poškození nervové tkáně při RS prokazatelně klesá její koncentrace v demyelinizačních lézích i v NAWM [103,104].
Pan et al [105] ve své studii popsali signifikantní změny v koncentraci NAA vlevo periventrikulárně a sníženým výkonem v Buschkově testu selektivního znovupoznávání (Buschke Selective Reminding Test). Redukce poměru NAA/kreatinin ve frontální NAWM byla sledována skupinou Foonga et al [106]. Korelát snížených exekutivních funkcí nebyl potvrzen, ale u pacientů s těžšími abnormitami v poměru NAA/kr byla pozorována významně častěji porucha pracovní paměti.
Pozitronová emisní tomografie (PET) a jednofotonová emisní tomografie (SPECT)
Vyšetření PET umožňuje hodnotit metabolickou aktivitu mozku. Pacientovi je aplikován analog glukózy obsahující radionuklid fluoru 18F neboli fluoro-deoxy-glukóza (FGD). Vychytávání této látky odpovídá metabolické aktivitě v dané oblasti mozku. Už z velmi časných studií využívajících PET a CT [107] vyplývá, že u pacientů s RS je snížena celková utilizace kyslíku jak šedou, tak i bílou hmotou oproti zdravým kontrolám. Tento nález byl asociován s nálezem kortikální atrofie na CT mozku a sníženým výkonem ve Wechslerových inteligenčních škálách. Zhoršení paměťových funkcí, především dlouhodobé a pracovní paměti, koreluje se snížením globálního a kortikálního metabolizmu glukózy, především rozsáhlých oblastí prefrontálního kortexu a hipokampu [108], také v cingulu, thalamu, v asociační kůře okcipitálního laloku a v mozečku [109]. Byla popsána asociace mozkového hypometabolizmu s nárůstem počtu a velikostí lézí na konvenčním MR a kognitivním deficitem [110].
Nejčastějším radionuklidem využívaným při zobrazování mozkové aktivity pomocí SPECT je techneciem značený hexa-metyl--propylen-amino-oxim (99mTc-HMPAO). Vyšetření pacientů s kognitivním deficitem ukázalo signifikantní redukci vychytávání 99mTc-HMPAO ve frontálních lalocích [111], dále v levém temporálním laloku u pacientů se zhoršenou verbální fluencí a poruchami ve verbální paměti [112].
Závěr
Deteriorace kognitivních funkcí je jev pozorovaný již ve velmi časných stadiích RS. Má velký dopad na běžný život pacienta, jeho pracovní i sociální aktivity. Zobrazovací metody již pomohly identifikovat některé klinickopatologické koreláty kognitivních poruch. Konvenční MR studie nalezly pouze průměrnou korelaci mezi celkovým objemem lézí a kognitivním deficitem. O něco přesvědčivější výsledky přinesly studie objemu lézí ve specifických oblastech mozku. Především atrofie corpus callosum, frontálního kortexu a šíře třetí komory se jeví jako velmi silný prediktor kognitivní dysfunkce. MRS je vyšetření časově náročné a vyžadující přístroj s velmi vysokou rozlišovací schopností, její použití se však zdá být poměrně přínosné, stejně jako využití DWI a DTI. K plnému klinickému využití těchto metod je třeba dalšího vývoje. Z funkčních zobrazovacích metod se zdá být nejpřínosnější fMR, pomocí níž se již u pacientů s CIS podařila prokázat spontánní funkční reorganizace, která do řešení konkrétního úkolu mozku dovoluje zapojovat nové oblasti. To pacientovi napomáhá podávat přes určitý stupeň mozkového postižení normální výkon. Zajímavé výsledky poskytuje i PET, jejíž nevýhodou je však nízká rozlišovací schopnost, invazivita, nutnost aplikovat radioizotop a cena vyšetření.
Zobrazovací metody by mohly v budoucnosti umožnit predikci rizika rozvoje kognitivního deficitu, resp. jeho významné progrese u konkrétního pacienta s RS. Výzkum je cílen také na hodnocení efektu terapeutických možností kognitivního deficitu (ať už formou rehabilitace, tedy kognitivního tréninku, nebo farmakoterapie) a na případné posílení kompenzačních schopností mozku.
Přijato k recenzi: 12. 8. 2011
Přijato do tisku: 13. 10. 2011
MUDr. Ivana Obhlídalová
Neurologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail:
ivana.obhlidalova@fnbrno.cz
Zdroje
1. Havrdová E. Roztroušená skleróza mozkomíšní. In: Havrdová E (ed). Neuroimunologie. 3rd ed. Praha: Maxdorf 2001 : 231.
2. Benedict RH. Integrating cognitive function screening and assessment into the routine care of multiple sclerosis patients. CNS Spectr 2005; 10(5): 384–391.
3. Rao SM, Leo GJ, Bernardin L, Unverzang F. Cognitive dysfunction in multiple sclerosis. Frequency, patterns and prediction. Neurology 1991; 41(5): 685–691.
4. Jennekens-Schinkel A, Sanders EA. Decline of cognition in multiple sclerosis: dissociable deficits. J Neurol Neurosurg Psychiatry 1986; 49(12): 1354–1360.
5. Peyser JM, Edwards KR, Poser CM, Filskov SB. Cognitive function in patients with multiple sclerosis. Arch Neurol 1980; 37(9): 577–579.
6. Rao SM. Multiple sclerosis. In: Cummings JL (ed). Subcortical demention. New York: Oxford University Press 1990 : 164–180.
7. Feldman RG, Albert ML, Willis AL. The “subcortical dementia” of progressive supranuclear palsy. J Neurol Neurosurg Psychiatry 1974; 37(2): 121–130.
8. Beatty WW. A strategy for studying memory disorders in multiple sclerosis. In: Square RL, Butters N (eds). Neuropsychology of memory. New York: NY Guilford Press 1992 : 285–298.
9. Beatty WW, Goodkin DE, Menson N, Beatty PA. Cognitive disturbances in patients with relapsing-remitting multiple sclerosis. Arch Neurol 1989; 46(10): 1113–1119.
10. Rao SM, Leo GJ, Haughton VM, St. Aubin-Faubert P, Bernardin L. Correlation of magnetic resonance imaging with neuropsychological testing in multiple sclerosis. Neurology 1989; 39(2): 161–166.
11. Ron MA, Callanan MM, Warrington EK. Cognitive abnormalitites oïn multiple sclerosis: a psychometric and MTI study. Psychol Med 1991; 21(1): 59–68.
12. Gainotti G. Measures of cognitive and emotional changes in multiple sclerosis and underlying models of brain dysfunction. J Neurol Sci 2006; 245(1–2): 15–20.
13. Vaněčková M, Seidl Z, Krásenský J, Horáková D, Havrdová E, Němcová J et al. Naše zkušenosti s MR monitorováním pacientů s roztroušenou sklerózou v klinické praxi. Cesk Slov Neurol N 2010; 73/106(6): 716–720.
14. Solomon MA. MRI in MS diagnosis. Neurology 1987; 37(9): 1566–1567.
15. Miller HD, Ormerod IE, Gibson A, de Boulay EP, Rudge P, McDonald WI. MR brain scanning in patiens with vasculitis: differentiation from multiple sclerosis. Neuroradiology 1987; 29(3): 226–231.
16. Ormerod IE, Miller DH, McDonald WI, Boulay EP, Rudge P, Kendall BE et al. The role of NMR imaging in the assessment of multiple sclerosis and isolated neurological lesions: a quantitative study. Brain 1987; 110(6): 1579–1616.
17. Software SepINRIA. Available from: http://www.sop.inria.fr/asclepios/software/SepINRIA/.
18. Ashton EA, Takahashi C, Berg MJ, Goodman A, Totterman S, Ekholm S. Accuracy and reproducibility of manual and semiautomated quantification of MS lesions by MRI. J Magn Reson Imaging 2003; 17(3): 300–308.
19. Zijdenbos AP, Dawant BM, Margolin RA, Palmer AC. Morphometric analysis of white matter lesions in MR images: method and validation. IEEE Trans Med Imaging 1994; 13(4): 716–724.
20. Van Leemput K, Maes F, Vandermeulen D, Colchester A, Suetens P. Automated segmentation of multiple sclerosis lesions by model outlier detection, IEEE transactions on medical imaging 2001; 20(8): 677–688.
21. Arnett PA, Rao SM, Bernardin L, Grafman J, Yetkin FZ, Lobeck L. Relationship between frontal lobe lesions and Wisconsin Card Sorting Test performance in patients with multiple sclerosis. Neurology 1994; 44(3): 420–425.
22. Foong J, Rozewicz L, Quaghebeur G, Davie CA, Kartsounis LD, Thompson AJ et al. Executive functions in multiple sclerosis. The role of frontal lobe pathology. Brain 1997; 120(1): 15–26.
23. Lazeron RH, Boringa JB, Schouten M, Uitdehaag BM, Bergers E, Lindeboom J et al. Brain atrophy and lesion load as explaining parameters for cognitive impairment in multiple sclerosis. Mult Scler 2005; 11(5): 524–531.
24. Truyen L, van Waesberghe JH, van Walderveen MA, van Oosten BW, Polman CH, Hommes OR et al. Accumulation of hypointense lesions (“black holes”) on T1 spin-echo MRI correlates with disease progression in multiple sclerosis. Neurology 1996; 47(6): 1469–1476.
25. Barkhof F, McGowan JC, van Waesberghe JH, Grossman RI. Hypointense multiple sclerosis lesions on T1-weighted spin echo magnetic resonance images: their contribution in understanding multiple sclerosis evolution. J Neurol Neurosurg Psychiatry 1998; 64 (Suppl 1): 77–79.
26. Rovaris M, Filippi M, Falautano M, Minicucci L, Rocca MA, Martinelli V et al. Relation between MR abnormalities and patterns of cognitive impairment in multiple sclerosis. Neurology 1998; 50(6): 1601–1608.
27. Patti F, Amato MP, Trojano M, Bastianello S, Tola MR, Goretti B et al. Cognitive impairment and its relation with disease measures in mildly disabled patients with relapsing-remitting multiple sclerosis: baseline results from the Cognitive Impairment in Multiple Sclerosis (COGIMUS) study. Mult Scler 2009; 15(7): 779–788.
28. Rao SM, Bernardin L, Ellington L, Ryan SB, Burg LS. Cerebral disconnection in multiple sclerosis. Relationship to atrophy of the corpus callosum. Arch Neurol 1989; 46(8): 918–920.
29. Pozzilli C, Bastianello S, Padovani A, Passafiume D, Millefiorini E, Bozzao L et al. Anterior corpus callosum atrophy and verbal fluency in multiple sclerosis. Cortex 1991; 27(3): 441–445.
30. Swirsky-Sacchetti T, Mitchell DR, Seward J, Gonzales C, Lublin F, Knobler R et al. Neuropsychological and structural brain lesions in multiple sclerosis: a regional analysis. Neurology 1992; 42(7): 1291–1295.
31. Huber SJ, Paulson GW, Shuttleworth EC, Chakeres D, Clapp LE, Pakalnis A et al. Magnetic resonance imaging correlates of dementia in multiple sclerosis. Arch Neurol 1987; 44(7): 732–736.
32. Brownell B, Hughes JT. The distribution of plaques in the cerebrum in multiple sclerosis. J Neurol Neurosurg Psychiatry 1962; 25 : 315–320.
33. Lumsden CE. The neuropathology of multiple sclerosis. In: Vinken PJ, Bruyn GW, eds. Handbook of clinical neurology. Amsterdam: North-Holland 1970 : 217–309.
34. Kidd D, Barkhof F, McConnell R, Algra PR. Allen IV, Revesz T. Cortical lesions in multiple sclerosis. Brain 1999; 122(1): 17–26.
35. Rovaris M, Youstry T, Calori G, FeslG, Voltz R, Filippi M. Sensitivity and reproducibility of fast FLAIR, FSE and TGSE sequences for the MRI assessment of brain lesions load in multiple sclerosis: a preliminary study. J Neuroimaging 1997; 7(2): 98–102.
36. De Coene B, Hajnal JV, Gatehouse P, Longmore DB, White SJ, Oatridge A, Pennock JM et al. MR of the brain using fluid-attenuated inversion recovery (FLAIR) pulse sequences. AJNR Am J Neuroradiol 1992; 13(6): 1555–1564.
37. Bakshi R, Ariyaratana S, Benedict RHB, Jacobs L. Fluid-attenuated inversion-recovery MRI detects cortical and juxtacortical MS lesions. Arch Neurol 2001; 58(5): 742–748.
38. Geurts JJ, Pouwels PJ, Uitdehaag BM, Polman CH, Barkhof F, Castelijns JA. Intracortical lesions in multiple sclerosis: improved detection with 3D double inversion-recovery MR imaging. Radiology 2005; 236(1): 254–260.
39. Pouwels PJ, Kuijer JP, Mugler JP 3rd, Guttmann CR, Barkhof F. Human gray matter: feasibility of single-slab 3D double inversion-recovery high-spatial-resolution MR imaging. Radiology 2006; 241(3): 873–879.
40. Nelson F, Poonawalla AH, Hou P, Huang F, Wolinsky JS, Narayana PA. Improved identification of intracortical lesions in multiple sclerosis with phase-sensitive inversion recovery in combination with fast double inversion recovery MR imaging. AJNR Am J Neuroradiol 2007; 28(9): 1645–1649.
41. Moriarty DM, Blackshaw AJ, Talbot PR, Griffiths HL, Snowden JS, Hillier VF et al. Memory dysfunction inmultiple sclerosis corresponds to juxtacortical lesion load on fast fluid attenuated inversion recovery MR images. AJNR Am J Neuroradiol 1999; 20(10): 1956–1962.
42. Rovaris M, Filippi M, Minicucci L, Iannucci G, Santuccio G, Possa F et al. Cortical/subcortical disease burden and cognitive impariment in patients with multiple sclerosis. AJNR Am J Neuroradiol 2000; 21(2): 402–408.
43. Calabrese M, Agosta F, Rinaldi F, Mattisi I, Grossi P, Favaretto A et al. Cortical lesions and atrophy associated with cognitive impairment in relapsing-remitting multiple sclerosis. Arch Neurol 2009; 66(9): 1144–1150.
44. Poonawalla AH, Hasan KM, Gupta RK, Ahn CW, Nelson F, Wolinsky JS, Narayana PA. Diffusion-tensor MR imaging of cortical lesions in multiple sclerosis: initial findings. Radiology 2008; 246(3): 880–886.
45. McAlpine D. Symptoms and signs. In: McAlpine D, Lumsden CE, Acheson ED. Multiple sclerosis: a reappraisal. 2nd ed. Edinburgh: Churchill Livingstone 1972 : 174–177.
46. Poser S. Multiple sclerosis: an analysis of 812 cases by means of electronic data processing. Berlin: Springer 1978.
47. Day TJ, Fisher AG, Mastaglia FL. Alexia with agraphia in multiple sclerosis. J Neurol Sci 1987; 78 : 343–348.
48. Miller DH, Barkhof F, Frank JA, Parker GJM, Thompson AJ. Measurement of atrophy in multiple sclerosis: pathological basis, methodological aspects and clinical relevance. Brain 2002; 125(8): 1676–1695.
49. Chard DT, Griffin CM, Parker GJM, Kapoor JR. Thompson AJ, Miller HD. Brain atrophy in cliniccaly early relapsing-remitting multiple sclerosis. Brain 2002; 125(2): 327–337.
50. De Stefano N, Matthews PM, Filippi M, Agosta F, De Luca M, Bartolozzi ML et al. Evidence of early cortical atrophy in. MS: Revalence to white matter changes and disability. Neurology 2003; 60(7): 1157–1162.
51. Zivadinov R, Sepcic J, Nasuelli D, de Masi R, Bragadin LM, Tommasi MA et al. A longitudinal study of brain atrophy and cognitive disturbances in the early phase of relapsing-remitting multiple sclerosis. J Neurol Neurosurg Psychiatry 2001; 70(6): 773–780.
52. Software SIENA. Available from: http://www.fmrib.ox.ac.uk/fsl/siena/index.html.
53. Rao SM, Glatt S, HammekeTA, McQuillen MP, Khatri BO, Rhodes AM et al. Chronic-progressive multiple sclerosis: relationship between cerebral ventricular size and neuropsychological impairment. Arch Neurol 1985; 42(7): 678–682.
54. Berg D, Mäurer M, Warmuth-Metz M, Rieckmann P, Becker G. The correlation between ventricular diameter measured by transcranial sonography and clinical disability andcognitive dysfunction in patients with multiple sclerosis. Arch Neurol 2000; 57(9): 1289–1292.
55. Comi G, Filippi M, Martinelli V, Sirabian G, Visciani A, Campi A et al. Brain magnetic resonance imaging correlates of cognitive impairment in multiple sclerosis. J Neurol Sci 1993; 115 (Suppl 1): 66–73.
56. Edwards SG, Liu C, Blumhardt LC. Cognittive correlates of supratentorial atrophy on MRI in multiple sclerosis. Acta Neurol Scand 2001; 104(4): 214–223.
57. Amato MP, Bartolozzi ML, Zipoli V, Portaccio E, Mortilla M, Guidi L et al. Neocortical volume decrease in relapsing remmiting MS patients with mild cognitive impariment. Neurology 2004; 63(1): 80–93.
58. Bermel RA, Bakshi R, Tjoa C, Puli SR, Jacobs L. Bicaudate ratio as a magnetic resonance imaging marker of brain atrophy in multiple sclerosis. Arch Neurol 2002; 59(2): 275–280.
59. Benedict RH, Weinstock-Guttman B, FishmanI, Sharma J, Tjoa C, Bakshi R. Prediction of neuropsychological impairment in multiple sclerosis. Arch Neurol 2004; 61(2): 226–230.
60. Sailer M, Fischl B, Salat D, Tempelmann C, Schönfeld MA et al. Focal thinning of the cerebral cortex in multiple sclerosis. Brain 2003; 126(8): 1734–1744.
61. Calabrese M, Rinaldi F, Mattisi I, Grossi P, Favaretto A, Atzori M et al. Widespread cortical thinning characterizes patients with MS with mild cognitive impairment. Neurology 2010; 74(4): 321–328.
62. Filippi M, Miller DH. Magnetic resonance imaging in the differential diagnosis and monitoring the treatment of multiple sclerosis. Curr Opin Neurol 1996; 9(3): 178–186.
63. Filippi M, Campi A, Dousset V, Baratti C, Martinelli V, Canal N, Scotti G et al. A magnetization transfer imaging study of normal-appearing white matter in multiple sclerosis. Neurology 1995; 45(3): 478–482.
64. Werring DJ, Clark CA, Barker GJ, Thompson AJ, Miller DH. Diffusion tensor imaging of lesions and normal-appearing white matter in multiple sclerosis. Neurology 1999; 52(8): 1626–1632.
65. Stevenson VL, Parker GJ, Barker GJ, Birnie K, Tofts PS, Miller HD et al. Variations in T1 and T2 relaxation times of normal appearing white matter and lesions in multiple sclerosis. J Neurol Sci 2000 : 178(2): 81–87.
66. Neema M, Stankiewicz J, Arora A, Dandamudi VS, Batt CE, Guss ZD et al. T1 - and T2-based MRI measures of diffuse gray matter and white matter damage in patients with multiple sclerosis. J Neuroimaging 2007; 17 (Suppl 1): 16–21.
67. Ormerod IEC, Johnson G, MacManus D, du Boulay EPHG, Macdonald WI. Relaxation times of apparently normal cerebral white matter in multiple sclerosis. Act Radiol 1986; 369 (Suppl): 382–384.
68. Feinstein A, Youl B, Thompson A. Acute optic neuritis. A cognitive and magnetic resonance imaging study. Brain 1992; 115(5): 1403–1415.
69. Gass A, Barker GJ, Kidd D, Thorpe JW, MacManus DG, Brennan A et al. Correlation of magnetization transfer ratio with disability in multiple sclerosis. Ann Neurol 1994; 36(1): 62–67.
70. van Buchem MA, Grossman RI, Armstrong C, Polansky M, Miki Y, Heyning FH et al. Correlation of volumetric magnetization transfer imaging with clinical data in MS. Neurology 1998; 50(6): 1609–1617.
71. Filippi M, Rocca MA, Minicucci L, Martinelli V, Ghezzi A, Bergamaschi R et al. Magnetization transfer imaging of patients with definite MS and negative conventional MRI. Neurology 1999; 52(4): 845–848.
72. Loevner LA, Grossman RI, Cohen JA, Lexa FJ, Kessler D, Kolson DL. Microscopic disease in normalappearing white matter on conventional MR imaging in patients with multiple sclerosis: assessment with magnetization-transfer measurements. Radiology 1995; 196(2): 511–515.
73. Filippi M, Tortorella C, Rovaris M, Bozzali M, Possa F, Iannucci G et al. Changes in the normal appearing brain tissue and cognitive impairment in multiple sclerosis. J Neurol Neurosurg Psychiatry 2000; 68(2): 157–176.
74. Zivadinov R, de Masi R, Nasuelli D, Bragadin LM, Ukmar M, Pozzi-Mucelli RS et al. MRI techniques and cognitive impairment in the early phase of relapsing remitting multiple sclerosis. Neuroradiology 2001; 43(4): 272–278.
75. Deloire MSA, Ruer A, Hamel D, Bonner M, Douset V, Brochet B. MRI predictors of cognitive outcome in early multiple sclerosis. Neurology 2011; 76(13): 1161–1167.
76. Audoin B, Duong MVA, Ranjeva JP, Ibarrola D, Malikova I, Confort-Gouny S et al. Magnetic resonance study of influence of tissue damage and cortical reorganization on PASAT performance at earliest stage of multiple sclerosis. Hum Brain Mapp 2005; 24(3): 216–228.
77. Keřkovský M, Šprláková-Puková A, Kašpárek T, Fadrus P, Mechl M, Válek V. Duffision tensor imaging – současné MR zobrazení bílé hmoty mozku. Cesk Slov Neurol N 2010; 73/106(2): 136–142.
78. Griffin CM, Declan TC, Ciccarelli O, Kapoor R, Barker GJ, Thompson AJ et al. Diffusion tensor imaging in early relapsing-remitting multiple sclerosis. Mult Scler 2001; 7 : 290–297.
79. Cercignani M, Inglese M, Pagani E, Comi G, Filippi M. Mean diffusivity and fractional anisotropy histograms of patients with multiple sclerosis. AJNR Am J Neuroradiol 2001; 22(5): 952–958.
80. Cercignani M, Bammer R, Sormani MP, Fazekas F, Filippi M. Inter-sequence and inter-imaging unit variability of diffusion tensor MR imaging histogram-derived metrics of the brain in healthy volunteers. AJNR Am J Neuroradiol 2003; 24(4): 638–643.
81. Bookstein FL. “Voxel-based morphometry” should not be used with imperfectly registered images. Neuroimage 2001; 14(6): 1454–1462.
82. Ashburner J, Friston KJ. Voxel-based morphometry – the methods. Neuroimage 2000; 11(6): 805–821.
83. Smith SM, Jenkinson M, Johansen-Berg H, Rueckert D, Nichols TE, Mackay CE et al. Tract-based spatial statistics: Voxelwise analysis of multi-subject diffusion data. Neuroimage 2006; 31(4): 1487–1505.
84. Software TBSS. Available from: http://fsl.fmrib.ox.ac.uk/fsl/tbss/.
85. Rovaris M, Iannucci G, Falautano M, Possa F, Martinelli V, Comi G et al. Cognitive dysfunction in patients with mildly disabling relapsing-remitting multiple sclerosis: an exploratory study with diffusion tensor MR imaging. J Neurol Sci 2002; 195(2): 103–109.
86. Benedict RH, Bruce J, Dwyer MG, Weinstock-Guttman B, Tjoa C, Tavazzi E et al. Diffusion-weighted imaging predicts cognitive impariment in multiple sclerosis. Mult Scler 2007; 13(6): 722–730.
87. Roosendaal SD, Geurts JJG, Vrenken H, Hulst HE, Cover KS, Castelijns JA et al. Regional DTI differences in multiple sclerosis patients. Neuroimage 2009; 44(4): 1397–1403.
88. Dineen RA, Vilisaar J, Hlinka J, Bradshaw CM, Morgan PS, Constatinescu CS et al. Disconnection as mechanism for cognitive dysfunction in multiple sclerosis. Brain 2009; 132(1): 239–249.
89. Chollet F, Dipiero V, Wise RJS, Brooks DJ, Dolan RJ, Frackowiak RS. The functional anatomy of motor recovery after stroke in humans: A study with positron emission tomography. Ann Neurol 1999; 29(1): 63–71.
90. Yoshiura T, Hasuo K, Mihara F, Masuda K, Morioka T, Fukui M. Increased activity of the ipsilateral motor cortex during a hand motor task in patients with brain tumor and paresis. AJNR Am J Neuroradiol 1997; 18(5): 865–869.
91. Filippi M, Rocca MA, Falini A, Caputo D, Ghezzi A, Colombo B et al. Correlations between structural CNS damage and functional MRI changes in primary progressive MS. Neuroimage 2002; 15(3): 537–546.
92. Pantano P, Iannetti GD, Caramia F, Mainero C, Di Legge S, Bozzao L et al. Cortical motor reorganization after a single clinical attack of multiple sclerosis. Brain 2002; 125(7): 1607–1615.
93. Werring DJ, Bullmore ET, Toosy AT, Miller DH, Barker GJ, MacManus DG et al. Recovery from optic neuritis is associated with a change in the distribution of cerebral response to visual stimulation: a functional magnetic resonance imaging study. J Neurol Neurosurg Psychiatry 2000; 68(4): 441–449.
94. Cabeza R, Nyberg J. Imaging Cognition II: An Empirical Review of 275 PET and fMRI Studies. J Cogn Neurosci 2000; 12(1): 1–47.
95. Cabeza R. Cognitive neuroscience of aging: contributions of functional neuroimaging. Scand J Psychol 2001; 42(3): 277–286.
96. Staffen W, Mair A, Zauner H, Unterrainer J, Niederhofer H, Kutzelnigg A et al. Cognitive function and fMRI on patients with multiple sclerosis: evidence for compensatory cortical activation during an attention task. Brain 2002; 125(6): 1275–1282.
97. Audoin B, Ibarrola D, Ranjeva JP, Confort-Gouny S, Malikova I, Ali-Chérif A et al. Compensatory cortical activation observed by fMRI during a cognitive task at the earliest stage of MS. Hum Brain Mapp 2003; 20(2): 51–58.
98. Mainero C, Caramia F, Pozzilli C, Pisani A, Pestalozza I, Borriello G et al. fMRI evidence of brain reorganization during attention and memory tasks in multiple sclerosis. Neuroimage 2004; 21(3): 858–867.
99. Sweet LH, Rao SM, Primeau M, Mayer AR, Cohen RA. Functional magnetic resonance imaging of working memory among multiple sclerosis patients. J Neuroimaging 2004; 14(2): 150–157.
100. Hillary FG, Chiaravalloti ND, Ricker JH, Steffener J, Bly BM, Lange G et al. An investigation of working memory rehearsal in multiple sclerosis using fMRI. J Clin Exp Neuropsychol 2003; 25(7): 965–978.
101. Penner IK, Opwis K, Kappos L. Relation between functional brain imaging, cognitive impairment and cognitive rehabilitation in patients with multiple sclerosis. J Neurol 2007; 254 (Suppl 2): 1153–1157.
102. Lazeron RH, Rombouts SA, Scheltens P, Polman CH, Barkhof F. An fMRI study of planning-related brain activity in patients with moderately advanced multiple sclerosis. Mult Scler 2004; 10(5): 549–555.
103. Davie CA, Barker GJ, Thompson AJ, Tofts PS, McDonald WI, Miller DH. 1H magnetic resonance spectroscopy of chronic cerebral white matter lesions and normal appearing white matter in multiple sclerosis. J Neurol Neurosurg Psychiatry 1997; 63(6): 736–742.
104. Leary SM, Davie CA, Parker GJ, Stevenson VL, Wang L, Barker GJ et al. 1H magnetic resonance spectroscopy of normal appearing white matter in primary progressive multiple sclerosis. J Neurol 1999; 246(11): 1023–1026.
105. Pan JW, Krupp LB, Elkins LE, Coyle PK. Cognitive dysfunction lateralizes with NAA in multiple sclerosis. Appl Neuropsychol 2001; 8(3): 155–160.
106. Foong J, Rozewicz L, Davie CA, Thompson AJ, Miller DH, Ron MA. Correlates of executive function in multiple sclerosis: the use of magnetic resonance spectroscopy as an index of focal pathology. J Neuropsychiatry Clin Neurosci 1999; 11(1): 45–50.
107. Brooks DJ, Leenders KL, Head G, Pantano P, Incoccia C, Bastianello S et al. Studies on regional cerebral oxygen utilization and cognitive function in multiple sclerosis. J Neurol Neurosurg Psychiatry 1984; 47(11): 1182–1191.
108. Blinkenberg M, Rune K, Jensen CV, Ravnborg M, Kyllingsbæk S, Holm S et al. Cortical cerebral metabolism correlates with MRI lesion load and cognitive dysfunction in MS. Neurology 2000; 54(3): 558–564.
109. Paulesu E, Perani D, Fazio F, Comi G, Pozzilli C, Martinelli V et al. Functional basis of memory impairment in multiple sclerosis: a[18F]FDG PET study. Neuroimage 1996; 4(2): 87–96.
110. Sun X, Tanaka M, Kondo S, Okamoto K, Hirai S. Clinical significance of reduced cerebral metabolism in multiple sclerosis: a combined PET and MRI study. Ann Nucl Med 1998; 12(2): 89–94.
111. Lycke J, Wikkelsö C, Bergh AC, Jacobsson L, Andersen O. Regional cerebral blood flow in multiple sclerosis measured by single photon emission tomography with technetium-99m hexamethylpropyleneamine oxime. Eur Neurol 1993; 33(2): 163–167.
112. Pozzilli C, Passafiume D, Bernardi S, Pantano P, Incoccia C, Bastianello S et al. SPECT, MRI and cognitive functions in multiple sclerosis. J Neurol Neurosurg Psychiatry 1991; 54(2): 110–115.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Webové okénko
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2012 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Posturálna instabilita, poruchy chôdze a pády pri Parkinsonovej chorobe
- Sulcus temporalis superior a jeho funkční význam
- Algoritmus vyšetření likvoru v návaznosti na doporučení Sekce neuroimunologie a likvorologie České neurologické společnosti JEP
- Využití perkutánní endoskopické gastrostomie – přehled indikací, popis techniky a současné trendy v neurologii
- Diagnostické možnosti zobrazovacích metod v hodnocení morfologického korelátu kognitivních změn u pacientů s roztroušenou sklerózou
- Poruchy výživy a metabolizmu u Parkinsonovy nemoci
- Měření kognitivního deficitu u pacientů po ošetření mozkových aneuryzmat
- Polysomnografické nálezy u dětí s poruchou pozornosti a hyperaktivitou (ADHD) vyšetřovaných pro poruchu spánku
- Léčba neurogenního hyperaktivního detruzoru po spinálním poranění aplikací botulinumtoxinu A. Porovnání endoskopické subslizniční a intramuskulární aplikace
- Naše zkušenosti s laterálním supraorbitálním přístupem při operacích mozkových aneuryzmat
- Diagnostika a léčba demence českými neurology a psychiatry
- Endoskopická ventrikulostomie III. komory v léčbě hydrocefalu u dětí s mozkovými tumory – zkušenosti jednoho centra
- Zrakové funkce nedonošených dětí s perinatálním mozkovým postižením
- Obstrukční spánková apnoe a CPAP – má význam řešit nosní průchodnost?
- Detekcia anaplastických ložísk v kontrastnou látkou sa nevýrazne farbiacich infiltratívnych gliómoch pomocou 5-aminolevulovej kyseliny – správa o piatich prípadoch
- Terapeutické možnosti prevence cévní mozkové příhody u pacientů s karotickým stump syndromem – kazuistiky
- Oligosymptomatické formy myotonické dystrofie typu 2
- Odeznění traumatické pentaplegie u pacienta po kombinované zlomenině C1–C2
- Klinický standard pro diagnostiku a léčbu myasthenia gravis
- Webové okénko
- Analýza dat v neurologii - XXXII. Bayesovská vs klasická statistika v klinických aplikacích
- Prof. MUDr. Zdeněk Kadaňka, CSc., sedmdesátiletý
- Novinky v diagnostice a léčbě primárních nádorů mozku – závěry mezioborového setkání „Winter GLIO TRACK Meeting“ 2012
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Využití perkutánní endoskopické gastrostomie – přehled indikací, popis techniky a současné trendy v neurologii
- Posturálna instabilita, poruchy chôdze a pády pri Parkinsonovej chorobe
- Algoritmus vyšetření likvoru v návaznosti na doporučení Sekce neuroimunologie a likvorologie České neurologické společnosti JEP
- Obstrukční spánková apnoe a CPAP – má význam řešit nosní průchodnost?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání









