-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Využití traktografie začleněné do neuronavigace při operacích intraaxiálních tumorů mozku uložených v těsné blízkosti kortikospinální dráhy
Tractography in Neuronavigation during Intraaxial Brain Tumour Surgery Near Corticospinal Tract
Objective:
This study was conducted to assess the benefit of integrating corticospinal tract diffusion tractography into neuronavigation during operations for intra-axial brain tumours located close to the corticospinal tract.Methods:
Diffusion tractography was used, together with subcortical electric stimulation, to locate the corticospinal tract. Motor-evoked potentials elicited by stimulation were recorded. The method was used in five patients with intra-axial brain tumour (astrocytoma gr. II–IV).Results:
The corticospinal tract was successfully confirmed by electro-stimulation in the approximate location predicted by diffusion tractography in all patients. Resection of the tumour was terminated when motor-evoked potentials were elicited by a stimulus current of 15 mA (monopolar stimulation, train of four pulses at a frequency of 500 Hz and pulse duration of 400 µs). No patient has since suffered from new permanent neurological deficit.Conclusion:
Although we remain convinced that, due to the brain shift that occurs during tumour resection, it is not enough to rely solely on the projections of the corticospinal tract in neuronavigation without electrophysiological validation of the tract course, diffusion tractography integrated into neuronavigation appears to be a valuable guide for the identification of the corticospinal tract in the surgical field.Key words:
neuronavigation – diffusion tractography – corticospinal tract – motor evoked potentials – brain tumours – diffusion tensor imaging
Autoři: E. Neuman 1; T. Svoboda 1; P. Fadrus 1; M. Keřkovský 2; A. Šprláková-Puková 2
Působiště autorů: LF MU a FN Brno Neurochirurgická klinika 1; LF MU a FN Brno Radiologická klinika 2
Vyšlo v časopise: Cesk Slov Neurol N 2011; 74/107(6): 675-680
Kategorie: Krátké sdělení
Souhrn
Cíl:
Práce hodnotí přínos traktografie kortikospinální dráhy začleněné do neuronavigace při operacích intraaxiálních nádorů mozku, jež se nacházejí v těsné blízkosti kortikospinální dráhy.Soubor a metodika:
Traktografie je využívána v kombinaci s elektrofyziologickými metodami (se subkortikální elektrickou stimulací k vybavení motorických evokovaných potenciálů) k nalezení kortikospinální dráhy. Soubor tvoří pět pacientů s intraaxiálním tumorem (astrocytomy gr. II–IV).Výsledky:
U všech pacientů v souboru se podařilo elektrostimulací potvrdit kortikospinální dráhu v přibližné lokalizaci předpovězené traktografií. Resekce byla ukončována při vybavení motorických evokovaných potenciálů při stimulačním proudu 15 mA (monopolární stimulace, train čtyř impulzů o frekvenci 500 Hz a šířce 400 µs). V souboru nevznikl nový trvalý neurologický deficit.Závěry:
I když se vzhledem k posunům mozkové tkáně, ke kterým dochází při resekci tumoru, domníváme, že nelze dostatečně spoléhat pouze na zobrazení kortikospinální dráhy neuronavigací bez elektrofyziologického ověření jejího průběhu, jeví se traktografie jako cenné vodítko k nalezení průběhu kortikospinální dráhy v operačním poli.Klíčová slova:
neuronavigace – traktografie – kortikospinální dráha – motorické evokované potenciály – mozkové nádory – zobrazení difuzních tenzorůÚvod
Operace intraaxiálních nádorů uložených v blízkosti motorických funkčních oblastí zůstávají i přes použití moderních technologií zahrnujících neuronavigaci (bezrámovou stereotaktickou navigaci) a elektrofyziologický monitoring nadále rizikové z hlediska možného poškození neurologických funkcí podílejících se na pohybu. Základním předpokladem dobrého funkčního výsledku je znalost uložení funkčních oblastí, resp. jejich nalezení při operaci.
Vyhledání funkčních motorických oblastí na mozkové kůře nebývá zpravidla obtížné. Zvrat fáze somatosenzorických potenciálů [1] umožní lokalizaci sulcus centralis a elektrická stimulace kůry se sledováním motorických evokovaných potenciálů (MEP) [1] umožní ověřit polohu precentrálního gyru.
Avšak v hloubce bílé hmoty nejsou již přítomny anatomické struktury, které by dovolovaly byť jen odhadovat, jak funkčně významná je která lokalita. Lze se samozřejmě pokusit stimulací na resekčních plochách v bílé hmotě nalézt případný průběh funkčně důležité (konkrétně kortikospinální) dráhy, avšak pro nepřítomnost anatomických záchytných bodů je takovéto hledání tápání s nejistým výsledkem. Přitom poranění nervových drah bílé hmoty má přinejmenším stejný funkční dopad jako poranění korových oblastí.
Traktografie vycházející z difuzně vážených obrazů magnetické rezonance (MR) umožňuje zobrazení silnějších svazků nervových drah v bílé hmotě mozku. Mezi dráhy, které je možné zobrazit, patří i kortikospinální dráha. Je tak možné sledovat prostorový vztah kortikospinální dráhy a léze chystané k operaci, například intraaxiálního tumoru. Ukázka MR s rekonstrukcí kortikospinální dráhy je na obr. 1.
Obr. 1. 3D rekonstrukce MR vyšetření jednoho z pacientů (muž, 34 let, histologicky anaplastický astrocytom) s intraaxiálním tumorem v blízkosti kortikospinální dráhy. 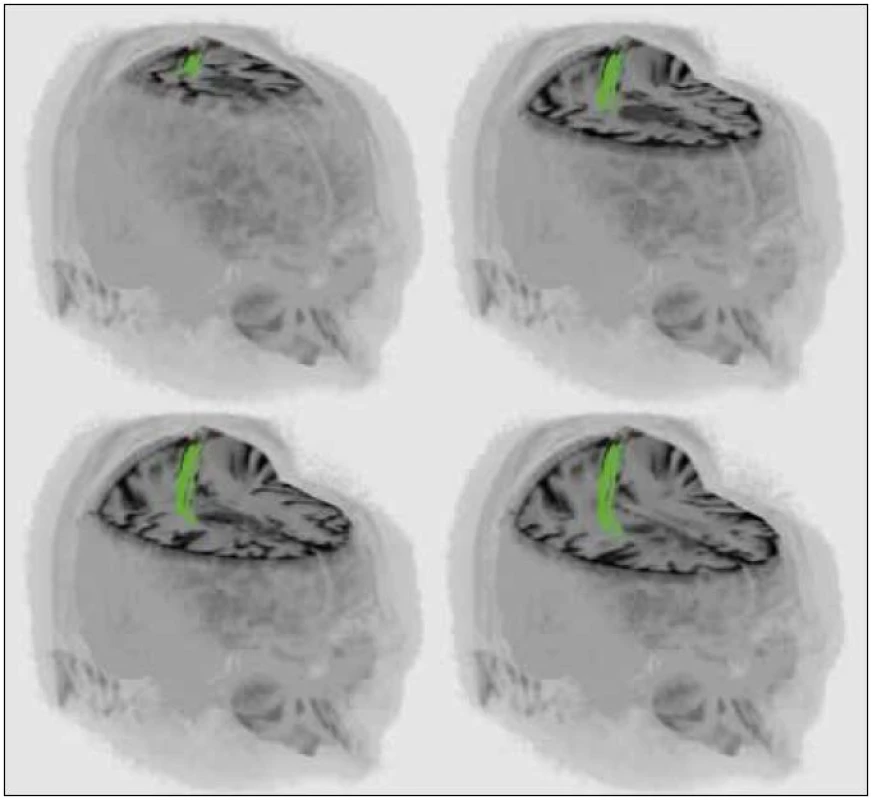
Myšlenka začlenění traktografie do neuronavigace se přímo nabízí. Avšak nezanedbatelný posun mozkové tkáně, ke kterému při resekčních výkonech dochází, již při teoretické rozvaze zpochybňuje spolehlivost detekce nervové dráhy v operačním poli pouze na základě údajů z neuronavigace.
Níže proto popisujeme své zkušenosti s kombinací obou přístupů – zobrazení kortikospinální dráhy v operačním poli pomocí neuronavigace a její ověření elektrofyziologicky – u operací intraaxiálních tumorů mozku lokalizovaných v těsném sousedství kortikospinální dráhy.
Metodika
Všichni pacienti podstoupili předoperační MR vyšetření na 1,5T přístroji. DTI vyšetření bylo provedeno technikou „single-shot“ echoplanárního zobrazení s použitím 32 opakovaných měření s různými směry přídatného magnetického gradientu o síle b = 1 000 mT/s, velikost voxelu 2 × 2 × 2 mm. K rekonstrukci průběhu kortikospinální dráhy byla provedena aplikace „FiberTrak“, která je součástí systému „MR extended workplace“ (release 2.6.3, Philips Medical Systems, Netherlands). Pro konečnou vizualizaci používáme projekci obrazu kortikospinální dráhy do T2 vážených obrazů echoplanárního zobrazení s nulovou hodnotou přídatného magnetického gradientu (b = 0), které jsou součástí DTI vyšetření.
Pro relativně nízké rozlišení (a současně pro pouze 2D reprezentaci snímků) nelze tyto snímky přímo použít k navigaci. Proto je v softwaru neuronavigace (Medtronic StealthStation) fúzujeme (tab. 1) se standardními navigačními skeny v T1 sekvenci (obr. 2). Pak pomocí nástrojů dostupných v navigaci vytvoříme trojrozměrný model kortikospinální dráhy a trojrozměrný model tumoru (obr. 3a). Obrysy obou objektů promítneme do navigačních skenů (obr. 3b–d). Současně jsou obrysy obou objektů při operaci promítány do zorného pole mikroskopu (Zeiss Pentero) (obr. 3e).
Obr. 2a. MR obraz anaplastického astrocytomu v navigační (T1) sekvenci (tentýž pacient jako na obr. 1). b) obdobný řez v T2 sekvenci s projekcí kortikospinální dráhy. c, d) fúze navigačního a traktografického obrazu v softwaru navigace, kortikospinální dráha je již zobrazena monochromaticky. 
Obr. 3a. 3D model kortikospinální dráhy a její vztah k tumoru, zeleně zobrazen tumor, červeně kortikospinální dráha. b–d) projekce 3D modelu kortikospinální dráhy a tumoru – obrázky z navigace. e) projekce kortikospinální dráhy a tumoru do operačního pole v zorném poli mikroskopu v hloubce odpovídající hloubce fokusu. Ve střední části obrázku patrná stimulační sonda přiložena na plochu resekce do oblasti zobrazení dráhy. f) odpovědi MEP ze svalů při stimulaci (po řadě – svaly tenaru, m. flexor carpi ulnaris, svaly hypotenaru, m. brachioradialis). 
V místech, kde se dle zobrazení v navigaci resekční plocha přibližuje ke kortikospinální dráze, resekční plochu kontrolujeme stimulací. Blízkost kortikospinální dráhy se potvrdí vyvoláním odpovědi v MEP (obr. 3f). V resekci postupujeme, dokud není dosaženo hranice tumoru anebo do okamžiku, kdy proud potřebný k vyvolání odpovědí MEP poklesne na 15 mA.
Vzhledem k tomu, že posun pyramidové dráhy může činit až 15 mm [2] a současně vzhledem k tomu, že manipulace ve vzdálenosti menší než cca 10 mm může již vést k ischemickému poškození kortikospinální dráhy [3], je nutné pro jistotu poprvé se stimulací začít již ve vzdálenosti cca 2 cm od dráhy dle navigace. Při tomto vyhledávání průběhu kortikospinální začínáme stimulovat proudem 15 mA a zvyšujeme jej až do nalezení odpovědi, nejvíce však do 30 mA.
Na monitorování MEP používáme přístroj Axon Eclipse. Monitorujeme zpravidla následující svaly: m. orbicularis oris, svaly tenaru, hypotenaru, m. brachioradialis, m. gastrocnemius, m. tibialis anterior, m. abductor hallucis. Subkortikálně stimulujeme monopolárně stimulační kuličkovou elektrodou zapojenou jako anoda, s referenční elektrodou (katodou) na pozici Fpz s frekvencí impulzů 2 Hz. Stimulační impulz – train čtyř dílčích impulzů o frekvenci 500 Hz a šířce 400 μs.
Pokud je tumor uložen tak, že je i primární motorická kůra dostupná ke stimulaci, pak monitorujeme MEP i kontinuálně během resekce při stimulaci stripovou elektrodou (jako anodou) s frekvencí 0,1 Hz.
Soubor
Kritériem k výběru pacientů byla jednak přítomnost intraaxiálního tumoru mozku těsně naléhajícího ke kortikospinální dráze (ve vzdálenosti okolo 5 až 10 mm) dle traktografického vyšetření a jednak také nepřítomnost těžkého předoperačního motorického deficitu (u těžkého motorického deficitu by pravděpodobně nebylo možno vybavit MEP).
Doposud jsme metodu použili u pěti pacientů. Jednalo se o tři muže a dvě ženy ve věkovém rozpětí od 34 do 80 let. Histologické nálezy – fibrilární astrocytom v jednom případě, anaplastický astrocytom ve dvou a glioblastom ve dvou případech.
Výsledky
Ve sledovaném souboru pacientů nevznikl pooperačně nový trvalý neurologický deficit. Přechodné zhoršení pohybu na končetinách jsme pozorovali ve čtyřech případech.
Kortikospinální dráhu se nám podařilo stimulací lokalizovat ve všech uváděných případech, resekci jsme vždy ukončili při udávané hodnotě stimulačního proudu 15 mA.
U dvou ze sledovaných pěti pacientů se podařilo takto resekovat tumor bez patrného rezidua ve směru ke kortikospinální dráze (hodnoceno podle pooperačního MR vyšetření). Příklad předoperačního a pooperačního MR vyšetření včetně průběhu kortikospinální dráhy jednoho ze zařazených pacientů je na obr. 4.
Obr. 2. MR jednoho ze zařazených pacientů, u tohoto pacienta se podařila resekce tumoru bez viditelného rezidua směrem ke kortikospinální dráze. a) předoperační snímek, axiální řez, obraz glioblastomu v levé hemisféře. b) fúze traktografie a předoperačního obrazu léze v axiálním řezu opět ukazuje těsný vztah léze ke kortikospinální dráze. c) pooperační MR, axiální řez, bez rezidua tumoru. d) předoperační snímek, sagitální řez. e) fúze traktografie a předoperačního obrazu léze v sagitálním řezu. f) pooperační MR, bez rezidua tumoru. 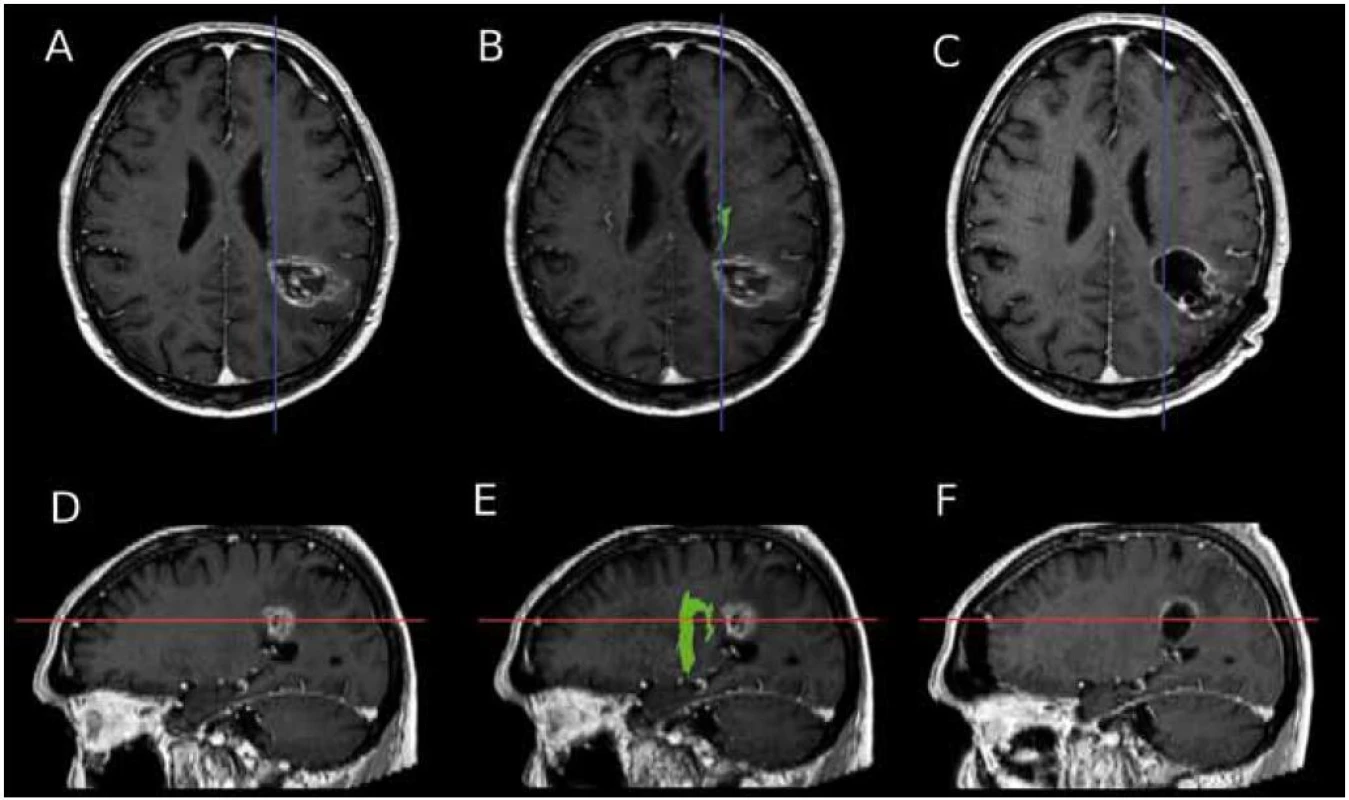
Diskuze
Hlavní přínos začlenění traktografie do neuronavigace je získání představy, v jakém prostorovém vztahu je kortikospinální dráha vzhledem k operačnímu poli. Získání představy o průběhu kortikospinální dráhy je bez možnosti začlenění do navigace obtížné – hlava pacienta bývá polohována individuálně dle uložení nádoru v různém sklonu a různě pootočená, a jak již bylo uvedeno, v hloubce bílé hmoty chybí jakýkoliv anatomický orientační bod – to vše znesnadňuje vytvoření a udržení anatomické představy o průběhu kortikospinální dráhy. Začlenění traktografie do neuronavigace, a zvláště pak projekce průběhu kortikospinální dráhy do obrazu operačního pole v mikroskopu, orientaci výrazně usnadňuje.
Pokud se subkortikální elektrickou stimulací podaří vybavit MEP, usuzujeme, že kortikospinální dráha se nachází v těsné blízkosti stimulované oblasti. Potíž ale je v tom, že nevíme, v jaké přesně vzdálenosti se dráha vyskytuje, pokud se ji podaří vystimulovat proudem o určité velikosti. Jisté je jen to, že nižšímu potřebnému proudu odpovídá menší vzdálenost. Jako práh stimulačního proudu, při kterém jsme ukončovali resekci, jsme zvolili 15 mA. Tuto hodnotu jsme vybrali na základě zkušenosti s kortikální stimulací. Kortikální MEP bývají zpravidla přibližně od této velikosti stimulačního proudu výbavné. Kortikospinální dráhu se nám takto podařilo ověřit ve všech případech.
Vzhledem k posunu mozkové tkáně, k němuž v průběhu resekce dochází [2], je k zobrazení kortikospinální dráhy nutno přistupovat spíše jako k orientačnímu vodítku než k zobrazené anatomické struktuře. Jelikož nemáme možnost provést peroperační MR, nemůžeme posuny tkáně v našem souboru pacientů zhodnotit.
Problematikou vzdálenosti kortikospinální dráhy a potřebného stimulačního proudu se zabývá článek autorů Kamada et al [3]. Autoři udávají pro proudy 20 mA, 15 mA, 10 mA a 5 mA tyto vzdálenosti – 16; 13,2; 9,6 a 4,8 mm. V práci Ostrého et al [1] se uvádí, že při stimulačním podnětu ≥ 10 mA je vzdálenost od dráhy bezpečná. S ohledem na údaje v těchto článcích by bylo pravděpodobně možné námi tolerovanou minimální hodnotu stimulačního proudu o několik miliampér snížit.
Zkušenosti se současným používáním elektrické stimulace a traktografie kortikospinální dráhy začleněné do neuronavigace popisuje práce autorů Mikuni et al [4]. Autoři v ní uvádějí, že kombinovaným využitím traktografie začleněné do neuronavigace a subkortikální elektrické stimulace byly dosaženo lepších funkčních výsledků než při izolovaném využití jen jedné nebo pouze druhé metody.
Traktografie prochází v současnosti bouřlivým vývojem spojeným s hledáním přesnějších rekonstrukčních algoritmů. Dosud však trpí důležitými omezeními, která je nutno brát v úvahu v jejím peroperačním používání [5].
Z hlediska náběru základních obrazových dat jde především o nejrůznější artefakty (pohybové artefakty, distorze v důsledku „vířivých“ proudů atd.), které v konečném důsledku snižují kvalitu rekonstrukcí.
Prostorová rozlišovací schopnost současných difuzně vážených MR obrazů používaných pro traktografii je poměrně nízká – jeden bod obrazu reprezentuje relativně velký objem cca 8 mm3. V takovémto objemu ale může procházet řada nervových vláken. Současná metodika DTI traktografie založená na gaussovském modelu procesu difuze může v tomto případě selhávat v místech křížení vláken, kde výpočetní algoritmus může mylně stopovat křížící se dráhy probíhající v různých směrech [6]. V těchto oblastech dochází též k „artificiálnímu“ snížení hodnoty frakční anizotropie a nechtěnému ovlivnění výsledků. Lze říci, že výpočetní algoritmus tak dokáže nejspolehlivěji zachytit a vyhodnotit ty oblasti, v nichž mají nervová vlákna víceméně stejný směr. Bylo by ale chybné předpokládat, že v těch bodech obrazu, kde algoritmus žádnou dráhu nezobrazí, žádná nervová vlákna nemohou probíhat.
Důsledkem uvedeného omezení rekonstrukčního algoritmu je fakt, že když se zobrazená kortikospinální dráha ve svém průběhu blíží ke korovým oblastem, nevětví se do vějíře vláken rozbíhajících se k jednotlivým korovým oblastem tak, jak je to běžně zobrazováno na anatomických kresbách a jak i ve skutečnosti probíhat musí. Namísto toho typicky končí v malé korové oblasti (obr. 5, obr. 1–5 byly zpracovány s použitím programu MedINRIA – http://gforge.inria.fr/projects/medinria), která rozsahem zdaleka neodpovídá primární motorické kůře. Jinými slovy, čím více se zobrazená dráha blíží korovým oblastem, tím méně se lze na obraz dráhy spolehnout.
Obr. 3. Trojrozměrný obraz kortikospinální dráhy na pozadí obrazu frakční anizotropie v koronárním řezu v úrovni precentrálního gyru. Výpočet frakční anizotropie je prvním krokem při traktografii. Frakční anizotropie vyjadřuje míru uspořádanosti nervových vláken v dané oblasti. Čím sytější je barva v určité oblasti obrázku, tím více nervových vláken procházejících oblastí má stejný směr. Barvy pak kódují, o jaký směr se jedná: modrá barva představuje směr shora-dolů, zelená směr předo-zadní, červená směr pravo-levý. Je patrné, že zobrazená kortikospinální dráha končí v malé oblasti precentrálního gyru – tam, kde je vysoká míra uspořádanosti nervových vláken reprezentovaná sytě modrým zbarvením – viz oblast pod bílou šipkou. Do oblasti pod žlutou šipkou naopak žádná zobrazená vlákna nesměřují, a to i přesto, že patří k primární motorické oblasti (jde přibližně o oblast zodpovědnou za pohyb ruky). Míra uspořádanosti nervových vláken je v oblasti pod žlutou šipkou nízká, což odpovídá nízké frakční anizotropii vyjádřené málo sytými barvami. Rekonstrukční algoritmus traktografie nedokáže zde probíhající vlákna zachytit. Vpravo dole je pro připomenutí schéma reprezentací částí těla na mozkové kůře a také náčrt probíhajících kortikospinálních (a kortikobulbárních) drah. Jedná se o vyšetření stále téhož pacienta jako v předchozích obrázcích, na průběhu kortikospinální dráhy je patrná defigurace daná přítomností tumoru. 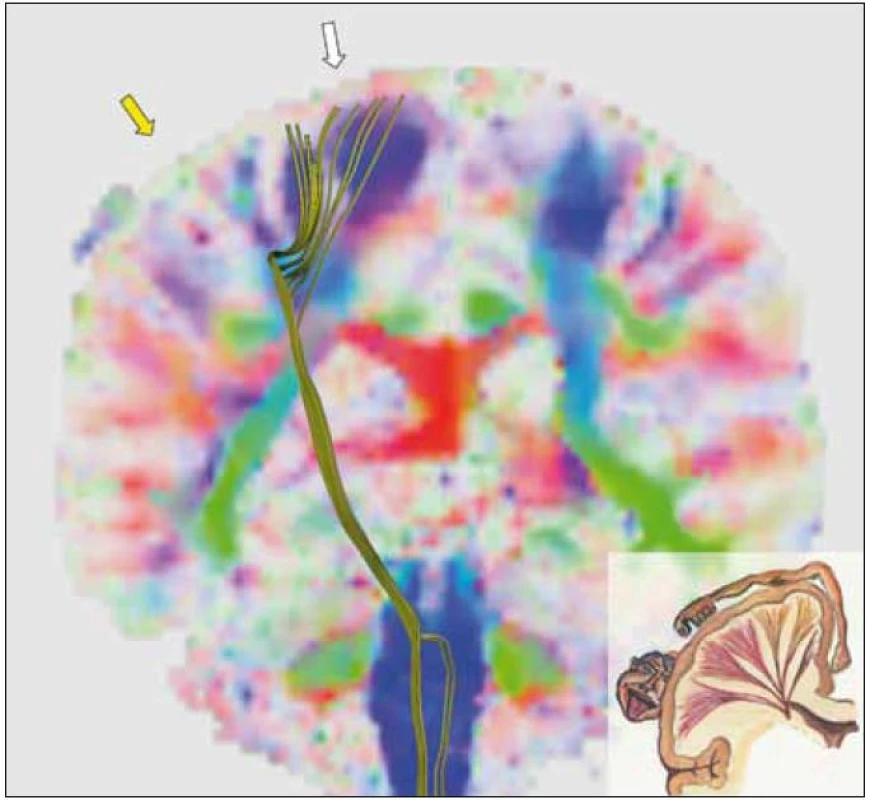
V neposlední řadě je nutno vzít v úvahu problémy při stopování dráhy vzniklé v důsledku působení vlastní tumorózní expanze na okolní bílou hmotu, kde dochází ke kompresi tkáně, zvýšení podílu extracelulární tekutiny (edém) a k degenerativním změnám tkáně [7]. Bylo zjištěno, že vazogenní edém v okolí tumorů vede ke snížení hodnoty frakční anizotropie [8], spolehlivost rekontrukčního algoritmu proto v těchto oblastech nemusí být stoprocentní.
V české literatuře se problematikou začlenění fraktografie do bezrámové navigace zabývá práce Zolala et al [9].
Závěr
Přestože začlenění traktografie do neuronavigace nemění u operací tumorů uložených v blízkosti kortikospinální dráhy průběh operace nebo operační strategii, usnadňuje orientaci v operačním poli. A i když traktografie v neuronavigaci představuje při nemožnosti korekcí posunu mozkové tkáně a při zmíněném omezení rekonstrukčního algoritmu pouze vodítko k nalezení kortikospinální dráhy prostřednictvím elektrostimulace, je to dle našeho názoru vodítko spolehlivé a cenné. K dosažení maximální, avšak bezpečné resekce je třeba získat více poznatků o vztahu velikosti potřebného stimulačního impulzu a vzdálenosti bodu stimulace od kortikospinální dráhy.
MUDr. Eduard Neuman
Neurochirurgická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: eneuman@fnbrno.cz
Přijato k recenzi: 28. 2. 2011
Přijato do tisku: 9. 5. 2011
Zdroje
1. Ostrý S, Stejskal L. Evokované odpovědi a elektromyografie v intraoperační monitoraci v neurochirurgii. Cesk Slov Neurol N 2010; 73/ 106(1): 8–19.
2. Nimsky C, Ganslandt O, Hastreiter P, Wang R, Benner T, Sorensen AG, Fahlbusch R. Preoperative and intraoperative diffusion tensor imaging based fiber tracking in glioma surgery. Neurosurgery 2005; 56(1): 130–137.
3. Kamada K, Todo T, Ota T, Ino K, Masutani Y, Aoki S et al. The motor-evoked potential threshold evaluated by tractography and electrical stimulation. J Neurosurg 2009; 111(4): 785–795.
4. Mikuni N, Okada T, Enatsu R, Miki Y, Hanakawa T, Urayama S et al. Clinical impact of integrated functional neuronavigation and subcortical electrical stimulation to preserve motor function during resection of brain tumors. J Neurosurg 2007; 106(4): 593–598.
5. Mukherjee P, Chung SW, Berman JI, Hess CP, Henry RG. Diffusion tensor MR imaging and fiber tractography: technical considerations. AJNR Am J Neuroradiol 2008; 29(5): 843–852.
6. Tournier JD, Yeh CH, Calamante F, Cho KH, Connelly A, Lin CP. Resolving crossing fibres using constrained spherical deconvolution: validation using diffusion-weighted imaging phantom data. Neuroimage 2008; 42(2): 617–625.
7. Schonberg T, Pianka P, Hendler T, Pasternak O, Assaf Y. Characterization of displaced white matter by brain tumors using combined DTI and fMRI. Neuroimage 2006; 30(4): 1100–1101.
8. Lu S, Ahn D, Johnson G, Cha S. Peritumoral diffusion tensor imaging of high-grade gliomas and metastatic brain tumors. AJNR Am J Neuroradiol 2003; 24(5): 937–941.
9. Zolal A, Sameš M, Vachata P, Bartoš R, Nováková M, Derner M. Použití DTI traktografie v neuronavigaci při operacích mozkových nádorů. Cesk Slov Neurol N 2008; 71/104 (3): 352–357.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Webové okénko
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2011 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Důvody a průběh novelizace české verze Addenbrookského kognitivního testu (ACE-CZ)
- Operační léčba poranění plexus brachialis
- Komentář k článku autorů Haninec a Kaiser Operační léčba poranění plexus brachialis
- Použití dotazníků aktivit denního života u pacientů s Alzheimerovou nemocí
- Parkinsonské fenotypy – na cestě k nové nozologii atypických parkinsonských syndromů
- Současný pohled na patofyziologii migrény
- Motorické aspekty poruch řeči u Parkinsonovy nemoci a jejich hodnocení
- Posturální reflexy v podmínkách zrakové poruchy
- Využití traktografie začleněné do neuronavigace při operacích intraaxiálních tumorů mozku uložených v těsné blízkosti kortikospinální dráhy
- Novelizace české verze Addenbrookského kognitivního testu (ACE-CZ)
- Rozšíření terapeutického časového okna pro intravenózní trombolýzu by nemělo vést k prodloužení „door-to-needle time“ intervalu
- Miller Fisherův syndrom – čtyři vlastní pozorování a přehled současných poznatků
- Parkinsonova nemoc s fenotypem progresivní supranukleární paralýzy – kazuistika
- Kognitivní a emocionální změny pět let po SAH – kazuistika
- Amisulprid v léčbě schizofrenie
- Webové okénko
- Analýza dat v neurologii - XXX. Validita klinických testů v širším kontextu
- MUDr. Jan Pařízek osmdesátníkem
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Miller Fisherův syndrom – čtyři vlastní pozorování a přehled současných poznatků
- Současný pohled na patofyziologii migrény
- Novelizace české verze Addenbrookského kognitivního testu (ACE-CZ)
- Operační léčba poranění plexus brachialis
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




