-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Prospektivní analýza subtypů a rizikových faktorů ischemické cévní mozkové příhody u dospělých do 50 let
Subtypes of Ischemic Stroke and Vascular Risk Factors up to the Age of 50 – a Prospective Study
Background:
Multiple risk factors (RF’s) have a role to play in the aetiology of ischemic stroke (IS), a disorder of considerable socio‑economic impact, in non‑elderly patients in their productive years. The aim of this study was to evaluate the aetiological subtypes of IS in non‑elderly (≤50 years) adults, its occurrence, and the type of vascular risk factors in different sex and age subgroups.Methods:
The set consisted of 96 consecutive non‑elderly patients (55 males; mean age 40 years ± 8.2) with first ischemic stroke (85.4%) or transient ischemic attack (14.6%) fromamong the total of 1,450 IS patients admitted to the Olomouc Teaching Hospital between January 2004 and December 2008. Detailed medical history, head magnetic resonance imaging/computedtomography, electrocardiography, transoesophageal echocardiography and coagulation examination were performed in all patients. Patients were divided by sex and into three age subgroups (<30, 31–40, 41–50 years). Stroke subtype was assessed in terms of the TOAST criteria. For statistical analysis, Pearson’s chi‑square test and Fisher’s exact test with Bonferroni correction for multiple comparisons were employed.Results:
The following IS subtypes were diagnosed: atherosclerotic macroangiopathy in two patients (2.3%), small vessel disease in 19 (19.2%), cardioembolism in 22 (22.9%), other determined causes in 23 (23.2 %) and undetermined cause in 30 (31.2%). Arterial hypertension was present in 50.0% of patients, hyperlipidemia (HLP) in 43.0%, cardioembolic source in 42.0%, smoking in 39.5%, diabetes mellitus in 15.6% and thrombophilia in 21.9%. HLP occurrence was significantly higher in the 41–50 age subgroup (47.9%, p = 0.048). Traditional stroke risk factors appeared more frequently among males, significantly HLP (54.5%, p = 0.007) and smoking (62.5%, p = 0.0001).Conclusions:
Traditional stroke RFs, especially hypertension, occurred frequently in the non‑elderly IS population, particularly in males.Key words:
ischemic stroke – age – aetiological subtype of ischaemic stroke – vascular risk factors
Autoři: A. Bártková 1; D. Šaňák 1; R. Herzig 1; I. Vlachová 1; J. Zapletalová 2; M. Král 1; P. Hluštík 1; P. Kaňovský 1
Působiště autorů: LF UP v Olomouci Iktové centrum, Neurologická klinika FN Olomouc 1; LF UP v Olomouci Ústav lékařské biofyziky a statistiky 2
Vyšlo v časopise: Cesk Slov Neurol N 2010; 73/106(2): 143-149
Kategorie: Původní práce
Souhrn
Úvod:
Ischemické cévní mozkové příhody (iCMP) představují významnou příčinu morbidity i mortality se zásadními socioekonomickými dopady především v populaci mladých nemocných v produktivním věku. Cílem studie bylo zjištění frekvence výskytu iCMP, jejich subtypů a vaskulárních rizikových faktorů v populaci pacientů do 50 let věku.Metodika:
Soubor tvoří 96 konsekutivních pacientů (věk 21–50; průměr 40 let ± 8,2 let) přijatých a prospektivně sledovaných pro první iCMP v Iktovém centru FN Olomouc v letech 2004–2008. Etiologický subtyp iktu byl určen dle Trial of Org 10172 in Acute Stroke Treatment (TOAST) klasifikace. Pro analýzy byl soubor rozdělen do věkových skupin a dále porovnán dle pohlaví. Statistické zpracování výsledků bylo provedeno pomocí chí‑kvadrát a Fisherova exaktního testu. Pro mnohonásobná porovnání sledovaných skupin byla použita Bonferroniho korekce.Výsledky:
Podle TOAST klasifikace byly zjištěny následující příčiny iktu: onemocnění malých tepen 19 (19,2 %), onemocnění velkých tepen 2 (2,3 %), kardioembolizmus 22 (22,9 %), jiné determinované ikty 23 (23,2 %) a nedeterminované ikty 30 (31,2 %). Arteriální hypertenze (AH) se vyskytla u 48 (50 %), hyperlipidemie (HLP) u 41 (42,7 %), diabetes (DM) u 15 (15,6 %), trombofilní stav u 21 (21,9%) pacientů. Frekvence výskytu HLP a kouření byly signifikantně vyšší u mužského pohlaví (p = 0,007; resp. 0,0001).Závěr:
I přes extenzivní vyšetřovací postup zůstává třetina iktů klasifikovaných jako nedeterminované. Ve sledovaném souboru byl zaznamenán významný výskyt tradičních vaskulárních rizikových faktorů, zejména AH. Nepříznivý kardiovaskulární profil byl zjištěn u mužského pohlaví.Klíčová slova:
ischemická cévní mozková příhoda – věk – etiologický subtyp ischemického iktu – vaskulární rizikové faktoryÚvod
Ischemické cévní mozkové příhody (iCMP) představují závažnou příčinu morbidity a mortality s dalekosáhlými socioekonomickými důsledky, především u mladých nemocných v produktivním věku. Roční incidence iCMP u osob do 45 let je v rozvinutých zemích odhadována na 6–20/100 000 obyvatel [1]. Ischemické ikty vyskytující se do 50 let věku tedy zahrnují asi 2–12% všech iCMP a jejich výskyt strmě narůstá od páté dekády [2]. V mladší populaci se vyskytují zejména méně obvyklé příčiny iktu, specifické pro mladší a střední věk (arteriální disekce, trombofilní stavy, komplikace gravidity), případně jejich kombinace s tradičními rizikovými faktory (RF) dobře známými v populaci starších pacientů: arteriální hypertenze (AH), hyperlipidemie (HLP), diabetes mellitus (DM), kouření. Cílem studie je prospektivní analýza výskytu, příčin a RF iCMP u nemocných do 50 let věku.
Metodika
Soubor pacientů
Do studie bylo zařazeno 96 konsekutivních pacientů (55 mužů, 21–50 let, průměrný věk 40,0 ± 8,2 let), z celkového počtu 1 450 nemocných přijatých od ledna 2004 do prosince 2008 pro první iCMP do Iktového centra Neurologické kliniky Fakultní nemocnice Olomouc (graf 1).
Graf 1. Pacienti s ischemickým iktem. 
Mozkový infarkt byl definován jako rychle se rozvíjející klinické známky ložiskového mozkového postižení trvající déle než 24 hod nebo vedoucí ke smrti, pokud klinické, laboratorní a základní zobrazovací vyšetření nesvědčí pro jinou příčinu neurologického deficitu [3]. Tranzitorní ischemická ataka (TIA) byla definována jako rychle rozvinuté klinické známky ložiskového mozkového postižení nebo poruchy monokulárního vizu, které typicky trvají méně než 1 hod, maximálně však 24 hod, pokud klinické, laboratorní a zobrazovací vyšetření nesvědčí pro jinou příčinu neurologického deficitu [4].
Provedená vyšetření
U všech pacientů byl proveden standardní diagnostický panel zahrnující krevní obraz a diferenciální rozpočet, aktivovaný parciální tromboplastinový čas (aPTT), protrombinový čas (PTT), INR, fibrinogen, sérové hladiny urey, kreatininu, albuminu a celkové bílkoviny, mineralogram, jaterní testy, glykemii, glykovaný hemoglobin, celkový cholesterol, triglyceridy (TAG), LDL a HDL cholesterol, C reaktivní protein, sedimentace erytrocytů (FW) a biochemické vyšetření moči [5]. U 90,6% pacientů byl proveden také trombofilní skríning: plazmatická hladina antikardiolipidových protilátek ve třídách IgG a IgM (ACLA IgG, M), protein C, S, antitrombin (AT), lupus antikoagulans (LA), rezistence proti aktivovanému proteinu C (APCr), Leidenská a protrombinová mutace. Při podezření na systémové revmatologické onemocnění bylo u 30% pacientů doplněno revmatologické laboratorní vyšetření: imunoelektroforéza a elektroforéza proteinů, hladina cirkulujících imunokomplexů (CIK), antinukleární protilátky (ANA), protilátky proti dvojspirálové DNA (anti ds‑DNA), protilátky proti extrahovatelným nukleárním antigenům (anti ENA), C3, C4 složky komplementu, revmatoidní faktor (RF), protilátky proti cytoplazmatickým granulím extrahovatelných neutrofilních granulocytů (ANCA). Dále bylo u všech nemocných provedeno zobrazení mozku buď pomocí magnetické rezonance (MR) včetně difuzí vážených obrazů (DWI) a magnetickorezonační angiografie (MRA; 94,8%) [6], nebo počítačová tomografie (CT; 5,2%). U nemocných s CT grafickým vyšetřením hlavy byly intrakraniální tepny zobrazeny pomocí intrakraniální barevně kódované ultrasonografie (TCCD). Mezi provedená vyšetření patřil standardní 12svodový elektrokardiograf (100%) a 24hodinový EKG holterovský monitoring (71%), rentgenové vyšetření srdce a plic a triplexní ultrasonografie magistrálních mozkových tepen (100%). Pomocí transezofageální echokardiografie (TEE) bylo vyšetřeno 80% pacientů, u zbývajících 20% nemocných nebylo jícnové vyšetření technicky možné, proto byla použita transtorakální sonda.
Sledované rizikové faktory
Výskyt jednotlivých vaskulárních RF byl stanoven na základě anamnestických dat a výsledků provedených vyšetření. AH byla definována jako opakovaně zjištěné hodnoty systolicko‑diastolického tlaku krve nad 140/90 mmHg nebo potřeba antihypertenzní medikace. Diagnóza HLP byla stanovena při překročení cílových laboratorních hodnot uvedených v doporučení České společnosti pro aterosklerózu nebo při léčbě hypolipidemiky [7]. Definice DM byla vytvořena podle současné klasifikace [8] anebo při potřebě režimové a medikamentózní terapie. Vzhledem k nízké četnosti výskytu DM v souboru byl zahrnut typ 1 a 2 do společné kategorie. Primární a sekundární antifosfolipidový syndrom (APS) byl diagnostikován po splnění klinických i laboratorních mezinárodních kritérií pro APS z roku 2001 [9]. Do kategorie kuřáků byli zařazeni pacienti kouřící více než jednu cigaretu denně minimálně šest měsíců před iCMP [10]. Migrenózní infarkt byl definován na základě kritérií International Headache Society z roku 2004 [11].
Výskyt uvedených vaskulárních RF byl sledován dle pohlaví a dále ve třech věkových skupinách. První skupinu tvořili pacienti do 30 let (13 pacientů), druhou mezi 31. a 40. rokem (36 pacientů) a třetí mezi 41. a 50. rokem věku (47 pacientů).
Etiologická klasifikace iktu
Etiologická diagnóza iktu byla stanovena na základě vyhodnocení výsledků provedených vyšetření neurologem s cerebrovaskulární erudicí pomocí kritérií TOAST [12]. Do kategorie etiologicky nedeterminovaných iktů byli zařazeni: a) nemocní, u kterých byl zvažován více než jeden mechanizmus vzniku iktu, nebo b) nemocní, u nichž se nepodařilo příčinu jednoznačně objasnit. Kauzalita stavů s nízkým nebo nejasným potenciálem vzniku ischemického iktu, např. u poruchy koagulace a patentního foramen ovale (PFO), byla stanovena až po vyloučení jiných příčin.
Statistické vyhodnocení
Statistické zpracování výsledků bylo provedeno pomocí chí‑kvadrát a Fisherova exaktního testu. K vyloučení chyby při mnohonásobné porovnání byla využita Bonferroniho korekce. Ke statistické analýze dat byl použit software SPSS verze 15 (SPSS Inc., Chicago, USA). Hladina signifikance provedených testů byla 0,05.
Souhlas etické komise
Studie byla provedena se souhlasem lokální etické komise Fakultní nemocnice Olomouc podle pravidel Helsinské deklarace z roku 1975 (revidovaných v letech 1983 a 2004). Všichni pacienti podepsali informovaný souhlas.
Výsledky
Dle klasifikace TOAST (graf 2) bylo do kategorie onemocnění malých tepen (small vessel disease) zařazeno celkem 19 (19,2%) pacientů a do kategorie onemocnění velkých tepen (large vessel disease) dva (2,3%) pacienti. Kardioembolický iktus prodělalo celkem 22 (22,9%) nemocných. Přesvědčivý kardiální embolizační zdroj byl nalezen 15krát, tj. ve 37,5% celkově zjištěných patologických kardiálních nálezů. Nejistý zdroj embolizace byl zjištěn 25krát (tj. ve 62,5%) – podrobně tab. 1. Skupinu tzv. jiných určených iktů (other determined) tvořilo 23 (23,2%) nemocných. Přehled příčin je uveden v tab. 2.
Graf 2. Subtypy ischemického iktu dle věku. 
Tab. 1. Přehled zjištěných kardiálních embolizačních příčin. 
Tab. 2. Jiné determinované ikty – příčiny. 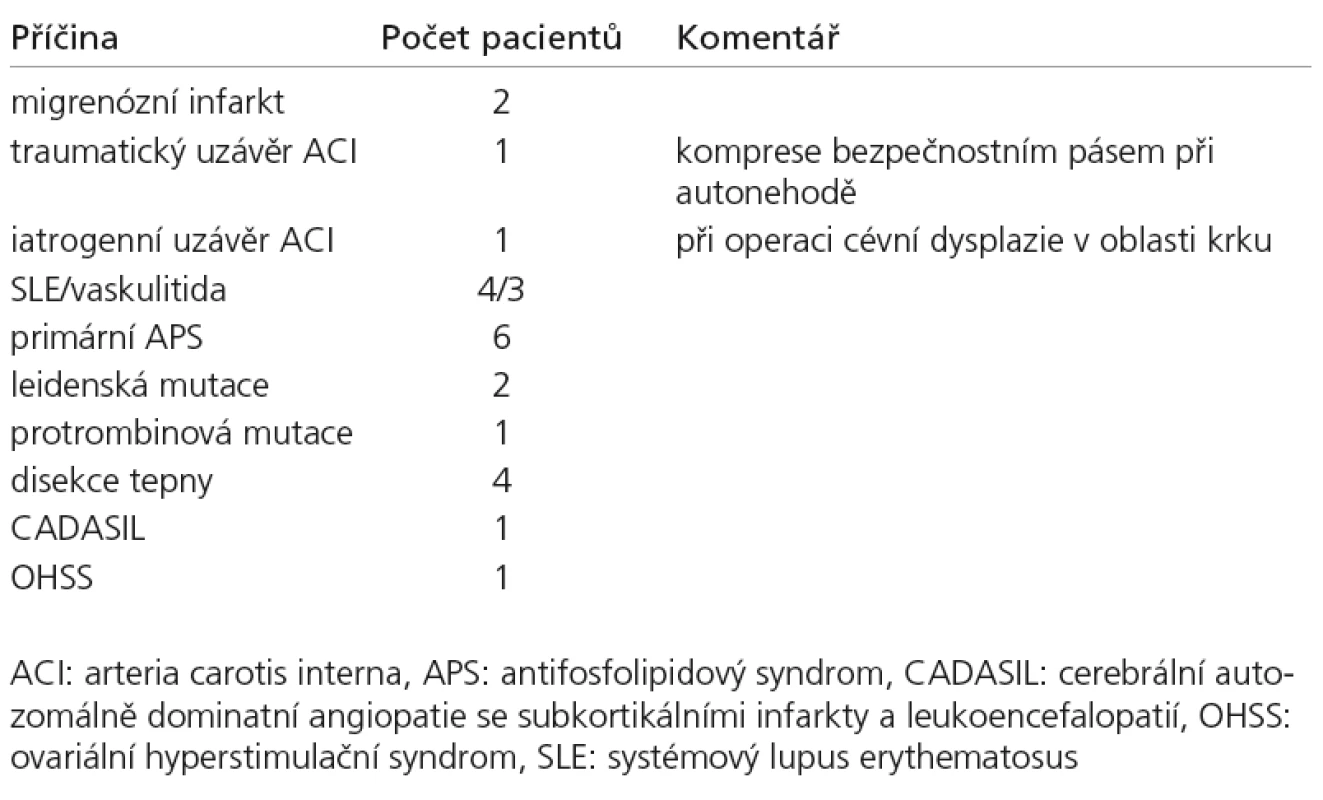
Do kategorie etiologicky nedeterminovaných iktů (undetermined) bylo zařazeno 30 (31,2%) pacientů. V 15 případech byl zvažován více než jeden mechanizmus vzniku iktu a u zbývajících 15 pacientů se i při pečlivém vyšetření příčinu nepodařilo objasnit.
Po rozdělení celého souboru do tří věkových skupin nebyl prokázán statisticky signifikantní rozdíl v distribuci subtypu iktu mezi danými skupinami (p = 0,096).
Tab. 3 uvádí rozložení vaskulárních RF v jednotlivých věkových skupinách. AH, DM, kardiální patologie s embolizačním potenciálem, trombofilie a kouření se vyskytovaly s rovnoměrnou distribucí napříč věkovými skupinami. Distribuce HLP byla signifikantně vyšší ve skupině mezi 41–50 lety, v porovnání s nemocnými do 30 let.
Tab. 3. Distribuce vaskulárních rizikových faktorů ve třech věkových skupinách. 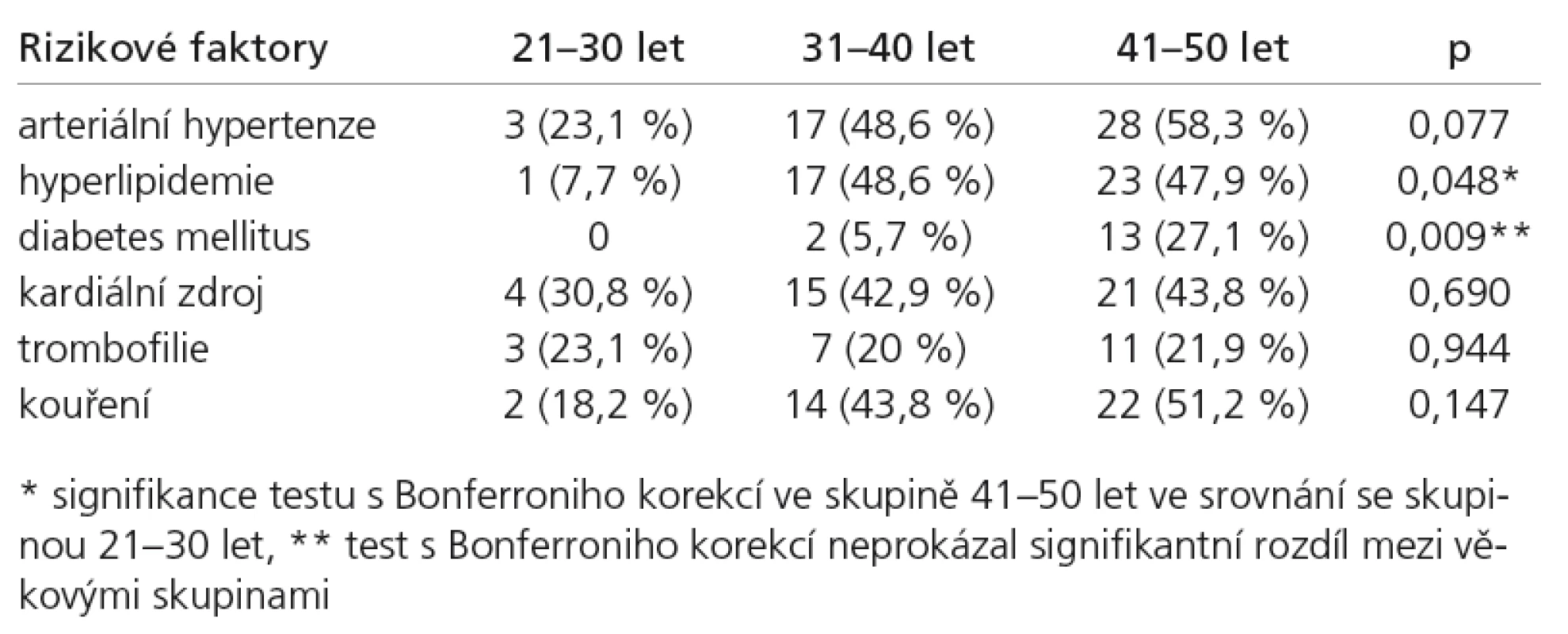
Při porovnání výskytu jednotlivých RF podle pohlaví byl u mužů zjištěn signifikantně vyšší výskyt HLP a kouření. Ve výskytu AH, DM, ICHS a trombofilie se muži a ženy nelišili statisticky významně (tab. 4). Hormonální antikoncepci užívalo 11 žen (26,8%) ve sledovaném souboru. U čtyř žen užívajících antikoncepci bylo současně zjištěno PFO a u dvou hyperkoagulační stav (jedenkrát rezistence proti aktivovanému proteinu C, jedenkrát APS).
Tab. 4. Distribuce rizikových faktorů podle pohlaví. 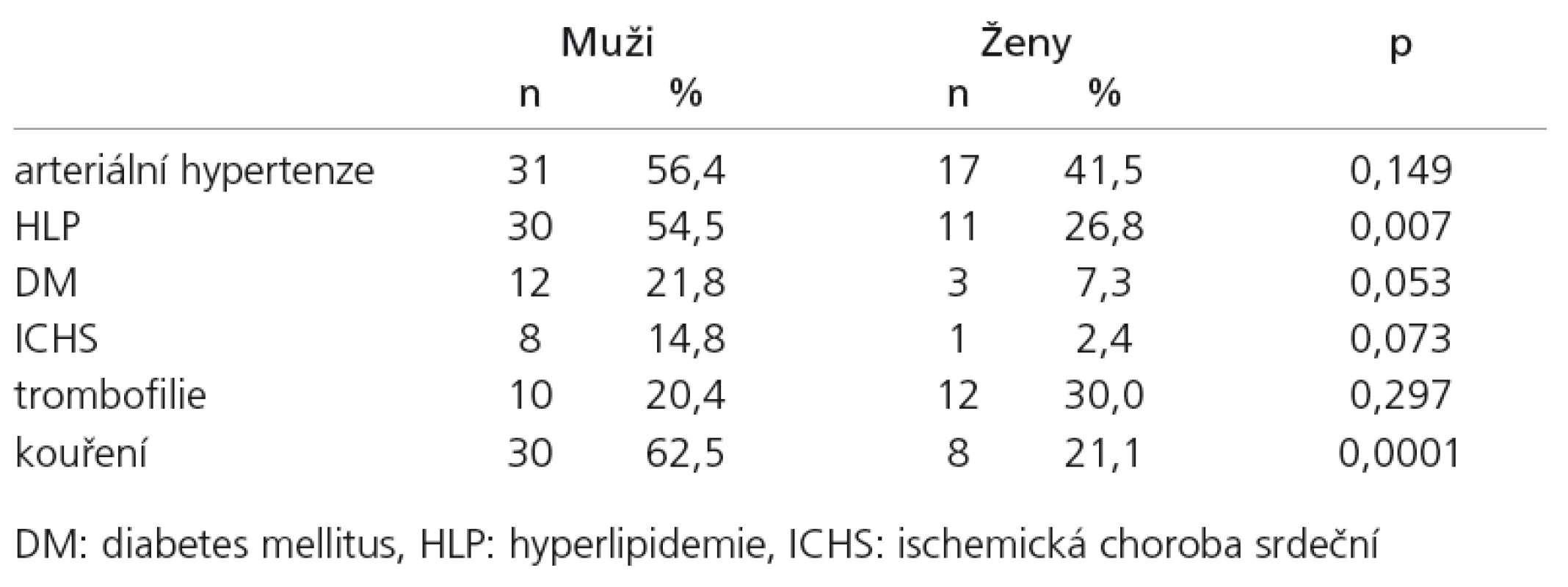
Při analýze distribuce vaskulárních rizik u subtypů mozkového infarktu dle klasifikace TOAST byl prokázán vyšší výskyt AH ve skupině onemocnění malých tepen ve srovnání s ikty kardioembolickými, resp. jinými určenými. Závislost mezi výskytem HLP, DM, kouření a subtypy iktu nebyla statisticky signifikantní (tab. 5). Nicméně u devíti pacientů nebyla anamnéza nikotinizmu odebrána.
Tab. 5. Distribuce rizikových faktorů u jednotlivých subtypů iktu dle TOAST klasifikace. 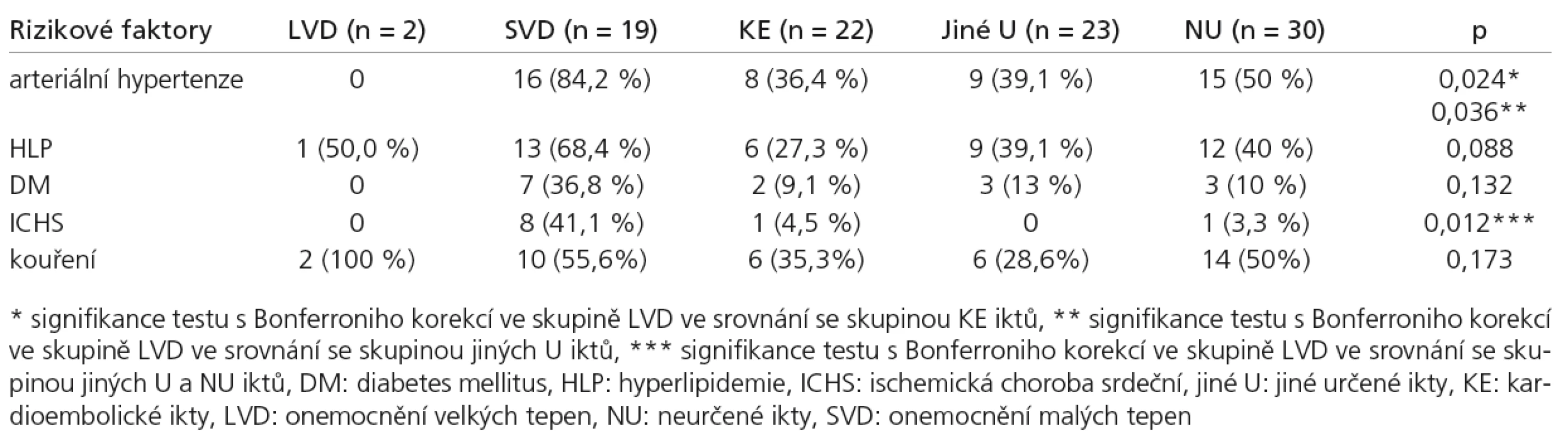
Diskuze
Prezentovaná prospektivní studie představuje soubor 96 pacientů do 50 let věku přijatých do Iktového centra Neurologické kliniky FN Olomouc během pěti let. Po rozdělení souboru do věkových skupin bylo dosaženo, podle očekávání, nejvyššího početního zastoupení ve skupině pacientů páté dekády. V celém souboru mírně převažovali muži (57%) shodně s většinou publikovaných evropských studií [13–15], ve kterých bylo zjištěno vyšší zastoupení mužů (59–62%) s jasným nárůstem dominance mezi 40.–50. rokem věku. Podle stejných autorů byly ženy silněji zastoupeny ve skupině nejmladších nemocných do 30 let věku [12–14], tento trend se v analyzovaném souboru nevyskytl. Rasura et al nenašli ve své sérii významnější rozdíl v zastoupení mužů a žen (47,5% mužů) [16].
Aterosklerotické postižení velkých a malých tepen bylo u sledovaného souboru zjištěno ve 21,5%, zejména u osob ve věku nad 40 let, zcela ojediněle pak ve čtvrté věkové dekádě. Podle literárních zdrojů se procentuální zastoupení aterosklerotické makro ‑ a mikroangiopatie pohybuje u mladší populace mezi 8–38% [2,15–21]. Do kategorie jednoznačných kardioembolických iktů bylo zařazeno 22,9% pacientů sledovaného souboru. U zbylých nemocných byla při nálezu potenciálního embolizačního substrátu zvažována i jiná etiologie, a proto byli zařazeni do skupiny neurčených iCMP. Nejčastěji se vyskytly méně pravděpodobné či nejisté zdroje, zejména PFO (45% zjištěných kardioembolizačních příčin), popřípadě PFO asociované s aneuryz-matem septa síní (10% zjištěných kardioembolizačních příčin). Kauzalita PFO a iktu zůstává nadále předmětem kontroverzí. V literatuře se opakovaně uvádí vyšší frekvence PFO ve skupině nemocných s ischemickým iktem do 55 let věku oproti zdravým kontrolám [22]. S ohledem na vysokou prevalenci PFO v obecné populaci (20%) a frekventní nález dalších vaskulárních RF u pacientů s PFO [23,24], je při interpretaci příčinné souvislosti PFO a iktu doporučována obezřetnost [5]. V prezentovaném souboru bylo PFO považováno za možnou příčinu kardioembolického iktu až po vyloučení pravděpodobnějšího substrátu. Významnou úlohu při potenciaci rizika hraje pravděpodobně kombinace PFO s dalšími RF, v analyzovaném souboru např. s rezistencí proti aktivovanému proteinu C a Leidenskou mutací faktoru V nebo užíváním hormonální antikoncepce. Nejčastějším vysoce pravděpodobným zdrojem byly fibrilace síní a nebakteriální endokarditida při APS. Nebakteriální APS indukovaná endokarditida činila i nejvíce diagnostických potíží. V diferenciální diagnóze bylo uvažováno o septické endokarditidě a v jednom případě byl nález vegetace na mitrální chlopni považován za myxom. Definitivní potvrzení diagnózy přinesla až regrese útvaru při antikoagulační terapii. Perzistence levé horní duté žíly, patřící mezi velmi vzácné vrozené vývojové vady srdce, se u jedné z pacientek klinicky manifestovala drobným kardioembolickým iktem. Na rozdíl od práce Adamse et al [25] se v prezentovaném souboru pouze v ojedinělých případech vyskytly degenerativní valvulopatie, respektive prostetická náhrada srdeční chlopně. Nízkou frekvenci si autoři, ve shodě s výsledky evropských studií [2,15,20], vysvětlují zanedbatelným výskytem revmatické horečky v české populaci a geografické oblasti.
Kategorii jiných určených iktů představuje široká škála různých příčin a vyvolávacích faktorů. V prezentovaném souboru tvořilo toto kategorii 23,2% nemocných (tab. 2). Tepenná disekce magistrálních krčních tepen byla nalezena u 5% nemocných. V naprosté většině nepředcházel disekci výraznější mechanický inzult a drobné trauma bylo zjištěno retrospektivně až po cílených anamnestických dotazech. Podle literárních zdrojů se výskyt disekce ve skupině pacientů do 50 let pohybuje od 2% (uvedených v práci Kittnera z roku 1998) [18] do 15–24% (podle recentních studií Putaaly et al a Nedeltcheva et al) [15,26]. Nízké procento výskytu disekce ve sledovaném souboru si autoři vysvětlují i při vysoké senzitivitě ultrazvukového vyšetření možným poddiagnostikováním, neboť invazivní digitální subtrakční angiografie, suverénní v diagnostice disekce na úrovni baze lební, nebyla prováděna standardně. Naopak koagulopatie, zejména získané, prezentované primárním a sekundárním APS, byly ve sledovaném souboru zastoupeny poměrně často. Ojediněle se vyskytly hereditární trombofilní stavy, jako Leidenská a protrombinová mutace, zatímco deficit proteinu C, S a antitrombinu nebyl prokázán. Relativně vyšší frekvenci výskytu APS (10,4%) oproti publikovaným zdrojům (3,3; resp. 4%) [15,21] si autoři vysvětlují provedením detailního hematologického vyšetření jak v akutní fázi, tak i v časovém odstupu a aktivní depistáží těchto pacientů. Frekvence ostatních příčin, jako cerebrální autozomálně dominantní angiopatie se subkortikálními infarkty a leukoencefalopatií, ovariálního hyperstimulačního syndromu [27], případně migrenózního infarktu byla spíše kazuistické povahy. Trombóza cerebrálních žilních splavů se ve sledovaném období na pracovišti autorů nevyskytla.
Přes poměrně rozsáhlé diagnostické možnosti zůstává nadále velká skupina pacientů s nedeterminovaným iktem. V prezentovaném souboru tento subtyp zahrnovalo 31,2% nemocných. Ve stejném početním zastoupení sem byli zařazeni pacienti s více možnými mechanizmy vzniku iktu (15,6%) a nemocní, u nichž se příčinu navzdory podrobnému vyšetření nepodařilo objasnit (15,6%). Lze předpokládat, že při stále pokročilejších diagnostických možnostech bude nedeterminovaných iktů ubývat. Proto je, při srovnání s literaturou, překvapivé, že od začátku 90. let minulého století doposud zůstává třetina ischemických iktů etiologicky neurčena [1,15,21,25]. Přehled distribuce subtypů mozkového infarktu podle TOAST klasifikace ve studiích z posledních let uvádí tab. 6.
Tab. 6. Subtypy ischemického iktu u pacientů do 50 let – přehled literatury. 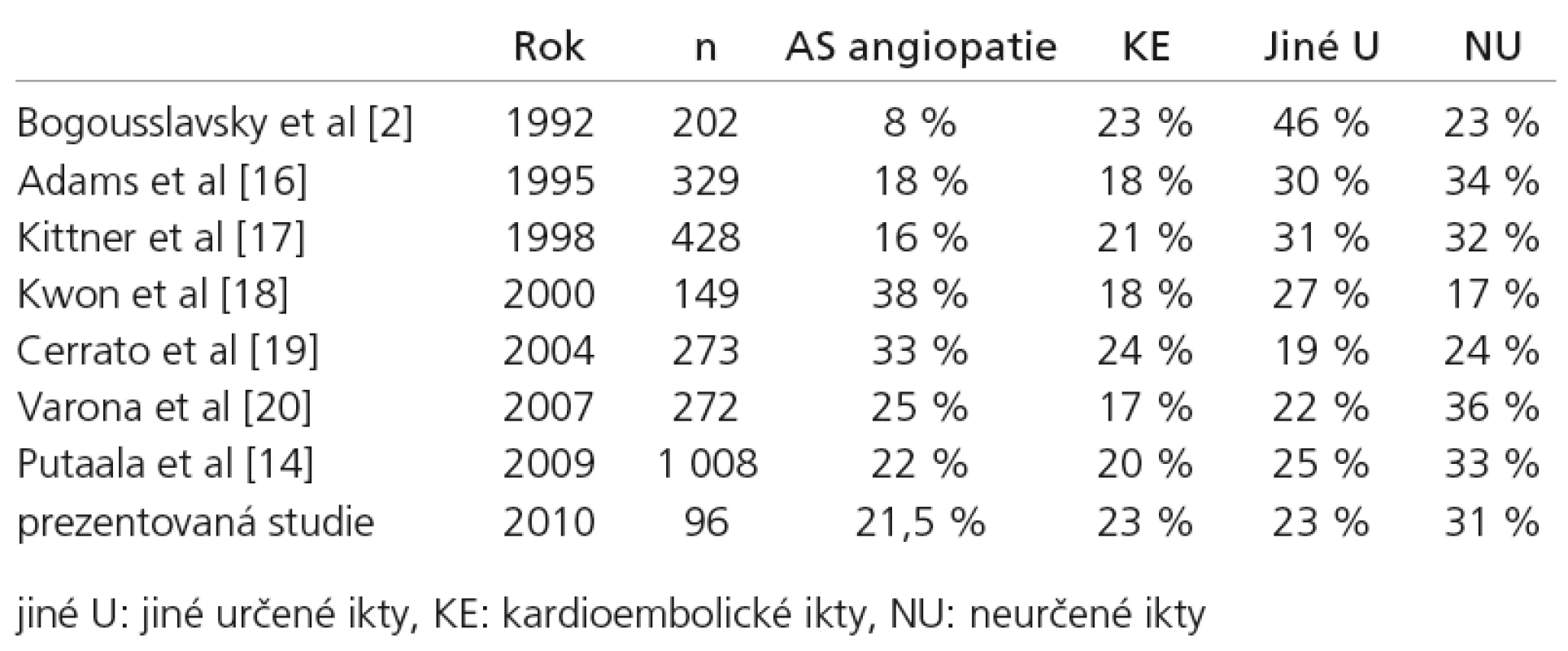
Nejvýznamnějšími z tradičních vaskulárních RF byly ve sledovaném souboru AH (50% pacientů) a HLP (42,7% pacientů). Frekvence výskytu AH se mezi jednotlivými věkovými skupinami statisticky signifikantně nelišila, a to i přesto, že byl zjištěn předpokládaný trend nárůstu výskytu do páté věkové dekády. Naopak výskyt HLP byl očekávaně ve skupině mezi 41.–50. rokem věku signifikantně vyšší.
Při sledování výskytu vaskulárních RF podle pohlaví bylo zjištěno signifikantně vyšší zastoupení HLP a kouření u mužů. Vyšší frekvence výskytu AH, DM a ICHS s vazbou na mužské pohlaví nebyla v analyzovaném souboru statisticky signifikantní (tab. 4). Nepříznivý kardiovaskulární profil je obecně u mužů pozorován přibližně od páté dekády [15]. Tato kumulace rizik v mužské populaci může být jednou z příčin vyšší incidence mozkového infarktu i nižšího věku výskytu prvního iktu u mužů. Dalšími faktory, které zesilují riziko prvého iktu u mužů v produktivním věku, jsou i vyšší výskyt obezity a vysoká spotřeba alkoholu v populaci mužů mladšího a středního věku.
Appelros et al ve své epidemiologické metaanalýze uvádí o 33% vyšší incidenci a o 41% vyšší prevalenci iktu u mužů ve srovnání se ženami. Podle stejné práce je průměrný věk prvního iktu u mužů 68,6 roku, zatímco u žen 72,9 let. [28]. Při sledování základních vaskulárních RF v české populaci uvádějí autorky Cífková a Škodová [29] prevalenci AH v letech 2000/2001 u obou pohlaví 39,1%, u mužů 45,6%, u žen 33% se sestupným trendem od roku 1985. Podle stejné práce kouřilo na přelomu milénia asi 40% českých mužů a 25% českých žen. Na vysoké prevalenci hypertenze, zvláště u mužů, se v české populaci může podílet i vysoká konzumace alkoholu, zejména piva [29].
Při analýze distribuce vaskulárních rizik u jednotlivých subtypů iCMP a TIA dle klasifikace TOAST byl očekávaným zjištěním vyšší výskyt AH ve skupině onemocnění malých tepen ve srovnání s kardioembolickými, resp. jinými určenými ikty. Vliv AH, DM a HLP na progresi aterotrombózy drobných mozkových tepen byl již opakovaně prokázán [30–32]. Naopak v práci Bejota et al [33] byla pozorována těsnější spojitost mezi AH a DM ke skupině nelakunárních iktů. Srovnání s prezentovanou studií je problematické pro absenci věkové adjustace rizikových faktorů na mladší populaci. Ve sledovaném souboru nebyla, na rozdíl od AH, závislost HLP a DM na subtypu iktu statisticky prokázána. K podobným závěrům u mladších nemocných došli ve své práci i Cerrato et al [20].
Základní limitací naší práce je malý počet subjektů v souboru, který vysvětluje sběr dat z jednoho centra v relativně krátkém časovém období pěti let. Podobně zaměřené publikované práce trvaly minimálně pět a více let [2,3,17–21]. Za horní věkovou hranici byl v našem souboru zvolen věk 50 let. Práce zabývající se problematikou ischemických iktů u mladší populace zahrnují nemocné do 45, resp. 49 let. Vyšší věková hranice souboru byla zvolena s ohledem na možnost registrace vývoje etiologie iktu a zastoupení rizikových faktorů od páté dekády směrem k tradičním příčinám známým v populaci starších nemocných. Vyšší věkový průměr tak vysvětluje vysokou frekvenci výskytu tradičních RF v analyzovaném souboru. Do studie nebyly zahrnuty některé z dalších rizikových faktorů, jako např. obezita, abúzus alkoholu a hyperhomocysteinemie, které by vedly ke komplexnímu vyhodnocení rizikového profilu pacientů s iCMP v mladším a středním věku. Nicméně podle jiné recentní studie se chronická konzumace alkoholu v olomouckém regionu neuplatňuje jako RF iCMP, jak u mužů, tak u žen [34].
Vzhledem k chybě malých čísel nebyl anamnestický údaj o užívání hormonální antikoncepce podroben dalšímu statistickému hodnocení. U malé části nemocných nebyl dodržen konzistentní vyšetřovací postup, případně nebyla odebrána detailní anamnestická data.
Závěr
Přesto, že etiologická škála je u mladších pacientů široká, tradiční rizikové faktory, zejména AH a HLP, hrají i v této věkové skupině důležitou úlohu.
Přes rozvinuté diagnostické postupy zůstává nadále poměrně velká část iktů u mladších nemocných neobjasněna. Pro primární a zejména sekundární prevenci je nezbytná pečlivá identifikace vaskulárních rizikových faktorů, včetně jejich kombinací, a jejich důsledná sanace. Pro názornou prezentaci rizikového profilu pacientů s iCMP se jeví být nadějnou nová fenotypická klasifikace iktu ASCO [35]. Její přínos, nejen u skupiny nedeterminovaných iktů, ukáže její užívání v klinické praxi.
Tato práce byla částečně podpořena výzkumným grantem MŠMT č. 6198959216.
Přijato k recenzi: 27. 10. 2009
Přijato do tisku: 4. 2. 2010
MUDr. Andrea Bártková
Neurologická klinika
LF UP a FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: abartkova@seznam.cz
Zdroje
1. Carolei A, Marini C, Di Napoli M, Di Gianfilippo G,Santalucia P, Baldassarre M et al. High stroke incidence in the prospective community‑based L’Aquila registry (1994–1998). First year’s results. Stroke 1997; 28(12): 2500–2506.
2. Bogousslavsky J, Pierre P. Ischemic stroke in patients under age 45. Neurol Clin 1992; 10(1): 113–124.
3. Mikulík R, Neumann J, Školoudík D, Václavík D. Standard pro diagnostiku a léčbu pacientů s mozkovým infarktem. Cesk Slov Neurol N 2006; 69/102(4): 320–325.
4. Neumann J, Mikulík R, Václavík D, Školoudík D. Standard pro diagnostiku a léčbu pacientů po tranzitorní ischemické atace. Cesk Slov Neurol N 2006; 69/102(4): 326–330.
5. European Stroke Organisation (ESO) Executive Committee, ESO Writing Committee. Guidelines for Management of Ischaemic Stroke and Transient Ischaemic Attack 2008. Cerebrovasc Dis 2008; 25(5): 457–507.
6. Sanák D, Nosáľ V, Horák D, Bártková A, Zelenák K,Herzig R et al. Impact of diffusion‑weighted MRI – measured initial cerebral infarction volume on clinical outcome in acute stroke patients with middle cerebral artery occlusion treated by thrombolysis. Neuroradiology 2006; 48(9): 632–639.
7. Doporučení pro diagnostiku a léčbu dyslipidemií v dospělosti, vypracované výborem České společnosti pro aterosklerózu. Cor Vasa 2007; 49(3): K73–K86.
8. From the NIH: New standards for classification and diagnosis of diabetes. JAMA 1980; 243(22): 2296–2297.
9. Wilson WA, Gharavi AE, Piette JC. International classification criteria for antiphospholipid syndrome: synopsis of a post‑conference workshop held at the Ninth International (Tours) aPL Symposium. Lupus 2001; 10(7): 457–460.
10. World Health Organization Europe. Evaluating Tobacco Control Activities: Experience and Guiding Principles. WHO: Geneva 1996.
11. Headache Classification Committee of international Headache Society. The International Classification of Headache Disorders. 2nd ed. Cephalalgia 2004; 24 (Suppl 1): 9–160.
12. Adams HP jr, Bendixen BH, Kapelle LJ, Biller J, Love BB, Gordo DL et al. Classification of subtype of acure ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Stroke 1993; 24(1): 35–41.
13. Kristensen B, Malm J, Carlberg B, Stegmayr B, Backman C, Fagerlund M et al. Epidemiology and etiology of ischemic stroke in young adults aged 18/44 years aged in northern Sweden. Stroke 1997; 28(9): 1702–1709.
14. Naess H, Nyland I, Thomassen L, Aarseth J, Myhr KM. Etiology and risk factors for cerebral infarction in young adults in western Norway: a population‑based case‑control study. Eur J Neurol 2004; 11(1): 25–30.
15. Putaala J, Metso AJ, Metso TM, Konkola N, Kraemer Y, Haaspaniemi E et al. Analysis of 1008 consecutive patients aged 15 to 45 with first ever ischemic stroke. Stroke 2009; 40(4): 1195–1203.
16. Rasura M, Spalloni A, Ferrari M, De Castro S, Patella R, Di Lisi F et al. A case series of young stroke in Roma. Eur J Neurol 2006; 13(2): 146–152.
17. Adams HP, Kappelle LJ, Biller J, Gordon DL, Love BB, Gomez F et al. Ischemic stroke in young adults. Experience in 329 patients enrolled in the Iowa Registry of stroke in young adults. Arch Neurol 1995; 52(5): 491–495.
18. Kittner SJ, Stern BJ, Wozniak M, Buchholz DW, Earley CJ, Feeser BR et al. Cerebral infarction in young adults: the Baltimore‑Washington Cooperative Young Stroke Study. Neurology 1998; 50(4): 890–894.
19. Kwon SU, Kim JS, Lee JH, Lee MC. Ischemic stroke in Korean young adults. Acta Neurol Scand 2000; 101(1): 19–24.
20. Cerrato P, Grasso M, Imperiale D, Priano L, Baima C,Giraudo M et al. Stroke in young patients: etiopathogenesis and risk factors in different age classes. Cerebrovasc Dis 2004; 18(2): 154–159.
21. Varona JF, Guerra JM, Bermejo F, Molina JA, Gomez de la Cámara A. Causes of ischemic stroke in young adults, and evolution of the etiological diagnosis over the long term. Eur Neurol 2007; 57(4): 212–218.
22. Ferro JM. Cardioembolic stroke: an update. Lancet Neurol 2003; 2(3): 177–188.
23. Kizer JR, Devereux RB. Clinical practice. Patent foramen ovale in young adults with unexplained stroke. N Engl J Med 2005; 353(22): 2361–2372.
24. Cramer SC. Patent foramen ovale and stroke prognosis and treatment in young adults. J Thromb Thrombolysis 2005; 20(2): 85–91.
25. Adams HP jr, Kapelle LJ, Biller J, Gordon DL, Love BB, Gomez F et al. Ischemic stroke in young adults. Experience in 329 patients enrolled in the Iowa Registry of stroke in young adults. Arch Neurol 1995; 52(5): 491–495.
26. Nedeltchev K, der Maur TA, Georgiadis D, Arnold M, Caso V, Mattle HP et al. Ischemic stroke in young adults: predictors of outcome and recurrence. J Neurol Neurosurg Psychiatry 2005; 76(2): 191–195.
27. Bartkova A, Sanak D, Dostal J, Herzig R, Otruba P, Vlachova I et al. Acute ischemic stroke in pregnancy: a severe complication of ovarian hyperstimulation syndrome. J Neurol Sci 2008; 29(6): 463–466.
28. Appelros P, Stegmayr B, Terént A. Sex differences in stroke epidemiology: a systematic review. Stroke 2009; 40(4): 1082–1090.
29. Cífková R, Škodová Z. Dlouhodobé trendy hlavních rizikových faktorů kardiovaskulárních onemocnění v české populaci. Čas Lék Čes 2004; 143(4): 219–226.
30. Arboix A, Martí‑Vilalta JL. Lacunar stroke. Expert Rev Neurother 2009; 9(2): 179–196.
31. Grau AJ, Weimar C, Buggle F, Heinrich A, Goertler M, Neumaier S et al. Risk factors, outcome, and treatment in subtypes of ischemic stroke: the German stroke data bank. Stroke 2001; 32(11): 2559–2566.
32. You R, McNeil JJ, O’Malley HM, Davis SM, Donnan GA. Risk factors for lacunar infarction syndromes. Neurology 1995; 45(8): 1483–1487.
33. Bejot Y, Catteau A, Caillier M, Rouaud O, Durier J, Marie C et al. Trends in incidence, risk factors, and survival in symptomatic lacunar stroke in Dijon, France, from 1989 to 2006: a population based study. Stroke 2008; 39(7): 1945–1951.
34. Herzig R, Vlachová I, Kamarádová D, Mareš J, Novotný D, Rusek J et al. Occurrence of chronic alcohol intake in patients with acute ischemic stroke: a carbohydrate‑deficient transferrin study. Cerebrovasc Dis 2009; 27 (Suppl 6): 163.
35. Amarenco P, Bogousslavsky J, Caplan LR, Don-nan GA, Hennerici MG. New approach to stroke subtyping: the A‑S‑C‑O (phenotypic) classification of stroke. Cerebrovasc Dis 2009; 27(5): 502–508.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2010 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Huntingtonova nemoc
- Trénink lokomoce v závěsu u pacientů po poranění míchy
- Neurorehabilitace
- Diffusion tensor imaging – současné možnosti MR zobrazení bílé hmoty mozku
- Prospektivní analýza subtypů a rizikových faktorů ischemické cévní mozkové příhody u dospělých do 50 let
- Srovnání české verze Montrealského kognitivního testu s Mini‑Mental State pro stanovení kognitivního deficitu u Parkinsonovy nemoci
- Faktory ovlivňující výsledek chirurgické léčby výhřezu meziobratlové ploténky bederní páteře
- Retrospektivní studie nálezů na magnetické rezonanci míchy a mozku u pacientů s diagnózou neuromyelitis optica
- Intramedulární astrocytom – soubor 15 pacientů a přehled literatury
- Neobvyklé klinické obrazy u migrény – kazuistiky
- Úprava sníženého mozkového krevního průtoku u Wernickeovy encefalopatie po alkoholové abstinenci – kazuistika
- Webové okénko
-
Analýza dat v neurologii XX.
Statistické testy pro četnosti kategorií – test dobré shody - Profesor Bartko – bard slovenskej neurologickej obce 80-ročný
- Průběh a závěry mezioborového setkání „Winter GLIO TRACK Meeting“ 2010
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Huntingtonova nemoc
- Neobvyklé klinické obrazy u migrény – kazuistiky
- Retrospektivní studie nálezů na magnetické rezonanci míchy a mozku u pacientů s diagnózou neuromyelitis optica
- Neurorehabilitace
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



