-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Diffusion tensor imaging – současné možnosti MR zobrazení bílé hmoty mozku
Diffusion Tensor Imaging – Current Possibilities of Brain White Matter Magnetic Resonance Imaging
Diffusion tensor imaging (DTI) is a relatively new magnetic resonance imaging technique that is capable of unique depiction of the structural detail in brain white matter. Its sophisticated software algorithms provide either three-dimensional reconstructions and visualizations of the particular tracts of the white matter or quantifications of various DTI parameters that appear, according to certain studies, to be highly sensitive to structural abnormalities in white matter. The aim of the present paper is to review the current applications of DTI for the depiction of brain white matter. Some basic technical remarks are made and clinical aspects are discussed, as well as purely research applications aimed at the detection and quantification of the subtle ultra‑structural pathology of brain white matter.
Key words:
magnetic resonance imaging – diffusion tensor imaging – tractography
Autoři: M. Keřkovský 1; A. Šprláková-Puková 1; T. Kašpárek 2; P. Fadrus 3; M. Mechl 1; V. Válek 1
Působiště autorů: LF MU a FN Brno Radiologická klinika 1; LF MU a FN Brno Psychiatrická klinika 2; LF MU a FN Brno Neurochirurgická klinika 3
Vyšlo v časopise: Cesk Slov Neurol N 2010; 73/106(2): 136-142
Kategorie: Přehledný referát
Souhrn
Zobrazení tenzorů difuze (diffusion tensor imaging, DTI) je poměrně nová technika vyšetření magnetickou rezonancí, která je v současné době jako jediná schopna zobrazit bližší strukturální detaily bílé hmoty mozku. Sofistikované softwarové zpracování základních dat umožňuje vizualizovat jednotlivé dráhy nebo měřit číselné hodnoty parametrů DTI, které dle dosavadních publikací citlivě reagují na strukturální poškození bílé hmoty. Autoři této práce si kladou za cíl přinést přehled současných aplikací DTI pro zobrazení bílé hmoty mozku. Probírány jsou základní technické aspekty, možnosti praktického využití této metody v běžné klinické praxi a v neposlední řadě i ryze výzkumné aplikace směřující k detekci a kvantifikaci diskrétní ultrastrukturální patologie u různých onemocnění bílé hmoty mozkové.
Klíčová slova:
magnetická rezonance – zobrazení tenzorů difuze – traktografieÚvod
Zobrazení magnetickou rezonancí (MR) disponuje excelentním kontrastem měkkých tkání. Zejména pro tuto vlastnost je tato v současnosti již poměrně dobře dostupná zobrazovací modalita dnes a denně oceňována v běžné praxi. Z hlediska zobrazení mozku nabízí MR výborný kontrast mezi šedou a bílou hmotou a umožňuje přesnou diagnózu širokého spektra patologií. Nicméně ani tak technicky pokročilá zobrazovací technika, jakou MR je, není schopna při použití konvenčních sekvencí zobrazit bližší strukturální detaily bílé hmoty. Ta se na běžně používaných sekvencích jeví jako víceméně homogenní tkáň, která je hypointenzní oproti šedé hmotě mozkové v T2 váženém obraze a mírně hyperintenzní v T1 váženém obraze.
Zobrazení tenzorů difuze (diffusion tensor imaging, DTI) je poměrně nová metoda MR zobrazení, jejíž technické základy byly poprvé popsány v roce 1994 [1]. Jedná se v současné době o jedinou metodu schopnou zobrazit nervové dráhy bílé hmoty mozku a míchy, která zároveň dokáže detekovat jemné strukturální abnormality bílé hmoty disponující v tomto směru vyšší senzitivitou v porovnání s konvenčním MR zobrazením [2].
Tato práce si klade za cíl přinést přehled současných aplikací DTI pro MR zobrazení mozku v oblasti praktické neurodiagnostiky i výzkumných aplikací spolu se shrnutím základních technických principů této „mladé“ zobrazovací metody.
Technické aspekty
DTI je metoda vycházející z principů difuzně váženého zobrazení (diffusion weighted imaging, DWI). Proces difuze představuje náhodný pohyb molekul vody ve tkáni, označuje se jako tzv. Brownův pohyb. Difuze je ovlivňována mnoha faktory, existují velké rozdíly v difuzivitě molekul vody v různých tkáních a v některých případech též mezi normální a patologicky změněnou tkání stejného druhu (obr. 1). Sekvence DWI umožňují zobrazení procesu difuze za pomoci použití zvláštních přídatných magnetických gradientů, které konvenční MR sekvence neobsahují. V okrscích tkáně, jež obsahují převážně stacionární protony vodíku vázané v molekulách vody, způsobí symetrické, opačně orientované magnetické gradienty rozfázování a opětovné sfázování spinů, a tudíž nedojde k žádnému úbytku signálu. Náhodný pohyb molekul vody v oblastech s vysokým stupněm difuze oproti tomu vede k nedokonalému sfázovaní spinů a následným fázovým posunům, což v konečném výsledku způsobuje pokles intenzity signálu [3]. Čím je tedy výraznější difuze ve tkáni, tím je nižší intenzita signálu výsledného DWI obrazu. Restrikce difuze naopak působí hyperintenzitu.
Obr. 1. DWI zobrazení mozku u pacienta s čerstvou ischemií v povodí a. cerebri media vpravo. 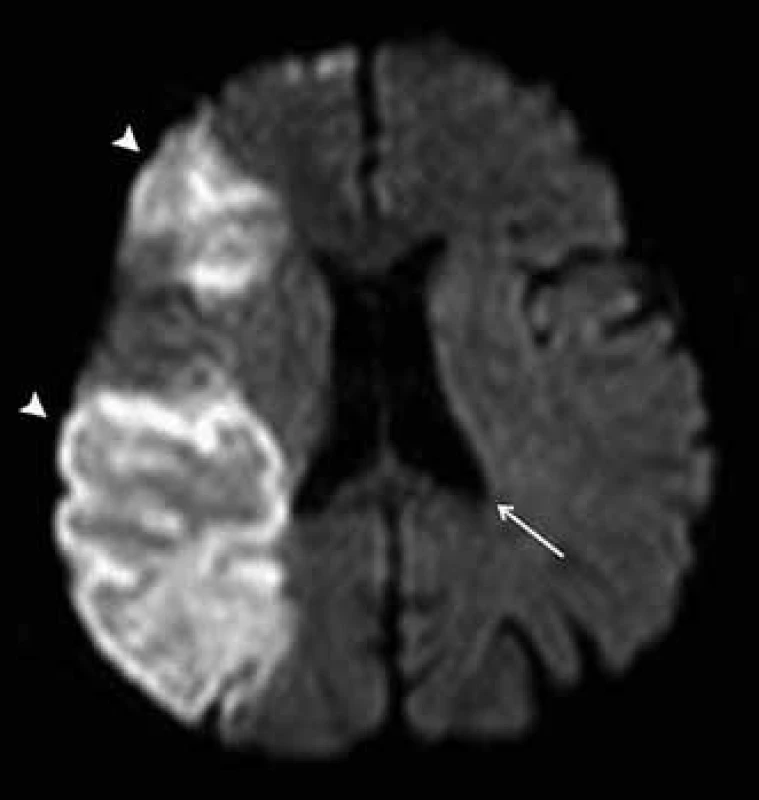
Kdyby zobrazovaná tkáň měla absolutně pravidelnou strukturu s nulovou směrovou závislostí (tzv. izotropní médium), výsledný obraz DWI by byl stále stejný bez ohledu na směr působícího přídatného magnetického gradientu. Ve skutečnosti reálné tkáně představují více či méně komplexně organizovanou strukturu, která proto vykazuje určitou míru anizotropie difuze. Intenzita signálu DWI obrazu je proto závislá na použitém směru přídatného magnetického gradientu; proces difuze je anizotropní (obr. 2) [4,5].
Obr. 2. Sada základních dat DTI vyšetření (b– g). Difuzně vážené obrazy mozku s použitím šesti různých směrů přídatného magnetického gradientu (B), což je minimální počet potřebný k rekonstrukci mapy FA a barevné mapy směrové závislosti difuze. V závislosti na orientaci gradientu se mění intenzity signálu v jednotlivých oblastech. a) B0 obraz nutný k výpočtu ADC mapy; jedná se o prostý T2 vážený obraz bez aplikace přídatného magnetického gradientu. h) Izotropní DWI obraz je průměrem obrazů b– g; spolu s B0 zobrazením slouží k výpočtu ADC mapy. 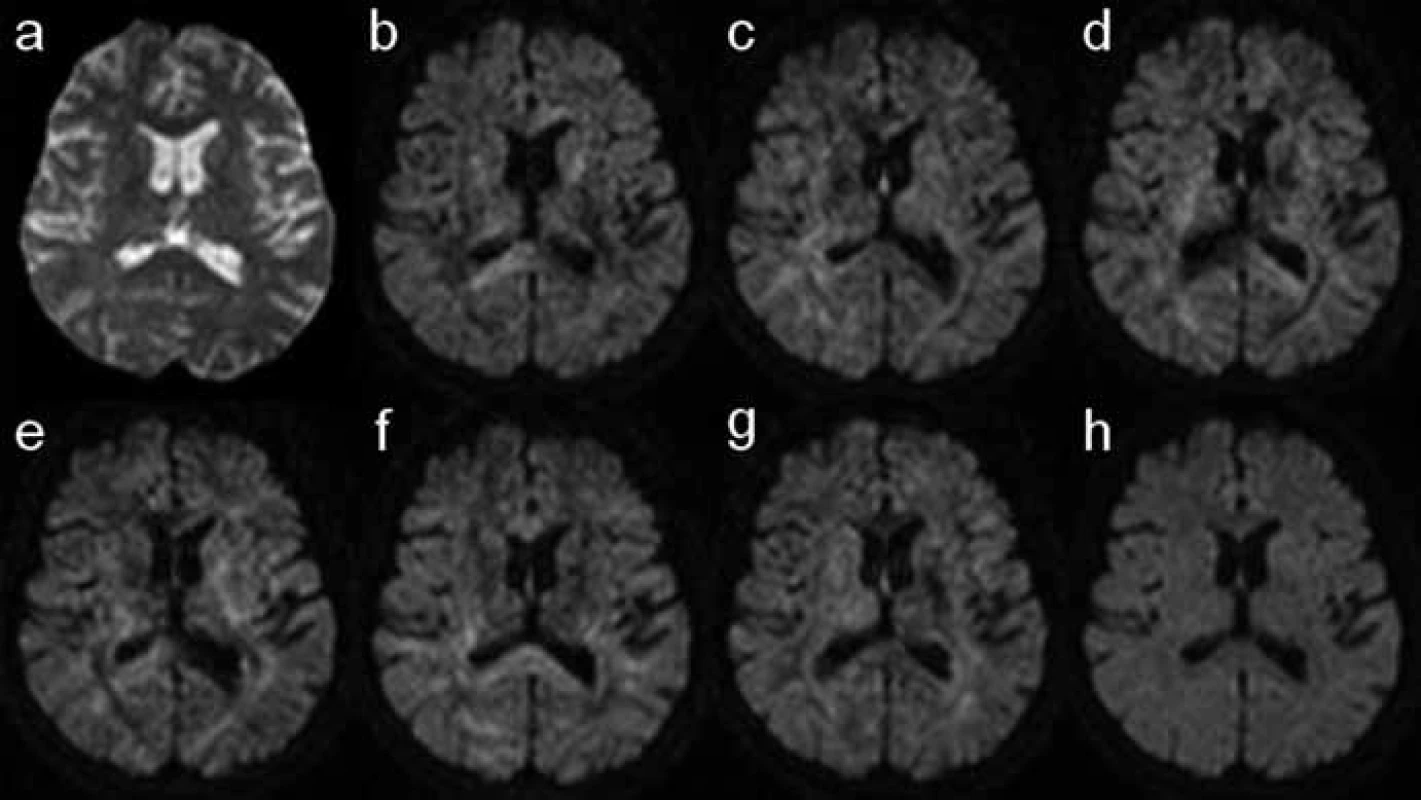
DTI technika využívá této zákonitosti aplikací přídatných gradientů opakovaně v mnoha různých směrech (typicky v 6 až 64). Výpočetní zpracování naměřených dat umožní stanovit směr, ve kterém difuze molekul vody probíhá nejsnadněji [6]. Bílá hmota mozku a míchy představuje z hlediska difuze vysoce anizotropní prostředí vzhledem k paralelnímu průběhu axonů. Je nasnadě, že molekuly vody v tomto prostředí daleko snáze difundují podél dlouhé osy svazků než napříč. Dominantní směr difuze v bílé hmotě proto v zásadě odpovídá směru průběhu nervových drah.
Výsledky DTI vyšetření je možno vyjádřit graficky i číselně. Jedním ze základních dvou parametrů kvantifikace DTI dat je hodnota ADC (apparent diffusion coefficient) používaná i při DWI zobrazení, která vyjadřuje celkovou difuzivitu vody ve tkáni bez ohledu na směrovou závislost difuze. Pro DTI je specifickým parametrem tzv. frakční anizotropie (FA), jež vyjadřuje míru směrové závislosti procesu difuze. Jde o relativní veličinu nabývající hodnot v rozmezí 0–1. Čím je tato hodnota vyšší, tím je vyšší anizotropie a směrové uspořádání struktury zobrazované tkáně. FA je v současnosti jeden z nejčastěji používaných parametrů ve výzkumu patologie bílé hmoty [2].
Softwarové zpracování DTI dat získaných vlastním měřením nabízí několik možností grafického znázornění. Jedním z nich je prostá mapa FA, která vizualizuje hodnoty FA v jednotlivých oblastech bílé hmoty v černobílé škále. Další možností je rekonstrukce barevné mapy anizotropie. Základy této metody položili Pajevic a Pierpaoli, kteří v roce 1999 navrhli barevně kódovaná schémata za účelem zobrazení komplexní prostorové informace o architektonice bílé hmoty do dvoudimenzionálního obrazu [7]. Různé barvy představují dominantní směr průběhu nervových vláken (obr. 3).
Obr. 3. Různé možnosti 2D prezentace DWI a DTI dat. a) Izotropní DWI obraz vzniká zprůměrováním intenzity signálu z vícečetných (v tomto případě 32) opakovaných měření s různým směrem přídatného magnetického gradientu. Směrová závislost difuze zde proto nehraje roli. b) ADC mapa kvantifikuje proces difuze ve tkáni též bez ohledu na izotropii. Pro výpočet je třeba izotropní DWI zobrazení s minimálně dvěma různými hodnotami přídatného gradientu (např. 0 a 1 000). c) Mapa frakční anizotropie vyjadřuje míru směrové závislosti difuze v jednotlivých oblastech. d) Směrová mapa difuze s barevným kódováním dominantního směru difuze, potažmo průběhu nervových drah. 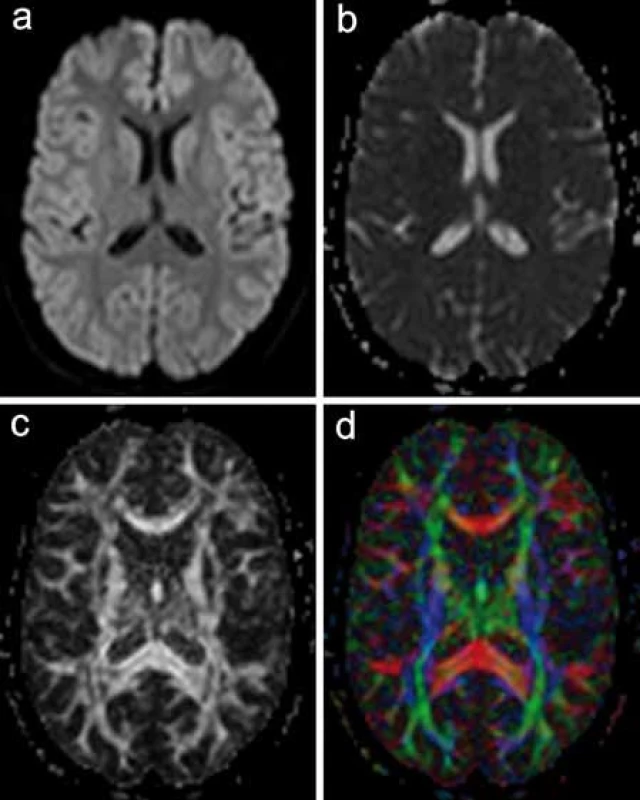
Výpočetně nejnáročnější je 3D zpracování – tzv. traktografie (fiber‑tracking), které je založeno na „stopování“ převládajícího směru difuze za předpokladu, že tento odpovídá skutečnému směru průběhu nervových traktů [8,9]. Tato technika tak umožňuje rekonstrukci průběhu jednotlivých drah a jejich zobrazení ve 3D prostoru (obr. 4) nebo vytvoření jejich projekce do základních strukturálních obrazů konvenčních MR sekvencí.
Obr. 4. 3D rekonstrukce komisurálních traktů kalózního tělesa (modrá) a obou kortikospinálních drah (žlutá, červená). 
Mluvíme‑li o technických aspektech DTI vyšetření, nelze se nezmínit o několika významných technických problémech a limitacích, se kterými se tato metoda potýká. Jde především o nejrůznější artefakty základních obrazových dat (pohybové artefakty, distorze v důsledku „vířivých“ proudů atd.), které v konečném důsledku snižují kvalitu rekonstrukcí. Při zpracování obrazu musíme též počítat s fenoménem „křížících se drah“. V místech křížení z různých směrů probíhajících nervových drah může docházet k artificiálnímu snížení hodnot FA. Problém zde může nastat také u 3D rekonstrukcí, kde výpočetní algoritmus může mylně stopovat průběh křížící dráhy [10,11].
DTI jako předoperační vyšetření
Současným trendem v neurochirurgii je maximální možná ochrana funkčně důležitých struktur mozku; předoperační MR vyšetření v tomto smyslu hraje důležitou roli [12]. Identifikaci kortikálních elokventních zón umožňuje v současné době mimo jiné funkční MR vyšetření (fMR), které pomáhá upřesnit strategii vlastní léčby a peroperačně usnadňuje provedení kortikální stimulace. Poranění kritických korových oblastí nicméně není jediným rizikem vzniku neurologického deficitu, k vážným důsledkům může vést také poškození subkortikálně probíhajících drah bílé hmoty.
Technika DTI byla v poslední době úspěšně použita pro předoperační vyšetření u pacientů s tumory a dalšími ložiskovými lézemi. Množství autorů potvrzuje spolehlivost DTI výsledků, když prokazují dobrou korelaci peroperační subkortikální stimulace motorických i jiných drah bílé hmoty s průběhem drah rekonstruovaných pomocí DTI [13,14]. Tato technika umožňuje zobrazení prostorového vztahu určité dráhy k patologické lézi, případně odlišení jejího odtlačení tumorem od přímé infiltrace a destrukce [15]. V některých pracích se popisují možnosti integrace DTI dat do morfologických obrazů určených pro peroperační stereotaktickou navigaci [16].
Poměrně častým předmětem zájmu předoperačního DTI vyšetření je kortikospinální dráha, která je jedním z nejdůležitějších traktů z hlediska možného peroperačního poškození a následného vzniku funkčního neurologického deficitu (obr. 5). Při zpracování může být výhodou integrace dat fMR mapující motorický kortex pro správné a specifické umístění oblastí zájmu (ROI) použitých pro specifikaci rekonstrukce dráhy [17]. Kombinace těchto dvou metod tak představuje pokročilé morfologicko‑funkční předoperační zmapování motorického systému (obr. 6).
Obr. 5. DTI vyšetření u pacientky s metastázou adenokarcinomu vpravo temporálně (plná šipka) s rekonstrukcí kortikospinální dráhy (šipka). a) Přehledný 3D pohled. b) Projekce do axiální roviny dobře znázorňuje těsný vztah dráhy k mediálnímu okraji tumoru. 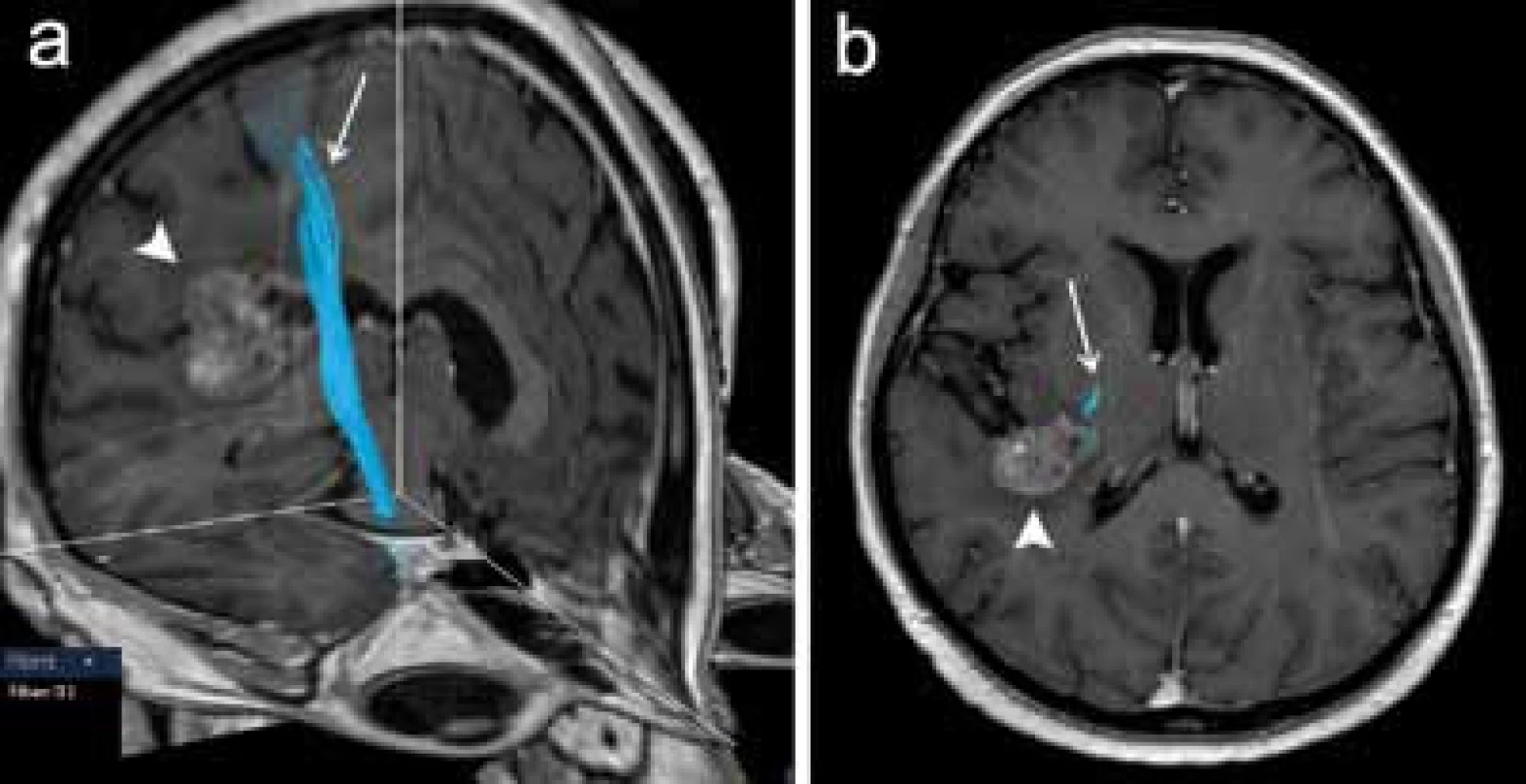
Obr. 6. Předoperační fMR a DTI vyšetření pacientky s low- grade gliomem v oblasti levé inzuly. a) Konvenční T2 vážené zobrazení, ložisko tumoru zde má vysokou intenzitu signálu (plné šipky). b) Projekce kortikospinální dráhy v koronární rovině. c) Fúze fMR a DTI dat simultánně zobrazuje aktivaci primárního motorického kortexu (otevřená šipka) a průřezovou projekci kraniální části kortikospinálního traktu do axiální roviny (šipka). d) Inversion recovery zobrazení se znázorněním prostorového vztahu průběhu kortikospinální dráhy k tumoru v axiální rovině. 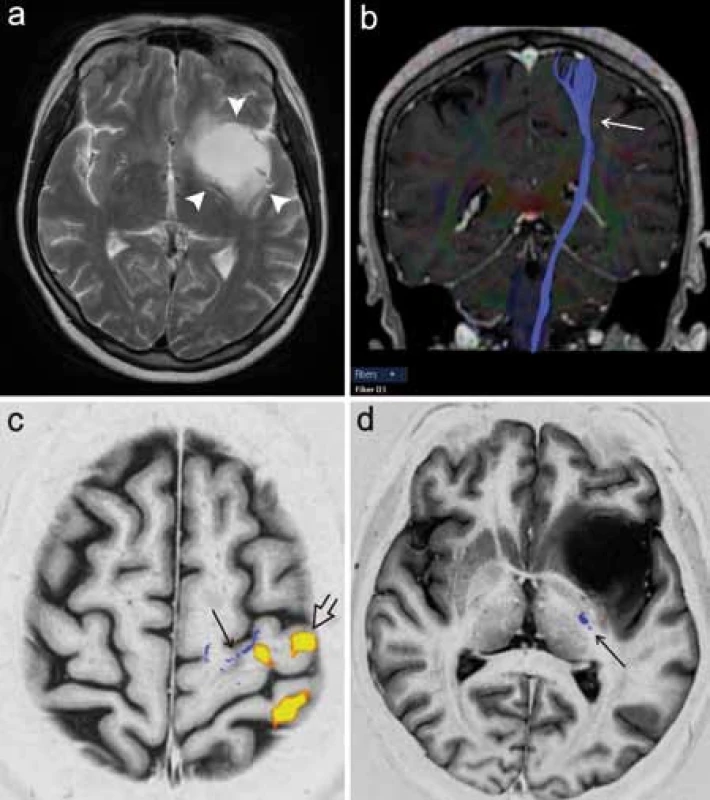
Dalším příkladem neméně funkčně významné dráhy je optická radiace, která vychází z talamického jádra corpus geniculatum lat., stáčí se laterálně a dorzálně ohybem označovaným jako Meyerova klička a dále směřuje dorzálně ke zrakovému kortexu okcipitálního laloku. V literatuře je popsána technika rekonstrukce této dráhy pomocí 3D traktografie, je zdůrazňována důležitost vizualizace této dráhy pro chirurgii spánkového laloku [18]. Resekce spánkového laloku např. u pacientů s epilepsií může představovat riziko poškození rostrální části Meyerovy kličky, které vede ke vzniku kontralaterálního defektu zorného pole. Autoři Nilsson et al (2007) a Yogarajah et al (2009) v této souvislosti poukazují na variabilitu uložení přední části Meyerovy kličky, což podtrhuje význam předoperačního DTI vyšetření pro posouzení rizika vzniku zrakového deficitu u pacientů s plánovanou resekcí spánkového laloku (obr. 7) [19,20].
Obr. 7. Pacientka s tumorózní expanzí vlevo (gliom gr. III), u níž bylo provedeno předoperační DTI vyšetření za účelem posouzení průběhu levostranné optické dráhy. a) T2 vážený obraz v axiální rovině, tumor má intenzity signálu blízké šedé hmotě mozku (plné šipky). b) Rekonstrukce obou optických drah na průřezu v koronární rovině. Vlevo je dobře patrno odtlačení dráhy kraniálně (šipka), vpravo optická radiace v obvyklém průběhu (otevřená šipka). c) Projekce obou optických drah v různých rovinách, vlevo je zřetelné odtlačení dráhy. 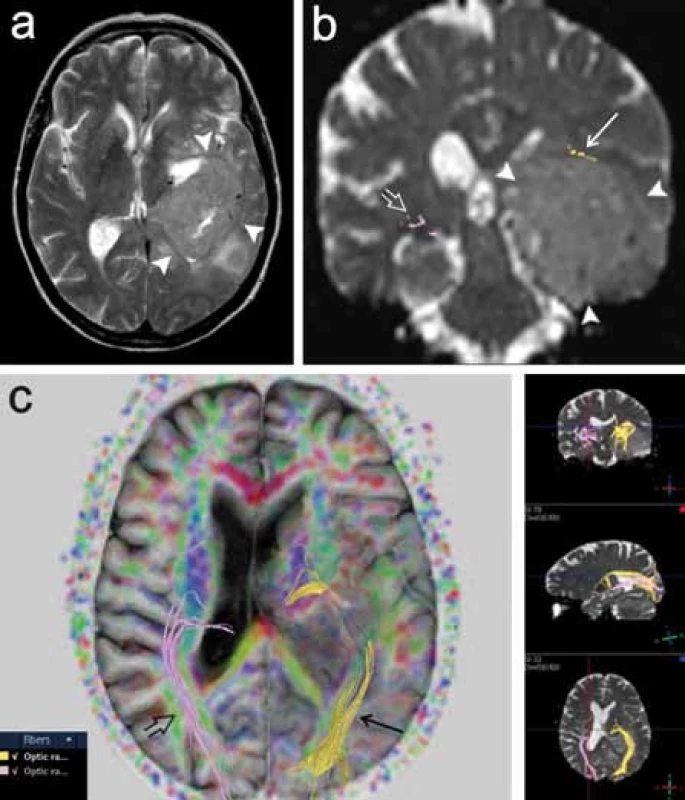
DTI jako citlivý ukazatel patologie bílé hmoty
Jak bylo uvedeno výše, vysoce organizovaná mikrostruktura normální bílé hmoty mozku je příčinou výrazné anizotropie difuze v této tkáni. Ukazuje se, že různé patologické změny v bílé hmotě často vedou ke snížení anizotropie při patologickém nárůstu difuzivity molekul vody napříč nervovými trakty. Tato skutečnost je detekovatelná pomocí DTI, senzitivita této techniky byla v tomto smyslu mnohokráte potvrzena včetně experimentů na zvířecích modelech [21]. Zejména index FA je v současnosti považován za parametr senzitivní k narušení integrity bílé hmoty a je nyní jedním z nejčastěji sledovaných parametrů ve studiích využívajících DTI zobrazení [2].
Z pohledu histologa je lidská bílá hmota mozková velmi komplexní tkáň sestávající z uspořádaných neuronálních axonů s různou mírou myelinizace a z několika typů podpůrných buněk neuroglie. Veškeré mikrostrukturální abnormality, které vedou ke změnám FA, nejsou ještě v současné době do detailu známy. Integrita myelinových pochev axonů je jistě jedním ze zásadních faktorů zodpovědných za anizotropii difuze; tento fakt dokládají mimo jiné četné odkazy na signifikantní změny FA u inkompletně myelinizované bílé hmoty v průběhu pre ‑ i postnatálního zrání centrálního nervového systému [22,23].
V posledních letech se objevuje mnoho prací zaměřených na problematiku DTI vyšetření u pacientů trpících roztroušenou sklerózou (RS). Z dosavadních výsledků je zřejmé, že patologický proces demyelinizace způsobuje prokazatelné změny v parametrech DTI měření. Jednotliví autoři se vesměs shodují ve zjištění poklesu hodnot FA v demyelinizačních plakách a v blízké zóně okolní bílé hmoty (obr. 8). Prokázány byly dokonce i významné odchylky FA v oblastech normálně vyhlížející bílé hmoty u pacientů s RS v porovnání s kontrolní skupinou zdravých subjektů [24,25]. Bester et al (2008) ve své práci analyzují FA bílé hmoty bez viditelného postižení na konvenčních sekvencích u pacientů s klinicky izolovaným syndromem manifestujícím se jako optická neuritida. U skupiny těchto pacientů byl zjištěn signifikantní pokles hodnot FA v oblasti splenia kalózního tělesa v porovnání s kontrolní skupinou zdravých dobrovolníků [26]. Uvedené skutečnosti potvrzují vysokou senzitivitu DTI v detekci patologie bílé hmoty v porovnání s konvenčním MR zobrazením a do budoucna mohou být příslibem praktického využití DTI u pacientů s RS.
RS nicméně není zdaleka jediným one-mocněním, kde bylo DTI zobrazení po-užito pro hodnocení diskrétnějších strukturálních změn bílé hmoty. Jako další příklady této aplikace lze uvést studie zaměřující se na využití DTI v diagnostice amyotrofické laterální sklerózy, kde byly prokázány signifikantní abnormality FA v průběhu kortikospinálního traktu v porovnání s kontrolní skupinou [27]. U pacientů s multisystémovou atrofií (MSA) se dle výsledků dosavadních studií jeví patologie bílé hmoty jako jeden z důležitých atributů tohoto neurodegenerativního onemocnění [28]. Autoři Prakash et al (2009) ve své poslední práci dokonce zmiňují možnost odlišení různých typů ataktických syndromů pomocí DTI [29].
DTI se v současné době též stále častěji uplatňuje jako výzkumný nástroj na poli psychiatrických onemocnění, a to zejména u pacientů se schizofrenií. Diagnostika této choroby v současnosti představuje výzvu pro zobrazovací diagnostické metody, neboť konvenční MR vyšetření, které je považováno za špičku v nynějších možnostech zobrazení mozku, obvykle při klasickém vizuálním hodnocení neprokáže viditelné patologické změny u pacientů trpících schizofrenií. Mluvíme‑li stále o diagnostice pomocí konvenčních MR sekvencí, je pro detekci jemných strukturálních abnormalit mozku třeba podrobnější analýzy obrazu se zapojením sofistikovaných metod výpočetního zpracování na bázi volumometrie a „voxel‑based“ analýzy. Již dříve byly popsány méně nápadné změny gyrifikace prokazatelné pomocí měření abnormálních hodnot gyrifikačních indexů [30,31] nebo změny objemu šedé hmoty mozku v nejrůznějších oblastech kortexu [32]. Bylo dále zjištěno, že uvedené změny ve funkční organizaci a strukturálním vývoji mozkového kortexu jsou úzce spjaty s konektivitou jednotlivých kortikálních oblastí [33]. Tato asociace kortikální organizace s funkční i anatomickou konektivitou je zčásti vysvětlena v současnosti přijímanou patofyziologickou hypotézou funkční dyskonektivity mozku u pacientů se schizofrenií [34].
DTI se v této souvislosti pro svoji známou citlivost k ultrastrukturální patologii bílé hmoty nabízí jako vhodný nástroj pro bližší výzkum patologické konektivity u schizofrenických pacientů. Na toto téma bylo provedeno množství prací, které vesměs porovnávají skupiny pacientů se schizofrenií se skupinami zdravých dobrovolníků. Pro zpracování dat jednotliví autoři používají buď ROI (region of interest) analýzu, kdy jsou měřeny parametry ADC a FA v konkrétních oblastech bílé hmoty, nebo složitější „voxel‑based“ zpracování. Jako potvrzení výše uvedených tezí byly prokázány signifikantní změny FA v mnoha různých oblastech bílé hmoty mozku u pacientů se schizofrenií, a to zejména v průběhu asociačních drah propojujících frontální, temporální a parietální kortex, v oblasti cingula a kalózního tělesa [35]. Několik málo autorů se zaměřuje též na korelaci mezi klinickou symptomatikou a měřením DTI parametrů s vesměs negativními výsledky [36]. Autoři Shin et al (2006) nicméně ve své práci prokazují pozitivní korelaci ADC hodnot bílé hmoty pravé inzuly se subskóre negativní symptomatiky v rámci škály pozitivních a negativních příznaků (PANSS) [37]. DTI nám na tomto poli poskytuje nový náhled na patofyziologii schizofrenie a podporuje teorii rozsáhlé ultrastrukturální abnormality bílé hmoty mozkové jako jeden z významných faktorů pro vznik tohoto onemocnění.
Závěr
Lze říci, že MR‑DTI je unikátní metoda, která jako jediná prozatím umožňuje podrobnější strukturální zobrazení bílé hmoty mozkové s vizualizací jednotlivých nervových drah. Nalézá praktické uplatnění jako předoperační vyšetření u pacientů s plánovaným neurochirurgickým výkonem, kdy umožňuje zobrazit vztah patologické léze k jednotlivým drahám, čímž pomáhá při stanovení celkové strategie léčby a umožňuje vhodně modifikovat operační postup za účelem minimalizace pooperačního neurologického deficitu.
Zároveň jde o metodu, která je výrazně citlivá k ultrastrukturální patologii bílé hmoty s novými možnostmi kvantifikace, což je skutečnost v posledních letech hojně využívaná pro výzkum nejrůznějších onemocnění bílé hmoty mozku.
Technika DTI prochází neustálým vývojem z hlediska základních parametrů sekvencí i výpočetního zpracování. Současná metodika DTI traktografie založená na Gaussovském modelu procesu difuze může selhávat v případě jeho komplexnější distribuce, jako např. v místech křížení vláken. Tento problém řeší nové techniky, jako např. „q‑ball imaging“, kde se používá větší počet směrů přídatných gradientů o vyšší síle, než je tomu v případě konvenčního DTI zobrazení [38,39]. Při kombinaci těchto technik s potenciálem doposud experimentálních MR přístrojů disponujících velmi vysokým statickým magnetickým polem (7T) se můžeme dočkat dalších překvapivých výsledků a výhledově snad i implementace DTI vyšetření do standardního diagnostického protokolu u některých onemocnění postihujících bílou hmotu mozku či míchy.
Práce vznikla s grantovou podporou IGA MZČR NR9855 - 4
Přijato k recenzi: 4. 11. 2009
Přijato do tisku: 6. 1. 2010
MUDr. Miloš Keřkovský
Radiologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: mkerkovsky@fnbrno.cz
Zdroje
1. Basser PJ, Mattiello J, LeBihan D. MR diffusion tensor spectroscopy and imaging. Biophys J 1994; 66(1): 259–267.
2. Assaf Y, Pasternak O. Diffusion tensor imaging (DTI)‑based white matter mapping in brain research: a review. J Mol Neurosci 2008; 34(1): 51–61.
3. Le Bihan D. Molecular diffusion, tissue microdynamics and microstructure. NMR Biomed 1995; 8(7–8): 375–386.
4. Pierpaoli C, Basser PJ. Toward a quantitative assessment of diffusion anisotropy. Magn Reson Med 1996; 36(6): 893–906.
5. Basser PJ. Inferring microstructural features and the physiological state of tissues from diffusion‑weighted images. NMR Biomed 1995; 8(7–8): 333–344.
6. Basser PJ, Pajevic S, Pierpaoli C, Duda J, Aldroubi A. In vivo fiber tractography using DT‑MRI data. Magn Reson Med 2000; 44(4): 625–632.
7. Pajevic S, Pierpaoli C. Color schemes to represent the orientation of anisotropic tissues from diffusion tensor data: application to white matter fiber tract mapping in the human brain. Magn Reson Med 1999; 42(3): 526–540.
8. Conturo TE, Lori NF, Cull TS, Akbudak E, Snyder AZ, Shimony JS et al. Tracking neuronal fiber pathways in the living human brain. Proc Natl Acad Sci U S A 1999; 96(18): 10422–10427.
9. Mori S, Crain BJ, Chacko VP, van Zijl PC. Three‑dimensional tracking of axonal projections in the brain by magnetic resonance imaging. Ann Neurol 1999; 45(2): 265–269.
10. Mukherjee P, Chung SW, Berman JI, Hess CP, Henry RG. Diffusion tensor MR imaging and fiber tractography: technical considerations. AJNR Am J Neuroradiol 2008; 29(5): 843–852.
11. Tournier JD, Yeh CH, Calamante F, Cho KH, Connelly A, Lin CP. Resolving crossing fibres using constrained spherical deconvolution: validation using diffusion‑weighted imaging phantom data. Neuroimage 2008; 42(2): 617–625.
12. Berman JI. Diffusion MR tractography as a tool for surgical planning. Magn Reson Imaging Clin N Am 2009; 17(2): 205–214.
13. Bello L, Gambini A, Castellano A, Carrabba G, Acerbi F, Fava E et al. Motor and language DTI Fiber Tracking combined with intraoperative subcortical mapping for surgical removal of gliomas. Neuroimage 2008; 39(1): 369–382.
14. Berman JI, Berger MS, Chung SW, Nagarajan SS, Henry RG. Accuracy of diffusion tensor magnetic resonance imaging tractography assessed using intraoperative subcortical stimulation mapping and magnetic source imaging. J Neurosurg 2007; 107(3): 488–494.
15. Wei CW, Guo G, Mikulis DJ. Tumor effects on cerebral white matter as characterized by diffusion tensor tractography. Can J Neurol Sci 2007; 34(1): 62–68.
16. Zolal A, Sameš M, Vachata P, Bartoš R, Nováková M, Derner M. Použití DTI traktografie v neuronavigaci při operacích mozkových nádorů: kazuistiky. Cesk Slov Neurol N 2008; 71/104(3): 352–357.
17. Smits M, Vernooij MW, Wielopolski PA, Vincent AJ, Houston GC, van der Lugt A. Incorporating functional MR imaging into diffusion tensor tractography in the preoperative assessment of the corticospinal tract in patients with brain tumors. AJNR Am J Neuroradiol 2007; 28(7): 1354–1361.
18. Sherbondy AJ, Dougherty RF, Napel S, Wandell BA. Identifying the human optic radiation using diffusion imaging and fiber tractography. J Vis 2008; 8(10): 1–11.
19. Nilsson D, Starck G, Ljungberg M, Ribbelin S, Jönsson L, Malmgren K et al. Intersubject variability in the anterior extent of the optic radiation assessed by tractography. Epilepsy Res 2007; 77(1): 11–16.
20. Yogarajah M, Focke NK, Bonelli S, Cercignani M, Acheson J, Parker GJ et el. Defining Meyer‘s loop‑temporal lobe resections, visual field deficits and diffusion tensor tractography. Brain 2009; 132(6): 1656–1668.
21. Harsan LA, Poulet P, Guignard B, Steibel J, Parizel N, de Sousa PL et al. Brain dysmyelination and recovery assessment by noninvasive in vivo diffusion tensor magnetic resonance imaging. J Neurosci Res 2006; 83(3): 392–402.
22. Mukherjee P, Miller JH, Shimony JS, Conturo TE, Lee BC, Almli CR et al. Normal brain maturation during childhood: developmental trends characterized with diffusion‑tensor MR imaging. Radiology 2001; 221(2): 349–358.
23. Mukherjee P, Miller JH, Shimony JS, Philip JV, Nehra D, Snyder AZ et al. Diffusion‑tensor MR imaging of gray and white matter development during normal human brain maturation. AJNR Am J Neuroradiol 2002; 23(9): 1445–1456.
24. Guo AC, MacFall JR, Provenzale JM. Multiple sclerosis: diffusion tensor MR imaging for evaluation of normal‑appearing white matter. Radiology 2002; 222(3): 729–736.
25. Andrade RE, Gasparetto EL, Cruz LC jr, Ferreira FB, Domingues RC, Marchiori E et al. Evaluation of white matter in patients with multiple sclerosis through diffusion tensor magnetic resonance imaging. Arq Neuropsiquiatr 2007; 65(3A): 561–564.
26. Bester M, Heesen C, Schippling S, Martin R, Ding XQ, Holst B et al. Early anisotropy changes in the corpus callosum of patients with optic neuritis. Neuroradiology 2008; 50(7): 549–557.
27. Hong YH, Sung JJ, Kim SM, Park KS, Lee KW, Chang KH et al. Diffusion tensor tractography‑based analysis of the pyramidal tract in patients with amyotrophic lateral sclerosis. J Neuroimaging 2008; 18(3): 282–287.
28. Shiga K, Yamada K, Yoshikawa K, Mizuno T, Nishimura T, Nakagawa M. Local tissue anisotropy decreases in cerebellopetal fibers and pyramidal tract in multiple system atrophy. J Neurol 2005; 252(5): 589–596.
29. Prakash N, Hageman N, Hua X, Toga AW, Perlman SL, Salamon N. Patterns of fractional anisotropy changes in white matter of cerebellar peduncles distinguish spinocerebellar ataxia‑1 from multiple system atrophy and other ataxia syndromes. Neuroimage 2009; 47 (Suppl 2): T72–T81.
30. Falkai P, Honer WG, Kamer T, Dustert S, Vogeley K, Schneider‑Axmann T et al. Disturbed frontal gyrification within families affected with schizophrenia. J Psychiatr Res 2007; 41(10): 805–813.
31. Harris JM, Yates S, Miller P, Best JJ, Johnstone EC, Lawrie SM. Gyrification in first‑episode schizophrenia: a morphometric study. Biol Psychiatry 2004; 55(2): 141–147.
32. Honea R, Crow TJ, Passingham D, Mackay CE. Regional deficits in brain volume in schizophrenia: a meta‑analysis of voxel‑based morphometry studies . Am J Psychiatry 2005; 162(12): 2233–2245
33. Van Essen DC. A tension‑based theory of morphogenesis and compact wiring in the central nervous system. Nature 1997; 385(6614): 313–318.
34. Stephan KE, Baldeweg T, Friston KJ. Synaptic plasticity and dysconnection in schizophrenia. Biol Psychiatry 2006; 59(10): 929–939.
35. Kubicki, M, McCarley R, Westin CF, Park HJ, Maier S,Kikinis R et al. A review of diffusion tensor imaging studies in schizophrenia. J Psychiatr Res 2007; 41(1–2): 15–30.
36. Kyriakopoulos M, Bargiotas T, Barker GJ, Frangou S.Diffusion tensor imaging in schizophrenia. Eur Psychiatry 2008; 23(4): 255–273.
37. Shin YW, Kwon JS, Ha TH, Park HJ, Kim DJ, Hong SB et al. Increased water diffusivity in the frontal and temporal cortices of schizophrenic patients. Neuroimage 2006; 30(4): 1285–1291.
38. Mukherjee P, Hess CP, Xu D, Han ET, Kelley DA, Vigneron DB. Development and initial evaluation of 7-T q‑ball imaging of the human brain. Magn Reson Imaging 2008; 26(2): 171–180.
39. Hess CP, Mukherjee P, Han ET, Xu D, Vigneron DB. Q‑ball reconstruction of multimodal fiber orientations using the spherical harmonic basis. Magn Reson Med 2006; 56(1): 104–117.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2010 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Huntingtonova nemoc
- Trénink lokomoce v závěsu u pacientů po poranění míchy
- Neurorehabilitace
- Diffusion tensor imaging – současné možnosti MR zobrazení bílé hmoty mozku
- Prospektivní analýza subtypů a rizikových faktorů ischemické cévní mozkové příhody u dospělých do 50 let
- Srovnání české verze Montrealského kognitivního testu s Mini‑Mental State pro stanovení kognitivního deficitu u Parkinsonovy nemoci
- Faktory ovlivňující výsledek chirurgické léčby výhřezu meziobratlové ploténky bederní páteře
- Retrospektivní studie nálezů na magnetické rezonanci míchy a mozku u pacientů s diagnózou neuromyelitis optica
- Intramedulární astrocytom – soubor 15 pacientů a přehled literatury
- Neobvyklé klinické obrazy u migrény – kazuistiky
- Úprava sníženého mozkového krevního průtoku u Wernickeovy encefalopatie po alkoholové abstinenci – kazuistika
- Webové okénko
-
Analýza dat v neurologii XX.
Statistické testy pro četnosti kategorií – test dobré shody - Profesor Bartko – bard slovenskej neurologickej obce 80-ročný
- Průběh a závěry mezioborového setkání „Winter GLIO TRACK Meeting“ 2010
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Huntingtonova nemoc
- Neobvyklé klinické obrazy u migrény – kazuistiky
- Retrospektivní studie nálezů na magnetické rezonanci míchy a mozku u pacientů s diagnózou neuromyelitis optica
- Neurorehabilitace
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



