-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Přínos vyšetření čichu v časné diagnostice demencí neurodegenerativní etiologie
Smell Perception Testing in Early Diagnosis of Neurodegenerative Dementia
Objective:
The aim of this study is to investigate the rate and prognostic value of smell impairment in the most common types of dementia and in patients in prodromal stages of these diseases. We also present a new smell identification test developed at our Memory Clinic – the Motol Hospital Smell Test (MHST).Subjects and Methods:
Based on the results of neuropsychological testing and MRI, 138 patients were classified into several groups as Alzheimer's disease (AD), Frontotemporal Lobar Degeneration (FTLD), Mild Cognitive Impairment (MCI) – amnestic (aMCI) and nonamnestic (naMCI), Subject Memory Complaint (SMC) and a control group. Smell identification was examined using MHST and the University of Pennsylvania Smell Identification Test (UPSIT).Results:
Smell identification was significantly impaired in AD (p < 0.001), FTLD (p < 0.001) and aMCI (p <0.01) when compared to the control group. The naMCI and SMC patients did not differ from control group. MHST results correlated with UPSIT results (r = 0.68, p < 0.0005).Conclusions:
Impaired smell identification in AD and aMCI and intact smell identification in naMCI correspondent with the hypothesis that aMCI represents a prodromal stage of AD, whereas naMCI typically converts to non-AD dementia. Results obtained by MHST and UPSIT show that sensitivity and specificity for assessment of smell identification impairment is at the same level in both tests.Key words:
smell perception testing – Alzheimer’s disease – frontotemporal lobar degeneration – mild cognitive impairment – subject memory complaint – Motol Hospital Smell Test – University of Pennsylvania Smell Identification Test
Autoři: H. Magerová; M. Vyhnálek; J. Laczó; M. Bojar; J. Hort
Působiště autorů: Neurologická klinika UK ; 2. LF a FN Motol, Praha ; Centrum pro poruchy kognitivních funkcí
Vyšlo v časopise: Cesk Slov Neurol N 2008; 71/104(3): 298-302
Kategorie: Původní práce
Souhrn
Cíl:
Cílem předkládané práce je zjistit míru a prognostický význam postižení čichu u nejčastěji se vyskytujících demencí neurodegenerativní etiologie a u pacientů v prodromálních stadiích těchto onemocnění. Zároveň předkládáme námi vyvinutý nový test čichové identifikace – The Motol Hospital Smell Test (MHST).Soubor a metodika:
Do souboru bylo zařazeno 138 osob. Na základě neuropsychologického vyšetření a vyšetření mozku magnetickou rezonancí byli rozčleněni do skupin: Alzheimerova choroba (ACH), frontotemporální lobární degenerace (FTLD), mírná kognitivní porucha (Mild Cognitive Impairment, MCI) amnestická (aMCI) a neamnestická (naMCI), subjektivní porucha paměti (Subjective Memory Complaint, SMC) a normy. K vyšetření čichové identifikace byl užit MHST a The University of Pennsylvania Smell Identification Test (UPSIT).Výsledky:
Čichová identifikace byla v porovnání s kontrolní skupinou postižena u ACH (p < 0,001), FTLD (p < 0,001) a aMCI (p < 0,01). Nalezený rozdíl mezi naMCI a normami nebyl statisticky signifikantní (p > 0,05). Skupina SMC skórovala na úrovni norem. Výsledky MHST korelovaly s UPSIT (r = 0,68, p < 0,0005).Závěry:
Lehčí postižení čichu u aMCI oproti ACH a neporušená čichová identifikace u naMCI jsou ve shodě s hypotézou, že aMCI představuje prodromální stadium ACH, zatímco naMCI konvertuje typicky v jiné druhy demence. Výsledky získané pomocí MHST a UPSIT dokazují, že specificita a senzitivita testů pro stanovení poruchy čichové identifikace je srovnatelná.Klíčová slova:
vyšetření čichu – Alzheimerova choroba – frontotemporální lobární degenerace – mírná kognitivní porucha – subjektivní porucha paměti – Motol Hospital Smell Test – University of Pennsylvania Smell Identification TestÚvod
Alzheimerova choroba (ACH) je nejčastější příčinou demence. V posledních letech roste snaha diagnostikovat ACH časně, ještě před rozvojem demence. V souvislosti s tím vzrůstá zájem o výzkum časných markerů tohoto onemocnění, např. postižení čichu. Struktury CNS důležité pro zpracování čichových podnětů se nacházejí v meziotemporálních oblastech mozku (MTO), tedy v oblastech, které jsou postiženy již ve velmi časných stadiích ACH. Časné degeneraci MTO je přisuzována porucha identifikace vůní a pachů, která se u ACH objevuje již v počátcích nemoci, ještě před samotným rozvojem demence [1]. Porucha čichu byla prokázána také u dalších neurodegenerativních onemocnění – u Parkinsonovy nemoci (PN), kde je její přítomnost častější než přítomnost tremoru [2], u frontotemporální lobární degenerace (FTLD) či demence s Lewyho tělísky (LBD - Lewy Bodies Demention), i u pacientů po kraniocerebrálních traumatech [3].
Čichová dráha začíná v horní třetině nosní dutiny, kde se nachází čichový neuroepitel. Axony těchto buněk vytváří I. hlavový nerv – nervus olfactorius, který prochází skrz lamina cribrosa čichové kosti na spodinu přední jámy lební do bulbus olfactorius. Odtud vychází II. neuron čichové dráhy do primární čichové korové oblasti (trigonum olfactorium, substantia perforata anterior, přední část uncus gyri hippokampi, entorinální area, prepiriformní kůra, amygdala a po přepojení i orbitofrontální kůra). Primární čichová oblast zodpovídá za schopnost vnímat čichové podněty a je propojena s jinými oblastmi mozku, zejména limbickým systémem. Neokortex, který sousedí s primární čichovou oblastí, se označuje jako sekundární čichová oblast a je důležitý pro vědomé zpracování čichových vjemů.
Zpracování čichového podnětu lze rozdělit do několika úrovní:
- čichová detekce (vnímání podnětů kvantitativně vyjádřené čichovým prahem)
- čichová diskriminace (rozlišení různých vůní a pachů)
- čichová identifikace (přiřazení správného verbálního nebo nonverbálního označení čichového vjemu)
- čichová paměť, na které se podílejí deklarativní i nedeklarativní paměťové mechanizmy.
Poškození čichu bylo u ACH popsáno opakovaně [4–9]. Je jedním z prvních projevů této nemoci a tíže čichového deficitu dobře koreluje s progresí onemocnění [10,11]. Nejčasněji postiženou čichovou funkcí je čichová identifikace [12,13], teprve postupně se přidává i porucha čichové diskriminace a detekce. Prvotní předpoklady, že porucha čichu u ACH je způsobena specifickými změnami čichového neuroepitelu [14], byly dalšími výzkumy zpochybněny [15]. Stejné změny nosní sliznice byly nalezeny i u zdravých jedinců bez kognitivního deficitu. Přestože postižení periferní čichové dráhy pravděpodobně hraje částečnou roli, je postižení čichu u ACH způsobeno převážně poškozením centrálních čichových struktur. V neuropatologických studiích u pacientů s ACH bylo prokázáno, že největší hustota alzheimerovských změn (přítomnost neurofibrilárních klubek, senilních amyloidových plak a úbytek neuronů) se nachází v piriformním a entorinálním kortexu a v area periamygdaloidea [16]. Neurofibrilární klubka byla prokázána i v jádrech čichového nervu [17].
Tyto změny jsou přítomny již v prodromálním stadiu nemoci, tedy ve stadiu mírné kongnitivní poruchy (MCI). MCI představuje mezistupeň mezi fyziologickým stárnutím a demencí. Část nemocných má subjektivní obtíže s pamětí (SMC), které nedosahují tíže objektivizovatelné testy paměti. Pacienti s MCI mají kognitivní deficit – subjektivně vnímaný i objektivně prokazatelný neuropsychologickými testy, který nenarušuje jejich soběstačnost a nesplňuje tedy kritéria demence. Kognitivní postižení může zahrnovat poruchu paměti, v takovém případě se jedná o amnestickou formu MCI (aMCI), nebo může paměť zůstat neporušena a hovoříme o neamnestické MCI (naMCI). MCI nemusí nutně znamenat předstupeň demence, ale riziko jejího rozvoje je u těchto osob vyšší než v běžné populaci. Každý rok se průměrně u 15 % pacientů s MCI rozvine ACH, zatímco u zdravých osob je to pouze v 1–2 %. Pacienti s naMCI mají oproti tomu vyšší riziko konverze do nonalzheimerovskýh demencí (vaskulární demence, FTLD a jiné).
Existuje několik studií, které popisují postižení čichu u FTLD [18,19]. FTLD představuje heterogenní skupinu postihující různé oblasti mozku. Zahrnuje frontální variantu – frontotemporální demence sensus stricto (FTD) s převažujícím postižením frontálního laloku a později i temporální kortexu, sémantickou demenci (SD), u které dochází k atrofii konvexity temporálního laloku a amygdaly a primární progresivní afázii (PPA) s asymetrickou atrofií levé hemisféry zahrnující Brocovu areu. Postižení temporálních oblastí u SD a v menší míře i u FTD a PPA vedlo k předpokladu, že i u tohoto onemocnění by mohly být vyšší čichové funkce porušeny.
Cílem této práce je:
- porovnat čichové funkce u ACH, FTLD, aMCI, naMCI, SMC a kontrol
- porovnat námi vyvinutý test - Motol Hospital Smell test (MHST) se standardně používaným UPSIT
Materiál a metodika
Do studie bylo zařazeno 118 pacientů vyšetřených na Neurologické klinice 2. LF UK a FN V Motole pro poruchu kognitivních funkcí a 20 věkově odpovídajících zdravých kontrol. Všechny testované osoby byly nekuřáci, bez onemocnění či léků ovlivňujících čichové schopnosti a podepsaly informovaný souhlas. Všichni pacienti včetně kontrolních podstoupili podrobné neuropsychologické vyšetření: Mini Mental State Examination (MMSE), Geriatric Depression Scale (GDS), Auditory Verbal Learning Test (AVLT), test hodin, Trail Making Test (TMT) A a B, Grober a Buschke Test, Benton's Visual Retention Test, Digit Span, Verbal Fluency Test, Reyovou figuru, DMS 48, Boston Naming test, Activities of Daily Living (ADL), Hachinski ischemic score, laboratorní vyšetření a vyšetření mozku magnetickou rezonancí (MRI). Někteří pacienti měli diagnózu ACH podpořenou vyšetřením mozkomíšního moku [20].
U 23 pacientů byla pomocí kritérií Diagnostic and Statistical Manual of Mental Disorders, fourth edition (DSM-IV-TR) a National Institute of Neurological and Communicative Disorders and Stroke-Alzheimer's Disease and Related Disorders Association (NINCDS-ADRDA) stanovena diagnóza ACH, u 9 osob diagnóza FTDL dle Nearyho kritérií, 70 pacientů splňovalo Petersenova kritéria pro MCI. Postižení těchto pacientů bylo dále diagnostikováno jako amnestická (n = 53) a neamnestická (n = 17) forma. U 16 pacientů nebyla kognitivní porucha objektivně prokázána a byli zařazeni do skupiny subjektivní porucha paměti (SMC).
Vyšetření čichu proběhlo testem čichové identifikace vytvořeným na naší klinice – The Motol Hospital Smell test (MHST). MHST je sestaven z 18 vůní prezentovaných ve formě olejových esencí, které byly sestaveny s použitím esencí firem KaMa, Phytos a Latus. Spektrum vůní bylo konzultováno s odborníky z oboru ORL a psychologie a vybíráno s ohledem na rozšířenost vůní v české populaci. Test obsahuje tyto vůně: borovice, broskev, citrón, růže, višeň, grep, hřebíček, levandule, peprmint, pomeranč, skořice, vanilka, káva, med, šeřík, jahoda, černý rybíz, rum. MHST probíhá formou multiple choice. Testované osobě je ve speciální lahvičce předložena vonná esence v množství 200 μl ve vzdálenosti 2 cm od nostril. Poté jsou jí nabídnuty 4 možnosti pojmenování této vůně, z nichž vždy 1 je správná. Interval mezi jednotlivými pokusy (jednotlivými vůněmi) je 20 s. Sadu MHST je možné používat po dobu 3 měsíců, poté je nutné vzorky obnovit.
U 60 osob (10 ACH, 5 FTLD, 20 aMCI, 8 naMCI, 8 SMC a 9 kontrol) bylo toto vyšetření doplněno testem čichové identifikace The University of Pennsylvania Smell Identification Test (UPSIT). Tento test obsahuje 40 různých vůní umístěných v mikrokapsulích nanesených na papíře, které se uvolní po seškrábnutí tužkou. Rovněž tento test probíhá formou multiple choice, ze 4 nabízených možnostmi je vždy pouze 1 správná.
Všechny testované osoby vyplnily podrobný strukturovaný dotazník sloužící k detekci jiného onemocnění spojeného s poruchou čichu. Součástí tohoto dotazníku bylo rovněž subjektivní hodnocení čichu a jeho změn pacientem.
Po ověření normality rozložení byl k porovnání čichové identifikace v jednotlivých skupinách použit 2výběrový t-test. Výkon u všech skupin pacientů byl porovnán s výkonem u zdravých jedinců. Vzhledem k vícečetným porovnáním byla hladina statistické významnosti upravena Bonferroniho korekcí. K měření lineární závislosti výkonu v testech MHST a UPSIT u vyšetřených pacientů a zdravých jedinců byl použit Pearsonův korelační koeficient. Ke statistické analýze byl použit program SPSS 13.0 pro Windows.
Výsledky
Charakteristika testovaných souborů pacientů je shrnuta v tab. 1, výsledky v testech čichové identifikace jsou shrnuty v tab. 2. V porovnání s kontrolní skupinou byla čichová identifikace výrazně postižena u ACH (p < 0,001), FTLD (p < 0,001) i u aMCI (p < 0,01). Nalezený rozdíl mezi naMCI a zdravými jedinci nebyl statisticky signifikantní (p > 0,05). Skupina SMC skórovala na úrovni norem pro zdravé jedince.
Tab. 1. Charakteristika souboru. 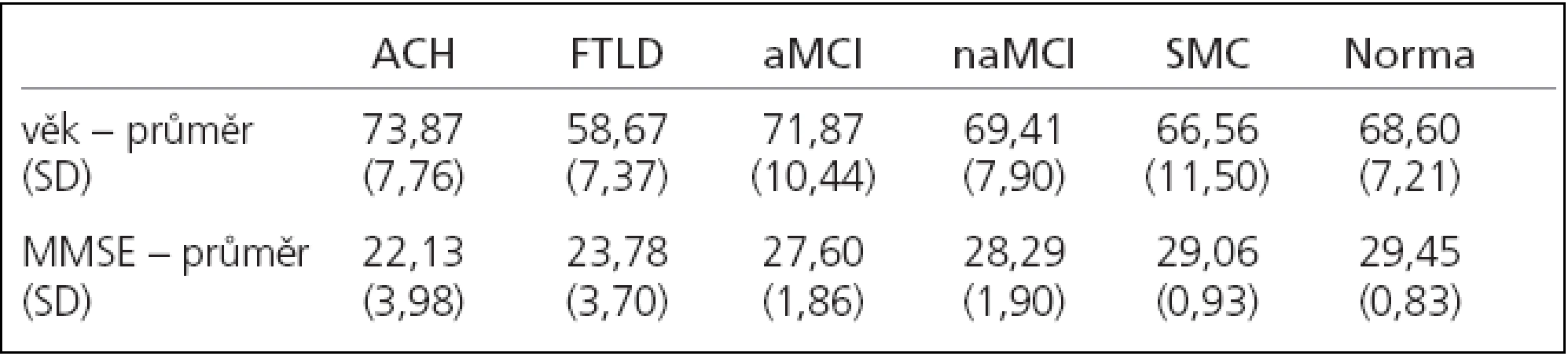
Tab. 2. Počet identifikovaných vůní v MHST. 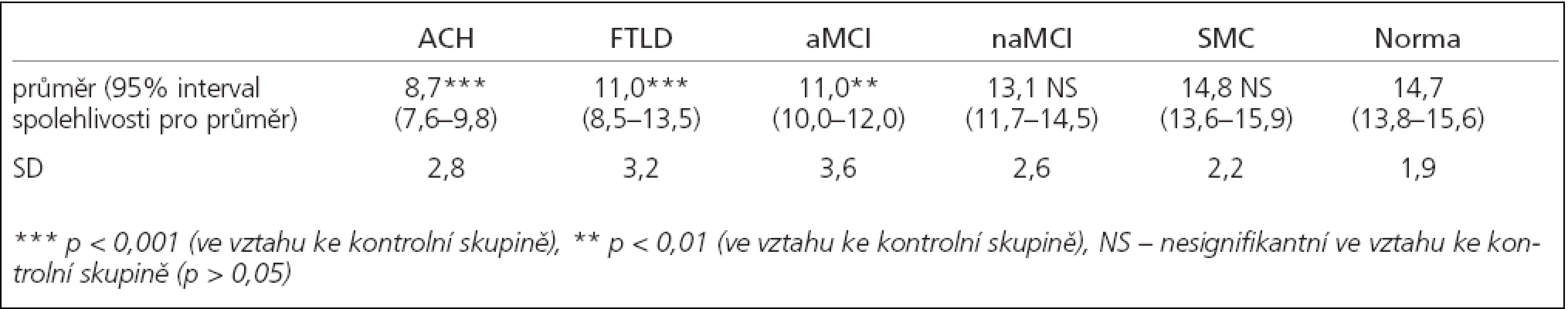
Nalezli jsme silnou korelaci mezi výkony pacientů v testech čichové identifikace MHST a UPSIT: r = 0,68, p < 0,0005 (graf 1).
Diskuse
Nejvýraznější postižení čichové identifikace jsme zjistili ve skupině pacientů s ACH, což je ve shodě s dosud provedenými studiemi a odpovídá neuropatologickým podkladům tohoto onemocnění [21]. Menší stupeň postižení čichové identifikace oproti ACH byl zjištěn ve skupině aMCI, naproti tomu pacienti s naMCI skórovali na úrovni norem pro zdravé jedince. Tento nález podporuje předpoklad, že aMCI představuje prodromální stadium ACH, zatímco naMCI častěji konvertuje do nonalzheimerovských typů demencí [22]. Porucha čichové identifikace u aMCI je způsobena počínající atrofií MTO, která je již v tomto stadiu prokazatelná na MRI. Postižení začíná v transentorinální a entorinální oblasti [21], odkud se šíří dle Braakových stadií do dalších oblastí temporálního laloku a postupně tak dochází ke globálnímu čichovému deficitu (přidává se postižení čichové diskriminace i detekce), který je přítomen u ACH. V prospektivní studii bylo zjištěno, že větší riziko přechodu z MCI do ACH je u pacientů, kteří mají objektivně prokázanou poruchu čichu, subjektivně si jí však nejsou vědomi [23].
Na úrovni norem zdravých jedinců skórovali také pacienti se SMC, což svědčí proti postižení MTO u této skupiny.
Poruchu čichové identifikace jsme prokázali rovněž u FTLD. FTLD představuje heterogenní skupinu z hlediska postižených struktur i klinických projevů. V našem souboru jsme významné postižení čichové identifikace zaznamenali u všech subtypů tohoto onemocnění. Podle dosud provedených studií je čich nejvíce postižen u SD a v menší míře u FTD [21]. Tato studie rovněž prokázala, že zatímco identifikace je porušena výrazně, detekce a diskriminace zůstává nezměněna. K horším výsledkům v čichových testech u FTD přispívá porušení exekutivních funkcí a podle některých autorů i podíl orbitofrontální kůry na čichové diskriminaci [24]. U pacientů s pokročilou SD dochází často k rozvoji anomické afázie, která by mohla výkon v testech čichové identifikace ovlivnit. Tento faktor jsme eliminovali použitím testu The Picture Identification Test (PIT). PIT představuje variantu UPSIT, v níž je vůně nahrazena obrázkem.
Celosvětově používaným testem pro vyšetřování a výzkum čichové identifikace u pacientů s kognitivním deficitem je UPSIT. Jedná se o komerčně dostupný test vyráběný v několika verzích (např. britská, americká, německá), které se liší v malém počtu vůní specifických pro danou zemi. UPSIT je standardizovaný test se stanovenými normami pro věk a pohlaví. Jeho nevýhodou je vysoká cena (vyšetření 1 pacienta se pohybuje okolo 25 USD), časová náročnost (délka vyšetření je přibližně 45 min) a spektrum vůní typické pro anglosaskou kulturu, pro českou populaci však často neznámé.
Rozšířeným testem je rovněž The Sniffin' Sticks. Jedná se o evropský (německý) test, který se skládá z fix naplněných vonnými látkami. Je dostupný ve dvou modifikacích. Tzv. Screening 12 Test je určený k orientačnímu vyšetření čichové identifikace a je tvořen 12 vůněmi. Cena tohoto testu je srovnatelná s MHST (cena vyšetření jednoho pacienta je přibližně 15 Kč). Druhou modifikací The Sniffin' Sticks je tzv. Erweiterter Test, který se skládá ze 3 modulů sloužících k vyšetření čichové identifikace, diskriminace a čichového prahu. Tento test je však finančně nákladný.
Výhodou MHST je snadné použití (je pochopitelný i pro pacienty s těžším kognitivním deficitem), přijatelná cena i délka vyšetření (pohybuje se okolo 15 min) a spektrum vůní volené speciálně pro českou populaci.
Podpořeno granty: GAUK 7910/2007, GAUK 74308, GAČR 309/05/0693, interní grant FN V Motole.
MUDr. Hana Magerová
Neurologická klinika UK
2. LF UK a FN V Motole
V Úvalu 84
150 06 Praha 5-Motol
e-mail: hana.magerova@email.cz
Přijato k recenzi: 13. 11. 2007
Přijato do tisku: 6. 3. 2008
Zdroje
1. Morgan CD, Nordin S, Murphy C. Odor identification is an early marker for Alzheimer’s disease: impact of lexical functioning and detection sensitivity. J Clin Exp Neuropsychol 1995; 17(5): 793–803.
2. Doty RL, Bromley SM, Stern MB. Olfactory testing as an aid in the diagnosis of Parkinson’s disease: development of optimal discrimination criteria. Neurodegeneration 1995; 4(1): 93–97.
3. Vodička J, Pokorný K, Ehler E, Pellant A. Poúrazová porucha čichu: kazuistiky. Cesk Slov Neurol N 2007; 70/103(6): 710–714.
4. Doty RL, Reyes PF, Gregor T. Presence of both odour identification and detection deficits in Alzheimer’s disease. Brain Res Bull 1987; 18(5): 597–600.
5. Mesholam RI, Moberg PJ, Mahr RN, Doty RL. Olfaction in neurodegenerative disease: a meta-analysis of olfactory functioning in Alzheimer’s and Parkinson’s diseases. Arch Neurol 1998; 55(1): 84–90.
6. Rezek DL. Olfactory deficits as a neurologic sign in dementia of the Alzheimer type. Arch Neurol 1987; 44(10): 1030–1032.
7. Feldman JI, Murphy C, Davidson TM, Jalowayski AA, Galindo de Jaime G. The rhinologic evaluation of Alzheimer’s disease. Laryngoscope 1991; 101(11):1198–1202.
8. Hawkes C. Olfaction in neurodegenerative disorder. Mov Disord 2003; 18(4): 364–372.
9. Nordin S, Murphy C. Impaired sensory and cognitive olfactory function in questionable Alzheimer’s disease. Neuropsychology 1996; 10 : 113–119.
10. Nordin S, Almkvist O, Berglund B, Wahlund L. Olfactory disfunction for pyridine and dementia progression in Alzheimer disease. Arch Neurol 1997; 54(8): 993–998.
11. Murphy C, Gilmore MM, Seery CS, Salmon DP, Lasker BR. Olfactory thresholds are associated with degree of dementia in Alzheimer̉s disease. Neurobiol Aging 1990; 11(4): 465–469.
12. Koss E, Weiffenbach JM, Haxby JV, Friedland MD. Olfactory detection and identification performance are dissociated in early Alzheimer΄s disease. Neurology 1988; 38(8): 1228–1232.
13. Serby M, Larson P, Kalkstein D. The nature and course of olfactory deficits in Alzheimer΄s disease. Am J Psychiatry 1991; 148(3): 357–360.
14. Talamo BR, Rudel R, Kosik KS, Lee VM, Neff S, Adelman L et al. Pathological changes in olfactory neurons in patients with Alzheimer's disease. Nature 1989; 337(6209): 736–739.
15. Trojanowski JQ, Newman PD, Hill WD, Lee VM. Human olfactory epithelium in normal aging, Alzheimer's disease, and other neurodegenerative disorders. J Comp Neurol 1991; 310(3): 365–376.
16. Reyes PF, Deems DA, Suarez MG. Olfactory-related changes in Alzheimer's disease: a quantitative neuropathologic study. Brain Res Bull 1993; 32(1): 1–5.
17. Price JL, Davis PF, Morris JC, White DL. The distribution of tangles, plaques and related immunohistochemical markers in healthy aging and Alzheimer’s disease. Neurobiol Aging 1991; 12(4): 295–312.
18. Luzzi S, Snowden JS, Neary D, Coccia M, Provinciali L, Ralph MAL. Distinct patterns of olfactory impairment in Alzheimer’s disease, semantic dementia, frontotemporal dementia, and corticobasal degeneration. Neuropsychologia 2007; 45(8): 1823–1831.
19. Rami L, Loy TC, Hailstone J, Warren DJ. Odor identification in frontotemporal lobar degeneration. J Neurol 2007; 254(4): 431–435.
20. Hort J, Glosová L, Vyhnálek M, Bojar M, Škoda D, Hladíková M. Tau protein a beta amyloid v likvoru u Alzheimerovy choroby. Cesk Slov Neurol N 2007; 69/101(1): 30–36.
21. Braak H, Braak E. Neuropathological staging of Alzheimer-related changes. Acta Neuropathol 1991; 82(4): 239–259.
22. Devanand DP, Michaels-Marston KS, Liu X, Pelton GH, Padilla M, Marder K et al. Olfactory deficits in patients with mild cognitive impairment predict Alzheimer’s disease at follow-up. Am J Psychiatry 2000; 157(9):1399–1405.
23. Lopez OL, Becker JT, Jagust WJ, Fitzpatrick A, Carlson MC, DeKosky ST et al. Neuropsychological characteristics of mild cognitive impairment subtypes. J Neurol Neurosurg Psychiatry 2006; 77(2): 159–165.
24. Zatorre RJ, Jones-Gotman M. Human olfactory discrimination after unilateral frontal or temporal lobectomy. Brain 1991; 114 (Part 1A): 71–84.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Asociace vybraných rizikových faktorů s tíží aterosklerotického postižení v karotické bifurkaciČlánek Retrospektivní analýza nálezů zrakových evokovaných potenciálů při akutním zánětu zrakového nervuČlánek Tau-protein, fosforylovaný tau-protein a beta-amyloid42 v likvoru u demencí a roztroušené sklerózyČlánek Migréna v těhotenstvíČlánek Sporadický „guamský parkinsonský komplex“ nebo koincidence více neurodegenerativních onmocnění?Článek Webové okénkoČlánek Gerhard Waberžinek
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2008 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Degenerace krční meziobratlové ploténky – indikace a možnosti chirurgické léčby
- Depersonalizace a derealizace – současné nálezy
- Sexuální dysfunkce u žen s epilepsií a jejich příčiny
- Pohybové aktivity pacientů trpících dědičnou polyneuropatií
- Asociace vybraných rizikových faktorů s tíží aterosklerotického postižení v karotické bifurkaci
- Funkce pravé komory srdeční a výskyt plicní hypertenze u pacientů se syndromem obstrukční spánkové apnoe
- Přínos vyšetření čichu v časné diagnostice demencí neurodegenerativní etiologie
- Analýza pulzové vlny v objektivizaci bolesti – předběžné sdělení
- Kvalita života u pacientů po subarchnoidálním krvácení – roční katamnéza
- Retrospektivní analýza nálezů zrakových evokovaných potenciálů při akutním zánětu zrakového nervu
- Laboratorní ukazatele neurodegenerace v likvoru a míra motorického postižení u Parkinsonovy nemoci: korelační studie
- Tau-protein, fosforylovaný tau-protein a beta-amyloid42 v likvoru u demencí a roztroušené sklerózy
- Migréna v těhotenství
- Sporadický „guamský parkinsonský komplex“ nebo koincidence více neurodegenerativních onmocnění?
- Použití DTI traktografie v neuronavigaci při operacích mozkových nádorů: kazuistiky
- Webové okénko
-
Analýza dat v neurologii
IX. Poissonovo rozdělení - Gerhard Waberžinek
- Management ischemické cévní mozkové příhody a tranzitorní ischemické ataky – doporučení European Stroke Organisation (ESO) 2008 – zestručněná česká verze
- Doporučený postup sekundární prevence recidivy po akutní cévní mozkové příhodě: mozkovém infarktu/tranzitorní ischemické atace a hemoragické cévní mozkové příhodě
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Depersonalizace a derealizace – současné nálezy
- Degenerace krční meziobratlové ploténky – indikace a možnosti chirurgické léčby
- Migréna v těhotenství
- Pohybové aktivity pacientů trpících dědičnou polyneuropatií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




