-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Zhoršování epileptických záchvatů a epilepsií antiepileptiky - je to možné?
Worsening of Epileptic Seizures and Epilepsies due to Antiepileptic Drugs – is it Possible?
Antiepileptic drugs may paradoxically aggravate epileptic seizures and epilepsies. Predictable worsening due to an antiepileptic drug arises in the so-called „selective syndrome or seizure – specific aggravation“ or inverse pharmacodynamic effects. Absences and myoclonic seizures are the most risky. In idiopathic generalized and focal epilepsies, carbamazepine, vigabatrin, tiagabine, gabapentin and phenytoin aggravate absences and myoclonias. Juvenile myoclonic epilepsy is worsened with carbamezepine, phenytoin and, quite exceptionally, with lamotrigine. Benign rolandic epilepsy may change into the so-called “atypical form” due to carbamazepine with the increasing number of absences, by provoking negative myoclonus and with the evolution of EEG epileptiform abnormity into electrical status epilepticus in sleep. From symptomatic generalized epilepsies in Lennox-Gastaut syndrome, carbamazepine worsens atypical absences but it can improve tonic seizures, on the other hand, benzodiazepines and phenobarbital provoke tonic seizures (even in West´s syndrome). Lamotrigine deteriorates the course of severe Dravet myoclonic epilepsy.
To solve the worsening of seizures after applying an antiepileptic drug, its doses should be either reduced or discontinued and substituted with a new medicament. The best prevention is the correct diagnosis of epilepsy and precise classification of epileptic seizures and epilepsies.Key words:
Therapy for epilepsy, antiepileptics, epileptic seizure, epileptic syndrome, worsening of seizures, undesirable effects, inverse pharmacodynamic effect of antiepileptics, tolerance
Autoři: MUDr. Hana Ošlejšková
Působiště autorů: Klinika dětské neurologie LF MU a FN Brno
Vyšlo v časopise: Cesk Slov Neurol N 2007; 70/103(2): 137-142
Kategorie: Přehledný referát
Souhrn
Antiepileptika mohou paradoxně zhoršovat epileptické záchvaty a epilepsie. Předvídatelné zhoršení antiepileptikem vznikne u tzv. selektivní, pro syndrom či záchvat specifické agravace nebo-li inverzního farmakodynamického efektu. Nejvíce rizikové jsou absence a myoklonické záchvaty. U idiopatických generalizovaných a ložiskových epilepsií zhoršuje absence a myoklonie karbamazepin, vigabatrin, tiagabin, gabapentin a fenytoin. Juvenilní myoklonickou epilepsii zhoršuje karbamazepin, fenytoin a zcela výjimečně lamotrigin. Benigní rolandickou epilepsii mění do tzv. atypické formy karbamazepin a zcela ojediněle i lamotrigin s nárůstem absencí, vyvoláním negativního myoklonu a možnou evolucí EEG epileptiformní abnormity do elektrického status epilepticus ve spánku ev. s doprovodným kognitivním zhoršením. Ze symptomatických generalizovaných epilepsií u Lenoxova-Gastautova syndromu karbamazepin zhoršuje atypické absence, ale může zlepšovat tonické záchvaty, benzodiazepiny a fenobarbital naopak tonické záchvaty někdy mohou provokovat (stejně tak občasně i u Westova syndromu). U těžké myoklonické epilepsie Dravetové zhoršuje průběh lamotrigin.
Řešením zhoršení záchvatů po nasazení antiepileptika je jeho snížení nebo vysazení a nahrazení novým. Nejlepší prevencí je správná diagnóza epilepsie a správná klasifikace epileptických záchvatů a epilepsií.Klíčová slova:
léčba epilepsie, antiepileptika, epileptický záchvat, epileptický syndrom, zhoršení záchvatů, nežádoucí účinky, inverzní farmakodynamický efekt antiepileptik, toleranceÚvod
Antiepileptické léky jsou určeny k potlačení epileptických záchvatů. Přesto v literatuře existují zprávy a v naší praxi zkušenosti o možném paradoxním zhoršování epileptických záchvatů a epilepsií při léčbě antiepileptiky. Jejich počet narůstá a lze předpokládat, že zhoršování záchvatů může být v budoucnu fenoménem ještě častějším s významným dopadem na průběh epilepsie v osobní historii pacienta. Nejčastěji se s fenoménem zhoršování záchvatů po podání antiepileptik setkáváme u dětských a adolescentních pacientů [1,2].
Proč nás mohou antiepileptika takto nepříjemně překvapit opačným prozáchvatovým efektem? Na jedné straně mají antiepileptika řadu mechanizmů působení. Některé účinkují jen na jedné biometabolické úrovni, u jiných se příznivěji z hlediska zhoršení záchvatů na účinku podílejí kombinace několika známých mechanizmů, ale velmi často se spolupodílejí i ty, které dosud nebyly rozpoznané a jsou neznámé. Na druhé straně epilepsie, epileptické syndromy a epileptické záchvaty existují v pestrém spektru forem a jsou vyvolávány opět velkým množstvím biochemických abnormalit a etiologických faktorů. Nesmíme zapomínat ani na individuální metabolické rysy pacienta a případně jeho komorbidity a komedikace. Tato trojí složitost je rámcovým vysvětlením, proč někdy může po nasazení antiepileptik ke zhoršení záchvatů dojít. V některých konkrétních případech nám k prevenci tohoto nežádaného efektu a poškození pacienta mohou pomoci naše znalosti a informovanost. Práce je přehledným shrnutím informací o fenoménu možného, nikoliv jistého zhoršování epileptických záchvatů a epilepsií antiepileptiky i s vyvozením některých praktických závěrů pro lékaře, kteří antiepileptika předepisují.
Co považujeme za zhoršení záchvatů? Je to zvýšení frekvence a/nebo závažnosti stávajících záchvatů, objevení se nové formy záchvatů, vznik status epilepticus nebo zhoršení EEG popřípadě s doprovodným kognitivním a/nebo behaviorálním zhoršením. To vše musí být v jasné časové koincidenci s nasazením antiepileptika a zlepšení by se mělo dostavit opět po jeho vysazení (snížení), což není vždy jednoduché v praxi vysledovat. Pomůže pozorně naslouchat pacientovi, nepodceňovat jeho informace a reagovat na jeho stesky na nový lék. Pokud nejsme v terapii epilepsie úspěšní včetně zhoršení záchvatů, je správné, že pomyslíme na selektivní a neselektivní agravaci záchvatů, ale nutností je současně vyloučit možnost chybného stanovení diagnózy epilepsie, nepravidelné užívání antiepileptik či jejich neužívání při nízké sociální úrovni klienta a jeho rodiny a nízké kompliance. I jakési kolísání výskytu, intenzity i frekvence záchvatů v rámci přirozeného průběhu epilepsie v závislosti na životním stylu pacienta a hlavně na psychomotorickém vývoji dítěte je možné.
Klasifikace zhoršování záchvatů antiepileptiky
Zhoršení záchvatů antiepileptiky lze klasifikovat do 2 základních odlišných skupin. Tzv. neselektivní (nespecifické) zhoršování záchvatů a zhoršování selektivní (specifické) nebo-li inverzní farmakologický efekt.
Nespecifické zhoršování záchvatů
Za nespecifické zhoršení je považováno zhoršení intoxikační a „paradoxně intoxikační“, což je zhoršení záchvatů po „nepřiměřené zátěži lékem“. Nejobvykleji se jedná o vysokou dávku léku či o hůře průhledné mechanizmy a interakce v důsledku excesivní polyterapie. Výjimečně tento typ zhoršování nastává i bez prokazatelně vysoké dávky i plazmatické hladiny antiepileptika. Pokud je zmnožení záchvatů jediným příznakem intoxikace, pak můžeme hovořit o „paradoxní intoxikaci“. Při projevech chronické či akutní idiosynkratické toxicity léku dochází obvykle ke zhoršení záchvatů v kontextu celkového zhoršení stavu pacienta a dalších projevů akutní či chronické toxicity a/nebo encefalopatie. Při předávkování antiepileptik se na zhoršení záchvatů podílí řada možných mechanizmů, které jsou často neznámé. Může se jednat o rozšíření farmakodynamických účinků antiepileptika i na jiné neuronové typy. Lze si např. představit, že jsou pak inhibovány inhibiční interneurony s rezultací do dezinhibice neuronů excitačních. Někdy se sníží vigilita a příčinou zhoršení záchvatů může být i toto, což bývá někdy popisováno jako součást mechanizmu podílejícího se na zhoršování tonických záchvatů u Lenoxova-Gastautova syndromu benzodiazepiny (BZD). Při vysoké hladině karbamazepinu (CBZ) může vzniknout hyponatremie, která je důsledkem diuretického efektu. Je to známý negativní účinek CBZ a díky němu může nastat zhoršení záchvatů. Při přisazení valproátu (VPA) ke CBZ musíme při zhoršení vždy myslet na možné ozřejmení toxicity CBZ epoxidu, což je aktivní metabolit CBZ. Hladiny CBZ jsou normální. CBZ epoxid je stabilní a farmakologicky aktivní. VPA zvyšuje jeho poločas vyloučení. Při terapii pouze VPA může dojít ke zvýšení záchvatů prvním signálem hepatotoxicity a neřídké valproátové encefalopatie [3,4].
Zprávy o nespecifickém zhoršování záchvatů lze v literatuře dohledat téměř u všech antiepileptik a zvláště pak u antiepileptik I. a také II. generace.Velmi průkazné zhoršování záchvatů i provokace status epilepticus nastávají požití velmi vysokých dávek antiepileptik při suicidiálních pokusech.
Řešením situace je v případě chronické toxicity pomalé snížení dávky léku až vysazení, a použití jiného antiepileptika. V případě idiosynkratické reakce je to rychlé vysazení a nahrazení jiným antiepileptikem.V řadě případů je tento typ intoxikace při dodržení všech obvyklých pravidel dávkování a strategie léčby antiepileptiky nepředvídatelný.
Specifické selektivní zhoršování záchvatů
Při selektivním horšení záchvatů je zhoršení důsledkem přímého farmakodynamického účinku antiepileptika.V tomto případě farmakodynamický efekt léku přímo interferuje s patogenetickým mechanizmem záchvatů či epilepsie u konkrétního pacienta. Zatímco zhoršení záchvatů při předávkování vyřeší někdy jen snížení dávky antiepileptika, u selektivní agravace je třeba lék vysadit zcela. Jedná se o specifický a celkem dobře předvídatelný efekt. Selektivita je specifická dle typu záchvatu, ale často jen dle typu syndromu, tedy „.... že se jeden typ záchvatů nutně nezhoršuje u všech typů epileptických syndromů.“
Úvahy o specifických farmakokinetických a farmakodynamických mechanizmech zhoršování jsou složité, někdy musí být velmi komplexní a některé z mnoha mechanizmů zůstávají neznámé. Uvádíme jen příklady: zesílení GABA inhibice může působit protizáchvatově nebo facilitačně v závislosti na lokalizaci svého účinku. GABA mediovaná hyperpolarizace thalamických neuronů zvyšuje oscilační thalamokortikální aktivitu. Je to podkladem facilitace generalizovaných záchvatů vigabatrinem (VGB), tiagabinem (TG), gabapentinem (GBP) a také fenobarbitalem (PHB). Na dávce závislým způsobem cestou napěťově řízených Na kanálů může CBZ a částečně i PHB exacerbovat typické a atypické absence, CBZ záchvaty atonické a myoklonické, u kterých byl popsán i vznik de novo u nemocných, kteří do té doby měli jen generalizované tonicko-klonické záchvaty (GTCS) a někdy jen dokonce multifokální specifický epileptický nález v EEG bez epileptických záchvatů. Obdobné účinky může mít i fenytoin (PHT). Poněkud samostatně stojí mechanizmus tolerance, který diferenciálně okrajově uvádíme. Vyvíjí se po určité době podávání léku, kdy dochází k opětovnému navýšení frekvence záchvatů. Zde zhoršení trvá i po snížení či vysazení léku. Zmíněný mechanizmus je hlavní limitací dlouhodobého podávání zejména benzodiazepinů, blokátorů karboanhydrázy, jako je sultiam (STM), a GABAergních agens, jako je VGB.
Fenomén, který nelze podcenit - selektivní horšení záchvatů u epileptických syndromů a epilepsií
Z didaktických důvodů „speciální část publikace“ člením na zhoršování epileptických záchvatů a syndromů. Je daleko přesnější vnímat zhoršení záchvatů selektivně syndrom-specificky, ale na druhé straně musíme mít na paměti, že ne vždy se nám daří epileptické onemocnění hned na počátku, a někdy i v průběhu léčby klasifikovat syndromologicky. Horšení epileptických záchvatů uvádíme v tabulkových přehledech.
Zhoršování epileptických záchvatů jednotlivými antiepileptiky
Pro zhoršování antiepileptiky jsou jednoznačně nejrizikovější absence a myoklonické záchvaty. Způsobují to hlavně antiepileptika s úzkým spektrem účinku, která jsou určena k terapii parciálních záchvatů – PHT, CBZ, VGB, TG a GBP.
Záchvaty s největším rizikem k zhoršování antiepileptiky jsou shrnuty v tab. 1.
Tab. 1. Nejčastěji horšené typy záchvatů. 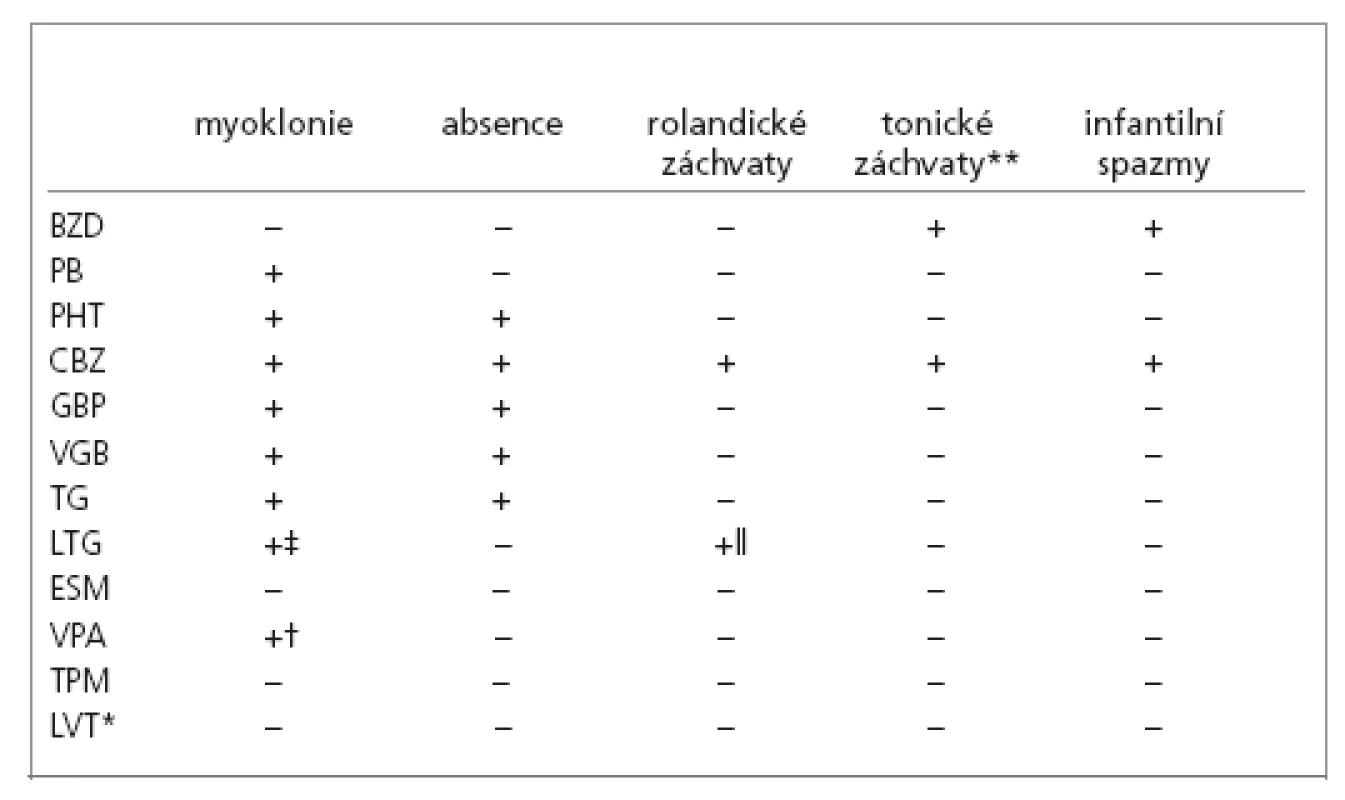
Vysvětlivky: * literární údaje chybí, lék používán nejkratší dobu † vysoký potenciál ke vzniku valproátové encephalopatie se zhoršením myoklonií ‡ u těžké myoklonické epilepsie Dravetové, ojedinělé zprávy u juvenilní myoklonické epilepsie ** především u Lennox-Gastautova syndromu a „tonic like“ u Westova syndromu || ojedinělá citace Zhoršování epilepsií a epileptických syndromů
1) Idiopatické generalizované epilepsie (IGE)
U tohoto typu epilepsií, které jsou k selektivnímu zhoršování obzvláště náchylné, jsou pravidlem 3 druhy záchvatů – typické absence, myoklonické záchvaty a generalizované tonicko-klonické záchvaty (GTCS) [23].
Typické absence jsou téměř konstantně zvyšovány CBZ, VGB [22, 24-28]. TG a PHT [2] je také zhoršují, ale poněkud méně. PB může mít duální účinek. Snižuje absence při nízkých dávkách, zvyšuje je při vysokých [2]. Status absencí může provokovat CBZ [24].
Myoklonické záchvaty např. u juvenilní myoklonické epilepsie jsou zhoršovány CBZ [25,26], méně PHT, VGB, GBP a zcela ojediněle LTG [21,22].
Generalizované tonicko–klonické záchvaty mohou reagovat pozitivně na léky, které jiné záchvaty v rámci téhož syndromu zhoršují. Tak např. vysazení CBZ pro zhoršení absencí může být provázeno zhoršením GTCS. Je to fenomén, ve kterém spočívá složitost medikace u epilepsií a syndromů s různými typy záchvatů a je mnohdy příčinou oprávněné racionální polyterapie [11].
Zhoršení záchvatů v rámci IGE výše uvedenými antiepileptiky bývá provázeno i výrazným zhoršením interiktálních EEG změn. Výjimkou v tomto kontextu je patrně ESM. Bývá popisován negativní efekt ESM u IGE na zvýšení frekvence GTCS. Ale současně je známo, že snižuje interiktální specifické změny v EEG a je možné, že prostě není jen účinný na GTCS, zatímco na ostatní typy záchvatů v rámci syndromu ano [2,29]. Nejedná se tedy o typický fenomén horšení.
2) U symptomatických (ev. kryptogenních) generalizovaných epilepsií souvisejících s difuzní encefalopatií
je situace velmi složitá a málo co platí absolutně. Pacienti mají často nejrůznější typy záchvatů a jejich reakce na různá antiepileptika je také různá.
U těžké myoklonické epilepsie Dravetové v dětském věku (SMEI) je prokázáno celkové zhoršení a provokace myoklonií po podávání lamotriginu (LTG) [14,18-20]. Musíme mít ovšem současně na mysli prvoplánově katastrofický průběh tohoto epileptického syndromu a často prakticky nemožné ovlivnění záchvatů jakýmkoliv antiepileptikem. Zhoršení myoklonií je v tomto případě pro syndrom specifické. Syndrom dále zhoršují léky efektivní na ložiskové epilepsie, jako je CBZ [30], VGB a GBP [9].
U Westova syndromu a infantilních spazmů může záchvaty zhoršit CBZ [2]. Klonazepam (CLZ) podávaný p.o. může někdy provokovat kratičké tonické záchvaty (tonic like seazures) i zhoršení infantilních spazmů.[31].
Tab. 2. Horšení epileptických záchvatů antiepileptiky. 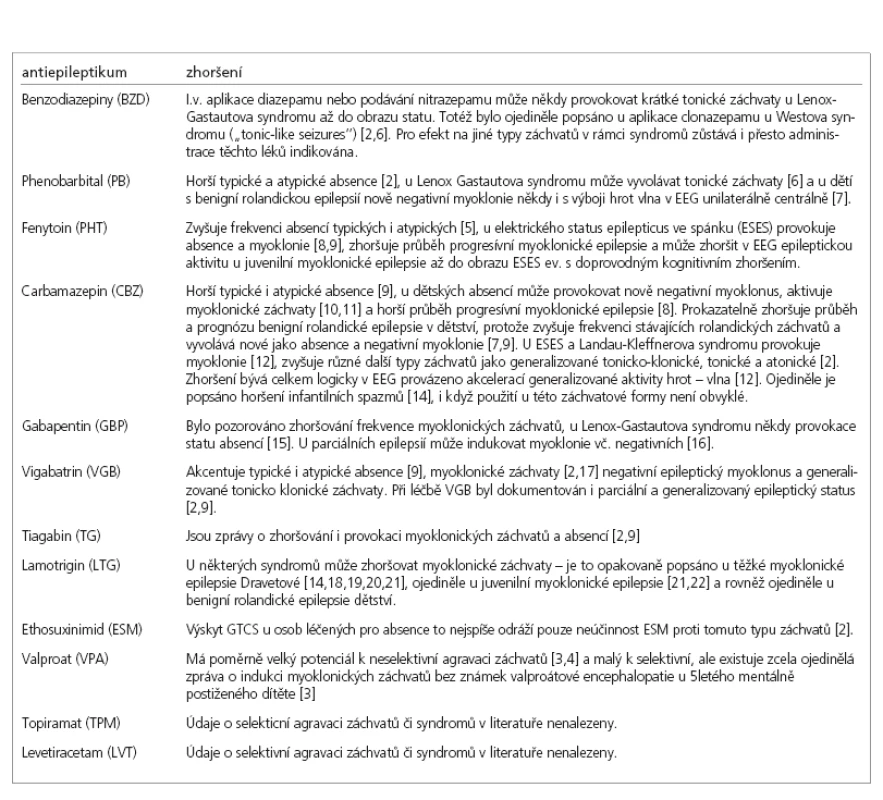
Tonické záchvaty u Lennoxova-Gastautova syndromu reagují na CBZ, ale ten současně může zhoršovat atypické absence v rámci téhož syndromu, proto je doporučována kombinovaná terapie zahrnující i VPA a ev. další léky. V literatuře jsou nečetné reference o provokaci tonických záchvatů často používanými i.v. BZD [6]. GBP může zhoršovat atypické absence a myoklonické záchvaty [15,32].
Myoklonické záchvaty (včetně u progresivní myoklonické epilepsie) zhoršují stejně jako u IGA CBZ, PHT, VGB a GBP.
3) Idiopatické fokální epilepsie
Benigní rolandická epilepsie s centro–temporálními / rolandickými hroty (BECTS, BERS) je syndrom dětského věku výrazně náchylný k selektivní agravaci. Zhoršení stávajících rolandických záchvatů a nově výskyt negativního myoklonu či atypických absencí s vysokou pravděpodobností vyvolá nasazení CBZ [7,9]. Často dojde i ke zvýšení extenze epileptických výbojů během probouzení a spánku při maximální evoluci až do ESES, případně i s doprovodnými kognitivními problémy. Obdobně může působit PB. Někteří pacienti s tzv. atypickou benigní rolandickou epilepsií, která již nemusí být prognosticky příznivá, jsou patrně výsledkem tohoto léčebného postupu [6,33-36]. V literatuře existuje i ojedinělá reference o obdobném nepříznivém efektu lamotriginu [33].
4) Symptomatické (ev. kryptogenní) ložiskové epilepsie
Mechanismy, které podmiňují tyto epilepsie, jsou značně rozmanité a je velmi složité sumarizovat a rozpoznat statisticky významné selektivní zhoršování, protože i literární údaje jsou často protichůdné a nejsou k dispozici spolehlivá kvantitativní data. Studie u farmakorezistentních případů s novými antiepileptiky prokazují, že skupina, která se zhorší, je obvykle menší než skupina, kde je podáváno placebo [36].
Jednoznačně podstatnou roli hrají komplexní individuální faktory, jako je konkrétní etiologie, věk pacienta, topografie epileptického ložiska, typy záchvatů, syndromu a typ EEG patologie. U některých dětských farmakorezistentních fokálních epilepsií může VGB provokovat myoklonické záchvaty [37].
5) Epilepsie a epileptické syndromy nezařaditelné jako ložiskové či generalizované
U pacientů s ESES či Landauovým-Kleffnerovým syndromem (LKS) mohou CBZ i jiné léky účinné na ložiskové epilepsie způsobit zhoršení. Zhoršení záchvatů je obvykle provázeno zhoršením kognitivním či behaviorálním [38]. I u těchto syndromů může být důležitá konkrétní etiologie. Pokud je příčinou fokální kortikální dysplazie, může být efektivní VGB.
Tab. 3. Selektivní zhoršování epilepsií a epileptických záchvatů antiepileptiky. 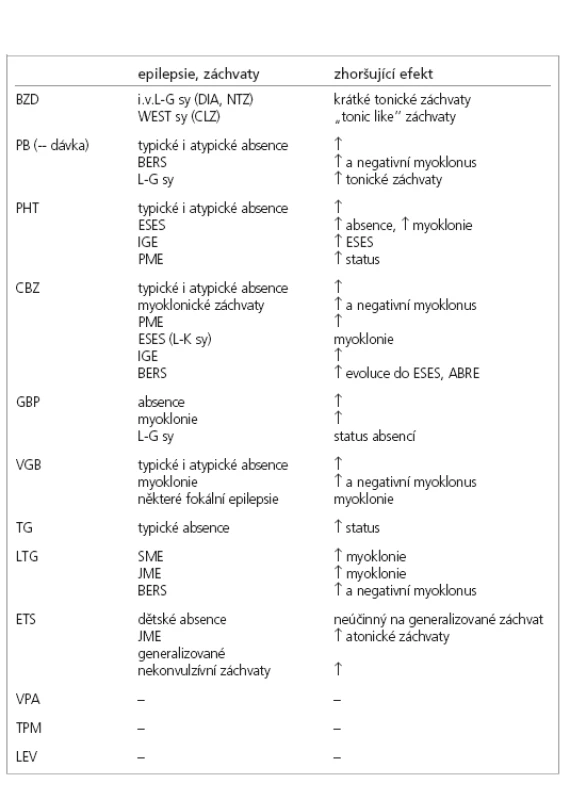
Vysvětlivky: L-G sy – Lannox-Gastaut syndrom, DIA – diazepam, NTZ – nitrazepam, CLZ – clonazepam, BERS – benigní epilepsie s rolandickými záchvaty, ESES – elektrický status epilepticus ve spánku, IGE – idiopatické generalizované epilepsie, PME – progresivní myoklonická epilepsie, L-K sy – Landau-Kleffner syndrom, JME – juvenilní myoklonická epilepsie, SME – těžká myoklonická epilepsie v dětství Dravetové, ABRE – atypická benigní rolandická epilepsie Závěr
Výskyt zhoršení epileptických záchvatů po podání antiepileptika je fenomén, se kterým musíme ve své praxi počítat, zvláště při terapii dětských a adolescentních pacientů. Pokud jej zjistíme, je třeba nejdříve ověřit, zda pacient léky užívá nebo nezměnil dávkování. Pokud je to možné, kontrolujeme hladinu léku v séru. Musíme si být jisti, že jsme diagnózu pacientovi správně vysvětlili a pacient i jeho rodina ji správně přijali. Srozumitelnost našeho vysvětlení je závislá na naší schopnosti podat ji pacientovi přiměřeně jeho mentální úrovni. U závažných sociálních případů je kompliance obvykle nízká, proto musíme mít o pacientovi a jeho rodině i informace v tomto smyslu, popř. být nápomocni řešení. Mnohdy je naprosto nezbytná revize diagnózy, a jistě všichni známe případy, kdy antiepileptiky byli neadekvátně léčeni pacienti s neepileptickými záchvaty. Tehdy se nemůžeme divit navýšení frekvence záchvatů navzdory podávání antiepileptika. Je nutné, abychom znali mechanizmy účinků antiepileptik a výčet již popsaných nežádoucích účinků. Antiepileptika s vícečetnými mechanizmy účinku (tzv. širokospektrá) mají obvykle menší potenciál k horšení záchvatů než ta s jediným mechanizmem účinku (tzv. úzkospektrá). Nejlepší prevencí zhoršení záchvatů je znalost pravidel nasazování, dávkování a indikace antiepileptik, přesná klasifikace záchvatů a ideálně epilepsií a epileptických syndromů. Jak víme, selektivní zhoršování je často úzce specifické a některé skupiny pacientů jsou obzvlášť náchylné k horšení záchvatů. Vysoce rizikové jsou epilepsie s mnohočetnými typy záchvatů, smíšené nebo neklasifikovatelné, s atypickým EEG nálezem, encefalopatií, mentálním postižením a poruchami chování. Dále doporučujeme vyhnout se excesivní neracionální terapii. Je nutno pacientovi naslouchat a nepodceňovat jeho stesky, protože si je pravděpodobně vědom zhoršení dříve než lékař. Řešením problému agravace záchvatů antiepileptikem je jeho snížení, ale častěji vysazení a použití jiného léku nebo kombinace. Počet antiepileptik, která můžeme zvolit pro terapii epilepsií u našich pacientů, narůstá, ale narůstá i riziko zhoršení záchvatů po podání některého z nich. Na druhé straně nemůžeme žádné z nich zatracovat, je jen třeba vědět, jak s nimi zacházet. Naše znalosti nám pomohou vyvarovat se omylů a poškození našich pacientů.
MUDr. Hana Ošlejšková
Klinika dětské neurologie
LF MU a FN Brno
Dětská nemocnice
Černopolní 9, 625 00 Brno
e-mail: hoslej@fnbrno.cz
Přijato k recenzi: 7. 3. 2006
Přijato do tisku: 31. 8. 2006
Zdroje
1. Sazger M, Bourgeois BFD. Aggravation of epilepsy by antiepileptic drugs. Pediatric Neurology 2005; 33(4): 227-34.
2. Guerrini R, Belmonte A, Genton P. Antiepileptic drug-induced worsening of seizures in children. Epilepsia 1998; 39(Suppl 3): S2-10.
3. Egg-Olofsson O, Lindskog U. Acute intoxication with valproate. Lencet 1982; 8284 : 1306.
4. Sannita WG. Valproate acute administration, EEG epileptic abnormalities, and ammonemia. Neurology 1992; 42 : 2003-5.
5. Bauer J. Seizure-inducing effects of antiepileptic drugs: a review. Acta Scand 1996; 94 : 367-77.
6. Tassinari CA, Dravet C, Roger J. Tonic status epilepticus precipitated by intravenous benzodiazepine in five patients with Lennox–Gastaut syndrom. Epilepsia 1972; 13 : 421-35.
7. Guerrini R, Belmonte A, Strumia S, Hirsch E. Exacerbation of epileptic negative myoclonus by carbamazepine or phenobarbital in children with atypical benign rolandic epilepsy. Epilepsia 1995; 36(Suppl 3): S65.
8. Genton P, Gelisse P, Thomas P, Dravet C. Do carbamazepine ans phenytoin aggravate juvenile myoclonic epilepsy? Neurology 2000; 55(8):1106-9.
9. Genton P. When antiepileptic drugs aggravate epilepsy. Brain Dev 2000; 22(2): 75-80.
10. Shields WD, Saslow E. Myoclonic, atonic and absence seizures following institution of carbamazepine therapy in chldren. Neurology 1983; 33 : 1487-9.
11. Berkovic SF. Aggravation of generalized epilepsies. Epilepsia 1998; 39(Suppl 3): S11-S4.
12. Fejeman N, De Blasi AM. Status epilepticus of benign partial epilepsies in children: report of two cases. Epilepsia 1987; 28 : 351-5.
13. Johnsen SD, Tarby TJ, Sidell AD. Carbamazepine-induced seizures. Ann Neurol 1984; 6 : 392-3.
14. Dulac O, Chiron C. Strategy of AED Treatment in Children. In: 3rd European Congress of Epileptology; 1998 May 24-28; Warsaw, Poland. Abstract 62.
15. Vossler DG. Exacerbation of Seizures in Lennox-Gastaut Syndrome by Gabapentin. Neurology 1996; 46 : 852-3.
16. Fromm GH. Gabapentin: discussion. Epilepsia 1994; 35(Suppl 5): S77-S80.
17. Chiron C, Dulac O, Beaumont D. Therapeutic Trial of Vigabatrin in Refractory Infantile Spasms. J Child Neurol 1991; 6(Suppl 2): S52-9.
18. Guerrini R, Dravet C, Genton P, Belmonte A, Kaminska A, Dulac O. Lamotrigine and seizure aggravation in severe myoclonic epilepsy. Epilepsia 1998; 39(5): 508-12.
19. Lamotrigine for adults and children: new indication. A noteworthy improvement in the assessment file [editorial]. Prescrire Int 1999; 8(41): 80-2.
20. Janszky J, Rasonyi G, Halasz P, Olajos S, Perenyi J, Szucs A, Debreczeni T. Disabling erratic myoclonus during lamotrigine therapy with high serum level - report of two cases. Clin Neuropharmacol 2000; 23(2): 86-9.
21. Biraben A, Allain H, Scarabin JM, Schück, Edan G. Exacerbation of juvenile myoclonic epilepsy with lamotrigin. Neurology 2000 Dec; 55(1 of 2).
22. Crespel A, Genton P, Berramdane M, Coubes P, Monicard C, Baldy-Moulinier M et al. Lamotrigine associated with exacerbation or de novo myoclonus in idiopatic generalized epilepsies. Neurology 2005; 65(5): 762-4.
23. Chaves J, Sander JW. Seizure aggravation in idiopatic generalized epilepsies. Epilepsia 2005; 46(Suppl 9):133-139.
24. Parker AP, Agothonikou A, Robinson RO, Panayiotopoulos CP. Inappropriate use of carbamazepin and vigabatrin in typical absence seizures. Dev med Child Neurol 1998; 40 : 517-9.
25. Gayatri NA, Livingston JH. Aggravation of epilepsy by anti-epileptic drugs. Dev Med Chil Neurol 2006; 48(5):394-8.
26. Thomas P, Valton L, Genton P. Absence and myoclonic status epilepticus precipitated by antiepileptic drugs in idiopathic generalized epilepsy. Brain 2006; 129 : 1281-92.
27. Wallengren C, Li S, Morris MJ, Jupp B, O’Brien TJ. Aggravation of absence seizures by carbamazepine in a genetic rat model does not induceneuronal c-Fos acctivation. Clin Neuropharmacol 2005; 28(2): 60-5.
28. Carter-Snead O, Hosey LC. Exacerbation of seizures in children by carbamazepine. New Engl J Med 1985; 313 : 916-21.
29. Lerentz de Haas AM, Kullman M. Ethosuximid and Grand Mal. Epilepsia 1964; 5 : 90-6.
30. Wakai S, Ito N, Sucoka H, Kawamoto MYM, Hayasaka H, Chiba S. Severe myoclonic epilepsy in infancy and carbamazepine. Eur J Pediatr 1996; 155 : 724.
31. Otani K, Tagawa T, Futagi Y, Okamoto N, Yabuuchi H. Induced microseizures in West syndrome. Brain Dev 1991; 13 : 196-199.
32. Vossler DG. Exacerbation of seizures in Lennox-Gastaut syndrome by gabapentin. Neurology 1996; 46 : 852-3.
33. Cerminara C, Montanaro ML, Curatolo P, Seri S. Lamotrigine-induced seizure aggravation and negative myoclonus in idiopathic rolandic epilepsy. Neurology 2004; 63 (2): 373-5.
34. Aicardi J, Chevrie JJ. Atypical benign partial epilepsy of childhood. Dev Med Child Neurol 1982; 24 : 281-92.
35. Parmeggiani L, Seri S, Bonanni P, Guerrini R. Electrophysiological characterization of spontaneus and carbamazepine-induced epileptic negative myoclonus in benign childhood epilepsy with centro-temporal spikes. Clin Neuropharmacol 2004; 115(1): 50-8.
36. Elger C, Bauer J, Scherrmann J, Widman G. Aggravation of focal epilepsies by antiepileptic drugs. Epilepsia 1998; 39(Suppl 3): S15-8.
37. Lortie A, Chiron C, Mumford J, Dulac O. The potential for increasing seizure frequency, relapse, and apperance of new seizure types with vigabatrin. Neurology 1993; 43(Suppl 5): S24-7.
38. Marescaux C, Hirsch E, Finck S, Marquet P, Schlumberger E, Sellal F et al. Landau-Kleffner syndrome: a pharmacological study of 5 caess. Epilepsia 1990; 31 : 768-77.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2007 Číslo 2- Magnosolv a jeho využití v neurologii
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Úvodník
- Súčasný pohľad na diagnostiku a terapiu afázie
- Epilepsie a cyklus spánku a bdění
- Zhoršování epileptických záchvatů a epilepsií antiepileptiky - je to možné?
- Význam MR v indikaci systémové trombolýzy – analýza prvních 30 pacientů
- Specifické protilátky proti beta-tubulinu v diferenciální diagnostice demencí
- Abnormální mikrostruktura spánku a autonomní odpověď u narkolepsie
- Riziko vzniku vaskulární příhody při léčbě fluvastatinem a fenofibrátem
- Korelace ptiO2 a apoptózy u fokální mozkové ischemie a vliv systémové hypertenze
- Turbulence srdeční frekvence v posouzení kardiální autonomní funkce u migreniků
- Radiochirurgická léčba schwannomu trojklaného nervu pomocí Leksellova gama nože
- EFNS Guidelines on pharmacological treatment of neuropathic pain - komentář
- Jednorázové intratékální podání baklofenu a následné zavedení pumpového systému v léčbě těžké spasticity u osob s roztroušenou sklerózou
- Chirurgická léčba ependymomů krční a horní hrudní míchy
- Komplikace operací z předního přístupu pro degenerativní onemocnění krční páteře
- Bazaliom s propagací do mostomozečkového koutu asociovaný s ipsilaterálním neurinomem akustiku – kazuistika
- Solitární fibrózní tumor mening
-
Analýza dat v neurologii. II.
Frekvenční analýza jako první vhled do dat - Webové okénko
- Zpráva o 5. CENS mikrovaskulárním workshopu
- Výroční kongres Neurochirurgické společnosti Indonésie ve spolupráci se Světovou federací neurochirurgických společností (WFNS).
- Prof. MUDr. Jaroslav HYMPÁN 95 ročný
- Prof. MUDr. Zdeněk Kadaňka, CSc. – 65 let
- Recenze
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Epilepsie a cyklus spánku a bdění
- Súčasný pohľad na diagnostiku a terapiu afázie
- Komplikace operací z předního přístupu pro degenerativní onemocnění krční páteře
- Zhoršování epileptických záchvatů a epilepsií antiepileptiky - je to možné?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



