-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Zmena epidemiologického charakteru klostrídiovej kolitídy – rastúci počet komunitných foriem a infekcií u detí
Changing epidemiology of Clostridioides difficile infection – increasing number of community-acquired forms and infections in children
Clostridioides difficile colitis has long been considered an infection associated with hospitalization and concomitant antibiotic treatment. However, the increasing number of community cases in recent years has led to a reassessment of the traditional understanding of its epidemiological characteristics. In addition, community-associated forms have been reported many times in children, young adults, or people without comorbidities and with a negative history of antibiotic use in the pre-disease period. These groups have traditionally been considered low risk for the development of the infection. Thus, many studies have naturally investigated the impact of asymptomatic Clostridioides difficile carriers, including neonates and infants, on the transmission of the causative agent in the community. The prevalence of this bacterium in animals, in food and in the environmental setting has also been the subject of research. The goal was to elucidate the role of these factors in the spread of the agent in community settings. In this article, we summarize the current knowledge on confirmed and potential risk factors for community-acquired Clostridioides difficile infection, together with the results of studies examining patient characteristics. We also provide information on the issue of Clostridioides difficile infection in the paediatric population, which is closely intertwined with the community-acquired form of the infection.
Keywords:
Epidemiology – Clostridioides difficile – asymptomatic carrier state – community-acquired infections
Autoři: M. Sučík 1
; R. Rosoľanka 1
; K. Šimeková 1; P. Bánovčin Jr. 2
; M. Schnierer 2
Působiště autorů: Klinika infektológie a cestovnej medicíny JLF UK a UN Martin 1; Interná klinika – gastroenterologická JLF UK a UN Martin 2
Vyšlo v časopise: Gastroent Hepatol 2023; 77(4): 315-321
Kategorie: Klinická a experimentální gastroenterologie: přehledová práce
doi: https://doi.org/10.48095/ccgh2023315Souhrn
Klostrídiová kolitída bola dlhodobo považovaná za infekciu asociovanú s hospitalizáciou a súčasnou antibiotickou liečbou. Narastajúci počet prípadov v komunite však v posledných rokoch viedol k prehodnoteniu tradičného chápania jej epidemiologických charakteristík. Komunitné formy boli navyše mnohokrát zaznamenané u detí, mladých dospelých či ľudí bez komorbidít a s negatívnou anamnézou užívania antibiotík v predchorobí. Uvedené skupiny boli tradične považované za nízkorizikové pre vznik ochorenia. Mnohé štúdie tak prirodzene skúmali vplyv asymptomatických prenášačov Clostridioides difficile, vrátane novorodencov a dojčiat, na prenos pôvodcu ochorenia v komunite. Predmetom výskumu sa stal aj výskyt tejto baktérie u zvierat, v potrave a environmentálnom prostredí. Snahou bolo ozrejmiť úlohu uvedených faktorov v šírení pôvodcu v komunitných podmienkach. V článku sumarizujeme aktuálne poznatky o potvrdených a potencionálnych rizikových faktoroch komunitnej formy klostrídiovej kolitídy, spoločne s výsledkami štúdií skúmajúcich charakteristiky týchto pacientov. Zároveň prinášame informácie o problematike výskytu klostrídiovej kolitídy v detskej populácii, ktorá je s komunitnou formou infekcie úzko previazaná.
Klíčová slova:
epidemiológia – Clostridioides difficile – asymptomatickí prenášači – komunitné infekcie
Úvod
Clostridioides difficile (CD), v minulosti označovaná Clostridium difficile, je grampozitívna tyčinkovitá sporulujúca baktéria. Po prvýkrát bola izolovaná v roku 1935 zo stolice zdravého dojčaťa. Až v roku 1978 bola preukázaná súvislosť CD s pseudomembranóznou kolitídou, ochorením, ktoré sa rozvíja v dôsledku črevnej dysbiózy navodenej antibiotickou liečbou. V sporulujúcej forme dokáže CD prežívať v nepriaznivom prostredí aj počas expozície vysokým teplotám, UV žiareniu a bežným sterilizačným technikám. Rezistencia spór voči pôsobeniu antibiotík (ATB) môže navyše viesť k rekurencii infekcie po liečbe a predchádzajúcej eradikácii vegetatívnej formy CD. Hlavnými faktormi virulencie sú toxíny A a B [1,2]. Prvé prípady hnačky asociovanej s infekciou CD boli zaznamenané počas liečby klindamycínom. Počet prípadov CDI sa následne prudko zvyšoval. Prispelo k tomu aj rozšírené používanie širokospektrálnych cefalosporínov tretej generácie, voči ktorým je CD prirodzene rezistentná. Dlhodobo prevažoval názor, že klostrídiová kolitída (CDI – Clostridioides difficile infection) je primárne nozokomiálnou nákazou vznikajúcou dominantne u pacientov liečených širokospektrálnymi ATB [3]. Už v 90. rokoch minulého storočia sa v odbornej literatúre začínajú objavovať správy o menších epidémiách CDI v komunite. Táto forma infekcie však bola popisovaná v nízkej incidencii a navyše vyústila len do malého počtu hospitalizácií [4–6]. Záujem odbornej verejnosti o skúmanie príčin komunitných epidémií CDI tak pomerne rýchlo upadol. Aktuálne údaje epidemiologických štúdií z USA však poukazujú na znepokojivý trend, podľa ktorého začínajú už dosahovať prípady klostrídiovej kolitídy rozvíjajúce sa na úrovni komunity (CA-CDI – community-acquired Clostridioides difficile infection) počty nemocničných foriem infekcie. Pozornosť sa tak upriamuje na problematiku vzniku a šírenia tejto infekcie v komunite. Rokmi zaužívané chápanie epidemiologických charakteristík CDI v súčasnosti podlieha dynamickým zmenám [3]. Definície jednotlivých foriem CDI podľa miesta a času nástupu príznakov, resp. ich súvislosti s hospitalizáciou, sumarizuje prehľadová tabuľka (tab. 1).
Tab. 1. Charakteristiky prípadov CDI v závislosti od miesta a času nástupu príznakov infekcie.
Tab. 1. Characteristics of CDI cases based on location and time of onset of symptoms.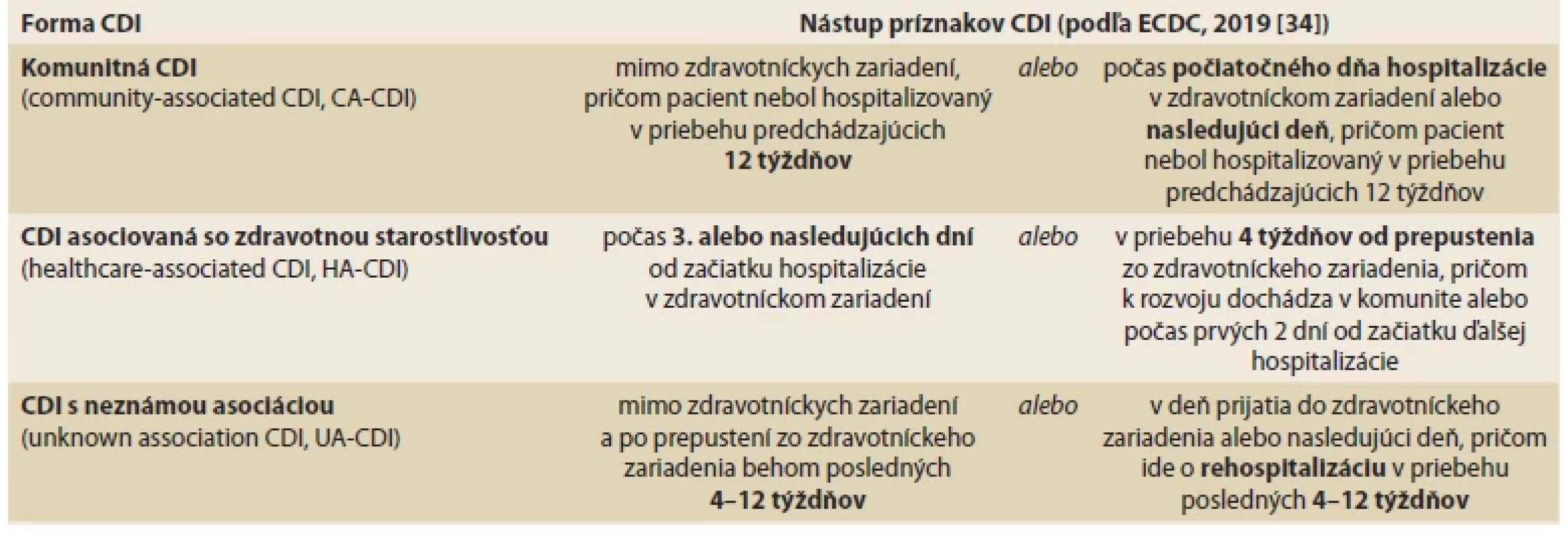
Komunitná forma klostrídiovej kolitídy
CDI je najčastejšia príčina infekčnej hnačky u hospitalizovaných pacientov v Európe a Severnej Amerike. V niektorých oblastiach už CDI asociovaná so zdravotnou starostlivosťou (HA-CDI – healthcare-associated Clostridioides difficile infection) predstihla infekcie spôsobené meticilín-rezistentným Staphylococcus aureus (MRSA), a stala sa tak najčastejšou nozokomiálnou nákazou vôbec. U hospitalizovaných pacientov sa CDI signifikantnou mierou podieľa na zvýšení morbidity a mortality [7]. Podľa epidemiologických štúdií reprezentuje CA-CDI v USA už takmer polovicu všetkých prípadov tejto infekcie [8]. Príkladom je retrospektívna kohortová štúdia, ktorú publikovali Mora Pinzon a kolektív, kde v súbore 15 972 pacientov s CDI predstavovala CA-CDI až 42 % [9]. Navyše sa predpokladá, že nemalá časť prípadov CA-CDI ostáva nediagnostikovaná, a to najmä v prípade jej nekomplikovaných foriem. Skutočná incidencia CA-CDI je tak zrejme omnoho vyššia, ako udávajú dostupné štatistiky. Pri nekomplikovanom priebehu hnačky u nízkorizikových pacientov lekári mnohokrát nezohľadňujú možnosť infekcie CD v rámci diferenciálne-diagnostickej rozvahy pacientových ťažkostí. Napr. v Holandsku a Francúzsku praktickí lekári požiadali o testovanie stolice na CDI len u zhruba 10 % z celkového počtu vyšetrovaných vzoriek [10]. Podobne ako pri HA-CDI je aj pri komunitných formách dominujúcim klinickým prejavom hnačka. Hnačky môže sprevádzať aj horúčka, bolesti brucha, patologická prímes hlienu alebo krvi v stolici. V klinickom obraze infekcie možno v niektorých prípadoch pozorovať aj známky dehydratácie alebo úbytok hmotnosti pacienta [11]. Vo všeobecnosti sa udáva, že CA-CDI zväčša prebehne pod obrazom mierneho gastrointestinálneho ochorenia. U vnímavých jedincov však môže viesť k vzniku komplikácií vrátane rozvoja závažnej formy infekcie. Podľa epidemiologickej štúdie 157 potvrdených prípadov CA-CDI v štáte Minnesota si infekcia vyžiadala hospitalizáciu až u 40 % pacientov. K rozvoju závažnej formy ochorenia došlo v 20 %, k zlyhaniu liečby v 20 % a k rekurencii v 28 % prípadov. Hospitalizovaní pacienti mali signifikantne vyšší vek, vyššie skóre the Charlson comorbidity index a taktiež zvýšené riziko rozvoja závažnej formy infekcie [12].
Asymptomatickí nosiči Clostridioides difficile
Clostridioides difficile sprevádza ľudský organizmus častokrát už od narodenia. Asymptomatická kolonizácia gastrointestinálneho traktu (GIT) non-toxikogennými a toxikogennými kmeňmi tejto baktérie býva prítomná až u 70 % detí mladších ako 12 mesiacov [13,14]. K rozvoju ochorenia v tomto období života však dochádza len raritne. Podľa jednej z hypotéz to môže byť vysvetlené chýbaním receptorov pre toxín A v stále sa vyvíjajúcej sliznici čreva u dojčiat [15]. CD kolonizuje GIT v detstve obvykle len prechodne. Pri opakovaných vyšetreniach je tak často možné aj u jedného dojčaťa v rôznom čase detegovať prítomnosť rôznych kmeňov tejto baktérie. GIT dojčených detí býva kolonizovaný menej často. V súvislosti s rastúcim počtom prípadov CA-CDI sa uvažuje aj o potencionálnom riziku prenosu CD z asymptomatických kolonizovaných dojčiat na osoby blízkeho kontaktu [11,16]. Niektoré zdroje dokonca kontakt s deťmi mladšími ako 2 roky priamo uvádzajú ako rizikový faktor pre vznik ochorenia u dospelých. Ako asymptomatickí nosiči tak dojčatá zrejme určitou mierou napomáhajú šíreniu CD v populácii [17]. Viaceré štúdie preukázali častejší vznik CA-CDI u žien [7,12,13]. To môže byť spôsobené bližším kontaktom matiek s ich dojčatami a s tým spojeným zvýšením rizika prenosu CD, napr. počas procesu prebaľovania. Postupným prechodom na rozmanitejšiu stravu sa GIT detí začína kolonizovať ďalšími baktériami, ktoré postupne kompetitívne znižujú mieru kolonizácie čreva klostrídiami [3]. Počas 2.–3. roka života sú asymptomatickými nosičmi CD už len zhruba 1–3 % detí. To je percentuálne porovnateľné s dospelou populáciou [14]. Miera kolonizácie zdravých nehospitalizovaných dospelých jedincov je tak relatívne nízka, u hospitalizovaných však môže dosahovať 25–50 %. Pozitívna anamnéza CDI a nedávna ATB liečba môžu poslúžiť ako prediktory asymptomatického nosičstva [16]. Štúdia realizovaná v prostredí zariadenia dlhodobej zdravotnej starostlivosti preukázala takmer rovnakú mieru kontaminácie kože a okolitých environmentálnych povrchov pri vyšetrovaní vzoriek získaných od asymptomatických nosičov CD, ako tomu bolo u pacientov s aktívne prebiehajúcou CDI. To naznačuje možný podiel asymptomatických nosičov na šírení pôvodcu infekcie v zariadeniach dlhodobej zdravotnej starostlivosti a rovnako tak aj ich potenciálnu účasť na interhumánnom prenose tejto baktérie v komunite [16,18].
Rizikové faktory rozvoja CA-CDI
Narušenie črevnej mikroflóry pôsobením ATB je jedným z najvýznamnejších faktorov predisponujúcich k rozvoju CDI aj na úrovni komunity [16]. Dostatočná diverzita fyziologickej mikroflóry (FMF) čreva zabezpečuje ochranu pred premnožením CD. Nenarušená FMF inhibuje germináciu, rast vegetatívnej formy aj produkciu spór klostrídií [3]. Epidemiologické štúdie však poukazujú na to, že až u tretiny pacientov s CA-CDI môže chýbať anamnéza užívania ATB v predchorobí [8,10,16]. V komunitných podmienkach tak zrejme ATB liečba nepredstavuje natoľko významný rizikový faktor, ako tomu je u hospitalizovaných pacientov. Na základe výsledkov dvoch metaanalýz možno označiť klindamycín, fluorochinolóny, aminopenicilíny s inhibítormi betalaktamáz a cefalosporíny vyšších generácií za najrizikovejšie ATB pre vznik CA-CDI [16]. Retrospektívna kohortová štúdia, ktorej autori analyzovali ATB asociované s rozvojom CA-CDI počas rokov 2008–2020 u viac ako 11 600 pacientov, potvrdila, že najviac rizikovým ATB asociovaným s rozvojom CA-CDI je klindamycín. K vysoko rizikovým patrili aj cefuroxím, v našich podmienkach aktuálne nedostupný cefdinír a fluorochinolóny. Zaujímavosťou je aj zistenie, že u starších pacientov bola CA-CDI mnohokrát asociovaná aj s užívaním nitrofurantoínu. Nitrofurantoín, ktorý je využívaný predovšetkým v liečbe infekcií močových ciest, sa po perorálnom podaní rýchlo absorbuje v tenkom čreve. Do hrubého čreva sa z celkového množstva podanej dávky dostáva len relatívne malé množstvo (6–13 %). V dôsledku krátkeho biologického polčasu podľa odbornej literatúry dosahuje terapeutické hladiny len v moči [19–21]. Napriek tomu bol nitrofurantoín podľa výsledkov danej štúdie zaradený k ATB so stredným rizikom pre vznik CA-CDI. Do určitej miery k tomu zrejme prispel aj výrazný nárast jeho užívania. V časovom horizonte rokov 2008–2020 preskripcia nitrofurantoínu narástla o viac ako 40 %, čo bolo najviac zo všetkých ATB. Spoločne s ním boli k stredne rizikovým ATB zaradené aj amoxicilín a cefalexín. Naproti tomu užívanie klaritromycínu, azitromycínu a penicilínu V sprevádzalo najnižšie riziko rozvoja CA-CDI [19]. Vysoký vek je ďalším dobre známym rizikovým faktorom rozvoja CDI, avšak v prípade CA-CDI je vek pacientov bežne nižší, ako tomu býva u HA-CDI. V rozsiahlej populačnej štúdii z 8 štátov USA realizovanej na vzorke 984 pacientov s potvrdenou CA-CDI bol vekový medián 51 rokov. Štúdia analyzovala aj expozíciu participantov rôznym úrovniam zdravotníckeho systému v predchorobí. V rámci danej vzorky až u 18 % pacientov nebola prítomná anamnéza nedávneho zdravotného ošetrenia; 40,7 % absolvovalo nízkorizikové zdravotné ošetrenie a 41,3 % vysokorizikové zdravotné ošetrenie. Za nízkorizikové zdravotné ošetrenie boli považované ambulantné vyšetrenia u lekára alebo zubára. Za vysokorizikové sa považovalo napr. chirurgické ošetrenie, dialýza, vyšetrenie na urgentnom príjme či krátkodobá hospitalizácia bez prenocovania. Pacienti s CA-CDI, ktorí neabsolvovali zdravotné ošetrenie v predchorobí a pacienti, ktorí absolvovali nízkorizikové zdravotné ošetrenie, mali častejšie negatívnu anamnézu užívania ATB 12 týždňov pred vznikom ochorenia. Pacienti s nízkorizikovým zdravotným ošetrením v predchorobí mávali častejšie člena domácnosti mladšieho ako 1 rok. V priebehu 7 dní od pozitívneho výsledku stolice na CD bolo hospitalizovaných až 25 % subjektov [13]. Aj táto štúdia tak poukázala na možné riziko prenosu CD z dojčiat na dospelých v prostredí komunity.
Prídavným rizikovým faktorom pre rozvoj CA-CDI je, podobne ako v prípade HA-CDI, prítomnosť závažných komorbidít ako napr. chronická choroba obličiek, imunodeficity a infekcia HIV, hypoalbuminémia, malignity, chemoterapia, idiopatické črevné zápaly (IBD – inflammatory bowel disease), celiakia či syndróm dráždivého čreva [7,16]. U pacientov s IBD bola preukázaná alterácia črevného mikrobiómu odlišujúceho sa od FMF zdravej populácie. Chronický zápal je spojený so zvýšeným zastúpením baktérií Enterobacteriaceae, Pasteurellacaea, Veillonellaceae, Fusobacteriaceae a úbytkom Erysipelotrichales, Bacteroidales a Clostridiales. Alterovaný mikrobióm produkuje menšie množstvo butyrátu, ktorý napomáha udržiavaniu integrity sliznice. Zároveň vedie k nadprodukcii kysliny sialovej, ktorá zohráva významnú úlohu v katabolických procesoch CD. Uvedená dysbióza zvyšuje náchylnosť pacientov s IBD na rozvoj CDI [8].
CDI ako zoonóza či alimentárna infekcia?
Absencia tradičných rizikových faktorov u mnohých pacientov s CA-CDI viedla k skúmaniu ďalších potencionálnych spôsobov prenosu infekcie. Podobnosť kmeňov izolovaných zo zvierat a ľudí prirodzene viedla k hypotéze o zoonotickom šírení CD s možným alimentárnym prenosom na človeka [16]. Pokroky v celogenómovom sekvenovaní odhalili, že kmene CD izolované z ľudí, zvierat, niektorých druhov potravy a vonkajšieho prostredia sú geneticky príbuzné, v niektorých prípadoch dokonca neodlíšiteľné [3]. GIT zvierat kolonizujú klostrídie veľmi často. Krátko po narodení možno, podobne ako u ľudí, detegovať CD u mláďat väčšiny cicavcov. Dokázané boli aj u vtákov a plazov. Konzumované zvieratá tak môžu predstavovať zdroj klostrídií či ich spór, ktoré kontaminujú mäso počas procesu spracovávania v bitúnkoch. Vďaka schopnosti spór prežívať viac ako dve hodiny pri teplote 70 °C ich konzumácia hrozí aj po tepelnom spracovaní potravy [3,15]. Štúdie potvrdili prítomnosť CD v mäsových produktoch hovädzieho, kuracieho a bravčového pôvodu. Ribotyp 078, ktorý bol pôvodne identifikovaný ako dominantný kmeň u ošípaných a hovädzieho dobytka, môže u ľudí vyvolávať závažné formy CA-CDI zaťažené zvýšenou mierou mortality [16]. Vysoká miera kontaminácie mäsových výrobkov CD bola zaznamenaná v USA, kde presiahla až 40 % v rámci skúmaných produktov. Naproti tomu v Európe dosahovala rádovo len niekoľko percent. Značné regionálne rozdiely môžu čiastočne vysvetľovať odlišné procesy spracovania mäsa v bitúnkoch [3]. Určitou mierou sa na vzniku CDI zrejme podieľa aj prítomnosť ATB v konzumovaných mäsových jedlách [13]. Okrem mäsových výrobkov bola CD izolovaná aj z morských plodov a zeleniny [3]. Predmetom výskumu bola aj prítomnosť toxikogénnych kmeňov CD u domácich zvierat a ich úloha v potencionálnom prenose infekcie na človeka. RT 010, RT 014/0 asociované s HA-CDI a potencionálne virulentné RT 027, RT 078 sa dokázateľne vyskytujú u psov a mačiek. Molekulárne charakteristiky doplnené epidemiologickými analýzami však nateraz preukázali len veľmi nízky zoonotický potenciál psov a mačiek v zmysle šírenia CD na ľudí. Napriek tomu riziko prenosu CD z domácich zvierat na ich majiteľov nemožno nateraz vylúčiť úplne [22]. Aj keď celogenómové sekvenovanie demonštruje možnosť prenosu CD zo zvierat na človeka, jednoznačné epidemiologické prepojenie v mnohých prípadoch chýba. Spôsob, akým k prenosu CD zo zvierat na človeka dochádza tak stále ostáva predmetom diskusií [3].
CA-CDI v pediatrickej populácii
Znepokojivým zistením sú narastajúce počty infekcií u pediatrických pacientov, ktorí boli tradične považovaní za nízkorizikovú skupinu. CA-CDI pritom môže predstavovať až 75 % všetkých prípadov klostrídiovej kolitídy u detí [14,16,23,24]. Komunitná forma je v detskej populácii podľa viacerých štúdií dominantným variantom infekcie. Raritou dokonca nie je ani rekurentná forma CA-CDI, ktorú srbskí autori počas siedmich rokov zaznamenali u viac ako 20 % detí s CA-CDI [23]. 20 % miera rekurencie bola zaznamenaná aj v populačnej štúdii CDI u detí v horizonte rokov 1991–2009 v štáte Minnesota [24]. Podobne ako u dospelých, sú aj v prípade CDI v pediatrickej populácii rizikovými faktormi recentná expozícia ATB, hospitalizácia a chronické komorbidity [14]. Ako nezávislý prídavný rizikový faktor CDI u detí bola identifikovaná aj prítomnosť gastrostomickej či jejunostomickej trubice [25]. Rozvoj komplikácií či závažnej formy CDI je u detí obvykle menej častý. Podľa odporúčaní Americkej spoločnosti infekčných ochorení (IDSA – Infectious Diseases Society of America) nie je rutinné testovanie stolice na CD odporúčané u detí s hnačkou vo veku 1–2 rokov, dokým neboli vylúčené ostatné infekčné a neinfekčné príčiny hnačky. U dojčiat < 12 mesiacov by stolica na CD mala byť testovaná, ak je súčasne prítomné toxické megakolon alebo pseudomembranózna kolitída, prípadne pri klinickej signifikantnej hnačke po vylúčení jej ostatných možných príčin. IDSA odporúča testovanie stolice na CD u detí starších ako 2 roky v prípade prolongovanej alebo zhoršujúcej sa hnačky, ak sú prítomné rizikové faktory ako imunosupresia, IBD, relevantná expozícia ATB či pobyt v zdravotníckom zariadení v predchorobí. Štúdie preukázali pozitivitu CD u viac ako 50 % detí hospitalizovaných pre akútnu gastroenteritídu, pri ktorej bol súčasne identifikovaný iný vyvolávajúci patogén [14]. V štúdii prípadov (CSS – case control study) signifikancie nálezu toxikogénnej CD v stolici u detí mladších ako 2 roky s hnačkou, nebol preukázaný výrazný rozdiel priebehu ochorenia medzi deťmi, ktoré boli liečené metronidazolom a deťmi s hnačkou, ktoré napriek nálezu toxikogénnej CD v stolici liečené metronidazolom neboli. Zároveň neboli detegované signifikantné rozdiely medzi deťmi s hnačkou a pozitivitou stolice na CD a deťmi s hnačkou bez nálezu CD v stolici [26]. K diagnóze CDI ako vlastnej príčiny gastrointestinálnych ťažkostí u detí mladších ako 2 roky je tak nutné pristupovať nanajvýš obozretne. Optimálne by v tejto vekovej skupine malo ísť o diagnózu per exclusionem, ktorá sa aj napriek pozitivite toxikogenného kmeňa CD v stolici dojčaťa zvažuje až po vylúčení ostatných infekčných a neinfekčných príčin hnačky. Valentini a kolektív však publikovali prospektívnu štúdiu, ktorá preukázala závažnejší priebeh hnačiek u detí pri koinfekcii dvoma rôznymi patogénmi, pričom najčastejšou koinfekciou (63 %) boli rotavírus a toxikogénna CD. Deti s koinfekciou bez ohľadu na vek vykazovali závažnejší klinický priebeh hnačiek s vyšším rizikom rozvoja ťažkej dehydratácie, horúčky > 38 °C, vyššej frekvencie stolice a dlhším trvaním hnačky a zvracania [27]. Na základe tejto štúdie tak možno usudzovať, že prítomnosť toxikogenného kmeňa CD v stolici dieťaťa s infekčnou hnačkou môže negatívne modulovať priebeh základného infekčného ochorenia postihujúceho GIT. Podľa odporúčaní IDSA sú u detí pri iniciálnej epizóde a prvej rekurencii nezávažnej CDI liečivami voľby metronidazol a vankomycín. Pri prvej epizóde závažnej CDI a druhej alebo vyššej rekurencii CDI je odporúčaným ATB vankomycín [14]. Zárubová vo svojej publikácii poukázala na dobrú efektivitu a bezpečnosť fidaxomicínu v liečbe CDI aj u detských pacientov [28]. Podľa doporučeného postupu Společnosti infekčního lékařství je fidaxomicín preferovaným ATB v liečbe CDI u detí. Podáva sa v dávke závislej od hmotnosti detského pacienta vo forme granulátu na prípravu perorálnej suspenzie 1–2-krát denne [29].
Záver
Tradičné vnímanie CDI ako infekcie postihujúcej len starších hospitalizovaných pacientov, ktorí boli v predchorobí liečení širokospektrálnymi ATB, je obsolentné. Tisíce zaznamenaných prípadov komunitných foriem u ľudí bez zrejmých rizikových faktorov svedčia o tom, že patogenéza a epidemiológia tohto ochorenia je omnoho komplexnejšia. Okrem asymptomatických nosičov, ktorých GIT je kolonizovaný toxikogennými kmeňmi CD, bola táto baktéria izolovaná aj z potravy, vody či zvierat. Do akej miery sa spomínané faktory podieľajú na vzniku CDI u vnímavého jedinca nie je dosiaľ zrejmé. Rastúci počet prípadov CDI v komunite kladie zvýšené nároky na ambulantných lekárov primárneho kontaktu. Tí musia možnosť tejto infekcie zohľadňovať v rámci diagnostiky a liečby ochorení, ktoré prebiehajú pod obrazom akútnej gastroenteritídy. V neposlednom rade musia myslieť aj na prevenciu vzniku tohto ochorenia. Tou je predovšetkým zodpovedná preskripcia ATB. Prakticky u všetkých systémovo podávaných ATB je nutné okrem žiadaného antimikrobiálneho pôsobenia proti pôvodcovi infekcie predpokladať aj negatívne ovplyvnenie črevnej mikroflóry pacienta. Výnimkou nie sú ani ATB s úzkym spektrom účinku. Ich „dificilogénny“ potenciál je v porovnaní so širospektrálnymi ATB (potencované aminopenicilíny, cefalosporíny 2. a ďalších generácií, fluorochinolóny…) ale obvykle nižší. Osobitnou výnimkou je linkozamidové ATB klindamycín. Jeho užívanie je spojené s obzvlášť vysokým rizikom vzniku CDI, a to aj napriek relatívne užšiemu spektru. K nevhodnému indikovaniu ATB v ambulantnej sfére dochádza najmä pri respiračných infekciách na úrovni horných dýchacích ciest [13,16]. K neopodstanému nadužívaniu ATB dochádzalo aj počas nedávnej pandémie ochorenia covidu-19. Podľa záverov viacerých metaanalýz a štúdií bakteriálne koinfekcie a superinfekcie sprevádzali okolo 10 % z celkového počtu prípadov infekcie covidu-19. Napriek tomu k preskripcii ATB došlo u viac ako polovice pacientov s týmto vírusovým ochorením [30–33]. Rešpektovanie zásad antibiotickej politiky môže nemalou mierou prispieť k zvráteniu negatívneho trendu rastúcich prípadov CA-CDI. Obvodní lekári a lekári primárneho kontaktu musia s ohľadom na zmenu epidemiologického charakteru CDI v rámci diferenciálnej diagnostiky hnačiek myslieť aj na možnosť CA-CDI, a to aj v prípade absencie tradičných rizikových faktorov rozvoja infekcie. Testovanie stolice na CD je tak potrebné zvážiť u všetkých pacientov s akútnou hnačkou, predovšetkým po vylúčení ostatných častých infekčných a neinfekčných príčin [16]. S prihliadnutím na epidemiologické štúdie je CDI a jej komunitná forma diagnóza, s ktorou sa budú v dennej praxi častejšie stretávať aj pediatri. Úskalie v diagnostike CDI u detí predstavuje predovšetkým veľmi častá kolonizácia čreva počas prvých mesiacov života. Pozitívny test stolice na toxikogénny kmeň CD tak nemusí automaticky znamenať odhalenie skutočnej etiológie gastrointestinálnych ťažkostí detského pacienta. Naopak, vytesnenie možnosti CDI v procese diferenciálnej diagnostiky môže mať negatívny dopad na výsledný stav, a to obzvlášť u imunokompromitovaných a onkologických pediatrických pacientov. Ak sa aktuálny trend v najbližších rokoch dramaticky nezmení, možno očakávať, že prípady komunitných foriem klostrídiovej kolitídy budú aj naďalej pribúdať. To zrejme vyústi v zvýšený záujem odbornej verejnosti o lepšie objasnenie príčin a zdrojov tejto infekcie. Mnohé z nich sú pri aktuálnych poznatkoch zatiaľ v kategórii potencionálnych.
Zoznam použitých skratiek
ATB antibiotiká
CD Clostridioides difficile, známa aj pod starším názvom Clostridium difficile
CA-CDI community-acquired Clostridioides difficile infection, v komunite získaná forma infekcie Clostridioides difficile
CDI Clostridioides difficile infection, infekcia spôsobená Clostridioides difficile
FMF fyziologická mikroflóra
GIT gastrointestinálny trakt
HA-CDI healthcare-associated Clostridioides difficile infection, nozokomiálna infekcia spôsobená Clostridioides difficile
IBD inflammatory bowel disease, idiopatické črevné zápaly
IDSA Infectious Diseases Society of America, Americká spoločnosť infekčných ochorení
RT ribotyp
ORCID autorov
M. Sučík ORCID 0009-0005-0300-6330,
R. Rosoľanka ORCID 0000-0003-0429-6833,
P. Bánovčin ORCID 0000-0001-6694-9364,
M. Schnierer ORCID 0000-0001-9880-619X.
Doručené/Submitted: 15. 7. 2023
Prijaté/Accepted: 1. 8. 2023
MUDr. Martin Sučík
Klinika infektológie a cestovnej medicíny
JLF UK a UN Martin
Kollárova 2
036 01 Martin
Konflikt záujmov: Autori deklarujú, že text článku zodpovedá etickým štandardom, bola dodržaná anonymita pacientov, a vyhlasujú, že v súvislosti s predmetom článku nemajú finančné, poradenské ani iné komerčné záujmy.
Publikačná etika: Príspevok nebol doteraz publikovaný ani nie je v súčasnosti zaslaný do iného časopisu na posúdenie. Autori súhlasia s uverejnením svojho mena a e-mailového kontaktu v publikovanom texte.
Dedikácia: Článok nie je podporený grantom ani nevznikol za podpory žiadnej spoločnosti.
Redakčná rada potvrdzuje, že rukopis práce splnil ICMJE kritériá pre publikácie zasielané do bio medicínskych časopisov.
Conflict of Interest: The authors declare that the article/ manuscript complies with ethical standards, patient anonymity has been respected, and they state that they have no financial, advisory or other commercial interests in relation to the subject matter.
Publication Ethics: This article/ manuscript has not been published or is currently being submitted for another review. The authors agree to publish their name and e-mail in the published article/ manuscript.
Dedication: The article/ manuscript is not supported by a grant nor has it been created with the support of any company.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for bio medical papers.
Gastroent Hepatol 2023; 77(4): 315 – 321
Zdroje
1. Heinlen L, Ballard JD. Clostridium difficile Infection. The American J Med Sci 2010; 340 (3): 247–252. doi: 10.1097/maj.0b013e3181e93 9d8.
2. Sandhu BK, McBride SM. Clostridioides difficile. Trends Microbiol 2018; 26 (12): 1049–1050. doi: 10.1016/j.tim.2018.09.004.
3. Lim SC, Knight DR, Riley TV. Clostridium difficile and One Health. Clin Microbiol and Infect 2020; 26 (7): 857–863. doi: 10.1016/j.cmi.2019. 10.023.
4. Kyne L, Merry C, O’Connell B et al. Community-acquired Clostridium difficile infection. J Infect 1998; 36 (3): 287–288. doi: 10.1016/s01 63-4453 (98) 94207-4.
5. Riley TV, Cooper M, Bell B et al. Community-Acquired Clostridium difficile-Associated Diarrhea. Clin Infect Dis 1995; 20 (Suppl.): S263–S265. doi: 10.1093/clinids/20.supplement_2.s263.
6. Hirschhorn LR, Trnka YM, Onderdonk AB et al. Epidemiology of Community-Acquired Clostridium difficile-Associated Diarrhea. J Infect Dis 1994; 169 (1): 127–133. doi: 10.1093/ infdis/169.1.127.
7. Thornton CS, Rubin JE, Greninger AL et al. Epidemiological and genomic characterization of community-acquired Clostridium difficile infections. BMC Infect Dis 2018; 18 (1): 443. doi: 10.1186/s12879-018-3337-9.
8. Fu Y, Luo Y, Grinspan AM. Epidemiology of community-acquired and recurrent Clostridioides difficile infection. Ther Adv Gastroenterol 2021; 14 : 175628482110162. doi: doi.org/10.1177/17562848211016248.
9. Mora Pinzon MC, Buie R, Liou J et al. Outcomes of Community and Healthcare-onset Clostridium difficile Infections. Clin Infect Dis 2018; 68 (8): 1343–1350. doi: 10.1093/cid/ciy715.
10. Viprey VF, Davis GL, Benson AD et al. A point-prevalence study on community and inpatient Clostridioides difficile infections (CDI): results from Combatting Bacterial Resistance in Europe CDI (COMBACTE-CDI), July to November 2018. Euro Surveill 2022; 27 (26): 2100704. doi: 10.2807/1560-7917.es.2022.27.26.2100 704.
11. Penit A, Bemer P, Besson J et al. Community-acquired Clostridium difficile infections. Médecine et Maladies Infectieuses 2016; 46 (3): 131–139. doi: 10.1016/j.medmal.2016.01.007.
12. Khanna S, Pardi DS, Aronson SL et al. Outcomes in community-acquired Clostridium difficile infection. Alimentary Pharmacol Ther 2012; 35 (5): 613–618. doi: 10.1111/j.1365-2036. 2011.04984.x.
13. Chitnis AS, Holzbauer SM, Belflower RM et al. Epidemiology of Community-Associated Clostridium difficile Infection, 2009 Through 2011. JAMA Int Med 2013; 173 (14): 1359. doi: 10.1001/jamainternmed.2013.7056.
14. McDonald LC, Gerding DN, Johnson S et al. Clinical Practice Guidelines for Clostridium difficile Infection in Adults and Children: 2017 Update by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA). Clin Infect Dis 2018; 66 (7): 987–994. doi: 10.1093/cid/ciy149.
15. Hensgens MPM, Keessen EC, Squire MM et al. Clostridium difficile infection in the community: a zoonotic disease? Clin Microbiol Infect 2012; 18 (7): 635–645. doi: 10.1111/j.14 69-0691.2012.03853.x.
16. Khanna S, Gupta A. Community-acquired Clostridium difficile infection: an increasing public health threat. Infection and Drug Resistance 2014 [online]. doi: 10.2147/idr.s46780.
17. Kim G, Zhu NA. Community-acquired Clostridium difficile infection. Can Fam Physician 2017; 63 (2): 131–132.
18. Riggs MM, Sethi AK, Zabarsky TF et al. Asymptomatic Carriers Are a Potential Source for Transmission of Epidemic and Nonepidemic Clostridium difficile Strains among Long-Term Care Facility Residents. Clin Infect Dis 2007; 45 (8): 992–998. doi: 10.1086/521854.
19. Zhang J, Chen L, Gomez-Simmonds A et al. Antibiotic-Specific Risk for Community-Acquired Clostridioides difficile Infection in the United States from 2008 to 2020. Antimicrob Agents Chemother 2022; 66 (12): e0112922. doi: 10.1128/aac.01129-22.
20. Vervoort J, Xavier BB, Stewardson A et al. Metagenomic analysis of the impact of nitrofurantoin treatment on the human faecal microbiota. J Antimicrob Chemother 2015; 70 (7): 1989–1992. doi: 10.1093/jac/dkv062.
21. Beneš J. Antibiotika: systematika, vlastnosti, použití. Praha: Grada Publishing 2018.
22. Rabold D, Espelage W, Abu Sin M et al. The zoonotic potential of Clostridium difficile from small companion animals and their owners. PLoS ONE 2018; 13 (2): e0193411. doi: 10.1371/journal.pone.0193411.
23. Predrag S, Kuijper EJ, Nikola S et al. Recurrent community-acquired Clostridium (Clostridioides) difficile infection in Serbian children. Eur J Clinical Microbiol Infect Dis 2020; 39 (3): 509–516. doi: 10.1007/s10096-019-03 751-4.
24. Khanna S, Baddour LM, Huskins WC et al. The Epidemiology of Clostridium difficile Infection in Children: A Population-Based Study. Clin Infect Dis 2013; 56 (10): 1401–1406. doi: 10.1093/cid/cit075.
25. Sandora TJ, Fung M, Flaherty K et al. Epidemiology and Risk Factors for Clostridium difficile Infection in Children. Pediatr Infect Dis J 2011; 30 (7): 580–584. doi: 10.1097/ inf.0b013e31820bfb29.
26. González-Del Vecchio M, Álvarez-Uria A, Marin M et al. Clinical Significance of Clostridium difficile in Children Less Than 2 Years Old: A Case-Control Study. Pediatr Infect Dis J 2016; 35 (3): 281–285. doi: 10.1097/INF.0000000000001 008.
27. Valentini D, Vittucci AC, Grandin A et al. Coinfection in acute gastroenteritis predicts a more severe clinical course in children. Eur J Clin Microbiol Infect Dis 2013; 32 (7): 909–915. doi: 10.1007/s10096-013-1825-9.
28. Zárubová K. Dificlir – fidaxomicin – an effective treatment option for C. difficile infections in children. Gastroenterol Hepatol 2022; 76 (6): 515–516. doi: 10.48095/ccgh2022 515.
29. Beneš J, Stebel R, Musil V et al. Aktualizovaný doporučený postup pro léčbu nemocných s kolitidou vyvolanou Clostridioides difficile. Doporučený postup Společnosti infekčního lékařství ČLS JEP. 2022 [online]. Dostupné z: https: //www. infektologie.cz/zprava22-39. htm.
30. Alshaikh FS, Godman B, Sindi ON et al. Prevalence of bacterial coinfection and patterns of antibiotics prescribing in patients with COVID - -19: A systematic review and meta-analysis. PLoS One 2022; 17 (8): e0272375. doi: 10.1371/journal.pone.0272375.
31. Karami Z, Knoop BT, Dofferhoff ASM et al. Few bacterial co-infections but frequent empiric antibiotic use in the early phase of hospitalized patients with COVID-19: results from a multicentre retrospective cohort study in The Netherlands. Infect Dis 2020; 53 (2): 102–110. doi: 10.1080/23744235.2020.1839672.
32. Langford BJ, So M, Raybardhan S et al. Antibiotic prescribing in patients with COVID - -19: rapid review and meta-analysis. Clin Microbiol Infect 2021; 27 (4): 520–531. doi: 10.1016/ j.cmi.2020.12.018.
33. Langford BJ, So M, Raybardhan S et al. Bacterial co-infection and secondary infection in patients with COVID-19: a living rapid review and meta-analysis. Clin Microbiol Infect 2020; 26 (12): 1622–1629. doi: 10.1016/j.cmi.2020.07.016.
34. European Centre for Disease Prevention and Control. European Surveillance of Clostridioides (Clostridium) difficile infections. Surveillance protocol version 2.4. Stockholm: ECDC; 2019. doi: 10.2900/60304.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2023 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Klinická a experimentální gastroenterologie
- Hepatogenní diabetes u kandidátů transplantace jater: prevalence, rizikové faktory a potransplantační vývoj – prospektivní studie
- Biofeedback asistovaný tréning hlbokého dýchania pri refraktérnych poruchách interakcie čreva a mozgu – naše prvé skúsenosti, dojmy a návrhy pre ďalšiu klinickú prax
- Robotická chirurgie slinivky břišní v pankreatochirurgickém high-volume centru – první zkušenosti
- Bolest na hrudi jako atypický příznak akutní cholecystitidy
- Vliv pandemie covidu-19 na akutní pankreatitidu v České republice – pilotní data studie PANACOTA (PANcreatitis Acuta in COvid Time Analysis)
- Zmena epidemiologického charakteru klostrídiovej kolitídy – rastúci počet komunitných foriem a infekcií u detí
- Proč bychom měli a neměli využívat ChatGPT v gastroenterologii?
- EUS navigovaná drenáž žlučníku: vlastní soubor 66 pacientů za období 2016–2022 z Nemocnice Jablonec nad Nisou
- „Switch“ z biosimilárního infliximabu CT-P13 na biosimilární infliximab SB-2 v dlouhodobé udržovací terapii IBD pacientů – prospektivní observační studie
- Lékové formy perorálního mesalazinu a jejich klinické využití
- Subkutánní infliximab – poznatky z praxe a další možnosti využití u pacientů s IBD
- Výběry z mezinárodních časopisů
- Správná odpověď na předchozí kvíz
- 12th Club Symposium on Portal Hypertension April, 14th–15th 2023, Banská Štiavnica
- 44. české a slovenské endoskopické dny a Olomouc Live Endoscopy 2023
- Kreditovaný autodidaktický test: Klinická a experimentální gastroenterologie
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Zmena epidemiologického charakteru klostrídiovej kolitídy – rastúci počet komunitných foriem a infekcií u detí
- Robotická chirurgie slinivky břišní v pankreatochirurgickém high-volume centru – první zkušenosti
- EUS navigovaná drenáž žlučníku: vlastní soubor 66 pacientů za období 2016–2022 z Nemocnice Jablonec nad Nisou
- Lékové formy perorálního mesalazinu a jejich klinické využití
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



