-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Radiofrekvenční ablace v gastrointestinálním traktu – aktuální stav ve světě a v ČR
Radiofrequency ablation in the GI tract – the “state of the art” in the Czech Republic and worldwide
Radiofrequency ablation (RFA) is a new and effective treatment modality for ablative therapy in the gastrointestinal tract. Barrett’s oesophagus (BE) is the most frequent indication for RFA. RFA is clearly indicated in patients with BE and high-grade dysplasia (HGD) or in patients after endoscopic resection (ER) of an early adenocarcinoma to ablate residual metaplastic mucosa. RFA is not routinely indicated in patients with BE and low-grade dysplasia (LGD) or in patients with non-dysplastic BE even though it can exceptionally be applied in these patients. RFA and endoscopic resection (ER) of the oesophagus can be mutually combined and can suitably complement each other. ER usually precedes RFA, however, it can also be performed after RFA, if necessary (e.g. if a visible lesion develops after RFA). RFA can also be indicated in patients with squamocellular neoplasias of the oesophagus, in patients with resistant and symptomatic GAVE syndrome (gastric antral vascular ectasia) or in patients with refractory postradiation colitis. In contrast to BE patients, these indications are not yet well established. In the Czech Republic, there are three RFA centres which offer this treatment modality – the Central Military Hospital in Prague, Vítkovice Hospital and the University Hospital in Olomouc. The treatment has not yet been approved or reimbursed. Thus, it is covered using the centres’ resources. The treatment began in 2009 and since then, 58 patients have started RFA, of which 24 have completed the treatment. The majority of patients suffered from BE with HGD without any visible lesion or they had undergone prior endoscopic resection for an early adenocarcinoma. There are not many patients indicated for RFA treatment, at least at present. Therefore, three RFA centres seem appropriate for the Czech Republic, enabling the treatment of all patients with a clear indication. However, the reimbursement issue remains to be solved since the problem is not sustainable in the long term. The article summarizes the “state of the art” concerning RFA and also provides the treatment results from all three RFA centres in the Czech Republic. At the end, the authors discuss the subsequent scenario concerning RFA indications in the Czech Republic as well as abroad.
Key words:
Barrett‘s oesophagus – radiofrequency ablation – adenocarcinoma – endoscopic resection
Autoři: J. Martínek 1; Přemysl Falt 2
; J. Gregar 3; Š. Suchánek 1; O. Urban 2; V. Procházka 3
; M. Zavoral 1
Působiště autorů: Interní klinika 1. LF UK a ÚVN Praha 1; Centrum péče o zažívací trakt, Vítkovická nemocnice, a. s., Ostrava 2; II. interní klinika gastro-enterologická a hepatologická, FN Olomouc a LF UP v Olomouci 3
Vyšlo v časopise: Gastroent Hepatol 2011; 65(5): 279-285
Kategorie: Digestivní endoskopie: přehledová práce
Souhrn
Radiofrekvenční ablace (RFA) představuje nový a účinný způsob ablační léčby v gastrointestinálním traktu. Nejčastěji se používá při léčbě pacientů s Barrettovým jícnem (BJ). Tato léčba je jednoznačně indikována u pacientů s BJ a vysokým stupněm dysplazie (HGD) nebo u pacientů s časným adenokarcinomem léčeným endoskopickou resekcí (ER). Cílem zákroku je eradikace zbytkové metaplastické či dysplastické sliznice. RFA prozatím není indikována u pacientů s BJ a nízkým stupněm dysplazie (LGD) nebo u pacientů s BJ bez dysplazie. Nicméně u těchto pacientů lze v individuálních případech RFA použít. RFA a endoskopická resekce v jícnu se mohou vzájemně kombinovat a vhodně doplňovat. Endoskopickou resekci lze dokonce provádět i po předchozí RFA (např. objeví-li se viditelná léze až po provedení RFA). V dalších indikacích lze RFA použít u pacientů s dlaždicobuněčnými neoplaziemi jícnu, rezistentním a symptomatickým GAVE syndromem (Gastric Antral Vascular Ectasia) či u pacientů s rezistentní postradiační kolitidou. Na rozdíl od Barrettova jícnu se však nejedná o prověřené a jednoznačně doporučované indikace. V ČR jsou tři centra, která RFA provádí (ÚVN Praha, Vítkovická nemocnice, FN Olomouc). Metodu nehradí zdravotní pojišťovny a léčba je prozatím hrazena ze zdrojů uvedených pracovišť. První pacienti byli ve všech centrech léčeni v r. 2009 a doposud léčbu zahájilo 58 pacientů a dokončilo ji 24 pacientů. Nejčastější indikací byl Barrettův jícen – buď po ER pro karcinom, nebo s HGD bez viditelné léze. Vzhledem k tomu, že indikovaných pacientů k RFA není v současné době příliš, jsou tři centra pro ČR (prozatím) dostačující k tomu, aby mohl být léčen každý indikovaný pacient. Nicméně otázka úhrady výkonu pojišťovnami zůstává nanejvýš aktuální, neboť bez jejího vyřešení není současný stav dlouhodobě udržitelný. Článek shrnuje současné výsledky a indikace RFA a shrnuje zkušenosti všech tří pracovišť z ČR. Na závěr autoři diskutují možný scénář dalšího rozvoje RFA u nás i ve světě.
Klíčová slova:
Barrettův jícen – radiofrekvenční ablace – adenokarcinom – endoskopická resekceAblační léčba BJ
Myšlenka ablace segmentu BJ není nikterak nová a mnohé ablační metody se používaly i dříve, s lepším či horším efektem. Žádná z metod však nedosáhla obecné popularity a většího rozšíření. Jednak proto, že ablační léčba neposkytuje klíčovou informaci o histologii (tu dodá jen endoskopická resekce), ale i proto, že každá z doposud užívaných metod měla své limitace. Např. fotodynamická léčba, v naší zemi nepoužívaná, vede nejen k relativně velkému počtu recidiv, ale také k vyššímu počtu stenóz jícnu. U nás populární argon-plazma koagulace bývá časově náročná a k eradikaci celého segmentu BJ je často potřeba i větší počet sezení. Navíc se prokázalo, že při ablaci argon-plazma koagulaci dochází pod nově vytvořeným dlaždicovým epitelem k růstu nebezpečných tzv. „burried“ glands (pohřbené žlázky). Nedochází tedy ke kompletní eradikaci intestinální metaplazie či dysplazie. Argon-plazma koagulace není doporučena ani standardy v USA či jinde [1]. Její použití v této indikaci by mohlo být považováno za postup non-lege artis. Podobné nevýhody jako argon-plazma koagulace měly či mají i různé koagulační či tepelné sondy [2].
Radiofrekvenční ablace a fotodynamická léčba jsou jediné dvě oficiálně doporučované metody ablační léčby BJ s HGD. V naší zemi tak RFA zůstává jedinou možnou ablační terapií.
Mimo radiofrekvenční ablaci je zkoušena ještě jiná slibná metoda. Jde o endoskopickou kryoterapii tekutým dusíkem [3]. Zatím se však nejedná o doporučovanou metodu ve smyslu medicíny založené na důkazech.
Radiofrekvenční ablace
Použití radiofrekvenční energie lze spatřit v chirurgii (např. RFA hepatocelulárního karcinomu, koagulace tkání, řezání), plastické chirurgii, dermatologii, urologii, angiologii apod., nejedná se tedy o převratně nový fyzikální vynález. Nicméně v gastroenterologii se jedná o její první aplikaci.
Radiofrekvenční energie je vysokofrekvenční elektromagnetická energie (frekvence v rozmezí 100 kHz a 100 Mhz), která se tvoří při průchodu nabitých částic uzavřeným okruhem. Radiofrekvenci řadíme obecně mezi tzv. vysokofrekvenční energie, které mají v živém organizmu převážně tepelné účinky. Vodné prostředí organizmu (extracelulární tekutina, intracelulární tekutina a tělesné tekutiny) obsahuje ionty, a proto se chová jako elektrolyt. Všechny elektromagnetické proudy mají v živém organizmu tři typy účinků – elektrolytické, dráždivé a tepelné. Nicméně RF proud (čili vysokofrekvenční střídavý) nemá žádné elektrolytické ani dráždivé účinky, uplatňují se zde pouze účinky tepelné.
Principem RF je rychlá změna polarity elektrod přístroje, který vyvolává pohyb nabitých částic tkáně (pozitivně nabité částice jsou přitahovány k zápornému pólu a negativně nabité ke kladnému pólu). Při změně polarity elektrod se záporné a kladné částice dávají do pohybu k opačnému pólu elektrody, a vzniká tak třecí teplo. Při frekvenci např. 10 MHz dochází ke změně polarity elektrod 10milionkrát za sekundu. Množství vznikajícího tepla ve tkáni závisí na množství RF proudu, odporu ošetřované tkáně a charakteru elektrod [4].
V lékařství se můžeme setkat s RF monopolárními, bipolárními, unipolárními a tripolárními. K ablační léčbě BJ se používá systém HALO360 a HALO90.
HALO360 (obr. 1) je určený pro cirkumferenciální RFA a na distálním konci má umístěný balon, který je pokrytý 30mm dlouhou bipolární elektrodou. V současné době jsou k dispozici balony pěti velikostí (18, 22, 25, 28, 31 mm). Před vlastní ablací je nutno provést tzv. kalibraci, tj. stanovit velikost vnitřního průměru jícnu měřicím balonem.
Obr. 1. Léčba RFA – HALO<sup>360</sup>. Pohled endoskopu skrze nafouknutý balon, kdy se aplikuje RFA. Fig. 1. RFA treatment – HALO<sup>360</sup>. Endoscopic view through an inflated balloon when RFA is applied. 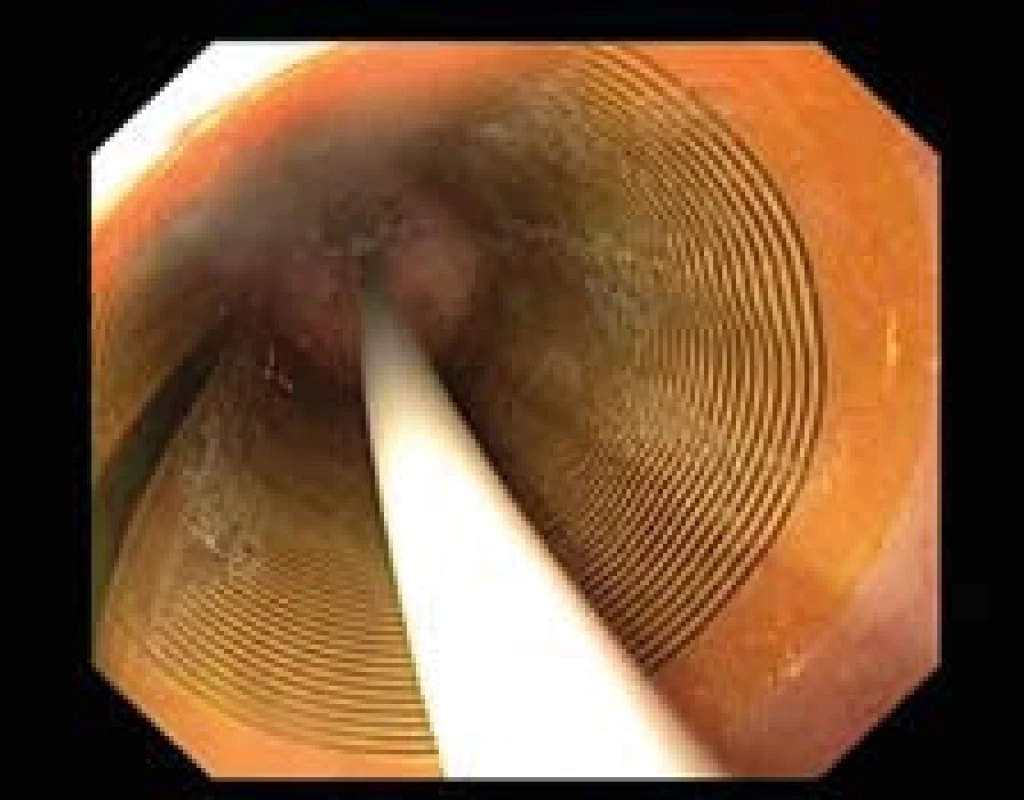
HALO90 (obr. 2) je elektroda obdélníkového tvaru velikosti 20 × 13 mm. Umísťuje se na distální konec endoskopu a je využíván pro RFA krátkého segmentu BJ a fokálních metaplastických ostrůvků.
Obr. 2. Léčba RFA – HALO<sup>90</sup>. Fig. 2. RFA treatment – <sup>90</sup>. 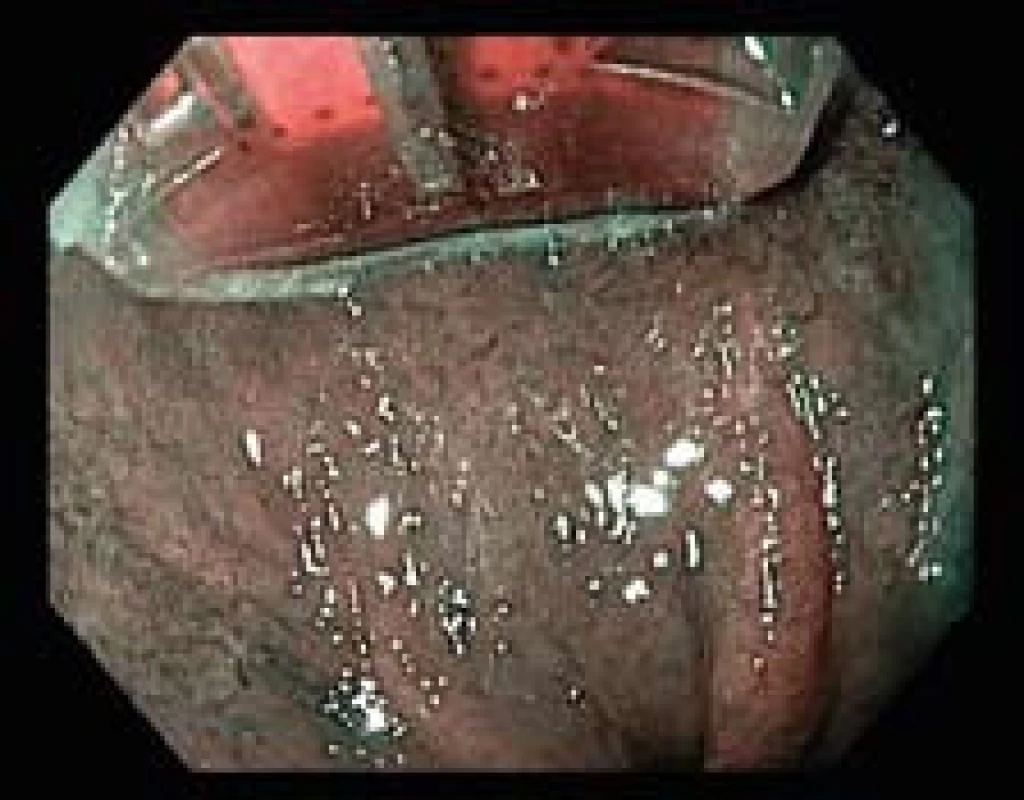
Nově byla do praxe uvedena i elektroda HALO90 Ultra s rozměrem 13,0 × 44,6 mm k ablaci větších ploch.
Používaná bipolární RF ablační energie se pohybuje mezi 10–12 J/cm2 a 40 W/cm2 u HALO360 a 12–15 J/cm2 a 40 W/cm2 u HALO90. Tato energie proniká do hloubky 1 000 μm, čímž se docílí destrukce epitelu, lamina propria a části lamina muscularis mucosae. Je důležité, že tepelný účinek energie již neprostupuje do submukózy. RFA má tedy předvídatelnou hloubku působení, která není příliš závislá na lékaři, který výkon provádí. Díky ablačnímu efektu, který je omezený jen na sliznici, není s touto metodou vysoké riziko stenóz.
Dříve byl ke každému systému nutný jeden generátor radiofrekvenční energie, v současnosti lze zakoupit pro oba typy ablace jeden generátor.
Radiofrekvenční ablace – provedení
Výkony se provádí buď v analgosedaci, event. celkové anestezii. Při použití HALO360 se nejprve zobrazí metaplastická sliznice, změří se pozice GE junkce a Z-line a pak se po zavaděči zavádí kalibrační balon. Po centimetru se pak tento balon nafukuje a vyfukuje a generátor automaticky uvádí doporučenou velikost skutečného pálícího balonu.
K vlastní ablaci se použije doporučený balon, event. balon o jedno číslo menší v případě, že pacient prodělal předchozí endoskopickou resekci.
Před ablací je vhodné sliznici jícnu důkladně opláchnout včetně aplikace mukolytika. Ablace pak probíhá za endoskopické kontroly (obr. 1) a dochází k ablaci celého segmentu BJ. Po první aplikaci energie se ze sliznice pomocí plastového cylindru odstraní nekrotické hmoty a ablace se opakuje. Balony mají maximální počet impulzů (16×), čímž se vyrábějící firma pravděpodobně chrání proti opakovanému používání balonů.
Při použití HALO90 je placka umístěna na endoskopu, před aplikací energie se opět sliznice opláchne mukolytikem. Po ablaci všech oblastí metaplastické sliznice, kdy klademe hlavní důraz na oblast Z-line (v podstatě „znovuvytvoříme“ Z-line), je pomocí placky odstraněna nekrotická sliznice a pak se na již ošetřená místa aplikuje další energie. Na každé místo je tak aplikována energie 4× (2× při první části ablace, 2× při druhé části). Maximální počet aplikace energie je 80×.
Po výkonu pacienty obvykle hospitalizujeme, podáváme protonové inhibitory a propouštíme 24–48 hod po výkonu. RFA lze však provádět i ambulantně.
Po výkonu ponecháváme pacienty na vyšších dávkách antisekreční léčby a endoskopickou kontrolu či další etapu léčby neplánujeme dříve než za 4–6 týdnů.
Byť se může zdát, že se jedná o jednoduchou metodu, byl zde prokázán zásadní efekt zkušenosti na účinnost ablace [5]. Američtí autoři prokázali redukci nutných léčebných seancí ze 4,4 („začátečník“) na 2,3 (zkušený „operátor“). Zkušenost endoskopisty s RFA byla spolu s délkou BJ jediným faktorem, který ovlivňoval celkovou délku a úspěšnost léčby. Autoři odhadli, že endoskopistu lze považovat za „zkušeného“ po provedení 80 RFA. Závěr autorů je takový, že RFA by se měla koncentrovat do center s dostatečným počtem pacientů.
Barrettův jícen – indikace k endoskopické léčbě
Panuje shoda, že pacienty s BJ bez dysplazie sledujeme endoskopicky jednou za tři roky. Riziko vzniku malignity je totiž u těchto pacientů velice nízké (0,2–0,5 %) [6].
Ani u pacientů s prokázanou dysplazií nízkého stupně LGD (tj. potvrzenou specializovaným patologem na problematiku BJ) není v současné době léčba indikována. Pacienty bychom měli sledovat každých 6–12 měsíců. V případě, kdy ve dvou po sobě následujících vyšetřeních není LGD zachycena, hledíme na takového pacienta jako „bez dysplazie“, tj. pacient se vrací do standardního systému sledování (endoskopie jednou za 3–5 let) [1].
Varianta intenzivního sledování [7] je sice stále možná i u pacientů s prokázanou dysplazií vysokého stupně (HGD) (včetně povinného druhého čtení specializovaným patologem), nicméně v současnosti se většina autorů přiklání k variantě endoskopické léčby.
Endoskopická léčba pacientů s BJ a HGD je doporučována i současnými standardy v USA [1], a to včetně RFA. Dalšími doporučenými metodami jsou endoskopická resekce a u nás nepoužívaná a velkým procentem nežádoucích účinků doprovázená fotodynamická léčba. RFA je tedy ve světě oficiálními doporučeními akceptována jako způsob léčby u pacientů s BJ a HGD.
Před 10–15 lety byla jedinou uznávanou léčbou pro pacienty s BJ a HGD (a samozřejmě i pro pacienty s časným karcinomem) ezofagektomie čili náročný operační zákrok doprovázený vysokou mortalitou i morbiditou. Alternativa intenzivního sledování byla proto pochopitelná. Autoři sdělení se domnívají, že téměř každý pacient s HGD (nebo časným karcinomem) v terénu BJ je indikován k endoskopické léčbě. Výjimkou jsou samozřejmě pacienti, jejichž délka života je jednoznačně limitována v důsledku jiného pre - či terminálního stavu.
RFA a endoskopická resekce (ER)
Vzhledem k tomu, že ER a RFA se u velké části pacientů kombinují a každá metoda má své vymezené indikace, považujeme za vhodné krátce zmínit i ER. ER je metoda, kdy dochází k odstranění sliznice a submukózy pomocí různých endoskopických metod. V jícnu jsou nejčastěji používanými technikami metoda aspirační s pomocí ligátoru (tkáň je nasáta a uchycena gumičkou a pak bez podpichu resekována) či aspirační metoda s pomocí plastového cylindru (po podpichu následuje aspirace a řez kličkou). Výhodou ER je možnost histopatologického zhodnocení vzorku, a tudíž staging, zvláště pak u pacientů s adenokarcinomem.
ER je jednoznačně indikována u pacientů s viditelnou lézí nebo s histologicky prokázaným karcinomem (obr. 3,4). U takových pacientů je RFA nevhodná. ER též preferujeme u pacientů s krátkými segmenty BJ s HGD i event. LGD, neboť resekce vede nejen k „eradikaci“ metaplastické sliznice, ale zůstává zde i nezanedbatelná výhoda histopatologického hodnocení. Jeden z autorů článku (JM) pamatuje případ pacienta, který měl v biopsiích hladkého jazýčku několikrát po sobě LGD, v resekátu z ER byl potvrzen adenokarcinom.
Obr. 3. Pacient s prominující lézí. U tohoto (a jiných pacientů s viditelnou lézí) není indikovaná RFA, nýbrž ER. Fig. 3. Patient with a prominent lesion. ER is indicated instead of RFA in this as well in other patients with a visible lesion. 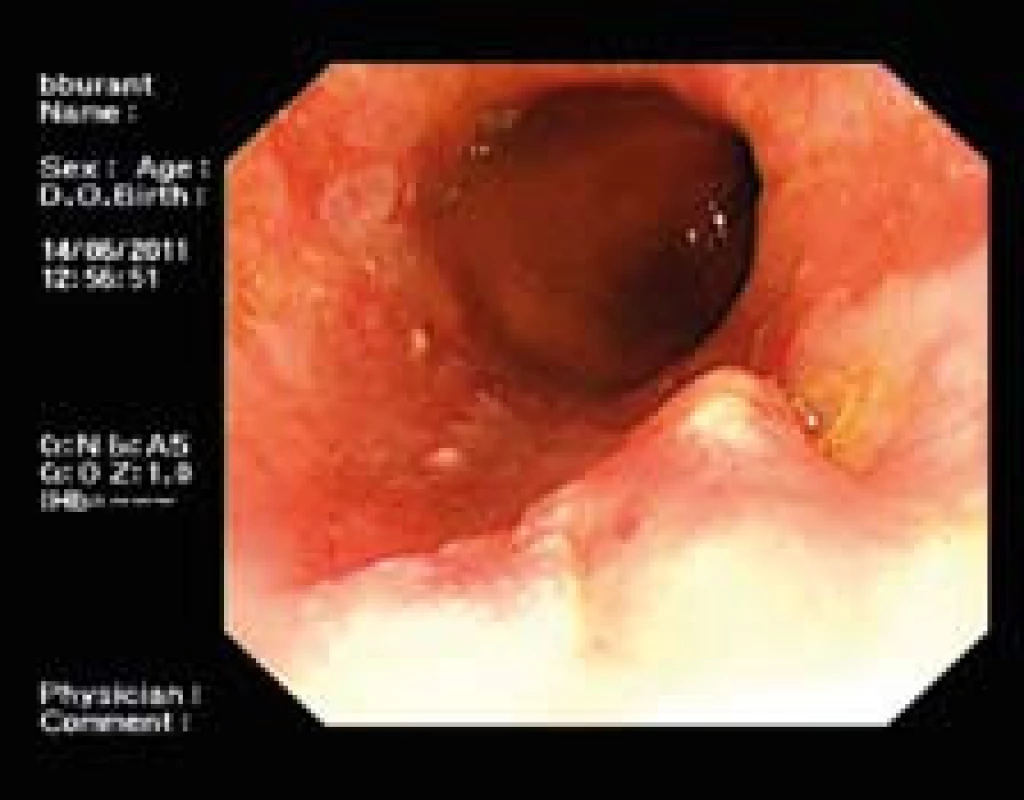
Obr. 4. Stav po ER léze u téhož pacienta (z obr. 3), histologicky byl přítomný adenokarcinom. Léčba RFA bude následovat k eradikaci zbytkového segmentu BJ. Fig. 4. Condition after lesion ER in the same patient (as in Fig. 3), histology identified the presence of adenocarcinoma. RFA treatment will follow to eradicate the BE residual segment. 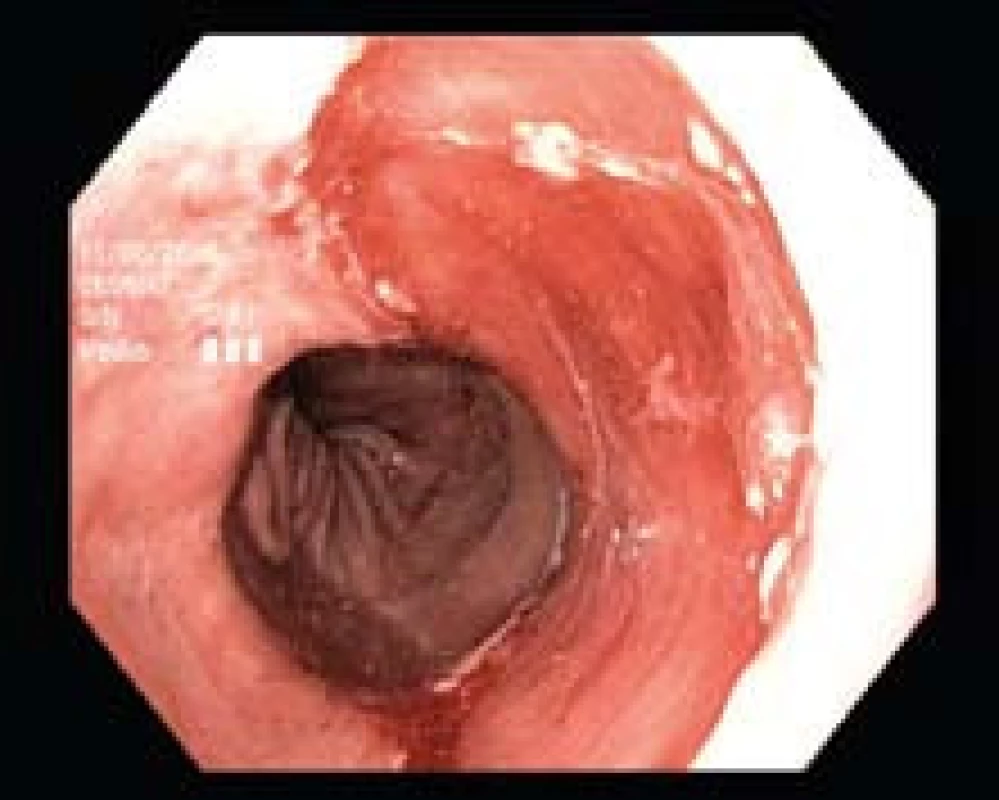
V současnosti se ER považuje za plně kurativní metodu pro pacienty s intramukózním karcinomem [8]. I u pacientů s adenokarcinomem s invazí do první třetiny submukózy (aktuálně doporučena ezofagektomie, nejsou-li k ní kontraindikace) nejsou výsledky ER špatné – většina léčených na karcinom jícnu nezemře [9]. Doplnění ER následnou RFA může dále snížit riziko vzniku metachronních lézí, nicméně studie musí tuto pravděpodobnou domněnku ještě potvrdit.
RFA lze s ER kombinovat v libovolném pořadí, tj. ER většinou předchází RFA, nicméně sami jsme ošetřovali několik pacientů, u kterých byla ER provedena až po předchozí RFA. Podobné výsledky byly publikovány i z Amsterodamu, kde se nachází špičkové světové centrum léčby pacientů s BJ [10].
Výsledky RFA v klinické praxi ve světě
Řada studií prokázala, že RFA je metodou účinnou a bezpečnou. Jedna z nejdůležitějších randomizovaných a „sham“ procedurou kontrolovaných studií vyšla v r. 2009 [11]. Autoři prokázali 77% eradikaci intestinální metaplazie (ITT analýza) vs 2 % u sham procedury), 90% eradikaci LGD (vs 23 %) a 81% eradikaci HGD (vs 19 %). Byl zde i trend (p = 0,045) k redukci progrese dysplazie směrem ke karcinomu (karcinom byl detekován u jednoho pacienta ve skupině RFA vs u čtyř pacientů ve skupině „sham“).
Nejčastějšími nežádoucími účinky byla bolest na hrudi a stenóza se objevila u 6 % léčených pacientů. Dále bývají popisovány ragády jícnu a občasné krvácení. Je však zřejmé, že RFA je bezpečnou a účinnou metodou i po předchozí ER, nicméně právě u pacientů po předchozí léčbě ER je vyšší riziko vzniku striktur. Tyto jsou však vždy léčitelné endoskopicky.
Podobné výsledky přinesly i práce dalších autorů [12]. Holandská skupina prokázala, že RFA vede nejen k makroskopickému i histologickému „vyléčení“, ale že u léčených pacientů nejsou přítomny genetické abnormality (jako např. Ki-67 či p53 aj.) [13].
Stejná skupina prokázala, že kombinace ER u viditelné léze s následnou RFA je stejně účinná v eradikaci neoplazie a metaplastické sliznice jako „kompletní“ endoskopická resekce metaplastické sliznice jícnu. Tento postup (čili ER + RFA) však vyžaduje méně léčebných etap a vede ke stenózám ve 14 % případů, zatímco kompletní endoskopická resekce vede ke stenózám jícnu až v 90 % případů [14]. V neposlední řadě po endoskopické resekci časného adenokarcinomu nedochází při ablaci reziduálního segmentu BJ k tak častým recidivám [10], jak tomu bylo v minulosti, kdy prof. Ell pozoroval recidivy karcinomu v 11–15 % [15].
Jak jsme již uvedli, RFA je od března 2011 uznávanou endoskopickou léčebnou metodou u pacientů s BJ a HGD [1].
Problémem a nevyřešenou otázkou jsou recidivy metaplastické sliznice a dysplazie po RFA. Zdá se, že mohou dosáhnout až 30 %, a to i přes adekvátní antisekreční léčbu. Účinným řešením je opětovná, většinou jediná, aplikace RFA [12].
I díky nevyjasněným otázkám recidiv a rizik je nutné vyléčené pacienty stále endoskopicky sledovat, interval endoskopických kontrol není jednoznačně určen. Může se pohybovat v rozmezí 1–5 let v závislosti na předchozí diagnóze (např. pacienty po resekci adenokarcinomu je nutné sledovat často, pacienty s BJ a LGD po RFA lze jistě sledovat ve 3–5letém intervalu). V budoucnu lze očekávat snížení doporučené frekvence endoskopických kontrol u pacientů s kompletní eradikací metaplastické sliznice. Otázka dlouhodobých výsledků léčby RFA je v současnosti nevyjasněná, vysoce aktuální a nepochybně klíčová.
RFA v ČR
V ČR jsou tři pracoviště, která poskytují léčbu RFA indikovaným pacientům: Interní klinika ÚVN, Vítkovická nemocnice, a. s. – Centrum péče o zažívací trakt a II. interní klinika FN Olomouc. V ÚVN byla RFA provedena u prvního pacienta v ČR dne 7. 4. 2009. Ve Vítkovicích následovala druhá ablace 8. 4. 2009 a v Olomouci 21. 5. 2009. Všechna pracoviště hradí metodu ze svých zdrojů a o svých zkušenostech s léčbou RFA v různých indikacích také publikovala několi prací [16–21]. Ve Vítkovicích byla provedena první RFA v ČR u pacienta s dlaždicobuněčnou dysplazií [18,21] a v Olomouci první aplikace této metody u pacientů s GAVE syndromem (Gastric Antral Vascular Ectasia) a u pacienta s postradiační kolitidou.
Celkové počty léčených pacientů udává tab. 1 a přehled indikací k léčbě udává tab. 2. Jak je z tabulek patrné, nejčastější indikací jsou pacienti s BJ a adenokarcinomem nebo HGD. Pacienti s BJ a LGD jsou léčeni výjimečně (s výjimkou Olomouce). Je to dáno tím, že v Olomouci se běžně vyšetřuje exprese molekulárních markerů a pacienti s BJ a LGD jsou k léčbě indikováni při jejich pozitivitě. Přesto je nutné zdůraznit, že i takový postup není jednoznačně doporučen a LGD nepatří ani u nás k jednoznačným indikacím RFA.
Tab. 1. Tab. 1. Analýza léčby RFA v ČR (k 30. 6. 2011). Tab. 1. Analysis of RFA treatment in the Czech Republic (as of June 30, 2011). 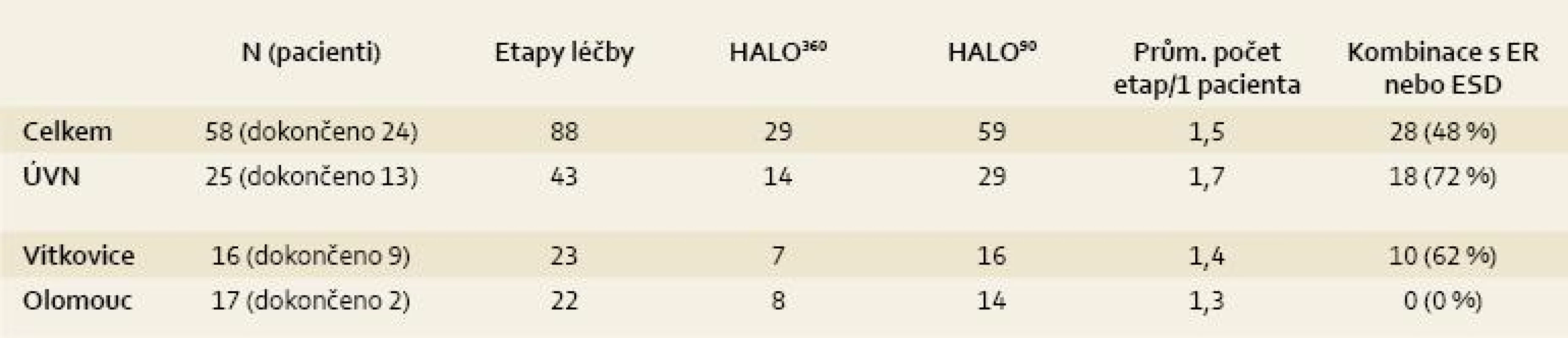
Tab. 2. Indikace k léčbě RFA v ČR (stav k 30. 6. 2011). Tab. 2. Indication for RFA treatment in the Czech Republic (as of June 30, 2011). 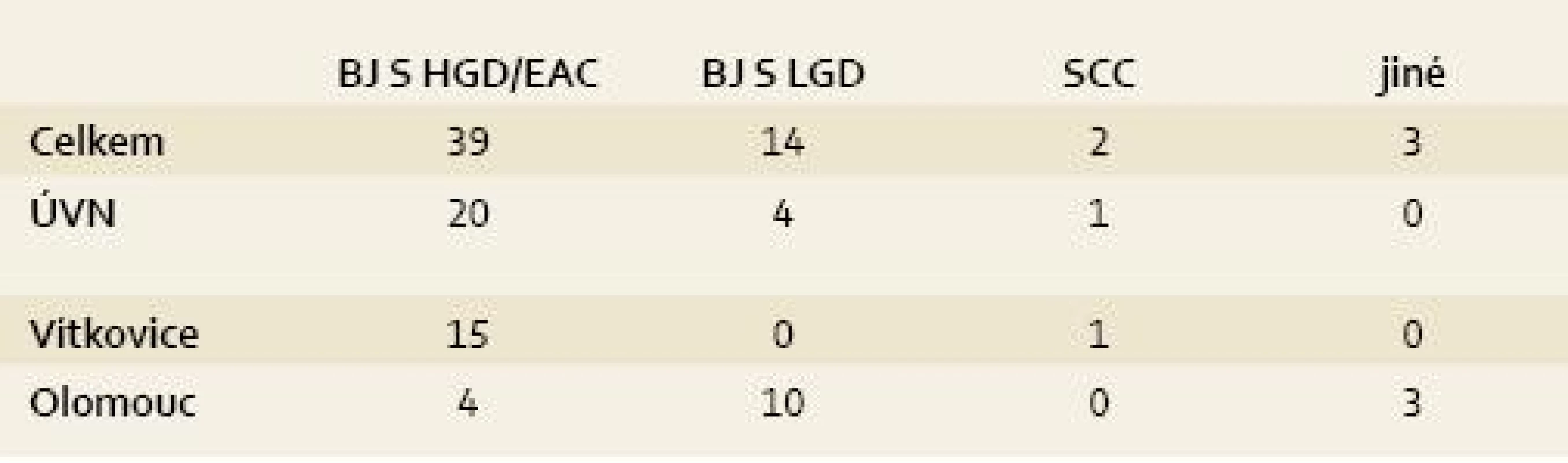
EAC = časný adenokarcinom, SCC = dlaždicobuněčný karcinom (nebo dysplazie) Celkem u dvou pacientů byla metoda indikována pro dlaždicobuněčnou neoplazii, která patří mezi slibné a oblíbené indikace RFA i jinde ve světě, včetně Číny, kde se tento typ neoplazie vyskytuje nejčastěji [21,22].
V ÚVN jsme provedli nejvíce etap léčby, což je způsobeno tím, že většina zde léčených pacientů měla dlouhé až extrémně dlouhé segmenty Barrettova jícnu (až 14 cm!). U jednoho pacienta bylo potřeba šest sezení léčby k jejímu dokončení. Ze 13 pacientů, kterým již léčba skončila, byla v ÚVN pozorována eradikace intestinální metaplazie u 50 % pacientů a dysplazie u 85 % pacientů. Nejrizikovějším místem, kde lze intestinální metaplazii detekovat i po skončení léčby, je oblast Z-line. V Olomouci léčbu kompletně ukončili dva pacienti, proto v budoucnu předpokládáme navýšení počtu seancí léčby na jednoho pacienta.
Ve FN Olomouc byla metoda HALO90 úspěšně použita k léčbě GAVE syndromu u dvou pacientů a k léčbě rezistentní postradiační kolitidy u jednoho pacienta.
S ohledem na technické problémy a nežádoucí účinky lze uvést, že v jednom případě nešlo zavést balon do jícnu v důsledku pokročilé Bechtěrevovy nemoci a jednou došlo k zalomení balonu při jeho zavádění a balon již nebylo možné dále použít.
V jednom případě nešel balon v jícnu (u pacienta po endoskopické resekci) vůbec roztáhnout a při nafouknutí zůstával deformován nejen v místě resekce, ale v celé délce lumen jícnu. Aplikace energie byla technicky nemožná, a tedy neúspěšná, a vzhledem k přetrvávajícímu nálezu HGD je nyní indikována ezofagektomie (obr. 5).
Obr. 5. Deformace balonu při jeho nafouknutí i přes úspěšnou kalibraci – příklad ojedinělého technického selhání léčby. Fig. 5. Balloon deformed while being inflated despite successful calibration – example of a rare technical failure of the treatment. 
Bolest a pálení na hrudi uvádělo až 30 % pacientů, u některých bylo nutné podávat analgetika. Z našeho pozorování plyne, že bolesti po RFA jsou vcelku časté na rozdíl od ER, po které pacienti žádné bolesti většinou neudávají. U většiny pacientů byla po výkonu přítomna přechodná leukocytóza (v ÚVN jsme ji nemohli pozorovat, neboť po výkonu pacientům neprovádíme rutinní kontroly krevního obrazu).
Dlouhodobé výsledky RFA v ČR nelze zatím jednoznačně hodnotit, neboť od léčby prvních pacientů jsou tomu teprve dva roky. V ÚVN jsme u prvního pacienta pozorovali jednoznačnou recidivu výskytu metaplastického jazýčku a pacient byl zaléčen další etapou RFA.
Úhrada a dostupnost RFA v ČR
Není pochyb o tom, že RFA je jednoznačně indikovanou a uznávanou metodou léčby pacientů s BJ a HGD [1]. V budoucnosti lze očekávat rozšíření indikací i na dlaždicobuněčné neoplazie a další indikace, jako jsou GAVE syndrom či postradiační kolitida.
Je jistě pozitivní, že RFA je pro pacienty u nás dostupná. Jsme tudíž o krok vpředu oproti jiným bývalým „východním“ zemím, kde tato metoda dostupná není a možná ani dlouho nebude.
Všechna tři výše uvedená pracoviště hradí léčbu indikovaných pacientů z vlastních zdrojů. Je proto logické, že by otázka zařazení metody do sazebníku výkonů a její úhrady měla být co nejdříve diskutována a vyřešena. V nedávném hlasování auditoria v rámci Českých a Slovenských endoskopických dnů 2010 konaných v Praze souhlasila naprostá většina přítomných (nad 95 %) s názorem, že RFA by měla být u indikovaných pacientů hrazena z veřejného zdravotního pojištění. Jeden z autorů tohoto článku (OU) navrhoval výboru ČGS, aby byl návrh této úhrady zpracován standardním způsobem (včetně návrhu center, diskuze nad možnou spoluúčastí pacientů atd.) [23]. Z tohoto návrhu lze připomenout závěrečná slova: „Navrhuji výboru České gastroenterologické společnosti předložit plátci zdravotní péče podklady k zařazení výkonu do sazebníku a určit centra, která budou s metodou pracovat. Logicky by se mělo jednat o pracoviště, která mají zkušenosti s endoskopickou slizniční resekcí a případně již s RFA. Výsledky těchto center navrhuji shromažďovat a analyzovat na národní úrovni. Jsem přesvědčen o tom, že tento postup dále přiblíží českou gastroenterologii evropské špičce. Především však zpřístupní moderní léčbu našim pacientům.“
Není tajemstvím, že RFA je metodou nákladnou. Cena jedné balonové elektrody se pohybuje v závislosti na vývoji kurzu dolaru mezi 45 a 50 tis. Kč, cena kalibračního balonu je 10–12 tis. Kč a cena „placky“ je 24–27 tis. Kč. Je tedy zřejmé, že zejména u pacientů s více než dvěma etapami léčby a u pacientů s recidivami jsou přímé náklady na léčbu vysoké. Validní ekonomické analýzy eventuelních nepřímých úspor (např. méně indikovaných ezofagektomií, méně endoskopických kontrol) i jiných přínosů (např. zlepšení kvality života pacientů s BJ, kteří se po léčbě zbaví „permanentního strachu z rakoviny“) chybí.
Lze si jen přát, aby k takové diskuzi a hlavně určitému posunu došlo. I proto, že v ČR budou zanedlouho s RFA zkušenosti téměř tříleté, a dosavadní výsledky nejsou nikterak špatné. Moderní endoskopická léčba časných neoplazií jícnu je nepochybně pro pacienty významným přínosem, nahrazuje mnohdy problematické chirurgické zákroky s vysokou mortalitou a dlouhodobou morbiditou, čímž může mít pro pacienty nejen léčebný, ale pro společnost i pozitivní ekonomický dopad.
Autoři článku se shodují, že RFA by měla být hrazena z prostředků veřejného pojištění u pacientů s BJ a HGD a metoda by měla být vázána na centra s dostatečným počtem pacientů.
Vzhledem k diskuzím o RFA léčbě pacientů s BJ a LGD a dokonce i bez dysplazie [12] je vhodné poznamenat, že u nedysplastického BJ autoři léčbu neindikují a ani nedoporučují. V případě zájmu o léčbu ze strany pacienta by byla jistě nutná plná úhrada pacientem. U pacientů s BJ a LGD je otázka otevřená a záleží na výsledcích dalších studií. V ostatních indikacích lze doporučit plnou úhradu u jednoznačně indikovaných pacientů (např. HGD u dlaždicobuněčné neoplazie nebo rezistentní a symptomatický GAVE syndrom po selhání argonové koagulace).
Zkratky
- BJ = Barrettův jícen
- ER = endoskopická resekce
- G-E junkce = gastroezofageální junkce
- GIT = gastrointestinální trakt
- HGD = vysoký stupeň dysplazie
- LGD = nízký stupeň dysplazie
- RCHJ = refluxní choroba jícnu
- RFA = radiofrekvenční ablace
- GAVE = Gastric Antral Vascular Ectasia
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Pozn.: Podle současné nomenklatury by se měly užívat pojmy jako LGIN (Low-Grade Intraepitelial Neoplasia) a HGIN (High-Grade Intraepitelial Neoplasia). Nicméně termíny LGD a HGD jsou pro naše lékaře známější a jejich použití snad učiní článek „čitelnějším“, proto se držíme tradiční terminologie. Nejsme sami, i v prestižních publikacích na toto téma používá velké množství autorů stále tradiční pojmy jako LGD a HGD.
Práce byla podpořena projektem MO: 1610.
Obdrženo/Submitted: 15. 7. 2011
Přijato/Accepted: 12. 8. 2011
MUDr. Jan Martínek, Ph.D.
Interní klinika 1. LF UK a ÚVN Praha
OGHM, ÚVN Střešovice
U Vojenské nemocnice 1200, 160 00 Praha 6
jan.martinek@volny.cz
Zdroje
1. Spechler et al. American Gastroenterological Association Medical Position Statement on the Management of Barrett’s Esophagus. Gastroenterology 2011; 140(3): 1084–1091.
2. Sharma P, McQuaid K, Dent J et al. A Critical review of the diagnosis and management of Barrett´s esophagus: The AGA Chicago Workshop. Gastroenterology 2004; 127(1): 310–330.
3. Shaheen NJ, Greenwald BD, Peery AF et al. Safety and efficacy of endoscopic spray cryotherapy for Barrett’s esophagus with high-grade dysplasia. Gastrointest Endosc 2010; 71(4): 680–685.
4. Martínek J, Zavoral M. Barrettův jícen – jak sledovat a jak léčit. Postrgrad Med 2009; 11(6): 674–682.
5. Bulsiewitz WJ, Pasricha S, Evan S et al. The Effect of Operator Experience On Treatment of Dysplastic Barrett’s Esophagus with Radiofrequency Ablation. DDW 2011. Sa1042.
6. Martínek J, Beneš M, Brandtl P et al. Low incidence of adenocarcinoma and high-grade intraepithelial neoplasia in patiens with Barrett´s esophagus: a prospective cohort study. Endoscopy 2008; 40(9): 711–716.
7. Schnell T, Sontag S, Chejfec G et al. Long-term nonsurgical management of Barrett´s esophagus with high grade dysplasia. Gastroenterology 2001; 120(7): 1607–1619.
8. Ell C, May A, Gossner L et al. Curative endoscopic resection of early esophageal adenocarcinomas. Gastrointest Endosc 2007; 65(1): 3–10.
9. Manner H, May A, Pech O et al. Early Barrett‘s carcinoma with „low-risk“ submucosal invasion: long-term results of endoscopic resection with a curative intent. Am J Gastroenterol. 2008; 103(10): 2589–2597.
10. Pouw RE, Wirths K, Eisendrath P et al. Efficacy of radiofrequency ablation combined with endoscopic resection for Barrett‘s esophagus with early neoplasia. Clin Gastroenterol Hepatol 2010; 8(1): 23–29.
11. Shaheen NJ, Sharma P, Overholt BF et al. Radiofrequency ablation in Barrett´s esophagus with dysplasia. N Engl J Med 2009; 360(22): 2277–2288.
12. Bulsiewicz WJ, Shaheen NJ. The role of radiofrequency ablation in the management of Barrett‘s esophagus. Gastrointest Endosc Clin N Am 2011; 21(1): 95–109.
13. Pouw RE, Gondrie JJ, Rygiel A et al. Properties of the neosquamous epithelium after RFA of Barrett esofagus containing neoplasia. Am J Gastroenterol 2009; 104(6): 1366–1373.
14. van Vilsteren FG, Pouw RE, Seewald S et al. Stepwise radical endoscopic resection versus radiofrequency ablation for Barrett‘s oesophagus with high-grade dysplasia or early cancer: a multicentre randomised trial. Gut 2011; 60(6): 765–773.
15. Pech O, Manner H, Ell C.Endoscopic resection. Gastrointest Endosc Clin N Am 2011; 21(1): 81–94.
16. Suchánek Š, Martínek J, Zavoral M. První radiofrekvenční ablace s využitím HALO systému v České republice. Čes a Slov Gastroent a Hepatol 2009; 63(4): 195–196.
17. Martínek J, Suchánek Š, Stefanová M et al. Radiofrekvenční ablace Barrettova jícnu. Současný stav a první vlastní zkušenosti. Folia Gastroenterol Hepatol 2009; 7(3–4): 105–111.
18. Falt P, Kajzrlíková I, Vítek P et al. Radiofrekvenční ablace v terapii časného spinocelulárního karcinomu jícnu. Endoskopie 2010; 19 : 71–74.
19. Gregar J, Procházka V, Konečný M et al. Naše první zkušenosti s radiofrekvenční ablací Barrettova jícnu. Čes a Slov Gastroenterol Hepatol 2009; 63 (Suppl 1): 17.
20. Falt P, Urban O, Fojtík P et al. Radiofrekvenční ablace v terapii Barrettova jícnu – naše první zkušenosti. Endoskopie 2009; 18(3): 118–123.
21. Kajzrlíková I, Vítek P, Falt P et al. Recurrent oesophageal intramucosal squamous cell carcinoma treated by endoscopic mucosal resection and subsequent radiofrequency ablation using HALO system. BMJ Case Reports 2010; doi:10.1136/bcr.08.2010.3211.
22. Zhang YM, Bergman J, Weusten B et al. Radiofrequency ablation for early esophageal squamous cell neoplasia. Endoscopy 2010; 42(4): 327–333.
23. Urban O. Radiofrekvenční ablace Barrettova jícnu s dysplazií: Jak dlouho necháme naše pacienty čekat? Čes a Slov Gastroenterol Hepatol 2010; 64(3): 41–42.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2011 Číslo 5- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Tento štát nie je pre lekárov
- Společnost gastrointestinální onkologie vás zve na I. národní kongres o kolorektálním karcinomu
-
Kvíz – Případ z klinické praxe
Stenóza terminálního ilea: věk, komorbidity a koincidující medikace jsou významné pro diferenciální diagnózu - Bude naše cesta bez vizí?
- Vítejte na palubě
- Přínos autofluorescence v diagnostice lehké intraepiteliální neoplazie u pacientů s Barrettovým jícnem
- Dvojí tvář rakoviny jícnu – epidemiologie a etiologie
- Natural Orifice Transluminal Endoscopic Surgery (NOTES) – současný stav, vlastní zkušenosti
- Eozinofilní ezofagitida
- Radiofrekvenční ablace v gastrointestinálním traktu – aktuální stav ve světě a v ČR
- Prognostické faktory a načasovanie endoskopie u akútneho nevarikózneho krvácania z horného gastrointestinálneho traktu
- Spontánní retroperitoneální perforace vzestupného tračníku a trombóza portálního řečiště u pacienta s ulcerózní kolitidou
- Za profesorkou MUDr. Dagmar Hauftovou, CSc.(2. 6. 1927–18. 7. 2011)
- Správná odpověď na kvíz
- Globální problémy s financováním zdravotní péče
- Biologická léčba IBD 2011
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Eozinofilní ezofagitida
- Dvojí tvář rakoviny jícnu – epidemiologie a etiologie
- Radiofrekvenční ablace v gastrointestinálním traktu – aktuální stav ve světě a v ČR
- Prognostické faktory a načasovanie endoskopie u akútneho nevarikózneho krvácania z horného gastrointestinálneho traktu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



