-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Protizánětlivý potenciál kompozitů kvasinkových glukanových částic a geranylovaného flavonoidu diplakonu
Anti-inflammatory potential of composites of yeast glucan particles and geranylated flavonoid diplacone
Geranylated flavanone diplacone is a flavanone iso - lated from Paulownia tomentosa (Thunb.) Steud. (Paulowniaceae) with anti-inflammatory and antioxidant properties, nevertheless showing high lipophilicity and low solubility in water. Diplacone was therefore used as a model molecule for incorporation into glucan particles (GPs). GPs are prepared by intensive washing of yeast (Saccharomyces cerevisiae) leading to hollow shells consisting of β-(1→3)/β-(1→6) glucan mainly. The aim of this study was to compare anti-inflammatory potential of GPs-diplacone composites with the compound itself, GPs themselves and the physical mixture of GPs and diplacone. The cell line THP1-XBlueTM-MD2-CD14 derived from human leukemic monocytes was stimulated with lipopolysaccharide (LPS) from Escherichia coli to trigger inflammatory reaction. The composites of GPs with diplacone significantly decreased the activity of pro-inflammatory transcription factors nuclear factor κB (NF-κB) and activator protein 1 (AP-1).
Keywords:
AP-1 – diplacone – encapsulation – glucan particles – NF-κB – inflammation
Autoři: Lucie Černá 1,2; Zuzana Ba O 1; Petra Šalamúnová 4; Karel Šmejkal 1,3; Jaroslav Hanuš 4; Jan Hošek 2
Působiště autorů: Farmaceutická fakulta, Masarykova univerzita, Brno 1; Přírodovědecká fakulta, Univerzita Palackého, Oddělení biologicky aktivních komplexů a molekulových magnetů, Regionální centrum pokročilých technologií a materiálů 2; Univerzita veterinárskeho lekárstva a farmácie, Katedra farmakognózie a botaniky, Košice, SR 3; Vysoká škola chemicko-technologická, Praha, Ústav chemického inženýrství, Fakulta chemicko-inženýrsk 4
Vyšlo v časopise: Čes. slov. Farm., 2020; 69, 130-136
Kategorie: Původní práce
Souhrn
Geranylovaný flavanon diplakon je látka izolovaná z Paulownia tomentosa (Thunb.) Steud. (Paulowniaceae) vykazující protizánětlivé a antioxidační vlastnosti a také vysokou lipofilitu a nízkou rozpustnost ve vodě. Jako modelová molekula byl proto použit k inkorporaci do glukanových částic (GP) s cílem zvýšit jeho potenciální biodostupnost. GP jsou v principu duté schránky připravené čištěním kvasinek Saccharomyces cerevisiae pro získání buněčné stěny, obsahující převážně β-(1→3)/β-(1→6) glukan. Cílem práce je porovnat antiflogistické působení kompozitů diplakonu a glukanového nosiče s působením samotné látky, samotných glukanových částic a fyzické směsi čistých glukanových částic s čistým diplakonem. Na buněčné linii odvozené z lidských leukemických monocytů THP1-XBlueTM-MD2-CD14 byla simulována zánětlivá reakce stimulací buněk lipopolysacharidem (LPS) z Escherichia coli. Kompozity GP a diplakonu signifikantně snížily aktivitu prozánětlivých transkripčních faktorů nukleárního faktoru κB (NF-κB) a aktivátorového proteinu 1 (AP-1) v porovnání s čistou látkou.
Klíčová slova:
AP-1 – diplakon – enkapsulace – glukanové částice – NF-κB – zánět
Úvod
Terapie zánětlivých onemocnění je stále aktuálním tématem. V současné době roste výskyt chronických zánětlivých onemocnění a léčba je často problematická. V případě běžných cenově dostupných protizánětlivých léčiv je pozorována celá řada nežádoucích účinků. U specifičtější biologické léčby je hlavním problémem vysoká cena, tyto látky se tak drží na předních příčkách nejdražších distribuovaných léčiv1, 2). Tento stav vede k myšlence finančně dostupné cílené terapie s co možná nejmenším výskytem nežádoucích účinků a nabízí se i hledání potenciálních léčiv v přírodních zdrojích. Mezi jedny z nejstudovanějších zástupců sekundárních metabolitů rostlin s protizánětlivými účinky patří flavonoidy. Jejich biodostupnost však může být nízká, a proto by jejich zacílení na imunitní systém mohlo vést k vyšší efektivitě léčby3).
Příkladem snadno dosažitelného a finančně nenáročného zdroje pro tvorbu cíleného nosiče látek mohou být β-glukany. Ty se vyskytují v mnoha přírodních zdrojích, nacházíme je i v patogenních mikroorganismech, například v Candida albicans. Z rostlinných zástupců je významným zdrojem Avena sativa L. (Poaceae) nebo Hordeum vulgare L. (Poaceae). Dále jsou nacházeny v houbách, jako například Grifola frondosa, Lentinus edodes, Pleurotus ostreatus, Sclerotinia sclerotiorum a Schizophillum commune, či v kvasinkách Saccharomyces cerevisiae4). V závislosti na zdroji β-glukanu se liší jeho struktura a s ní související účinky. V β-glukanech obilovin se nacházejí glykosidické vazby β-(1→3) a β-(1→4) s převažující rozpustnou složkou. U takto strukturovaných β-glukanů jsou popisovány spíše pozitivní účinky na metabolismus, zejména snížení hladiny cholesterolu5) a glukózy v krvi6). Na rozdíl od obilovin převažuje v houbách složka nerozpustná a β-glukan v nich obsažený se nazývá také heteroglukan, protože obsahuje vazby β-(1→3)/β-(1→4) i β-(1→3)/β-(1→6). V případě S. cerevisiae se jedná převážně o β-(1→3)/β-(1→6) glukan7). U β-glukanů s β-(1→3)/β-(1→6) glykosidickou vazbou byly prokázány imunomodulační a protizánětlivé účinky. Tyto β-glukany ovlivňují reakce vrozené imunity, například pomocí aktivace makrofágů. Tím spouští fagocytózu nežádoucích částic a patogenů a prostřednictvím lysozomálních enzymů pak dochází k jejich rozkladu. Stimulují také uvolnění zánětlivých cytokinů a dalších mediátorů, především oxidu dusnatého a peroxidu vodíku. Představují také jednu z klíčových molekul, které jsou rozpoznávány neutrofily při napadení organismu patogenem, a řadí se tak mezi molekulární struktury asociované s patogenem, tzv. PAMPs (patogen associated molecular patterns)4). Interakce β-glukanu s buněčným povrchem makrofágů, NK (natural killer) buněk a neutrofilů je závislá na struktuře a původu jednotlivých typů β-glukanu. Působení je rovněž závislé na rozpustnosti a velikosti molekuly použitého glukanu, což ovlivňuje aktivaci nebo inhibici signálních drah, kdy rozdílné formy β-glukanu mohou působit na dané receptory agonisticky nebo antagonisticky3, 8). Předpokládá se, že β-(1→3)/β-(1→6)-glukany ovlivňují imunitu prostřednictvím interakce s M-buňkami v Peyerových placích a následným efektem na produkci cytokinů. Dále je možné i vychytávání glukanových částic střevními makrofágy, které je následně transportují do kostní dřeně, sleziny a lymfatických uzlin. V kostní dřeni mohou být předloženy granulocytům9).
Jak již bylo výše zmíněno, glukanové částice jsou schopné interagovat s fagocytujícími buňkami imunitního systému, a z tohoto důvodu skrývají velký potenciál jako nosiče léčiv pro cílenou terapii zaměřenou právě na tyto buňky10). Pro vytvoření nosiče se často využívají β-glukanové částice ze S. cerevisiae. Tyto mikrosférické glukanové schránky mívají velikost 2–4 µm a jsou tvořené hlavně řetězci glukózových jednotek10). Buněčné stěny S. cerevisiae obsahují 85 % β-glukanů s převážně β-(1→3), ale i β-(1→6) glykosidickou vazbou. Hlavní stavební jednotky, lineární β-(1→3) řetězce, obsahují okolo 1500 glukózových jednotek, postranní rozvětvené β-(1→6) řetězce mívají v průměru 350 jednotek a slouží jako elastické pojivo stěny. Buněčná stěna S. cerevisiae dále obsahuje cca 15 % mannoproteinu, nacházejícího se na vnější straně buněčné stěny, a 1 % chitinu složeného z jednotek N-acetyl-glukosaminu, který přispívá k nerozpustnosti buněčné stěny ve vodě a nachází se na její vnitřní straně11,12). Za přispění mannoproteinu a kovalentních vazeb propojuje chitin jednotlivé složky do buněčné stěny kvasinek7). Při úpravě kvasinky za účelem tvorby glukanových částic (GP) dochází k odstranění většiny organel a neglukanových složek buněčné stěny. Vzniká tím dutá schránka připravená k dalšímu použití.
Cílenou terapií zánětu v souvislosti s využitím GP ze S. cerevisiae jako nosiče se zabývala řada studií, které však pro inkorporaci využívaly zejména makromolekulární látky typu siRNA13). Z nízkomolekulárních látek, inkorporovaných do GP ze S. cerevisiae, lze zmínit například kurkumin vyskytující se v kořenech Curcuma longa L. (Zingiberaceae), který má významné protizánětlivé a antioxidační účinky, avšak špatnou biodostupnost. Plavcová et al. porovnávali působení kurkuminu, GP, jejich fyzické směsi a kompozitu na modelu zánětu vytvořeného stimulací THP1-XBlueTM-MD2/CD14 buněk LPS z E. coli a prokázali, že po inkorporaci kurkuminu do GP došlo k výraznějšímu snížení aktivity transkripčních faktorů NF-κB/AP-1 v porovnání s působením samotného kurkuminu. Došlo také ke snížení sekrece prozánětlivých cytokinů – tumor nekrotizujícího faktoru (TNF-α) a interleukinu (IL) 1β. Po inkorporaci došlo také ke zvýšení antioxidačních vlastností materiálu14). Pro vytvoření kompozitu pro cílenou terapii na makrofágy použili Chen et al. tyloforin malát (NK007). Takto připravený kompozit snížil sekreci TNF-α na buněčné linii RAW 264.7, která byla inkubována s kompozity a následně stimulována LPS. Pro in vivo studii využili model akutní kolitidy indukované dextran sodium sulfátem sodným u BALB/c myší, kterým byly kompozity podávány orální sondou. U myší léčených inkorporovanou látkou NK007 došlo k menšímu úbytku hmotnosti, délka střeva byla delší v porovnání s kontrolní skupinou, také došlo k ovlivnění tvorby otoku a infiltrace zánětlivých buněk. Spojení modelové látky NK007 a glukanového nosiče se projevilo jako výhodné pro léčbu kolitidy se zaměřením na makrofágy15).
Cílem této práce bylo porovnání protizánětlivého in vitro potenciálu geranylovaného flavanonu diplakonu, samotných glukanových částic ze S. cerevisiae, jejich fyzické směsi a kompozitů tvořených diplakonem inkorporovaným do glukanových částic. Diplakon (obr. 1) je látka izolovaná z Paulownia tomentosa (Thunb.) Steud. (Paulowniaceae) a byl vybrán jako modelová látka na základě předešlých studií, ve kterých se projevil především jeho protizánětlivý potenciál a antioxidační působení in vitro i in vivo16–18). Samotný protizánětlivý efekt testovaných vzorků byl stanoven na základě inhibice aktivity transkripčních faktorů NF-κB a AP-1, které hrají důležitou úlohu během zánětlivé reakce19, 20).
Obr. 1. Strukturní vzorec diplakonu 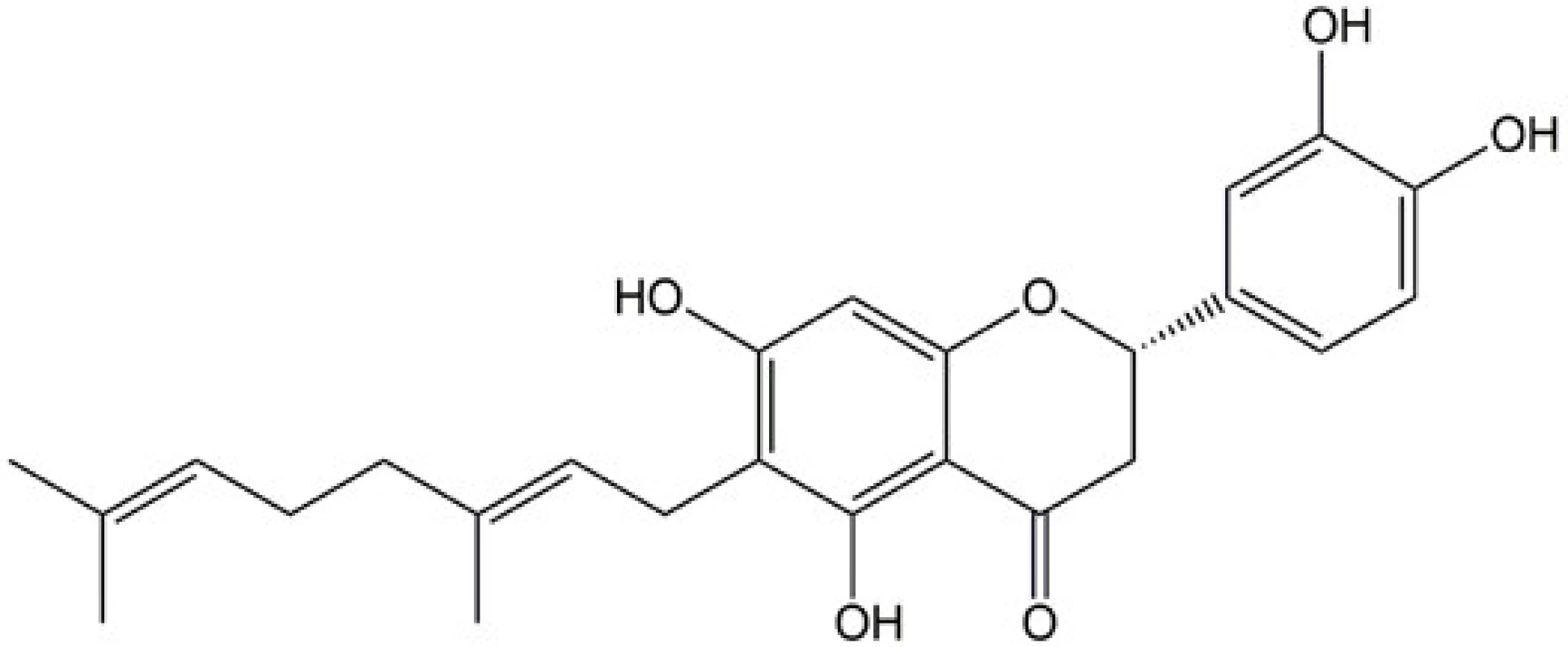
Pokusná část
Materiál
RPMI 1640 médium, fosfátový pufr (PBS) a penicilin 100 U/ml/streptomycin 100 mg/ml byly zakoupeny od firmy Biosera, Francie. Erythrosin B, referenční látka prednison a lipopolysacharid (LPS) izolovaný z E. coli O111:B4 byly pořízeny od Sigma-Aldrich, Německo. Fetální bovinní sérum (FBS) bylo pořízeno od firmy HyClone, USA. Detekční činidlo QUANTI-BlueTM bylo zakoupeno od Invivogen, USA.
Glukanové částice (GP) a kompozity byly připraveny úpravou pekařského droždí ze S. cerevisiae značky Pakmaya® na Vysoké škole chemicko-technologické v Praze, jak bylo popsáno dříve21).
Diplakon byl izolován na Ústavu přírodních léčiv (ÚPL) Farmaceutické fakulty Veterinární a farmaceutické univerzity v Brně z plodů P. tomentosa. Jeho čistota byla stanovena pomocí vysokoúčinné kapalinové chromatografie (HPLC) na minimálně 95 %22, 23).
In vitro kultivace buněčných kultur
Buněčná linie lidských leukemických monocytů THP1-XBlueTM MD2/CD14 (Invivogen, USA) byla kultivována v RPMI 1640 médiu s obsahem s obsahem penicilinu (100 U/ml)/streptomycinu (100 µg/ml) a 10% FBS (dále jen kompletní médium) v inkubátoru o konstantní teplotě 37 °C a stabilní hladině CO2 5 %. Průběžně byla sledována viabilita pomocí barvení buněčné suspenze erythrosinem B a počítání v Bürkerově komůrce pod světelným mikroskopem. Pro experimenty byla používána buněčná suspenze o viabilitě ≥ 95 %. Buňky byly pravidelně pasážovány a bylo jim přidáváno čerstvé kompletní médium.
Příprava vzorků
Glukanové částice a kompozity byly naváženy, naředěny v médiu bez séra (medium-free medium – SFM) na koncentraci 6,74 mg/mlL, zvortexovány a zhomogenizovány pomocí mixéru Ultra-Turrax T8 (IKA-Werke, Německo). Po dobu 5 min byly ponořeny do vodní ultrazvukové lázně a před finálním ředěním do SFM byly opět zvortexovány. GP byly testovány v koncentracích 670 µg/ml a 67 µg/ml. Kompozity GP a diplakonu byly připraveny ve třech variantách s různým váhovým poměrem diplakonu vůči čistým GP – 0,063 % w/w, 0,013 % w/w a 0,63 % w/w. Testované suspenze kompozitů v médiu pak odpovídaly složením 670 µg/ml GP a 1 µM diplakonu (0,063 % w/w), 670 µg/ml GP a 0,2 µM diplakonu (0,013 % w/w) a 67 µg/ml GP s 1 µM diplakonem (0,63 % w/w). Diplakon i prednison byly připraveny stejným způsobem, tj. ve formě suspenze v médiu, ale byly naředěny na koncentraci 1 µM, v případě diplakonu i 0,2 µM. Fyzické směsi byly připraveny ad hoc, kdy se suspenze GP a diplakonu přidaly k buňkám v množství, které odpovídalo testovaným kompozitům. Všechny používané koncentrace byly pro použitou buněčnou linii vyhodnoceny jako netoxické.
Morfologie vzorků
Připravené čisté glukanové částice i kompozity s diplakonem byly nejprve charakterizovány pomocí skenovací elektronové mikroskopie (SEM). Částice byly pokoveny 5nm vrstvou zlata v přístroji Emitech K550X (Quorum Technologies, Velká Británie) a snímány pomocí mikroskopu JCM-5700 (Jeol, Japonsko). Následně byly zkontrolovány pomocí optické mikroskopie v procházejícím světle i pomocí fluorescenční mikroskopie. Snímky byly pořízeny invertovaným mikroskopem Olympus IX81s objektivem UPLSAPO 40× (Olympus Corporation, Japonsko) a fluorescence byla excitována světlem v rozsahu 330–385 nm a snímána ve světle s vlnovou délkou nad 420 nm.
Vyhodnocení obsahu diplakonu v glukanových částicích
Enkapsulovaný diplakon byl z glukanových částic extrahovaný pomocí methanolu, jak bylo popsáno dříve14). Následně byla koncentrace vyextrahovaného diplakonu analyzována pomocí HPLC. Stručně: Agilent 1100 DAD (Agilent, Německo), kolona Ascentis Express RP-Amide (100 × 2,1 mm, 2,7 μm) (Supelco, USA), průtok 0,3 ml/min, gradient acetonitrilu a 0,2 % HCOOH, 0. minuta 10 % acetonitrilu, 36. minuta 100 % acetonitrilu. Teplota kolonového bloku 40 ℃, detekce λ 280 nm, nástřik 1 μl.
Modifikace aktivity transkripčních faktorů NF-κB a AP-1
Před každým experimentem byl daný objem buněčné suspenze s potřebným počtem buněk odstředěn, promyt PBS a přenesen do čerstvého RPMI 1640 média bez obsahu FBS (SFM). Ve všech případech bylo na jednu jamku v 96-jamkové mikrotitrační destičce použito 50 000 buněk. Buňky THP1-XBlueTM-MD2/CD14 byly poté inkubovány v inkubátoru o konstantní teplotě 37 °C a stabilní hladině oxidu uhličitého 5 % s testovaným materiálem po dobu 1 h. Následně k nim byl přidán LPS rozpuštěný v PBS, ředěný do SFM, ve finální koncentraci 1 µg/ml. Po 24 h inkubace byla mikrotitrační destička odstředěna a aktivita NF-κB/AP-1 byla vyhodnocena pomocí QUANTIBlueTM činidla dle doporučení výrobce.
Statistické vyhodnocení
Při experimentech byly látky testovány v triplikátech s přítomností pozitivní kontroly v podobě buněčné suspenze v SFM s obsahem 1 µg/ml LPS, negativní kontroly bez LPS a reference s přídavkem LPS a prednisonu. U každé hodnoty byl odečten vliv pozadí a výsledky byly přepočítány na procenta, kdy 100 % tvořila pozitivní kontrola. Data byla dále zpracována v programu GraphPad Prism 6 (GraphPad Software, USA). Odlehlé hodnoty byly odstraněny metodou ROUT s parametrem Q = 1 %. Pro zjištění signifikantních rozdílů byla provedena jednofaktorová analýza rozptylu (one-way ANOVA) s Bonferroniho korekcí mnohočetného srovnávání s 95% intervalem důvěryhodnosti. Z takto upravených dat byl vytvořen graf.
Výsledky
Hlavním cílem práce bylo posoudit vliv inkorporace diplakonu do GP porovnáním jeho působení s fyzickou směsí GP + diplakon a samotným diplakonem. Povrchová morfologie připravených glukanových částic byla skenována pomocí SEM (obr. 2). Velikost a tvar připravených glukanových částic odpovídal kvasinkovým obalům. Kompozity s diplakonem byly sledovány pomocí optické a fluorescenční mikroskopie, kde byla pozorována homogenní enkapsulace diplakonu v glukanových částicích (obr. 3). Obsah enkapsulovaného diplakonu v částicích byl stanoven pomocí HPLC a jeho hmotnostní zastoupení uspokojivě odpovídalo předem požadované koncentraci diplakonu v kompozitech (tab. 1).
Obr. 2. Připravené glukanové částice z pekařských kvasinek S. cerevisiae – skenovací elektronová mikroskopie. Tvar a velikost odpovídá kvasinkám a vrásčitá morfologie částic je způsobená odstraněním vnitřního obsahu buněk a následným usušením částic pomocí lyofilizace. 
Obr. 3. Připravené glukanové částice z pekařských kvasinek S. cerevisiae – optická mikroskopie
A – čisté glukanové částice v procházejícím světle, B – čisté glukanové částice ve fluorescenci, C – kompozity glukanových částic v procházejícím světle, D – kompozity glukanových částic ve fluorescenci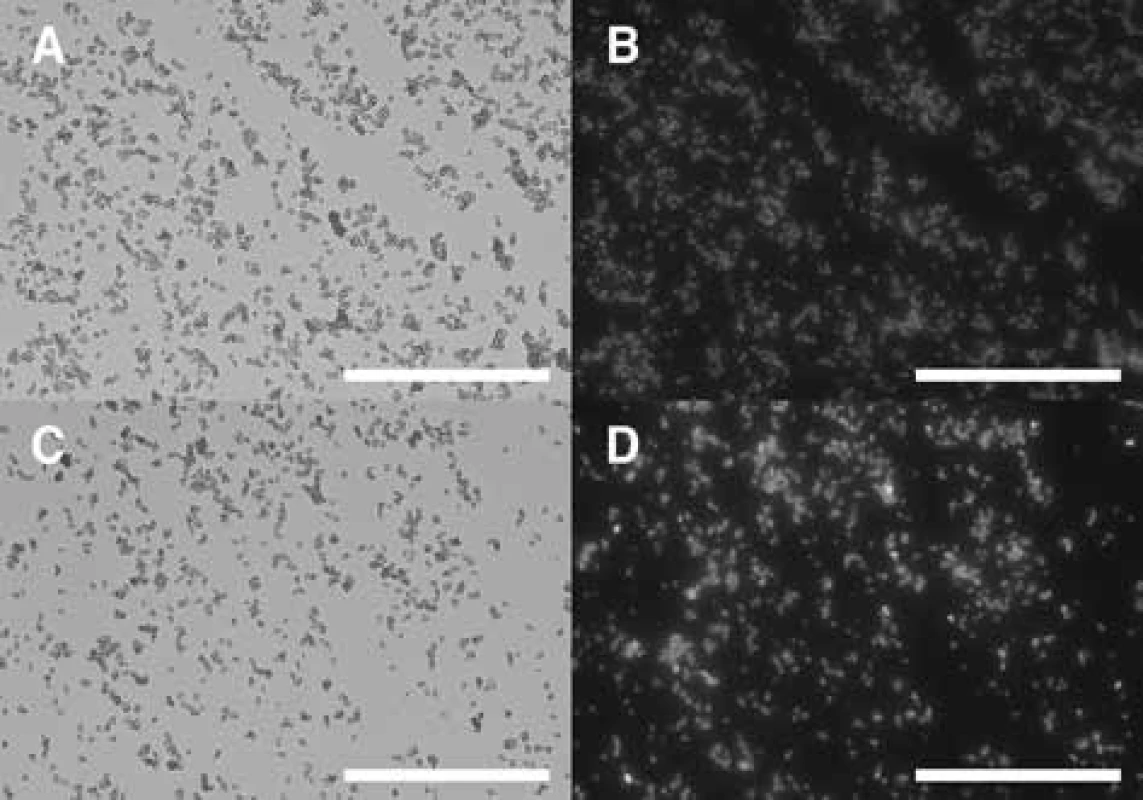
Tab. 1. Vyhodnocení obsahu diplakonu extrahovaného z připravených kompozitů
Obsah diplakonu byl měřen 3krát pro každý typ kompozitu; SD představuje směrodatnou odchylku. Kompozit 670/1 = kompozit ze 670 µg/ml GP a 1 µM diplakonu, kompozit 670/0,2 = kompozit ze 670 µg/ml GP a 0,2 µM diplakonu, kompozit 67/1 = kompozit ze 67 µg/ml a 1 µM diplakonu.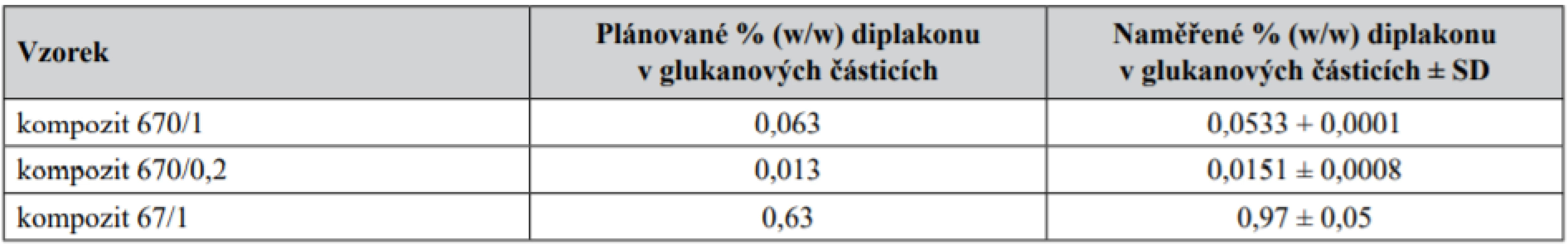
Při experimentu analyzujícím vliv na aktivitu transkripčních faktorů NF-κB/AP-1 byl efekt připravených kompozitů výrazně vyšší v porovnání s ostatními analyzovanými vzorky (obr. 4). Po inkorporaci došlo ke zlepšení potenciálních protizánětlivých vlastností testované látky.
Obr. 4. Srovnání NF-κB/AP-1 inhibiční aktivity kompozitů s fyzickou směsí a jejími složkami Hodnoty v grafu vyjadřují průměr ± SEM. LPS = lipopolysacharid; GP = glukanové částice, směs 670 + 1 = 670 µg/ml GP + 1 µM diplakon, směs 670 + 0,2 = 670 µg/ml GP + 0,2 µM diplakon, směs 67 + 1 = 67 µg/ml GP + 1 µM diplakon, kompozit 670/1 = kompozit ze 670 µg/ml GP a 1 µM diplakonu, kompozit 670/0,2 = kompozit ze 670 µg/ml GP a 0,2 µM diplakonu, kompozit 67/1 = kompozit ze 67 µg/ml a 1 µM diplakonu, POZITIVNÍ KONTROLA = samotné LPS 1 µg/ml, NEGATIVNÍ KONTROLA = bez LPS * vyjadřuje signifikantní rozdíl vztažený k POZITIVNÍ KONTROLE, # vyjadřuje signifikantní rozdíl mezi vyznačenými skupinami, #### p < 0,0001 *p < 0,1, **p < 0,01, ****p < 0,0001 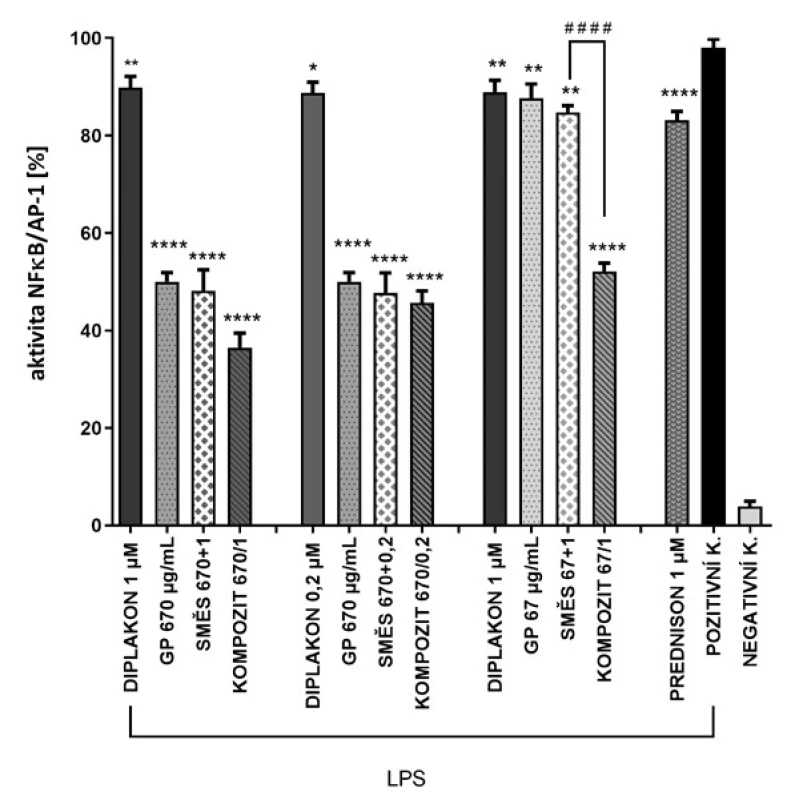
Ve všech sledovaných skupinách byla pozorována inhibice NF-κB/AP-1 aktivity se signifikantním rozdílem oproti pozitivní kontrole. Při porovnání signifikantních rozdílů mezi jednotlivými testovanými materiály (myšleno kompozit, směs, GP, diplakon) došlo ve všech případech k rozdílu mezi působením samotného diplakonu a jemu odpovídajícímu kompozitu. Na druhou stranu, rozdíl mezi působením kompozitu a fyzické směsi, připravené prostým smícháním glukanových částic se suspenzí diplakonu v daných koncentracích, nebyl ve většině případů statisticky signifikantní. Jedinou skupinou, ve které byl statisticky signifikantní rozdíl mezi působením připraveného kompozitu a všech dalších sledovaných skupin včetně fyzické směsi, je kompozit složený z koncentrace 67 µg/ml GP a 1 µM diplakonu. Při srovnání kompozitu s vyšší koncentrací GP (670 µg/ml) a stejnou koncentrací diplakonu (1 µM) můžeme pozorovat sice výraznější snížení aktivity NF-κB/AP-1, ale pro posílení efektu stejné koncentrace diplakonu posloužila i nižší koncentrace glukanových částic. Zde je vidět, že výsledek byl závislý na koncentraci GP. Porovnání působení pouze kompozitů ukázalo jejich efekt úměrný jejich koncentraci, tedy kompozity s nejvyšší koncentrací (670 µg/ml/1 μM) nejvíce snížily aktivitu transkripčních faktorů NF-κB/AP-1 a kompozity s nižší koncentrací GP měly efekt nejnižší. Vliv na účinek měla i použitá koncentrace diplakonu inkorporovaného do glukanového nosiče, což vyplývá z porovnání působení kompozitů s koncentrací 670 µg/ml GP a diplakonem inkorporovaným ve vyšší a nižší koncentraci. Procentuální rozdíl mezi těmito dvěma kompozity se pohybuje kolem 10 %. Vliv koncentrace GP byl patrný i při porovnání fyzických směsí. Směs s obsahem 670 µg/ml GP a 1 µM diplakonu vykázala téměř dvojnásobný efekt ve srovnání se směsí, ve které byly GP pouze v koncentraci 67 µg/ml. Aktivita směsí byla podobná jako aktivita čistých GP, přítomnost diplakonu výslednou aktivitu zvyšovala pouze nevýznamně.
Diskuse
β-glukany jsou sledovány pro své imunomodulační působení4) a schopnost ovlivnit buňky imunitního systému v souvislosti se zánětem24), léčbou ran25) nebo prevencí infekcí26). Jsou ve středu zájmu pro jejich použití jako nosiče pro bioaktivní látky cílené na makrofágy – buňky imunitního systému. β-glukany byly již dříve použity a testovány jako nosiče nanočástic12), vysokomolekulárních látek (RNA, DNA, proteinů)13, 27) i nízkomolekulárních látek, jako je například rifampicin28) nebo vybrané přírodní sloučeniny14, 29). Jejich využití jako nosičů v kombinaci s jejich vlastními účinky vedlo k myšlence vytvořit kompozity glukanových částic s přírodními látkami s protizánětlivým účinkem. Takto vzniklé komplexy by měly nejen zlepšit biodostupnost inkorporované biologicky aktivní látky, ale vzhledem k vlastním účinkům β-glukanů i zesílit protizánětlivý efekt. K těmto účelům jsou využívány hlavně β-glukany s β-(1→3)/(1→6) glykosidickou vazbou, u kterých byla na rozdíl od glukanů s β-(1→3)/(1→4) vazbou prokázána schopnost aktivovat buňky imunitního systému30). Jedním z nejvíce využívaných zdrojů při tvorbě glukanových nosičů cílících na buňky imunitního systému je β-glukan ze S. cerevisiae.
Ten byl použit i v této práci pro přípravu kompozitů s diplakonem. Byl sledován vliv inkorporace diplakonu do glukanového nosiče na aktivitu transkripčních faktorů NF-κB/AP-1. Při aplikaci diplakonu inkorporovaného do GP došlo k výraznému poklesu aktivity transkripčních faktorů NF-κB/AP-1 při stimulaci LPS. Tento jev by mohl být spojen s lepším průnikem diplakonu do buňky vzhledem k interakci GP s povrchem makrofágů. Z testovaných kompozitů vykazoval kompozit 67/1 nejlepší vlastnosti, kdy inkorporace diplakonu vedla k signifikantně vyšší aktivitě než při použití prosté směsi nebo působení jednotlivých složek. Podobných výsledků dosáhli také Plavcová et al. ve své práci s kompozity kurkuminu14). Z jejich práce vyplývá podobný efekt koncentrace kurkuminu a GP na potlačení modelového zánětu vytvořeného na buněčné linii THP1-XBlueTM-MD2/CD14 aktivované pomocí LPS. I v tomto případě byl pozorován signifikantní rozdíl mezi působením fyzické směsi 1 µM kurkuminu a 67 µg/ml GP a jeho kompozitu. Na rozdíl od kompozitů diplakonu byly kurkuminové kompozity připraveny ve více koncentracích a jako nejlepší byl vyhodnocen kompozit odpovídající 670 µg/ml GP a 10 µM kurkuminu, který nejvíce snížil aktivitu NF-κB/AP-114).
Pozorováno bylo také snížení aktivity transkripčních faktorů NF-κB/AP-1 způsobené samotnými GP, a to i v případě nižší použité koncentrace. Ve vyšších koncentracích byl tento efekt předpokládán, avšak koncentrace 67 µg/ml je až několikanásobně nižší, než je popisováno v jiných studiích. Například Sun et al. sledovali snížení produkce prozánětlivých mediátorů na myších makrofázích RAW 264.7, které aktivovali pomocí LPS. Na rozdíl od naší práce sledovali přímo pokles hladiny zánětlivých mediátorů (IL-6, IL-1β, NO), jejichž tvorba je mimo jiné ovlivněna aktivací transkripčních faktorů NF-κB a AP-1. Zkoušeli různé frakce β-glukanu ze S. cerevisiae, z jejich výsledků je viditelný pokles hladiny prozánětlivých mediátorů u buněk, které byly inkubovány s β-glukany o koncentraci 200 µg/ml. Své výsledky následně ověřili i v in vivo studii na modelu kolitidy C57BL/6 myší vyvolané dextran sulfátem sodným (DSS)24). Použili zde koncentraci více než 3krát nižší, než je nejvyšší koncentrace použitá v této práci. Xu et al. došli k podobným výsledkům. Použili buňky RAW 264.7 stimulované bakteriálním LPS a při aplikaci β-glukanů (S. cerevisiae) zaznamenali až 70% snížení produkce NO vyvolané LPS při koncentraci β-glukanů 120–200 µg/ml. Zjistili, že ke snížení hladiny NO došlo u buněk, které byly kultivovány s β-glukanem před přidáním LPS, stejně jako v našem případě. Snížení hladiny NO se ale ukázalo i u buněk, kde byl LPS a β-glukan přidán zároveň nebo i u těch, k nimž byl β-glukan přidán až po LPS. Jejich výsledky však na rozdíl od naší práce nepopisují ovlivnění NF-κB/AP-131).
Z výše uvedených studií vyplývá, že pro další analýzu působení GP by byly vhodné detailní experimenty zaměřené na expresi prozánětlivých a protizánětlivých mediátorů. Použití LPS ke stimulaci buněk in vitro při sledování protizánětlivého potenciálu GP je vzhledem k jejich interakci se stejnými nebo podobnými receptory vhodné a působení GP je závislé na jejich koncentraci.
U diplakonu jako takového byl také již dříve prokázán protizánětlivý potenciál in vitro16, 23) i in vivo ve studii na modelu kolitidy potkana vyvolané DSS18). Rozsuspendování diplakonu v SFM a aplikaci ve formě suspenze může mít vliv na finální působení v porovnání s testy, ve kterých byl rozpuštěn v dimethylsulfoxidu a použit ve formě roztoku16, 23). Nicméně, použití a testování vodných roztoků je z hlediska případného dalšího uplatnění v in vivo či klinických studií vhodnější než použití jakýchkoliv organických rozpouštědel. Spojení GP a diplakonu zvýšilo protizánětlivý potenciál. Pro dosažení významných výsledků byla dostačující nižší koncentrace GP. Při koncentraci GP 67 µg/ml s obsahem 0,63 % (w/w) diplakonu se vytvořil vhodný materiál s výrazným efektem snižujícím aktivitu NF-κB/AP-1. To by mohlo vést k menší spotřebě materiálu pro přípravu účinných kompozitů. Vzhledem k dobrému vstřebávání GP by kompozity mohly zlepšit biodostupnost diplakonu i jiných nízkomolekulárních látek9), a glukanové částice by tak mohly sloužit jako vhodný nosič pro další přírodní látky s významným protizánětlivým potenciálem. Aplikace by tak v konečném důsledku mohla vést ke změně farmakodynamických a farmakokinetických vlastností daných molekul a mít vliv na jejich terapeutické uplatnění.
Závěr
Při srovnání testování jednotlivých složek, čili samotného diplakonu, GP, fyzické směsi vzniklé in situ a připraveného kompozitu, kompozit vždy vykázal posílení protizánětlivého potenciálu diplakonu. Nejvyšší pokles aktivity transkripčních faktorů NF-κB/AP-1 byl popsán u kompozitu s nejvyšší koncentrací, složeného z 670 µg/ml GP a 1 µM diplakonu. Statisticky průkazný rozdíl od všech ostatních skupin vykázal pouze kompozit z 67 µg/ml GP a 1 µM diplakonu.
Z výše uvedených výsledků vyplývá, že inkorporace diplakonu do glukanového nosiče byla úspěšná a takto vzniklý kompozit výrazně zvýšil potenciální protizánětlivý efekt diplakonu. Glukanové částice jsou tak vhodným biologicky aktivním nosičem i pro nízkomolekulární látky s protizánětlivým působením a představují slibný směr cílené imunomodulační terapie.
Střet zájmů: žádný.
Rukopis vznikl na základě diplomové práce PharmDr.Lucie Černé s názvem „Biologický potenciál kompozitů glukanových částic a diplakonu“, kterou obhájila v roce 2019 na Farmaceutické fakultě VFU Brno.
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. 16-27522A. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
L. Černá1,2 • Z. Baďo1 • K. Šmejkal1,3 • doc. RNDr. Jan Hošek, Ph.D.2 (∗)
1Farmaceutická fakulta, Masarykova univerzita, Brno
2 Přírodovědecká fakulta, Univerzita Palackého
Oddělení biologicky aktivních komplexů a molekulových magnetů
Regionální centrum pokročilých technologií a materiálů
Šlechtitelů 27, 783 71 Olomouc
e-mail: jan.hosek@upol.cz
3Univerzita veterinárskeho lekárstva a farmácie, Katedra farmakognózie a botaniky, Košice, SR
P. Šalamúnová • J. Hanuš
Vysoká škola chemicko-technologická, Praha
Ústav chemického inženýrství, Fakulta chemicko-inženýrská
Zdroje
1. Hodnocení vývoje dodávek léčivých přípravků podle ATC skupin. Státní ústav pro kontrolu léčiv. http://www.sukl.cz/dodavky-leciv-v-ceske-republice-v-1-ctvrtleti-roku-2019 (14. 10. 2019).
2. Hodnocení vývoje dodávek léčivých přípravků podle ATC skupin. Státní ústav pro kontrolu léčiv. http://www.sukl.cz/informace-o-distribuci-leciv-lekarnam-jinym-zdravotnickym-22 (17. 10. 2019).
3. Sak K., Everaus H. Nanotechnological approach to improve the bioavailability of dietary flavonoids with chemopreventive and anticancer properties. Nutraceuticals 2016; 4, 427–479.
4. Akramienė D., Kondrotas A., Didžiapetrienė J. Effects of β-glucans on the immune system. Medicina (Kaunas) 2007; 43(8), 597–606.
5. Wang S., Zhou H., Feng T., Wu R., Sun X., Guan N., Qu L., Gao Z., Yan J., Xu N., Zhao J., Qi C. β-Glucan attenuates inflammatory responses in oxidized LDL-induced THP-1 cells via the p38 MAPK pathway. Nutr. Metab. Cardiovasc. Dis. 2014; 24(3), 248–255.
6. Shen R. L., Cai F. L., Dong J. L., Hu X. Z. Hypoglycemic effects and biochemical mechanisms of oat products on streptozotocin-induced diabetic mice. J. Agric. Food Chem. 2011; 59(16), 8895–8900.
7. Aimanianda V., Clavaud C., Simenel C., Fontaine T., Delepier-re T., Latgé J. P. Cell wall β-(1,6)-glucan of Saccharomyces cerevisiae. Structural characterization and in situ synthesis. J. Biol. Chem. 2009; 284(20), 13401–13412.
8. Ishimoto Y., Ishibashi K., Yamanaka D., Adachi Y., Kanzaki K., Okita K., Iwakura Y., Ohno N. Modulation of an innate immune response by soluble yeast β-glucan prepared by a heat degradation method. Int. J. Biol. Macromol. 2017; 104, 367–376.
9. Volman J. J., Ramakers J. D., Plat J. Dietary modulation of immune function by β-glucans. Physiol. Behav. 2008; 94(2), 276–284.
10. Soto E. R., Caras A. C., Kut L. C., Castle M. K., Ostroff G. R. Glucan particles for macrophage targeted delivery of nanoparticles. J. Drug Deliv. 2012; 2012, 1–13.
11. Lesage, G., Bussey, H. Cell wall assembly in Saccharomyces cerevisiae. Microbiol. Mol. Biol. Rev. 2006; 70(2), 317–343.
12. Waszkiewicz-Robak, B. Spent Brewer’s Yeast and beta-glucans isolated from them as diet components modifying blood lipid metabolism disturbed by an atherogenic diet. Lipid Metabolism 2013; Rodrigo Valenzuela Baez, IntechOpen, https://www.intechopen.com/books/lipid-metabolism/spent-brewer-s-yeast-and-beta-glucans-isolated-from-them-as-diet-components-modifying-blood-lipid-me (5. 6. 2020).
13. Aouadi M., Wang M., Chouinard M., Soto E., Ostroff G. R., Czech M. P., Nicoloro S. M., Tesz G. J. Orally delivered siRNA targeting macrophage Map4k4 suppresses systemic inflammation. Nature 2009; 458(7242), 1180–1184.
14. Plavcová Z., Šalamúnová P., Saloň P., Štěpánek F., Hanuš J., Hošek J. Curcumin encapsulation in yeast glucan particles promotes its anti-inflammatory potential in vitro. Int. J. Pharm. 2019; 568, 118532.
15. Chen S., Wang J., Cheng H., Guo W., Yu M., Zhao Q., Wu Z., Zhao L., Yin Z., Hong Z. Targeted delivery of NK007 to macrophages to treat colitis. J. Pharm. Sci. 2015; 104(7), 2276–2284.
16. Hošek J., Závalová V., Šmejkal K., Bartoš M. Effect of Diplacone on LPS-Induced Inflammatory Gene Expression in Macrophages. Folia Biologica 2010; 56, 124–130.
17. Zima A., Hošek J., Treml J., Muselík J., Suchý P., Pražanová G., Lopes A., Žemlička M. Antiradical and cytoprotective activities of several c-geranyl-substituted flavanones from Paulownia tomentosa Fruit. Molecules 2010; 15(9), 6035–6049.
18. Vochyánová Z., Bartošová L., Bujdáková V., Fictum P., Husník R., Suchý P., Šmejkal K., Hošek J. Diplacone and mimulone ameliorate dextran sulfate sodium-induced colitis in rats. Fitoterapia 2015; 101, 201–207.
19. Tak P. P., Firestein G. S. NF-κB: a key role in inflammatory diseases. J. Clin. Investig. 2001; 107(1), 7–11.
20. Fujioka S., Niu J., Schmidt Ch., Sclabas G. M., Peng B., Uwagawa T., Li Z., Evans D. B., Abbruzzese J. L., Chiao P. J. NF-κB and AP-1 connection: mechanism of NF-κB-dependent regulation of AP-1 activity. Mol. Cell. Biol. 2004; 24(17), 7806–7819.
21. Saloň I. Hanuš J., Ulbrich P., Štěpánek F. Suspension stability and diffusion properties of yeast glucan microparticles. Food Bioprod. Process. 2016; 99, 128–135.
22. Šmejkal K., Grycová L., Marek R., Lemiere F., Jankovská D., Forejtníková H., Vančo J., Suchý V. C-Geranyl compounds from Paulownia tomentosa fruits. J. Nat. Prod. 2007; 70(8), 1244–1248.
23. Hošek J., Toniolo A., Neuwirth O., Bolego Ch. Prenylated and geranylated flavonoids increase production of reactive oxygen species in mouse macrophages but inhibit the inflammatory response. J. Nat. Prod. 2013; 76(9), 1586−1591.
24. Sun Y., Shi X., Zheng X., Nie S., Xu X. Inhibition of dextran sodium sulfate-induced colitis in mice by baker’s yeast polysaccharides. Carbohydr. Polym. 2019; 207, 371–338.
25. Fusté N. P., Guasch M., Guillen P., Anerillas C., Cemeli T., Pedraza N., Ferrezuelo F., Encinas M., Moralejo M., Garí E. Barley β-glucan accelerates wound healing by favoring migration versus proliferation of human dermal fibroblasts. Carbohydr. Polym. 2019; 210, 389–398.
26. Medina-Gali R. M., Ortega-Villaizan M., Mercado L., Novoa B., Coll J., Perez L. Beta-glucan enhances the response to SVCV infection in zebrafish. Dev. Comp. Immunol. 2018; 84, 307–314.
27. Soto E. R., Ostroff G. Characterization of multilayered nanoparticles encapsulated in yeast cell wall particles for DNA Delivery. Bioconjugate Chem. 2008; 19(4), 840–848.
28. Soto E., Kim Y. S., Lee J., Kornfeld H., Ostroff G. Glucan particle encapsulated rifampicin for targeted delivery to macrophages. Polymers 2010; 2(4), 681–689.
29. Esfanjania A. F., Jafari S. M. Biopolymer nano-particles and natural nano-carriers for nano-encapsulation of phenolic compounds. Colloids Surf. B 2016; 146, 532–543.
30. Jayachandran M., Chen J., Chung S. S. M., Xu B. A critical review on the impacts of β-glucans on gut microbiota and human health. J. Nutr. Biochem. 2018; 61, 101–110.
31. Xu X., Yasuda M., Mizuno M., Ashida H. β-Glucan from Saccharomyces cerevisiae reduces lipopolysaccharide-induced inflammatory responses in RAW264.7 macrophages. Biochim. Biophys. Acta 2012; 1820(10), 1656–1663.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2020 Číslo 3- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Přerušovaný půst může mít významná zdravotní rizika
-
Všechny články tohoto čísla
- Ingavirín môže byť sľubnou zlúčeninou v boji proti koronavírusu 2 vyvolávajúcemu ťažký akútny respiračný syndróm (SARS-CoV-2)
- Léčivé přípravky s řízeným uvolňováním léčiva pro terapii nespecifických střevních zánětlivých onemocnění z pohledu farmaceutické technologie
- Komplexy kovov v medicíne a farmácii – minulosť a súčasnosť III
- Protizánětlivý potenciál kompozitů kvasinkových glukanových částic a geranylovaného flavonoidu diplakonu
- Studium hypoglykemické a hypolipidemické aktivity extraktů z Camelina sativa (L.) Crantz u potkanů s dietou s vysokým obsahem fruktózy
- Farmakodynamická studie nového gelu obsahujícího extrakt z Aloe vera a extrakt z dubové kůry pro potenciální léčbu onemocnění parodontu
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Léčivé přípravky s řízeným uvolňováním léčiva pro terapii nespecifických střevních zánětlivých onemocnění z pohledu farmaceutické technologie
- Ingavirín môže byť sľubnou zlúčeninou v boji proti koronavírusu 2 vyvolávajúcemu ťažký akútny respiračný syndróm (SARS-CoV-2)
- Komplexy kovov v medicíne a farmácii – minulosť a súčasnosť III
- Farmakodynamická studie nového gelu obsahujícího extrakt z Aloe vera a extrakt z dubové kůry pro potenciální léčbu onemocnění parodontu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



