-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Komplexy kovov v medicíne a farmácii – minulosť a súčasnosť II*
Metal complexes in medicine and pharmacy – the past and the present II
Therapy of malignant tumors is among the oldest and at the same time the most promising application areas of therapeutic metal complexes. The second part of our survey on metallopharmaceuticals deals with historical development and current state of coordination compounds in cancer therapy. It starts with the most famous and most successful metallodrug – cisplatin. After a brief account of the discovery of the anticancer properties of this substance follows the discussion of its chemical properties, toxicity, clinical application and resistance. Hereafter, complexes of other metals along with innovative research directions are addressed. The aim of this brief survey is to provide basic overview of the area of metallopharmacy, aimed at specialists in pharmacy and chemistry as well as at the general educated public.
Keywords:
bioinorganic chemistry – metallopharmaceuticals – metal complexes – Chemotherapy – platinum – ruthenium
Autoři: Ladislav Habala; Jindra Valentová
Vyšlo v časopise: Čes. slov. Farm., 2020; 69, 3-16
Kategorie: Přehledy a odborná sdělení
Souhrn
Terapia zhubných nádorových ochorení patrí medzi najstaršie a zároveň najperspektívnejšie oblasti aplikácie zlúčenín kovov v terapii. Druhá časť prehľadu o metalofarmakách sa zameriava na dejinný vývoj a súčasné využitie komplexných zlúčenín v terapii rakoviny. Najprv sa venuje najznámejšiemu a najúspešnejšiemu liečivu spomedzi metalofarmák – cisplatine. Po stručnom náčrte objavu antineoplastických vlastností tejto zlúčeniny sa zaoberá jej chemickými vlastnosťami, toxicitou, klinickými aplikáciami, mechanizmom účinku a vývojom rezistencie. V ďalšom sú diskutované tiež komplexy iných kovov ako potenciálne chemoterapeutiká, ako aj perspektívne smery výskumu v tejto oblasti. Tento stručný prehľad má za cieľ poskytnúť základnú orientáciu v tejto problematike pre farmaceutov i chemikov, ako aj ostatných záujemcov o danú oblasť z radov odbornej verejnosti.
Klíčová slova:
bioanorganická chémia – metalofarmaká – komplexy kovov – platina – ruténium – chemoterapia
Úvod
Zlúčeniny kovov predstavujú perspektívnu oblasť vývoja nových liečiv. Okrem aplikácií v antimikróbnej terapii a v diagnostike, diskutovaných v prvej časti tohto prehľadu1), patrí k najrýchlejšie sa rozvíjajúcim smerom výskumu metalofarmák terapia rakoviny. V tejto druhej časti prehľadu sa zaoberáme objavom a vlastnosťami cisplatiny, ako aj ďalším vývojom chemoterapeutík na báze komplexov platiny. Následne je venovaná pozornosť antineoplastickým metalofarmakám obsahujúcim iné kovy než platinu. Na záver sú stručne načrtnuté aktuálne smery ďalšieho výskumu v oblasti metalofarmák. Vzhľadom k rozsahu i zameraniu prehľadu je pri citovaní prameňov daná prednosť prehľadnej literatúre. Dúfame, že popri špecialistoch v danej oblasti bude publikácia prínosom aj pre pokročilejších študentov a diplomantov so zameraním na farmáciu a chémiu.
<hr>
*Habala L., Valentová J. Komplexy kovov v medicíne a farmácii – minulosť a súčasnosť I. Čes. slov. Farm. 2018; 67, 182–191.
<hr>
Rakovina je ochorenie, ktoré sprevádza ľudstvo od jeho počiatkov. Jedná sa v skutočnosti o celú skupinu ochorení, ktoré zdieľajú určité spoločné charakteristiky. V súčasnosti predstavuje jedno z najčastejších ochorení, pričom je evidentný trvalý nárast jej výskytu.
Je neľahké uviesť presný dátum vzniku modernej chemoterapie, keďže pokusy o liečbu tohto ochorenia sa nesú celými dejinami, či už sa jednalo o látky rastlinného, živočíšneho, alebo minerálneho pôvodu2–5). K najstarším dochovaným dokumentom opisujúcim rakovinu a spôsoby jej liečby patria staroveké egyptské papyrusy, najmä tzv. Papyrus Edwina Smitha a Ebersov papyrus. Tieto záznamy obsahujú prvé zmienky týkajúce sa mamakarcinómu a karcinómu utera (nádorov prsníka a maternice).
V raných teóriách podstaty a príčin rakoviny ešte absentuje rigorózny vedecký prístup a sú poplatné predstavám, prevládajúcim v dobe ich vzniku, spájajúcim empirické pozorovanie so špekulatívnymi, magickými či religióznymi predstavami. Napríklad „otec medicíny“, antický grécky lekár Hippokratés, pripisoval vznik nádorov nadbytku „čiernej žlči“ (μελαγχολία), jednej zo štyroch „telesných tekutín“ antickej fyziológie spájanej tiež (ako napovedá grécky názov) s výskytom stavov melanchólie a depresie. Tieto predstavy si udržali vplyv v európskej medicíne po dlhé storočia, prakticky až do konca stredoveku.
Napriek tomu dochádza postupne praktickým pozorovaním k identifikácii látok s reálnym antineoplastickým účinkom. Tak napr. popisuje antický lekár Dioskorides použitie extraktu z jesienky obyčajnej (Colchicum autumnalis), rastliny obsahujúcej kolchicín, účinný inhibítor tvorby mikrotubúl. Malígnymi ochoreniami sa v svojich spisoch zaoberá aj perzský lekár Avicenna (päťzväzkový Kánon medicíny).
Počínajúc renesanciou dochádza k intenzívnemu rozvoju medicíny, vrátane terapie rakoviny. Hoci po dlhú dobu v liečbe prevažovali chirurgické zákroky, začínajú sa častejšie objavovať aj pokusy o aplikáciu chemických látok. Okrem liečiv rastlinného pôvodu sa jedná o anorganické látky, napr. zlúčeniny arzénu či ortute, používané aj v terapii infekčných ochorení1).
Napriek mnohým skorším pokusom dochádza k etablovaniu protinádorovej terapie ako medicínskej a farmaceutickej disciplíny až koncom 19. storočia v súvislosti s prácami vedcov Rudolfa Virchowa a Paula Ehrlicha. Skutočným prelomom v modernej chemoterapii sa stal objav antineoplastickej aktivity zlúčenín typu sírnych a dusíkových yperitov, z chemického hľadiska tioéterov, resp. terciárnych amínov obsahujúcich halogénalkylové reťazce s výrazným alkylačným účinkom. Ako prvé boli skúmané sírne analógy, pôvodne známe z bojísk 1. svetovej vojny ako bojové plyny. Prvé klinické skúšky látok tohoto typu sa uskutočnili v USA v roku 1943. Neskôr ich miesto zaujímajú dusíkové yperity s relatívne nižšou toxicitou (cyklofosfamid, chlorambucil a iné)6). Po skončení 2. svetovej vojny dochádza k búrlivému rozvoju chemoterapie a postupnému uvedeniu do klinickej praxe antifolátov (metotrexát), cytostatických antibiotík (aktinomycín D), tiopurínov (6-merkaptopurín a 6-tioguanín), 5-fluóruracilu, kortikosteroidov a ďalších. V nasledujúcich desaťročiach k nim pribudli napr. vinka-alkaloidy (vinkristín a vinblastín), taxol, imatinib mezylát a doxorubicín. K značnému zvýšeniu účinnosti liečby prispelo tiež zavedenie kombinačnej terapie viacerými chemoterapeutikami7). V 60. rokoch bola do liečby rakoviny zavedená cisplatina, prvé a zatiaľ zrejme najúspešnejšie skutočne účinné chemoterapeutikum na báze komplexov kovov (metalofarmák), bližšie popísané v nasledujúcej sekcii.
V súčasnosti výskum neoplastík zahrňuje viaceré oblasti: prípravu nových látok s vyššou účinnosťou voči rakovinovým bunkám, hľadanie analógov s nižšou systémovou toxicitou, výskum možností prekonania rezistencie u rakovinových buniek a selektívneho pôsobenia liečiv výhradne na rakovinové bunky (targeting), ako aj zdokonaľovanie terapeutických postupov s použitím existujúcich liečiv, najmä v rámci kombinačnej terapie.
Antineoplastiká (liečivá v terapii rakoviny) je možné rozdeliť podľa viacerých kritérií, či už podľa pôvodu, štruktúrnej príbuznosti, alebo mechanizmu účinku8). Jednou z možných je napr. nasledujúca klasifikácia:
- alkylanciá – ich mechanizmus účinku je založený na tvorbe kovalentných väzieb s molekulami DNA, čo vedie k blokovaniu replikácie DNA a aktivácii mechanizmov apoptózy. Príkladmi sú dusíkaté yperity (napr. cyklofosfamid) alebo deriváty nitrózomočoviny.
- antimetabolity – štruktúrne analógy prírodných metabolitov, ktoré vstupujú namiesto nich do biochemických dráh v bunke (najmä syntézy DNA) a narušujú ich funkciu. Patria medzi ne analógy pyrimidínu (napr. 5-fluóruracyl), purínu (6-merkaptopurín), alebo kyseliny listovej (napr. methotrexát).
- cytotoxické antibiotiká – zvyčajne interferujú so syntézou DNA či RNA, často prostredníctvom interakcie s topoizomerázou II, enzýmom aktívnym pri replikácii a transkripcii DNA. Ďalšie mechanizmy účinku zahrňujú interkaláciu (vsunutie molekuly medzi dve rovnobežné nukleobázy) a produkciu aktívnych foriem kyslíka (voľných radikálov), poškodzujúcich biomolekuly v bunke. K najznámejším liečivám tejto kategórie sa radia doxorubicín, aktinomycín a bleomycín.
- deriváty prírodných zlúčenín – patria k nim napr. látky rastlinného pôvodu, ako sú vinka-alkaloidy (vinkristín, vinblastín), taxánové alkaloidy a ich syntetické deriváty (paklitaxel, doketaxel), syntetické deriváty prírodného alkaloidu kamptotecínu (topotekan, irinotekan). Uvedené látky interagujú s mikrotubulami (vinka-alkaloidy, taxány), prípadne s topoizomerázou I (kamptotecíny).
- antineoplastiká na báze komplexov kovov – v klinickej praxi sa v súčasnosti jedná predovšetkým o komplexy platiny, účinkujúce prevažne prostredníctvom interferencie s bunkovou syntézou DNA. Komplexy platiny sa svojim mechanizmom účinku spravidla radia medzi alkylanciá, avšak komplexné zlúčeniny iných kovov (ruténium, gálium, titán a iné), nachádzajúce sa v rôznych štádiách výskumu, môžu mať mechanizmus účinku zásadne odlišný od mechanizmu účinku zlúčenín platiny.
- liečivá pre cielenú terapiu – syntetické bioaktívne látky interagujúce so špecifickými cieľovými molekulami resp. biochemickými dráhami zapojenými v kancerogenéze a raste tumorov. Ako príklady môžeme menovať imatinib a bortezomib.
Komplexy platiny v chemoterapii
Cisplatina
Napriek viacerým skorším pokusom k skutočnému prelomu v oblasti aplikácie kovov v terapii rakoviny dochádza až v 60. rokoch 20. storočia v dôsledku objavu antineoplastického účinku cisplatiny (cis-diammin-dichloridoplatnatého komplexu). Jedná sa zrejme o doteraz najúspešnejšie liečivo spomedzi metalofarmák a zároveň o jedno z najvýznamnejších chemoterapeutík, tvoriace „zlatý štandard“ v liečbe určitých typov rakoviny9, 10). Táto zlúčenina platiny je známa už od polovice 19. storočia (Michele Peyron, 1844)11) a neskôr zohrala významnú úlohu vo vývoji štruktúrnej teórie koordinačných zlúčenín v prácach Alfreda Wernera12), ktorý jej správne priradil štvorcovo-planárnu štruktúru a rozlíšil jej dva izoméry – cisplatinu a transplatinu (obr. 1).
Obr. 1. Štruktúra oboch stereoizomérov diammindichloridoplatnatého komplexu – cisplatiny (vľavo) a transplatiny (vpravo) 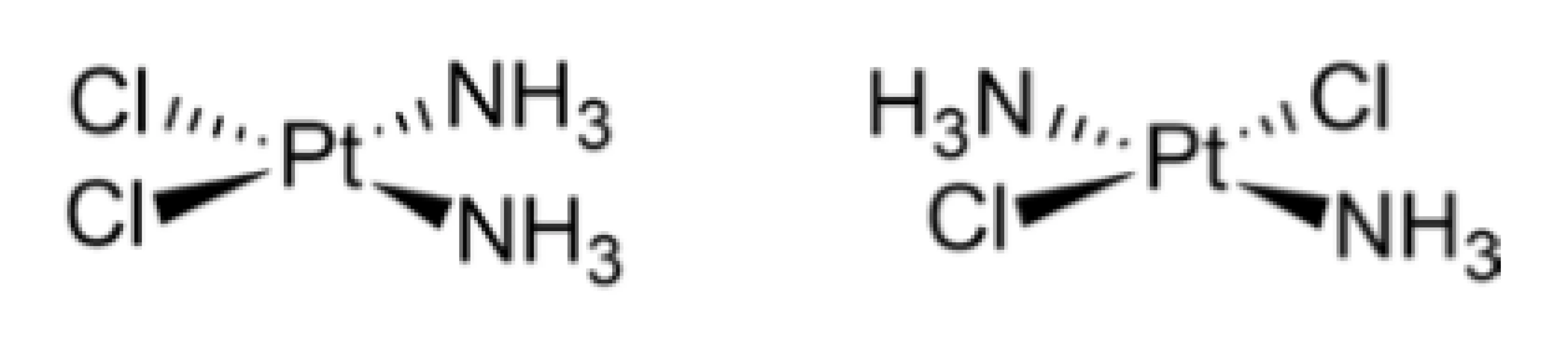
V 60. rokoch minulého storočia skúmal Barnett Rosenberg, biofyzik na americkej Michigan State University, vplyv elektrického prúdu na rast a delenie bakteriálnych buniek13). Za týmto účelom umiestnil kolónie tyčinkovitých baktérií Escherichia coli v živnom médiu obsahujúcom chlorid amónny do elektrického poľa tvoreného platinovými elektródami. Po určitom čase pozoroval zvláštny jav – zastavenie delenia buniek pri ich pokračujúcom raste, pričom tieto nadobudli charakteristický filamentárny tvar, dosahujúc 200–300-násobok pôvodnej dĺžky.
V priebehu ďalších experimentov Rosenberg a jeho spolupracovníci zistili, že pozorovaný jav nesúvisí s vplyvom elektrického poľa, ale je spôsobený prítomnosťou malého množstva zlúčenín platiny v živnom roztoku baktérií14). Tieto komplexné zlúčeniny platiny vznikajú v malej miere elektrolytickým rozpúšťaním použitých platinových elektród, pôvodne považovaných za inertné, a následnými reakciami s amoniakom a chloridovými iónmi v živnom roztoku. V prvej fáze vzniká elektrochemickou reakciou hexachloridoplatičitý anión PtCl62–, ktorý potom reaguje v zmysle reakcie:
PtCl62– + 2NH4+ → (NH4 )2 [PtCl6 ].
Tento produkt vykazuje výrazné baktericídne vlastnosti, avšak nespôsobuje filamentárny rast buniek. Následným skúmaním bolo zistené, že roztoky hexachloridoplatičitanu boli počas experimentov náhodne vystavené slnečnému žiareniu, pričom došlo v dôsledku fotokatalytickej reakcie k substitúcii:
(NH4 )2 [PtCl6 ] → cis-[PtCl4 (NH3 )2 ] + 2HCl.
Tento produkt vykazoval výrazné inhibičné účinky na rast baktérií. Neskôr sa ukázalo, že ešte vyššiu aktivitu prejavoval redukovaný komplex platiny PtCl2(NH3)2. Neskoršie experimenty in vivo potvrdili, že tento efekt vykazuje len cis-izomér diammin-dichloridoplatnatého komplexu, kým trans-izomér je prakticky neaktívny. Týmto spôsobom bola definitívne identifikovaná cisplatina ako príčina zastavenia bunkového delenia.
Je známych viacero spôsobov prípravy cisplatiny15). Najznámejšia a väčšinou aj najvýhodnejšia metóda vychádza z tetrachloridoplatnatanu draselného (obr. 2). Tento najprv reaguje vo vodnom roztoku s jodidom draselným za vzniku medziproduktu syntézy – tetrajodidoplatnatanu draselného. Výhodou tejto zámeny chloridových ligandov za jodidové je výrazný trans-efekt jodidoligandov, ako aj ich vyššia reaktivita v nasledujúcej reakcii – substitúcii halogenidu za amoniak, pričom vzniká neutrálny diammin-dijodidoplatnatý komplex v cis-konfigurácii. Účinkom roztoku dusičnanu strieborného na tento komplex dôjde k zámene zvyšných jodido ligandov za akva ligandy (vodu), ktoré predstavujú ligandy ľahko dostupné pre reakciu substitúcie. V poslednom stupni poskytuje diakva-diamminplatnatan draselný reakciou s nadbytkom chloridových aniónov (KCl) výsledný produkt – cisplatinu. Pre syntézu vo väčšom meradle, vhodnú pre farmaceutickú produkciu, vykazuje uvedený postup aj viaceré nevýhody, predovšetkým nevyhnutnosť presného dávkovania dusičnanu strieborného (má vplyv na nežiadúci výskyt striebra v konečnom produkte) a vznik ťažko spracovateľných odpadov obsahujúcich jód.
Obr. 2. Syntetická schéma prípravy cisplatiny 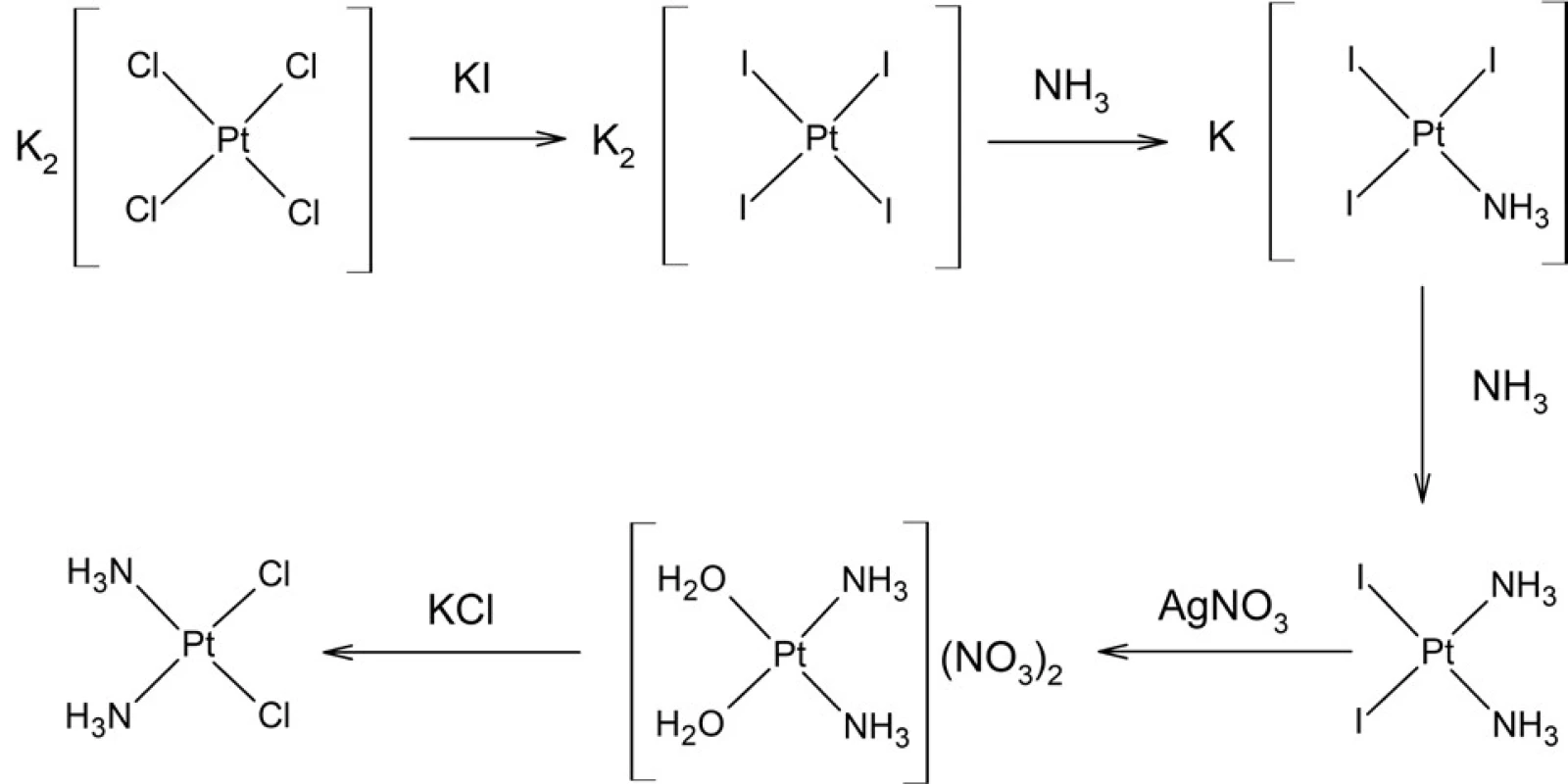
Antineoplastická aktivita cisplatiny sa obmedzuje na niektoré druhy rakoviny, v týchto však často vykazuje vysokú účinnosť liečby a v určitých prípadoch umožňuje úplne vyliečenie pacienta. Vzhľadom k svojej nízkej resorpcii z tráviaceho traktu je aplikovaná výhradne intravenózne, pričom jednotlivá dávka sa pohybuje zhruba v rozmedzí 20–100 mg/m2, podľa druhu ochorenia a terapeutického režimu9). Používa sa samotná, alebo častejšie v kombinácii s chemoterapeutikami ako sú 5-FU, etoposid, doxorubicín, cyklofosfamid, gemcitabín a iné.
Zrejme najúspešnejšou oblasťou klinickej aplikácie cisplatiny je terapia testikulárneho karcinómu, kde vo väčšine prípadov (85–90%) možno očakávať úplne vyliečenie ochorenia16). Spolu s terapiou metastazujúceho ovariálneho karcinómu bola zároveň prvou oblasťou použitia cisplatiny, ktorá získala oficiálne schválenie (americká FDA, 1978). Dôvody pozorovanej vysokej selektivity voči testikulárnemu karcinómu nie sú s určitosťou známe, hoci boli postulované viaceré možné mechanizmy. V liečbe ovariálneho karcinómu vykazuje taktiež vysokú účinnosť, pričom je súčasťou štandardnej terapie pre toto ochorenie, najčastejšie vo forme adjuvantnej terapie v kombinácii s inými liečivami. Okrem spomenutých oblastí nachádza cisplatina uplatnenie aj v celom rade ďalších druhov rakoviny, hoci spravidla s nižšou terapeutickou účinnosťou než v predchádzajúcich prípadoch. Jedná sa napr. o terapiu rôznych tumorov mozgu, žalúdka, leukémie a iných malignít.
Mechanizmus antineoplastického účinku cisplatiny je založený predovšetkým na jej interakcii s DNA v bunkovom jadre17). Cisplatina je vo vodnom roztoku značne nestabilná voči hydrolýze (polčas približne 2,5 h pri laboratórnej teplote). Po intravenóznej administrácii sa nachádza v krvnom obehu v prostredí s relatívne vysokou koncentráciou chloridových iónov, čo zamedzuje jej hydrolýze (výmene chloridových ligandov za vodu). Na druhej strane sa dostáva do kontaktu so zložkami krvi, ktoré obsahujú reaktívne sulfhydrylové skupiny, napríklad proteíny (sérový albumín), glutatión a metalotioneíny18). V dôsledku toho dochádza k vzniku pevnej väzby medzi sírou a platinou (preferovaná interakcia medzi mäkkým centrálnym atómom platiny a mäkkým, polarizovateľným donorovým atómom síry v zmysle HSAB teórie). Tvorba väzieb platiny s bunkovými tiolmi je považovaná za jeden zo základných mechanizmov deaktivácie cisplatiny in vivo a tiež má značný podiel na vzniku nežiadúcich účinkov tohto liečiva.
Intaktná časť platiny prechádza bunkovou membránou a preniká do bunky. Tento prechod sa uskutočňuje prevažne pasívnou difúziou, bol však postulovaný aj aktívny mechanizmus transportu s účasťou transportných proteínov medi (CTR1)19, 20). Bolo dokázané, že bunky rezistentné voči cisplatine vykazujú v mnohých prípadoch zníženú expresiu tohoto transportéra. Transportu cisplatiny cez bunkovú membránu sa pravdepodobne môžu zúčastňovať aj ďalšie biomolekuly, napr. Na+/K+-ATPáza.
Vzhľadom k podstatne nižšej koncentrácii chloridových iónov vnútri bunky dochádza k hydrolýze a zámene jedného alebo oboch chloridoligandov molekulami vody (obr. 3). Vznikajúce akvakomplexy následne podliehajú acidobázickým rovnováham, pričom sa koordinované molekuly vody zamieňajú za hydroxidoligandy.
Obr. 3. Hydrolýza cisplatiny a následné acidobázické rovnováhy 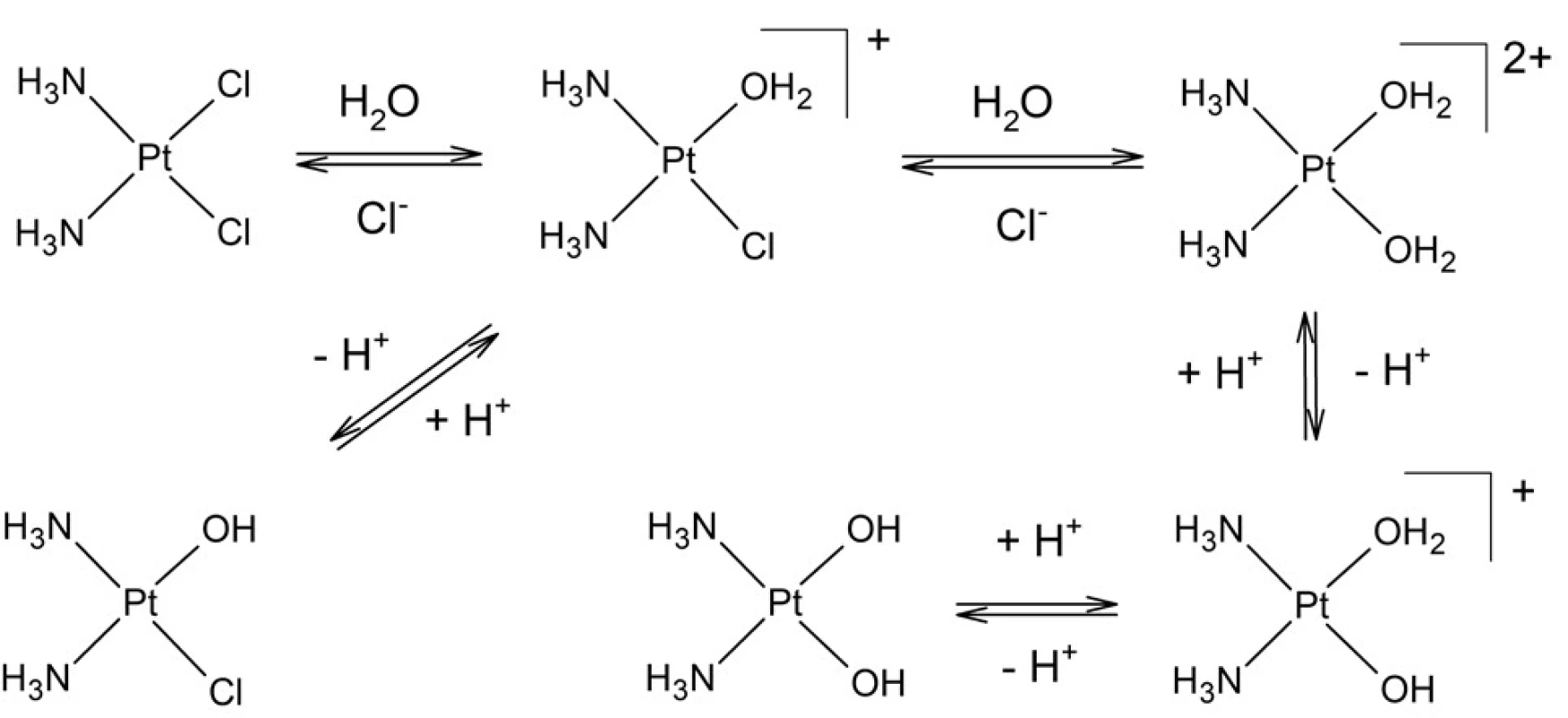
Takýto akvakomplex vykazuje podstatne vyššiu reaktivitu v porovnaní so samotnou cisplatinou a reaguje s biomolekulami prítomnými v bunke, vrátane DNA. Akvakomplex sa viaže na jeden z nukleotidov v DNA (prevažne na guanín) a vytvára monofunkčný Pt-DNA adukt (obr. 4). Následne môže dôjsť k vnútromolekulovej cyklizácii v dôsledku substitúcie ďalšieho atómu chlóru cisplatiny dusíkom inej nukleobázy a vzniku bifunkčných aduktov (najmä guanín-guanín a adenín-guanín). Môže sa jednať o adukty spájajúce dva nukleotidy na jednom vlákne dvojzávitnice DNA (intrastrand crosslinks), alebo na oboch (interstrand crosslinks). Tieto adukty spôsobujú lokálnu deformáciu (distorziu) dvojzávitnice DNA, čo vedie k ich rozpoznaniu proteínmi viažúcimi sa na DNA a k spusteniu mechanizmov vedúcich k riadenej smrti bunky (apoptóze). Alternatívne môže dochádzať k aktivácii reparačných mechanizmov bunky a oprave postihnutých úsekov DNA21).
Obr. 4. Tvorba aduktov cisplatiny s DNA a preferované miesto naviazania na nukleotid (guanín) 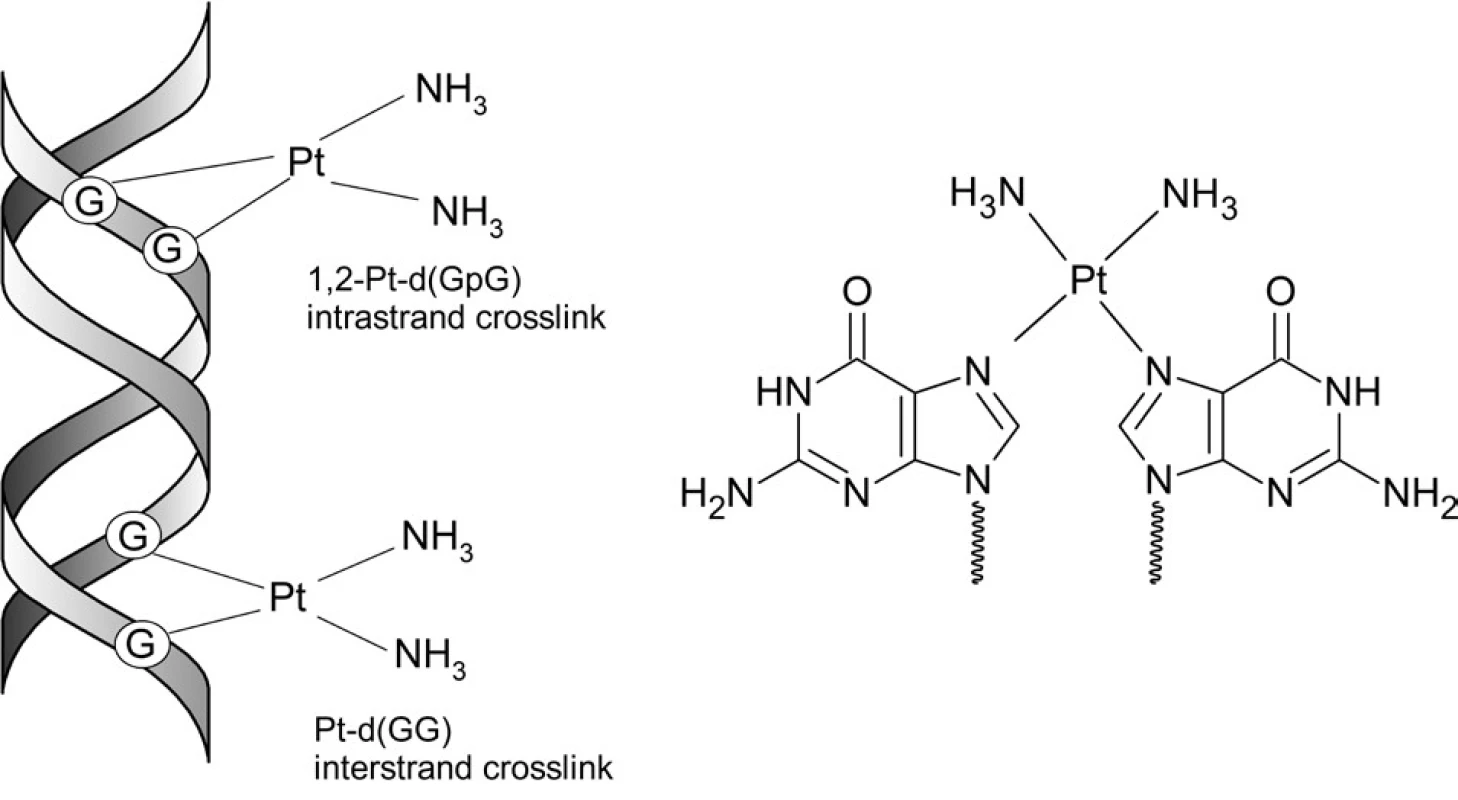
V dôsledku vysokej reaktivity cisplatiny a produktov jej hydrolýzy in vivo môžu tieto reagovať s celým radom ďalších biomolekúl prítomných v bunke a prispievať tak k celkovej cytotoxicite tohto liečiva, zároveň však aj k systémovej toxicite a vzniku nežiadúcich účinkov. Okrem väzby cisplatiny na nukleotidy DNA v bunkovom jadre boli ako alternatívne, resp. suplementárne mechanizmy aktivity navrhnuté napr. interakcia s mitochondriami a tvorba reaktívnych foriem kyslíka (ROS), väzba s mikrotubulmi alebo zinkovými prstami (zinc fingers), blokáda Na+/H+ transportného proteínu bunkovej membrány, ireverzibilná inhibícia enzýmu tioredoxínreduktáza a ďalšie22).
Načrtnutý mechanizmus biologického účinku cisplatiny umožňuje aj pochopiť príčiny podstatne nižšej aktivity jej stereoizoméru – transplatiny (trans-diammin-dichloridoplatnatého komplexu). Transplatina vykazuje výrazne vyššiu reaktivitu v porovnaní s cisplatinou, tak v reakcii hydrolýzy (substitúcia chloridoligandov a vznik reaktívneho akvakomplexu) ako aj v reakciách s inými bunkovými nukleofilmi, čo má za následok jej rýchlejšiu deaktiváciu in vivo. K absencii aktivity u transplatiny prispievajú tiež odlišnosti v charaktere jej aduktov s DNA, ktoré sú v porovnaní s cisplatinou podstatne ľahšie rozpoznateľné a dostupnejšie pre reparačné mechanizmy buniek.
Podobne ako u iných chemoterapeutík je klinické použitie cisplatiny obmedzené výskytom rezistencie, či už inherentnej, vlastnej určitým druhom rakoviny (napr. kolorektálny karcinóm), alebo získanej v priebehu terapie týmto liečivom21). Mechanizmus vzniku rezistencie je komplikovaný a v súčasnosti ešte nedostatočne preskúmaný. Zahrňuje viaceré procesy: zníženú vnútrobunkovú akumuláciu liečiva (znížený prestup do bunky a/alebo zvýšené vylučovanie z bunky pomocou detoxikačných mechanizmov), nárast produkcie bunkových tiolov, vedúcich k deaktivácii cisplatiny, ako aj aktiváciu opravných bunkových mechanizmov pre opravu poškodenej DNA, brániacich spusteniu apoptózy a iné.
Vnútrobunková koncentrácia cisplatiny je znižovaná aktívnym transportom smerom von z bunky (eflux). Tento transport je sprostredkovaný predovšetkým ATP-ázami P-typu (ATP7A a ATP7B) zapojenými taktiež do transportu medi. Tieto transportéry vykazujú vyššiu expresiu v rezistentných bunkách a sú spájané s nepriaznivou prognózou pri liečbe cisplatinou. Podobne bola pozorovaná aj zvýšená produkcia bunkových antioxidantov obsahujúcich síru v bunkách rezistentných voči cisplatine23). Tieto látky značnou mierou prispievajú k zníženiu vnútrobunkovej koncentrácie liečiva, napr. adukty cisplatiny s glutatiónom sú vylučované aktívnym mechanizmom prostredníctvom efluxného transportéra MRP2 zo skupiny ABC-transmembránových proteínov.
Aktivácia apoptotických mechanizmov v dôsledku väzby cisplatiny na DNA je závislá na rozpoznaní týchto aduktov kontrolnými a opravnými mechanizmami bunky24). Tento proces je sprostredkovaný viacerými proteínmi. HMG proteíny sa zúčastňujú regulácie génovej expresie a ovplyvňujú štruktúru chromatínu. Majú pozitívny vplyv aj na cytotoxicitu cisplatiny, keďže chránia Pt-DNA adukty pred opravnými mechanizmami pre DNA, akými sú napr. proteíny nukleotidovej excíznej opravy (NER). Tieto spôsobujú odstránenie Pt-DNA aduktov a opravu poškodených úsekov DNA. Reparačné proteíny MMR naopak spôsobujú zvýšené rozpoznávanie aduktov a fungujú ako spúšťače apoptózy. Ďalšie potenciálne mechanizmy rezistencie môžu súvisieť s modifikáciou samotných apoptotických dráh bez priamej interakcie s cisplatinou či jej DNA-aduktami. Dominantným medzi nimi je mechanizmus deaktivácie tumorového supresorového proteínu p53.
Napriek svojej vysokej efektivite v liečbe určitých druhov rakoviny vykazuje cisplatina, podobne ako iné chemoterapeutiká, množstvo nežiadúcich účinkov25). Tieto sú závislé od dávky a terapeutického režimu. Zrejme najzávažnejšou toxicitou cisplatiny je nefrotoxicita, vzhľadom k tomu, že hlavnou cestou eliminácie tohto liečiva z organizmu je vylučovanie obličkami (renálna exkrécia). Nefrotoxicita môže byť do značnej miery eliminovaná aplikáciou intravenózneho hydratačného režimu. Pomerne častá je tiež ototoxicita (poškodenie sluchu) a hepatotoxicita, obe zapríčinené predovšetkým oxidačným stresom. Takmer všeobecne bola u pacientov zaznamená silná nauzea – nevoľnosť a zvracanie, ktorá však môže byť potlačená podávaním antiemetík.
Komplexy platiny novej generácie
Vzhľadom k vyššie uvedeným nedostatkom cisplatiny ako chemoterapeutika (nežiadúce účinky, nedostatočná účinnosť v mnohých druhoch rakoviny, vznik rezistencie v priebehu liečby) dochádza už čoskoro k snahám o vývoj nových komplexov platiny s vylepšeným farmakologickým a toxikologickým profilom26). Od objavu antineoplastických účinkov cisplatiny boli pripravené a testované tisíce ďalších komplexov platiny, pričom boli porovnávaním ich bioaktivity postulované určité vzťahy medzi ich štruktúrou a aktivitou:
- Komplex obsahuje centrálny atóm platiny v oxidačnom stupni II a štvorcovo-planárnej konfigurácii.
- Centrálny atóm sa viaže na dva donorové atómy dusíka, pochádzajúce buď z dvoch monodentátnych ligandov, alebo z jedného bidentátneho; táto väzba je stabilná a zostáva zachovaná aj v štruktúre aduktu s DNA.
- Komplex ďalej obsahuje jeden bidentátny alebo dva monodentátne odchádzajúce ligandy, napríklad chloridové alebo karboxylátové ligandy, ktoré sú ľahko hydrolyzovateľné vo vodnom prostredí bunky.
- Geometria štvorcovo-planárneho komplexu je cis (komplexy v trans konfigurácii sú považované za neaktívne).
- Komplex by mal byť neutrálny.
- Komplexy obsahujúce nesubstituovanú aminoskupinu (primárne amíny) vykazujú vyššiu aktivitu; aminoskupina by mala v každom prípade mať aspoň jeden atóm vodíka.
Väčšina testovaných komplexov platiny zodpovedá týmto konvenciám. V prvej fáze výskumu dochádza k selekcii platnatých komplexov s nižšou toxicitou v porovnaní s cisplatinou (tzv. komplexy platiny druhej generácie). Jedná sa predovšetkým o redukciu nefrotoxicity, dávku limitujúcej toxicity cisplatiny. Táto redukcia bola dosiahnutá sčasti variáciou odchádzajúcich ligandov platnatého komplexu – zámenou chloridových ligandov za karboxylátové, čo má vplyv na farmakokinetické vlastnosti komplexu a poskytuje komplexu vyššiu stabilitu (odolnosť voči hydrolýze a substitučným reakciám s nukleofilmi). Najúspešnejším spomedzi nich je karboplatina, diammin-(cyklobután-1,1-dikarboxyláto)platnatý komplex, oficiálne uvedený do klinickej praxe v roku 1985 (obr. 5). Tento komplex vykazuje výrazne nižšiu mieru toxicity, najmä nefrotoxicity, a tiež menšiu intenzitu nevoľnosti (nauzea, dávenie), zrejme v dôsledku vyššej stability odchádzajúceho ligandu (cyklobután-1,1-dikarboxylátu) voči substitúcii27). Z tohto dôvodu je možné použiť v liečbe vyššie terapeutické dávky. Príkladmi aplikácie karboplatiny sú terapia ovariálneho a bronchiálneho karcinómu a nádorov mozgu, takmer výhradne v kombinácii s inými cytostatikami. Hlavným nežiadúcim účinkom karboplatiny je jej negatívny vplyv na krvotvorbu (myelosupresia – narušenie funkcie kostnej drene). Má tiež značne vyšší biologický polčas v porovnaní s cisplatinou. V priebehu klinických štúdií bolo zistené, že karboplatina má obdobné spektrum aktivity ako cisplatina, a je teda neúčinná pri nádoroch rezistentných voči tomuto liečivu, ako aj v prípadoch získanej rezistencie (tzv. krížová rezistencia – cross resistance). Príčinou tohto javu je veľmi podobný mechanizmus účinku ako cisplatina, predovšetkým analogická štruktúra aduktov s DNA. Táto vlastnosť sa vzťahuje aj na ostatné komplexy platiny prvej generácie.
Obr. 5. Štruktúra karboplatiny 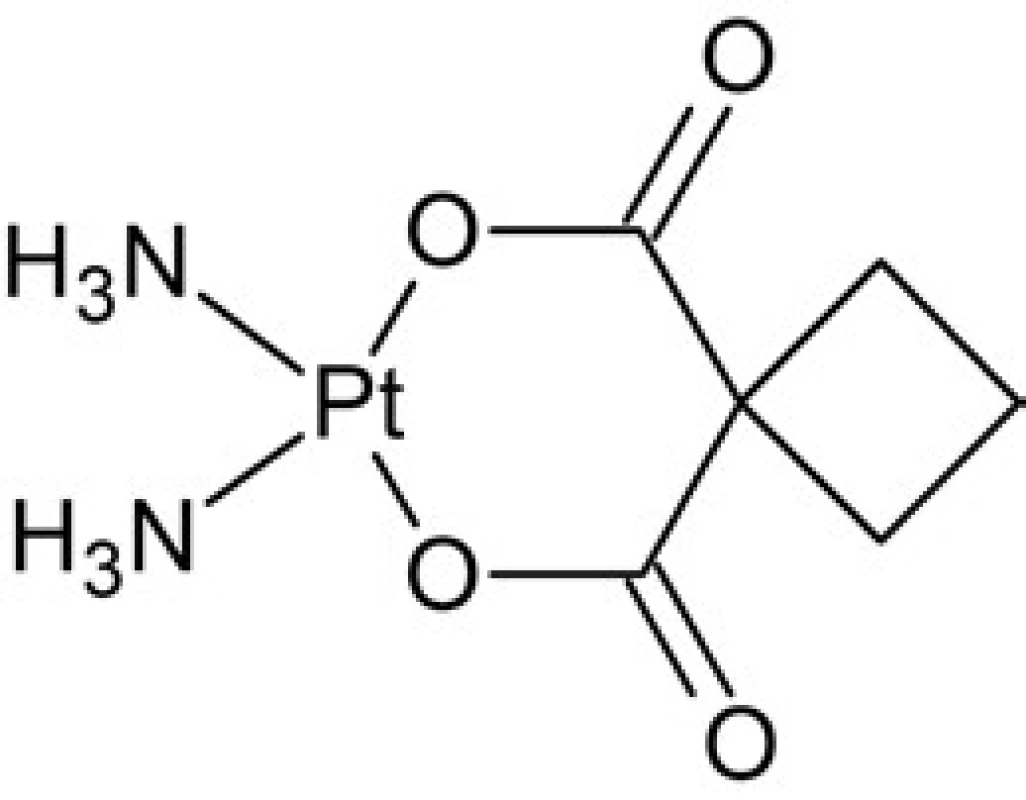
V záujme získania komplexov platiny so širším, resp. odlišným spektrom aktivity boli syntetizované ďalšie komplexy platiny s výraznejšie modifikovanou štruktúrou v porovnaní s cisplatinou, u ktorých bol predpoklad tvorby DNA aduktov s odlišnou štruktúrou než v prípade cisplatiny (tzv. komplexy platiny tretej generácie). Spomedzi týchto zlúčenín našla všeobecné použitie oxaliplatina, (1R,2R-diaminocyklohexán)-oxalátoplatnatý komplex (obr. 6). Jej hlavné použitie je v kombinačnej terapii kolorektálneho karcinómu, ochorenia, pri ktorom je cisplatina prakticky neúčinná28). Podobne ako cisplatina a karboplatina je aj oxaliplatina aplikovaná výhradne intravenózne. Limitujúcou toxicitou sú v prípade oxaliplatiny najčastejšie rôzne formy neurotoxicity, ako sú periferálna neuropatia a ototoxicita (poškodenie sluchového nervu), kým nefrotoxita je na rozdiel od cisplatiny zanedbateľná.
Obr. 6. Chemická štruktúra oxaliplatiny 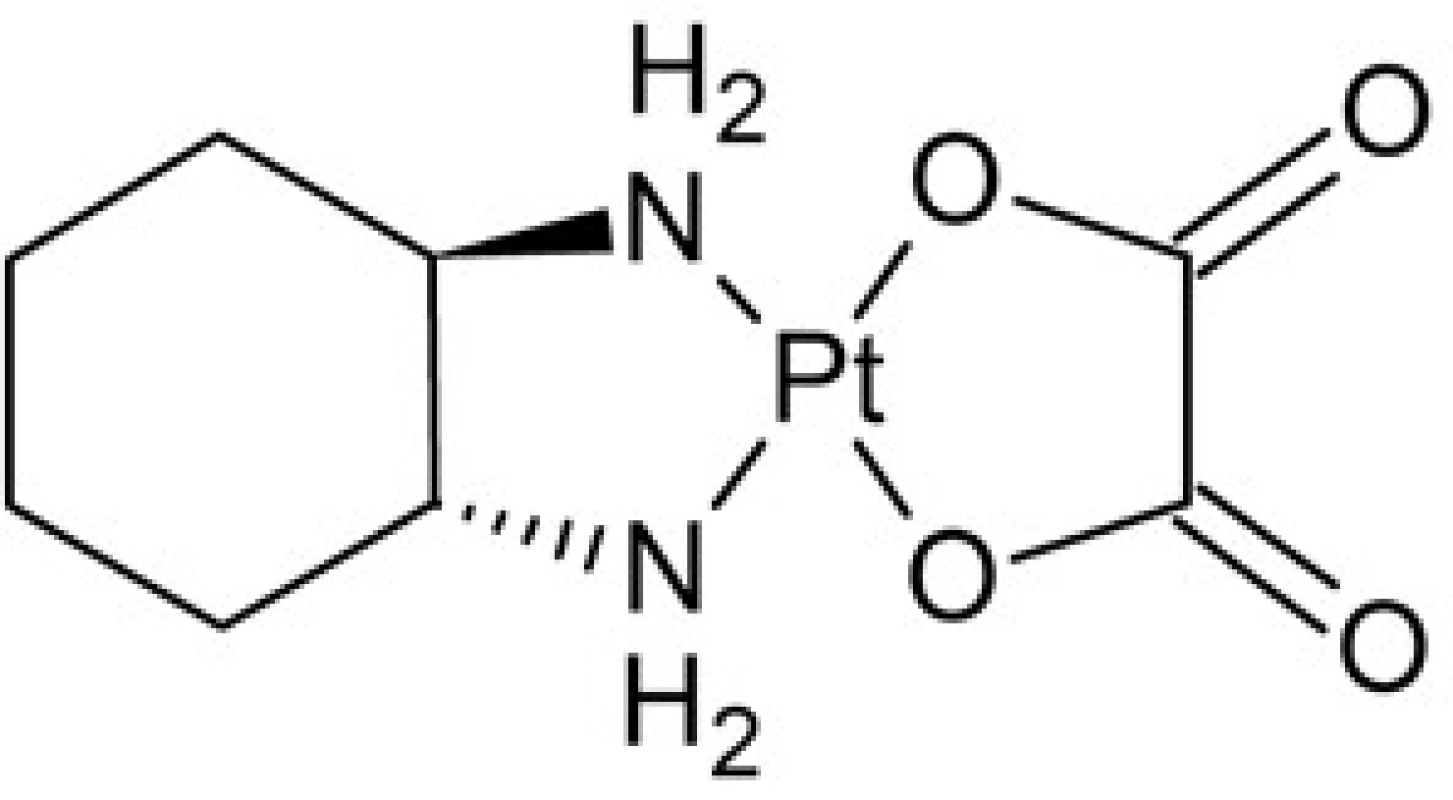
Lokálny význam majú viaceré ďalšie komplexy platiny, povolené ako liečivá v niektorých krajinách – nedaplatina (Japonsko, 1995), heptaplatina (Južná Kórea, 1999) a lobaplatina (Čína, 2005). Uvedené liečivá sú v súlade s vyššie uvedenými pravidlami pre štruktúru aktívnych komplexov platiny a spektrom aktivity ani toxicity sa výrazne nelíšia od zodpovedajúcich antineoplastických komplexov platiny s globálnou distribúciou.
Komplexy platiny s nekonvenčnou štruktúrou
Postupom času sa ukázalo, že komplexy platiny zodpovedajúce konvenčnému dizajnu (pôvodným pravidlám štruktúra-aktivita) vykazujú analogické spektrum aktivity a sú spravidla neúčinné v rezistentných druhoch rakoviny. Na druhej strane bolo pripravených množstvo komplexov platiny, ktorých štruktúra nezodpovedá uvedeným pravidlám, a napriek tomu sú značne cytotoxické. Niektoré z nich prejavovali aktivitu aj u nádorov málo citlivých voči terapii cisplatinou a jej analógmi, prípadne boli účinné v prípade buniek so získanou rezistenciou. Vzhľadom k neštandardnej štruktúre týchto komplexov je možné u nich očakávať odlišný mechanizmus účinku, umožňujúci prekonať mechanizmy rezistencie29, 30). Neustále sú pripravované nové komplexy tohto typu a vybrané komplexy sa nachádzajú v štádiu klinického testovania.
Jedným z nich je AMD473 (pikoplatina), ammin-dichlorido-(2-metylpyridín)platnatý komplex. Tento neobsahuje na donorovom atóme dusíka pyridínového kruhu žiaden atóm vodíka, napriek tomu vykazuje vysokú antineoplastickú aktivitu, napr. voči kolorektálnemu karcinómu alebo karcinómu prostaty. Má podstatne nižšiu reaktivitu voči substitúcii chloridoligandov, čo je spôsobené chrániacim sterickým efektom objemného 2-metylpyridínového ligandu. Podobný efekt prítomnosti stericky náročného ligandu je možné pozorovať aj u iných komplexov tohto typu. Nižšia reaktivita voči substitúcii má za následok vyššiu stabilitu komplexu v prítomnosti bunkových tiolov, a bráni tak jeho deaktivácii. Z tohto dôvodu je pikoplatina účinná vo viacerých bunkových líniách so získanou rezistenciou voči cisplatine.
Iným typom komplexov platiny, ktoré nezodpovedajú konvenčným vzťahom štruktúra-aktivita, sú komplexy s trans-usporiadaním ligandov31). Je známych viacero takýchto komplexov, napr. s hydroxyalkylpyridínovými ligandmi alebo s N-heterocyklickými karbénmi. Takéto komplexy často vykazujú značnú aktivitu aj v prípade rezistentných bunkových línií, v niektorých prípadoch výrazne prevyšujúcu aktivitu cisplatiny. Mechanizmus ich biologického účinku nie je zatiaľ dostatočne preskúmaný. Ako jedna z možností je uvádzaná izomerizácia trans-komplexov za vzniku aktívnych cis-izomérov, sú však známe i komplexy, u ktorých je samotný cis-izomér podstatne menej aktívny než trans-forma.
Osobitnou kategóriou antineoplastických platnatých komplexov sú viacjadrové komplexy platiny32). Tieto často vykazujú vysokú cytotoxicitu in vitro a sú schopné prekonať získanú rezistenciu u mnohých rakovinových bunkových kultúr. Najznámejším predstaviteľom tejto kategórie zlúčenín je BBR3464 (obr. 7), liečivo, ktoré sa dostalo do 2. fázy klinického skúšania. Bolo zistené, že rakovinové bunky vykazujú zvýšený príjem tejto látky a v jadre bunky dochádza k nárastu platinácie DNA v porovnaní s cisplatinou. Ďalším možným faktorom, ktorý prispieva k aktivite viacjadrových platnatých komplexov, je nižšia miera ich deaktivácie vnútrobunkovými nukleofilmi.
Obr. 7. Štruktúra komplexu BBR3464 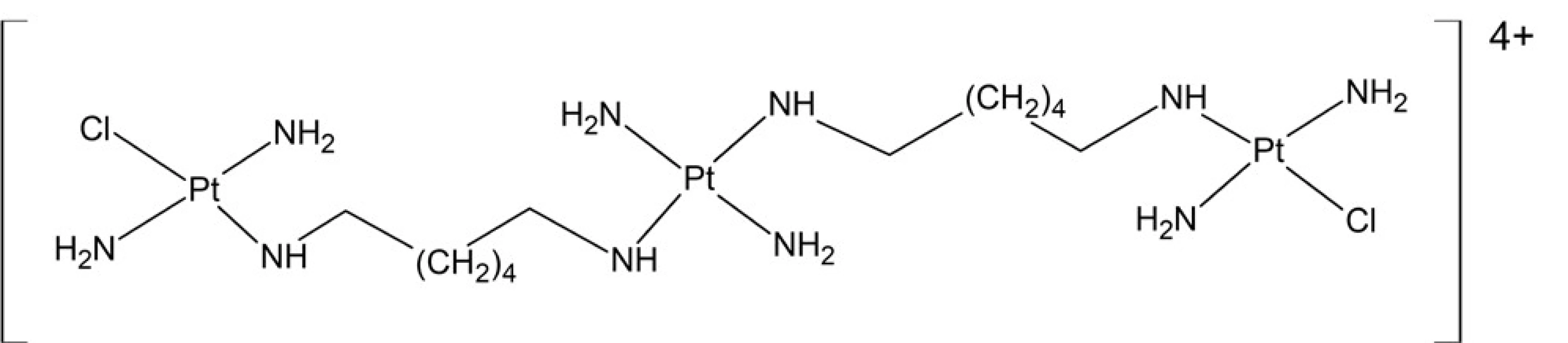
K aktuálnym oblastiam výskumu metalofarmák na báze platiny patria komplexy platiny v oxidačnom stupni IV33, 34). Platina má v týchto komplexoch koordinačné číslo 6 v oktaédrickej koordinácii. Sú charakteristické vysokou kinetickou inertnosťou, ktorá ich robí odolnými voči hydrolýze a inaktivácii reakciami s nukleofilmi obsiahnutými v bunke. Dva dodatočné ligandy v axiálnej polohe majú vplyv na farmakokinetické vlastnosti komplexu, napr. na jeho lipofilnosť, čo má za následok vyššiu mieru difúzie cez bunkovú membránu, a tým pádom aj zvýšenú akumuláciu liečiva v bunke. Komplexy platiny v oxidačnom stupni IV účinkujú v podstate ako prekurzory účinných (cytotoxických) látok, ktorými sú komplexy v oxidačnom stupni II. Tieto vznikajú redukciou platičitých komplexov vo vnútri bunky. Takýto spôsob je obzvlášť výhodný, keďže platičité komplexy sú stabilnejšie a odolnejšie voči deaktivácii mimo bunky aj v nej, je teda možné dosiahnuť ich vyššiu cytoplazmatickú koncentráciu. Ľahkosť redukcie je možné ovplyvniť vhodným výberom axiálnych ligandov. Ďalším výhodným dôsledkom ich kinetickej inertnosti je možnosť perorálnej aplikácie týchto zlúčenín (na rozdiel od ostatných komplexov platiny v klinickej praxi) a nízka intenzita nežiadúcich účinkov. Zatiaľ najúspešnejšou z nich je satraplatina (obr. 8a) nachádzajúca sa v II./III. fáze klinických štúdií. Tento orálne aplikovateľný platičitý komplex obsahuje dva axiálne viazané acetátoligandy, čo zvyšuje lipofilnosť komplexu a tiež jeho biodostupnosť v gastrointestinálnom trakte. V priebehu redukcie dochádza k eliminácii týchto axiálnych ligandov za vzniku platnatého metabolitu (obr. 8b). Liečivo vykazuje všeobecne nízku systémovú toxicitu. Limitujúcou toxicitou je trombocytopénia (nedostatok krvných doštičiek – trombocytov) a neutropénia (abnormálne nízky počet bielych krviniek – neutrofilov).
Obr. 8. Štruktúra satraplatiny (a) a jej metabolitu vznikajúceho redukciou (b) 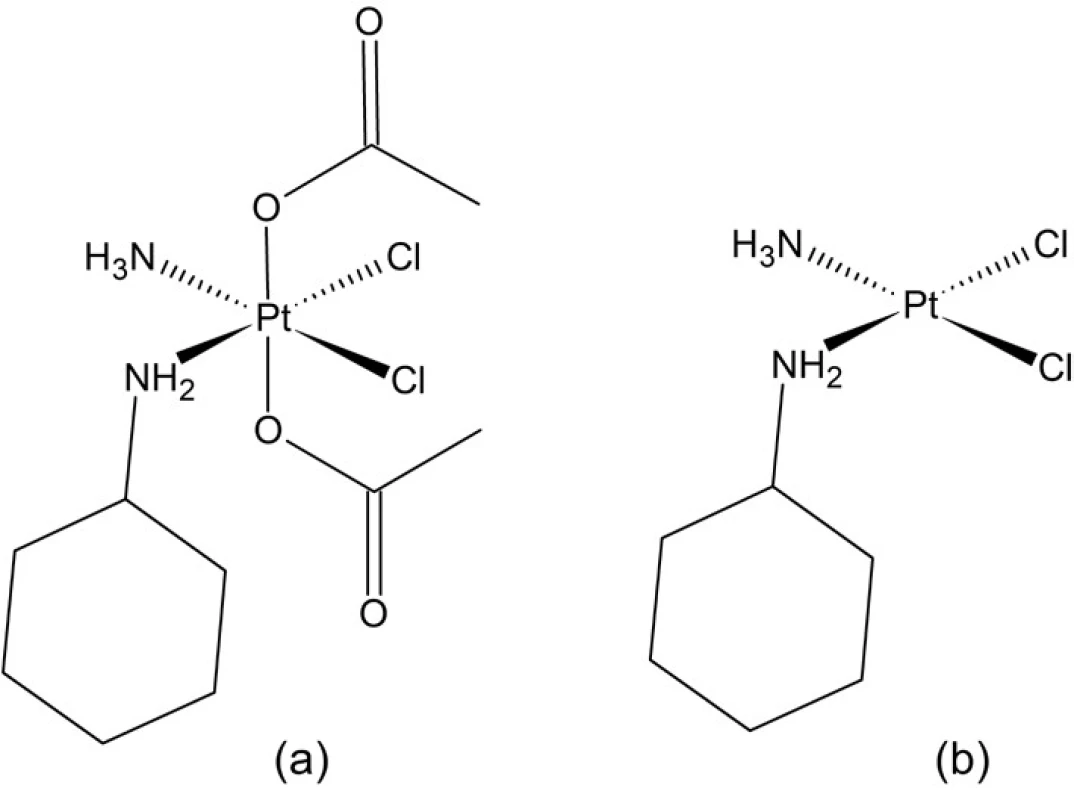
Ostatné kovy v chemoterapii
V dôsledku úspechu cisplatiny ako liečiva proti rakovine a hľadania analógov so zlepšenými farmakologickými vlastnosťami sa pozornosť vedcov čoskoro obracia na komplexy s inými centrálnymi atómami než platina35–37). Odvtedy bola antineoplastická aktivita pozorovaná vo väčšej či menšej miere u všetkých prechodných kovov. Vzhľadom k obmedzenému priestoru spomenieme len stručne niektoré z nich.
Komplexy ruténia patria k prvým skúmaným alternatívam antineoplastických komplexov platiny a v súčasnosti predstavujú zrejme najperspektívnejšiu oblasť vývoja nových metalofarmák38–40). Ich chemické vlastnosti sú v mnohom analogické platnatým komplexom, predovšetkým podobnou kinetikou substitúcie ligandov. Už v 70. rokoch 20. storočia bola objavená antineoplastická aktivita komplexov ruténia s jednoduchými anorganickými ligandmi (NH3, Cl–), avšak prekážkou ich klinickej aplikácie bola ich nízka rozpustnosť. Neskôr boli pripravené a klinicky testované viaceré účinné komplexy ruténia s organickými ligandmi, vykazujúce vyššiu rozpustnosť. Dva z nich sa dostali do 2. fázy klinických skúšok – ruténité komplexy NAMI-A a KP1019 (obr. 9)41). Hoci vykazujú aj aktivitu voči primárnym nádorom, napr. KP1019 proti kolorektálnemu karcinómu, ich hlavnou oblasťou potenciálneho využitia sa javí byť antimetastatická aktivita.
Obr. 9. Štruktúra komplexov ruténia KP1019 (a) a NAMI-A (b) 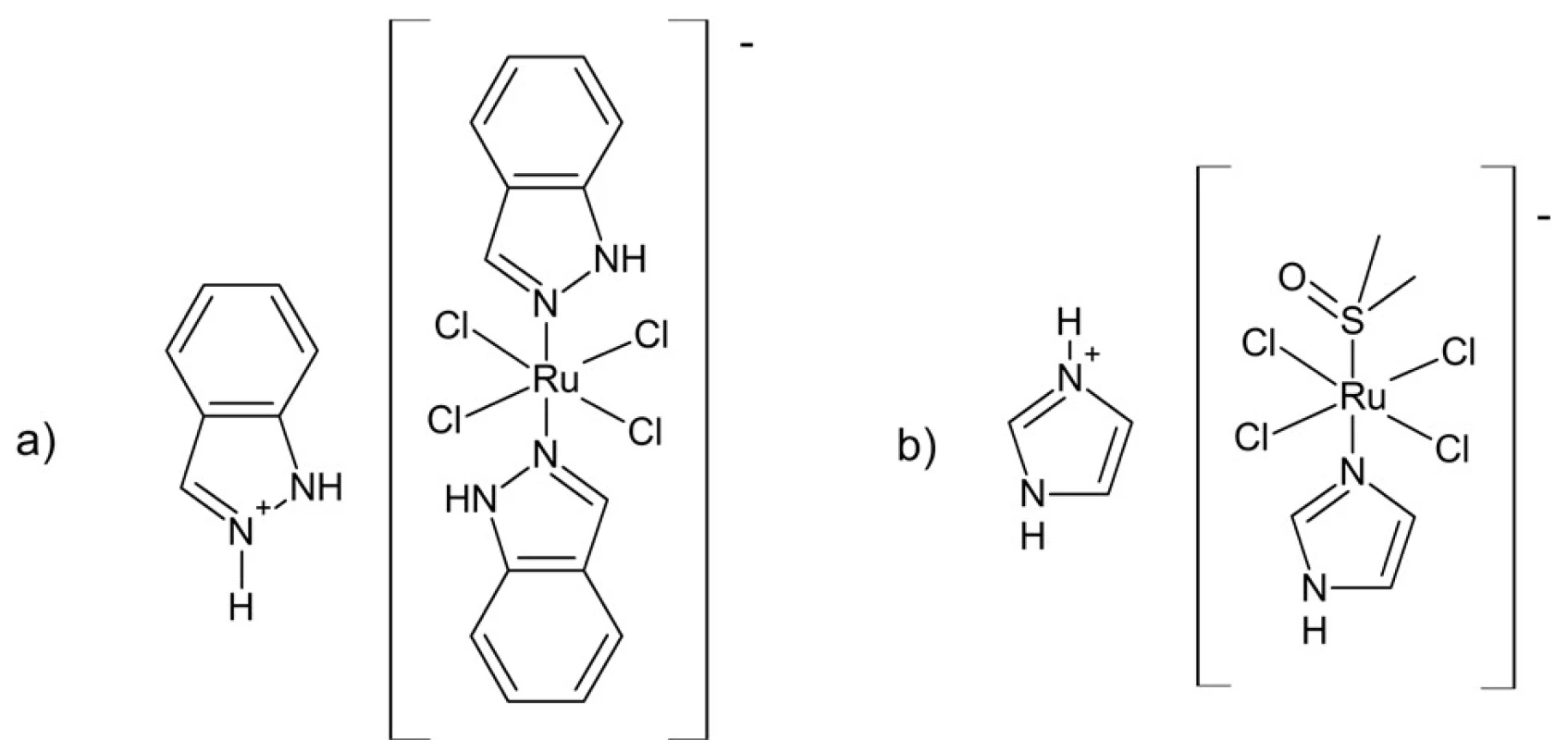
Mechanizmus ich účinku je značne komplexný. Koordinačné zlúčeniny ruténia vytvárajú pevné väzby s DNA, podobne ako komplexy platiny, avšak významnú úlohu zrejme zohráva aj interakcia s proteínmi (napr. topoizomerázy a matrixové metaloproteinázy)42). Transport do bunky je sprostredkovaný transferínom, čo môže viesť k zvýšenej akumulácii ruténia v rakovinových bunkách, vzhľadom k vyššej hustote transferínových receptorov na povrchu rakovinových buniek (zvýšený príjem železa).
Dôležitým aktivačným predstupňom biologického účinku sú hydrolytické reakcie, pri ktorých dochádza k zámene chloridoligandov za akvaligandy. Vznikajúce akvakomplexy vykazujú zvýšenú reaktivitu voči bunkovým nukleofilom, napr. DNA, podobne ako analogické komplexy platiny. V redukujúcom prostredí bunky môže dochádzať k redukcii centrálneho atómu ruténia z oxidačného stupňa III na II, ktorý je značne reaktívnejší v reakciách substitúcie, preto je možné na ruténité komplexy nahliadať ako na prekurzory (prodrugs) aktívnej formy liečiva (tzv. „aktivácia redukciou“)43). Tento mechanizmus môže výraznou mierou prispievať k aktivite liečiv v prostredí pevných nádorov, ktoré sa vyznačujú hypoxiou (redukujúce prostredie tumorov, charakteristické nízkou hladinou O2).
Iným typom bioaktívnych komplexov ruténia sú organokovové komplexy s arénovými ligandmi, tzv. polosendvičové komplexy (napr. RAPTA komplexy, obsahujúce η6-bifenylový ligand)44). Majú odlišné spektrum protirakovinového účinku v porovnaní s predchádzajúcou kategóriou komplexov a pravdepodobne aj odlišný mechanizmus bioaktivity. Podobne ako komplexy typu NAMI-A a KP1019 obsahujú reaktívne chlorido-ligandy schopné substitúcie molekulami vody. Mnohé z nich prejavujú antineoplastickú aktivitu aj v prípade buniek rezistentných voči cisplatine.
Komplexy paládia v oxidačnom stupni dva majú štruktúru analogickú platnatým komplexom (sú izoštruktúrne), sú však reaktívnejšie a reakcie substitúcie ligandov prebiehajú podstatne rýchlejšie45, 46). Pokiaľ nie sú stabilizované vhodnými ligandmi, podliehajú ľahšie hydrolýze a následným reakciám s nukleofilmi než ich platinové analógy. Typická je tiež vyššia stabilita trans-izomérov paládnatých komplexov, ktoré sú často inaktívne podobne ako u komplexov platiny47). Na druhej strane je výhodou ich relatívne lepšia rozpustnosť vo vode.
Zlúčeniny prechodných kovov sa vo všeobecnosti vyznačujú značnou systémovou toxicitou a množstvom nežiadúcich účinkov. K najmenej toxickým prechodným kovom patrí titán, ktorého niektoré zlúčeniny sa používajú i v potravinárstve a ako pomocné látky vo farmácii (napr. TiO2). Oxid titaničitý sa vyznačuje tiež fotokatalytickými vlastnosťami, pričom je schopný katalyzovať vznik kyslíkových radikálov a oxidovať rôzne organické substráty. Túto jeho vlastnosť je možné využiť na prípravu antibakteriálnych povrchových úprav v medicínskych aplikáciách. Antineoplastické vlastnosti zlúčenín titánu boli rozpoznané už v 70. rokoch 20. storočia 48). V roku 1986 dosiahol 1. fázu klinického skúmania budotitán, oktaedrický komplex štvormocného titánu s výraznou aktivitou voči kolorektálnemu karcinómu (obr. 10a). Ďalším komplexom testovaným v klinických štúdiách bol dichlorid titanocénu (obr. 10b). Táto zlúčenina je súčasťou významnej skupiny komplexov nazývaných metalocény. Jedná sa o tzv. sendvičové komplexy, organokovové zlúčeniny obsahujúce dva cyklopentadienylové ligandy obklopujúce centrálny atóm kovu49, 50). Radia sa k nim tiež polosendvičové komplexy obsahujúce len jeden cyklopentadienylový ligand. Budotitán aj dichlorid titanocénu obsahujú dva labilné ligandy (chloridové, resp. etoxidové), ľahko zameniteľné za vodu a iné nukleofily. Akvakomplexy titánu môžu podliehať následným acidobázickým reakciám vedúcim ku vzniku rôznych hydroxidokomplexov a nakoniec až k TiO251). Táto vlastnosť spôsobuje značné problémy s ich farmaceutickou formuláciou, najmä vzhľadom k ich intravenóznej aplikácii, čo viedlo k pozastaveniu klinických štúdií u oboch liečiv. Mechanizmus účinku komplexov titánu nie je zatiaľ dostatočne preskúmaný, zrejme sa však nejedná výhradne o väzbu na DNA52). Vstup titaničitých iónov do bunky je pravdepodobne sprostredkovaný transferínovými receptormi. V súčasnosti pokračuje hľadanie nových derivátov s vysokou cytostatickou aktivitou a zvýšenou stabilitou v roztoku53).
Obr. 10. Budotitán (a) a dichlorid titanocénu (b) 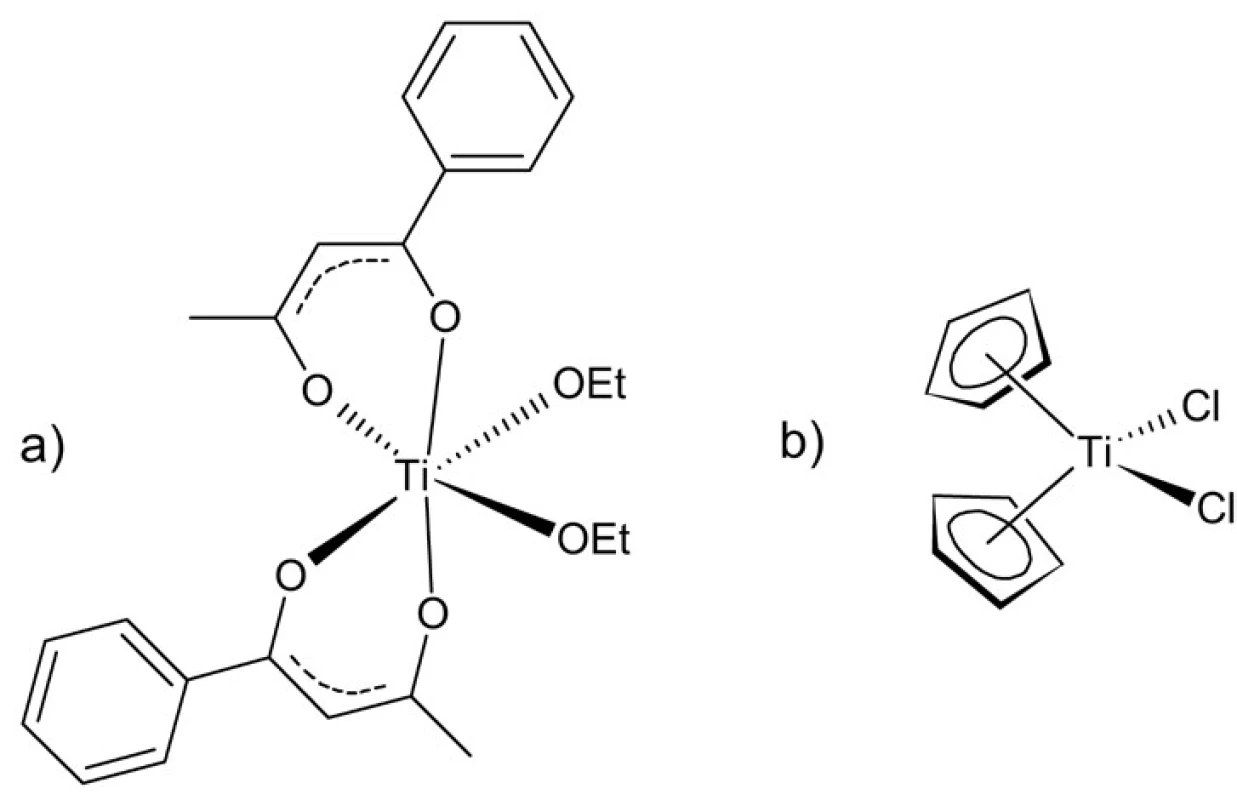
Gálium je kovový prvok patriaci medzi p-prvky. Vyskytuje sa v stabilnom oxidačnom stupni III, ktorý vykazuje značnú podobnosť so železitým katiónom, hoci na rozdiel od neho nepodlieha redoxným reakciám. Na tejto analógii je založený aj transport gália cez bunkovú membránu. Zlúčeniny gália prejavujú aktivitu voči viacerým druhom rakoviny, napr. uroteliálnemu a renálnemu karcinómu a lymfómu54, 55). Prvou takto skúmanou zlúčeninou gália bol dusičnan galitý, ktorý však podlieha rýchlej hydrolýze v biologickom prostredí. Komplexácia gália vhodnými ligandmi poskytuje týmto zlúčeninám vyššiu stabilitu vo vodnom roztoku. Najúspešnejším v klinických skúškach bol komplex KP46 obsahujúci ako ligand 8-hydroxychinolín a vykazujúci vyššiu aktivitu než jednoduché soli gália (obr. 11)56). Ďalšou výhodou je možnosť jeho perorálnej aplikácie. Hlavným mechanizmom antineoplastickej aktivity galitých zlúčenín sa javí byť inhibícia enzýmu ribonukleotidreduktáza.
Obr. 11. Štruktúra komplexu KP46 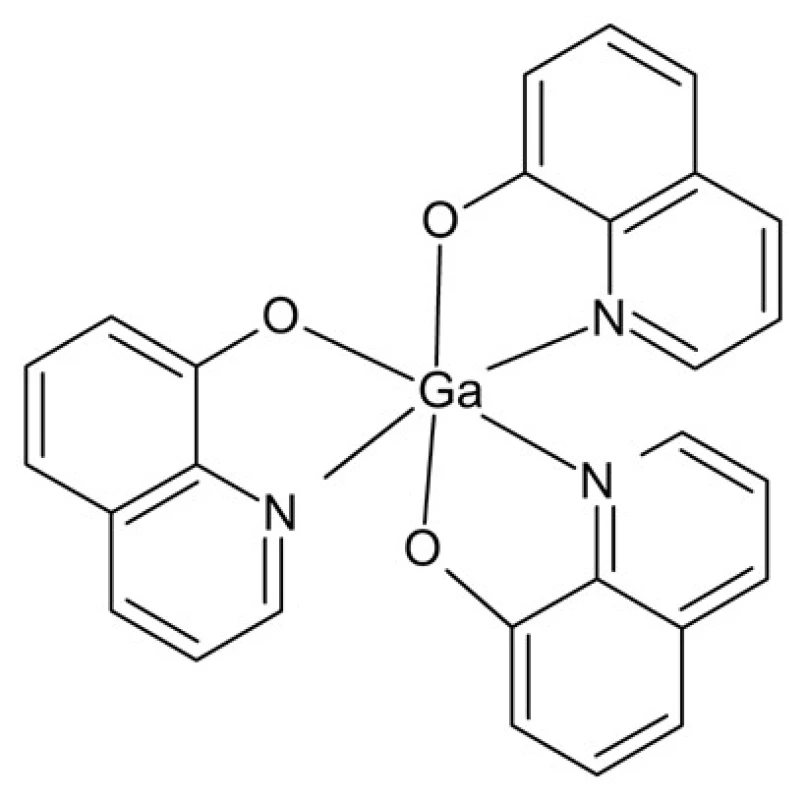
Potenciál zlúčenín cínu v liečbe rakoviny bol rozpoznaný už v 70. rokoch 20. storočia a následne bolo skúmané množstvo derivátov s účinnosťou v rôznych druhoch malignancií57, 58). Pri týchto zlúčeninách sa jedná o organokovové komplexy, obsahujúce jednu, alebo viacero kovalentných väzieb C-Sn. Zloženie väčšiny z nich zodpovedá vzorcu RnSnL4-n, kde R je alkyl alebo aryl a L aniónový ligand. Mnohé vykazujú značnú cytotoxicitu v bunkových kultúrach aj vo zvieracích modeloch, ako aj iné druhy biologickej aktivity – baktericídnu, fungicídnu, antivirotickú a iné. Obzvlášť vysoká aktivita bola často pozorovaná v modeli leukémie P388. Boli podniknuté viaceré pokusy stanoviť vzťahy medzi štruktúrou a aktivitou organokovových zlúčenín cínu. Ich cytotoxicita všeobecne klesá v rade R3Sn > R2Sn > RSn, pričom tetraalkylciničité zlúčeniny R4Sn sú in vivo dealkylované na R3Sn. Ako potenciálne mechanizmy biologickej aktivity boli navrhnuté inhibícia oxidatívnej fosforylácie v mitochondriách, interakcia s bunkovou membránou alebo inhibícia syntézy DNA.
Viaceré typy komplexov zlata vykazujú výraznú antineoplastickú aktivitu59). Zlato vo svojich zlúčeninách sa vyskytuje prevažne v oxidačných stupňoch I a III, pričom vyšší oxidačný stupeň je menej stabilný. Dôležitou kategóriou bioaktívnych zlúčenín zlata sú zlatné komplexy s fosfánovými ligandmi. Tieto účinkujú zrejme prostredníctvom narušenia membránového potenciálu v mitochondriách, pričom interakcia s DNA zohráva len vedľajšiu úlohu. Ďalším typom vysokoúčinných komplexov v oxidačnom stupni I sú N-heterocyklické karbény. Mnohé komplexy zlata v oxidačnom stupni III takisto vykazujú vysokú aktivitu voči rakovinovým bunkám, vyžadujú si však stabilizáciu vhodnými ligandmi, napr. ako súčasť porfyrínového skeletu. Zaujímavá aktivita bola zistená aj u niektorých komplexov určených pôvodne k liečbe reumatoidnej artritídy, predovšetkým u auranofinu60).
Zlúčeniny arzénu patria napriek svojej toxicite k najstarším liečivám, tak ako bolo popísané v prvej časti tohto prehľadu1).Po prechodnom ústupe ich používania dochádza v poslednej dobe k renesancii záujmu o tieto látky, najmä v liečbe rakoviny61, 62). Po stáročia ako súčasť tradičnej čínskej medicíny boli tieto látky systematicky skúmané v rámci klinického testovania na čínskych univerzitách v 70. až 80. rokoch 20. storočia. Výsledkom bolo zavedenie oxidu arzenitého do terapie akútnej promyelocytickej leukémie, najprv v Číne a následne aj v USA. As2O3 vykazuje aktivitu taktiež pri mnohopočetnom myelóme. Mechanizmus účinku zahrňuje najmä indukciu apoptózy prostredníctvom kolapsu protónového potenciálu mitochondriálnej membrány. V súčasnosti prebieha výskum možností cielenej terapie arzénom, či už ako derivátov jednoduchých zlúčenín arzénu (organoarzenité zlúčeniny), alebo pomocou targetingu – selektívnej akumulácie v cieľových tkanivách (napr. enkapsulácia v lipozómoch, nanočastice, kontrolované uvoľňovanie liečiva v závislosti od pH prostredia a pod.).
Komplexy vanádu, pôvodne skúmané predovšetkým v súvislosti s ich inzulínomimetickou aktivitou, boli neskôr identifikované ako účinné cytostatiká63, 64). Podobne ako pri ich antidiabetickom účinku aj ich protirakovinová aktivita zrejme súvisí s interakciou s bunkovými signálnymi dráhami na základe biochemickej podobnosti hydratovaného vanadylového iónu s fosforečnanovým aniónom (fosfátom), napr. inhibícia PTPáz. V mnohých prípadoch pritom dochádza v bunke k hydrolýze pôvodných komplexov vanádu a uvoľneniu iónovej formy vanádu. Medzi prvými takto skúmaných látkami boli deriváty vanadocénu, s výraznou aktivitou voči Ehrlichovmu ascitickému karcinómu. Niektoré komplexy vanádu vykazujú aktivitu v bunkových kultúrach rezistentných voči cisplatine65). Jedným z najúspešnejších potenciálnych chemoterapeutík na báze vanádu je metvan, oxidovanadičitý komplex obsahujúci substitované fenantrolínové ligandy, so širokým spektrom antineoplastickej aktivity in vitro66).
Perspektívne smery vo vývoji chemoterapeutík na báze kovov
Napriek mnohým dosiahnutým úspechom vo vývoji antineoplastických metalofarmák je ich využitie limitované faktormi, ako sú výrazné nežiadúce účinky, výskyt rezistencie (inherentnej alebo získanej), problémy s biodostupnosťou (nutnosť intravenóznej aplikácie), nízka rozpustnosť vo vode a pod. Okrem prístupov k riešeniu týchto problémov načrtnutých v sekcii Komplexy platiny s nekonvenčnou štruktúrou existuje rad ďalších, zahrňujúcich nové, inovatívne koncepcie. Kým prvé metalofarmaká boli objavené prevažne náhodne, v dnešnej dobe rastie význam cieleného vývoja liečiv s požadovanými chemickými a farmakologickými vlastnosťami na základe vzťahov medzi štruktúrou a aktivitou bioaktívnych komplexov. Dôležitá je znalosť cieľových štruktúr pre dané ochorenie, pričom významnú pomoc pri jeho identifikácii môžu poskytnúť proteomika a genomika67). Metalomika ako súčasť bioanorganickej chémie popisuje všetky chemické formy v ktorých sa viažu dané kovy v bunkách jednotlivých orgánov/tkanív, ako aj ich resorpciu, transport, funkciu, exkréciu a interakciu s metabolómom, proteómom a genómom.
Modernou stratégiou racionálneho dizajnu metalofarmák je spojenie viacerých farmakoforov v jednej molekule, umožňujúce súčasný účinok na viaceré cieľové štruktúry (duálne liečivá). Príkladom sú komplexy kovov obsahujúce malé planárne hydrofóbne molekuly, akými sú polycyklické aromáty (interkalátory). Takéto molekuly majú schopnosť vsunúť sa medzi susedné páry báz DNA, a indukovať tak apoptotické procesy68). Liečivá tohto typu teda disponujú dvomi nezávislými mechanizmami účinku: kovalentným prepojením susedných báz DNA a nekovalentnou interkaláciou medzi bázy DNA. Podobnou stratégiou je i konjugácia komplexov kovov s bioaktívnymi ligandmi, napr. s farmakologicky účinnými prírodnými látkami69).
Jedným zo zásadných trendov súčasnosti je vývoj liečiv so zvýšenou akumuláciou v bunkách tumorov v porovnaní so zdravým tkanivom. Takýto efekt je možné dosiahnuť cieleným prísunom liečiva pomocou vhodného nosiča so zvýšenou afinitou k rakovinovým bunkám, na základe rozdielnych biochemických charakteristík samotných buniek, alebo tkaniva tumoru ako celku (mikroprostredie tumoru)70). Značne atraktívnym sa javí byť využitie zníženého pH mnohých pevných tumorov (kyslé prostredie). V prípade takýchto komplexov sa jedná v podstate o prekurzory uvoľňujúce aktívnu formu liečiva v závislosti od pH prostredia. Ďalšou možnosťou sú prekurzory liečiv aktivované zmenou redoxného potenciálu prostredia. Viaceré druhy tumorov vykazujú redukujúce vnútrobunkové prostredie, spôsobené najmä zvýšenou koncentráciou glutatiónu v rakovinových bunkách. Typickým príkladom je redukcia relatívne biologicky inertných platičitých komplexov na platnaté, prípadne ruténitých komplexov na ruténaté.
V súčasnosti tiež pozorujeme zvýšený záujem o komplexy kovov zamerané na „netradičné“ cieľové štruktúry. Takéto liečivá namiesto väzby na DNA využívajú napr. interakciu s proteínmi, či už kovalentnú, alebo nekovalentnú (napr. inhibícia enzýmov)71). Pri iných liečivách, ako napr. niektorých komplexoch ruténia, nie je primárnou vlastnosťou ich cytotoxicita ako u „klasických“ komplexov platiny, ale ich antimetastatický účinok. Ďalšie komplexy môžu pôsobiť proti vytváraniu vlásočníc v tkanive tumoru (angiogenéza), pokrývajúcich nadmerné energetické nároky rakovinových buniek.
Antineoplastické metalofarmaká môžu byť konjugované s biomolekulami, alebo naviazané na nanočastice72). Takáto stratégia umožňuje zvýšiť rozpustnosť a biodostupnosť, ako aj napomáhať selektívnej akumulácii komplexu kovu v rakovinových bunkách. Biomolekuly najčastejšie používané ako nosiče sú predovšetkým peptidy a proteíny, ktoré navyše potenciálne umožňujú aj cielenú terapiu prostredníctvom väzby na tumorové markery, najmä v prípade protilátok. Taktiež je možné uzavretie metalofarmák do lipozómov/miciel. Najúspešnejším takýmto liečivom je lipoplatina, lipozomálna formulácia cisplatiny, zabezpečujúca jej pomalé uvoľňovanie do prostredia (biologický polčas in vivo asi 120 h). Lipoplatina tiež znižuje toxické systémové účinky cisplatiny a zvyšuje jej akumuláciu v tkanive tumorov v porovnaní so zdravým tkanivom.
Na aktivácii komplexných zlúčenín viditeľným svetlom je založená fotodynamická terapia73). Pri tejto terapii je aplikovaná netoxická alebo málo toxická zlúčenina (fotosenzibilizátor), ktorá sa akumuluje prednostne v rakovinových bunkách. Po dosiahnutí dostatočnej akumulácie je tkanivo ožarované svetlom vo forme laseru emitujúceho pri vhodnej vlnovej dĺžke, pričom dochádza k premene pôvodnej zlúčeniny (prekurzoru) na aktívnu formu liečiva. Takto aktivovaná zlúčenina pôsobí poškodenie rakovinových buniek, spravidla prostredníctvom tvorby reaktívnych foriem kyslíka a iných radikálov. Fotosenzibilizátory môžu byť organické zlúčeniny aj koordinačné zlúčeniny kovov. Komplexné zlúčeniny často obsahujú ligandy porfyrínového typu. Príkladom iného typu komplexu je zlúčenina TLD1433, ruténatý komplex obsahujúci viaceré heteroaromatické ligandy74). Tento komplex nedávno postúpil do štádia klinických skúšok proti uroteliálnemu karcinómu. Výhodou metódy je i minimálna toxicita voči zdravému tkanivu. Je použiteľná aj v terapii viacerých iných ochorení, ako sú napr. psoriáza alebo makulárna degenerácia.
Záver
Malígne ochorenia dnes patria k vedúcim príčinám úmrtí v celosvetovom meradle. Aplikácia koordinačných zlúčenín kovov v terapii rakoviny predstavuje zrejme najperspektívnejšiu a najintenzívnejšie sa rozvíjajúcu oblasť medicínskej anorganickej chémie. Popri komplexoch platiny, patriacich dnes už medzi „klasické“ chemoterapeutiká, priťahujú čoraz väčší záujem aj zlúčeniny iných kovov s antineoplastickými účinkami, v súčasnosti predovšetkým komplexy ruténia. K aktuálnym smerom výskumu patrí aj využitie cielenej terapie a administrácia liečiv vo forme prekurzorov s nízkou toxicitou. Zlepšenie terapeutickej účinnosti pri súčasnom znížení systémovej toxicity liečiv sú ciele, ktoré si vyžadujú predovšetkým dôkladnú znalosť biologických cieľových štruktúr a mechanizmov ich interakcie s metalofarmakami. Oblasť antineoplastických metalofarmák predstavuje veľmi širokú interdisciplinárnu oblasť výskumu, využívajúcu poznatky anorganickej, farmaceutickej a analytickej chémie, ako aj biochémie a molekulárnej biológie.
Práca bola podporovaná Vedeckou grantovou agentúrou MŠVVaŠ SR a SAV, grant VEGA 1/0346/16.
Konflikt záujmov: žiadny.
Ing. Ladislav Habala, PhD. (∗) • J. Valentová
Katedra chemickej teórie liečiv, Farmaceutická fakulta UK
Odbojárov 10, 832 32 Bratislava, SR
e-mail: habala@fpharm.uniba.sk
Zdroje
1. Habala L., Valentová J. Komplexy kovov v medicíne a farmácii – minulosť a súčasnosť I. Čes. slov. Farm. 2018; 67, 182–191.
2. DeVita V. T., Chu E. A history of cancer chemotherapy. Cancer Res. 2008; 68, 8643‒8653.
3. Papac R. J. Origins of cancer therapy. Yale J. Biol. Med. 2001; 74, 391‒398.
4. Hajdu S. I. 2000 years of chemotherapy of tumors. Cancer 2005; 103, 1097‒1102.
5. Morrison W. B. Cancer chemotherapy: An annotated history. J. Vet. Intern. Med. 2010; 24, 1249‒1262.
6. Gilman A. The initial clinical trial of nitrogen mustard. Am. J. Surg. 1963; 105, 574‒578.
7. Humphrey R. W., Brockway-Lunardi L. M., Bonk D. T., Dohoney K. M., Doroshow J. H., Meech S. J., Ratain M. J., Topalian S. L., Pardoll D. M. Opportunities and challenges in the development of experimental drug combinations for cancer. J. Natl. Cancer Inst. 2011; 103, 1222‒1226.
8. Oktábec Z., Jampílek J. Stručná historie chemoterapie. Chem. Listy 2013; 107, 151‒159.
9. Ghosh S. Cisplatin: The first metal based anticancer drug. Bioorg. Chem. 2019; 88, 102925.
10. Lippert B. Cisplatin: Chemistry and biochemistry of a leading anticancer drug. Zürich: Verlag Helvetica Chimica Acta 1999.
11. Peyron M. Ueber die Einwirkung des Ammoniaks auf Platinchlorür. Ann. Chem. Pharm. 1844; 51, 1‒29.
12. Barry N. P. E., Sadler P. J. 100 years of metal coordination chemistry: from Alfred Werner to anticancer metallodrugs. Pure Appl. Chem. 2014; 86, 1897‒1910.
13. Muggia F. M., Bonetti A., Hoeschele J. D., Rozencweig M., Howell S. B. Platinum antitumor complexes: 50 years since Barnett Rosenberg’s discovery. J. Clin. Oncol. 2015; 33, 4219‒4226.
14. Grimley E. Discovery and identification of the first platinum anticancer compound. Inorg. Chim. Acta 2019; 495, 118986.
15. Wilson J. J., Lippard S. J. Synthetic methods for the preparation of platinum anticancer complexes. Chem. Rev. 2014; 114, 4470–4495.
16. Motzer R. J. Optimal treatment for advanced seminoma? Cancer 1993; 72, 3–4.
17. Marloye M., Berger G., Gelbcke M., Dufrasne F. A survey of the mechanisms of action of anticancer transition metal complexes. Future Med. Chem. 2016; 8, 2263–2286.
18. Wexselblatt E., Yavin E., Gibson D. Cellular interactions of platinum drugs. Inorg. Chim. Acta 2012; 393, 75–83.
19. Arnesano F., Losacco M., Natile G. An updated view of cisplatin transport. Eur. J. Inorg. Chem. 2013; 2013, 2701–2711.
20. Arnesano F., Nardella M. I., Natile G. Platinum drugs, copper transporters and copper chelators. Coord. Chem. Rev. 2018; 374, 254–260.
21. Yu J. J. Unlocking the molecular mechanisms of DNA repair and platinum drug resistance in cancer chemotherapy. Curr. Drug Ther. 2009; 4, 19–28.
22. Bergamo A., Dyson P. J., Sava G. The mechanism of tumour cell death by metal-based anticancer drugs is not only a matter of DNA interactions. Coord. Chem. Rev. 2018; 360, 17–33.
23. Wang X., Guo Z. The role of sulfur in platinum anticancer chemotherapy. Anti-Cancer Agents Med. Chem. 2007; 7, 19–34.
24. Galluzzi L., Senovilla L., Vitale I., Michels J., Martins I., Kepp O., Castedo M., Kroemer G. Molecular mechanisms of cisplatin resistance. Oncogene 2012; 31, 1869–1883.
25. Florea A.-M., Büsselberg D. Cisplatin as an anti-tumor drug: cellular mechanisms of activity, drug resistance and induced side effects. Cancers 2011; 3, 1351–1371.
26. Dilruba S., Kalayda G. V. Platinum-based drugs: past, present and future. Cancer Chemother. Pharmacol. 2016; 77, 1103–1124.
27. Di Pasqua A. J., Goodisman J., Dabrowiak J. C. Understanding how the platinum anticancer drug carboplatin works: From the bottle to the cell. Inorg. Chim. Acta 2012; 389, 29–35.
28. Alcindor T., Beauger N. Oxaliplatin: a review in the era of molecularly targeted therapy. Curr. Oncol. 2011; 18, 18–25.
29. Cai L., Yu C., Ba L., Liu Q., Qian Y., Yang B., Gao C. Anticancer platinum-based complexes with non-classical structures. Appl. Organomet. Chem. 2018; 32, e4228.
30. Montaña Á. M., Batalla C. The rational design of anticancer platinum complexes: the importance of the structure-activity relationship. Curr. Med. Chem. 2009; 16, 2235–2260.
31. Coluccia M., Natile G. Trans-platinum complexes in cancer therapy. Anti-Cancer Agents Med. Chem. 2007; 7, 111–123.
32. Wheate N. J., Collins J. G. Multi-nuclear platinum drugs: a new paradigm in chemotherapy. Curr. Med. Chem. Anti-Cancer Agents 2005; 5, 267–279.
33. Ravera M., Gabano E., McGlinchey M. J., Osella D. A view on multi-action Pt(IV) antitumor prodrugs. Inorg. Chim. Acta 2009; 492, 32–47.
34. Gibson D. Multi-action Pt(IV) anticancer agents; do we understand how they work? J. Inorg. Biochem. 2019; 191, 77–84.
35. Medici S., Peana M., Nurchi V. M., Lachowicz J. I., Crisponi G., Zoroddu M. A. Noble metals in medicine: Latest advances. Coord. Chem. Rev. 2015; 284, 329‒350.
36. Simpson P. V., Desai N. M., Casari I., Massi M., Falasca M. Metal-based antitumor compounds: beyond cisplatin. Future Med. Chem. 2019; 11, 119‒135.
37. Trudu F., Amato F., Vaňhara P., Pivetta P., Peña-Méndez E. M., Havel J. Coordination compounds in cancer: past, present and perspectives. Future Med. Chem. J. Appl. Biomed. 2015; 13, 79‒103.
38. Kostova I. Ruthenium complexes as anticancer agents. Curr. Med. Chem. 2006; 13, 1085‒1107.
39. Bergamo A., Gaiddon C., Schellens J. H. M., Beijnen J. H., Sava G. Approaching tumour therapy beyond platinum drugs. Status of the art and perspectives of ruthenium drug candidates. J. Inorg. Biochem. 2012; 106, 90‒99.
40. Coverdale J. P. C., Laroiya-McCarron T., Romero-Canelón I. Designing ruthenium anticancer drugs: what have we learnt from the key drug candidates? Inorganics 2019; 7, 31.
41. Alessio E., Messori L. NAMI-A and KP1019/1339, two iconic ruthenium anticancer drug candidates face-to-face: a case story in medicinal inorganic chemistry. Molecules 2019; 24, 1995.
42. Brabec V., Kasparkova J. Ruthenium coordination compounds of biological and biomedical significance. DNA binding agents. Coord. Chem. Rev. 2018; 376, 75‒94.
43. Graf N., Lippard S. J. Redox activation of metal-based prodrugs as a strategy for drug delivery. Adv. Drug Deliv. Rev. 2012; 64, 993‒1004.
44. Thota S., Rodrigues D. A., Crans D. C., Barreiro E. J. Ru(II) compounds: next-generation anticancer metallotherapeutics? J. Med. Chem. 2018; 61, 5805‒5821.
45. Garoufis A., Hadjikakou S. K., Hadjiliadis N. Palladium coordination compounds as anti-viral, anti-fungal, anti-microbial and anti-tumor agents. Coord. Chem. Rev. 2009; 253, 1384‒1397.
46. Fischer-Fodor E., Mikláš R., Rišiaňová L., Cenariu M., Grosu I. G., Virag P., Perde-Schrepler M., Tomuleasa C., Berindan-Neagoe I., Devínsky F., Miklášová N. Novel palladium(II) complexes that influence prominin-1/CD133 expression and stem cell factor release in tumor cells. Molecules 2017; 22, 561.
47. Alam M. N., Huq F. Comprehensive review on tumour active palladium compounds and structure-activity relationships. Coord. Chem. Rev. 2016; 316, 36–67.
48. Kostova I. Titanium and vanadium complexes as anticancer agents. Anti-Cancer Agents Med. Chem. 2009; 9, 827‒842.
49. Bowman D. C. The amazingly versatile titanocene derivatives. J. Chem. Ed. 2006; 83, 735‒740.
50. Skoupilová H., Hrstka R. Pokroky ve využití organokovových sloučenin při vývoji protinádorových léčiv. Klin. Onkol. 2019; 32(Suppl 3), 3S25–3S33.
51. Buettner K. M., Valentine A. M. Bioinorganic chemistry of titanium. Chem. Rev. 2012; 112, 1863–1881.
52. Olszewski U., Hamilton G. Mechanisms of cytotoxicity of anticancer titanocenes. Anti-Cancer Agents Med. Chem. 2010; 10, 302–311.
53. Tshuva E. Y., Ashenhurst J. A. Cytotoxic titanium(IV) complexes: renaissance. Eur. J. Inorg. Chem. 2009; 2009, 2203–2218.
54. Jakupec, M. A., Keppler B. K. Gallium in cancer treatment. Curr. Top. Med. Chem. 2004; 4, 1575–1583.
55. Lessa J. A., Parrilha G. L., Beraldo H. Gallium complexes as new promising metallodrug candidates. Inorg. Chim. Acta 2012; 393, 53–63.
56. Timerbaev A. R. Advances in developing tris(8-quinolinolato)gallium(III) as an anticancer drug: critical appraisal and prospects. Metallomics 2009; 1, 193–198.
57. Devi J., Yadav J. Recent advancements in organotin(IV) complexes as potential anticancer agents. Anti-Cancer Agents Med. Chem. 2018; 18, 335–353.
58. Niu L., Li Y., Li Q. Medicinal properties of organotin compounds and their limitations caused by toxicity. Inorg. Chim. Acta 2014; 423, 2–13.
59. Ott I. On the medicinal chemistry of gold complexes as anticancer drugs. Coord. Chem. Rev. 2009; 253, 1670–1681.
60. Onodera T., Momose I., Kawada M. Potential anticancer activity of auranofin. Chem. Pharm. Bull. 2019; 67, 186–191.
61. Hoonjan M., Jadhav V., Bhatt P. Arsenic trioxide: insights into its evolution to an anticancer agent. J. Biol. Inorg. Chem. 2018; 23, 313–329.
62. Dilda P. J., Hogg P. J. Arsenical-based cancer drugs. Cancer Treat. Rev. 2007; 33, 542–564.
63. Bishayee A., Waghray A., Patel M. A., Chatterjee M. Vanadium in the detection, prevention and treatment of cancer: the in vivo evidence. Cancer Lett. 2010; 294, 1–12.
64. Pessoa J. C., Etcheverry S., Gambino D. Vanadium compounds in medicine. Coord. Chem. Rev. 2015; 301–302, 24–48.
65. Habala L., Bartel C., Giester G., Jakupec M. A., Keppler B. K., Rompel A. Complexes of N-hydroxyethyl-N-benzimidazolylmethylethylenediaminediacetic acid with group 12 metals and vanadium – synthesis, structure and bioactivity of the vanadium complex. J. Inorg. Biochem. 2015; 147, 147–152.
66. D’Cruz O. J., Uckun F. M. Metvan: a novel oxovanadium(IV) complex with broad spectrum anticancer activity. Expert Opin. Investig. Drugs 2002; 11, 1829–1836.
67. Sutton E. C., McDevitt C. E., Yglesias M. V., Cunningham R. M., DeRose V. J. Tracking the cellular targets of platinum anticancer drugs: current tools and emergent methods. Inorg. Chim. Acta 2019; 498, 118984.
68. Deo K. M., Pages B. J., Ang D. L., Gordon C. P., Aldrich-Wright J. R. Transition metal intercalators as anticancer agents – recent advances. Int. J. Mol. Sci. 2016; 17, 1818.
69. Ma D.-L., Wu C., Cheng S.-S., Lee F.-W., Han Q.-B., Leung C.-H. Development of natural product-conjugated metal complexes as cancer therapies. Int. J. Mol. Sci. 2019; 20, 341.
70. Wang X., Wang X., Jin S., Muhammad N., Guo Z. Stimuli-responsive therapeutic metallodrugs. Chem. Rev. 2019; 119, 1138‒1192.
71. Meggers E. Targeting proteins with metal complexes. Chem. Commun. 2009; 1001‒1010.
72. Poursharifi M., Wlodarczyk M. T., Mieszawska A. J. Nano-based systems and biomacromolecules as carriers for metallodrugs in anticancer therapy. Inorganics 2019; 7, 2.
73. Imberti C., Zhang P., Huang H., Sadler P. J. New designs for phototherapeutic transition metal complexes. Angew. Chem. Int. Ed. 2019; 58, 2‒15.
74. Munro S., Colón K. L., Yin H., Roque J., Konda P., Gujar S., Thummel R. P., Lilge L., Cameron C. G., McFarland S. A. Transition metal complexes and photodynamic therapy from a tumor-centered approach: challenges, opportunities, and highlights from the development of TLD1433. Chem. Rev. 2019; 119, 797‒828.
Štítky
Farmacie Farmakologie
Článek Zomrel Alois Borovanský
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2020 Číslo 1- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Farmakokinetické aspekty terapie beta-laktamovými antibiotiky u kriticky nemocných pacientů: Zkušenosti jednoho centra s TDM
- Dvojitě obalené pelety se semipermeabilním obalem z ethylcelulosy určené k detekci inhibitorů cholinesteras
- Komplexy kovov v medicíne a farmácii – minulosť a súčasnosť II*
- Vývoj a hodnocení stejnoměrnosti žvýkacích gum s nízkou dávkou léčiv připravených lisováním
- Výzkum kompatibility kyseliny thioktové, magnesium-stearátu a pyridoxin-hydrochloridu
- Složení aminokyselin a sacharidů v nati a kořenech Smallanthus sonchifolius
- K životnému jubileu pani doc. RNDr. Zuzany Vitkovej, CSc.
- Životné jubileum prof. RNDr. Daniela Grančaia, CSc.
- Zomrel Alois Borovanský
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Komplexy kovov v medicíne a farmácii – minulosť a súčasnosť II*
- Farmakokinetické aspekty terapie beta-laktamovými antibiotiky u kriticky nemocných pacientů: Zkušenosti jednoho centra s TDM
- Výzkum kompatibility kyseliny thioktové, magnesium-stearátu a pyridoxin-hydrochloridu
- Zomrel Alois Borovanský
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



