-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Signálne dráhy bunkovej proliferácie a smrti ako ciele potenciálnych chemoterapeutík
Signal pathways of cell proliferation and death as targets of potential chemotherapeutics
The purpose of this paper is to review current information concerning signal transduction pathways of cell proliferation and cell death applicable in the research of antitumor compounds with a specific effect. Actually, cancer counts among the world gravest diseases. Research of the mechanisms of action of chemotherapeutics helps us to find compounds with high cytotoxic activity to tumor cells and low or no cytotoxicity to normal cells. Many present studies deal with the ability of drugs to hit the proliferation signal pathways or cell death pathways specifically. Various proliferation signal pathways have been identified, e.g. pathways of mitogen-activated proteinkinases. In original studies, cell death was considered to perform in necrotic and apoptotic forms, whereas in contrast to necrosis, apoptosis represented the programmed process. However, other forms of programmed cell death were discovered, the programmed necrosis and autophagic cell death. Similarly, beside the intrinsic, mitochondrial-mediated, and extrinsic, receptor-mediated pathways, new mechanisms of induction of apoptosis were discovered: the endoplasmic reticulum stress pathway in which calcium plays an important role, the lysosomal pathway and the ceramide-induced pathway. Current information concerning transduction of antiproliferative and death stimuli in cells allows to explain the mechanisms of action of known drugs and also brings novel therapeutical targets which can serve in treatment of such diseases as cancer.
Key words:
cell proliferation – MAPK – programmed cell death – apoptotic pathways
Autoři: A. Repický 1; S. Jantová 1; V. Milata 2
Působiště autorů: Slovenská technická univerzita v Bratislave, Fakulta chemickej a potravinárskej technológie, Ústav biochémie, výživy a ochrany zdravia 1; Slovenská technická univerzita Bratislava, Fakulta chemickej a potravinárskej technológie, Ústav organickej chémie, katalýzy a petrochémie 2
Vyšlo v časopise: Čes. slov. Farm., 2008; 57, 4-10
Kategorie: Přehledy a odborná sdělení
Souhrn
Cieľom práce je poskytnúť stručný prehľad najnovších poznatkov týkajúcich sa signálnej transdukcie, ktoré sú využiteľné pre štúdium špecificky pôsobiacich protinádorových látok so zameraním na bunkovú proliferáciu a bunkovú smrť. Onkologické ochorenia patria v súčasnosti medzi najzávažnejšie ochorenia. Výskum mechanizmu účinku liečiv, chemoterapeutík, napomáha hľadať látky s vysokou cytotoxickou aktivitou, ktoré by zároveň v čo najmenšej miere ovplyvňovali normálne zdravé bunky. Mnohé súčasné práce sa zaoberajú schopnosťou látok špecificky zasahovať do signálnych dráh proliferácie alebo bunkovej smrti. V súvislosti s proliferáciou sa identifikovali viaceré signálne dráhy, napr. signálne dráhy mitogénom aktivovaných proteínkináz. Bunková smrť sa podľa pôvodných štúdii rozdeľovala na nekrotickú a apoptotickú formu smrti, pričom apoptóza, na rozdiel od nekrózy, predstavuje programovaný proces. Okrem apoptózy sa však identifikovali aj iné alternatívne formy programovanej smrti, a to programovaná nekróza a autofagická bunková smrť. Takisto aj v rámci apoptózy sa okrem mitochondriálnej a receptorovej signálnej dráhy objavili dôkazy o ďalších mechanizmoch. Patria sem vápniková signálna dráha súvisiaca s endoplazmovým retikulom, lyzozomálna a ceramidová signálna dráha. Doterajšie poznatky týkajúce sa prenosu antiproliferačných a smrtiacich signálov v bunke pomáhajú vysvetliť pôsobenie liečiv a takisto tiež prinášajú nové terapeutické ciele, ktoré môžu slúžiť pre liečbu takých ochorení ako je napr. malignita.
Kľúčové slová:
bunková proliferácia – MAPK – programovaná bunková smrť – signálne dráhy apoptózyNádorové ochorenia predstavujú v súčasnosti jedno z najzávažnejších rizík ohrozujúcich život človeka. Onkologickému výskumu sa preto celosvetovo venuje zvýšená pozornosť.
V liečbe nádorových ochorení majú svoje nezastupiteľné postavenie látky s protinádorovou aktivitou, chemoterapeutiká. Výraznou komplikáciou takejto liečby je však vznik a rozvoj rezistencie na súčasné liečivá. Rezistencia tak predstavuje jeden z hlavných impulzov v objavovaní nových prírodných alebo syntetických protinádorových látok.
Výskum mechanizmu účinku liečiv napomáha hľadať látky s vysokou cytotoxickou aktivitou, ktoré by zároveň v čo najmenšej miere ovplyvňovali normálne zdravé bunky. Mnohé súčasné práce sa zaoberajú schopnosťou látok špecificky zasahovať do signálnych dráh proliferácie alebo bunkovej smrti, hlavne apoptózy 1).
Bunková proliferácia – signálne dráhy bunkovej proliferácie
Zmeny v signálnych dráhach bunkovej proliferácie vedú často k závažným ochoreniam, ako je napr. malignita. Pri zlúčeninách s antiproliferačnými účinkami sa v poslednej dobe charakterizuje ich schopnosť zasahovať do signálnych dráh bunkového rastu, diferenciácie a smrti bunky.
Stimulácia rastovým faktorom aktivuje v bunke tri základné typy signálnej transdukcie. Patrí sem mitogénom aktivovaný proteínkinázový (MAPK) mechanizmus, mechanizmus spojený s proteínkinázou-C (PKC) a mechanizmus aktivácie Janusovej tyrozínkinázy a signálneho transduktora a aktivátora transkripcie JAK/STAT 2).
MAPK (obr. 1) predstavuje rodinu eukaryotických evolučne konzervovaných Ser/Thr proteínových kináz, ktoré sú zapojené tak v bunkovej proliferácii ako aj v diferenciácii a smrti bunky. Do tejto rodiny patria MAPK/ERK, p38MAPK a SAPK/JNK. Signálna kaskáda MAPK/ERK je aktivovaná cez tyrozínkinázové receptory, integríny a iónové kanály. Aktívny dimér ERK reguluje viaceré transkripčné faktory regulujúce génovú expresiu proteínov zodpovedných za bunkovú proliferáciu, diferenciáciu, metastázovanie a angiogenézu 3). p38MAPK(α, β, γ a δ) sú aktivované ionizačným žiarením, teplom, oxidačným a osmotickým stresom, zápalovými cytokínmi a receptormi TNF. Aktívne formy p38MAPK fosforylujú viaceré jadrové transkripčné faktory produkcie cytokínov a nepriamo aktivujú šaperónové proteíny Hsp27, ktoré súvisia s prestavbou aktívneho cytoskeletu pri bunkovom strese 4). Signálna dráha stresom aktivovanej proteínkinázy a c-Jun N-terminálnej kinázy, SAPK/JNK, je aktivovaná UV a γ-žiarením, ceramidom, zápalovými cytokínmi a rastovými faktormi. SAPK/JNK je zodpovedná za aktiváciu transkripčných faktorov proliferácie a diferenciácie ako aj proapoptotického p53 5).
Obr. 1. Signálna dráha mitogénom aktivovaných proteínkináz 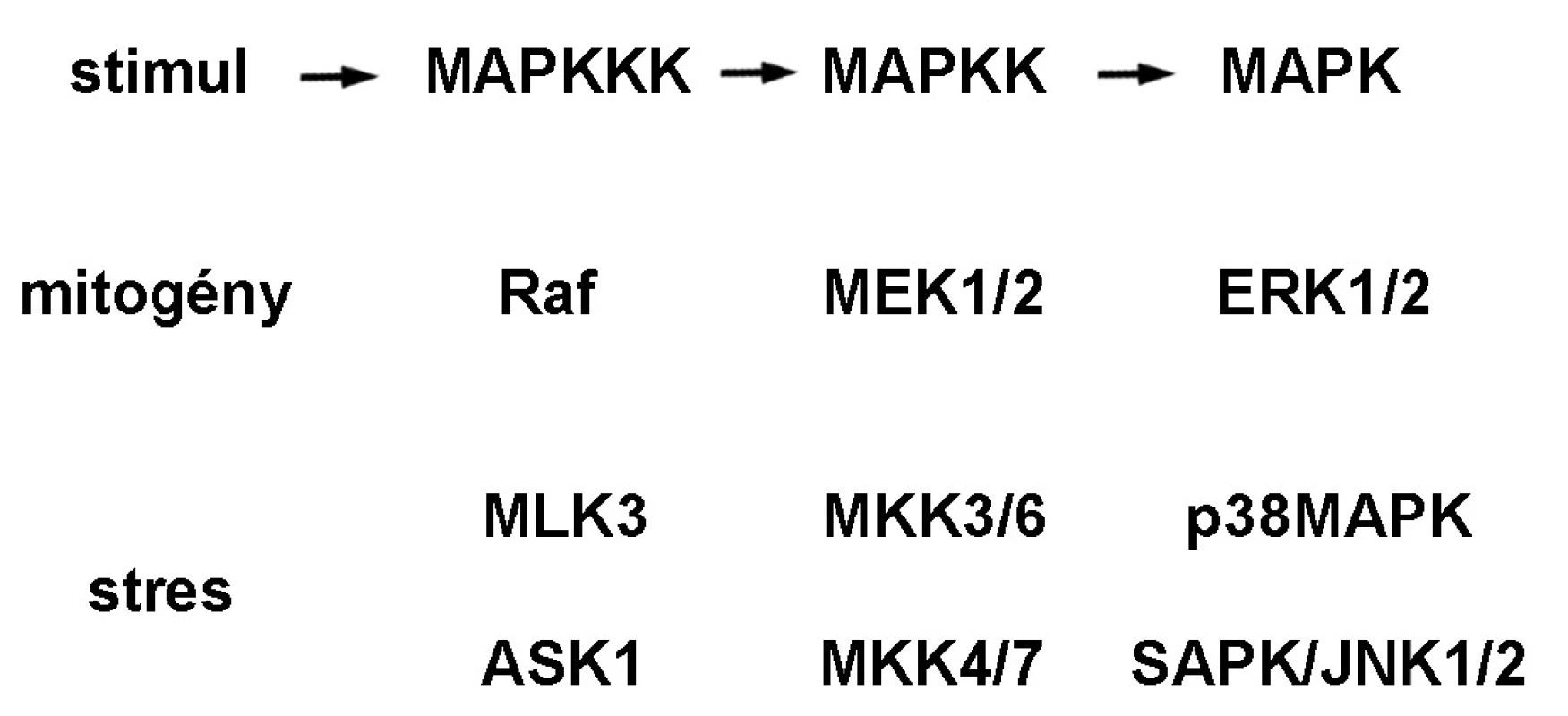
Ser/Thr kinázy PKC sú zahrnuté v bukovej proliferácii a diferenciácii, ako aj v bunkovej transformácii a karcinogenéze. Hlavným regulátorom PKC je fosfolipid diacylglycerol, ktorý viaže PKC na cytoplazmovú membránu. Aktívna PKC potom fosforyluje ďalšie kinázy vrátane rodiny MAPK 6).
JAK/STAT sa aktivuje interakciou špecifických cytokínov s príslušnými receptormi. Väzba cytokínu na receptor spôsobuje jeho dimerizáciu a naviazanie JAK. Vysoká koncentrácia JAK na receptore spôsobuje krížové fosforylácie, pri ktorých sa fosforyluje samotný receptor, ktorý v takejto forme aktivuje STAT. STAT potom aktivuje viaceré kinázy a po translokácii do jadra priamo moduluje transkripciu 7). Porušenie JAK/STAT signalizácie súvisí s rozvojom takých ochorení, ako sú autoimunitné ochorenia a malignita.
Bunková smrť
Normálna bunka prekonáva za fyziologických podmienok určité zmeny, pričom zostáva v dynamickej rovnováhe, ktorá sa označuje ako normálna homeostáza. V prípade veľkej záťaže alebo nedostatočnej adaptácie dochádza k poškodeniu bunky, a to vratnému alebo nevratnému, ktoré vedie k bunkovej smrti 8).
Klasická štúdia Kerr et al. 9) ukázala, že bunka môže zomierať minimálne dvoma spôsobmi. Prvým je nekróza, náhla a rýchla forma smrti. Značne odlišný spôsob bunkovej smrti predstavuje apoptóza. Prvé charakteristiky považovali nekrózu za náhodné, nekontrolované poškodenie, kým apoptóza prezentovala charakteristiky programovanej smrti. Mnoho výskumných skupín začalo považovať apoptózu a programovanú bunkovú smrť za jedno, a to isté, napriek odôvodnenej kritike priekopníkov v tejto oblasti. Sú však dôkazy, že existujú alternatívne formy bunkovej smrti, ako aj dôkazy o prelínaní vnútrobunkových procesov degenerácie bunky. Alternatívne neapoptotické formy programovanej smrti sa klasifikovali ako autofagická bunková smrť a programovaná nekróza (obr. 2).
Obr. 2. Morfologické znaky normálnej (a), autofagickej (b), apoptotickej (c) a nekrotickej bunky (d) 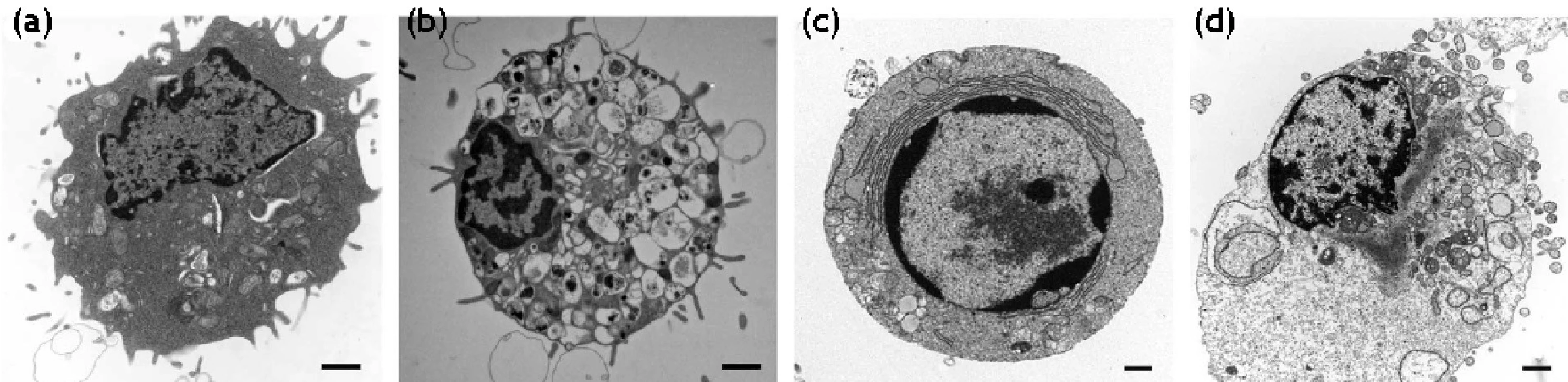
Dôkazy o existencii ďalších neapoptotických formách programovanej smrti tak podporujú úsilie viacerých odborníkov odlišovať pojmy apoptóza a programovaná bunková smrť. Akceptácia minimalistickej definície programovanej smrti ako sekvencie udalostí vychádzajúcich z bunkového metabolizmu, ktoré vedú k bunkovej deštrukcii tak prisudzuje zodpovedajúcu váhu alternatívnym formám programovanej bunkovej smrti, aj napriek výraznej dominancii apoptózy v literatúre.
Nekróza
Nekróza je patologický proces, ku ktorému dochádza v rôznych tkanivách v dôsledku závažnej hypoxie, ischémie alebo pri autolýze. Taktiež môže byť následkom poškodenia cytoplazmovej membrány komplementom, traumy, pôsobenia niektorých toxínov, alebo veľkej dávky žiarenia 10). Nekrózu spôsobujú inhibítory metabolizmu, reaktívne metabolity kyslíka, rôzne toxické látky a inhibítory iónových púmp. Nekrotické bunky sú charakteristické viacerými morfologickými prejavmi. Tie sa spočiatku prejavujú na mitochondriách, ktoré sa zväčšujú, pričom vzniká zrnitý matrix a na endoplazmovom retikule, ktoré sa rozťahuje, pričom sa uvoľňujú ribozómy. Postupne sa pozoruje zväčšovanie objemu bunky, zhlukovanie a postupné miznutie až strata chromatínu. V poslednej fáze dochádza k rozpadu bunky a uvoľneniu jej obsahu do okolitého prostredia, čo v organizme vyvoláva zápalovú reakciu. Počas nekrózy sa sledujú aj viaceré biochemické prejavy. V prvých štádiách dochádza k zlyhaniu regulácie membránového transportu, čo má za následok zvýšenie koncentrácie vnútrobunkového Ca2+, a z toho vyplývajúcu aktiváciu niektorých membránových fosfolipáz. Dochádza k nepravidelnej fragmentácii DNA, deplécii ATP a celkovému zrúteniu vnútrobunkovej homeostázy. V poslednom štádiu sa rozpadajú lyzozómy, pričom sa uvoľňujú hydrolázy zodpovedné za rozpad bunky.
Programovaná nekróza
Programovaná nekróza sa vo fyziologických podmienkach pozorovala prvýkrát v cicavčích bunkách infikovaných vírusom vakcínie, kedy priebeh bunkovej smrti bol podobný nekróze, pričom však niesol známky programovanej smrti. Nešlo však o apoptózu, pretože tá bola v dôsledku expresie vírusovej genetickej informácie blokovaná vysokou koncentráciou apoptotických inhibítorov. Takáto forma smrti môže byť teda rezervným procesom v prípade zlyhania apoptózy v cicavčích bunkách a môže hrať dôležitú úlohu v boji s mikrobiálnou infekciou 11).
Programovaná nekróza môže byť významná aj pri ochrane organizmu pred akumuláciou buniek s poškodenou DNA. 12). Poškodenie DNA aktivuje opravný proteín PARP, čo vedie k rapídnemu poklesu jadrového aj cytoplazmového NADH, čím sa inhibuje glykolýza. Výsledkom je, že v rýchlo sa deliacich bunkách, ktoré sú závislé od glykolýzy, sa po aktivácii PARP veľmi rýchlo vyčerpá ATP a bunky zomierajú nekrózou.
Programovaná smrť by mohla vysvetľovať účinok niektorých chemoterapeutík, keď bunky zomierali nezávisle od kaspáz 13). Takáto programovaná smrť by teda mohla priniesť nové terapeutické ciele pri liečbe ochorení, pri ktorých je apoptóza blokovaná.
Apoptóza
Apoptóza je programovaný a regulovaný fyziologický proces, ktorý vedie k bunkovej smrti. V organizme sa vyskytuje prirodzene počas embryonálneho alebo postembryonálneho vývoja, pri odstraňovaní buniek T bunkami imunitného systému a homeostáze tkanív. Narušenie rovnováhy medzi proliferáciou a apoptózou vedie k mnohým patologickým procesom, ako sú neurodegeneratívne ochorenie, AIDS alebo malignita 14).
Apoptóza ako súčasť normálneho života eukaryotických organizmov bola pozorovaná už pred viac ako storočím 15). Viditeľné morfologické zmeny buniek a ich miznutie bolo vtedy často jediným dôkazom o prítomnosti bunkovej smrti. Až práca Kerr et al. z roku 1972 9) objasnila a definovala charakteristické znaky apoptózy, ktoré dodnes tvoria základ pre detekciu apoptózy.
Väčšina buniek zomierajúcich v procese apoptózy vykazuje viaceré podobné znaky, pričom niektoré možno pozorovať pomocou svetelného mikroskopu s použitím špecifických farbív, alebo pomocou elektrónového mikroskopu 16). Pomocou svetelného mikroskopu sa pozoruje oddeľovanie bunky od okolia a jej zaokrúhľovanie. Bunka zmenšuje objem cytoplazmy, pričom osmotický tlak v bunke zostáva zachovaný. Dochádza k tvorbe rôznych vychlípenín cytoplazmovej membrány, zmenšovaniu jadra a zhlukovaniu chromatínu. V poslednom štádiu sa bunka dezintegruje do membránou ohraničených apoptotických teliesok. Pomocou elektrónového mikroskopu možno detegovať dilatáciu endoplazmového retikula a agregáciu ribozómov, reorgaizáciu aktínu, rozpad jadrovej lamíny, rozpad intermediárnych filamentov, rozpad a repolymerizáciu mikrotubúl a vznik cytoskeletárnej štruktúry podporujúcej vznik apoptotických teliesok.
Biochemické prejavy apoptózy závisia od typu mechanizmu, ktorým sa apoptóza iniciovala (obr. 3). Mechanizmy indukcie apoptózy predstavujú kaskádu udalostí, ktoré vedú od počiatočného stimulu až k bunkovej smrti. Vo všeobecnosti sa delia na dva druhy 17). Vnútorná, alebo mitochondriálna signálna dráha, reaguje na stimuly vo vnútri bunky, zatiaľ čo vonkajšia, alebo receptorová signálna dráha reaguje na extracelulárne stimuly cez receptory. Hoci sú v týchto dráhach zapojené rozdielne molekuly, existuje tu vzájomná komunikácia na viacerých úrovniach. Posledné štúdie hovoria aj o ďalších signálnych dráhach. Vápniková signálna dráha súvisí so zmenami endoplazmového retikula v stresových podmienkach 18). Lyzozomálna dráha vychádza zase zo zmien v permeabilite membrány lyzozómov 19). Niektoré práce uvádzajú tiež indukciu apoptózy zvýšením vnútrobunkovej koncentrácie ceramidu 20).
Obr. 3. Mechanizmy indukcie apoptózy v bunke 17) 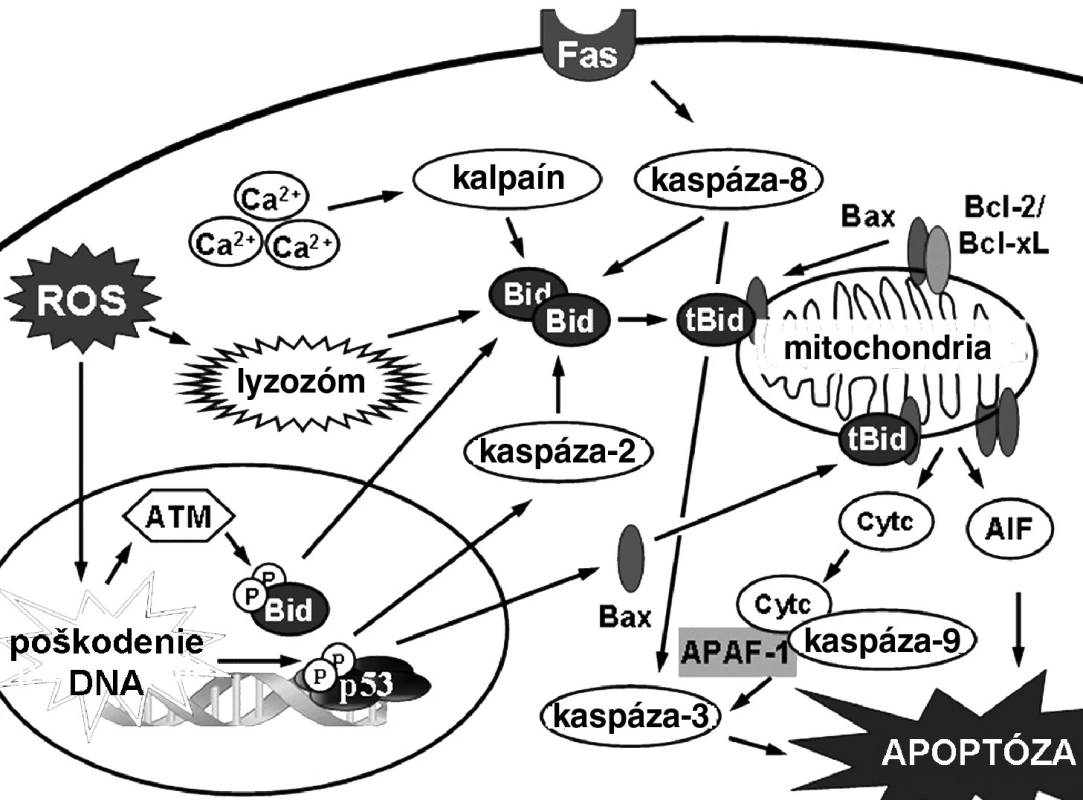
Mitochondrie plnia v eukaryotickej bunke viaceré esenciálne biochemické procesy 21). Správne fungovanie katalytických dejov zabezpečujú dve membrány oddelené medzimembránovým priestorom. Porušenie týchto membrán tak ohrozuje ďalšie prežitie bunky jednak zastavením esenciálnych procesov, ako aj uvoľňovaním molekúl, ktoré participujú na deštrukcii bunky. Mitochondrie teda hrajú dôležitú úlohu v iniciácii bunkovej smrti v procese apoptózy. Mitochondriálna signálna dráha je charakteristická hlavne aktiváciou proapoptotických proteínov z rodiny Bcl-2 proteínov (Bax, Bak), permeabilizáciou mitochondriálnej membrány a poklesom mitochondriálneho potenciálu, uvoľňovaním proapoptotických faktorov (cytochróm-c, AIF, Smac/Diablo, HtrA2/Omi), tvorbou komplexu Apaf-1 a následnou aktiváciou iniciačnej kaspázy-9. Aktivovaná kaspáza-9 ďalej aktivuje kaskádu efektorových kaspáz-3/-6/-7.
Vonkajšia signálna dráha apoptózy je aktivovaná ligáciou receptorov smrti (DR) lokalizovaných na cytoplazmovej membráne špecifickými ligandami. Doteraz bolo identifikovaných šesť DR: TNF-R, CD95, DR3, TRAIL R1, TRAIL-R2 a DR6 22). Všetky tieto receptory sú transmembránové proteíny typu I s opakujúcimi sa extracelulárnymi jednotkami bohatými na cysteín. V intracelulárnej časti obsahujú interakčnú smrtiacu doménu (DD), ktorá zabezpečuje indukciu apoptózy 23). Receptorová signálna dráha apoptózy začína ligáciou receptorov smrti (FAS,TNFR, TRAIL) za vzniku signálneho komplexu indukujúceho smrť (DISC). Cez adaptorový proteín FADD (príp. aj TRADD) sa prenáša apoptotický signál a aktivuje sa iniciačná kaspáza-8/-10. Podľa množstva aktivovanej kaspázy-8 sa apoptóza indukuje dvoma cestami. Ak je DISC v bunkách vytvorený slabo, aktivuje sa len malé množstvo kaspázy-8 a apoptóza je závislá od rozkladu Bid kaspázou-8 na proapoptotický tBid, ktorý permeabilizuje mitochondriálnu membránu. Vysoký stupeň aktivácie na DISC naopak zabezpečuje dostatočnú koncentráciu aktívnej kaspázy 8, ktorá je potom schopná aktivovať kaspázu-3 priamo, bez prepojenia na mitochondriu cez tBid 24).
Aktivácia efektorových kaspáz-3/-6/-7 vedie v konečnom dôsledku k fragmentácii DNA, pričom vznikajú intranukleozomálne dvojvláknové zlomy. Veľkosť fragmentov DNA začína pri 50–300 kbp, ktoré môžu byť ďalej štiepené až na 10–40 kbp fragmenty 25).
Okrem indukcie apoptózy v receptorovej signálnej dráhe cez aktiváciu kaspázy-8/-10, má nezastupiteľnú úlohu spustenie JNK signalizácie 26). Na adaptorových proteínoch FADD a TRADD sa aktivuje signálna kináza 1 pre apoptózu (ASK1), ktorá spúšťa fosforylačnú kaskádu viacerých MAPK vedúcu k aktivácii JNK. Aktivovaná JNK fosforyluje substráty ako c-Jun, p53 a Bim. JNK tiež štiepi Bid. Na rozdiel od produktu štiepenia Bid pomocou kaspázy-8, vzniká iná skrátená forma Bid, nazvaná jBid, ktorá spúšťa selektívne uvoľňovanie Smac z mitochondrie. Následne Smac inhibuje IAPs, čím stimuluje apoptózu.
V poslednej dobre objavujú tiež poznatky o samostatnej skupine receptorov nazvanej „dependence“ receptory 27). Tieto proteíny zahrňujú širokú skupinu štrukturálne značne odlišných proteínov. Ich spoločným znakom je prenos signálov dvoma spôsobmi. V prítomnosti ligandu (pozitívny signál) zabezpečujú prežitie, diferenciáciu, prípadne migráciu buniek, kým v neprítomnosti ligandu (negatívny signál) iniciujú, alebo znásobujú stimuly vedúce k programovanej smrti buniek.
Pre prežitie bunky je kritické udržiavanie vápnikovej homeostázy. Jej narušenie vedie k poškodeniu a smrti bunky 17). V súvislosti s vápnikovou signalizáciou hrá dôležitú úlohu endoplazmové retikulum (ER). Uvoľnenie Ca2+ z ER hrá kritickú úlohu v signálnej dráhe vedúcej k apoptóze. Ca2+ sa uvoľňuje cez ATPázy, ktoré za normálnych podmienok pumpujú Ca2+ do ER. Na ich aktivitu vplývajú molekuly inozitol-3-fosfátu (IP3) a cytoplazmová ADP-ribóza 28). Uvoľnenie Ca2+ spúšťa viaceré procesy smerujúce k bunkovej smrti, vrátane permeabilizácie mitochondriálnej membrány, aktivácie kalpaínu, a tým proapoptotických Bax a Bid, aktivácie kalcineurínu, ktorý podporuje expresiu FasL, aktivácie skrambláz, čím dochádza k expozícii fosfatidylserínu do vonkajšej cytoplazmovej membrány a stimulácie NO syntázy a tvorby ROS.
Okrem uvoľňovania Ca2+, hlavného mediátora apoptózy pri ER strese, existujú aj ďalšie mechanizmy. V bunkách hlodavcov sa nachádza kaspáza-12, ktorá sa zdá byť zapojená v procese indukcie apoptózy. 29). Takýto význam kaspázy-12 je však otázny, keďže v ľudských bunkách sa nenachádza. Najbližší analóg kaspázy-12 v ľudských bunkách je kaspáza-4. Transmembránový proteín v ER Bap31 je schopný asociácie s prokaspázou 8 30). Iný proteín Ire1 aktivuje kinázu ASK1, ktorá následne aktivuje JNK a p38MAPK 31). Tyrozínkináza c Abl sa počas ER stresu translokuje na mitochondriu a spúšťa apoptózu zatiaľ neznámym mechanizmom 32). Ďalším induktorom apoptózy pri ER strese je skotín, ktorý je priamym terčom p53, čo naznačuje prepojenie poškodenia DNA s indukciou apoptózy pri zmenách v ER 33). Pri narušení permeability ER sa podobne ako pri mitochondrii uvoľňujú apoptogénne faktory, o čom svedčí objav proteínu Jafrac2. Ten je za normálnych podmienok súčasťou obsahu ER, ale pri ER strese sa dostáva do cytoplazmy, kde sa viaže s IAPs a znemožňuje ich inhibičnú aktivitu voči kaspázam 34).
V poslednej dobe sa hromadia dôkazy o význame lyzozómov v procese programovanej smrti 35). Doteraz sa predpokladalo, že lyzozómy sa do smrti bunky zapájajú iba v neskorých štádiách nekrózy. Najnovšie sa zistila čiastočná permeabilizácia lyzozomálnej membrány, ktorá síce zachováva normálnu štruktúru lyzozómu, ale umožňuje únik lyzozomálnych katepsínov do cytoplazmy 36). Tieto lyzozomálne hydrolázy môžu zvyšovať permeabilitu mitochondriálnej membrány, aktiváciu proapoptotických Bcl-2 proteínov ako aj kondenzáciu chromatínu, expozíciu fosfatidylserínu a tvorba membránových vychlípenín nezávisle od aktivácie kaspáz. Permeabilizáciu lyzozomálnej membrány iniciujú viaceré faktory vrátane kaspázovej signalizácie, receptorovej signalizácie a oxidačného stresu 37).
Hlavným ochranným faktorom permeabilizácie lyzozómov je šaperónový proteín Hsp70, ktorý chráni bunku pred tepelným a oxidačným stresom, protinádorovými liečivami, FasL a TNF 38). Práve nádorové bunky obsahujú v membránach Hsp70 v nadmernom množstve.
Ceramid je lipid zložený zo sfingozínu a mastnej kyseliny a ako zložka sfingomyelínu sa nachádza vo vysokých koncentráciách v cytoplazmovej membráne buniek. Uvoľnený ceramid funguje ako signálna molekula, čo naznačuje jeho význam v regulácii bunkových procesov, ako je delenie, diferenciácia a smrť bunky 39). Ceramid môže v bunke interagovať s mnohými enzýmami, čím ovplyvňuje rozličné signálne dráhy vrátane apoptotických 40). Viaceré štúdie potvrdili, že ceramid môže podporovať uvoľnenie cytochrómu-c z mitochondrie do cytoplazmy, aktivovať signálnu dráhu SAPK/JNK, zasahovať do regulácie TNF a Fas receptorov, a tým zvyšovať účinok FasL a TNF dependentných procesov. Ceramid aktivuje niektoré tyrozínkinázy, ktoré aktivujú proapoptotickú formu PKC 41).
Autofágia
Autofágia hrá úlohu pri prežívaní organizmu v čase hladovania, alebo pri obnove poškodených organel 42). Veľké počty buniek v pokročilom štádiu autofágie sa však pozorovali aj pri neurodegeneratívnych ochoreniach, ako je Alzheimerova a Parkinsonova choroba. To viedlo k myšlienke, že autofágia má okrem adaptatívnej úlohy aj význam v bunkovej smrti.
Autofágia sa prejavuje viacerými morfologickými zmenami, ako sú vznik autofagických vezikúl, tmavnutia cytoplazmy a nukleoplazmy, dilatácia endoplazmového retikula, Golghiho aparátu a zväčšovanie mitochondrii, strata mikrovíl a medzibunkových spojov. Takisto sa pozorujú membránové vychlípeniny podobné apoptotickým, intenzívna endocytóza, a tým redukcia povrchu membrány, zvyšovanie počtu vakuol, vznik cytoplazmových inklúzii a piknotického jadra. V posledných štádiách je bunkový zvyšok odstránený heterofágiou, i keď nie v takej zreteľnej forme, ako je odstraňovanie apoptotických teliesok 43).
Najnovšie štúdie hovoria aj o funkcii autofágie v programovanej smrti buniek 44). Autofágia začína vznikom autofagických vakuol (autofagozómy), ktoré pohlcujú cieľovú organelu, spájajú sa s lyzozómom, čím vzniká autolyzozóm. Vznik autofagozómu je regulovaný fosfatidyl-inozitol-3-kinázami (PI3) typu I a III a autofagickými Ser/Thr kinázami (Atg1-16). PI3-I je aktivovaná rastovými faktormi a inhibuje autofágiu zatiaľ neznámym mechanizmom. PI3-III, ktorá vo svojom komplexe obsahuje beklín-1 (Atg6), stimuluje vznik autofagických molekúl. Mechanizmus ďalších autofagických procesov je regulovaný dvoma systémami podobnými ubiquitínu. Prvým je dráha cez Atg12 a druhým spôsobom je dráha cez Atg8 (obr. 4). Atg12 sa konjuguje s Atg5, zatiaľ čo Atg8 sa konjuguje s fosfatidyletanolamínom (PE). Práve Atg8-PE komplex je markerom pre autofágiu 45).
Obr. 4. Regulácia vzniku autolyzozómu. PI3 kináza typu 3 vyžaduje Atg6 a jeden z dvoch systémov: Atg12 resp. Atg8 44) PE – fosfatidyletanolamín 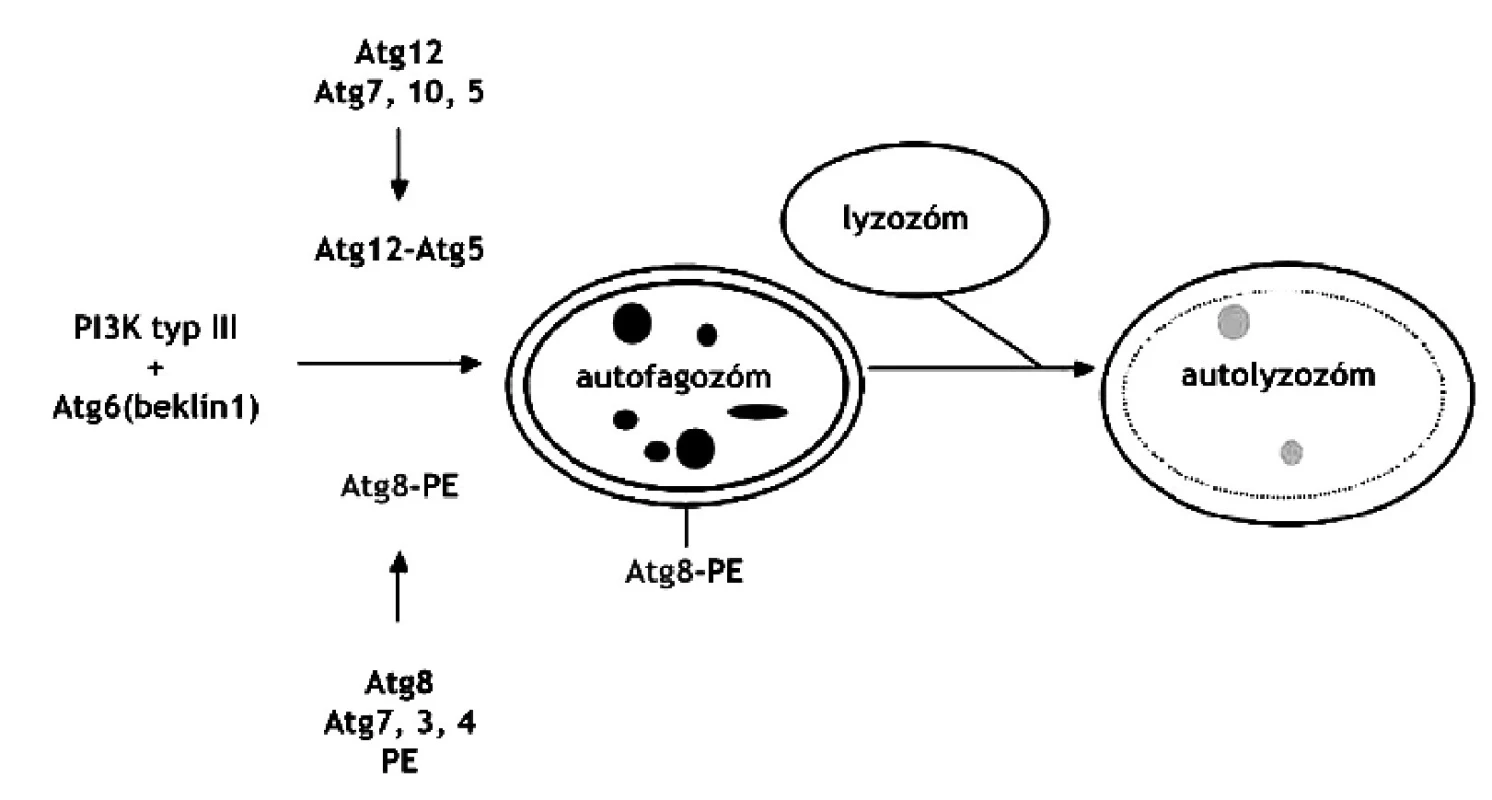
Dôležitým regulátorom autofagickej smrti sú Bcl-2 proteíny. Autofágia môže byť alternatívnou programovanou smrťou v bunkách, ktoré majú zvýšené antiapoptotické Bcl-2 a znížené proapoptotické Bax/Bak. Takisto sa autofágia potvrdila v bunkách v prítomnosti kaspázových inhibítorov 46).
Spôsob, akým sa autofagický proces stimuluje, zostáva otázny. Niektoré práce spájajú autofagická programovanú smrť s JNK signalizáciou, pretože JNK sa ukázala byť nevyhnutná pre autofagickú smrť, na rozdiel od samotnej autofágie, ktorá od JNK nezávisí. Preto treba odlišovať autofagickú bunkovú smrť od autofágie, ktorej jedinou úlohou je získanie energie. Dôvodom, prečo sa v niektorých bunkách iniciuje autofágia ako programovaná smrť a prečo v iných bunkách dochádza len k aktivácii autofágie pri energetickom strese, sa zdá byť rozdielna hladina niektorých proteínov Atg 47).
Zoznam použitých skratiek
AIF faktor indukujúci apoptózu
Apaf-1 aktivačný faktor-1 apoptózovej proteázy
Atg autofagická Ser/Thr kináza
Bap-31 proteín spojený s receptorom B-buniek
Bax Bcl-2 spojené s proteínom X
Bcl-2 proteíny izolované z leukemických B buniek 2
Bid doménový smrtiaci agonista ovplyvňujúci BH3
Bim mediátor bunkovej smrti interagujúci s Bcl-2
c-Abl homológ 1 Abelsonovho myšacieho leukemického vírusového onkogénu
cFLIP bunkový proteín inhibujúci FLICE
DR3 resp. DR6 receptor smrti 3 resp. 6
ERK kináza regulovaná extracelulárnym signálom
FADD proteín spojený s Fas cez smrtiacu doménu
FasL resp. Fas apoptózový antigénový ligand 1 resp. receptor pre FasL (Apo-1, CD95)
FLICE interleukín 1ß premieňajúci enzým podobajúci sa na FADD
Hsp proteíny tepelného šoku
Htr2/Omi proteín A2 vyžadujúci vysokú teplotu/Omiho stresom regulovaná endoproteáza
IAPs inhibítory proteínov apoptózy
IRE1 kináza 1 vyžadujúca inozitol
Jafrac2 tioredoxínperoxidáza 2
JAK Janusova tyrozínkináza
JNK c-Jun N-terminálna proteínkináza
MAPK mitogénom aktivovaná proteínkináza
p38 MAPK mitogénom aktivovaná proteínkináza 14
p53 ľudský nádorový antigén lokalizovaný na chromozóme 17
PARP poly(ADP-ribóza)polymeráza
PKC proteínkináza-C
ROS reaktívne kyslíkové druhy
SAPK proteínkináza aktivovaná stresom
Smac/Diablo druhý mitochondriálny aktivátor kaspáz/proteín s nízkym pI viažuci IAPs
STAT signálny transduktor a aktivátor transkripcie
TNF resp. TNFR tumor nekrotizujúci faktor resp. receptor pre TNF
TRADD proteín spojený s TRAIL cez smrtiacu doménu
TRAIL ligand spojený s TNF indukujúci apoptózu
Z-VAD-FMK špecifický inhibítor kaspázy 3
∆ ψmmitochondriálny membránový potenciál
Práca bola podporovaná Agentúrou na podporu vedy a techniky na základe Zmluvy č. APVT-20-007304 a Grantovou agentúrou VEGA SR projektom č. 1/4305/07 a 1/2448/05.
Došlo: 29. října 2007
Přijato: 31. prosince 2007
Zdroje
1. Stiborová, M.: Studium enzymů biotransformujících xenobiotika – nástroj k poznání mechanizmu působení karcinogenů a konstrukce kancerostatik nové generace. Doktorská dizertační práce. Přírodovědecká fakulta, Univerzita Karlova v Praze, 2003.
2. Aubert, J., Belmonte, N., Dani, C.: Cell. Mol. Life Sci., 1999; 56, 538–542.
3. Pouyssegur, J., Volmat, V., Lenormand, P.: Biochem. Pharmacol., 2002; 64, 755–763.
4. Dodeller, F., Schulze-Koops, H.: Arthritis Res. Ther., 2006; 8, 205.
5. Nishina, H., Wada, T., Katada, T.: J. Biochem., 2004; 2, 23–126.
6. Mackay, H. J., Twelves, C. J.: Endocr. Relat. Cancer, 2003; 10, 389–396.
7. Heinrich, P. C., Behrmann, I., Haan S., Hermanns, H. M. et al.: Biochem. J., 2003; 15, 1–20.
8. Masopust, J., Bartůňková, J., Goetz, P. et al.: Patobiochémie buňky. Univerzita Karlova v Prahe, 2. lékařská fakulta, 2003.
9. Kerr, J. F. R., Wyllie, A. H., Currie, A. R.: Br. J. Cancer, 1972; 26, 239–257.
10. Chaloupka, J.: Biologické listy, 1996; 61, 249–252.
11. Chan, F. K., Shisler, J., Bixby J. G. et al.: J. Biol. Chem., 2003; 278, 51613–51621.
12. Zong, W. X., Ditsworth, D., Bauer D. E. et al.: Genes. Dev., 2004; 18, 1272–1282.
13. Okada, M., Adachi, S., Imai, T. et al.: Blood, 2004; 103, 2299–2307.
14. Green, D.R., Kroemer, G.: Science, 2004; 305, 626–629.
15. Clarke, P. G., Clarke S.: Anat. Embry., 1996; 193, 81–99.
16. Hacker, G.: Cell Tissue Res., 2000; 301, 5–17.
17. Culmsee, C., Plesnila, N.: Biochem. Soc. Trans., 2006; 34, 1334–1340.
18. Rao, R. V., Ellerby, H. M., Bredesen, D. E.: Cell Death. Differ., 2004; 11, 372–380.
19. Guicciardi, M. E., Leist, M., Gores, G. J.: Oncogene, 2004; 23, 2881–2890.
20. Hannun, Y. A., Luberto, C.: Trends Cell. Biol., 2000; 10, 73–80.
21. Desagher, S., Martinou, J. C.: Trends Cell. Biol., 2000; 10, 369–377.
22. Krueger, A., Fas, S. C., Baumann, S., Krammer, P. H.: Immunol. Rev., 2003; 193, 58–69.
23. Dempsey, P. W., Doyle, S. E., He, J. Q., Cheng, G.: Cytokine Growth Factor Rev., 2003; 14, 193–209.
24. Scaffidi, C., Fulda, S., Srinivasan, A. et al.: EMBO J., 1998; 17, 1675–1687.
25. Walker, P. R., Leblanc, J., Smith, B. et al.: Methods, 1999; 17, 329–338.
26. Davis, R. J.: Cell, 2000; 103, 239–252.
27. Bredesen, D. E., Mehlen P., Rabizadeh S.: Physiol. Rev., 2004; 84, 411–430.
28. Berridge, M. J., Lipp, P., Bootman, M. D.: Nat. Rev. Mol. Cell Biol., 2000; 1, 11–21.
29. Nakagawa, T., Yuan, J.: J. Cell Biol., 2000; 150, 887–894.
30. Ng, F. W. H., Nguyen, M., Kwan, T. et al.: J. Cell Biol., 1997; 39, 327–338.
31. Yamamoto, K., Ichijo, H., Korsmeyer, S. J.: Mol. Cell Biol., 1999; 19, 8469–8478.
32. Ito, Y., Pandey, P., Mishra, N. et al.: Mol. Cell Biol., 2001; 21, 6233–6242.
33. Bourdon, J. C., Renzing, J., Robertson, P. L. et al.: J. Cell Biol., 2002; 16, 1479–1489.
34. Tenev, T., Zachariou, A., Wilson, R. et al.: EMBO J., 2002; 21, 5118–5129.
35. Leist, M., Jaattela, M.: Cell Death Differ., 2001; 8, 324–326.
36. Jaattela, M.: Ann. Med., 2002; 34, 480–488.
37. Werneburg, N., Gucciardi, M. E., Yin, X. M., Gorez, G. J.: Am. J. Physiol. Gastrointest. Liver Physiol., 2004; 287, 436–443.
38. Multhof, G.: Int. J. Hyprethemia, 2002; 18, 576–585.
39. Van Blitterswijk, W. J., Van Der Luit, A. H., Veldman, R. J. et al.: Biochem. J., 2003; 369, 199–211.
40. Selzner, M., Bielawska, A., Morse, M. A. et al.: Cancer Res., 2001; 61, 1233–1240.
41. Joseloff, E., Cataisson, C., Aamodt, H. et al.: J. Biol. Chem., 2002; 277, 12318–12323.
42. Levine, B., Klionsky, D. J.: Dev. Cell, 2004; 6, 463–477.
43. Klionsky, D. J., Emr, S. D.: Science, 2000; 290, 1717–1721.
44. Shimizu, S., Kanaseki, T., Mizushima, N. et al.: Nat. Cell Biol., 2004; 6, 1221–1228.
45. Tal-Or, P., Di-Segni, A., Lupowitz, Z., Pinkas-Kramarski, R.: Prostate, 2003; 55, 147–157.
46. Yu, L., Alva, A., Su, H. et al.: Science, 2004; 304, 1500–1502.
47. Gozuak, D., Kimchi, A.: Oncogene, 2004; 23, 2891–2906.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2008 Číslo 1- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Hemostatické účinky oxidované celulosy
- Nové knihy
- Podvýživa a nevhodná výživa
- Vliv auxinů na růst a akumulaci skopoletinu v suspenzní kultuře Angelica archangelica L.
- Studium vlastností tablet z přímo lisovatelné maltosy
- Látky ovlivňující aktivitu kaspas
- ČASOPIS ČESKÁ A SLOVENSKÁ FARMACIE V ROCE 2008
- Antioxidační aktivita tinktur připravených z hlohových plodů a nati srdečníku
- POKROKY V LÉKOVÝCH FORMÁCH – PRACOVNÍ DEN SEKCE TECHNOLOGIE LÉKŮ ČFS JEP
- Signálne dráhy bunkovej proliferácie a smrti ako ciele potenciálnych chemoterapeutík
- Abstrakta z akcí ČFS v časopisu Česká a slovenská farmacie
- Ze zasedání výboru České farmaceutické společnosti
- Mezinárodní kongres historie farmacie
- Cena pro doc. RNDr. PhMr. Václava Ruska, CSc.
- Jubileum doc. RNDr. Ruženy Čižmárikovej, CSc.
- Životné jubileum prof. RNDr. Vladimíra Špringera, CSc.
- Nové knihy
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Signálne dráhy bunkovej proliferácie a smrti ako ciele potenciálnych chemoterapeutík
- Hemostatické účinky oxidované celulosy
- POKROKY V LÉKOVÝCH FORMÁCH – PRACOVNÍ DEN SEKCE TECHNOLOGIE LÉKŮ ČFS JEP
- Podvýživa a nevhodná výživa
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



