-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Diferenciálně diagnostické stavy systémové sklerodermie z pohledu dermatologa
Differential diagnosis of systemic scleroderma from the perspective of dermatologist
Conditions assessed in the differential diagnosis of systemic sclerosis or scleroderma (SSc) are associated with some degree of skin fibrosis. These diseases are sometimes referred to as scleroderma-like syndromes and they are diverse and completely different etiology and often unclear pathogenesis. The different and relatively various clinical characteristics of each of these diseases may help to differentiate these conditions from systemic sclerosis. Histopathological examination with clinical-pathological correlation is, in some cases, necessary to make a definitive diagnosis and to select an appropriate therapeutic approach. This summary provides a brief overview of diseases that, because of their skin involvement, are the most common parts of the differential diagnosis of SSc. The differential diagnosis includes generalized morphea (localized scleroderma), eosinophilic fasciitis, nephrogenic systemic fibrosis, stiff skin syndrome, scleromyxedema, scleredema adultorum, diabetic cheiroarthropathy and systemic amyloidosis. The interdisciplinary approach, and the cooperation of rheumatology and dermatology, is an irreplaceable differential diagnostic procedure for the correct diagnosis of these diseases.
Keywords:
scleromyxedema – generalized localized scleroderma – eosinophilic fasciitis – nephrogenic systemic fibrosis – scleredema
Autoři: O. Kodet 1,2,3; J. Štork 1
Působiště autorů: Dermatovenerologická klinika 1. LF UK a VFN, Praha 1; Anatomický ústav 1. LF UK, Praha 2; BIOCEV – Biotechnologické a biomedicínské centrum Akademie věd a Univerzity Karlovy, Vestec u Prahy 3
Vyšlo v časopise: Čes. Revmatol., 28, 2020, No. 3, p. 169-181.
Kategorie: Přehledový článek
Souhrn
Diferenciálně diagnostické stavy systémové sklerodermie (SSc) spojuje určitý stupeň fibrózy kůže. Tato onemocnění jsou někdy označována jako pseudosklerodermie. Jedná se o onemocnění rozmanité a naprosto odlišné etiologie a často i nejasné patogeneze. Odlišné a poměrně různorodé klinické charakteristiky těchto jednotlivých onemocnění mohou pomoci odlišit tyto stavy od systémové sklerodermie. Histopatologické vyšetření s klinicko-patologickou korelací je v některých případech nezbytné ke stanovení definitivní diagnózy a následného zvolení adekvátního terapeutického přístupu. V tomto článku je podán stručný přehled onemocnění, která pro své kožní postižení, jsou nejčastější součástí diferenciální diagnózy SSc. Zahrnují generalizovanou morfeu (lokalizovanou sklerodermii), eozinofilní fascitidu, nefrogenní systémovou fibrózu, syndrom ztuhlé kůže (stiff skin syndrome), skleromyxedém, scleredema adultorum, diabetickou cheiroartropatii a systémovou amyloidózu. Mezioborový přístup a zejména spolupráce revmatologie a dermatologie je nenahraditelným diferenciálně diagnostickým postupem jak tato onemocnění správně diagnostikovat.
Klíčová slova:
generalizovaná lokalizovaná sklerodermie – eozinofilní fasciitida – nefrogenní systémová fibróza – skleromyxedém – scleredema adultorum
ÚVOD
Řada onemocnění se může projevit určitým stupněm fibrózy kůže a následně může být tento stav mylně považován za systémovou sklerodermii (SSc). Diferenciálně diagnostická rozvaha vychází ze znalosti těchto onemocnění, která mohou mít některé podobné příznaky, jako má SSc. SSc je autoimunitní onemocnění pojivové tkáně s roční incidencí 2 až 46 postižených na 1 milion obyvatel a prevalencí 30 až 580 na 1 milion obyvatel. Onemocnění postihuje více ženy ve středním věku (ženy : muži 4–6 : 1) (1, 2). Typické znaky SSc představují zejména symetrické postižení rukou, sklerodaktylie, kapilaroskopické změny nehtových valů, postižení obličeje, teleangiektázie, přítomnost Raynaudova fenoménu, celková symptomatologie včetně možného postižení vnitřních orgánů (hlavně postižení plic, srdce, gastrointestinálního traktu a ledvin) a typická pozitivita antinukleárních protilátek (až v 95 %) a autoprotilátek specifických pro SSc, jako zejména anti-DNA-topoizomeráza I, anti-centromerové protilátky a protilátky proti RNA-polymeráze III. Na prvním místě v diferenciálně diagnostické rozvaze onemocnění, která připomínají systémovou sklerodermii je generalizovaná morfea.
LOKALIZOVANÁ SKLERODERMIE, MORFEA
Lokalizovaná sklerodermie (morfea) je zánětlivé onemocnění projevující se lokalizovanou kožní fibrózou v podobě ložisek, ploch a někdy až generalizovaným postižením kožního povrchu. Na rozdíl od SSc morfea postihuje pouze kůži (je „lokalizovaná“), přičemž zánětlivé a fibrotické změny nacházíme především v dermis, případně v podkožní tukové tkáni, fascii přilehlého svalu a výjimečně až u kosti (3). Zánětlivé změny vedou v začátku postižení při zánětlivé fázi k přechodnému erytému projevů s následnou fibrotizací podkoží a tvorbou jizevnatých, tuhých kožních změn. Histopatologické změny v podobě zánětlivého infiltrátu kůže a změny malých cév jsou obdobné jak u lokalizované sklerodermie, tak i u SSc (3–5).
Samotný termín lokalizovaná sklerodermie či morfea zahrnuje všechny formy lokalizované sklerodermie, existuje několik klasifikací, ale pro účely diferenciální diagnostiky systémové sklerodermie je nejvhodnější zmínit klasifikaci dle Kreutera (tab. 1). V této klasifikaci je pod generalizovanou formou lokalizované sklerodermie zahrnuta generalizovaná morfea s postižením tří a více anatomických krajin: pansklerotická invalidizující morfea a eozinofilní fasciitida (6).
Tab. 1. Klasifikace lokalizované sklerodermie (6) 
Incidence morfey je odhadována asi na tři postižené na 100 000 obyvatel, přičemž prevalence se s věkem zvyšuje. Průměrný věk začátku onemocnění je přibližně 45 let. Až na lineární morfeu, která nemá genderově vázané postižení a je nejčastější v dětském věku, postihuje morfea více ženy než muže v poměru 2,6 : 1 (4, 5, 7).
Na multifaktoriální patogenezi onemocnění se mohou podílet vlivy genetické predispozice, vlivy prostředí, imunologické poruchy (5). Z infekčních vlivů je diskutována infekce borrelie sp., která však nebyla doposud jednoznačně prokázána (5, 8). Fibróza kůže je indukována vaskulárním poškozením, aktivovanými T-lymfocyty a zvýšenou tvorbou vazivové tkáně dermálními fibroblasty. Vaskulární změny představují snížení počtu kapilár. Zvýšená produkce kolagenu a dalších složek extracelulární matrix je indukována cytokiny produkovanými aktivovanými T-lymfocyty, resp. produkcí interleukinu 4 (IL-4), IL-6, IL-8, IL-13 a transformujícího růstového faktoru beta (TGF-β) (5, 9, 10).
V typickém klinickém obraze se morfea vyznačuje tvorbou mírně elevovaných, erytematózních nebo lividních ložisek s oválným tvarem. Samotný klinický projev podstupuje tři vývojová stadia onemocnění: 1. zánětlivé, 2. sklerotické a 3. atrofické (3–5, 7). V zánětlivé fázi se jedná o ohraničená erytematózní ložiska s výrazněji akcentovanými kožními póry, která dávají kůži vzhled „pomerančové kůry“ a jsou podmíněny edémem koria s následnou dilatací folikulárních ústí. V okrajích erytematózních ložisek mohou být projevy až lividní. Přítomný erytém poukazuje na aktivitu onemocnění. V dalším vývoji se vytvoří většinou ve středu léze nažloutlá či bělavá barva podmíněná převládající tvorbou pojivové tkáně (5). Ve sklerotické fázi onemocnění chybí již zánětlivý lem projevů. Kůže v místě postižení je hladká, lesklá a obtížně zřasitelná. V konečné atrofické fázi indurace léze zmizí, projevy jsou měkké a kůže je atrofická se sklonem k hyperpigmentacím. U některých pacientů jsou projevy výrazněji rigidní a mohou být mírně bolestivé (4, 5). Hluboká morfea představuje sklerotizaci, která postihuje primárně hlubokou část dermis a podkožního tuku. Může se jednat o vpáčené tuhé infiltráty, které mohou způsobovat artralgie či kontraktury při lokalizaci nad klouby (11).
Generalizovaná morfea
Generalizovaná morfea začíná jako více ložisek cirkumskriptní morfey (lokalizované sklerodermie), nebo i rovnou postižením celých oblastí kožního povrchu (obr. 1). Tato klinická varianta je definována postižením více než tří různých anatomických lokalit (6). Na rozdíl od systémové sklerodermie se generalizovaná morfea neprojevuje primárně postižením akrálních lokalizací a sklerodaktylií, i když i tyto anatomické lokality u generalizovaného stavu mohou být postiženy (12). Generalizovaná morfea může postihnout kromě kůže i podkožní tuk a fascii, také ji mohou výjimečně doprovázet, bez klinických příznaků, mírné fibrózní změny ve vnitřních orgánech (zejména v gastrointestinálním traktu a v plících). Může být přítomna i tvorba kloubních kontraktur plynoucí z většinou sekundárního postižení kůže kloubů a následného omezení pohybu. I difuzní postižení hrudníku, které vytváří až jakýsi krunýř, může omezit dýchací a polykací pohyby (13, 14). Jako zvláštní formu generalizované sklerodermie je popisována pansklerotická invalidizující morfea.
Obr. 1. Generalizovaná morfea, splývající erytematózní ložiska a plochy na břiše a hrudníku s cirkulárním postižením na prsou vytlačující nepostiženou kůži v okolí areol. Bělavé plochy v kubitách a na břiše poukazují na možné smíšené postižení s lichen sclerosus et atrophicus. 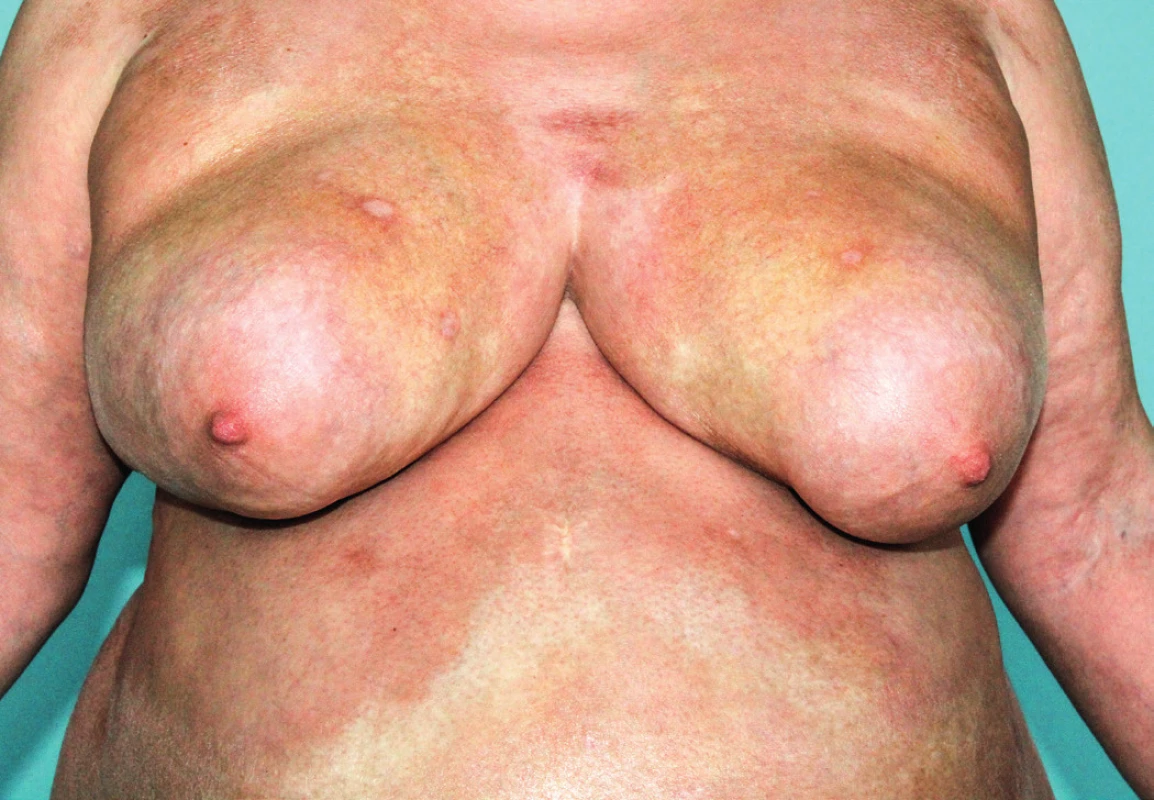
Pansklerotická invalidizující morfea je vzácné postižení, které často vzniká jako smíšená forma lineární a generalizované morfey s typickým cirkulárním postižením končetin nebo i trupu, ale bez postižení rukou a nohou. Tato forma je charakterizována hlubokým fibrózním procesem v dermis, podkožní tukové tkáni, fascii, svalu s přesahem až na kosti a vznikem flekčních kontraktur. Tento proces může progredovat až s následkem možné zástavy růstu končetiny a tvorbou trofických končetinových vředů. Sklon k regresi onemocnění je spíše ojedinělý a dominuje trvalé invalidizující postižení.
Laboratorní abnormality jsou obvykle spojené s generalizovanou a lineární morfeou. U některých pacientů lze detekovat antinukleární protilátky (ANA), a to poměrně s velkým rozpětím nálezů, kdy se udává možná pozitivita u 18–68 % pacientů. Mezi další autoprotilátky, které jsou detekovány méně často než ANA, patří protilátky proti histonům, dsDNA, ssDNA, topoisomeráze IIα, antifosfolipidové protilátky a revmatoidní faktor (RF) (3, 11). K rutinnímu vyšetření patří i biopsie kůže.
Histopatologické nálezy závisejí na vývojovém stadiu onemocnění a oblasti, kde byla biopsie odebrána (zánětlivá hranice nebo centrální jizevnatá část léze). Bioptické odběry vzorků musí být provedeny hluboko do podkožní tukové tkáně. Biopsie prováděné ze zánětlivých lézí vykazují intersticiální a perivaskulární infiltrát zánětlivých buněk složený primárně z CD4 + T-lymfocytů, eozinofilů, plazmatických buněk a žírných buněk. Zánětlivé změny mohou být přítomné i v podkožní tukové tkáni. Biopsie z léze s klinicky manifestovanou jizevnatou tkání ukazuje na homogenizaci papilární dermis se zahuštěnými kolagenními svazky zasahující do retikulární dermis (15).
Eozinofilní fasciitida
Eozinofilní fasciitida (Schulmanův syndrom) je dle některých autorů považována za formu generalizované morfey, která je charakterizována tuhými infiltráty kůže (typicky končetin) s hypereozinofilií v periferní krvi a zvýšenou sedimentací erytrocytů (FW). Prevalence eozinofilní fasciitidy je uváděna přibližně 14 postižených na 1 milion obyvatel, častěji postihuje ženy ve 4. a 5. deceniu (16). U některých pacientů předchází vzniku onemocnění namáhavá fyzická aktivita. Klinický obraz začíná jako náhle vzniklý bolestivý edém, který progreduje do fibrózy se zánětlivým vzhledem postižené lokality. Typické je dolíčkování v místech s anatomicky výraznější podkožní tukovou tkání (vnitřní partie paží a stehen), které vznikají v důsledku retrakce zmnoženého vaziva sept podkožní tukové tkáně (matracovitý obraz) (obr. 2). Dalším projevem je tzv. příznak „žlábku“, který je podmíněn vtažením povrchových žil. Kožní změny zahrnují i projevy charakteru již zmíněné pomerančové kůry (peau d’orange). Zánětlivé a fibrózní změny postihují tedy svalovou fascii, sval a podkoží tukovou tkáň s přilehlou dermis. Postižení je typicky symetrické na obou končetinách s vynecháním rukou, nohou a obličeje, vzácněji je postižen trup a břicho (obr. 3) (17). Klinický obraz může být doprovázen asi ve 30 % případů projevy ložiskové morfey, které samotné fasciitidě mohou předcházet nebo se objevují po akutní fázi onemocnění (18). Mezi laboratorní nálezy eozinofilní fasciitidy patří zvýšená sedimentace, hypergamaglobulinemie a na začátku příznaků může být hypereozinofilie v periferní krvi. Vzácněji může být pozitivita ANA protilátek, RF a elevace svalových enzymů, které však mohou být normální i v rámci myalgie při eozinofilní fasciitidě (19). U eozinofilní fasciitidy byla popsána i pancytopenie, anemie, trombocytopenie, myeloproliferativní poruchy s monoklonální gamapatií. Samotná diagnostika se opírá o hlubokou kožní biopsii se zavzetím přilehlé svalové fascie a svalu (20, 21). V histologickém vyšetření je dominantní 10–50násobné zesílení svalové fascie oproti normálnímu stavu. V dermis jsou vedle fibrózy přítomné eozinofily s příměsí žírných buněk, patrné jsou i zánětlivé infiltráty T-lymfocytů a plazmatických buněk (20). V diagnostice lze využít i magnetickou rezonanci (MR) s průkazem symetrického ztluštění a hyperintenzity (v sekvenci T1, T2) povrchové svalové fascie postižené lokality (22).
Obr. 2. Eozinofilní fasciitida, postižení s „matracovitým“ vzhledem mediální části levé paže přecházející v tuhý erytém v oblasti levého lokte 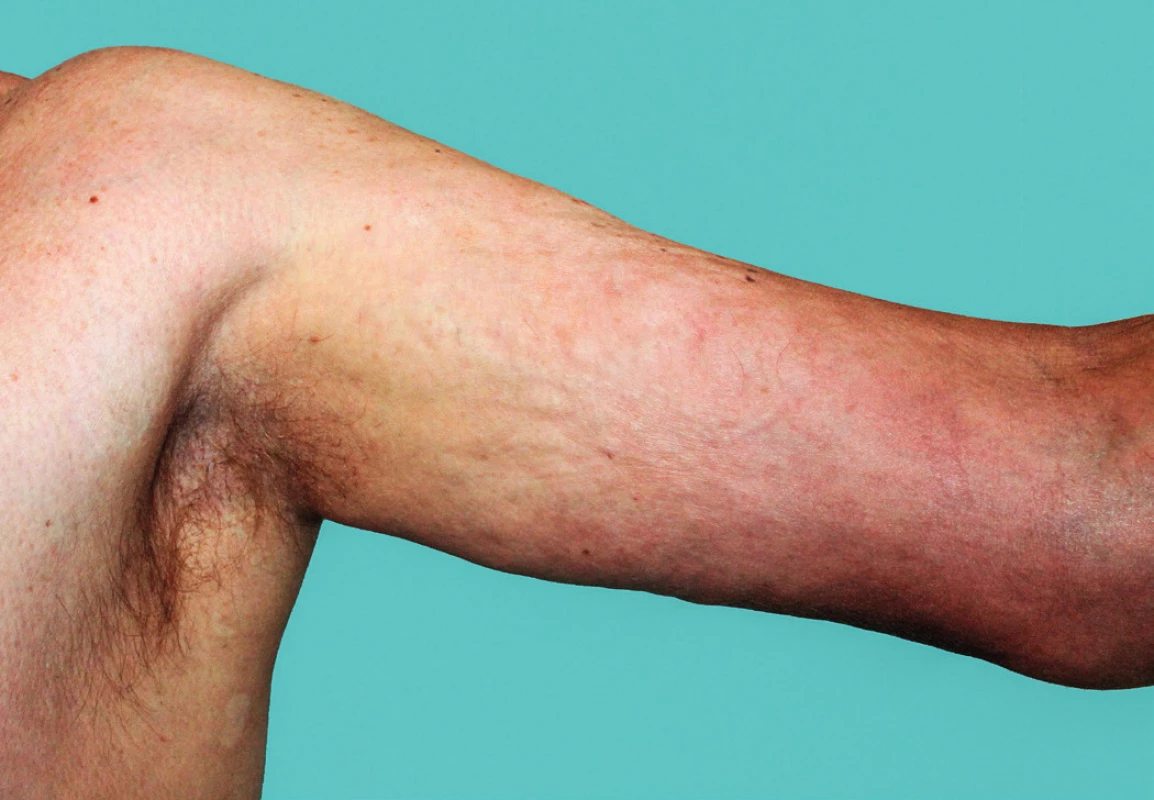
Obr. 3. Obraz rozsáhlého postižení v oblasti břicha, typické je dolíčkování v místech s anatomicky výraznější podkožní tukovou tkání 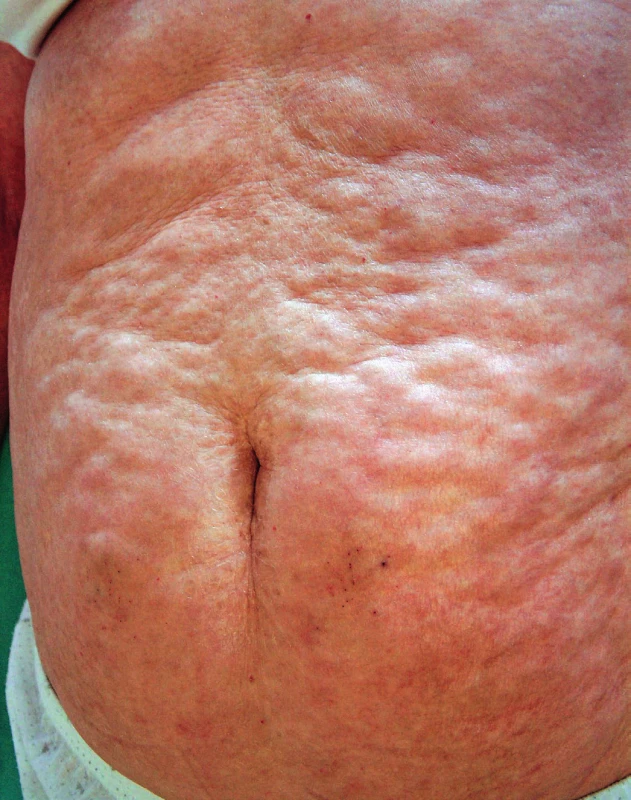
V diferenciálně diagnostickém přístupu je řada projevů, které se podobají morfee. U generalizované morfey je nutné odlišit systémovou sklerodermii nebo např. scleredema diabeticorum. Kromě kožní fibrózy začíná systémová sklerodermie obvykle Raynaudovým fenoménem, difuzními otoky případně i sklerotizací kůže prstů (sklerodaktylií) doprovázenou kapilárními změnami nehtových valů (tab. 2) (23–25). U pacientů s morfeou tyto změny zcela chybí. Do diferenciální diagnostiky cirkumskriptní morfey zahrnujeme v první řadě lichen sclerosus et atrophicus, který mnohdy nelze zcela rozlišit jak klinicky, tak i histopatologicky z kožní biopsie od morfey, a hovoříme poté o překryvném stavu (v histologickém vyšetření mohou být přítomné znaky obou onemocnění v jedné biopsii) (viz i obr. 1). Při projevech v solární lokalizaci a pomalu progredujících ložiskách je nutné myslet i na morfeaformní bazocelulární karcinom. U pacientů po zevní radioterapii může být přítomna i postradiační morfea (3, 11, 21). Do diferenciálně diagnostické rozvahy tzv. pseudosklerodermických stavů lze zařadit celou řadu jak exogenně, tak endogenně indukovaných projevů, jejichž přehled ukazuje tabulka 3 (23, 25).
Tab. 2. Diferenciální diagnostické schéma systémové sklerodermie (23–25) 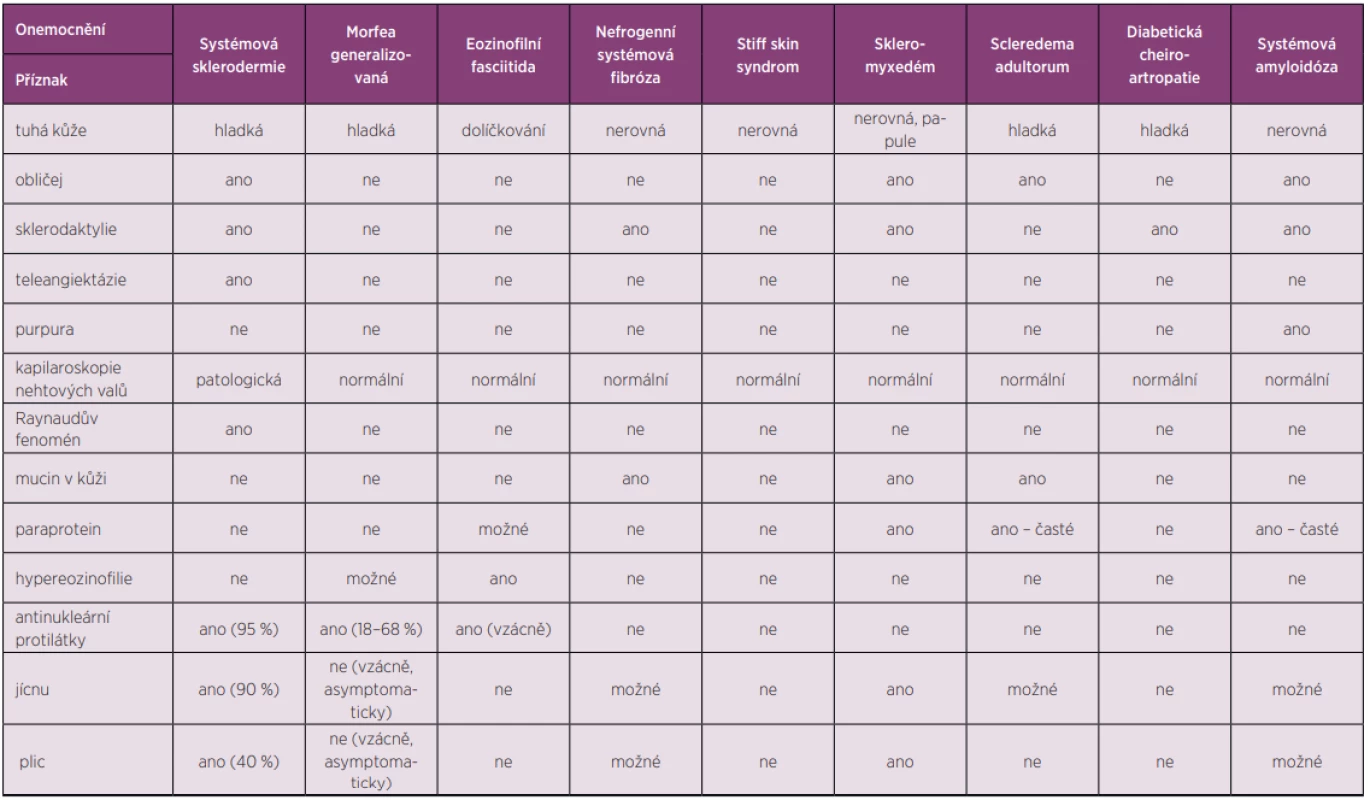
Tab. 3. Pseudosklerodermické stavy (23) 
Principem léčby lokalizované sklerodermie je terapie aktivního onemocnění, které lze případnou terapií ovlivnit. Klinickými známkami aktivity nemoci je přítomnost erytému, přibývání nových či rozšiřování již přítomných projevů. Dále se terapie řídí dle rozsahu a hloubky postižení s následnou hrozbou mutilace a funkčního postižení. Pro sledování průběhu onemocnění a efekt případné terapie lze použít např. validované skóre LoSCAT (localized scleroderma cutaneous assessment tool). Jedná se o snadno použitelný biomarker hodnocení průběhu a léčby onemocnění bez nutnosti použití přístrojového vybavení, který zahrnuje tři samostatné parametry:
- hodnocení aktivity nemoci přítomným erytémem, zánětlivé indurace a tvorby nových projevů v bodové škále 0 až 3 v 18 anatomických krajinách (mLoSSI – modified localized scleroderma severity index)
- zhodnocení následného poškození v podobě přítomné atrofie dermis i podkožní tukové tkáně a případné hyper - či hypopigmentace (LoSDA – localized scleroderma skin damage assessment)
- zhodnocení projevů lékařem (PGA – physician global assessment) (6, 26)
Z léčebných modalit lokalizované sklerodermie lze zmínit možnosti jak lokální, tak i celkové terapie. I když je v současné době celá řada možností, terapeutický efekt řady preparátů je doložitelný jen na menší skupině pacientů. Samotným očekávaným výsledkem úspěšné léčby však není kompletní vyhojení daného projevu, ale především u pacientů s progredujícími projevy zastavení tvorby nových lézí a omezení šíření stávajících projevů (3, 27).
K léčbě morfey se standardně používají lokálně aplikované velmi silné nebo silné kortikosteroidy (1krát denně po dobu 1–3 měsíců, v závislosti na síle preparátu). Z dalších preparátů byl popsán efekt lokálně aplikovaného takrolimu (0,1% takrolimus v masti) v zánětlivé fázi onemocnění. Určitý efekt v inhibici projevů byl zdokumentován i při lokálním použití derivátů vitaminu D. Lokálně aplikovaný 0,005% calcipotriol může inhibovat účinky na proliferaci fibroblastů, syntézu kolagenu a aktivaci T-lymfocytů a v některých klinických studiích bylo během této terapie zaznamenáno zlepšení (27–29). Imiquimod je topický imunomodulátor, který indukuje interferon γ, cytokin, který se podílí na inhibici TGF-β a produkci proteinů extracelulární matrix. Imiquimod také reguluje profibrotický cytokin IL-4. Standardně se tento preparát používá v České republice na lokální terapii bazocelulárního karcinomu a solárních keratóz, omezené studie ale naznačují, že může být účinný u některých pacientů s lokalizovanou sklerodermií (30). Další doménou dermatologie je možnost terapeutické aplikace arteficiálních zdrojů UV záření. Fototerapii je možné použít u pacientů s lokalizovanou sklerodermií, především pro její vlastnosti imunomodulační, případně i protizánětlivé a antifibrotické, jako podpůrnou formu lokální či systémové terapie. Principiálně lze použít především UVA fototerapii (320–400 nm, proniká až do horního koria), kdy požadované vlnové délky jsou schopné pronikat do hlubších částí kůže. Méně údajů je k dispozici s použitím fotochemoterapie tzv. PUVA (kombinace UVA a topického nebo celkově podaného psoralenu). Méně se zdá být účinná forma záření pomocí UVB (290–320 nm, pronikající pouze do dermoepdiermální junkce) (31).
Pacienti s progresivním onemocněním zejména i generalizované formy vyžadují systémovou terapii methotrexátem nebo kortikosteroidy. Methotrexát v nízkých dávkách je nejvhodnější a nejpoužívanější dlouhodobou systémovou terapií lokalizované morfey. Methotrexát se obvykle podává po dobu nejméně 6–12 měsíců v týdenní dávce 15–25 mg. Systémové kortikoidy se používají v dávce p.o. 0,5–1,0 mg/kg. Délka léčby průměrně trvá 18 měsíců. Další možností je pulzní intravenózní terapie methylprednisolonem (500–1000 mg) aplikovaná po 3 následující dny a opakovaná po 1 měsíci po dobu 3–4 měsíců (27,32).
Léčba eozinofilní fasciitidy má zpravidla rychlou terapeutickou odpověď na systémovou léčbu kortikosteroidy (např. Prednison 1–2 mg/kg denně). Celkové klinické zlepšení může být pozorováno během několika měsíců. Alternativou je celková léčba methotrexátem, mykofenolát mofetilem, hydroxychlorochinem, cyklosporinem, dapsonem, nebo infliximabem samostatně nebo v kombinaci se systémovou terapií kortikosteroidy. Terapeutický efekt může i u této formy přinášet fototerapie jako UVA nebo fotochemoterapie PUVA (17, 33).
NEFROGENNÍ SYSTÉMOVÁ FIBRÓZA
Nefrogenní systémová fibróza (NSF) je vzácné onemocnění nejčastěji postihující dospělé pacienty středního věku, ale bylo popsána i u dětí a starších jedinců. Incidence a prevalence není udávána, ale mezi roky 2006–2016 bylo popsáno 779 případů (34). Doposud nebyla popsána žádná predilekce pohlaví ani rasy. V patogenezi pravděpodobně hraje klíčovou roli renální dysfunkce a expozice kontrastnímu médiu na bázi gadolinia. Samotný vývoj fibrotických změn je ale stále nejasný (35, 36).
Onemocnění je charakterizováno tvorbou velkých symetrických fibrotických ložisek na končetinách a trupu. Samotná ložiska jsou nepravidelná, mapovitá, erytematózní se sklonem k hyperpigmentacím. Postižení na končetinách, které je často symetrické, vede k rozvoji až bolestivých kontraktur s omezenou pohyblivostí. Tento stav je často spojen se značnou bolestí a ztrátou pohyblivosti. Jsou zdokumentované i extrakutánní projevy s tvorbou žlutavých sklerálních plaků a systémovou fibrózou s postižením srdce, kosterních svalů a plic (37, 38).
K histopatologické diagnostice je nutná hluboká biopsie, kde lze prokázat zmnožení fibroblastů s pozitivitou CD34 a prokolagenu I. V dermis jsou přítomné náhodně uspořádané zesílené svazky kolagenu. Dále může být přítomna zvýšená vaskulární proliferace a depozita mucinu (barvení alciánovou modří).
Nefrogenní systémová fibróza je refrakterní k léčbě kortikosteroidy a dalšími imunosupresivy. Byly popsány ojedinělé případy s dosaženým mírným zlepšením po použití imatinibu, rapamycinu, či fototerapií UVA, fotochemoterapií PUVA nebo při použití plazmaferézy. Zlepšení renálních funkcí po úspěšné léčbě základního renálního onemocnění nebo transplantaci ledvin však může tento typ fibrózy výrazněji zmírnit nebo zastavit její progresi (38).
SYNDROM „ZTUHLÉ“ KŮŽE (STIFF SKIN SYNDROME)
Toto onemocnění může být dědičné s vrozeným postižením, nebo se může rozvíjet v průběhu časného dětství. Jedná se o velice vzácné onemocnění bez udávané prevalence a incidence (v roce 2008 43 popsaných případů) (39). Známá dědičnost je způsobena heterozygotní mutací v genu, který kóduje fibrillin-1 (FBN1). Dysfunkce tohoto genu má za následek produkci obřích kolagenových fibril v oblasti postižené svalové fascie (40).
Samotné onemocnění je charakterizováno výrazně tuhou kůží, tvorbou indurovaných a tuhých ložisek, postihující kůži a podkožní tukovou tkáň. V oblasti stehen a hýždí se utváří nápadná hypertrichóza, ale bez patrného postižení v oblasti třísel. Tato hereditární porucha nepostihuje ruce a nohy. Onemocnění je většinou stabilní nebo pomalu progreduje a nejsou dokumentovány jiné abnormality či postižení vnitřních orgánů. V diferenciální diagnostice se onemocnění může podobat skleredému, hluboké nebo i lineární morfee (41).
Histologicky lze prokázat významné rozšíření svalové fascie s depozity hyalinu, ale bez přidruženého zánětlivého infiltrátu. V dermis mohou být přítomné zhuštěné svazky kolagenu a ukládání mucinu. Epidermis a papilární dermis jsou většinou bez postižení (42).
Léčba vzhledem k vrozené dispozici a jednoznačně geneticky determinovanému mechanismu onemocnění je velice obtížná. Doposud nebyla nalezena jednoznačně efektivní terapie. Jsou doporučovány fyzikální možnosti terapie a rehabilitace a dále režimová opatření zabraňující významným kontrakturám a kloubní imobilitě (41, 42).
SKLEROMYXEDÉM
Skleromyxedém (syn. generalizovaný a sklerodermoidní lichen myxoedematosus, papilární mucinóza) je chronické idiopatické onemocnění charakterizované tvorbou papul, ložisek a indurací s depozity mucinu a kolagenu v dermis, což je spojené s tuhostí kůže. Do roku 2018 bylo popsáno v literatuře jen 200 případů (43). U řady pacientů lze prokázat monoklonální gamapatii. Skleromyxedém představuje generalizované onemocnění, které je nutné odlišit od lokalizovaného postižení lichen myxedematosus (varianta bez fibrotizace a paraproteinemie) Přehled systémové a lokalizované formy ukazuje tabulka 4 (44, 45).
Tab. 4. Klasifikace skleromyxedému (45) 
Přesná patogeneze skleromyxedému není známá, obvykle postihuje dospělé osoby středního věku obou pohlaví stejně, vzácně se vyskytuje i u dětí. Role přidružené monoklonální gamapatie není plně vysvětlena, protože například hladiny paraproteinu nesouvisejí s progresí onemocnění. Byla však popsána klinická remise skleromyxedému během redukce paraproteinu, která následovala po autologní transplantaci krvetvorných buněk (44, 46).
V klinickém obraze skleromyxedému jsou obvykle přítomny tuhé, voskovité papuly s predilekční lokalizací hlava, krk, horní polovina trupu, předloktí a stehna (obr. 4). Projevy mohou postihovat proximální části prstů horních končetin. Okolní kůže papul je lesklá a pohmatově tuhá. V oblasti glabely se mohou vytvářet hluboké podélné rýhy, lemované tuhým infiltrátem a progredující na zbytek obličeje. Projevy v obličeji se přirovnávají ke lvímu obličeji (facies leontina). Při progresi onemocnění ložiska mohou být erytematózní, výrazněji infiltrovaná a tuhá, může být přítomna sklerodaktylie a snížená mobilita kloubů. Přidružená monoklonální gamapatie je obvykle IgG lambda. Pacienti se skleromyxedémem mohou mít řadu interních obtíží, jako je dysfagie, slabost proximálního svalstva způsobená myozitidou, periferní neuropatie, artropatie, syndrom karpálního tunelu, obstrukční plicní onemocnění a také postižení ledvin připomínající systémovou sklerodermii (46, 47).
Obr. 4. Skleromyxedém s postižením šíje a tvorbou tuhých papul a infiltrátů 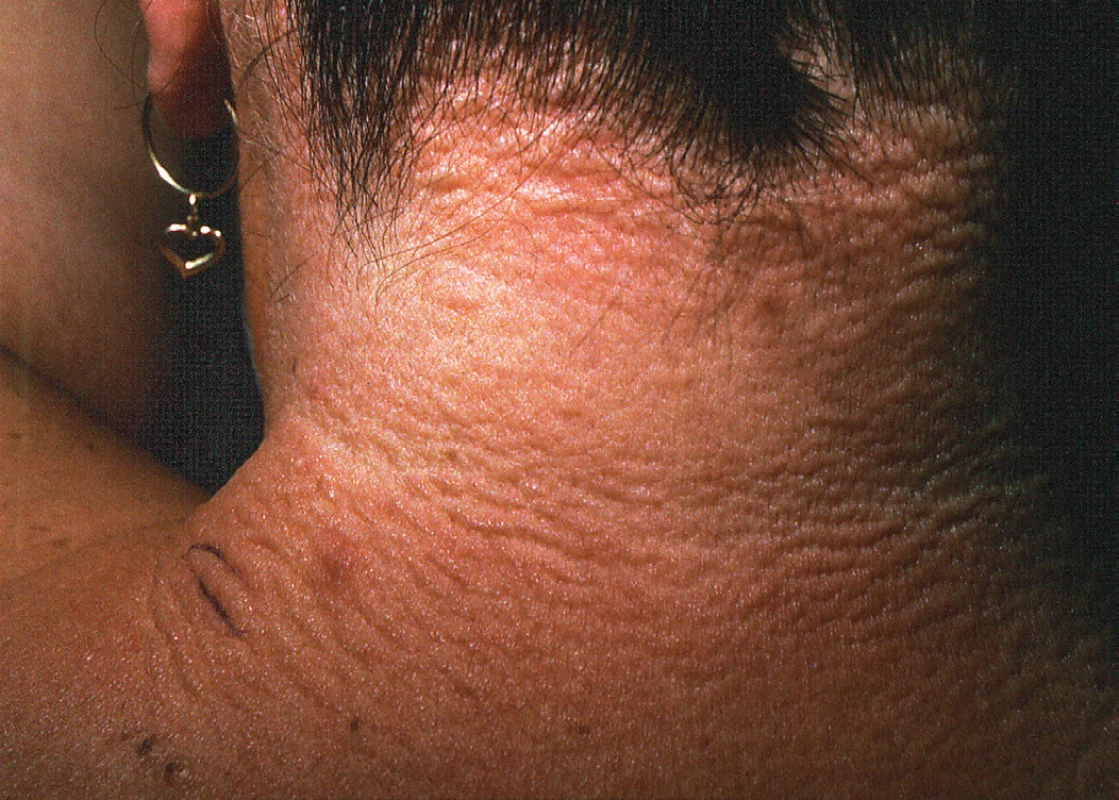
V histopatologickém obraze u skleromyxedému jsou charakteristická difuzní depozita mucinu v horní a střední části retikulární dermis. Poté je patrný nárůst ukládání kolagenu v retikulární dermis a se signifikantní proliferací nepravidelně distribuovaných fibroblastů. Mucin se může ukládat i do stěn krevních cév myokardu, ledvin, pankreatu, nadledvin, nervů nebo lymfatických uzlin (48).
V diferenciální diagnostice je na prvním místě systémová sklerodermie, dále nefrogenní systémová fibróza, při které mohou být v biopsiích kůže také přítomna depozita mucinu. U postižení obličeje s obrazem facies leontina lze myslet i na leishmaniózu, primární kožní lymfomy (mycosis fungoides, ojediněle i B-buněčné lymfomy), aktinický retikuloid, systémovou amyloidózu, nodulární mastocytózu, sarkoidózu nebo u nás nevyskytující se lepromatózní změny (44).
Lékem první volby jsou systémově podávané imunoglobuliny IVIg (2 g/kg/měsíc) samostatně nebo i v kombinaci s thalidomidem, nebo systémovými kortikoidy (49). Terapeutické možnosti jsou však založeny na jednotlivých kazuistikách nebo sériích menších skupin pacientů. V systémové léčbě byl s různým efektem dále zkoušen cyklofosfamid, methotrexát, nebo melfalan. Celkovou terapii lze kombinovat s fototerapií UVA nebo terapií PUVA. S různým efektem bylo popsáno na omezeném množství pacientů zkoušení systémových retinoidů, cyklosporinu, provádění plazmaferézy či autologní transplantaci kostní dřeně (50).
SCLEREDEMA ADULTORUM BUSCHKE
Scleredema adultorum je typicky symetrické difuzní ztuhnutí kůže horní poloviny trupu, způsobené ztluštěním dermis a depozity mucinu. Jedná se o vzácnější onemocnění, které postihuje pacienty všech ras. Skleredém spojený s diabetem je častější u mužů (2,5–14 % pacientů s diabetem) (51, 52), zatímco jiné formy jsou častější u žen, případně se vyskytují i v dětském věku (tab. 5). Patogeneze onemocnění je neznámá. Na tuhosti kůže se může podílet zvýšená produkce kolagenu typu 1 a glykosaminoglykanů fibroblasty v retikulární dermis, dále i ukládání mukopolysacharidů v dermis. Vedle genetické predispozice může tento jev být vyvolán různými stimuly, včetně infekcí, léky, imunoglobuliny, hyperinzulinismem a zánětlivými procesy (53, 54).
Tab. 5. Rozdělení scleredema adultorum – dle etiologie a četnosti (55, 57) 
Scleredema adultorum lze rozdělit do tří klinických variant. První typ postihuje především děti a ženy středního věku. Předchází mu horečka, malátnost a infekce (obvykle streptokoková) horních nebo dolních dýchacích cest. Typická lokalizace tohoto typu je cervikofaciální oblast, horní polovina trupu a proximální partie horních končetin. Při postižení obličeje dochází k obtížnému otevírání úst a obtížnému polykání. Tento typ má obvykle spontánní remisi do 2 let. Druhý typ má stejné klinické projevy jako první, ale s velmi pozvolnou manifestací projevů, tendencí k pomalé progresi stavu a chronickému postižení. Častěji je spojený s monoklonální gamapatií bez prokázané souvislosti s infekční etiologií (54, 55). Třetí typ zpravidla postihuje obézní muže středního věku s diabetem závislým na inzulinu (scleredema diabeticorum). Klinické projevy obvykle začínají velmi pomalu a postižení perzistuje. Postižená kůže může být erytematózní, je výrazně tuhá, s typickou lokalizací dorzální strany krku a zad (obr. 5). Ve všech třech formách mohou být přítomné systémové projevy, jako je serozitida, myozitida, dysartrie, dysfagie, parotitida a oční a srdeční abnormality (53, 55–57).
Obr. 5. Scleredema adultorum, postižení zad s patrným tuhým erytémem, který při abdukci paží vytváří na zádech bělavé okrsky kůže (v důsledku utlačení dermálních cév a následné ischemii kůže zesílenou a tuhou dermis při abdukčním postavení horních končetin) 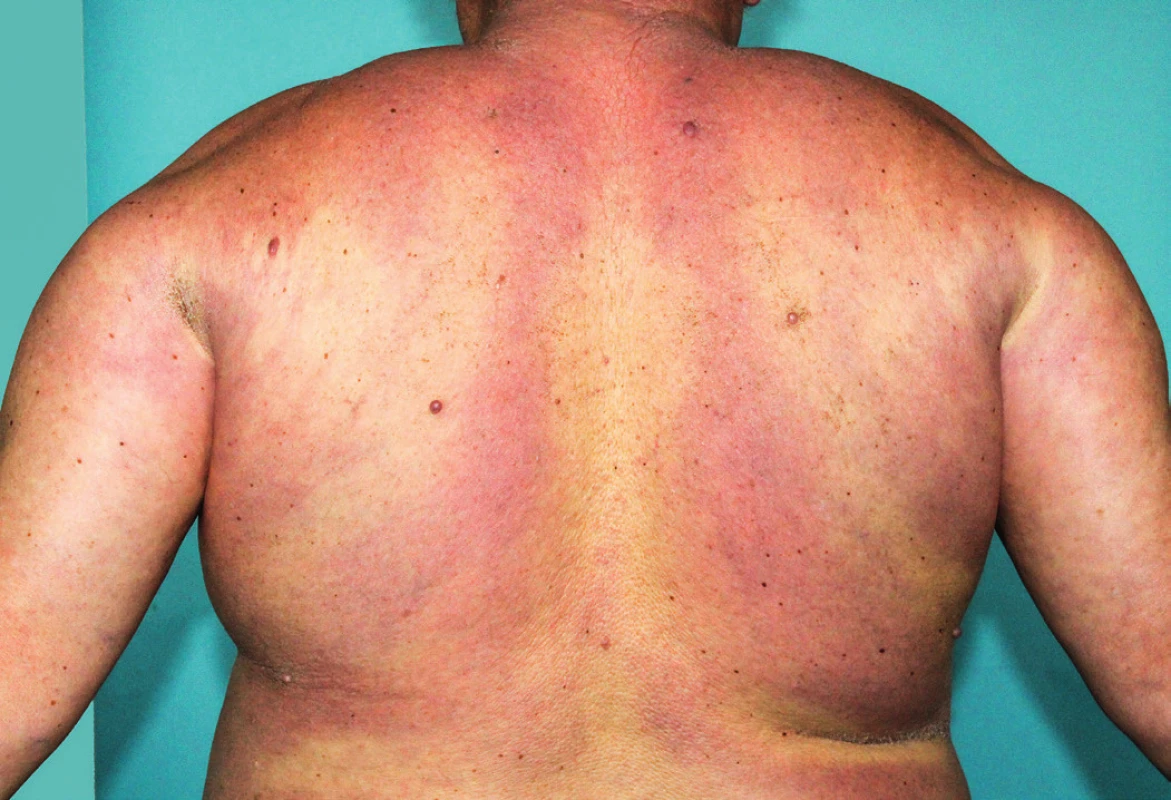
V bioptickém vyšetření je hlavním histopatologickým rysem zhuštěná retikulární dermis s atypickými velkými kolagenními svazky, mezi kterými lze prokázat depozita mucinu. Dále pak je i snížený počet elastických vláken, ale zachovaný počet fibroblastů. Mucinová depozita lze prokázat i v biopsiích kosterní či srdeční svaloviny.
Terapie prvního typu nutná není vzhledem k dobré prognóze a spontánnímu odeznění projevů. Terapie skleredému spojeného s diabetem nebo monoklonální gamapatií je obtížnější a není k dispozici žádná specifická a především účinná forma léčby. Fototerapie UVA nebo PUVA terapie je léčbou první volby. Byly zkoušeny systémové a intralezionální kortikosteroidy, intralezionálně aplikovaná hyaluronidáza, různá antibiotika, methotrexát, cyklosporin, pulzní terapie cyklofosfamidem, tamoxifen a alopurinol s různým efektem, který v případě alespoň částečného efektu je dokumentován spíš jen na ojedinělých případech. U pacientů se suboptimálně kompenzovaným diabetem je vhodné se vyhnout systémovému podávání glukokortikoidů (55–57).
DIABETICKÁ CHEIROARTROPATIE
Diabetes mellitus je spojován s celou řadou revmatologických projevů, které mohou výrazně ovlivnit kvalitu života pacienta. Jeden z těchto projevů zahrnuje diabetickou cheiroartropatii, která je spojena zejména s diabetem 1. typu, ale vyskytuje se i u diabetu 2. typu (8–53 %; jak 1. tak 2. typu) a tento typ artropatie můžeme vzácně nalézt i u nediabetické populace (12–25 %) (58–60). Diabetická cheiroartropatie postihuje typicky ruce. Předpokládá se, že je důsledkem zvýšené glykosylace kolagenu v kůži a je spojen s diabetickou retinopatií, nefropatií, délkou trvání diabetu, věkem a hladinou glykovaného hemoglobinu. Plošné zlepšení kontroly glykemie u diabetiků v posledních dvou dekádách vedlo k čtyřnásobnému poklesu výskytu diabetické cheiroartropatie (61, 62).
V klinickém obraze nacházíme zesílenou, tuhou kůži a omezenou pohyblivosti drobných kloubů rukou a prstů, což vede ke vzniku flekčních kontraktur a k neschopnosti sevřít prsty v pěst či špetku. U některých pacientů jsou přítomné na prstech i bolestivé ischemické ulcerace.
Terapie se opírá především o adekvátní kontrolu hladin glykemie, dále pak jsou doporučovány nesteroidní antirevmatika, k potlačení bolesti s podpůrným protizánětlivým efektem. Velký význam má fyzikální terapie a důkladná rehabilitační cvičení. Při zlepšených a korigovaných hladinách glykemie lze symptomy a příznaky zmírnit či dokonce navodit postupné odeznění projevů (62).
AMYLOIDÓZA
Amyloidózy představují heterogenní skupinu stavů, ve kterých je fibrilární materiál, který může být důsledkem patologické degradace různých proteinů, ukládán nejen v orgánech, ale i v kůži. Při primární kožní amyloidóze jsou depozita důsledkem ukládání a patologické degradace keratinu (makulární, lichenoidní) nebo imunoglobulinů (nodulární varianta) (63–65). Naproti tomu primární systémová (AL) amyloidóza je způsobena produkcí patologických proteinů plazmatickými buňkami (např. u mnohočetného myelomu), zatímco sekundární systémová (AA) amyloidóza vzniká z chronických zánětlivých stavů, jako je revmatoidní artritida nebo u chronických infekcí (66).
Specifické kožní léze primární systémové amyloidózy jsou voskové, někdy erytematózní, nebo nažloutlé papuly, noduly až ložiska. Může být přítomna tuhost kůže na rukou. Křehkost cév s depozity amyloidu vede ke krvácení do projevů a ke vzniku purpury, petechií a ekchymóz, někdy až s tvorbou hemoragických bul typicky v oblasti očních víček, krku, třísel a anogenitální oblasti. Z dalších příznaků může být přítomna makroglosie, edémy kardiální i renální etiologie, syndrom karpálního tunelu, artralgie, hepatomegalie, parestezie končetin, únava a nápadný váhový úbytek. Postižení končetin je charakteristické pro AL amyloid vznikající v důsledku poruchy plazmatických buněk u hematologických malignit (63, 64, 66).
Biopsie kůže odhaluje akumulaci amyloidu s charakteristickými vlastnostmi barvení konžskou červení (zelený dvojlom) při použití polarizační mikroskopie. Dále lze využít technik imunohistochemických s průkazem amyloidu za použití specifické protilátky. Imunofixace séra nebo moči je nezbytná pro jednoznačnou identifikaci monoklonální složky odpovědné za systémovou formu amyloidózy (67).
Léčba všech forem amyloidózy je svízelná. U primárních kožních amyloidóz lze vyzkoušet aplikaci lokálních kortikoidů, případně v kombinaci s fototerapií UVA, i když UV záření je jedním ze zvažovaných možných vyvolávajících faktorů. U primární systémové (AL) amyloidózy je nezbytná léčba primárního např. hematologického onemocnění. U sekundárních (AA) amyloidóz spočívá terapie v léčbě vyvolávajícího zánětlivého onemocnění zejména pomocí konvenčních syntetických chorobu modifikujících léků (csDMARDs) a z novějších léků pak zejména anti-TNF preparáty, tocilizumabem a inhibitory Janus kináz (JAKi) (65, 66, 68).
ZÁVĚR
Onemocnění připomínající systémovou sklerodermii představují heterogenní skupinu onemocnění různorodé etiologie a patogeneze. Základem správné diagnostiky a léčby je interdisciplinární spolupráce revmatologie a dermatologie s možností odběru biopsie kůže a histopatologické diagnostiky onemocnění. Multioborový přístup se uplatňuje i při léčebném postupu, včetně možností chirurgických a následných rehabilitačních technik. Základem diagnostiky je ale i pečlivě provedená anamnéza a fyzikální vyšetření, které přispívají k diagnostice a mohou odlišit tato onemocnění od systémové sklerodermie. Distribuce a struktura postižení kůže (u SSc obvykle: sklerodaktylie; difuzní edém prstů, ischemické defekty/gangrény/jamkovité jizvičky, teleangiektázie, kalcinóza), přítomnost Raynaudova fenoménu (obvykle se známky sekundárního Raynaudova fenoménu: nástup po 40. roce života, ischemické bolesti, anamnéza příznaků méně než 3 roky, relativně rychlé zhoršování záchvatů) nebo abnormální kapilaroskopie nehtových valů (charakteristické změny pro SSc). Přítomnost a typ charakteristických systémových projevů SSc (typické orgánové postižení a komplikace charakteristické pro SSc) nebo specifických laboratorních parametrů (ANA a autoprotilátky specifické pro SSc jako zejména anti-DNA-topoizomeráza I, anti-centromerové protilátky a anti-RNA-polymeráza III) mohou být nápomocné při stanovení diagnózy (viz tab. 2) (23–25).
Nejčastějším diferenciálně diagnostickým problém SSc je lokalizovaná sklerodermie, též nazývaná morfea. Mnozí odborníci doporučují užívání souhrnného termínu morfea pro všechny formy tohoto onemocnění, protože lokalizovaná sklerodermie, na rozdíl od SSc, zpravidla nepostihuje vnitřní orgány, jako je gastrointestinální trakt, srdce, plíce a ledviny, a není spojena se zkráceným přežitím nemocných. Důvodem je předejít zbytečnému zneklidnění a zaměňování těchto dvou chorob jak u nemocných, tak i lékařů. I když se u obou onemocnění uplatňují podobné patogenetické pochody, jedná se o různá onemocnění, která se vzácně mohou vyskytovat současně, ale nepřechází jedno v druhé (6).
V rámci dermatologického vyšetření lze provézt diagnosticky mnohdy nenahraditelnou hlubokou biopsii kůže, někdy i s nezbytným odběrem přilehlé fascie a svalu pod ní. Následné možnosti základních a rozšířených technik histologického barvení (detekce depozit mucinu – alciánová modř; barvení na kolagen – Massonův trichrom, elastická vlákna – zelený trichrom, nebo barvení amyloidu – kongo červeň) přispívají v širším diagnostickém procesu a slouží k upřesnění klinicko-patologické korelace nálezů.
Pro některá tato onemocnění jsou k dispozici relativně účinné formy terapie, zatímco jiné jsou bohužel k léčebným modalitám refrakterní a terapeutické úspěchy jsou zaznamenány pouze na jednotlivých pacientech. Správná a rychlá diagnostika s diferenciálně diagnostickou rozvahou pomáhá zahájit, pokud možno efektivní léčbu, která by pro pacienta představovala přiměřené zdravotní zatížení.
Konflikt zájmů: žádný.
adresa pro korespondenci:
MUDr. Ondřej Kodet, Ph.D
Dermatovenerologická klinika 1. LF UK a VFN
U Nemocnice 2, 128 00, Praha 2
e-mail: ondrej.kodet@lf1.cuni.cz
Zdroje
1. Ingegnoli F, Ughi N, Mihai C. Update on the epidemiology, risk factors, and disease outcomes of systemic sclerosis. Best Pract Res Clin Rheumatol 2018; 32 : 223–240.
2. Nikpour M, Stevens WM, Herrick AL, Proudman SM. Epidemiology of systemic sclerosis. Best Pract Res Clin Rheumatol 2010; 24 : 857–869.
3. Sehgal VN, Srivastava G, Aggarwal AK, Behl PN, Choudhary M, Bajaj P. Localized scleroderma/morphea. Int J Dermatol 2002; 41 : 467–475.
4. Gabrielli A, Avvedimento E V, Krieg T. Scleroderma. N Engl J Med 2009; 360 : 1989–2003.
5. Fett N, Werth VP. Update on morphea: Part I. Epidemiology, clinical presentation, and pathogenesis. J Am Acad Dermatol 2011; 64 : 217–228.
6. Kreuter A, Krieg T, Worm M, et al. German guidelines for the diagnosis and therapy of localized scleroderma. JDDG – J Ger Soc Dermatology 2016; 14 : 199–216.
7. Peterson LS, Nelson AM, Su WPD, Mason T, O’Fallon WM, Gabriel SE. The epidemiology of morphea (localized scleroderma) in Olmsted County 1960–1993. J Rheumatol 1997; 24 : 73–80.
8. Kreuter A, Wischnewski J, Terras S, Altmeyer P, Stücker M, Gambichler T. Coexistence of lichen sclerosus and morphea: A retrospective analysis of 472 patients with localized scleroderma from a German tertiary referral center. J Am Acad Dermatol 2012; 67 : 1157–1162.
9. Badea I, Taylor M, Rosenberg A, Foldvari M. Pathogenesis and therapeutic approaches for improved topical treatment in localized scleroderma and systemic sclerosis. Rheumatology (Oxford) 2009; 48 : 213–221.
10. Yamane K, Ihn H, Kubo M, et al. Increased serum levels of soluble vascular cell adhesion molecule 1 and E-selectin in patients with localized scleroderma. J Am Acad Dermatol 2000; 42 : 64–69.
11. Marzano A V., Menni S, Parodi A, et al. Localized scleroderma in adults and children. Clinical and laboratory investigations of 239 cases. Eur J Dermatology 2003; 13 : 171–176.
12. Sato T, Goto M, Takeo N, Hatano Y. Case of generalized morphea with the manifestation of diffuse systemic cutaneous sclerosis without sclerodactyly. J Dermatol 2018; 45: e100–101.
13. Adamska U, Slinko A, Białecka A, Męcińska-Jundziłł K, Adamski P, Czajkowski R. Unilateral generalized morphea: a case report and literature review. Postep dermatologii i Alergol 2018; 35 : 425–428.
14. Cantisani C, Miraglia E, Richetta AG, Mattozzi C, Calvieri S. Generalized morphea successfully treated with tacrolimus 0.1% ointment. J Drugs Dermatol 2013; 12 : 14–15.
15. Walker D, Susa JS, Currimbhoy S, Jacobe H. Histopathological changes in morphea and their clinical correlates: Results from the Morphea in Adults and Children Cohort V. J Am Acad Dermatol 2017; 76 : 1124–1130.
16. Spielmann L, Arnaud L, Severac F, et al. Population-based prevalence of eosinophilic fasciitis (Shulman syndrome): a capture-recapture study. Br J Dermatol 2018; 179 : 516–517.
17. Lakhanpal S, Ginsburg WW, Michet CJ, Doyle JA, Moore SB. Eosinophilic fasciitis: Clinical spectrum and therapeutic response in 52 cases. Semin Arthritis Rheum 1988; 17 : 221–231.
18. Bielsa Marsol I. Update on the classification and treatment of localized scleroderma. Actas Dermosifiliogr 2013; 104 : 654–666.
19. Liu Y, Zeng Y, Xie Y, et al. Eosinophilic fasciitis associated with myositis: Report of four cases and review of the literature. Australas J Dermatol 2019; 60: e227–231.
20. Onajin O, Wieland CN, Peters MS, Lohse CM, Lehman JS. Clinicopathologic and immunophenotypic features of eosinophilic fasciitis and morphea profunda: A comparative study of 27 cases. J Am Acad Dermatol 2018; 78 : 121–128.
21. Walker D, Susa JS, Currimbhoy S, Jacobe H. Histopathological changes in morphea and their clinical correlates: Results from the Morphea in Adults and Children Cohort V. J Am Acad Dermatol 2017; 76 : 1124–1130.
22. Baumann F, Brühlmann P, Andreisek G, Michel BA, Marincek B, Weishaupt D. MRI for diagnosis and monitoring of patients with eosinophilic fasciitis. Am J Roentgenol 2005; 184 : 169–174.
23. Haustein U-F. Scleroderma and pseudo-scleroderma: uncommon presentations. Clin Dermatol 2005; 23 : 480–490.
24. Foti R, Leonardi R, Rondinone R, et al. Scleroderma-like disorders. Autoimmun Rev 2008; 7 : 331–339.
25. Ferreli C, Gasparini G, Parodi A, Cozzani E, Rongioletti F, Atzori L. Cutaneous Manifestations of Scleroderma and Scleroderma-Like Disorders: a Comprehensive Review. Clin Rev Allergy Immunol 2017; 53 : 306–336.
26. Kelsey CE, Torok KS. The localized scleroderma cutaneous assessment tool: responsiveness to change in a pediatric clinical population. J Am Acad Dermatol 2013; 69 : 214–220.
27. Zwischenberger BA, Jacobe HT. A systematic review of morphea treatments and therapeutic algorithm. J Am Acad Dermatol 2011; 65 : 925–941.
28. Caca-Biljanovska NG, Vlckova-Laskoska MT, Dervendi D V, Pesic NP, Laskoski DS. Treatment of generalized morphea with oral 1,25-dihydroxyvitamin D3. Adv Exp Med Biol 1999; 455 : 299–304.
29. Stefanaki C, Stefanaki K, Kontochristopoulos G, et al. Topical tacrolimus 0.1% ointment in the treatment of localized scleroderma. An open label clinical and histological study. J Dermatol 2008; 35 : 712–718.
30. Dytoc M, Wat H, Cheung-Lee M, Sawyer D, Ackerman T, Fiorillo L. Evaluation of the efficacy and safety of topical imiquimod 5% for plaque-type morphea: a multicenter, prospective, vehicle-controlled trial. J Cutan Med Surg 2015; 19 : 132–139.
31. Kroft EBM, Berkhof NJG, van de Kerkhof PCM, Gerritsen RMJP, de Jong EMGJ. Ultraviolet A phototherapy for sclerotic skin diseases: A systematic review. J Am Acad Dermatol 2008; 59 : 1017–1030.
32. Kreuter A, Gambichler T, Breuckmann F, et al. Pulsed high-dose corticosteroids combined with low-dose methotrexate in severe localized scleroderma. Arch Dermatol 2005; 141 : 847–852.
33. Mazori DR, Femia AN, Vleugels RA. Eosinophilic Fasciitis: an updated review on diagnosis and treatment. Curr Rheumatol Rep 2017; 19 : 74.
34. Endrikat J, Dohanish S, Schleyer N, Schwenke S, Agarwal S, Balzer T. 10 years of nephrogenic systemic fibrosis: A Comprehensive Analysis of Nephrogenic Systemic Fibrosis Reports Received by a Pharmaceutical Company from 2006 to 2016. Invest Radiol 2018; 53 : 541–550.
35. Smorodinsky E, Ansdell DS, Foster ZW, et al. Risk of nephrogenic systemic fibrosis is low in patients with chronic liver disease exposed to gadolinium-based contrast agents. J Magn Reson Imaging 2015; 41 : 1259–1267.
36. Bruce R, Wentland AL, Haemel AK, et al. Incidence of Nephrogenic Systemic Fibrosis Using Gadobenate Dimeglumine in 1423 Patients with Renal Insufficiency Compared with Gadodiamide. Invest Radiol 2016; 51 : 701–705.
37. Thomsen HS. Nephrogenic systemic fibrosis: A serious adverse reaction to gadolinium-1997-2006-2016. Part 2. Acta Radiol 2016; 57 : 643–648.
38. Thomsen HS. Nephrogenic systemic fibrosis: A serious adverse reaction to gadolinium-1997-2006-2016. Part 1. Acta Radiol 2016; 57 : 515–520.
39. Liu T, McCalmont TH, Frieden IJ, Williams ML, Connolly MK, Gilliam AE. The stiff skin syndrome: Case series, differential diagnosis of the stiff skin phenotype, and review of the literature. Arch Dermatol 2008; 144 : 1351–1359.
40. Deng X, Chen F, Song Z, et al. Four new cases of stiff skin syndrome with unusual presentations. J Eur Acad Dermatol Venereol 2016; 30 : 163–165.
41. Geng S, Lei X, Toyohara JP, Zhan P, Wang J, Tan S. Stiff skin syndrome. J Eur Acad Dermatol Venereol 2006; 20 : 729–732.
42. Guiducci S, Distler JHW, Milia AF, et al. Stiff skin syndrome: Evidence for an inflammation-independent fibrosis? Rheumatology (Oxford) 2009; 48 : 849–852.
43. Victor V, Margareat RM. Plasma cell myeloma masquerading as scleromyxedema. Indian Dermatol Online J 2019; 10 : 50–53.
44. Aoki M, Matsushita S, Kawai K, Kanekura T. Scleromyxedema clinically resembling to scleroderma. Indian J Dermatol 2016; 61 : 127.
45. Rongioletti F, Rebora A. Updated classification of papular mucinosis, lichen myxedematosus, and scleromyxedema. J Am Acad Dermatol 2001; 44 : 273–281.
46. Nofal A, Amer H, Nofal E. Scleromyxedema without paraproteinemia. Int J Dermatol 2016; 55: e418–419.
47. Lipsker D. Monoclonal gammopathy of cutaneous significance: review of a relevant concept. J Eur Acad Dermatology Venereol 2017; 31 : 45–52.
48. Rongioletti F, Rebora A. Cutaneous mucinoses: microscopic criteria for diagnosis. Am J Dermatopathol 2001; 23 : 257–267.
49. Guarneri A, Cioni M, Rongioletti F. High-dose intravenous immunoglobulin therapy for scleromyxoedema: a prospective open-label clinical trial using an objective score of clinical evaluation system. J Eur Acad Dermatology Venereol 2017; 31 : 1157–1160.
50. Saniee S, Davarnia G. Scleromyxedema without paraproteinemia: Treatment with thalidomide and prednisolone. Case Rep Dermatol 2016; 8 : 327–332.
51. Cole GW, Headley J, Skowsky R. Scleredema diabeticorum: A common and distinct cutaneous manifestation of diabetes mellitus. Diabetes Care 1983; 6 : 189–192.
52. Sattar MA, Diab S, Sugathan TN, Sivanandasingham P, Fenech FF. Scleroedema diabeticorum: a minor but often unrecognized complication of diabetes mellitus. Diabet Med 1988; 5 : 465–468.
53. Meguerditchian C, Jacquet P, Béliard S, et al. Scleredema adultorum of Buschke: An under recognized skin complication of diabetes. Diabetes Metab 2006; 32 : 481–484.
54. Miguel D, Schliemann S, Elsner P. Treatment of scleroedema adultorum buschke: A systematic review. Acta Derm Venereol 2018; 98 : 305–309.
55. Kreuter A. Scleredema adultorum: Clinical presentation, diagnostic workup, differential diagnosis, treatment option. Hautarzt 2018; 69 : 908–915.
56. Raboudi A, Litaiem N. Scleredema (Buschke Disease, Scleredema of Buschke, Scleredema Adultorum). In: StatPearls. Treasure Island (FL): StatPearls Publishing 2020.
57. Beers WH, Ince A, Moore TL. Scleredema adultorum of Buschke: a case report and review of the literature. Semin Arthritis Rheum 2006; 35 : 355–359.
58. Jelinek JE. The skin in diabetes. Diabet Med 1993; 10 : 201–213.
59. Arkkila PE, Kantola IM, Viikari JS. Limited joint mobility in type 1 diabetic patients: correlation to other diabetic complications. J Intern Med 1994; 236 : 215–223.
60. Ramchurn N, Mashamba C, Leitch E, et al. Upper limb musculoskeletal abnormalities and poor metabolic control in diabetes. Eur J Intern Med 2009; 20 : 718–721.
61. Cherqaoui R, McKenzie S, Nunlee-Bland G. Diabetic cheiroarthropathy: a case report and review of the literature. Case Rep Endocrinol 2013; 2013 : 257028.
62. Hider SL, Roy DK, Augustine T, Parrott N, Bruce IN. Resolution of diabetic cheiroarthropathy after pancreatic transplantation. Diabetes Care 2004; 27 : 2279–2280.
63. Palladini G, Merlini G. Systemic amyloidoses: what an internist should know. Eur J Intern Med 2013; 24 : 729–739.
64. Schreml S, Szeimies R-M, Vogt T, Landthaler M, Schroeder J, Babilas P. Cutaneous amyloidoses and systemic amyloidoses with cutaneous involvement. Eur J Dermatol 2010; 20 : 152–160.
65. Weidner T, Illing T, Elsner P. Primary localized cutaneous amyloidosis: a systematic treatment review. Am J Clin Dermatol 2017; 18 : 629–642.
66. Wechalekar AD, Gillmore JD, Hawkins PN. Systemic amyloidosis. Lancet 2016; 387 : 2641–2654.
67. Nilsson KPR, Ikenberg K, Aslund A, et al. Structural typing of systemic amyloidoses by luminescent-conjugated polymer spectroscopy. Am J Pathol 2010; 176 : 563–574.
68. Dember LM, Madias NE, Harrington JT, Perrone RD, Levey AS, Kausz A. Emerging treatment approaches for the systemic amyloidoses. Kidney Int 2005; 68 : 1377–1390.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2020 Číslo 3- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Národní registr biologické a cílené léčby revmatických onemocnění ATTRA – 20leté zkušenosti
- Validace české verze dotazníků hodnotících únavu a pohybovou aktivitu u pacientů s revmatickými onemocněními: Fatigue Impact Scale (FIS), Multidimensional Assessment of Fatigue Scale (MAF), Human Activity Profile (HAP)
- Současný význam séronegativní revmatoidní artritidy
- Úloha virů při vzniku autoimunitních onemocnění
- Diferenciálně diagnostické stavy systémové sklerodermie z pohledu dermatologa
- Dieta u dny – máme omezit puriny?
- Vzpomínka na profesora Lenocha
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Současný význam séronegativní revmatoidní artritidy
- Validace české verze dotazníků hodnotících únavu a pohybovou aktivitu u pacientů s revmatickými onemocněními: Fatigue Impact Scale (FIS), Multidimensional Assessment of Fatigue Scale (MAF), Human Activity Profile (HAP)
- Úloha virů při vzniku autoimunitních onemocnění
- Dieta u dny – máme omezit puriny?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



