Revmatologické manifestace HIV infekce
Rheumatic manifestations in HIV
Diagnosis of Human Immunodeficiency Virus (HIV) infection is still rare in rheumatology outpatient clinics. HIV infection has typically long latent period with a slow progression to the acquired immunodeficiency syndrome (AIDS). Specific rheumatic symptoms associated with HIV infection are painful joint syndrome, HIV-associated arthritis, HIV-associated arthritis and the diffuse infiltrative lymphocytosis syndrome (DILS). Systemic connective tissue disease may develop de novo in HIV patients, and its manifestations may overlap with the manifestations of infection. The overlapping manifestations could delay diagnosis of HIV infection in patients with pre-existing rheumatic disease prior to HIV infection. Retroviral therapy effectively slows down the course of HIV infection. It reduces the prevalence of opportunistic infections and DILS, but it can induce a number of immunological abnormalities. Interestingly, diseases associated with CD4 + lymphocyte activity, such as rheumatoid arthritis or systemic lupus erythematosus are going to remission in the course of HIV infection, but may relapse after effective retrovirus therapy, when level CD4+ rises. This paper will address the characteristics of rheumatic manifestations in HIV infection.
Keywords:
AIDS – systemic disease of the binder – arthritis – DMARD – rheumatic manifestation
Autoři:
H. Ciferská; J. Hořínková
Působiště autorů:
Revmatologický ústav a Revmatologická klinika 1. LF UK, Praha
Vyšlo v časopise:
Čes. Revmatol., 27, 2019, No. 1, p. 30-41.
Kategorie:
Přehledový článek
Souhrn
Diagnostika infekce lidského viru imunitní nedostatečnosti (HIV) spojená s postižením muskuloskeletálního aparátu patří dosud k poměrně raritním onemocněním v revmatologické ambulanci. HIV je retrovirus, pro který je typická dlouhodobá latentní infekce s pomalou progresí do syndromu získaného imunodeficitu (AIDS). Mezi specifické revmatické projevy asociované s infekcí HIV patří bolestivý kloubní syndrom, HIV asociovaná artritida a syndrom difuzní infiltrativní lymfocytózy (DILS). Systémové onemocnění pojiva může vzniknout de novo u nemocných z HIV a jeho manifestace se může překrývat s projevy infekce, stejně tak jako u nemocných s již preexistujícím onemocněním před infekcí HIV. Retrovirová terapie efektivně zabraňuje progresi infekce HIV, snižuje manifestaci oportunních infekcí za předpokladu včasné diagnózy této infekce, ale může indukovat řadu imunologických abnormalit v rámci imunorestitučního zánětlivého syndromu (IRIS) – myopatii, rabdomyolýzu, osteonekrózu a další. Zajímavostí je, že onemocnění spojené s aktivitou CD4+ lymfocytů, např. revmatoidní artritida či systémový lupus erythematodes, mají sklon k remisi při vzplanutí HIV infekce, ale může dojít k jejich relapsu při efektivní retrovirové terapii. Sdělení se zabývá charakteristikou revmatických projevů u HIV infekce.
Klíčová slova:
AIDS – systémové onemocnění pojiva – artritida – DMARD – revmatické manifestace
ÚVOD
Projevy spojené s postižením pohybového aparátu spojené s infekcí lidského viru imunitní nedostatečnosti (HIV) byly popsány poměrně záhy po identifikaci viru HIV jako původce syndromu získaného imunodeficitu. Nástup účinné antiretrovirové terapie (cART) zabraňuje rozvinutí AIDS (syndromu získaného imunodeficitu) spojeného s projevy potenciálně fatálních infekčních komplikací či neoplazií (1). V současnosti, za předpokladu včasné diagnózy HIV infekce, včasné nasazení účinné antiretrovirové léčby, která je pacientem pravidelně užívaná, nedojde k progresi HIV a rozvoji AIDS. Bylo dokumentováno, že HIV pozitivní nemocní mají vyšší riziko vzniku revmatického onemocnění, které se může manifestovat v jakémkoliv stadiu onemocnění. Postižení muskuloskeletálního aparátu výrazně snižuje kvalitu života a zvyšuje dependenci nemocných a může vést k postupné invalidizaci. Revmatické onemocnění u HIV infekce může předcházet infekci, může vzniknou de novo v průběhu infekce či může být indukované podáváním cART. Kloubní syndromy dokumentované u HIV zahrnují HIV asociovanou artritidu, artralgie, bolestivý kloubní syndrom, séronegativní spondyloartropatie (SpA), reaktivní artritidu, psoriatickou artritidu (PsA) a revmatoidní artritidu (RA). Systémové onemocnění pojiva u HIV nemocných je ovlivňováno celou řadou imunologických abnormalit spojených se změnami v populaci CD4+ buněk, zejména se jedná o systémový lupus erythematodes či RA. Mezi další onemocnění pozorovaná u HIV patří vaskulitidy, HIV asociovaná myozitida, avaskulární osteonekróza a poruchy kostního metabolismus s rozvojem osteoporózy (2).
Terapie revmatických onemocnění u HIV je ovlivněna celou řadou faktorů, mezi které patří aktivita a stadium HIV, počet CD4+ buněk a lékové interakce s cART. Imunosupresivní terapie sice potlačuje projevy zánětlivého revmatického onemocnění, ale zvyšuje riziko infekčních komplikací. Dalším aspektem je léková interakce mezi užívanými cART a chorobu modifikujícími léky (csDMARD) či podávání bDMARD. Dosud nebyla publikována data velkého počtu nemocných s HIV a revmatickými chorobami, která by sledovala bezpečnost a účinnost imunosupresivní terapie, nicméně jsou k dispozici data na malých kohortách nemocných a kazuistická sdělení (1, 3).
INFEKCE HIV – STRUČNÁ CHARAKTERISTIKA A DIAGNOSTIKA
HIV je retrovirus s afinitou především k celé řadě buněčných populací dendritických buněk, makrofágů k T-lymfocytům CD4+. Působením viru dochází k poklesu CD4+ pozitivních buněčných populací, což vede k narušení buněčné i humorální imunity s nárůstem rizika rozvoje infekčních a nádorových onemocnění. Vliv poklesu CD4+ má vliv i na probíhající autoimunitní onemocnění (4).
Fylogenetické virologické studie poukázaly na podobnost HIV viru s opičím virem imunitní nedostatečnosti (SIV). SIV byl identifikován ve dvou opičích populacích – jedné žijící na ostrově Bioko u afrického pobřeží a u šimpanzů v Kamerunu (5). Přímý průkaz přenosu z opičího hostitele na člověka nebyl prokázán. Spekuluje se o mutaci virových regulátorových genů a adaptaci viru na jiného hostitele. Dosud jsou popsány dva typy HIV viru: HIV-1 a HIV-2. Tyto varianty mají podobnost se SIV, ale s variantami SIV u různých populací primátů. HIV-1 má podobnost se SIV šimpanzů a HIV-2 se SIV dedikovaným v populaci magabejů kouřových. Virus HIV-1 je původcem celosvětového 95% případu infekce, zatímco HIV-2 pouze 5%. HIV-1 má celou řadu subtypů, jejichž původ lze nalézt v různorodých populacích primátů. Poslední varianta HIV-1 P byla popsána v Kamerunu u jedné pacientky v roce 2009 a následně u dalšího pacienta tamtéž, zajímavostí je jeho blízká podobnost s gorilí SIV (6, 7).
Infekce HIV se přenáší třemi hlavními způsoby: pohlavním stykem (heterosexuálním a homosexuálním), parenterálním přenosem zejména u intravenózních uživatelů drog a perinatálním přenosem z matky na dítě. Nejčastější cestou přenosu je sexuální styk a míra rizikovosti přenosu závisí na jeho formě. Za nejrizikovější se považuje nechráněný anální styk, vzhledem k riziku vzniku slizničního krvácení. Riziko infekce HIV se zvyšuje s počtem sexuálních partnerů, nechráněným stykem a současném užíváním drog. U tohoto přenosu bývá častá koincidence s dalšími sexuálně přenosnými chorobami. Intravenózní uživatelé drog patří k velmi rizikové skupině stran parenterálního přenosu HIV infekce – obzvláště při sdílení jehel a injekčních stříkaček v komunitě. Získání HIV cestou transfuze je možnou, ale v současnosti poměrně vzácnou formou přenosu. Zdrojem bývá bodnutí o jehlu, obzvláště ve zdravotnictví, či styk cizí krve se sliznicí nebo pokousání HIV pozitivním pacientem. V tomto případě je teoreticky možná nákaza, pokud se jedná o „krvavé pokousání“. K přenosu HIV nemůže dojít i za předpokladu, že HIV pozitivní je na léčbě a dosáhl nedetekovatelné virové nálože v krvi. Virus je v různé míře obsažen v tělesných tekutinách nemocných s různým infekčním potenciálem (krev, sperma, vaginální sekret, mozkomíšní mok, mateřské mléko, preejakulační tekutina a ve velmi nízkých koncentracích ve slinách, slzách a moči), kromě potu (8–11).
HIV infekce probíhá v několika různě dlouhých stadiích. Dnes se používají dva klasifikační systémy: jeden podle Světové zdravotnické organizace (WHO) a druhý dle Centra pro kontrolu a prevenci nemocí v USA (CDC) (12, 13).
Akutní retrovirový syndrom vzniká s odstupem asi kolem 4. týdne od vstupu viru HIV do orga-
nismu a představuje akutní projevy HIV infekce. Typicky se obtíže objeví u 50–90 % pacientů v podobě symptomů podobným mononukleóze (tozilofaringitida, lymfadenitida, febrilie), nebo flu-like projevy (artralgie, myalgie, prchavý exantém). U malé části nemocných může být toto stadium zcela asymptomatické (11). Postupně dochází k replikaci viru a nárůstu virové nálože s přechodem onemocnění do chronicity.
Asymptomatické stadium je individuální a postupně dochází k poklesu CD4+ s alteracemi imunitního systému a onemocnění přechází do časného symptomatického stadia spojeného zprvu s nespecifickými příznaky v podobě váhového úbytku, febrilií, nočními poty či únavy. Pokles CD4+ buněk pod 200/mm3 je spojený s rozvojem pozdního symptomatického stadia – AIDS. Objevují se oportunní infekce, dochází ke kachektizaci, HIV specifickému orgánovému postižení, např. HIV asociované encefalopatii a dalším. Toto období je spjaté i s manifestací malignit asociovaných s HIV (Kaposiho sarkom a další). Popis terapeutických cART režimů přesahuje obsah toho článku a je podáván ve specializovaných infektologických ambulancích. Zahájení a průběh cART terapie může být komplikované rozvojem imunorestitučního zánětlivého syndromu (IRIS). IRIS je paradoxní reakce spojená se zhoršením projevů HIV infekce, manifestací oportunních infekcí a vznikem či zhoršením stávajících autoimunitních onemocnění a HIV asociovaných nádorových onemocnění. Rizikovou skupinu pro rozvoj IRIS tvoří nemocní, kteří měli v úvodu přítomnou výraznou depleci CD4+ buněk a je u nich dobrá odpověď na cART s nárůstem CD4+ buněk a poklesem virových kopií. Vznik IRIS není většinou důvodem k přerušení cART a prognóza je většinou dobrá v závislosti na jeho manifestacích (11, 12, 14).
Vyšetření při podezření na přítomnost HIV lze provést pouze se souhlasem pacienta. Lokální laboratoř provede screeningový test s detekcí protilátek proti HIV-1, HIV 2 a antigen p24 HIV-1, což umožňuje zkrácení diagnostického okna. V případě pozitivity screeningu je nutná konfirmace prostřednictvím vyšetření v Národní referenční laboratoř Státního zdravotního ústavu (NRL SZÚ). Nemocní s pozitivním výsledkem jsou referování infekční pracoviště – AIDS centra. V současnosti je v České republice k dispozici osm pracovišť (15).
MUSKULOSKELETÁLNÍ PROJEVY HIV INFEKCE
Postižení muskuloskeletálního aparátu u HIV nemocných se dá rozdělit do třech subtypů předcházejících infekci asociované s HIV infekcí a nezávisle na HIV infekci vzniklé v průběhu infekce. HIV infekce není jedinou infekční příčinou obtíží spojených s pohybovým aparátem, je třeba brát v úvahu i oportunní infekce a v endemických oblastech i tuberkulózu. Epidemiologická studie zabývající se prevalencí bolesti v populaci pacientů s HIV dokumentuje, že až 63 % nemocných udávalo výskyt bolesti nejčastěji v podobě artralgií a myalgií (16).
Nezánětlivé kloubní projevy u HIV infekce
Nezánětlivé kloubní projevy se projevují typicky artralgiemi s různou intenzitou bez přítomnosti artritidy.
Artralgie jsou často spojené s pocitem ztuhlosti. Prevalence je mezi 5–79 % (17, 18). Artralgie jsou intermitentní s převahou v oblasti loktů, ramen a kolen. Mohou postihovat jeden či více kloubů. Vzácně progredují k zánětlivému kloubnímu onemocnění. Literární údaje se však rozcházejí a uvádějí, že není rozdíl mezi zdravou populací a populací s HIV. Léčba je symptomatická většinou nesteroidními antirevmatiky (19).
Bolestivý kloubní syndrom je popisován jako velmi intenzivní bolest kloubů a kostí trvající
méně než 24 hodin obtížně reagující na analgetickou terapii. Bolesti kloubů jsou bez přítomnosti artritidy. Nejčastější je bolest udávána v oblasti velkých kloubů, ale mohou být postiženy i drobné klouby rukou a nohou. Rentgenové nálezy jsou nespecifické, ojediněle je popisována periartikulární poróza. Terapie je doporučována symptomatická k překlenutí bolesti, neopiátová analgetika (20–22).
Avaskulární nekróza je vzácnější komplikace HIV infekce, předpokládá se roční incidence rozvoje symptomatické osteonekrózy 1 %, což převyšuje výskyt v běžné populaci (23). Patogeneze podílející se na vzniku avaskulární osteonekrózy u HIV není dosud plně objasněna. Studie na velkých kohortách pacientů poukázaly na možnou souvislosti mezi cART a současným podáváním glukokortikoidů. Metaanalýzy identifikovaly další rizikové faktory, a to přítomnost antifosfolipidových protilátek, alkohol, intravenózní užívání drog – stejně tak jako samotná infekce HIV. Typickým příznakem je bolest v postižené oblasti při zatížení, ale u části asymptomatických nemocných může být osteo-
nekróza zachycena při rentgenovém vyšetření z jiné indikace (23, 24).
Osteopenie/osteoporóza se vykytuje až třikrát častěji u pacientů s HIV proti zdravé populaci. Mezi rizikové faktory u nemocných s HIV patří užívání inhibitorů proteáz (atazanavir, efavirenz, darunavir a další), pokročilá HIV infekce, vysoká virová nálož, nízká tělesná hmotnost, nízká hladina vitaminu D a kouření. U nemocných s HIV byly pozorovány změny kalciofosfátového metabolismu jednak v důsledku přímého vlivu infekce na kost a tkáň příštítných tělísek. Terapie se neliší od pacientů HIV negativních. Zahájíme suplementaci vápníkem a vitaminem D, při nálezu osteoporózy je indikována antiresorpční terapie (25, 26).
Zánětlivé kloubní projevy
HIV infekce je asociovaná s několika typy artritid. Nejčastějším typem je reaktivní artritida. HIV-
-asociovaná artritida je specifická pro AIDS. Přítomnost artritidy a omezení funkce postižených kloubů jsou typické pro zánětlivé kloubní onemocnění manifestující se u HIV. Jedná se buď o artritidy asociované s HIV, nebo projevy revmatických onemocnění zhoršených při probíhající infekci nebo nově manifestovaných v rámci infekce, či při zahájení terapie jako součást imunorestitučního zánětlivého syndromu (IRIS). Mezi vzácnější projevy patří myopatie, vaskulitidy, sicca syndrom, imunologický laboratorní syndrom. Další skupinou jsou infekční artritidy (tab. 1).
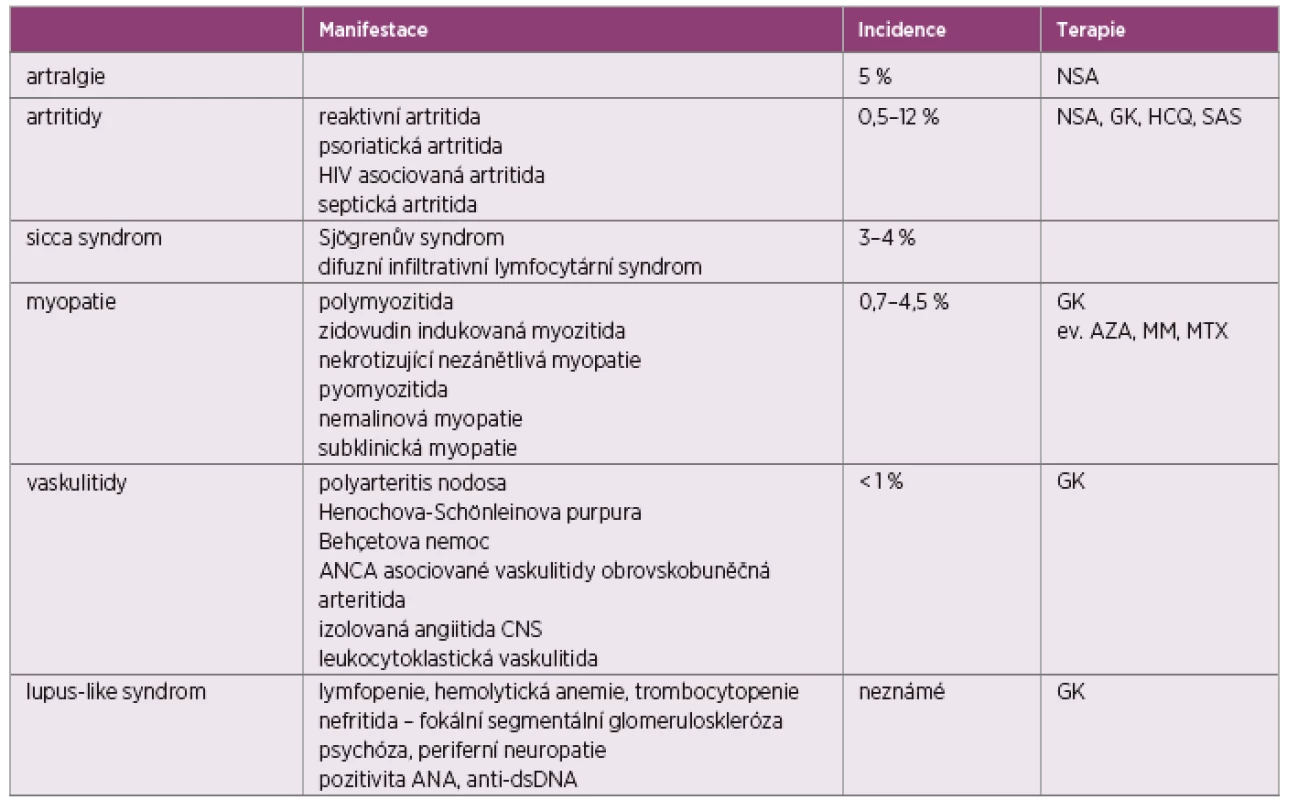
HIV-asociovaná artritida se může projevit v kterémkoliv stadiu HIV infekce. Většinou probíhá pod obrazem asymetrické oligoartritidy či mono-
artrtidy, méně často polyartritidy (27, 28). Nejčastěji bývají postiženy kolenní či hlezenní klouby. Pokud je přítomná symetrická polyartritida s rozvojem deformit (ulnární deviace a další), může připomínat RA. Na rozdíl od RA je typický rychlý nástup a progrese obtíží a většinou nejsou přítomné eroze. Jaccoudova artropatie byla rovněž popsána jako jeden z projevů HIV asociované artritidy. Nebyla pozorována asociace mezi HLA-B27 pozitivních pacientů s HIV. Jedná se o aseptickou artritidu a kultivace kloubních výpotků je negativní. Histologickým vystřením synoviální tkáně lze prokázat chronický mononukleární infiltrát. Nebyla popisována přítomnost systémových příznaků, pouze výjimečně může být přítomna entezitida (29). HIV asociovaná artritida má většinou krátký průběh, udává se mezi 1–6 týdny, nicméně u malé části pacientů dojde k rozvoji chronické destruktivní artritidy. Předpokládá se vliv HIV infekce na rozvoji synovitidy prostřednictvím detekce antigenu p24 a HIV RNA inkluzí v synoviální tekutině postižených kloubů. Přesná prevalence HIV asociované artritidy není známá, předpokládá se vyšší, než je obecně udávána. Vyšší výskyt byl pozorován nemocných ve stadiu AIDS. Terapeuticky se doporučují u mírnějších forem nesteroidní antirevmatika (NSA), eventuálně nízká dávka glukokortikoidů – ať systémově, či v podobě obstřiků. Chorobu modifikující léky (csDMARD) lze využít pro kortikoid šetřící efekt, například sulfasalazin či hydroxychlorochin (18, 21, 30).
Reaktivní artritida se typicky manifestuje na počátku HIV infekce, ale může se objevit i v rámci relapsů HIV infekce. Typicky se jedná o těžkou, periferní séronegativní oligoartritidu postihující převážně dolní končetiny, sakroiliitidu a entezitidy (daktylitidu, tendinitidu Achillovy šlachy a plantární fasciitidu). Axiální postižení a uveitida bývá vzácnější a jeho přítomnost je považována za špatný prognostický faktor. Mukokutánní příznaky jsou velmi pestré a zahrnují keratoderma blenorhagicum, balanitis circinata a bolestivé ulcerace v dutině ústní. Mohou se objevit rozsáhlé psoriasiformní eflorescence u těžkého průběhu onemocnění. U HIV nemocných se vyskytuje uretritida (80–90 %). Asociace s HLA-B27 byla popsána u bílé populace HIV pozitivních nemocných, u černé populace naopak převažují HLA-B27 negativní jedinci. Udává se, že HLA-B27 antigen může být spojený s pomalejší progresí HIV infekce do stadia AIDS. Údaje o prevalenci reaktivní artritidy v populaci pacientů s HIV kolísá dle sledovaných kohort mezi 0–11 %, přičemž v některých kohortách nebyl zaznamenán vyšší výskyt reaktivní artritidy proti HIV negativní populaci. Předpokládá se i vliv rizikového chování na výskytu reaktivní artritidy, kterou může vyvolat celá řada mikroorganismů, mimo jiné i sexuálně přenosné choroby. Přístup k léčbě se rámcově neliší od terapie reaktivní artritidy u HIV negativních pacientů. Podávaní NSA je doporučováno u mírných projevů, např. indometacin, u kterého byla prokázána in vitro schopnost do jisté míry ovlivnit replikaci HIV. Steroidní terapii lze podat celkově či lokálně. Mezi csDMARD je preferován sulfasalazin obvykle v dávce 2 g/den. Hydroxychlorochin, kromě vlivu na příznaky reaktivní artritidy, je účinný při snižování replikace viru HIV in vitro i při snižování virové nálože HIV in vivo. Jistou alternativu představuje methotrexát, ale jeho podávání vyžaduje pečlivou monitoraci virové nálože a počtu CD4+ lymfocytů. Limitujícím faktorem podávání MTX jsou závažné komplikace s kombinovanou antiretrovirovou terapií. Biologickou léčbu je možné zvážit pouze u HIV pozitivních pacientů s počtem CD4+ větším než 200/μl a virovou náloží HIV menší než 60 000 kopií/mm3 (19, 22, 27, 31).
Psoriatická artritida. U pacientů s HIV je postižení kůže psoriázou rozsáhlé až celotělové (psoriasis erythrodermica), obzvláště u těch, u kterých nebyla zahájena cART. Pacienti s HIV mají závažnější a na terapii rezistentní formu psoriázy, může být také přítomné postižení inverzní. Diferenciálně diagnosticky je nutné pomýšlet i na možnost kožního T-lymfomu. Prevalence psoriatické artritidy se udává u nemocných s HIV mezi 0,2–5,7 %, nejčastěji však kolem 2 %. Projevy zahrnují oligoartritidu dolních končetin, entezitidy, daktylitidy, kožní psoriaziformní léze a onychodystrofie. Na rozdíl od revmatoidní artritidy nedochází s nástupem stadia AIDS k remisi. Bylo dokumentováno zlepšení kožního nálezu po podání cART. Terapie vyžaduje multidisciplinární přístup infektologa, dermatologa a revmatologa. Fototerapií dochází u nemocných ke zlepšení postižení kůže, ale může vést ke zvýšení replikace viru a relapsu onemocnění, dále zvyšuje riziko kožních malignit. Přístup k HIV pozitivním pacientům s psoriatickou artritidou se rámcově neliší od terapie psoriatické artritidy u HIV negativních nemocných. Určitým omezením podléhá podávání MTX či biologické léčby (2, 31–33).
Ankylozující spondylitida byla popisována v literatuře jako relativně méně častá příčina postižení muskuloskeletálního aparátu u pacientů s HIV. Předpokládá se, že imunologické mechanismy podílející se na rozvoji ankylozující spondylitidy jsou nezávislé na populaci CD4+ lymfocytů (2, 34).
Nediferencovaná spondyloartritida nesplňuje diagnostická kritéria reaktivní artritidy, psoriatické artritidy či ankylozující spondylitidy. Mezi typické projevy patří entezopatie v oblasti dolních končetin, a to plantární fasciitida či Achillova tendinitida. Terapeuticky se uplatňují nesteroidní antirevmatika, lokální podávání glukokortikoidů eventuálně u závažnějších případů sulfasalazinu (2, 30, 27).
Revmatoidní artritida (RA) – u nemocných s preexistující chorobou může dojít ke zlepšení symptomů při infekci HIV před zahájením cART. Tento jev je vysvětlován virem indukovanou deplecí CD4+ lymfocytů, které se podílejí na zánětlivých pochodech při rozvoji synovitidy u RA. Projevy artritidy vzniklé v průběhu HIV infekce, obzvláště symetrická erozivní polyaritritida, mohou představovat diagnostické rozpaky, zda se jedná o samostatné revmatické onemocnění nezávislé na HIV, nebo o komplikaci HIV infekce imitující RA. Terapie RA u nemocných s HIV infekcí je spojená s těsnou spolupráci s infektologem. Systémové a lokální podávání glukokortikoidů csDMARD a bDMARD podléhá omezením daným lékovými interakcemi s cART a počtem CD4+ lymfocytů (35–37).
Septická artritida. Nejčastějším infekčním agens je Staphylococcus aureus, dále méně obvyklé patogeny (Mycobacterium tuberculosis, Salmonella, Nocardia asteroides, Streptococcus pneumoniae, Neisseria gonorrhoeae, Cytomegalovirus, invazivní Aspergillus, Toxoplasma gondii, Torulopsis glabrata, Cryptococcus neoformans a Coccidioides immitis), projevující se chronickou synovitidou metakarpofalangeálních a proximálních interfalangeálních kloubů. Rizikovým faktorem pro vznik septické u HIV pozitivních je intravenózní užívání drog. Dalším faktorem zvyšujícím riziko infekčních komplikací je výrazný pokles CD4+ lymfocytů ve stadiu AIDS (2, 22, 27, 38). Osteomyelitida je spojena s vyšší úmrtností – až 20%. Nejčastěji postižené kosti jsou zápěstní, tibie, hlavice femuru a hrudní koš, byly zaznamenány i vzácné lokality, jako je patella a mandibula.
Krystalové artropatie. Hyperurikemie bývá detekovaná u nemocných s HIV obzvláště při zvýšeném buněčném obratu při vysokou virové replikací nebo při podávání některý zástupců cART (didanosin, stavudin), nicméně rozvoj dny je u pacientů s HIV poměrně vzácný a chybí údaje o prevalenci a incidenci této HIV asociované krystalové artropatie (39).
SVALOVÉ PROJEVY U HIV INFEKCE
Svalové postižení u HIV zahrnuje benigní myalgie, ale i zánětlivé myopatie spojené s těžkým průběhem u HIV nemocných. Alterace imunitního systému může být potencována i současně podávanou cART terapií. Sérokonverze HIV může být provázena akutními myalgiemi a může být detekována myoglobinurie (2) (tab. 2).

Myalgie provází různá stadia HIV infekce a udává se, že v populaci HIV pacientů se vyskytuje dvakrát častěji než u zdravých jedinců (27). Myalgie byla pozorována častěji u nemocných před zahájením cART, nicméně podávání zidovudinu může myalgie způsobit (40).
Fibromyalgie je často spojená s anamnézou depresí a delším trváním HIV infekce. Mezi typické projevy patří chronická plošná muskuloskeletální bolest, která je doprovázena celou řadou dalších symptomů, zejména únavou, poruchami spánku, nálady či kognitivních funkcí. Prevalence fibromyalgie u HIV infekce je 11–17% (41, 42). Kromě imunitně zprostředkovaných myopatií je nutné diferenciálně diagnosticky pomýšlet i na nežádoucí účinky cART.
Nezánětlivá nekrotizující myopatie a wasting syndrom asociovaný s HIV. Wasting syndrom, závažná ztráta váhy, kachexie společně s chronickými infekcemi, malignitou, malabsorpcí a nedostatek výživy, je charakteristický pro pozdní stadium AIDS. Jde o nezánětlivou nekrotizující myopatii, nejasné patogeneze, která představuje 42 % pacientů s myopatií. Dokonce i u pacientů bez významného zhubnutí prokázala svalová biopsie difuzní atrofii s mírným neurogenním podílem, bez nápadného zánětu. Zda je toto onemocnění zprostředkováno imunitou, jak někteří navrhují (46), nebo zda je způsoben metabolickými nebo nutričními faktory, zůstává nejasné. Bylo hlášeno, že glukokortikoidy obnovují svalovou sílu a hmotu (28, 42).
Nemalinová myopatie je ve své typické formě vzácné autozomálně recesivní onemocnění, pro které je typická chybná diferenciace svalových vláken. Mezi projevy nemalinové myopatie patří generalizovaná hypotonie, která postihuje mimo jiné i respirační a bulbární svaly. Toto onemocnění není obvykle progresivní a projeví se v kojeneckém či předškolním věku. Čím později dojde k jeho propuknutí, tím lepší je prognóza. Diagnóza nemalinové myopatie je stanovena svalovou biopsií, kde je popisována přítomnost typických tyčinkovitých (nemalinových) inkluzí na úrovni elektronového mikroskopu. Vzácná sporadická nemalinová myopatie byla pozorována u HIV nemocných (43).
Rabdomyolýza je charakterizována poškozením myocytů s následným uvolněním intracelulárního obsahu vaskulárního systému. Může probíhat asymptomaticky a její přítomnost je zaznamenána pouze laboratorní mírnou elevací svalových enzymů, pokud ale dojde k jejich výrazné elevaci, může dojít k rozvoji akutního renálního selhání vyžadující dialyzační podporu. Rabdomyolýza u nemocných s HIV může mít tři různé příčiny: První skupinu tvoří rambdomyolýza asociovaná s HIV infekcí (rabdomyolýza při primární infekci, izolovaná rabdomyolýza a rekurentní rabdomyolýza). Druhá skupina je rabdomyolýza v konečné fázi plně rozvinutého stadia AIDS, asociováno s infekčním postižením svalů oportunním agens. Třetí skupinu tvoří rabdomyolýza, kterou způsobují léky, např. ritonavir, indinavir, raltegravir, didanozin, lamivudin a další (44).
Myozitida s inkluzními tělísky je charakterizovaná pozvolnou svalovou slabostí pánevního pletence a distálních svalových skupin, s elevací svalových enzymů a typickou histologickým průkazem inkluzních tělísek β-amyloidu v elektronové mikroskopii. Průběh a nálezy u nemocných s HIV se rámcově neliší od nemocných bez HIV infekce s myozitidou s inkluzními tělísky. Předpokládá se, že virus HIV může vyvolat svým působením zánětlivou aktivitu ve svalech, které vede ke vzniku myozitidy s inkluzními tělísky (45).
HIV asociovaná polymyozitida byla poprvé popsána v osmdesátých letech 20. století a následně byla prokázána její asociace s HIV infekcí. Typicky dochází ke vzniku polymyozitidy v časných stadiích HIV infekce a může být jedním z prvních příznaků. Klinicky je přítomna progredující proximální svalová slabost. Myalgie nejsou dominujícím příznakem. Hladiny kreatinkinázy mohou být zvýšené, ale u části nemocných mohou být normální. Diagnostika HIV asociované polymyozitidy se neliší od vyšetřovacího postupu u idiopatické polymyozitidy bez přítomnosti HIV. Anamnéza, fyzikální vyšetření, laboratorní nálezy následně EMG a MR svalu zhodnotí klinický stav nemocného společně se svalovou biopsií, která
dokáže odlišit HIV asociovanou polymyozitidu od dalších myopatií postihujících nemocné s HIV. Histologicky lze prokázat infiltráty doprovázené degenerací a regenerací myofibril, bývá přítomná vaskulitida. V porovnání s polymyozitidou bez HIV je u pacientů s HIV výrazně redukován počet CD4+ buněk. Léčba se rámcově neliší od terapie polymoyzitidy bez HIV. Nosnou linií tvoří glukokortikoidy většinou ve střední dávce a u refrakterních případů jsou do terapie přidány imunosupresivní léky s přihlédnutím k aktuálnímu stavu a terapii HIV infekce (počet CD4+ buněk, počet virových kopií) (45–48).
Myopatie asociovaná s léčbou cART je další možnou formou myopatie, která se může objevit u pacientů s HIV v rámci kombinované antiretrovirové terapie. Projevy kolísají od prostých myalgií až po rozvoj závažné svalové slabosti. Reverzibilní toxická mitochondriální myopatie byla popsána u pacientů na terapii vysokodávkovaným 3´-azido-2´,3´-dideoxythymidin (zidovudin) a dalších nukleosidových inhibitorů reverzní transkriptázy (NRTIs). Typický histologický nález pro tento druhy myopatie jsou tzv. ragged red fibres, tj. svalová vlákna „rozedraného“ vzhledu s subsarkolemálními a intermyofibrilárními depozity červené barvy. Tento nález je spojený proliferací a akumulací mitochondrií, kterou lze prokázat i histochemicky detekcí zvýšené aktivity mitochondriálních dehydrogenáz. Symptomy odeznívají po přerušení terapie a hladiny kreatinkinázy se normalizují do několika týdnů. Mezi další léky, které mohou mít svalovou toxicitu, patří raltegravir (49, 50) (tab. 3).
SYSTÉMOVÁ ONEMOCNĚNÍ POJIVA ASOCIOVANÁ S HIV INFEKCÍ
Koincidence systémových onemocnění pojiva a infekce HIV je poměrně vzácná. Popisován je sicca syndrom, vaskulitidy a lupus-like syndrom s hematologickými abnormalitami, proteinurií při nefritidě, psychóza a pozitivita autoprotilátek. Projevy HIV a systémových onemocnění se mohou překrývat a představovat určitý diagnostický problém.
Systémový lupus erythematodes (SLE) je systémové onemocnění, které se může projevit celou řadou nespecifických symptomů obdobných k projevům infekce HIV, např. febrilie, noční pocení, hubnutí, uzlinový syndrom. Infekce HIV může vyvolat produkci nespecifických autoprotilátek bez přítomnosti systémového onemocnění pojiva (51). Patogeneze obou chorob je spojená s aktivitou CD4+ lymfocytů. Koincidence SLE a HIV je poměrně vzácná a častěji je popisována u žen. Nemocní s preexistujícím SLE vykazovali po infekci HIV zlepšení aktivity SLE, nicméně po zahájení cART bylo pozorováno vyšší riziko vzplanutí (52). Rozvoj SLE či lupus-like syndromu u nemocných s již probíhající HIV infekcí je poměrně vzácný a může často unikat diagnostice pro překrývající se symptomy obou chorob. Terapie SLE u HIV infekce se rámcově neliší od léčby u pacientů bez HIV (53, 54).
Vaskulitida asociovaná s HIV infekcí může postihovat cévy všech kalibrů. Spouštěčem mohou být specifická infekční agens (cytomegalovirus a tuberkulóza), léky a idiopatické příčiny. U nemocných s HIV byly popisovány vaskulitidy postihující cévy malého kalibru, např. u hypersenzitivních vaskulitid, střední cévy u nekrotizujících vaskulitid typu polyarteriitis nodosa, kryoglobulinemické vaskulitidy, Kawasakiho vaskulitidy a dalších. Vaskulitidy u HIV nemocných patří k vzácným komplikacím onemocnění a dle literatury se předpokládá, že jimi trpí cca
1 % HIV pozitivních. V části bioptických nálezů byla detekována přítomnost virového antigenu p24 a virové RNA, což naznačuje význam HIV infekce v patogenezi vaskulitid u těchto nemocných. Glukokortikoidy tvoří nosnou linii léčby a dle závažnosti manifestací a orgánového postižení může být indikováno podání další imunosupresivní terapie (cyklofosfamid, azathioprin, IVIG). Podobně jako u ostatních autoimunitních onemocnění je léčba velmi limitována současným imunodeficientním stavem (55, 56).
LABORATORNÍ ABNORMALITY ASOCIOVANÉ Z HIV
Nemocní s HIV mohou vykazovat přítomnost autoprotilátek typických pro systémová onemocnění pojiva, ale tyto abnormality bývají velmi zřídka spojeny s přítomností klinických projevů revmatického onemocnění. Bývá detekována polyklonální hyperglobulinemie, která se vyskytuje až u 45 % HIV pozitivních pacientů. Analýzou dat kohorty pacientů s HIV byla zjištěna asi 17% pozitivita antinuklearních protilátek a revmatoidního faktoru. Revmatoidní faktor a anticitrulinové protilátky mohou být detekovány u nemocných s pokročilou HIV infekcí a jejich přítomnost je většinou asymptomatická. Vzácně jsou detekovány anti-dsDNA protilátky a nízké hladiny složek komplementu či cANCA nebo pANCA protilátky. U neléčených nemocných byly nalezeny antikardiolipinové protilátky IgG v 95 % a jsou pouze vzácně spojeny s přítomnosti tromboembolické příhody. Léčba cART vede ke snížení titru či dokonce vymizení těchto imunologických abnormalit (2, 21, 28) (viz tab. 3).

INFEKCE MUSKULOSKELETÁLNÍHO APARÁTU U NEMOCNÝCH S HIV
Infekční komplikace jsou spjaté s progresí HIV, která je spojena s poklesem CD4+ lymfocytů. Stadium AIDS přináší rozvoj závažných oportunních infekcí. Septická artritida byla již zmíněna výše. Staphylococcus aureus patří mezi nejčastější infekční agens při infekci měkkých tkání (burzitidy, periartritidy, tendinitidy). Infekční postižení svalů, pyomyozitida, postihuje většinou velké svalové skupiny dolních končetin. Typicky se projevuje jako jednostranné bolestivé zduření stehna s indurací. Osteomyelitida je považována za špatný prognostický faktor, mezi infekční původce patří například Staphylococcus aureus, Mycobacterium tuberculosis, Salmonella, Streptococcus, Pneumonie, Neisseria gonorrhoae, cytomagalovirus, Aspergillus, Toxoplasma gondii a další. Infekce tuberkulózou představuje v souvislosti s HIV infekcí závažnou komplikaci. Pokud je postižen pohybový aparát, mohou být u pacientů s AIDS přítomná vícečetná ložiska infekce, na rozdíl od většinou izolovaného postižení u HIV negativní nemocných. Mezi manifestace patří tuberkulózní spondyldiscitida, osteomyelitida, artritida či burzitida. Atypické mykobakterie jsou vzácnější příčinou osteomyelitidy či septické artritidy (Mycobacterium avium, Mycobacterium kansasii a další). Mykotické infekce, obzvláště ve své invazivní formě, mohou zvýšit mortalitu nemocných s AIDS, rovněž mohou být komplikací terapie glukokortikoidy. Parazitární infekce pohybového aparátu jsou relativně vzácné. Myalgie se svalovou slabostí bývají nacházeny u toxoplazmózy (Toxoplasma gondii) (57–59).
SYNDROM DIFUZNÍ INFILTRATIVNÍ LYMFOCYTÓZY
Syndrom difuzní infiltrativní lymfocytózy (diffuse infiltrative lymphocytosis syndrome – DILS) se vyskytuje pouze u HIV pozitivních nemocných. DILS má vyšší prevalenci u mužů než u žen s HIV. Typickým projevem tohoto onemocnění je zduření příušních žláz, lymfadenopatie a CD8+ lymfocytóza. Nemocní udávají sicca příznaky očí a úst. Masivní infiltrace tkáně slinných žláz CD8+ buňkami odlišuje DILS od primárního Sjögrenova syndromu, kdy jsou slinné žlázy infiltrovány CD4+ T-buňkami. Lymfocytární infiltrace může být nalezena u DILS kromě slinných žláz i ve sliznici gastrointestinálního traktu, dále v ledvinách a nervovém systému (lymfocytární meningitida, polyneuropatie). Vzácněji může dojít k postižení dolních cest dýchacích v podobě lymfocytární intersticiální pneumonitidy. Nemocní s DILS mají vyšší riziko vzniku lymfomu a varovným znamením maligní transformace může být nově vzniklá kryoglobulinemie nebo monoklonální gamapatie.
Pro DILS byla navržena prozatimní diagnostická kritéria:
- a) prokázaná séropozitivita HIV metodou EIA s konfirmací WB
- b) oboustranné zduření slinných žláz nebo prokázaná xerostomie trvající déle než 6 měsíců
- c) histologický nález lymfocytární infiltrace v slinných nebo slzných žlázách
Symptomatická terapie se neliší od léčby sicca projevů u Sjögrenova syndromu. Antivirová terapie vede ke zmenšení infiltrace slinné žlázy a zlepšení sicca projevů, což naznačuje vliv HIV viru na rozvoji DILS. Terapie glukokortikoidy ve vyšších dávkách je indikována při viscerálním postižení (prednison 60 mg/den). Kompli-
kací kortikosteroidní terapie u imunokompromitovaných nemocných obzvláště v pozdních stadiích HIV může být generalizovaná kandidóza (60–62).
IMUNORESTITUČNÍ ZÁNĚTLIVÝ SYNDROM SPOJENÝ S TERAPIÍ HIV
Zahájení cART může být provázeno reakcí imunitního systému na podávanou léčbu a může být provázeno vznikem IRIS. Jedná se o paradoxní reakci, při které i přes účinnou léčbu cART dochází ke zhoršení stávajících příznaků choroby, či dokonce k manifestaci oportunních infekcí, imunologických abnormalit (RA, SLE, psoriáza, sarkoidóza, Graves-Basedova choroba a další), či nádorových onemocnění (Kaposiho sarkom, lymfomy). Dle literatury postihuje IRIS v různé formě až 1/3 nemocných s dobrou odpovědí na léčbu (nárůst CD4+ buněk, pokles virových kopií); jedná se o nemocné, kteří již v úvodu terapie měli výraznou depleci CD4+. Diagnóza IRIS nevede k nutnosti přerušení terapie cART. Prognóza je většinou dobrá a příznaky spontánně odeznívají, či vyžadují krátkodobou terapii glukokortikoidy (63, 64).
NEŽÁDOUCÍ ÚČINKY ANTIVIROVÉ TERAPIE NA MUSKOSKELETÁLNÍ APARÁT
Artralgie a myalgie byly popisovány v rámci terapie nukleosidovými inhibitory reverzní trans-
kriptázy zvláště u zidovudinu. U nemocných léčených zidovudinem byla popisována vzácně polymyozitida se svalovou slabostí s histologickým nálezem mírného zánětlivého infiltrátu. Po vysazení léku obtíže odeznívají spontánně bez nutnosti specifické léčby, ale mohou relabovat při vrácení léčby. Pokud obtíže přetrvávají i po vysazení, je indikována biopsie k odlišení polékové polymyozitidy od dalších příčin. U podávání indinaviru byly popisovány nežádoucí účinky postihující muskuloskeletární aparát v podobě adhezivní kapsulitidy, tendosynovitid, Dupuytrenovy kontraktury a postižení temporomandibulárního kloubu (2, 65) (viz tab. 3).
LÉČBA REVMATICKÝCH CHOROB U NEMOCNÝCH S HIV
Léčba revmatických chorob v populaci nemocných s HIV se řídí celou řadou aspektů daných nejen průběhem HIV infekce, ale i podávanou cART. Nezbytná je multioborová spolupráce k dosažení co nejlepšího efektu léčby. Léčba revmatických chorob u nemocných s HIV, kteří mají počet CD4+ nad 200 lymfocytů/mm3, většinou nemusí být modifikována, pokud nejsou přítomny lékové interakce (65).
Glukokortikoidy
Glukokortikoidy jsou užívány v léčbě celé řady autoimunitních zánětlivých onemocnění. Nežádoucí účinky jsou obdobné u pacientů s HIV jako u HIV negativní. Podávání inhibitoru proteáz ritonaviru vede k inhibici metabolismu steroidů prostřednictvím cytochromu P450, což vede k zvýšení účinku glukokortikoidů až o 50 %. Současné podávání ritonaviru a glukokortikoidů je možné, ale je nutné redukovat dávku podávaných steroidů k omezení jejich toxicity. Standardně při nutnosti léčby glukokortikoidy nasazujeme suplementaci vápníkem a vitaminem D (66).
Antimalarika
Hydroxychlorochin je antimalarikum, u kterého byla popsána imunomodulační schopnost inhibovat virovou replikaci HIV a zvyšovat počet cirkulujících CD4+ lymfocytů (67, 68).
Sulfasalazin
Sulfasalazin je využíván u nemocných s HIV s efektem a dosud nebyly zachyceny významné lékové interakce s cART (69, 70).
Methotrexát
Methotrexát je využíván v léčbě celé řady revmatických chorob, ale i těžkých forem psoriázy u pacientů s HIV, nicméně toto imunosupresivum může mít celou řadu interakcí s cART a je nutná opatrnost u pacientů s velmi nízkým počtem CD4+ buněk (71).
Leflunomid
Leflunomid prokázal jisté virostatické schopnosti proti několika virům – včetně HIV infekce. Dosud chybí studie na větších kohortách pacientů s HIV se souběžným revmatickým onemocněním. Je doporučována pravidelná kontrola jaterních testů u HIV nemocných vzhledem ke zvýšenému riziku rozvoje toxické hepatopatie u této skupiny (72, 73).
Azathioprin
Dosud chybí data o bezpečnosti podávání u nemocných s HIV a jsou k dispozici pouze údaje získané z menších kohort nemocných (74).
Inhibitory TNF-α
Inhibitory TNF-α jsou podávány u nemocných s HIV nejen z revmatologické indikace, ale i z gastroenterologické či dermatologické. Dostupné literární údaje zabývající se kohortami těchto nemocných popisují dobrý účinek biologické terapie, nicméně u části nemocných se vyvine závažná infekce (75, 76).
ZÁVĚR
Záchyt infekce HIV v revmatologické ambulanci v rámci diferenciální diagnostiky systémových onemocnění pojiva je v České republice poměrně vzácný, nicméně závisí na lokální epidemiologické situaci daného regionu či státu. V současné době žije podle epidemiologických odhadů v České republice okolo 700 HIV pozitivních nemocných, kteří o své pozitivitě stále neví. V rámci diferen-
ciální diagnostiky je nutné na HIV infekci pomýšlet obzvláště u nejasných případů spojených s atypickými systémovými projevy. Revmatologické manifestace u HIV lze rozdělit do tří skupin:
první jsou manifestace spojené s infekcí HIV
druhou tvoří komplikace cART a
třetí koexistence revmatického onemocnění a HIV infekce
Mezi revmatologické manifestace spojené s HIV infekcí patří HIV asociovaná artritida, DILS a HIV asociovaná polymoyozitida. Efektivní cART terapie snižuje prevalenci DILS, ale může být asociovaná s nežádoucími účinky postihující pohybový aparát (myalgie, artralgie, rabdomyolýza, osteonekróza, osteoporóza).
Komplikací efektivní cART může být IRIS, tento syndrom může mimikovat celou řadu autoimunitních onemocnění, a to i revmatologických. U revmatologických onemocnění, v jejichž patogenezi hrají roli CD4+ buňky, např. SLE či RA, většinou narůstající aktivita HIV infekce vede k remisi onemocnění – a naopak úspěšná léčba cART s nárůstem CD4+ buněk k relapsu. V době dobře dostupné účinné antiretrovirové terapie stárnoucích pacientů s HIV lze předpokládat, že se budeme s problematikou revmatologických onemocnění – ať již souvisejících, či nesouvisejících primárně s HIV – setkávat častěji. Přístup k pacientovi s HIV prokázaným revmatologickým onemocněním vyžaduje multidisciplinární přístup založený na spolupráci revmatologa a infekčního specialisty.
Konflikt zájmů: žádný.
přehledový článek
adresa pro korespondenci:
MUDr. Hana Ciferská, Ph.D.
Revmatologický ústav, Na Slupi 4, 128 50 Praha 2
e-mail: ciferska@revma.cz
Zdroje
1. Yao Q, Frank M, Glynn M, et al. Rheumatic manifestations in HIV-1 infected in-patients and literature review. Clin Exp Rheumatol 2008; 26(5): 799–806.
2. Nguyen BY, Reveille JD. Rheumatic manifestations associated with HIV in the highly active antiretroviral therapy era. Curr Opin Rheumatol 2009; 21(4): 404–410.
3. Walker-Bone K, Doherty E, Sanyal K, Churchill D. Assessment and management of musculoskeletal disorders among patients living with HIV. Rheumatology (Oxford) 2017; 56(10): 1648–1661.
4. Boyd MA, Boffito M, Castagna A, et al. Rapid initiation of antiretroviral therapy at HIV diagnosis: definition, process, knowledge gaps. HIV Med 2019; 20(Suppl 1): 3–11.
5. Worobey M, Telfer P, Souquière S, et al. Island biogeography reveals the deep history of SIV. Science 2010; 329: 1487.
6. Keele BF, Van Heuverswyn F, Li Y, et al. Chimpanzee reservoirs of pandemic and nonpandemic HIV-1. Science 2006; 313: 523.
7. Murphey-Corb M, Martin LN, Rangan SR, et al. Isolation of an HTLV-III-related retrovirus from macaques with simian AIDS and its possible origin in asymptomatic mangabeys. Nature 1986; 321: 435.
8. Beyrer C. HIV epidemiology update and transmission factors: risks and risk contexts – 16th International AIDS Conference epidemiology plenary. Clin Infect Dis 2007; 44: 981.
9. Marešová M. Zpráva o výskytu a šíření HIV/AIDS za rok 2018. [online] http://www.szu.cz/tema/ prevence/zpravaovyskytuasirenihivaidszarok2018
10. Arasteh K, Des Jarlais DC. Injecting drug use, HIV, and what to do about it. Lancet 2008; 372: 1709.
11. Branson BM, Stekler JD. Detection of acute HIV infection: we can’t close the window. J Infect Dis 2012; 205: 521.
12. World Health Organization. WHO case definitions of HIV for surveillance and revised clinical staging and immunologic classification of HIV-related disease in adults and children. Geneva, Switzerland: World Health Organization 2007; 1–48.
13. Joint United Nations Programme on HIV/AIDS (UNAIDS). Global AIDS update 2017. http: //www.unaids.org/sites/default/files/media_asset/20170720_Data_book_2017_en.pdf
14. Sedaghat AR, Rastegar DA, O’Connell KA, et al. T cell dynamics and the response to HAART in a cohort of HIV-1-infected elite suppressors. Clin Infect Dis 2009; 49: 1763.
15. Zákoucká H. Národní referenční laboratoř pro HIV/AIDS. http://www.szu.cz/ narodnireferencnilaboratorproaids
16. Lawson E, Sabin C, Perry N, Richardson D, et al. Is HIV painful? An epidemiologic study of the prevalence and risk factors for pain in HIV-Infected patients. Clin J Pain 2015; 31(9): 813–819.
17. Parker R, Stein DJ, Jelsma J. Pain in people living with HIV/AIDS: a systematic review. J Int AIDS Soc 2014; 17(1): 18719.
18. Muñoz Fernández S, Cardenal A, Balsa A, et al. Rheumatic manifestations in 556 patients with human immunodeficiency virus infection. Sem Arth Rheum 1991; 21: 30–39.
19. Hochberg MC, Fox R, Nelson KE, et al. HIV infection is not associated with Reiter’s syndrome: data from the Johns Hopkins Multicenter AIDS cohort study. AIDS 1990; 4: 1149–1151.
20. Berman A, Espinoza LR, Diaz JD, et al. Rheumatic manifestations of Human Immunodeficiency Virus infection. Am J Med 1988; 85: 59–64.
21. Marquez J, Restrepo CS, Candia L, et al. Human immunodeficiency virus-associated rheumatic disorders in the HAART era. J Rheumatol 2004; 31: 741–746.
22. Ouédraogo DD, Ntsiba H, et al. Clinical spectrum of rheumatologic diseases in a department of rheumatology in Ouagadougou (Burkina Faso). Clin Rheumatol 2014; 33(3): 385–389.
23. Keruly JC, Chaisson RE, Moore RD. Increasing incidence of avascular necrosis of the hip in HIV-infected patients. J Acquir Immune Defic Syndr 2001; 28: 101–102.
24. Miller KD, Masur H, Jones EC, et al. High prevalence of osteonecrosis of the femoral head in HIV-infected adults. Ann Intern Med 2002; 137(1): 17.
25. Goh SSL, Lai PSM, Tan ATB, et al. Reduced bone mineral density in human immunodeficiency virus-infected individuals: a meta-analysis of its prevalence and risk factors. Osteoporos Int 2018; 29(3): 595–613.
26. Dao CN, Patel P, Overton ET, et al. Low vitamin D among HIV-infected adults: prevalence of and risk factors for low vitamin D levels in a cohort of HIV-infected adults and comparison to prevalence among adults in the US general population. Clin Infect Dis 2011; 52: 396.
27. Berman A, Robredo G, Spindler A, et al. Rheumatic manifestations in populations at risk for HIV infection: the added effect of HIV. J Rheumatol 1991; 18: 1564–1567.
28. Cuellar ML, Espinoza LR. Rheumatic manifestations of HIV-AIDS. Baillieres Best Pract Res Clin Rheumatol 2000; 14: 579.
29. Stein CM, Davis P. Arthritis associated with HIV infection in Zimbabwe. J Rheumatol 1996; 23: 506.
30. Ekwom PE, Oyoo GO, Amayo EO, Muriithi IM. Prevalence and characteristics of articular manifestations in human immunodeficiency virus infection. East Afr Med J 2010; 87(10): 408–414.
31. Duvic M, Johnson TM, Rapini RP, et al. Acquired immunodeficiency syndrome-associated psoriasis and Reiter’s syndrome. Arch Derm 1987; 123: 1622–1632.
32. Yao Q, Frank M, Glynn M, Altman RD. Rheumatic manifestations in HIV-1 infected in-patients and literature review. Clin Exp Rheumatol 2008; 26(5): 799–806.
33. Reveille JD, Conant MA, Duvic M. Human immunodeficiency virus-associated psoriasis, psoriatic arthritis, and Reiter’s syndrome: a disease continuum? Arthritis Rheum 1990; 33(10): 1574.
34. Njobvu P, McGill P. Soft tissue rheumatic lesions and HIV infection in Zambians. J Rheumatol 2006; 33: 2493–2497.
35. Bijlsma JWJ, Derksen RHWM, Huber-Brunning O, Borleffs JCC. Does AIDS ‚cure‘ rheumatoid arthritis? Ann Rheum Dis 1988; 47: 350–351.
36. Siva C, Brasington RD. Worsening of arthritis with antiretroviral therapy: the coexistence of rheumatoid arthritis and human immunodeficiency virus infection revisited. J Clin Rheum 2001; 7: 42–46.
37. Du Toit R, Whitelaw D, Taljaard JJ, et al. Lack of specificity of anti-cyclic citrullinated peptide antibodies in advanced human immunodeficiency virus infection. J Rheumatol 2011; 38(6):
1055–1060.
38. Mehsen-Cêtre N, Cazanave C. Osteoarticular manifestations associated with HIV infection. Joint Bone Spine 2017; 84(1): 29–33.
39. Nicholson P, Saunsbury E, D’Angelo S, et al. Prevalence of and risk factors for gout in HIV-positive adults: a case-control study. Int J STD AIDS. doi:10.1177/0956462418799803 [Epub ahead of print].
40. Silverberg MJ, Jacobson LP, French A, et al. Age and racial/ethnic differences in the prevalence of reported symptoms in HIV-infected persons on antiretroviral therapy. J Pain Symptom Manage 2009; 38: 197–207.
41. Chiowchanwisawakit P, Koolvisoot A, Ratanasuwan W, Suwanagool S. Prevalence of rheumatic disease in HIV-infected Thai patients. J Med Assoc Thailand 2005; 88: 1775–1781.
42. Kole AK, Roy R, Kole DC. Musculoskeletal and rheumatological disorders in HIV infection: Experience in a tertiary referral center. Indian J Sex Transm Dis 2013; 34(2): 107–112.
43. Schnitzler LJ, Schreckenbach T, Nadaj-Pakleza A, et al. Sporadic late-onset nemaline myopathy: clinico-pathological characteristics and review of 76 cases. Orphanet J Rare Dis 2017; 12(1): 86.
44. Noe MM, Jain AG, Shahi d S, Majeed U. severe rhabdomyolysis as an unusual presentation of primary human immunodeficiency virus infection. Cureus 2018; 10(7): e3041.
45. Lloyd TE, Pinal-Fernandez I, Michelle EH, et al. Overlapping features of polymyositis and inclusion body myositis in HIV-infected patients. Neurology 2017; 88(15): 1454–1460.
46. Virot E, Duclos A, Adelaide L, et al. Autoimmune diseases and HIV infection: a cross-sectional study. Medicine (Baltimore) 2017; 96(4): e5769.
47. Robinson-Papp J, Simpson DM. Neuromuscular diseases associated with HIV-1 infection. Muscle Nerve 2009; 40: 1043–1053.
48. Johnson RW, Williams FM, Kazi S, et al. Human immunodeficiency virus-associated polymyositis: a longitudinal study of
outcome. Arthritis Rheum 2003; 49: 172–178.
49. Sagar A, Mohanty AP, Bahal A. Zidovudine-induced myopathy: A study in Indian patients. J Neurosci Rural Pract 2010; 1(2): 63–66.
50. Cupler EJ, Danon MJ, Jay C, et al. Early features of zidovudine-associated myopathy: histopathological findings and clinical correlations. Acta Neuropathol (Berl) 1995; 90: 1–6.
51. Daikh BE, Holyst MM. Lupus-specific autoantibodies in concomitant human immunodeficiency virus and systemic lupus erythematosus: case report and literature review. Semin Arth Rheum 2001; 30(6): 418–425.
52. Colon M, Martińez DE. Clinical remission of systemic lupus erythematosus after human immunodeficiency virus infection. P R Health Sci J 2007; 26(1): 79–81.
53. Haas M, Kaul S, Eustace JA. HIV-associated immune complex glomerulonephritis with ‚lupus-like‘ features: a clinicopathologic study of 14 cases. Kidney Int 2005; 67(4): 1381–1390.
54. Jakez-Ocampo J, Carrillo-Maravilla E, Richaud-Patin Y, et al. An unusual multiplex systemic lupus erythematosus family with high prevalence of nephropathy, late-onset disease, and one member with disease-onset post-HIV therapy. J Clin Rheumatol 2008; 14(1): 34–37.
55. Chetty R. Vasculitides associated with HIV infection. J Clin Pathol 2001; 54(4): 275–278.
56. Chetty R, Batitang S, Nair R. Large artery vasculopathy in HIV-positive patients: another vasculitic enigma. Hum Pathol 2000; 31(3): 374–379.
57. Gallant JE, Moore RD, Chaisson RE. Prophylaxis for opportunistic infections in patients with HIV infection. Ann Intern Med 1994; 120: 932.
58. Aberg JA, Gallant JE, Ghanem KG, et al. Primary care guidelines for the management of persons infected with HIV: 2013 update by the HIV medicine association of the Infectious Diseases Society of America. Clin Infect Dis 2014; 58: e1.
59. Djawe K, Buchacz K, Hsu L, et al. Mortality risk after AIDS-defining opportunistic illness among HIV-infected persons – San Francisco, 1981–2012. J Infect Dis 2015; 212: 1366.
60. Basu D, Williams F, Ahn C, Reveille J. Changing spectrum of the diffuse infiltrative lymphocytosis syndrome. Arth Rheum 2006; 55(3): 466–472.
61. Kazi S, Cohen PR, Williams F, et al. The diffuse infiltrative lymphocytosis syndrome. Clinical and immunogenetic features in 35 patients. AIDS 1996; 10(4): 385–391.
62. De Silva DJ, Obi AA, Mitchell SM. Bilateral panuveitis in HIV-1-infected patients with CD8 lymphocytosis. Ocul Immunol Inflamm 2005; 13(4): 311–316.
63. Lawson E, Bond K, Churchill D, Walker-Bone K. A case of immune reconstitution syndrome: adult-onset still’s disease in a patient with HIV infection. Rheumatology 2009; 48: 446–447.
64. Fournier A, Martin-Blondel G, Lechapt-Zalcman E, et al. Immune reconstitution inflammatory syndrome unmasking or worsening AIDS-related progressive multifocal leukoencephalopathy: a literature review. Front Immunol 2017; 8: 577.
65. Fox C, Walker-Bone K. Evolving spectrum of HIV-associated rheumatic syndromes. Best Pract Res Clin Rheumatol 2015; 29(2): 244–258.
66. Foisy MM, Yakiwchuk EM, Chiu I, Singh AE. Adrenal suppression and Cushing’s syndrome secondary to an interaction between ritonavir and fluticasone: a review of the literature. HIV Med 2008; 9(6): 389–396.
67. Piconi S, Parisotto S, Rizzardini G, et al. Hydroxychloroquine drastically reduces immune activation in HIV-infected, antiretroviral therapy-treated immunologic nonresponders. Blood 2011; 118(12): 3263–3272.
68. Chiang G, Sassaroli M, Louie M, et al. Inhibition of HIV-1 replication by hydroxychloroquine. Clin Ther 1996; 18(6): 1080–1092.
69. Njobvu PD, McGill PE. Sulphasalazine in the treatment of HIV-related spondyloarthropathy. Br J Rheumatol 1997; 36(3): 403–404.
70. Carroll MB, Fields JH, Clerc PG. Rheumatoid arthritis in patients with HIV: management challenges. Open Access Rheumatol 2016; 8: 51–59.
71. Menon K, Van Voorhees AS, Bebo BF, Jr, et al. Psoriasis in patients with HIV infection: from the medical board of the National Psoriasis Foundation. J Am Acad Dermatol 2010; 62(2): 291–299.
72. Read SW, DeGrezia M, Ciccone EJ, et al. The effect of leflunomide on cycling and activation of T-cells in HIV-1-infected participants. PLoS One 2010; 5(8): e11937.
73. Schlapfer E, Fischer M, Ott P, Speck RF. Anti-HIV-1 activity of leflunomide: a comparison with mycophenolic acid and hydroxyurea. AIDS 2003; 17: 1613–1620.
74. Chamberlain FE, Dinani N, Gurmit K, et al. Azathioprine can be safely used in HIV-infected patients. AIDS 2014; 28: 447–448.
75. Sellam J, Bouvard B, Masson C, et al. Use of infliximab to treat psoriatic arthritis in HIV-positive patients. Joint Bone Spine 2007; 74(2): 197–200.
76. Cepeda EJ, Williams FM, Ishimori ML, et al. The use of anti-tumour necrosis factor therapy in HIV-positive individuals with rheumatic disease. Ann Rheum Dis 2008; 67(5): 710–712.
Štítky
Dermatologie Dětská revmatologie RevmatologieČlánek vyšel v časopise
Česká revmatologie

2019 Číslo 1
- Specifika v komunikaci s pacienty s ránou – laická doporučení
- MUDr. Lenka Klimešová: Multioborová vizita může být klíčem k efektivnější perioperační léčbě chronické bolesti
- Diagnostický algoritmus při podezření na syndrom periodické horečky
Nejčtenější v tomto čísle
- Revmatologické manifestace HIV infekce
- Rizikové faktory vzniku artrózy kolenního a kyčelního kloubu u pacientů indikovaných k totální endoprotéze
- Gastrointestinální postižení u systémové sklerodermie – jeho následky a strategie terapie
- Stanovisko České revmatologické společnosti k personálnímu a technickému vybavení center biologické léčby v revmatologii a ke způsobu organizace jejich sítě
