-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Gastrointestinální postižení u systémové sklerodermie – jeho následky a strategie terapie
Gastrointestinal involvement is systemic sclerosis – the consequences and treatment strategy
Gastrointestinal tract (GIT) involvement is the most common internal organ manifestation in patients with systemic sclerosis (SSc). GIT involvement is present in up to 90% of SSc patients, with the clinical manifestations differing according to the disease course and the part of the GIT affected. The majority of the symptoms is caused by GIT dysmotility. Up to 8% of SSc patients develop severe GIT symptoms, which increase the mortality. Although GIT involvement is rarely the direct cause of death, it can lead to several comorbidities including malnutrition and negative alterations of body composition. These factors have a negative impact on quality of life and increase the mortality. To date, no specific treatment has been developed and the therapy is rather symptomatic. There is a need to clarify the pathogenesis of GIT involvement to improve the treatment approaches including e.g. intravenous immunoglobulins and miRNA interventions.
Keywords:
Gastrointestinal tract – systemic sclerosis – body composition – diagnosis management
Autoři: S. Oreská 1; H. Štorkánová 1; M. Špiritović 2; B. Heřmánková 2; M. Tomčík 1
Působiště autorů: Revmatologický ústav a Revmatologická klinika 1. LF UK, Praha 1; Katedra fyzioterapie, Fakulta tělesné výchovy a sportu UK, Praha 2
Vyšlo v časopise: Čes. Revmatol., 27, 2019, No. 1, p. 16-28.
Kategorie: Přehledový článek
Souhrn
Gastrointestinální trakt (GIT) je jedním z nejčastěji postižených vnitřních orgánů u pacientů se systémovou sklerodermií (SSc). Postižení se týká až 90 % pacientů a jeho klinická manifestace se liší podle celkového průběhu onemocnění a postižené části GIT. Většina symptomů vyplývá z dysmotility trávicí trubice. Až 8 % pacientů trpí závažnými symptomy, které zvyšují mortalitu. Ačkoliv postižení GIT nebývá přímou příčinou úmrtí, často vede k dalším komorbiditám, včetně těžké malnutrice a nepříznivých změn tělesného složení. Tyto následky negativně ovlivňují kvalitu života a mortalitu. Dosud neexistuje specifická terapie a léčba je zejména symptomatická. Je nutné především objasnit zatím z velké části neznámou patogenezi postižení GIT a umožnit tak zlepšení terapeutických postupů, například včetně využití intravenózních imunoglobulinů a molekul miRNA.
Klíčová slova:
gastrointestinální trakt – systémová sklerodermie – tělesné složení – strategie péče
ÚVOD
Systémová sklerodermie (SSc) je autoimunitní onemocnění charakterizované chronickou zánětlivou aktivitou, postižením cév a nadprodukcí kolagenních vláken s depozicí v tkáních ústící ve fibrózu. Tyto patofyziologické pochody mohou postihovat různé tkáně a orgány. Kompletní etiopatogeneze SSc však dosud není zcela objasněná (1).
Gastrointestinální trakt (GIT) je u pacientů se SSc nejčastěji postiženým vnitřním orgánem. Určitý stupeň fibrózy GIT se vyskytuje až u 90 % pacientů, přičemž se významně neliší frekvence postižení mezi kožně limitovanou formou (limited cuta-
neous SSc – lcSSc) a kožně difuzní (diffuse cutaneous SSc – dcSSc) formou onemocnění. Nicméně u dcSSc bývá manifestace závažnější a mortalita vyšší než u lcSSc. Individuálně se liší postižení GIT svým rozsahem, závažností a průběhem a u některých pacientů se může projevit i bez kožní manifestace. Patognomická je porucha motility (dysmotilita) trávicí trubice (2).Patofyziologické změny v GIT obecně odpovídají postižení kůže a dalších orgánů u SSc. Dochází k fibrotizaci enterální pojivové tkáně, dysfunkci myenterické nervové pleteně vlivem protilátkové aktivity a depozice kolagenu a nakonec k atrofii hladké svaloviny v důsledku zánětlivé infiltrace (1). Z hlediska etiologie postižení GIT hraje zřejmě významnou roli genetická predispozice a připouští se i hypotéza infekční etiologie (Helicobacter pylori), zatímco kouření je zatím jediný potvrzený environmentální faktor zhoršující závažnost symptomů (2).
Postižení GIT velmi významně zhoršuje kvalitu života a prognózu pacientů. Fibróza GIT a související malnutrice se podílí na mortalitě až z 12 % (1). Zhruba u 8 % pacientů se SSc zvyšuje závažné postižení GIT mortalitu a zkracuje dobu přežití
(9 let přežívá jen 15 %) (2).PATOFYZIOLOGIE
Patomechanismus postižení GIT u SSc je komplexní a dosud ne zcela objasněný proces, kde se uplatňují tři klíčové děje: vaskulopatie, porucha regulace imunitní reakce a fibróza (2).
Poškození endoteliální tkáně je zásadní krok v patogenezi SSc a iniciuje zvýšenou produkci volných kyslíkových radikálů (ROS) a uvolňování chemokinů, růstových faktorů a profibrotických mediátorů za účasti atrahovaných imunokompetentních buněk (B-, T-lymfocyty a profibrotické makrofágy) (3). Tyto mechanismy vedou ke zhoršení průtoku krve v mukózní vrstvě sliznice antra žaludku a duodena (4), apoptóze endoteliálních buněk kapilár ve stěně jícnu a žaludku, ukládání perivaskulárních infiltrátů a nakonec ke ztluštění bazální membrány kapilár, jak prokázaly histologické nálezy z biopsie jícnu (2, 5, 6).
Specifické protilátky u pacientů se SSc interagují s funkcí hladkých svalových buněk ve stěně GIT inhibicí vazby acetylcholinu (nejvýznamnější nervosvalový mediátor v GIT) na muskarinové receptory typu 3 (M3) (7). V časném stadiu postižení GIT – neuropatickém, vykazují tyto protilátky vyšší afinitu k M3 receptorům na myenterických neuronech. V další, myopatické fázi později roste jejich afinita i k receptorům na hladkých svalových buňkách stěny GIT. Růst afinity může vysvětlovat progresivní charakter postižení GIT u SSc. Protilátky proti M3 receptorům u SSc mají zřejmě na svědomí dysmotilitu GIT prokázanou manometricky, která předchází histologickým změnám (2). Neutralizace těchto protilátek pomocí intravenózních imunoglobulinů (IVIGs) či antigen vázajícího fragmentu (F(ab)2) se jeví jako potenciálně vhodná terapie (8). Atrofie hladké svaloviny a fibróza GIT v poslední fázi vede ke ztrátě kontraktility a schopnosti odpovídat na externí podněty a terapie dysmotility je už neúčinná (2).
Významnou roli v rozvoji postižení GIT hraje také dysregulace buněčně zprostředkované imunitní odpovědi (9, 10). T-lymfocyty typu 2 (Th2) ze skupiny CD4+ T-lymfocytů jsou u SSc převažujícím buněčným typem a potencují protilátkovou imunitní odpověď (3, 11). Zřejmě jsou také zodpovědné za indukci produkce výše zmíněných patogenních protilátek a za následnou fibrózu GIT (2, 12). Zvýšená depozice kolagenních vláken typu I a III se vyskytuje ve všech vrstvách stěny GIT spolu se silnou expresí profibrotických cytokinů – transformující růstový faktor β (TGF-β), růstový faktor pojivové tkáně (CTGF) a aktinových vláken typu alfa (α-SMA) (13). Naopak exprese matrixové metaloproteinázy-1 (MMP-1) je snížená a dochází také k poškození a úbytku telocytů, které za normálních okolností regulují skládání a výstavbu extracelulární matrix (14). Samotná vyšší tuhost stěny GIT působí jako další stimul podporující fibrotický proces (15).
V patogenezi SSc se uplatňuje také odlišná exprimace mikroRNA vláken (miRNAs), které za normálních okolností regulují zánětlivé a fibrotické mechanismy. Deplece molekuly z rodiny miRNA-29, které regulují expresi genu pro kolagen a fibrózu, pravděpodobně vede ke zvýšené depozici kolagenu ve tkáních (2, 16).
KLINICKÉ MANIFESTACE
Postižení trávicího ústrojí u SSc se může týkat jakékoliv jeho části s odpovídající klinickou manifestací. Velká část pacientů je asymptomatická, případně jsou symptomy nespecifické (1). Fibróza a dysfunkce GIT vede k četným komplikacím, jako je gastroezofageální reflux (GER) a refluxní choroba jícnu (GERD), striktury a Barrettův jícen, dilatace žaludku a gastroparéza, syndrom bakteriálního přerůstání v tenkém střevě (SIBO), dilatace kolon a v neposlední řadě porucha funkce análních svěračů. Vaskulopatie se projevuje vznikem gastrických antrálních vaskulárních ektázií (gastric antral vascular ectasia – GAVE) a ektázií v tenkém střevě. Objevuje se také divertikulóza jícnu, tenkého a tlustého střeva. V neposlední řadě vede postižení fibrózou a vaskulopatií k fekální inkontinenci a také ke snížení vstřebávání živin (malabsorpce) (2). V následujícím textu jsou klinické manifestace rozděleny podle postižení jednotlivých orgánů GIT (tab. 1).
Tab. 1. Postižení GIT podle orgánové manifestace (podle Miller JB, et al. Gastrointestinal involvement in systemic sclerosis: an update. J Clin Rheumatol 2018; 24(6): 328–337) 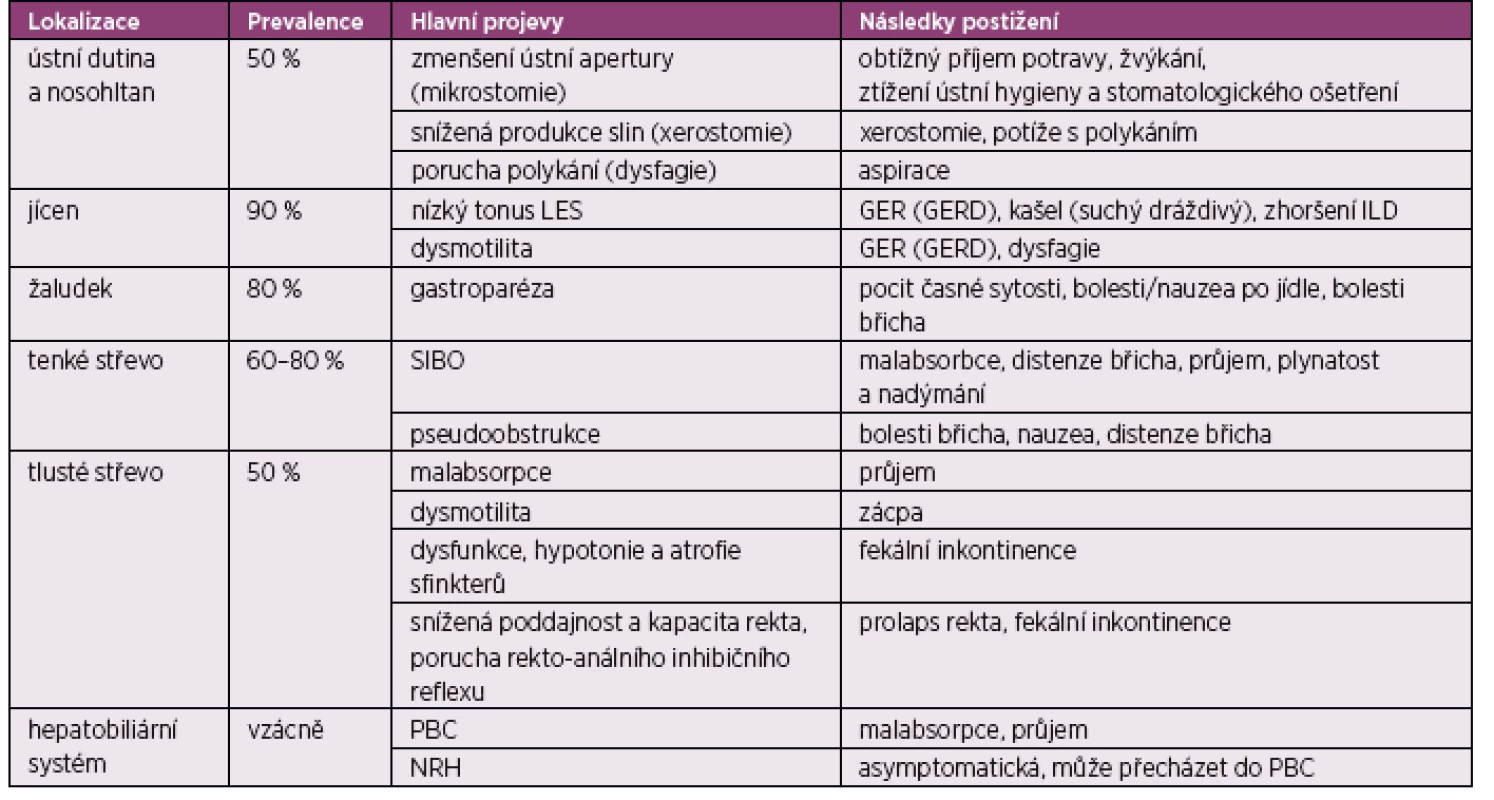
LES – dolní jícnový svěrač (low esophageal sphincter), GER – gastroezofageální reflux, GERD – gastroezofageální refluxní choroba (GER disease), ILD – intersticiální plicní postižení (intersticial lung disease), SIBO – syndrom bakteriálního přerůstání v tenkém střevě (small intestinal bacterial overgrowth), PBC – primární biliární cirhóza, NRH – nodulární regenerativní hyperplazie Ústní dutina a hltan
Postižení ústní dutiny u SSc je komplexní. Fibróza vede typicky ke zmenšení ústní apertury (mikrostomie), ztluštění sublinguálního frenula a rozšíření periodontálních ligament (17). Spolu se sekundárním Sjögrenovým syndromem popsaným u 20 % pacientů se SSc způsobují tyto projevy zvýšenou kazivost a vypadávání zubů. Navíc toto postižení komplikuje udržování zubní hygieny i stomatologické ošetření (18). U 20 % pacientů se SSc může docházet k resorpci mandibulární kosti, která predisponuje k patologickým frakturám, neuralgii trigeminu a vzácně osteomyelitidě a nekróze mandibulární kosti (19). Porucha polykání (dysfagie) v orofaryngeální části (25 % pacientů) způsobená dysmotilitou a reflexním mechanismem při extraezofageálním refluxu zvyšuje riziko aspirační pneumonie (20). Z maligních komplikací bylo u pacientů se SSc v jedné studii popsáno asi 25krát vyšší riziko karcinomu jazyka oproti běžné populaci (21).
Jícen
Porucha funkce jícnu je zřejmě nejčastějším projevem postižení GIT u SSc a týká se až 90 % pacientů. Prevalence je vyšší u dcSSc, spolu s horší závažností projevů a sklonem k progresi v porovnání s lcSSc. Až 30 % pacientů je však asymptomatických. Hlavním projevem je dysfagie, která vzniká na podkladě atrofie hladkých svalových buněk a poškození nervového plexu. V diferenciální diagnostice by se mělo myslet i na jiné příčiny dysfagie, jako léky indukovanou dysfagii či kvasinkovou ezofagitidu, zvlášť při imunosupresivní terapii (1, 2).
GER je definovaný jako retrográdní pohyb žaludečního obsahu přes dolní jícnový svěrač (low esophageal sphincter – LES) do jícnu. Dysfunkci LES podmiňuje několik mechanismů: abnormální relaxace svaloviny svěrače, snížený tonus svěrače a zvýšený nitrobřišní tlak (22). K faktorům, které přispívají k vzniku GER, patří také snížená produkce slin, poškozená peristaltika a snížená odolnost sliznice jícnu, hiátová hernie a gastroparéza (dysmotilita s opožděným vyprazdňováním žaludku) (23).
GERD neboli refluxní choroba jícnu je chronické poškození sliznice dané abnormálním refluxem žaludečního obsahu do jícnu, které se projevuje zejména pálením žáhy – pálivou bolestí za sternem (24). K dalším projevům patří nevolnost, říhání a vzácněji tvorba vřídků v ústní dutině, chronický dráždivý kašel, chrapot, pálení v krku a faryngitida, laryngospazmus až astma a rekurentní pneumonie (2, 25).
Dlouhotrvající GERD vede k rozvoji distální refluxní ezofagitidy až peptických striktur a Barrettova jícnu (BE). Prevalence BE mezi jedinci s GERD v běžné populaci se pohybuje mezi 5–15 % (26). Studie Wipff et al. prokázala pomocí endoskopického vyšetření pacientů se SSc léčených inhibitory protonové pumpy (PPI) prevalenci BE 12,7 %, přičemž u tří pacientů z této podskupiny (tedy 21 %) se rozvinuly dysplastické změny (26). Dřívější retrospektivní studie prokázaly přítomnost BE u pacientů se SSc nekonzistentně mezi 2–37 %, přičemž současná terapie PPI nebyla jasně definovaná (27–29). Přibližně u 20 % z těchto pacientů dochází k dysplastickým změnám, kde je vyšší riziko vzniku adenokarcinomu v porovnání s pacienty se SSc a BE bez přítomné dysplazie. Riziko maligního zvratu se ale nejeví vyšší než u pacientů s GERD v běžné populaci (30). GERD může zhoršit intersticiální plicní nemoc (ILD) kvůli mikroaspiraci žaludečního obsahu, proto je nezbytná včasná diagnostika a případně zahájení terapie PPI (31). Typickým nálezem při mikroaspiraci jsou například dorzobazální opacity mléčného skla (ground glass) na HRCT (high resolution computed tomography) (obr. 1).
Obr. 1. HRCT (high resolution computed tomography) plic pacienta s GER Dorzobazální drobné opacity mléčného skla (ground glass), které odpovídají aspiraci při refluxu. Nález nemá charakter intersticiálního plicního postižení (z archivu Revmatologického ústavu) 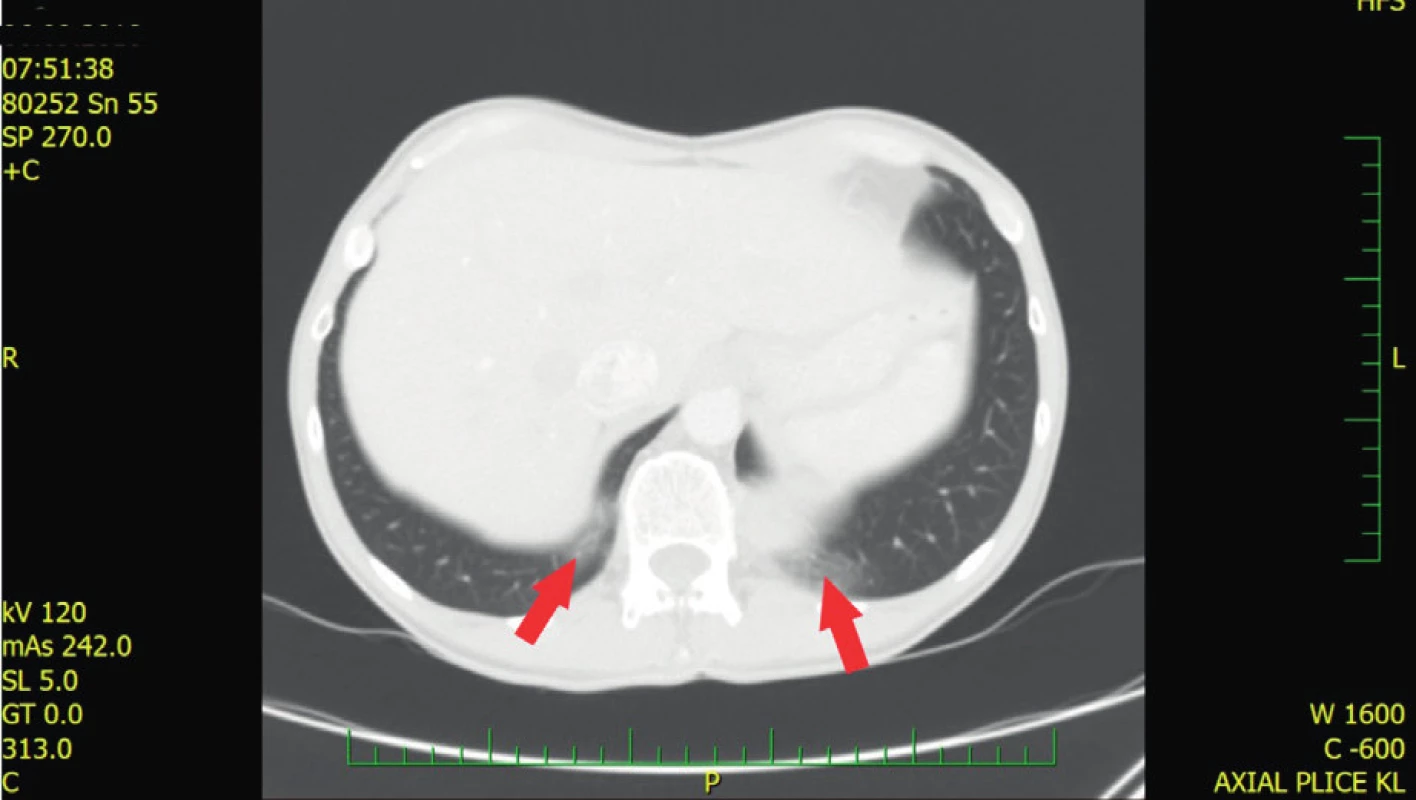
Žaludek
Postižení žaludku se projevuje zejména gastroparézou a syndromem GAVE (s endoskopickým nálezem tzv. melounového žaludku) (obr. 2). Dyspeptické symptomy mohou vést až ke kompletní intoleranci stravy (1).
Obr. 2. Gastrické antrální vaskulární ektázie (GAVE) u pacienta se SSc (laskavě poskytl MUDr. Bohuš Bunganič z Interní kliniky – oddělení gastroenterologie, hepatologie a metabolismu 1. LF UK a ÚVN, Praha)
2a Diagnostické vyšetření: cévní ektázie v antru žaludku směřující od pyloru připomínající uspořádáním vodní meloun (watermelon stomach). Hyperemie a edém sliznice, které vznikají na podkladě dilatovaných kapilár s tromby, fibromuskulární hyperplazie lamina propria a abnormálního uspořádání cév v submukóze.
2b Po ošetření argon plazma koagulací: černé až bělavé okrsky ošetřené tkáně zasahující do submukózy.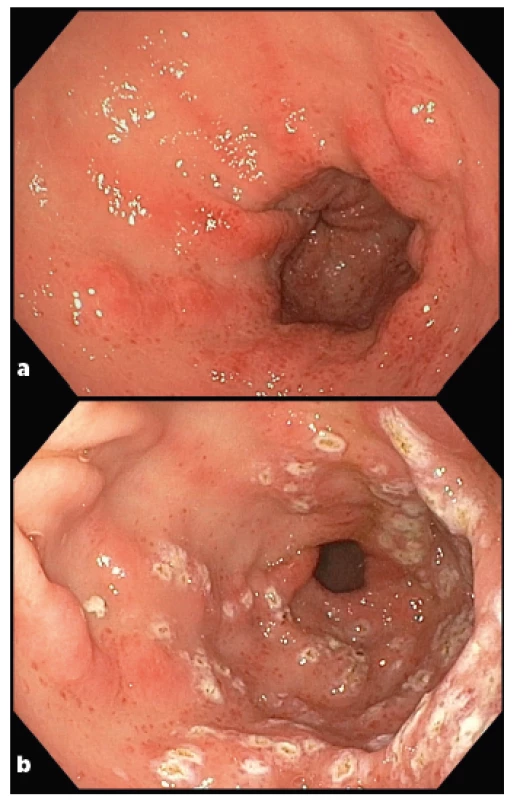
GAVE jakožto makroskopická vaskulopatická manifestace odpovídá kožním teleangiektáziím a je asociován s Raynaudovým fenoménem. Prevalence GAVE se u pacientů se SSc pohybuje mezi 6 a 22 % (32–34). Většinou se toto postižení rozvíjí během několika prvních let od nástupu systémového onemocnění, ale může být také první manifestací bez postižení kůže. Klinicky dominuje obraz anemie kombinované etiologie – nejčastěji z deficitu železa (sideropenie) a chronických krevních ztrát z GIT (34). Přítomnost GAVE negativně koreluje s pozitivitou protilátek proti topoizomeráze I (anti-Scl70). Analýza databáze EUSTAR (European Scleroderma Trials and Research Group) potvrdila významnou asociaci GAVE s pozitivitou protilátek proti RNA polymeráze III (anti-RNAP) (35). Asociace se specifickými protilátkami a její případné terapeutické využití zatím zůstává otázkou (33).
Tenké střevo
K častěji postiženým orgánům GIT patří hned po jícnu a anorektu tenké střevo. Typická dysmotilita má za následek lokální dilataci, pseudoobstrukci a syndrom bakteriálního přerůstání v tenkém střevě (SIBO). Dalšími komplikacemi jsou jejunální divertikulóza a pneumatóza střevní stěny (pneumatosis cystoides intestinalis – PCI). Škála projevů je široká, od dyspepsie po systémové příznaky malabsorpce (2).
SIBO je obecně definován jako zvýšení množství bakterií (nad 105 CFU/ml; CFU – colony forming units) a/nebo přítomnost atypické flóry (36). K přirozeným endogenním mechanismům, které zabraňují rozvoji bakteriálního přerůstání, patří sekrece žaludeční kyseliny, motilita střeva, funkční ileocékální (Bauhinova) chlopeň, slizniční imunoglobuliny produkované ve střevě a bakteriostatické účinky pankreatických a žlučových šťáv. Podkladem SIBO pak mohou být četné patologie (imunologické, anatomické abnormity, dysmotilita). Nejčastějšími symptomy jsou nadýmání, průjem, malabsorpce s malnutricí a hubnutí (37). Vedoucí příčinou rozvoje SIBO u SSc se zdá být dysmotilita, ale svou roli může hrát i snížení kyselosti žaludečních šťáv při užívání PPI (36).
SIBO je příčinou malabsorpce tuků, proteinů i sacharidů. Bakterie v tenkém střevě mají na svědomí dekonjugaci žlučových kyselin, což znemožňuje trávení a absorpci tuků. Zároveň jsou tyto bakterie zodpovědné za deaminaci proteinů v potravě. Uvolněný kyslík je následně zabudován do močoviny, kterou lidský metabolismus nedokáže využít jako zdroj dusíku. Konečně malabsorpce sacharidů je způsobená sníženou aktivitou disacharidázy a současně intraluminální degradací uhlovodíků bakteriemi (38).
Predisponujícími faktory pseudoobstrukce je nejen postižení střeva u SSc (dilatace, atonie, opožděná pasáž), ale také některé léky, zejména opiáty (39). Stáza střevního obsahu současně podporuje vznik SIBO, který se objevuje téměř u poloviny pacientů se SSc (40–50 %) (40).
PCI je vzácná benigní komplikace SSc diagnostikovaná na základě charakteristického nálezu na rentgenovém obrazu, kde jsou popsány četné vzduchové cysty v submukóze a subseróze tenkého střeva. Tento nález bývá většinou náhodný. Příčinou je zejména dysmotilita, SIBO, ischemie střeva a atrofie hladké svaloviny. Velmi vzácně dochází ke vzniku spontánního pneumoperitonea, či závažnější ischemii střeva, perforaci a peritonitidě. Terapie benigního pneumoperitonea spočívá v konzervativním postupu (oxygenace, antibiotika, klid a šetřící dieta). Závažnější případy vyžadují chirurgickou intervenci (2, 41).
Tlusté střevo
Postižením tlustého střeva trpí až polovina pacientů se SSc. Jedná se hlavně o snížení motility, vznik teleangiektázií a divertikulózu. Většinou je postižení asymptomatické, případně se typicky projevuje chronickou zácpou a distenzí břišní dutiny, v extrémních případech dochází až k impakci stolice a perforaci střeva s nutností chirurgického řešení (1). Divertikly (zejména se širokým ústím) jsou většinou asymptomatické a nepřecházejí v divertikulitidu (2).
Anorektální oblast je považována za druhou nejčastěji postiženou část GIT u SSc s prevalencí 50–70 % (2). Symptomy zahrnují inkontinenci, tenesmus a bolestivou defekaci. Inkontinencí stolice trpí asi 40 % pacientů a podílí se na ní více příčin: průjem, dysfunkce a atrofie vnitřního i vnějšího análního sfinkteru, snížená poddajnost a kapacita rekta, poškození rekto-análního inhibičního reflexu, prolaps rekta a také zácpa s paradoxním průjmem (2).
Játra a slinivka
Hepatobiliární systém nebývá u SSc postižen tak často jako předchozí zmíněné orgány. Z benigních onemocnění bývá u SSc pozorována nodulární regenerativní hyperplazie (NRH), která ale může předcházet vývoji primární biliární cirhózy (PBC) s progresí do necirhotické portální hypertenze. Patogeneze NRH spočívá v obliteraci portálních žil odpovídající mikrovaskulárním změnám u SSc (2).
PBC je nejčastější postižení jater asociované se SSc. Vyskytuje se přibližně u 2 % pacientů se SSc, častěji u lcSSc (42). Může také předcházet samotnou diagnózu SSc, například jako Reynoldův syndrom, který spojuje PBC a Raynaudův fenomén (43). PBC je asociovaná s pozitivitou anticentromerových protilátek (ACA) (42). Nicméně pozitivita autoprotilátek specifických pro PBC (antimitochon-
driální, anti-gp21, anti-sp100) se vyskytuje i u 20 % pacientů se SSc bez jaterního postižení (44). Z neznámého důvodu je progrese do konečného stadia s nutností transplantace jater u pacientů se SSc méně častá než u běžné populace (non-SSc) s PBC (45). Cholestáza a snížená sekrece žluči při PBC se podílí na malabsorbci (1).K vzácnějším jaterním manifestacím patří autoimunitní hepatitida, idiopatická portální hypertenze a primární sklerózující cholangoitida (2).
Postižení pankreatu se vyskytuje vzácně a symptomy se mohou překrývat se SIBO. Dysfunkce exokrinní sekrece přispívá k malabsorpci. Kazuistiky pacientů se SSc popisují uzávěr středně velkých pankreatických arterií ústící v hemoragickou pankreatitidu s fatálními následky (2).
MALNUTRICE
Podvýživa se týká 15–58 % pacientů se SSc (46, 47). Mortalita u takových pacientů se významně zvyšuje v porovnání s pacienty bez nutričního deficitu s odhadem asi 4 % úmrtí na vrub následků malnutrice (47). Hlavními příčinami malnutrice jsou postižení GIT a chronický zánět (48). Existují ale i další faktory, například deprese, jejichž význam není zcela jasný (1).
Podle dat z databáze kanadské skupiny pro výzkum sklerodermie (The Canadian Scleroderma Research Group) u téměř 600 pacientů koreluje malnutrice s délkou trvání a závažností onemocnění, závažností anemie, distenzí břicha a tíží subjektivních symptomů (48). Americká společnost pro parenterální a enterální výživu (American Society for Parenteral and Enteral Nutrition, ASPEN) doporučuje časný screening malnutrice u každého nově diagnostikovaného pacienta se SSc a dále každoročně. Rizikoví pacienti by měli být pečlivě sledováni a při známkách nutriční insuficience by měla být zahájena terapeutická intervence optimálně ve spolupráci s nutričním odborníkem a gastroenterologem (49). V pokročilém stadiu je indikována podpora výživy pomocí sondy či invazivních metod. Nejzávažnější případy vyžadují zahájení parenterální výživy (2).
ZMĚNY TĚLESNÉHO SLOŽENÍ
Nízká kostní minerální denzita (bone mineral density – BMD), tělesná hmotnost a atrofie svalů u pacientů se SSc jsou spojeny nejen s nutričním deficitem, ale souvisí také se sníženou schopností fyzické aktivity a závažností onemocnění. Dosud existuje pouze několik menších studií věnujících se problematice změn tělesného složení u pacientů se SSc (50).
Dostupné studie prokázaly snížení kostní denzity podmíněné více faktory: malnutrice a deficit vitaminu D, nízká fyzická aktivita, kortikoterapie a imunosupresivní terapie a chronický zánět v rámci autoimunitního onemocnění (51, 52). Nízká hladina vitaminu D zřejmě souvisí s rozsahem kožního postižení (53).
Pouze několik studií hodnotí hmotnostně výškový index (body mass index – BMI) a další parametry, většinou z denzitometrie (dual X-ray absorptiometry – DXA) a jejich výsledky se rozcházejí. Corrado et al. neprokázali ve své studii u pacientů se SSc žádné rozdíly v množství tukové tkáně (fat mass – FM) a tukuprosté svalové hmoty (lean body mass – LBM) v porovnání s jedinci z běžné populace (53). Marighela et al. naopak popsali u žen se SSc významně nižší hodnoty BMI, LBM a FM a současně nižší BMD oproti ženám z běžné populace, přičemž se změny výrazněji projevily u dcSSc (54). Hodnota BMI významně negativně korelovala s trváním nemoci, což byl současně jediný faktor asociovaný s nízkým LBM (sarkopenií). Negativní změny tělesného složení kupodivu nesouvisely s dietními návyky pacientů (54).
Rosato et al. označili za potenciální marker malnutrice sníženou hmotnost levé komory srdeční (left ventricular mass – LVM) na echokardiografii, která pozitivně korelovala s hodnotou BMI, závažností vaskulopatického postižení, ale negativně s rozsahem fibrózy kůže (55). Caramaschi et al. popsali korelaci množství viscerálního tuku s hlavními kardiovaskulárními rizikovými faktory (56). V obou těchto studiích ale chybí kontrolní skupiny z běžné populace.
Vzhledem k nedostatku znalostí je potřeba větších studií zahrnujících komplexní vyšetřovací metody a odpovídající kontrolní skupiny, aby bylo možné objasnit míru a následky negativních změn tělesného složení a stanovit způsob sledování a terapie pacientů.
DIAGNOSTIKA
Každý pacient s nově stanovenou diagnózou SSc by měl být vyšetřen gastroenterologem, a to i pokud neudává symptomy postižení GIT (2). Na péči by se měli podílet i další specialisté (stomatolog, logoped, čelistní chirurg). V neposlední řadě nelze opomínat ani psychosociální faktory, které také ovlivňují trávicí potíže (1).
K vyšetření postižení GIT je v dnešní době k dispozici široké spektrum nástrojů včetně laboratorních a zobrazovacích metod (2). Klíčovou roli zejména při vyšetření jícnu a žaludku hrají endoskopické metody s výhodou možnosti intervence. Kromě obvyklé video-endoskopie se využívá i manometrie a pH-metrie k vyšetření dysmotility a refluxu zvláště u refrakterního GERD. Endoskopická biopsie je metodu volby k diagnostice BE a k pravidelnému sledování. Frekvence kontrol závisí na závažnosti nálezu: není-li přítomná dysplazie, stačí kontrola jednou za 3–5 let, v případě dysplazie nízkého či vysokého stupně je doporučeno provádět kontrolu v intervalech 3–6 měsíců (58).
Ambulantní pH-metrie slouží k verifikaci GERD, zejména její neerozivní formy (non-erosive reflux disease – NERD). Jedná se o 24hodinové monitorování hodnoty pH pomocí tenké sondy (zavedené nosem) s čidlem v oblasti přechodu jícnu a kardie (asi 5 cm nad LES). Vzhledem k možnému diskomfortu pacientů kvůli zavedené sondě a tím i možné přechodné změně stravovacích návyků může být výsledek testu negativní i v přítomnosti GERD (57).
Manometrie jícnu slouží k přesnému vyšetření dysmotility. Pomocí tenkého katétru zavedeného nosem do jícnu až žaludku je snímán tlak při polykání tekutiny podávané v průběhu vyšetření pacientovi. Tlak odpovídá peristaltice jícnu a nejvyšší by měl být v oblasti LES.
Gastroskopie by měla být provedena u všech pa-
cientů se SSc pro možné asymptomatické postižení. U anemických pacientů může endoskopie odhalit příčinu, včetně GAVE (58) (obr. 2).Vyšetření tenkého střeva lze v běžné populaci provést pomocí kapslové endoskopie. Vyšetření spočívá ve spolknutí kapsle (velikosti větší pilulky), která přirozeně prochází trávicím traktem a současně zaznamenává obraz a přenáší ho do snímače v podobě menší krabičky upevněné kolem pasu pacienta. Toto vyšetření ale není u pacientů se SSc a dysmotilitou vhodné pro větší riziko uvíznutí kapsle a nutnosti endoskopické či chirurgické extrakce (59). Na druhou stranu Marie et al. ve své studii v roce 2014 pomocí kapslové endoskopie odhalili vaskulopatické postižení žaludku a tenkého střeva, které korelovalo s nálezy na kapilaroskopii nehtových valů. Pacienti dostali půl hodiny před vyšetřením erytromycin intravenózně jako prevenci gastroparézy a vyšetření bylo u všech dokončeno bez potíží (32).
RTG vyšetření ezofagogramu (RTG pasáž s použitím baria) je indikované při podezření na striktury jícnu a k verifikaci gastroparézy, kdy je při vyšetření s kontrastní látkou popsán typický obraz opožděného vyprazdňování žaludku (58). Kromě RTG pasáže lze k vyšetření motility využít také scintigrafické vyšetření (obr. 3 a 4).
Obr. 3. Vyšetření polykacího aktu pomocí RTG jícnu s kontrastem – bariová suspenze (200 ml Micropaque) u pacientky s dysmotilitou jícnu při SSc (z archivu Revmatologického ústavu) Je patrný volně výbavný polykací akt. Horní část jícnu (obr. 3a) není rozšířená a pasáž je volná, na snímku 1 a 2 je dobře patrná projekce osteofytů krční páteře do zadní stěny hypofaryngu. Pod obloukem aorty (obr. 3b) se jícen hypotonicky rozšiřuje a peristaltika je vymizelá, jícen se konicky zužuje k hiátu – kontrastní látka zde stagnuje a žaludek se poté plní užším kanálem.
3a Předozadní projekce, horní část jícnu
3b Boční projekce, dolní část jícnu (včetně části pod aortálním obloukem)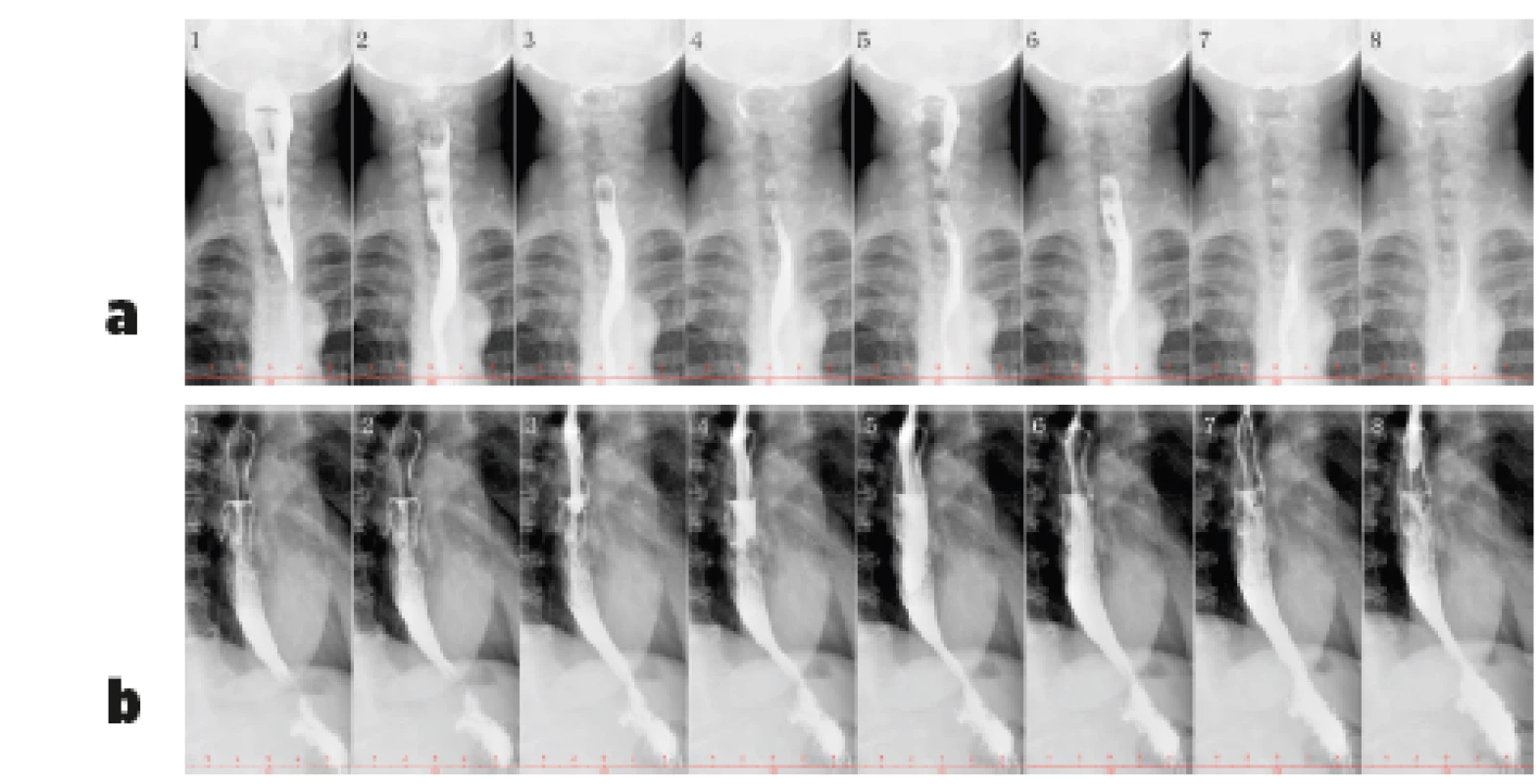
Obr. 4. Scintigrafie jícnu: vyšetření polykacího aktu (per os podání 40 MBq 99mTc – Sn koloidu) u pacientky s dysmotilitou jícnu při SSc – vybrané snímky (z archivu Revmatologického ústavu). Významně narušená motilita jícnu: po polknutí kontrastní látka (KL) setrvává po celou dobu vyšetření ve střední třetině jícnu (snímek 1 až 6), na okamžik se cca 20 % KL dostává do žaludku (snímek 2), načež dochází k regurgitaci (snímek 3 až 5), ke konci vyšetření zvolna proniká do žaludku (snímek 8). 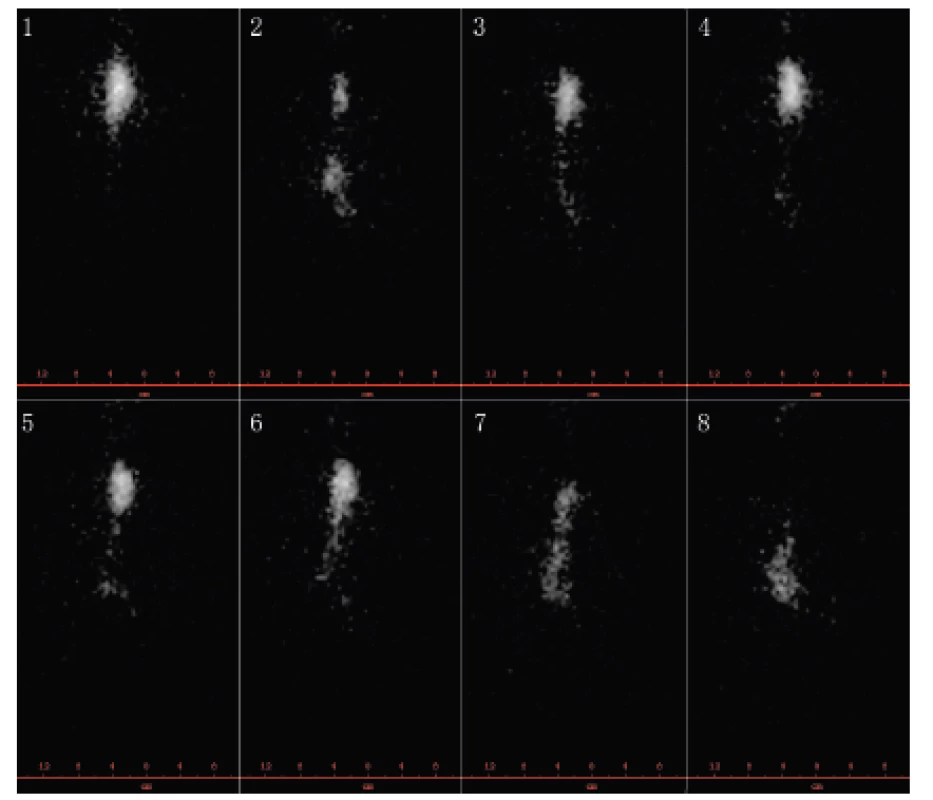
Diagnostika SIBO je postavena zejména na subjektivních symptomech (nadýmání po jídle, nevolnost až zvracení, bolesti břicha, průjem, plynatost) spolu s objektivními známkami malabsorpce (resp. malnutrice), jako je hubnutí, klinické a laboratorní známky deficitu živin. Jako laboratorní markery malnutrice lze použít hladinu hemoglobinu (jehož nízká hladina může značit deficit železa, kyseliny listové nebo vitaminu B12), sérovou hladinu karotenu (který odpovídá absorpci vitaminu A rozpustného v tucích, a tedy i absorpci tuků) nebo hladinu kyseliny listové (zvýšená u SIBO) (58). Hladina albuminu v séru není senzitivní ani specifická, neboť jeho hladiny klesají i během akutního zánětlivého stavu a mohou být normální u dlouhodobé protein-energetické malnutrice. Teprve při poklesu hladiny albuminu pod 35 g/l má albumin výpovědní hodnotu vzhledem k malnutrici. Hodnota prealbuminu je považována za validnější. Dále je doporučeno například stanovení hladiny kyseliny metyl-mevalonové, zinku, 25-hydroxycholekalciferolu (odpovídá celkovému stavu vitaminu D), vitaminu K a protrombinového času a případně dalších mikronutrientů – zvlášť při podezření na SIBO (49, 58).
Dechový test je považován za ekonomicky nejvýhodnější, široce dostupnou, neinvazivní metodu k vyšetření SIBO. Principem je detekce vodíku nebo metanu ve vydechovaném vzduchu. Lidské buňky nejsou schopné tyto plyny produkovat. Vodík a metan v lidském střevě vznikají činností bakterií, které rozkládají zbytky uhlovodíků. Tyto plyny se poté absorbují střevní stěnou do krevního oběhu a jsou z těla vyloučeny respirační cestou. Charakteristické změny koncentrace metanu a vodíku ve vydechovaném vzduchu po podání glukózy a laktulózy svědčí pro přítomnost SIBO (36, 60).
Přestože tzv. dechový test vykazuje vysokou specificitu pro SIBO, jeho senzitivita je nedostatečná (65–70 %) a nelze ho využít k hodnocení bakteriální přerůstání v distálních partiích tenkého střeva. Stále chybí dostatečně specifický a současně senzitivní test k hodnocení SIBO (58).
HODNOCENÍ POSTIŽENÍ PACIENTEM
Prvním dotazníkem hodnotícím celkovou závažnost onemocnění a kvalitu života pacientů v kontextu s postižením GIT byl Scleroderma Gastrointestinal Tract 1.0 (SSC-GIT 1.0), vytvořený a následně validovaný v roce 2009 (61). Později byl tento dotazník revidován a upraven do konečné verze nazvané University of California, Los Angeles Scleroderma Clinical Trial Consortium GIT 2.0 (UCLA SCTC GIT 2.0) (62).
Dalším nástrojem je Patient Reported Outcome Measurement Information System (PROMIS), konkrétně část zaměřená na symptomy postižení GIT, vytvořený Národním institutem pro zdraví (National Institute of Health) (63). Oproti UCLA GIT 2.0 má PROMIS více položek a navíc obsahuje škálu pro hodnocení poruchy polykání, nevolnosti a zvracení. Oba dotazníky dobře korelují navzájem i se závažností postižení, ačkoliv se PROMIS jeví jako srozumitelnější pro běžnou a zdravotnicky nevzdělanou populaci (64). Dalšími dotazníky, které prokázaly dobrou senzitivitu v detekci GIT manifestací u pacientů se SSc, jsou UCLA GIT 2.0 Reflux Scale, PROMIS Reflux Scale a QOLRAD (Quality of Life in Reflux and Dyspepsia questionnaire). Tyto dotazníky by měly být do budoucna součástí dalších studií a klinických hodnocení u SSc (65).
Zatím jediný validovaný nástroj k hodnocení malnutrice u chronicky nemocných, který byl studován u pacientů se SSc, je tříbodový dotazník Malnutrition Universal Screening Tool (MUST), který má však své limitace u pacientů s chronickou malnutricí (u kterých nemusí docházet v čase k významným úbytkům hmotnosti) (48, 66).
SOUČASNÉ TERAPEUTICKÉ MOŽNOSTI
Do dnes neexistuje žádná specifická chorobu modifikující terapie, která by dokázala zastavit progresi onemocnění. Pro symptomatickou léčbu je důležitá zejména časná diagnóza orgánového postižení, neboť rozvinutá tkáňová fibróza je těžko terapeuticky ovlivnitelná (2). Přehled terapeutických možností uvádí tabulka 2.
Tab. 2. Terapie a sledování pacientů se SSc s postižením GIT (podle Nagaraja V, et al. Management of gastrointestinal involvement in scleroderma. Curr Treatm Opt Rheumatol 2015; 1(1): 82–105) 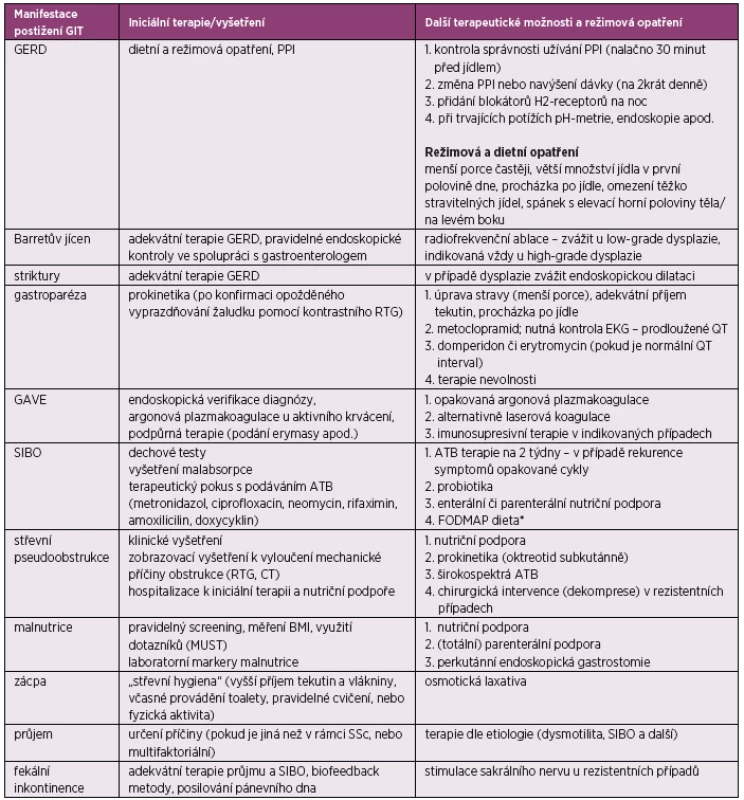
*FODMAP potraviny: nevhodné a dráždivé suroviny u pacientů se syndromem dráždivého tračníku, či chronickým střevním onemocněním (idiopatické střevní záněty, celiakie a další), FODMAP dieta spočívá v eliminaci příjmu těchto potravin: fermentovatelné oligosacharidy (lepek, cibule, česnek atd.), disacharidy (laktóza), monosacharidy (fruktóza) a polyoly (alkoholové cukry) – jedná se o sacharidy špatně absorbovatelné v tenkém střevě. GIT – gastrointestinální trakt, GERD – gastroezofageální refluxní choroba (GER disease), PPI – inhibitory protonové pumpy (proto pump inhibitors), RTG – rentgen, EKG – elektrokardiogram, GAVE – gastrická antrální vaskulární ektázie (gastric antral vascular ectasia), SIBO – syndrom bakteriálního přerůstání v tenkém střevě (small intestinal bacterial overgrowth), ATB – antibiotika, CT – počítačová tomografie, BMI – hmotnostně výškový index (body mass index), MUST – nástroj k hodnocení malnutrice (malnutrition universal screening tool) Na prvním místě je nefarmakologická terapie spočívající v režimových opatřeních (např. spát s elevací horní poloviny těla a/nebo na levém boku) a v úpravě stravy (eliminace těžkých jídel, jíst častěji po menších porcích, nejíst později než
3–4 hodiny před ulehnutím ke spánku), vyhýbání se se některým potravinám (např. čokoláda, kofeinové nápoje) a lékům (např. nitráty, blokátory kalciových kanálů), které snižují tonus LES, a edukace ohledně užívání rizikové medikace (např. bisfosfonáty, tetracykliny, preparáty železa, NSA). Dále je doporučená redukce hmotnosti u obézních jedinců a abstinence kouření a alkoholu (58).Společnost EULAR (European League Against Rheumatism) ve svém nejnovějším vydání Doporučení pro terapii SSc z roku 2017 shrnula terapii postižení GIT do tří bodů:
- inhibitory protonové pumpy (PPI) při GERD k prevenci vzniku komplikací
- prokinetika při dysmotilitě
- antibiotika (ATB) u symptomatického SIBO
Bohužel dosud neexistují velké randomizované kontrolované studie (randomised control trials – RCT), které by hodnotily efekt této terapie specificky u SSc (67).
Menší RCT prokázaly příznivý efekt PPI na zmírnění symptomů postižení horní části GIT u SSc. Omeprazol má navíc potenciál redukovat fibrózu stěny jícnu. Na druhou stranu nese dlouhodobé podávání PPI svá rizika – SIBO, infekce (např. C. difficile), zhoršení vstřebávání živin, či dokonce kardiovaskulární nemoci, malignity, demence a další (67). Antagonisté H2 - receptorů (H2RA) jsou indikovány k terapii GERD v dalším kroku buď v monoterapii, nebo v kombinaci s PPI. H2RA snižují zejména noční sekreci žaludečních kyselin, která je dependentní na histaminu a současně není terapeuticky ovlivnitelná pomocí PPI (58).
Co se týče prokinetik, několik nerandomizovaných nebo nekontrolovaných studií prokázalo zlepšení symptomů GIT u pacientů se SSc. Zařazení prokinetik do kombinace je výhodné zejména v časné fázi onemocnění, zatímco v pozdějších fázích s převažující atrofií hladké svaloviny je efekt léků minimální (67). Výběr konkrétního přípravku z této skupiny záleží na individuálním posouzení přínosu pro pacienta. Terapie první linie u gastroparézy je metoklopramid následovaný domperidonem, erythromycinem či pyristigminem. Všechny preparáty vyžadují monitoraci možných nežádoucích účinků (58).
Při podezření na SIBO je indikována empirická terapie jedním či více širokospektrými ATB po dobu 2 týdnů s následným zhodnocením efektu léčby. Při přetrvávání symptomů pokračují dvoutýdenní cykly ATB střídané dvoutýdenními intervaly bez léčby. Délka a režim terapie závisí na závažnosti symptomů a klinické odpovědi na terapii (67). Současně by měla být zajištěna nutriční suplementace, vhodné je i podávání probiotik (58).
Dalšími terapeutickými možnostmi jsou například u GERD antagonisté receptoru typu B pro γ-aminomáselnou kyselinu (GABA-B) či metabotropních antagonistů glutamátového receptoru (mGluR), které zpomalují snižování bazálního tonu dolního jícnového svěrače. Nicméně tento jejich příznivý efekt zatím nebyl zkoumán u SSc. Z nových farmakologických cílů jsou zkoumány například syntáza oxidu dusnatého (NOS), kanabinoidní, muskarinové či opioidní receptory, s cílem snížit přechodnou relaxaci dolního jícnového svěrače. Chirurgické intervence nejsou obecně u SSc doporučovány z důvodu vyššího rizika komplikací oproti běžné populaci (58).
Intervenční endoskopie je metodou volby jen v indikovaných případech. Například endoskopická dilatace jícnových striktur by neměla být prováděna empiricky, ale jen na základě jasně stanovené diagnózy kvůli riziku perforace. Laserová či argonová plazmová koagulace je indikována u GAVE po adekvátní substituční terapii anemie. Chirurgické řešení by mělo být až na posledním místě po selhání všech předchozích intervencí (58).
V případě podezření na intestinální pseudoobstrukci musí být nejdříve vyloučena mechanická překážka. Základní terapie spočívá v šetřící dietě, nutriční podpoře, korekci mineralogramu, podávání prokinetik a případně ATB při symptomech SIBO. Ve většině případů (70 %) vede konzervativní terapie k ústupu symptomů. U některých pacientů se ale nelze vyhnout chirurgickému řešení (9 %). Odborníci také doporučují subkutánní podávání oktreotidu v dávce 50–200 mikrogramů za den (58).
Terapie postižení tlustého střeva je zejména symptomatická a řídí se převažující symptomatologií (dietní opatření, laxativa anebo antidiaroika). Při obstipaci je nutné vyloučit obstrukci, zkontrolovat stávající medikaci a vyloučit léky způsobující obstipaci. Stejně tak by měla být vyloučena jiná etiologie průjmu než postižení v rámci SSc (infekční, autoimunitní nemoci – celiakie, mikroskopická kolitida, amyloidóza). Antidiaroika (např. loperamid) je nutné předepisovat s opatrností kvůli riziku pseudoobstrukce. Pro zlepšení vstřebávání živin při SIBO je vhodná suplementace žlučových kyselin. Terapie inkontinence je složitá a vyžaduje komplexní přístup sestávající z léčby průjmu, behaviorální terapie (anorektální biofeedback), posilování svalů pánevního dna a případně mikrochirurgické intervence k stimulaci sakrálních nervů (58).
Léčba malnutrice
U pacientů s progresivní či už pokročilou formou onemocnění je často indikovaná enterální a někdy i dlouhodobá parenterální podpůrná výživa (1). Neexistují žádné studie, které by se věnovaly enterální výživě u SSc. Skupina The North American Expert Panel doporučuje suplementační terapii podobně jako u jiných chronicky nemocných pacientů. V případě gastroparézy jsou doporučeny dietní opatření (bezezbytková, nízkotučná dieta s vysokým obsahem tekutin) spolu s pravidelným sledováním tělesné hmotnosti (47). Alternativou enterální výživy při omezení perorálního příjmu jsou perkutánní endoskopická gastrostomie (PEG), nazojejunální sonda, či perkutánně nebo chirurgicky zavedená enterální sonda a nakonec parenterální výživa (PV) (1).
PV je možností terapie pro pacienty s refrakterní malnutricí, kde enterální výživa nestačí (těžké SIBO) nebo je chirurgicky neproveditelná (těžká kožní fibróza). Nevýhodou PV je vysoká cena a komplikace (katétrové infekce, hepatopatie, osteoporóza, volumové přetížení a další). Navíc se přidávají problémy specifické pro SSc v souvislosti s postižením kůže, vaskulopatií a deformitami rukou vyžadující asistenci při aplikaci infuzí (1).
Na základě studií u pacientů s chronickým střevním onemocněním a retrospektivních studií sledujících nutrici u pacientů se SSc je PV považována za efektivní i u SSc. Je ovšem nutná pravidelná monitorace případných komplikací a tělesné hmotnosti, edukace pacienta a optimalizace nutriční suplementace. Vhodná délka PV zatím nebyla jasně stanovena (1).
Perspektivy terapie v budoucnu
Stále jsou zkoumány nové možnosti terapie postižení GIT u SSc, zejména imunosupresivní terapie a malé molekuly cílené na profibrotické cytokiny a IVIG. Efekt IVIG je vícečetný: antiidiotypová neutralizace cirkulujících protilátek proti muskarinovým receptorům, fibroblastům či endotelovým buňkám a redukce profibrotických cytokinů. IVIG mají lepší bezpečnostní profil ve srovnání s ostatními imunosupresivy a podle observačních studií mají dobrý potenciál mírnit symptomy postižení GIT (2, 68, 69). Další možností je inhibice miRNA-29 molekul (70). Nicméně je zapotřebí velkých kontrolovaných studií, které by potvrdili benefit těchto zatím slibných terapeutických přístupů u SSc.
ZÁVĚR
Postižení gastrointestinálního traktu se vyskytuje u většiny pacientů se SSc. V některých případech může být asymptomatické a může předcházet typické kožní postižení. Screening v časné fázi onemocnění je proto důležitý, aby bylo možné zahájit terapii před rozvojem nevratného orgánového postižení. Patofyziologie je stejně jako specifická terapie stále předmětem výzkumu. V současnosti spočívá terapie v symptomatické léčbě a nutriční podpoře, nejlépe v kooperaci s dalšími specialisty. Neměli bychom zapomínat na celkový dopad tohoto postižení na zdravotní stav a kvalitu života, který v současnosti také není komplexně objasněný.
Poděkování
Práce vznikla za podpory grantu AZV NV18-01-00161 A, 16-33542A, 16-33574A, institucionální podpory Ministerstva zdravotnictví ČR pro Revmatologický ústav č. 023728 a GA UK 312218.
Konflikt zájmů: žádný.
adresa pro korespondenci:
doc. MUDr. Michal Tomčík, Ph.D.
Revmatologický ústav
Na Slupi 4, 128 50 Praha 2
e-mail: tomcik@revma.cz
Zdroje
1. Bharadwaj S, Tandon P, Gohel T, Corrigan ML, Coughlin KL, Shatnawei A, et al. Gastrointestinal Manifestations, Malnutrition, and Role of Enteral and Parenteral Nutrition in Patients With Scleroderma. J Clin Gastroenterol 2015; 49(7): 559–564.
2. Kumar S, Singh J, Rattan S, DiMarino AJ, Cohen S, Jimenez SA. Review article: pathogenesis and clinical manifestations of gastrointestinal involvement in systemic sclerosis. Aliment Pharmacol Ther 2017; 45(7): 883–898.
3. Gabrielli A, Avvedimento EV, Krieg T. Scleroderma. N Engl J Med 2009; 360(19): 1989–2003.
4. Piasecki C, Chin J, Greenslade L, McIntyre N, Burroughs AK, McCormick PA. Endoscopic detection of ischaemia with a new probe indicates low oxygenation of gastric epithelium in portal hypertensive gastropathy. Gut 1995; 36(5): 654–656.
5. Malandrini A, Selvi E, Villanova M, Berti G, Sabadini L, Salvadori C, et al. Autonomic nervous system and smooth muscle cell involvement in systemic sclerosis: ultrastructural study of 3 cases. J Rheumatol 2000; 27(5): 1203–1206.
6. Russell ML, Friesen D, Henderson RD, Hanna WM. Ultrastructure of the esophagus in scleroderma. Arthritis Rheum 1982; 25(9): 1117–1123.
7. Goldblatt F, Gordon TP, Waterman SA. Antibody-mediated gastrointestinal dysmotility in scleroderma. Gastroenterology 2002; 123(4): 1144–1150.
8. Kumar S, Singh J, Kedika R, Mendoza F, Jimenez SA, Blomain ES, et al. Role of muscarinic-3 receptor antibody in systemic sclerosis: correlation with disease duration and effects of IVIG. Am J Physiol Gastrointest Liver Physiol 2016; 310(11): G1052–1060.
9. Chizzolini C, Boin F. The role of the acquired immune response in systemic sclerosis. Semin Immunopathol 2015; 37(5): 519–528.
10. O’Reilly S, Hugle T, van Laar JM. T cells in systemic sclerosis: a reappraisal. Rheumatology (Oxford) 2012; 51(9): 1540–1549.
11. Raja J, Denton CP. Cytokines in the immunopathology of systemic sclerosis. Semin Immunopathol 2015; 37(5): 543–557.
12. Manetti M, Neumann E, Muller A, Schmeiser T, Saar P, Milia AF, et al. Endothelial/lymphocyte activation leads to prominent CD4+ T cell infiltration in the gastric mucosa of patients with systemic sclerosis. Arthritis Rheum 2008; 58(9): 2866–2873.
13. Manetti M, Neumann E, Milia AF, Tarner IH, Bechi P, Matucci-Cerinic M, et al. Severe fibrosis and increased expression of fibrogenic cytokines in the gastric wall of systemic sclerosis patients. Arthritis Rheum 2007; 56(10): 3442–3447.
14. Manetti M, Rosa I, Messerini L, Guiducci S, Matucci-Cerinic M, Ibba-Manneschi L. A loss of telocytes accompanies fibrosis of multiple organs in systemic sclerosis. J Cell Mol Med 2014; 18(2): 253–262.
15. Parker MW, Rossi D, Peterson M, Smith K, Sikstrom K, White ES, et al. Fibrotic extracellular matrix activates a profibrotic positive feedback loop. J Clin Invest 2014; 124(4): 1622–1635.
16. O’Reilly S. MicroRNAs in fibrosis: opportunities and challenges. Arthritis Res Ther 2016; 18 : 11.
17. Jung S, Martin T, Schmittbuhl M, Huck O. The spectrum of orofacial manifestations in systemic sclerosis: a challenging management. Oral Dis 2017; 23(4): 424–439.
18. Avouac J, Sordet C, Depinay C, Ardizonne M, Vacher-Lavenu MC, Sibilia J, et al. Systemic sclerosis-associated Sjogren’s syndrome and relationship to the limited cutaneous subtype: results of a prospective study of sicca syndrome in 133 consecutive patients. Arthritis Rheum 2006; 54(7): 2243–2249.
19. Auluck A, Pai KM, Shetty C, Shenoi SD. Mandibular resorption in progressive systemic sclerosis: a report of three cases. Dentomaxillofac Radiol 2005; 34(6): 384–386.
20. Rajapakse CN, Bancewicz J, Jones CJ, Jayson MI. Pharyngo-oesophageal dysphagia in systemic sclerosis. Ann Rheum Dis 1981; 40(6): 612–614.
21. Derk CT, Rasheed M, Spiegel JR, Jimenez SA. Increased incidence of carcinoma of the tongue in patients with systemic sclerosis. J Rheumatol 2005; 32(4): 637–641.
22. Ntoumazios SK, Voulgari PV, Potsis K, Koutis E, Tsifetaki N, Assimakopoulos DA. Esophageal involvement in scleroderma: gastroesophageal reflux, the common problem. Semin Arthritis Rheum 2006; 36(3): 173–181.
23. Young MA, Rose S, Reynolds JC. Gastrointestinal manifestations of scleroderma. Rheum Dis Clin North Am 1996; 22(4): 797–823.
24. Shaheen N, Ransohoff DF. Gastroesophageal reflux, barrett esophagus, and esophageal cancer: scientific review. JAMA 2002; 287(15): 1972–1981.
25. Koufman JA. The otolaryngologic manifestations of gastroesophageal reflux disease (GERD): a clinical investigation of 225 patients using ambulatory 24-hour pH monitoring and an experimental investigation of the role of acid and pepsin in the development of laryngeal injury. Laryngoscope 1991; 101(4 Pt 2 Suppl 53): 1–78.
26. Wipff J, Allanore Y, Soussi F, Terris B, Abitbol V, Raymond J, et al. Prevalence of Barrett’s esophagus in systemic sclerosis. Arthritis Rheum 2005; 52(9): 2882–2888.
27. Marie I, Dominique S, Levesque H, Ducrotte P, Denis P, Hellot MF, et al. Esophageal involvement and pulmonary manifestations in systemic sclerosis. Arthritis Rheum 2001; 45(4): 346–354.
28. Recht MP, Levine MS, Katzka DA, Reynolds JC, Saul SH. Barrett’s esophagus in scleroderma: increased prevalence and radiographic findings. Gastrointest Radiol 1988; 13(1): 1–5.
29. Weston S, Thumshirn M, Wiste J, Camilleri M. Clinical and upper gastrointestinal motility features in systemic sclerosis and related disorders. Am J Gastroenterol 1998; 93(7): 1085–1089.
30. Wipff J, Coriat R, Masciocchi M, Caramaschi P, Derk CT, Hachulla E, et al. Outcomes of Barrett’s oesophagus related to systemic sclerosis: a 3-year EULAR Scleroderma Trials and Research prospective follow-up study. Rheumatology (Oxford) 2011; 50(8): 1440–1444.
31. Richardson C, Agrawal R, Lee J, Almagor O, Nelson R, Varga J, et al. Esophageal dilatation and interstitial lung disease in systemic sclerosis: A cross-sectional study. Semin Arthritis Rheum 2016; 46(1): 109–114.
32. Marie I, Antonietti M, Houivet E, Hachulla E, Maunoury V, Bienvenu B, et al. Gastrointestinal mucosal abnormalities using videocapsule endoscopy in systemic sclerosis. Aliment Pharmacol Ther 2014; 40(2): 189–199.
33. Hung EW, Mayes MD, Sharif R, Assassi S, Machicao VI, Hosing C, et al. Gastric antral vascular ectasia and its clinical correlates in patients with early diffuse systemic sclerosis in the SCOT trial. J Rheumatol 2013; 40(4): 455–460.
34. Ingraham KM, O’Brien MS, Shenin M, Derk CT, Steen VD. Gastric antral vascular ectasia in systemic sclerosis: demographics and disease predictors. J Rheumatol 2010; 37(3): 603–607.
35. Lazzaroni MG, Cavazzana I, Colombo E, Dobrota R, Hernandez J, Hesselstrand R, et al. Malignancies in patients with anti-RNA polymerase III antibodies and systemic sclerosis: analysis of the EULAR scleroderma trials and research cohort and possible recommendations for screening. J Rheumatol 2017; 44(5): 639–647.
36. Polkowska-Pruszynska B, Gerkowicz A, Szczepanik-Kulak P, Krasowska D. Small intestinal bacterial overgrowth in systemic sclerosis: a review of the literature. Arch Dermatol Res 2019; 311(1): 1–8.
37. Bures J, Cyrany J, Kohoutova D, Forstl M, Rejchrt S, Kvetina J, et al. Small intestinal bacterial overgrowth syndrome. World J Gastroenterol 2010; 16(24): 2978–2990.
38. Grace E, Shaw C, Whelan K, Andreyev HJ. Review article: small intestinal bacterial overgrowth – prevalence, clinical features, current and developing diagnostic tests, and treatment. Aliment Pharmacol Ther 2013; 38(7): 674–688.
39. Valenzuela A, Li S, Becker L, Fernandez-Becker N, Khanna D, Nguyen L, et al. Intestinal pseudo-obstruction in patients with systemic sclerosis: an analysis of the Nationwide Inpatient Sample. Rheumatology (Oxford) 2016; 55(4): 654–658.
40. Marie I, Ducrotte P, Denis P, Menard JF, Levesque H. Small intestinal bacterial overgrowth in systemic sclerosis. Rheumatology (Oxford) 2009; 48(10): 1314–1319.
41. Balbir-Gurman A, Brook OR, Chermesh I, Braun-Moscovici Y. Pneumatosis cystoides intestinalis in scleroderma-related conditions. Intern Med J 2012; 42(3): 323–329.
42. Assassi S, Fritzler MJ, Arnett FC, Norman GL, Shah KR, Gourh P, et al. Primary biliary cirrhosis (PBC), PBC autoantibodies, and hepatic parameter abnormalities in a large population of systemic sclerosis patients. J Rheumatol 2009; 36(10): 2250–2256.
43. Reynolds TB, Denison EK, Frankl HD, Lieberman FL, Peters RL. Primary biliary cirrhosis with scleroderma, Raynaud’s phenomenon and telangiectasia. New syndrome. Am J Med 1971; 50(3): 302–312.
44. Cavazzana I, Ceribelli A, Taraborelli M, Fredi M, Norman G, Tincani A, et al. Primary biliary cirrhosis-related autoantibodies in a large cohort of italian patients with systemic sclerosis. J Rheumatol 2011; 38(10): 2180–2185.
45. Rigamonti C, Shand LM, Feudjo M, Bunn CC, Black CM, Denton CP, et al. Clinical features and prognosis of primary biliary cirrhosis associated with systemic sclerosis. Gut 2006; 55(3): 388–394.
46. Caporali R, Caccialanza R, Bonino C, Klersy C, Cereda E, Xoxi B, et al. Disease-related malnutrition in outpatients with systemic sclerosis. Clin Nutr 2012; 31(5): 666–671.
47. Krause L, Becker MO, Brueckner CS, Bellinghausen CJ, Becker C, Schneider U, et al. Nutritional status as marker for disease activity and severity predicting mortality in patients with systemic sclerosis. Ann Rheum Dis 2010; 69(11): 1951–1957.
48. Baron M, Hudson M, Steele R, Canadian Scleroderma Research G. Malnutrition is common in systemic sclerosis: results from the Canadian scleroderma research group database. J Rheumatol 2009; 36(12): 2737–2743.
49. Baron M, Bernier P, Cote LF, Delegge MH, Falovitch G, Friedman G, et al. Screening and therapy for malnutrition and related gastro-intestinal disorders in systemic sclerosis: recommendations of a North American expert panel. Clin Exp Rheumatol 2010; 28(2 Suppl 58): S42–46.
50. Tanner SB, Moore CF, Jr. A review of the use of dual-energy X-ray absorptiometry (DXA) in rheumatology. Open Access Rheumatol 2012; 4 : 99–107.
51. Frediani B, Baldi F, Falsetti P, Acciai C, Filippou G, Spreafico A, et al. Bone mineral density in patients with systemic sclerosis. Ann Rheum Dis 2004; 63(3): 326–327.
52. Carbone L, Tylavsky F, Wan J, McKown K, Cheng S. Bone mineral density in scleroderma. Rheumatology (Oxford) 1999; 38(4): 371–372.
53. Corrado A, Colia R, Mele A, Di Bello V, Trotta A, Neve A, et al. Relationship between body mass composition, bone mineral density, skin fibrosis and 25(OH) vitamin D serum levels in systemic sclerosis. PLoS One 2015; 10(9): e0137912.
54. Marighela TF, Genaro Pde S, Pinheiro MM, Szejnfeld VL, Kayser C. Risk factors for body composition abnormalities in systemic sclerosis. Clin Rheumatol 2013; 32(7): 1037–1044.
55. Rosato E, Gigante A, Gasperini ML, Molinaro I, Di Lazzaro Giraldi G, Afeltra A, et al. Nutritional status measured by BMI is impaired and correlates with left ventricular mass in patients with systemic sclerosis. Nutrition 2014; 30(2): 204–209.
56. Caramaschi P, Biasi D, Caimmi C, Barausse G, Gatti D, Ferrari M, et al. Relationship between body composition and both cardiovascular risk factors and lung function in systemic sclerosis. Clin Rheumatol 2014; 33(1): 77–82.
57. Vardar R, Keskin M. Indications of 24-h esophageal pH monitoring, capsule pH monitoring, combined pH monitoring with multichannel impedance, esophageal manometry, radiology and scintigraphy in gastroesophageal reflux disease? Turk J Gastroenterol 2017; 28(Suppl 1): S16–S21.
58. Nagaraja V, McMahan ZH, Getzug T, Khanna D. Management of gastrointestinal involvement in scleroderma. Curr Treatm Opt Rheumatol 2015; 1(1): 82–105.
59. Braun-Moscovici Y, Brun R, Braun M. Systemic sclerosis and the gastrointestinal tract-clinical approach. Rambam Maimonides Med J 2016; 7(4).
60. Rezaie A, Pimentel M, Rao SS. How to test and treat small intestinal bacterial overgrowth: an evidence-based approach. Curr Gastroenterol Rep 2016; 18(2): 8.
61. Khanna D, Hays RD, Park GS, Braun-Moscovici Y, Mayes MD, McNearney TA, et al. Development of a preliminary scleroderma gastrointestinal tract 1.0 quality of life instrument. Arthritis Rheum 2007; 57(7): 1280–1286.
62. Khanna D, Hays RD, Maranian P, Seibold JR, Impens A, Mayes MD, et al. Reliability and validity of the University of California, Los Angeles Scleroderma Clinical Trial Consortium Gastrointestinal Tract Instrument. Arthritis Rheum 2009; 61(9): 1257–1263.
63. Spiegel BM, Hays RD, Bolus R, Melmed GY, Chang L, Whitman C, et al. Development of the NIH Patient-Reported Outcomes Measurement Information System (PROMIS) gastrointestinal symptom scales. Am J Gastroenterol 2014; 109(11): 1804–1814.
64. Nagaraja V, Hays RD, Khanna PP, Spiegel BM, Chang L, Melmed GY, et al. Construct validity of the Patient-Reported Outcomes Measurement Information System gastrointestinal symptom scales in systemic sclerosis. Arthritis Care Res (Hoboken) 2014; 66(11): 1725–1730.
65. McMahan ZH, Frech T, Berrocal V, Lim D, Bruni C, Matucci-Cerinic M, et al. Longitudinal assessment of Patient-reported Outcome Measures in systemic sclerosis patients with gastroesophageal reflux disease – scleroderma clinical trials consortium. J Rheumatol 2019; 46(1): 78–84.
66. Stratton RJ, Hackston A, Longmore D, Dixon R, Price S, Stroud M, et al. Malnutrition in hospital outpatients and inpatients: prevalence, concurrent validity and ease of use of the ‚malnutrition universal screening tool‘ (‚MUST‘) for adults. Br J Nutr 2004; 92(5): 799–808.
67. Kowal-Bielecka O, Fransen J, Avouac J, Becker M, Kulak A, Allanore Y, et al. Update of EULAR recommendations for the treatment of systemic sclerosis. Ann Rheum Dis 2017; 76(8): 1327–1339.
68. Raja J, Nihtyanova SI, Murray CD, Denton CP, Ong VH. Sustained benefit from intravenous immunoglobulin therapy for gastrointestinal involvement in systemic sclerosis. Rheumatology (Oxford) 2016; 55(1): 115–119.
69. Clark KE, Etomi O, Denton CP, Ong VH, Murray CD. Intravenous immunogobulin therapy for severe gastrointestinal involvement in systemic sclerosis. Clin Exp Rheumatol 2015; 33(4 Suppl 91): S168–170.
70. Ciechomska M, van Laar J, O’Reilly S. Current frontiers in systemic sclerosis pathogenesis. Exp Dermatol 2015; 24(6): 401–406.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2019 Číslo 1- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Rizikové faktory vzniku artrózy kolenního a kyčelního kloubu u pacientů indikovaných k totální endoprotéze
- Gastrointestinální postižení u systémové sklerodermie – jeho následky a strategie terapie
- Revmatologické manifestace HIV infekce
- Nejlepší publikace z časopisu Česká revmatologie v roce 2018
- Kalendár vzdelávacích akcí Ceské revmatologické spolecnosti na rok 2019
- Stanovisko České revmatologické společnosti k personálnímu a technickému vybavení center biologické léčby v revmatologii a ke způsobu organizace jejich sítě
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Revmatologické manifestace HIV infekce
- Rizikové faktory vzniku artrózy kolenního a kyčelního kloubu u pacientů indikovaných k totální endoprotéze
- Gastrointestinální postižení u systémové sklerodermie – jeho následky a strategie terapie
- Stanovisko České revmatologické společnosti k personálnímu a technickému vybavení center biologické léčby v revmatologii a ke způsobu organizace jejich sítě
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



