-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Doporučení ČRS pro léčbu nemocných se SLE
Recommendations of the Czech Society for Rheumatology for the treatment of patients with SLE
The article presents the recommendations of the Czech Society for Rheumatology for the treatment of systemic lupus erythematosus. The paper includes the definition of disease activity, general recommendations and used drugs. It summarizes the recommendations for the use of particular drugs according to the severity of the disease. The article defines the status of biological therapy (belimumab) in the treatment of SLE.
Key words:
systemic lupus erythematosus, treatment, biological therapy
Autoři: P. Horák; D. Tegzová; Z. Závada; M. Olejárová; M. Skácelová; A. Smržová; M. Žurek
Vyšlo v časopise: Čes. Revmatol., 21, 2013, No. 3, p. 110-122.
Kategorie: Doporučené postupy
Souhrn
Článek představuje doporučení České revmatologické společnosti pro léčbu systémového lupusu erythematodes. Věnuje se definici aktivity nemoci, všeobecným doporučením a užívaným léčivům. Sumarizuje doporučení k užití jednotlivých léků dle závažnosti choroby. Definuje postavení biologické léčby (belimumab) v terapii SLE.
Klíčová slova:
systémový lupus erythematodes, léčba, biologická léčbaÚvod
Léčba systémového lupus erythematodes (SLE) je zaměřena na zvládnutí aktivní nemoci, udržení remise onemocnění, zabránění vzniku závažného orgánového postižení, prevenci vzniku druhotných komplikací či na jejich zvládání. Vyžaduje správný výklad řady klinických symptomů i laboratorních nálezů a systematickou prevenci a terapii relapsů onemocnění, komplikujících infekcí, jakož i efektivní tlumení vedlejších účinků terapie a chronického zánětlivého procesu. SLE představuje onemocnění s heterogenním klinickým obrazem vyžadující často velmi individuální přístup k terapii.
Hodnocení aktivity a závažnosti choroby
Efektivní léčba vyžaduje přesné stanovení aktivity i závažnosti choroby (1). Aktivita choroby se vztahuje většinou ke stupni zánětu, zatímco závažnost choroby závisí na úrovni orgánového postižení a dysfunkce a na relativním významu postiženého orgánu či tkáně. Aktivita choroby je hodnocena kombinací anamnézy, klinického vyšetření, orgánově specifických testů a sérologických biomarkerů (2). Kvantifikaci aktivity choroby umožňují validované skórovací systémy aktivity (3, 4, 5, 6). V našich doporučeních panuje nejvýraznější shoda ohledně použití systému SLEDAI-2K, který je na jednu stranu poměrně jednoduchý, na stranu druhou je nejčastěji používán i v rámci klinických studií. Systém SLEDAI-2K (SLE Diasease Activity Index) se skládá z 24 kritérií, která postihují 9 orgánových systémů včetně imunitního (hladiny komplementu, anti-dsDNA protilátky) a hodnotí přítomnost projevů v posledních 10 dnech. Nejvyšší bodové ohodnocení mají postižení CNS, očí a nález vaskulitidy. Za aktivní chorobu lze považovat dosažení skóre 6 a více (5). Je si však třeba uvědomit, že hodnocení aktivity nelze v žádném případě omezit pouze na ohodnocení samotného indexu, skórovací systém však umožňuje sledování vývoje pacienta a jejich porovnání (7). Stupeň ireverzibilního orgánového či tkáňového postižení pak vyjadřuje index poškození „damage index“, nejčastěji používaným a rovněž doporučovaným je v této souvislosti systém SLICC (8).
1. Všeobecná doporučení:
V rámci edukace pacienta je nezbytné upozornit na faktory zevního prostředí, které mohou významným způsobem přispět k aktivitě choroby a ovlivnit její léčbu.
Fotoprotekce
Nemocné se SLE je třeba upozornit na riziko přímé expozici slunečnímu záření či jiným zdrojům ultrafialového světla pro možnost fotosenzitivní kožní reakce a aktivace choroby, mimo jiné se doporučuje používat ochranné faktory s vysokými filtry (9).
Dieta a nutrice
Jelikož existují pouze omezená data o vlivu dietních modifikací u SLE, doporučuje se konzervativní přístup založený na dobře vyvážené stravě obsahující dostatek sacharidů, proteinů a tuků. Existují údaje o pozitivním vlivu nenasycených mastných kyselina omega 3 na snížení aktivity choroby a snížení četnosti vzplanutí nemoci (10, 11). Dieta by měla být modifikovaná dle průběhu a aktivity choroby. Nemocní s vysokou zánětlivou aktivitou a horečkou vyžadují větší kalorický přísun. Na druhou stranu glukokortikoidy samy o sobě zvyšují apetenci, což má za důsledek nežádoucí přibývání na hmotnosti. Často se vyskytuje výrazná hypercholesterolémie a hyperlipidémie, a to nejen v souvislosti s nefrotickým syndromem. Tito nemocní by měli být instruováni k dietě se sníženým množstvím tuků (12, 13, 14). Lze doporučit multivitaminy v situaci, kdy je potřeba uplatnit dietní restrikce. Většina pacientů se SLE má nižší sérové hladiny 25 hydroxyvitaminu D (15) z řady příčin (fotosenzitivita, postižení ledvin, špatná utilizace), proto by nemocní užívající dlouhodobě glukokortikoidy a ženy v menopauze měli dostávat 800-1200 IU vitaminu D a suplementaci vápníkem.
Aerobní kondiční cvičení
Doporučuje se jako prevence rychlé ztráty svalové hmoty a působí pozitivně na snížení únavy (16, 17).
Kouření
Kouření zvyšuje riziko rozvoje SLE a zhoršuje výrazně jeho prognózu. Důrazně se doporučuje případné kouření ukončit (18, 19).
Imunizace
Doporučuje se provést pokud možno před zahájením imunosupresní terapie (20). Samotný lupus i terapie glukokortikoidy protilátkovou odpověď při vakcinaci zhoršují. Doporučuje se vyhnout živým vakcínám (varicela, rubeolla, spalničky, příušnice, poliomyelitida) (21). Problematiku vakcinace nemocných s autoimunitními zánětlivými revmatickými chorobami podrobně řeší doporučení EULAR (22). Všeobecně by této problematice měla být věnována větší pozornost než dosud, zejména s ohledem na vyšší riziko nemocných s SLE spojeným s infekcemi chřipkou, pneumokokem, herpetickými viry atd.
Další medikace
Existují kazuistická data, která svědčí pro možnost vlivu sulfonamidů na exacerbaci lupusu. Existují také léky, které mohou vyvolávat tzv. léky indukovaný lupus (prokainamid, hydralazin a řada dalších), nezpůsobují však vzplanutí idiopatického SLE, poněvadž tyto dvě jednotky jsou patogeneticky rozdílné. U SLE je často nutná terapie častých komorbidit, na předních místech se jedná o akcelerovanou aterosklerózu, infekce, hypertenzi, osteopenii a osteoporózu, projevy antifosfolipidového syndromu či o plicní hypertenzi (23).
Těhotenství a antikoncepce
Jelikož aktivní choroba s přítomností orgánového postižení přispívá k vysokému riziku potratovosti a následnému zhoršení průběhu SLE a léčba imunosupresivy je spojena s vyšším rizikem embryotoxicity a teratogenicity, doporučuje se ženám neotěhotnět, pokud choroba není v remisi alespoň 6 měsíců (24). Kontraceptiva, která obsahují vysokou dávku estrogenů, mohou přispívat k exacerbaci choroby. Tato komplikace se ale prakticky neobjevuje u moderních přípravků obsahujících nízkou dávkou estrogenu či progesteron. Hormonální antikoncepce je kontraindikovaná u nemocných s antifosfolipidovým syndromem či anamnézou tromboembolické choroby (25). Hormonálním kontraceptivům bychom se měli vyhnout rovněž u nemocných s migrenózními bolestmi hlavy (lupus headache) či s těžším Raynaudovým syndromem.
V léčbě SLE jsou běžně užívány léky, které jsou řazeny dle FDA (Food and Drug Administration, USA) do skupin s vyšším rizikem pro graviditu. Hlavním a relativně bezpečným lékem v graviditě jsou glukokortikoidy, a to zejména v nižších dávkách. Mezi relativně bezpečné léky patří nesteroidní antirevmatika s krátkým poločasem, podávaná však maximálně do 32. týdne těhotenství. Za bezpečnou je považována i terapie antimalariky, resp. hydroxychlorochin a je doporučováno ji v graviditě ponechat, jelikož její přínos převýší její možná rizika. Přísně kontraindikovány jsou cyklofosfamid, methotrexát, mykofenolát a leflunomid. Tyto léky je nutno před koncepcí ukončit a je nutno dodržet doporučené „vymývací období“, které je pro jednotlivé léky individuální. Azathioprin a cyklosporin A lze za určitých vážných situací v graviditě použít (27, 28). Jedná se zejména o případy relapsu závažné orgánové formy SLE, které ohrožují život matky, nejčastěji o lupusovou nefritidu. Samostatnou problematiku představuje riziko spontánních potratů u žen s přítomností antifosfolipidového syndromu
2. Medikamentózní léčba
Nesteroidní antirevmatika (NSA)
Jsou často předepisována u SLE k symptomatickému potlačení projevů choroby jako je únava, teploty, obtíže ze strany muskuloskeletálního systému a mírné sérozitidy. Dosud neexistuje přesvědčivý důkaz, že by některé z NSA bylo u lupusu všeobecně vhodnější (29). Nežádoucí účinky NSA jsou dobře známy, v popředí zájmu stojí gastrotoxicita, rizikovější při kombinaci s glukokortikoidy či s warfarinem (30). Poškození ledvin či neurologické postižení jako vzácnější vedlejší účinky NSA mohou být zaměněny s postižením těchto orgánů při samotném lupusu.
Antimalarika
Jedná se o léky původně určené pro terapii a prevenci malárie, které se postupem času staly významnými prostředky v terapii revmatoidní artritidy a zejména SLE. Antimalarika (hydroxychlorochin, chlorochin) aktivně stabilizují lysozomální membrány, potlačují chemotaxi a migraci polymorfonukleárů a zasahují i do některých funkcí T a B lymfocytů. Jsou nezastupitelná při terapii kožních forem lupusu, ale také u muskuloskeletárního postižení a u mírnějších serozitid a jejich indikace se v rámci lupusu stále rozšiřuje. Dlouhodobé studie ukázaly, že zejména hydroxychlorochin zabraňuje poškození ledvin, centrálního nervového systému, redukuje četnost relapsů a zřejmě díky antitrombotickému účinku snižuje i riziko akcelerované aterosklerózy a kardiovaskulárních příhod; snižuje i mortalitu nemocných (31–34). V monoterapii mají význam u mírnějších forem SLE, u středně závažných pak v kombinaci s glukokortikoidy (35) či imunosupresivy. Dle současných doporučení by naprostá většina nemocných se SLE měla užívat hydroxychlorochin jako základní lék s vynikajícím „cost/benefit“ poměrem ve většině klinických situací, se kterými se v rámci SLE setkáváme (1).
Na trhu jsou k dispozici oba preparáty z této skupiny, chlorochin v tabletách po 250 mg a hydroxychlorochin v tabletách s obsahem 200 mg účinné látky. Hydroxychlorochin je patrně bezpečnější než chlorochin a měl by být proto preferován (34). Dávkování je jednoduché, na počátku léčby a při aktivní nemoci se podávají dvě tablety po dobu 6–8 týdnů, pak se dávka snižuje na jednu tabletu denně.
Mezi nežádoucí účinky antimalarik patří gastrointestinální potíže v podobě nevolnosti, vzácně útlum krvetvorby či rozvoj hemolytické anémie při nedostatečnosti glukóza-6 fosfátdehydrogenázy či při závažnějších poruchách jater.
Závažným problémem podávání antimalarik je poškození zraku. Existuje možnost ukládání léku do rohovky projevující se rozmazaným viděním a kruhy kolem světelných bodů. Keratopatie je však v naprosté většině případů po vysazení léku plně reverzibilní. Obávanější komplikací je retinopatie, která je způsobena vazbou antimalarik na melanin pigmentové vrstvy a na poškození tyčinek a čípků sítnice. Dle dnešních poznatků představuje vysoká denní dávka větší riziko poškození zraku než dávka kumulativní. Pozdní formy postižení sítnice vedou k makulární degeneraci, atrofii očního nervu a dokonce ztrátě zraku. Mezi základní vyšetření před i během podávání antimalarik proto patří vyšetření zrakové ostrosti, vyšetření štěrbinovou lampou a zhodnocení očního pozadí. Kontroly se provádějí při dlouhodobé léčbě u rizikových pacientů v intervalech 6–12 měsíců (36).
Glukokortikoidy
Glukokortikoidy jsou stále nejúčinnějším prostředkem v léčbě SLE, jejich podání vede k rychlému, byť pouze dočasnému zlepšení většiny projevů SLE. Mohou být podávány různým způsobem – místně u kožních manifestací, aplikací přímo do hlubokých kožních lézí u diskoidní kožní formy, injekčně při entezopatiích či synovitidách, v nízkých či ve vysokých dávkách perorálně i parenterálně (velmi často také v podobě i.v. pulzů) při akutních, těžkých orgánových projevech choroby (37–40).
U choroby s nízkou aktivitou procesu vystačíme s úvodním dávkováním prednisonu (či metylprednisolonu) menším než 0,5 mg/kg/den, při vysoké aktivitě choroby pak s dávkami do 1 mg/kg/den. Vysoké dávky glukokortikoidů (až 1 g metylprednisolonu) lze podávat intravenózně ve 3–5 pulzech. Podávání vysokých dávek glukokortikoidů by mělo být časově omezeno na 6–8 týdnů (41, 42). Po dosažení ústupu aktivity choroby je třeba dávku postupně redukovat na nejnižší možnou úroveň. Nežádoucí účinky glukokortikoidů jsou časté, velká pozornost je v současné době věnována glukokortikoidy indukované osteoporóze (43, 44). Je třeba mít na zřeteli také přítomnost útlumu činnost nadledvin u nemocných v dlouhodobé terapii glukokortikoidy. Další úskalí terapie představují vývoj iatrogenního hyperkortizolismu, myopatie, avaskulární nekrózy hlavice kosti stehenní, glaukomu, vředové choroby žaludku a duodena, pankreatitidy, neuropsychiatrických komplikací, poruchy glukózové tolerance či steroidního diabetu. U pulzní terapie pak hrozí bezprostředně vznik arytmie, srdečního selhání či hypertenzní krize zejména u disponovaných jedinců. Je si třeba uvědomit, že dlouhodobě podávané glukokortikoidy zásadně přispívají k rozvoji řady poškození u SLE tak, jak je definuje systém SLICC (katarakta, osteoporóza, aseptická nekróza kosti, riziko aterosklerózy, svalová slabost a atrofie, diabetes mellitus) (45, 46).
Přes všechna úskalí, která s sebou přináší léčba glukokortikoidy, je jejich použití u SLE často nezbytné a život zachraňující.
Azathioprin
Azathioprin je purinový analog ovlivňující biosyntézu purinů, má výrazný imunosupresní a protizánětlivý účinek. Je indikován u aktivních forem lupusu s orgánovým postižením. Je méně účinný než cyklofosfamid, ale je bezesporu bezpečnější (47, 48). Lze jej také podávat jako udržovací léčbu remise dosažené cyklofosfamidem či jako prostředek umožňující snížit stávající dávku glukokortikoidů (49, 50). Podává se v dávkách 1–3 mg/kg/den, udržovací dávka se pohybuje mezi 1–2 mg/kg/den. Na trhu je k dispozici v tabletách po 25 a 50 mg.
Mezi hlavní nežádoucí účinky patří útlum krvetvorby, zažívací potíže, hepatopatie s elevací jaterních enzymů, větší dispozice k oportunním infekcím (herpes zoster). Thiopurin metyltransferáza (TPMT) je enzym podílející se na metabolismu azathioprinu. Jeho některé genetické varianty jsou spojeny s celkově sníženou aktivitou TPMT. Heterozygotní forma je v populaci poměrně častá (10 %) a je spojena se zvýšeným rizikem myelosuprese po azathioprinu. Vysoké riziko myelosuprese azathioprinem doprovází mnohem vzácněji se vyskytující kompletní deficience TPMT (1 případ na 300 lidí).
Při dlouhodobém podávání se předpokládá možnost vyšší incidence malignit zejména hemopoetického a lymforetikulárního systému. Je třeba dávat pozor na známou, ale někdy opomíjenou interakci s allopurinolem, který zvyšuje toxicitu azathioprinu a může navodit vleklý útlum kostní dřeně s pancytopenií.
Methotrexát
Postavení methotrexátu, antagonisty kyseliny listové, v terapii SLE není tak výlučné, jako je tomu v léčbě revmatoidní artritidy, i když jsou jeho indikace i na tomto poli poměrně časté. Představuje alternativu podání antimalarik u dominantního postižení kůže, synovie, serózních blan a u forem doprovázených pyretickou reakcí. Je podáván v dávce 7,5–20 mg jedenkrát týdně, perorálně či parenterálně (53, 54).
Cyklofosfamid (CFA)
Alkylační agens cyklofosfamid účinkuje na úrovni nukleových kyselin prakticky během všech fází buněčného cyklu, zejména však v S fázi. Má účinek cytotoxický, imunosupresivní a protizánětlivý. Představuje v současnosti standardní terapii aktivního SLE s přítomností lupus nefritidy zejména III. a IV. histologického typu (fokální a difúzní proliferativní glomerulonefritida), vaskulitidy, rezistentní trombocytopenie či závažnějších forem postižení CNS. Cyklofosfamid se metabolizuje v játrech na aktivní alkylační metabolity. Lze jej podávat jak perorálně, tak intravenózně. Vylučuje se zejména ledvinami, takže při poruše funkce ledvin je třeba jeho dávku redukovat. Perorálně se cyklofosfamid podává kontinuálně v dávce 1–3 mg/kg/den. Jako velmi účinné a poměrně bezpečné se ukázaly intravenózní pulzy CFA v dávce 0,3–1g/m2 v léčbě proliferativní lupusové nefritidy. Pulzy se obvykle opakují v intervalu 3-4 týdnů po dobu prvních 6 měsíců, intervaly jejich podávání je možno dle stavu pacienta i prodloužit (41, 42, 49, 55, 56, 57).
Bezpečnější alternativou agresivně podávaného cyklofosfamidu zejména z pohledu gonadální toxicity je v případě systémového lupusu u lupusové nefritidy podávání tzv. minipulzů (500 mg pro každou infuzi) v intervalu 2 týdnů po dobu 3 měsíců s následnou udržovací imunosupresí (azathioprin, mykofenolát) dle doporučení a výsledků skupiny Eurolupus (58). Pro intravenózní podání CFA existuje řada dalších schémat, která je nutno často přizpůsobit individualitě nemocného s ohledem na výsledky sledování aktivity choroby a bezpečnosti podávání látky. Četné klinické studie prokázaly, že CFA zpomaluje progresi jizvícího procesu v ledvinných glomerulech a snižuje riziko rozvoje konečného stádia ledvinného selhání (41, 42, 49).
Graf 1. Léčebné postupy využívané v terapii SLE a jejich schematická indikace 
Nežádoucí účinky CFA jsou častější než u azathioprinu, jedná se především o útlum krvetvorby, gastrointestinální potíže, většinou reverzibilní alopecii, poškození gonád, zvýšené riziko infekce, urotoxicitu (hemoragická cystitida, fibróza močového měchýře, karcinom močového měchýře), vznik sekundárních malignit. Zvláště opatrně musí být CFA podáván u nemocných s leukopenií, je pravidlem, že počet leukocytů by neměl klesnout pod 2x109 /l či počet neutrofilů pod 1 x109 /l. Pravidelné sledování hodnot krevního obrazu je nezbytné. Jako prevence poškození močového měchýře je nutno zajistit dostatečný příjem tekutin a lze též podávat 2-merkaptoetansulfonát (MESNA), který na sebe váže akrolein (metabolit CFA, který vyvolává akutní cystitidu). Je rovněž prokázáno, že CFA působí teratogenně, před zahájením léčby a během ní je nutno vyloučit případnou graviditu. Jako prevence předčasného ovariálního selhání se doporučuje podávání hormonálních kontraceptiv s nízkým obsahem estrogenů (59) či u bezdětných mladších žen zajištění odběru a uložení vajíček. U mužů může vést podávání CFA k ireverzibilním změnám spermiogramu (azoospermie), před zahájením podávání u mladších mužů se doporučuje provést odběr a zmrazení spermatu.
Cyklosporin A (CyA)
Lék, který byl primárně používaný v transplantologii, našel své uplatnění také v léčbě orgánových manifestací aktivního SLE. Brzdí aktivaci T pomahačských lymfocytů prostřednictvím snížené produkce IL-2. Je to látka s vysokým imunosupresivním účinkem. Nejvýraznější úspěch zaznamenává CyA v léčbě nefrotických syndromů u různých typů lupusové nefritid (zejména V. typu). Jeho použití u lupusové nefritidy III. a IV. typu není všeobecně přijímáno, v některých zemích byl však v této indikaci používán relativně často. Komparativní kontrolované a randomizovaná studie tuzemské provenience srovnávající efekt terapie cyklosporinem A a cyklofosfamidem na indukci a udržení remise prokázala obdobnou účinnost, počet zařazených pacientů byl ale poměrně malý (60). Byl rovněž účinný u některých nemocných refrakterních na běžnou imunosupresivní léčbu či jako alternativa podání cyklofosfamidu při jeho špatné toleranci zejména ze strany hemopoetického systému. Lze jej také použít v terapii trombocytopenie, hemolytické anémie a leukopenie či rezistentních serozitid. Cyklosporin A se podává v dávce 3–5 mg/kg/den.
Rovněž podávání CyA s sebou nese řadu nežádoucích účinků, na prvním místě je třeba jmenovat vznik hypertenze. Mimo hypertenze se při terapii CyA mohou objevit projevy nefro-, neuro - a hepatoxicity. Při podávání je třeba pravidelně sledovat hodnoty krevního tlaku, krevního obrazu, urey, kreatininu a urikémii (61).
Mykofenolát mofetil
Mykofenolát mofetil má v současnosti velmi pevnou pozici v terapii lupusu. V nových doporučeních American College of Rheumatology (62) i EULAR a European Renal Association (ERA-EDTA)(63) pro léčbu lupusové nefritidy je lékem doporučovaným pro indukční i udržovací léčbu proliferativních i membranózních forem lupusové nefritidy. Jeho podání se opírá o výsledky řady studií (64-67), které prokazují jeho ekvivalentní účinnost v indukční léčbě lupusové nefritidy v porovnání s cyklofosfamidem, přičemž pacienti léčeni mykofenolátem mají menší incidenci nežádoucích účinků (amenorhea, infekce, leukopenie) (67). V indukční léčbě se podává v dávce 2–3 g denně, v udržovací léčbě v dávce 1–2 g/denně. V udržovací léčbě choroby byl srovnáván především s azathioprinem, kdy účinnost dle výsledků byla buď srovnatelná (64, 68, 69) či lepší (70) a s lepší snášenlivostí (68).
Mezi nežádoucí účinky mykofenolátu se řadí průjem, riziko infekcí, možnost vzniku leukopenie, trombocytopenie či hypertenze. Podobně jako cyklofosfamid či methotrexát je kontraindikovaný v graviditě.
I.v. imunoglobuliny
Intravenózní podávání imunoglobulinů je indikováno u SLE výjimečně častokrát jako alternativní léčba při kontraindikaci jiné formy imunosuprese. Hlavní klinickou indikací, a to ve vybraných případech, je refrakterní trombocytopenie, hemolytická anémie či refrakterní lupusová glomerulonefritida. Zpravidla se podávají vysoké dávky 300–400 mg/kg/den po dobu 5 dnů (event. 1–2 g/kg 2 dny) s možností opakovaní za 3–4 týdny dle klinické odpovědi a dle závažnosti stavu nemocného. Kontraindikací podání imunoglobulinů je IgA deficience, kdy jejich podání vyvolá vysokou horečku, třesavky, bolesti břicha a na hrudi či ve svalech (71-73).
Vzácněji podávané léky
Dapson je oslabený androgen, který se v některých zemích používá v terapii trombocytopenie a léčbě diskoidní formy SLE (74). Dehydroepiandrosteron vedl k snížení aktivity SLE v některých klinických studiích a je v rámci léčby SLE zmiňován více než dvě desetiletí. U nás se léčba těmito preparáty prakticky nepoužívá. Jednoznačnější údaje o efektu těchto léků zatím chybí (75). Tacrolimus (FK 506) lokálně aplikovaný zlepšoval kožní chorobu u několika nemocných rezistentních na cyklofosfamid a cyklosporin (76). Existují také otevřené studie u lupusové nefritidy (77). Tyto léky jsou zmíněny pouze pro úplnost, jejich použití není Českou revmatologickou společností doporučováno.
Antikoagulační a antiagregační léčba
Antikoagulační a antiagregační léčba je základem terapie antifosfolipidového syndromu, který se často v souvislosti se SLE vyskytuje. Antifosfolipidový syndrom je charakterizován přítomností venózní nebo arteriální trombózy či specifické komplikace gravidity při současném laboratorním průkazu přítomnosti antifosfolipidových protilátek.
Podávání heparinu, dnes častěji nahrazovaného frakcionovanými formami LMWH (low molecular weight heparine), se standardně zahajuje při akutně vzniklé trombóze. Při podávání nefrakcionovaného heparinu je třeba kontrolovat aPTT. LMWH se dávkuje dle hmotnosti pacienta. Laboratorní kontroly účinnosti není ve většině případů třeba provádět, v případě pochybnosti o účinnosti léčby či při podezření na jeho předávkování se měří faktor anti-Xa. Současně s heparinem se zahajuje také podávání warfarinu, překrývání obou léků je zvykle 4–5 dní do doby, než se INR (International Normalized Ratio) dostává do terapeutického rozmezí (2,0 až 3,0) po dobu dvou následujících dní. LMWH hraje také zásadní roli v léčbě těhotných žen s APS, jelikož warfarin je u nich kontraindikován (78–84).
Po stabilizaci stavu pacienta s trombotickou epizodou u nemocného s APS je standardní terapií warfarin udržovaný v terapeutické hladině dle INR (2,0–3,0) (78–82).
Kyselina acetylsalicylová podávaná v nízkých dávkách (50–100 mg/denně) dle retrospektivních studií nemá dostatečný efekt u antifosfolipidového syndromu v prevenci trombotických manifestací u nemocných, kteří již tyto projevy měli. Některé studie (byť ne všechny) poukazují na redukci rizika trombotických manifestací u jedinců s pozitivními protilátkami a zatím bez klinické manifestace primárního APS. Její paušální použití v profylaxi se však nedoporučuje. Častěji je nasazován u nemocných se sekundárním antifosfolipidovým syndromem u SLE či jiných chorob (78–84).
Účinnost podávání hydroxychlorochinu u primárního antifosfolipidového syndromu není jistá. Data, která poukazují na jeho účinek, pocházejí ve velké většině z kohort lupusových pacientů (33). Hydroxychlorochin může mít protidestičkový efekt a snižuje hladinu homocysteinu, hyperlipidémii a titry antifosfolipidových protilátek. Snižuje rovněž i aktivitu SLE. Chybí však randomizovaná studie, která by skutečný efekt tohoto léku potvrdila.
Rituximab
Kombinace terapie chimérickou protilátkou anti CD20, cyklofosfamidu a glukokortikoidů přinesla slibné výsledky v nekontrolovaných, observačních studiích (85-89). Léčba byla efektivní také ve skupině 90 pacientů s refrakterní chorobou. Výsledky dvou velkých dvojitě slepých randomizovaných studií s rituximabem u lupusu bez nefritidy (EXPLORER)(90) a s lupusovou nefritidou (LUNAR)(91) však v primárních cílech neprokázaly oproti placebu očekávaný efekt. Subanalýzy svědčí pro větší efektivitu této léčby u afroamerické a afrokaribské populace a u velmi těžkých forem nemoci. V těchto studiích se podával rituximab ve dvou infuzích v dávce 1g po 14 dnech (91, 92). Neúspěch těchto studií se vysvětluje vysoce efektivní imunosupresní terapií v obou ramenech (glukokortikoidy, mykofenolát). Terapie rituximabem by měla zůstat zatím vyhrazena refrakterním formám lupusu zejména s lupusovou nefritidou, u kterých selhala terapie cyklofosfamidem a/nebo mykofenolátem. Mezi obávané účinky rituximabu patří alergické reakce, riziko infekcí a obávanou komplikací je reaktivace JC viru s fatální progresivní multifokální leukoencefalopatií (PML) (92, 93).
Belimumab
Belimumab je lidská monoklonální protilátka IgG1λ, která se váže na solubilní aktivační protein lidských B-lymfocytů (BLyS) a blokuje jeho biologickou aktivitu. Belimumab inhibuje přežití B-lymfocytů, včetně autoreaktivních B-lymfocytů a snižuje diferenciaci B-lymfocytů na plazmatické buňky produkující imunoglobuliny. Na základě studií BLISS-52 a BLISS-76 (94, 95) byl registrován FDA a EMA jako přídatná léčba u dospělých pacientů s aktivním SLE s vysokým stupněm aktivity onemocnění (nízká hladina komplementu a pozitivní protilátky ANA a/nebo protilátky proti dvouvláknové DNA (anti-dsDNA)) navzdory standardní léčbě. Údaje o účinnosti belimumabu u pacientů se závažnou aktivní lupusovou nefritidou nebo se závažným aktivním postižením CNS při lupusu nejsou k dispozici nebo jsou nedostatečné. Použití belimumabu se proto k léčbě těchto stavů nedoporučuje. Za zmínku stojí, že je to první registrovaný lék po 50 letech s výslovnou indikací lupusu (po aspirinu, glukokortikoidech a hydroxychlorochinu). Doporučené dávkovací schéma je 10 mg/kg belimumabu ve dnech 0, 14 a 28 a poté ve čtyřtýdenních intervalech (96–97).
Další perspektivy léčby SLE
V současné době probíhají klinické studie III. fáze u řady léků SLE (abatacept, epratuzumab, atacicept, ocrelizumab, tocilizumab, ofatumumab, inhibitory JAK-kináz), jenž zhodnotí jejich případný přínos pro léčbu choroby.
3. Nefarmakologická léčba
Plazmaferéza je u SLE stále diskutovanou metodou. Je schopna odstranit cirkulující imunokomplexy a protilátky z oběhu, které jsou pokládány za prostředníky tkáňového poškození. Jeví se užitečná v úzce specifikovaných a vybraných situacích (mikroangiopatické postižení ledvin, hemolyticko-uremický syndrom), často ve spojení s bezprostředně po plazmaferéze podanými pulzy cyklofosfamidu (98).
Do sféry experimentální léčby refrakterních forem nemoci bez možnosti další farmakologické intervence patří autologní transplantace hemopoetických buněk po imunoablativní chemoterapii cyklofosfamidem. Je to však metoda komplexní, velmi drahá a zatížená v případě SLE velkou mortalitou (99, 100).
Chirurgická splenektomie je alternativní léčbou závažných, na terapii nereagujících cytopenií. Přistupuje se k ní po selhání předcházející léčby, po výkonu existuje zvýšené riziko infekcí jak bezprostředně, tak v rámci tzv. OPSI (Overwhelming postsplenectomy infection) syndromu i s odstupem času. OPSI syndrom je život ohrožující komplikace projevující se nejprve katarálními příznaky, pocitem neklidu, bolestí hlavy, zvracením a febrilním stavem. Tyto jsou následovány hypotenzí, septickým šokem, diseminovanou intravaskulární koagulopatií až úmrtím. V prevenci se uplatňuje především aktivní imunizace pneumokokovou vakcinou či očkování proti meningokokovi.
Extrakorporální fotochemoterapie – při této metodě, která patří mezi experimentální, jsou krevní elementy vystaveny extrakorporálně účinku metoxypsoralenu a UV záření. Tento postup ovlivňuje zejména T buňky (CD8) a vede k poklesu klinické aktivity choroby (101).
Imunoadsorpce patří rovněž mezi extrakorporální metody. Je používaná u refrakterního SLE k odstranění cirkulujících imunokomplexů a protilátek. Pozitivně ovlivňuje aktivitu choroby. Jedná se rovněž o experimentální metodu (102).
4. Strategie léčby SLE
Strategie léčby SLE je velmi individuální. U pacienta v těžkém celkovém stavu s multiorgánovým selháváním jsou cíle i strategie léčby podřízeny snaze o přežití. U nemocných ve stabilním stavu je třeba ohodnotit aktivitu choroby, přítomnost orgánového postižení, kvalitu života, riziko toxicity zvažované či již nasazené léčby.
Indukční léčba představuje úvodní terapii choroby či její nové manifestace, která je zaměřena na rychlou kontrolu imunologické aktivity choroby, restituci a zlepšení funkce, zastavení procesu tkáňového poškození a indukci remise. Indukční fáze léčby využívá agresivnější dávkování používaných léčiv a je zpravidla také spojena s vyšším rizikem vzniku nežádoucích účinků léčby.
Udržovací léčba je delší období méně intenzivní a toxické léčby, která s sebou nese nižší riziko komplikací a lepší toleranci. Jejím účelem je konsolidace remise a prevence exacerbace (flare) aktivity SLE.
Při volbě terapie hraje klíčovou roli přítomnost či nepřítomnost orgánového postižení a stupeň jeho závažnosti. Všeobecnou indikaci imunosupresivní terapie (antimetabolity, alkylační látky, mykofenolát mofetil, případně cyklosporin A) představuje závažné orgánové postižení nebo extenzivní postižení kůže či kloubů, refrakterní na léčbu, a selhání odpovědi či nemožnost adekvátního snížení glukokortikoidů k akceptovatelné dávce. Specifickou indikací k nasazení imunosupresivní terapie pak představují stavy shrnuté v tabulce 1 dle Papadimitraki et al. (103). Tabulka 2 sumarizuje rozhodovací proces (102, 104) při léčbě nemocných se SLE dle závažnosti stavu. Mezi základní léčiva patří hydroxychlorochin a glukokortikoidy, které mají své místo v jak léčbě kožně kloubních forem nemoci, tak forem lupusu s různým stupněm orgánového postižení (mírné, středně či vysoce závažné).
Tab. 1. Specifické indikace pro imunosupresivní léčbu nemocných s SLE, upraveno dle Papadimitraki ED et al. (103). 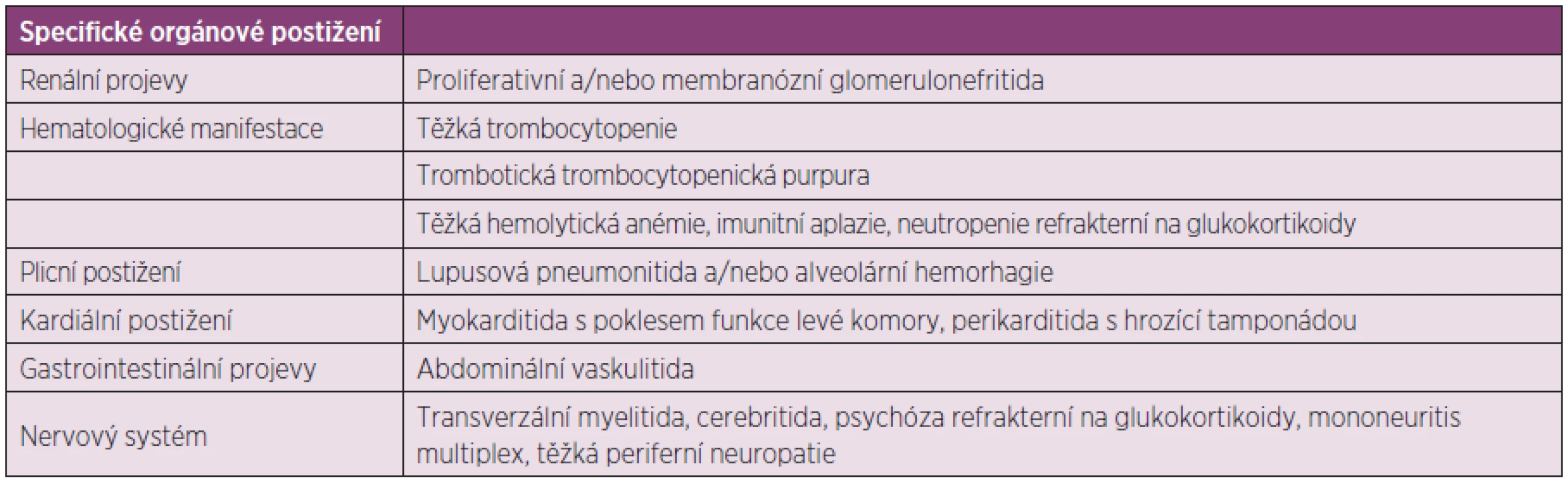
Tab. 2. Doporučená léčba SLE dle závažnosti stavu. 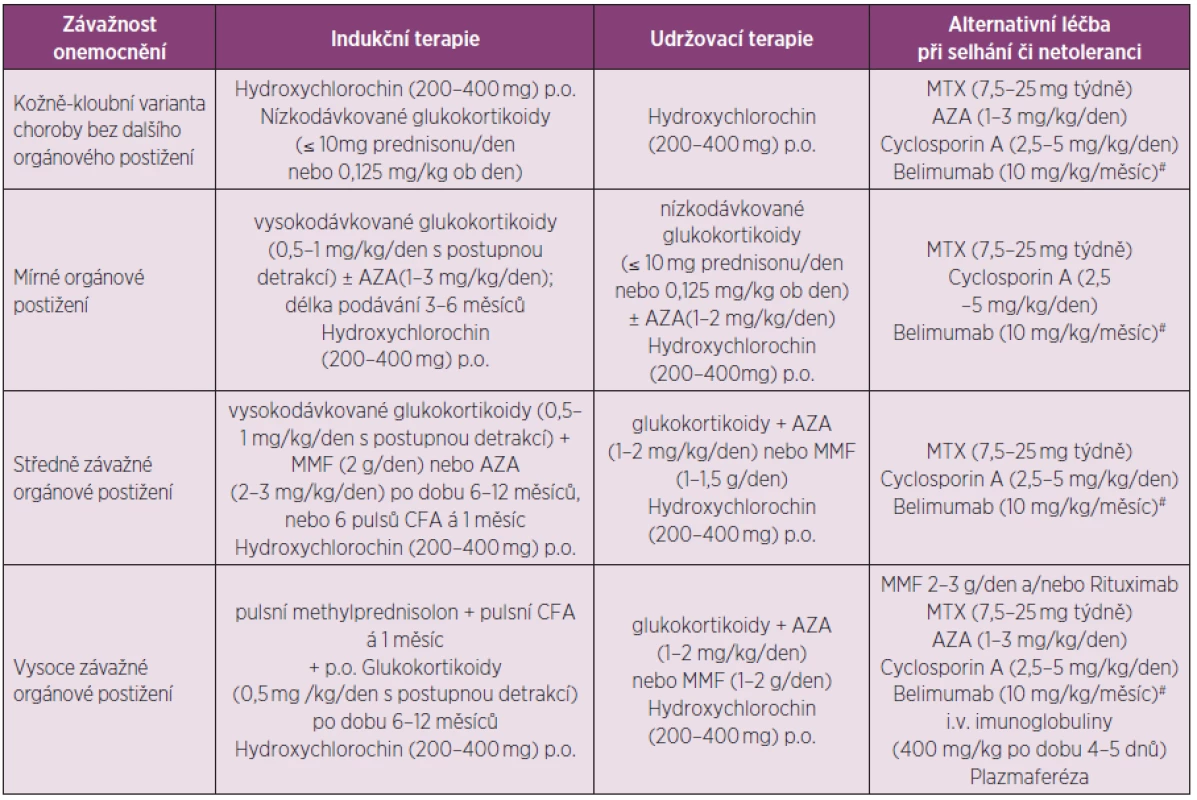
AZA – azathioprin, MMF – mykofenolát mofetil, CFA – cyklofosfamid, MTX – methotrexát #Doporučené dávkovací schéma belimumabu je 10 mg/kg ve dnech 0, 14 a 28 a poté ve 4týdenních intervalech Z imunosupresiv je třeba zmínit cyklofosfamid, azathioprin a mykofenolát mofetil, které dnes představují nejvýznamnější imunosupresiva používaná v indukční léčbě závažných orgánových manifestací SLE. Azathioprin a mykofenolát mofetil jsou pak doporučovány také v rámci udržovacích léčebných režimů. Za alternativu při selhání či netoleranci těchto léčiv lze považovat cyklosporin A či methotrexát, nově pak také léčbu belimumabem. U vysoce závažných forem SLE lze také zvážit podání rituximabu, i.v. polyklonálních imunoglobulinů či plazmaferézu.
5. Kritéria pro použití belimumabu v léčbě SLE
Při definici místa nově registrovaného belimumabu v léčbě SLE je třeba vyjít z klinických údajů, které jsou k dispozici (94, 95). Vycházejíc z registrace léčiva jak FDA, tak EMA v roce 2011 (97) je léčba belimumabem dle doporučení ČRS indikovaná u nemocných se SLE při splnění všech následujících podmínek:
Ukončení léčby belimumabem a definice non-respondéra 
Pokud po 6 měsících léčby belimumabem nedojde ke klinickému či laboratornímu zlepšení kontroly onemocnění (snížení SELENA-SLEDAI skóre o 4 body nebo dochází k nárůstu skóre), je třeba zvážit ukončení léčby.
Vylučovací kritéria nasazení belimumabu představuje přítomnost:
- dominujícího závažného aktivního postižení CNS při lupusu
- závažné aktivní lupusové nefritidy (nově diagnostikovaná lupusová nefritida III., IV. a V. typu vyžadující standardní léčbu dle protokolu, nebo proteinurie
- > 6 g/24 h nebo hladina sérového kreatininu > 220 µmol/l)
- HIV
- anamnézy či aktivní onemocnění hepatitidou B nebo C
- hypogamaglobulinémie (IgG < 400 mg/dl) nebo deficience IgA (IgA < 10 mg/dl)
- anamnézy orgánové transplantace, nebo transplantace hematopoetických kmenových buněk/kostní dřeně
- léčené chronické či akutní infekce
Závěr
Při sestavení doporučení České revmatologické společnosti pro léčbu SLE vycházeli autoři z řady zdrojů. Základní osnovu představovala jednak doporučení Evropské ligy proti revmatismu (EULAR) shrnující v roce 2008 poznatky založené na důkazech o racionální diagnostice, monitoraci a léčbě SLE (1), jednak nová doporučení ACR i EULAR pro léčbu lupusové nefritidy publikovaná v letošním roce (62, 63). Je nesporné, že prognóza nemocných se systémovým lupusem se mění ruku v ruce s pokroky v jeho léčbě. V období před zavedením glukokortikoidů se pětileté přežívání od stanovení diagnózy pohybovalo kolem 50 %. Po zavedení glukokortikoidní léčby se pětileté přežívání zvýšilo na 75 %. Použití imunosupresivní terapie zvyšuje dále pětileté přežívání na 90 % (45). Současně se však zvyšuje potřeba prevence a léčby závažných pozdních komplikací choroby jako je osteoporóza, akcelerovaná ateroskleróza, zvýšené riziko nádorových onemocnění či infekce. Přes nesporné úspěchy imunosupresivní terapie stále u řady nemocných selhává a navíc je spojena s řadou nežádoucích účinků. Řada léků je stále používaná de facto „off label“, což je například i případ mykofenolátu či rituximabu. Jejich použití je v současnosti třeba dle platné legislativy dojednat s plátci. Úkolem nových doporučení ČRS pro léčbu SLE je jednak vytvoření odborné podpory pro použití řady léku při terapii lupusu, jednak stanovení podmínek pro použití biologické léčby choroby.
Podpořeno grantem IGA Ministerstva zdravotnictví ČR č. NT/13707-4 a projektem MZ ČR koncepčního rozvoje výzkumné organizace č. 000 000 23728.
Adresa pro korespondenci:
Prof. MUDr. Pavel Horák, CSc.
III. interní klinika FN a LF UP
I. P. Pavlova 6
772 00 Olomouc
e-mail: horakp@fnol.cz
Zdroje
1. Bertsias G, Ioannidis JPA, Boletis J et al. EULAR recommendations for the management of systemic lupus erythematosus. Report of a Task Force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics. Ann Rheum Dis 2008;67 : 195-205.
2. Illei GG, Tackey E, Lapteva L, Lipsky PE. Biomarkers in systemic lupus erythematosus. I. General overview of biomarkers and their applicability. Arthritis Rheum 2004;50 : 1709-20.
3. Bencivelli W, Vitali C, Isenberg DA, et al. Disease activity in systemic lupus erythematosus: report of the Consensus Study Group of the European Workshop for Rheumatology Research. III. Development of a computerised clinical chart and its application to the comparison of different indices of disease activity. The European Consensus Study Group for Disease Activity in SLE. Clin Exp Rheumatol 1992;10 : 549-54.
4. Gladman DD, Ibañez D, Urowitz MB. Systemic lupus erythematosus disease activity index 2000. J Rheumatol 2002;29 : 288-91.
5. Bombardier C, Gladman DD, Urowitz MB, et al. Derivation of the SLEDAI. A disease activity index for lupus patients. The Committee on Prognosis Studies in SLE. Arthritis Rheum 1992;35 : 630-40.
6. Hay EM, Bacon PA, Gordon C, et al. The BILAG index: a reliable and valid instrument for measuring clinical disease activity in systemic lupus erythematosus. Quart J Medicine 1993;86 : 447-458.
7. Jolly M. Pitfalls and opportunities in measuring patient outcomes in lupus. Curr Rheumatol Rep 2010;12 : 229-236.
8. Gladman DD, Goldsmith CH, Urowitz MB, et al. The Systemic Lupus International Collaborating Clinics/American College of Rheumatology (SLICC/ACR) Damage Index for Systemic Lupus Erythematosus International Comparison. J Rheumatol 2000;27 : 373-276.
9. Gold DG, Miller RC, Pinn ME, et al. Chronic toxicity risk after radiotherapy for patients with systemic sclerosis (systemic scleroderma) or systemic lupus erythematosus: association with connective tissue disorder severity. Radiother Oncol 2008;87 : 127-31.
10. Duffy EM, Meenagh GK, McMillan SA, et al. The clinical effect of dietary supplementation with omega-3 fish oils and/or copper in systemic lupus erythematosus. J Rheumatol 2004;31 : 1551-56.
11. Wright SA, O'Prey FM, McHenry MT, et al. A randomised interventional trial of omega-3-polyunsaturated fatty acids on endothelial function and disease activity in systemic lupus erythematosus. Ann Rheum Dis 2008;67 : 841-48.
12. Ettinger WH, Goldberg AP, Applebaum-Bowden D, Hazzard WR. Dyslipoproteinemia in systemic lupus erythematosus. Effect of corticosteroids. Am J Med 1987;83 : 503-508.
13. Petri M, Lakatta C, Magder L, Goldman D. Effect of prednisone and hydroxychloroquine on coronary artery disease risk factors in systemic lupus erythematosus: a longitudinal data analysis. Am J Med 1994;96 : 254-9.
14. Hearth-Holmes M, Baethge BA, Broadwell L, Wolf RE. Dietary treatment of hyperlipidemia in patients with systemic lupus erythematosus. J Rheumatol 1995;22 : 450-4.
15. Toloza SM, Cole DE, Gladman DD, et al. Vitamin D insufficiency in a large female SLE cohort. Lupus 2010;19 : 13-19.
16. Robb-Nicholson LC, Daltroy L, Eaton H, et al. Effects of aerobic conditioning in lupus fatigue: a pilot study. Br J Rheumatol 1989;28 : 500-5.
17. Tench CM, McCarthy J, McCurdie I, et al. Fatigue in systemic lupus erythematosus: a randomized controlled trial of exercise. Rheumatology (Oxford) 2003;42 : 1050-1054.
18. Formica MK, Palmer JR, Rosenberg L, McAlindon TE. Smoking, alcohol consumption, and risk of systemic lupus erythematosus in the Black Women's Health Study. J Rheumatol 2003; 30 : 1222-6.
19. Ghaussy NO, Sibbitt W Jr, Bankhurst AD, Qualls CR. Cigarette smoking and disease activity in systemic lupus erythematosus. J Rheumatol 2003;30 : 1215-21.
20. O'Neill SG, Isenberg DA. Immunizing patients with systemic lupus erythematosus: a review of effectiveness and safety. Lupus 2006;15 : 778-783.
21. Battafarano DF, Battafarano NJ, Larsen L, et al. Antigen-specific antibody responses in lupus patients following immunization. Arthritis Rheum 1998;41 : 1828-34.
22. Van Assen S, Agmon-Levin N, Elkayam O, et al. Eular recommendations for vaccination in adult patients with autoimmune inflammatory rheumatic diseases. Ann Rheum Dis 2011;70 : 414-422.
23. Wallace DJ. Improving the prognosis of SLE without prescribing lupus drugs and the primary care paradox. Lupus 2008;17 : 91-92.
24. Shur P.H. Overview of the therapy and prognosis of systemic lupus erythematosus in adults. UpToDate 2011; This topic last updated: Oct 9, 2012.
25. Buyon JP, Petri MA, Kim MY, et al. The effect of combined estrogen and progesterone hormone replacement therapy on disease activity in systemic lupus erythematosus: a randomized trial. Ann Intern Med 2005;142 : 953-62.
26. Clowse ME, Magder L, Witter F, Petri M. Hydroxychloroquine in lupus pregnancy. Arthritis Rheum 2006;54 : 3640-47.
27. Østensen M, Khamashta M, Lockshin M, et al. Anti-inflammatory and immunosuppressive drugs and reproduction. Arthritis Res Ther 2006;8 : 209-227.
28. Petri M. Immunosuppressive drug use in pregnancy. Autoimmunity 2003;36 : 51-6.
29. Lander SA, Wallace DJ, Weisman MH. Celecoxib for systemic lupus erythematosus: case series and literature review of the use of NSAIDs in SLE. Lupus 2002;11 : 340-347.
30. Østensen M., Villiger PM. Nonsteroidal anti-inflammatory drugs in systemic lupus erythematosus. Lupus March 2001;10 : 135-139.
31. Fessler BJ, Alarcón GS, McGwin G Jr, et al. Systemic lupus erythematosus in three ethnic groups: XVI. Association of hydroxychloroquine use with reduced risk of damage accrual. Arthritis Rheum 2005;52 : 1473-1480.
32. The Canadian Hydroxychloroquine Study Group. A randomized study of the effect of withdrawing hydroxychloroquine sulfate in systemic lupus erythematosus. N Engl J Med 1991;324 : 150-154.
33. Shinjo, SK, Bonfa E, Wojdyla D et al. Antimalarial treatment may have a time-dependent effect on lupus survival. Data from a multinational Latin American inception cohort. Arthritis Rheum 2010;62 : 855-862.
34. Ruiz-Irastorza G, Ramos-Casals M, Brito-Zeron P, Khamashta MA. Clinical efficacy and side effects of antimalarials in systemic lupus erythematosus: a systematic review. Ann Rheum Dis 2010;69 : 20-8.
35. Bootsma H, Spronk P, Derksen R, et al. Prevention of relapses in systemic lupus erythematosus. Lancet 1995;345 : 1595-9.
36. Marmor MF, Kellner U, Lai TY, et al. Revised recommendations on screening for chloroquine and hydroxychloroquine retinopathy. Ophthalmology 2011;118 : 415-422.
37. Klippe JH, Dieppe PA. Rheumatology. Mosby-Year Book Eurolimited 1994;8.284.
38. Bootsma H, Spronk P, Derksen R, et al. Prevention of relapses in systemic lupus erythematosus. Lancet 1995;345 : 1595-9.
39. Denburg SD, Carbotte RM, Denburg JA. Corticosteroids and neuropsychological functioning in patients with systemic lupus erythematosus. Arthritis Rheum1994;37 : 1311-20.
40. Austin HA 3rd, Klippel JH, Balow JE, et al. Therapy of lupus nephritis. Controlled trial of prednisone and cytotoxic drugs.N Engl J Med 1986;314 : 614-9.
41. Illei GG, Austin HA, Crane M, et al. Combination therapy with pulse cyclophosphamide plus pulse methylprednisolone improves longterm renal outcome without adding toxicity in patients with lupus nephritis. Ann Intern Med 2001;135 : 248-57.
42. Boumpas DT, Austin HA 3rd, Vaughn EM, et al. Controlled trial of pulse methylprednisolone versus two regimens of pulse cyclophosphamide in severe lupus nephritis. Lancet 1992;340(8822):741-5.
43. Sambrook P, Birmingham J, Kelly P, et al. Prevention of corticosteroid osteoporosis. A comparison of calcium, calcitriol, and calcitonin. N Engl J Med 1993;328 : 1747-52.
44. Adachi JD, Bensen WG, Bianchi F, et al. Vitamin D and calcium in the prevention of corticosteroid induced osteoporosis: a 3 year followup. J Rheumatol 1996;23 : 995-1000.
45. Urowitz MB, Gladman DD, Tom BD et al. Changing patterns in mortality and disease outcomes for patients with systemic lupus erythematosus. J Rheumatol 2008 Nov;35(11):2152-8.
46. Urowitz MB, Gladman DD, Ibañez D, et al. Evolution of disease burden over five years in a multicenter inception systemic lupus erythematosus cohort. Arthritis Care Res (Hoboken) 2012;64 : 132-7.
47. Ginzler E, Sharon E, Diamond H, Kaplan D. Long-term maintenance therapy with azathioprine in systemic lupus erythematosus. Arthritis Rheum 1975;18 : 27-34.
48. Nossent HC, Koldingsnes W. Long-term efficacy of azathioprine treatment for proliferative lupus nephritis. Rheumatology 2000;39 : 969-974.
49. Flanc RS, Roberts MA, Strippoli GF, Chadban SJ, Kerr PG, Atkins RC. Treatment of diffuse proliferative lupus nephritis: a meta-analysis of randomized controlled trials. Am J Kidney Dis 2004;43 : 197-208.
50. Austin HA 3rd, Klippel JH, Balow JE, le Riche NG, et al. Therapy of lupus nephritis. Controlled trial of prednisone and cytotoxic drugs.N Engl J Med 1986;314 : 614-9.
51. Evans WE, Hon YY, Bomgaars L, et al. Preponderance of thiopurine S-methyltransferase deficiency and heterozygosity among patients intolerant to mercaptopurine or azathioprine. J Clin Oncol 2001;19 : 2293-301.
52. Ford L, Prout C, Gaffney D, Berg J. Whose TPMT activity is it anyway? Ann Clin Biochem 2004;41 : 498-500.
53. Fortin PR, Abrahamowicz M, Ferland D, et al. Steroid-sparing effects of methotrexate in systemic lupus erythematosus: a double-blind, randomized, placebo-controlled trial. Arthritis Rheum 2008; 59 : 1796-1806.
54. Carneiro JR, Sato EI. Double blind, randomized, placebo controlled clinical trial of methotrexate in systemic lupus erythematosus. J Rheumatol 1999;26 : 1275-9.
55. Boumpas D, Barez S, Klippel J, et al. Intermittent cyclophosphamide for the treatment of autoimmune thrompocytopenia in systemic lupus erythematosus. Ann Int Med 1990;112 : 674-677.
56. Gourley MF, Austin HA 3rd, Scott D, Yarboro CH, Vaughan EM, Muir J, et al. Methylprednisolone and cyclophosphamide, alone or in combination, in patients with lupus nephritis. A randomized, controlled trial. Ann Intern Med 1996;125 : 549-57.
57. Ntali S, Bertsias G, Boumpas DT. Cyclophosphamide and lupus nephritis: when, how, for how long? Clin Rev Allergy Immunol 2011; 4 : 181-91.
58. Houssiau FA, Vasconcelos C, D’Cruz D, et al. Early response to immunosuppressive therapy predicts good renal outcome in lupus nephritis: lessons from long-term follow up of patients in the Euro-Lupus Nephritis Trial. Arthritis Rheum 2004;50 : 3934-40.
59. Somers EC, Marder W, Christman GM, Ognenovski V, McCune WJ. Use of agonadotropin-releasing hormone analogue for protection against premature ovarianfailure during cyclophosphamide therapy in women with severe lupus. Arthritis Rheum 2005;52 : 2761-7.
60. Závada L, Pešičková S, Ryšavá R, et al. Cyclosporine A or intravenous cyclophosphamide for lupus nephritis: the Cyclofa-Lune study. Lupus 2010;19 : 1281-1289.
61. Tam LS, Li EK, Leung CB et al. Long-term treatment of lupus nephritis with cyclosporine A. QJM 1998;91 : 573-578.
62. Hahn B, McMahon MA, Wilkinson A, et al. American College of Rheumatology Guidelines for Screening, Treatment, and Management of Lupus Nephritis. Arthritis Care & Research 2012;64 : 797-808.
63. Bertsias GK, Tektonidou M, Amoura Z, et al. Joint European League Against Rheumatism and European Renal Association-European Dialysis and Transplant Association (EULAR/ERA-EDTA) recommendations for the management of adult and paediatric lupus nephritis. Ann Rheum Dis 2012;71 : 1771-1782.
64. Chan TM, Tse KC, Tang CS, Mok MY, Li FK. Long-term study of mycophenolate mofetil as continuous induction and maintenance treatment for diffuse proliferative lupus nephritis. J Am Soc Nephrol 2005;16 : 1076-84.
65. Ginzler EM, Dooley MA, Aranow C, et al. Mycophenolate mofetil or intravenous cyclophosphamide for lupus nephritis. N Engl J Med 2005;353 : 2219-28.
66. Appel GB, Contreras G,Dooley MA, Ginzler EM. Mycophenolate mofetil versus cyclophosphamide for induction treatment of lupus nephritis. J Am Soc Nephrol 2009;20 : 1103-12.
67. Touma Z, Gladman DD, Urowitz MB, Beyene J, Uleryk EM, Shah PS. Mycophenolate mofetil for induction treatment of lupus nephritis: a systematic review and metaanalysis. J Rheumatol 2011;38 : 69-78.
68. Contreras G, Pardo V, Leclercq B, et al. Sequential therapies for proliferative lupus nephritis. N Engl J Med 2004; 350 : 971-80.
69. Houssiau FA, D’Cruz D, Sangle S, et al. Azathioprine versus mycophenolate mofetil for long-term immunosuppression in lupus nephritis: results from the MAINTAIN Nephritis Trial. Ann Rheum Dis 2010;69 : 2083-9.
70. Dooley MA, Jayne D, Ginzler EM, et al, for the ALMS Group. Mycophenolate versus azathioprine as maintenance therapy for lupus nephritis. N Eng J Med 2011;365 : 1886-95.
71. Boletis JN, Ionnidis JP, Boki KA et al. Intravenous immunoglobulin compared with cyclophosphamide for proliferative lupus nephritis. Lancet 1999;354 : 569-570.
72. Orbach H, Katz U, Sherer Y, Shoenfeld Y. Intravenous immunoglobulin: adverse effects and safe administration. Clin Rev Allergy Immunol 2005;29 : 173-84.
73. Sherer Y, Kuechler S, Scali JJ, et al. Low Dose Intravenous Immunoglobulin in Systemic Lupus Erythematosus: Analysis of 62 Cases. Mosaic of Autoimmunity 2008;10 : 55-58.
74. Aranow C, Ginzler EM. Treatment of constitutional symptoms, skin, joint, serositis, cardiopulmonary, hematologic and central nervous system manifestations. In: Hochberg MC, Silman AJ, Smolen JS et al. Rheumatology, Mosby 2003 : 1395-1404.
75. Vollenhoven R., Engleman E., McGuire J. An open study of dehydroepiandrosterone in systemic lupus erythematosus. Arthr Rheum 1994;37 : 1305-1310.
76. Lampropoulos CE, Sangle S, Harrison P et al. Topical tacrolimus therapy of resistant cutaneous lesions in lupus erythematosus: a possible alternative. Rheumatology 2004; 43 : 1383-1385.
77. Mok CC, Tong KH, To CH, Siu YP, Au TC. Tacrolimus for induction therapy of diffuse proliferative lupus nephritis: an open-labeled pilot study. Kidney Int;2005;68 : 813-7.
78. Khamashta MA, Cuadrado MJ, Mujic F, Taub NA, Hunt BJ, Hughes GR. The management of thrombosis in the antiphospholipid-antibody syndrome. N Engl J Med 1995;332 : 993-7.
79. Munoz-Rodriguez FJ, Font J, Cervera R, et al. Clinical study and follow-up of 100 patients with the antiphospholipid syndrome. Semin Arthritis Rheum 1999;29 : 182-90.
80. Ruiz-Irastorza G, Khamashta MA, Hunt BJ, Escudero A, Cuadrado MJ, Hughes GR. Bleeding and recurrent thrombosis in definite antiphospholipid syndrome: analysis of a series of 66 patients treated with oral anticoagulation to a a target international normalized ratio of 3.5. Arch Intern Med 2002; 162 : 1164-9.
81. Crowther MA, Ginsberg JS, Julian J, et al. A comparison of two intensities of warfarin for the prevention of recurrent thrombosis in patients with the antiphospholipid antibody syndrome. N Engl J Med 2003;349 : 1133-8.
82. Finazzi G, Marchioli R, Brancaccio V, et al. A randomized clinical trial of high-intensity warfarin vs. conventional antithrombotic therapy for the prevention of recurrent thrombosis in patients with the antiphospholipid syndrome (WAPS). J Thromb Haemost 2005;3 : 848-53.
83. Rivier G, Herranz MT, Khamashta MA, Hughes GR. Thrombosis and antiphospholipid syndrome: a preliminary assessment of three antithrombotic treatments. Lupus 1994;3 : 85-90.
84. Rosove MH, Brewer PM. Antiphospholipid thrombosis: clinical course after the first thrombotic event in 70 patients. Ann Intern Med 1992;117 : 303-8.
85. Jónsdóttir T, Gunnarsson I, Risselada A, et al. Treatment of refractory SLE with rituximab plus cyclophosphamide: clinical effects, serological changes, and predictors of response. Ann Rheum Dis 2008;67 : 330-334.
86. Looney RJ, Anolik JH, Campbell D, et al. B cell depletion as a novel treatment for systemic lupus erythematosus: a phase I/II dose-escalation trial of rituximab. Arthritis Rheum 2004;50 : 2580-2589.
87. Gottenberg JE, Guillevin L, Lambotte O, et al. Tolerance and short term efficacy of rituximab in 43 patients with systemic autoimmune diseases. Ann Rheum Dis 2005;64 : 913-920.
88. Smith KG, Jones RB, Burns SM, Jayne DR. Long-term comparison of rituximab treatment for refractory systemic lupus erythematosus and vasculitis: Remission, relapse, and re-treatment. Arthritis Rheum 2006;54 : 2970-82.
89. Terrier B, Amoura Z, Ravaud P, et al. Safety and efficacy of rituximab in systemic lupus erythematosus: results from 136 patients from the French AutoImmunity and Rituximab registry. Arthritis Rheum 2010;62 : 2458-66.
90. Merrill JT, Neuwelt CM, Wallace DJ, et al. Efficacy and safety of rituximab in moderately-to-severely active systemic lupus erythematosus: the randomized, double-blind, phase II/III systemic lupus erythematosus evaluation of rituximab trial. Arthritis Rheum 2010;62 : 222-233.
91. Furie R, Looney RJ, Rovin B, et al. Efficacy and safety of rituximab in subjects with active proliferative lupus nephritis (LN): results from the randomized, double-blind phase III LUNAR study [abstract]. Arthritis Rheum ROK;60(Suppl.10):1149.
92. FDA alert (12/18/2006). Rituximab (marketed as Rituxan) Information. www.fda.gov/cder/drug/InfoSheets/HCP/rituximab.pdf (Accessed Dec 21, 2006).
93. Carson KR, Evens AM, Richey EA, et al. Progressive multifocal leukoencephalopathy after rituximab therapy in HIV-negative patients: a report of 57 cases from the Research on Adverse Drug Events and Reports project. Blood 2009;113 : 4834-4840.
94. Navarra SV, Guzmán RM, Gallacher AE, et al. Efficacy and safety of belimumab in patients with active systemic lupus erythematosus: a randomised, placebo-controlled, phase 3 trial. Lancet 2011;377 : 721-731.
95. Furie R, Petri M I, Zamani O II, et al. A phase III, randomized,placebo-controlled study of belimumab, a monoclonal antibody that inhibits B lymphocyte stimulator, in patients with systemic lupus erythematosus. Arthritis Rheum 2011; 63 : 3918-30.
96. van Vollenhoven RF, Petri MA, Cervera R, et al. Belimumab in the treatment of systemic lupus erythematosus: high disease activity predictors of response. Ann Rheum Dis 2012; 71(8):1343-9.
97. FDA briefing information, belimumab (BENLYSTA), for the November 16, 2010 meeting of the Arthritis Advisory Committee www.fda.gov/AdvisoryCommittees Drugs/ArthritisDrugsAdvisoryCommittee/ucm233578.htm (Accessed on March 16, 2011)
98. Musio F, Bohen EM, Yuan CM , Welch PG. Review of thrombotic thrombocytopenic purpura in the setting of systemic lupus erythematosus. Seminars in Arthritis and Rheumatism 1998; 28 : 1-19.
99. Burt RK, Traynor A, Statkute L, et al. Nonmyeloablative hematopoietic stem cell transplantation for systemic lupus erythematosus. JAMA 2006;295 : 527-535.
100. Tyndall A. Cellular therapy of systemic lupus erythematosus. Lupus 2009;18 : 387-393.
101. Smolen JS. Therapy of systemic lupus erythematosus: a look into the future. Arhtritis Res 2002;4(Suppl 3):S25-S30.
102. Majdan M. Recommendation for diagnosis and treatment. Systemic lupus erythematosus. Rheumatológia 2012;50 : 103-110.
103. Papadimitraki ED, Bertsias G, Chamils G, Boumpas DT. Systemic lupus erythematosus: Cytotoxic agents. In: Lahita RG (Ed). Systemic lupus erythematosus. 5th Edition, Elsevier, 2011, 1083-1108.
104. Hahn BH. Kelley´s textbook of rheumatology. Harris ED, 7th Edition 2005
105. Tan EM, Cohen AS, Fries JF et al. The 1982 revised criteria for the classification of systemic lupus erythematosus. Arthritis Rheum 1982;25 : 1271-1277.
106. Petri M, Orbai AM, Alarcon GS, et al. Derivation and validation of the Systemic Lupus International Collaborating Clinics classification criteria for systemic lupus erythematosus. Arthritis Rheum 2012;64 : 2677-86.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2013 Číslo 3- Kterým pacientům se SLE nasadit biologickou léčbu?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Prof. MUDr. Jiří Vencovský, DrSc., slaví 60 let
- Zemřel prof. MUDr. Ctibor Dostál, DrSc.
- Doporučení ČRS pro léčbu nemocných se SLE
- Zdravím podmíněná kvalita života u pacientů s revmatoidní artritidou v průběhu prvního roku anti-TNF léčby (hodnocení dotazníkem SF-36 a srovnání se vzorkem všeobecné populace České republiky) – výsledky z registru biologické léčby ATTRA
- Jaké jsou prediktivní faktory odpovědi na léčbu tocilizumabem v běžné klinické praxi? Zkušenosti z Českého národního registru ATTRA
- Mykofenolát mofetil v léčbě systémového lupus erythematodes
- Abstrakta přednášek z X. slapského sympozia o problémech revmatologie, rehabilitace a revmatochirurgie
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Doporučení ČRS pro léčbu nemocných se SLE
- Prof. MUDr. Jiří Vencovský, DrSc., slaví 60 let
- Zemřel prof. MUDr. Ctibor Dostál, DrSc.
- Mykofenolát mofetil v léčbě systémového lupus erythematodes
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



