-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Jaké jsou prediktivní faktory odpovědi na léčbu tocilizumabem v běžné klinické praxi? Zkušenosti z Českého národního registru ATTRA
What are the predictive factors of response to treatment with tocilizumab in routine clinical practice? The experience of the Czech national registry ATTRA
Tocilizumab is a monoclonal antibody against IL-6R, which is registered for the treatment of moderately - and highly active rheumatoid arthritis in the first and second line of biological treatment. Tocilizumab has been registered on the basis of a series of randomized phase III clinical trials. Other valuable data have been obtained from registries of biological treatment. In the present paper the issue of predictive factors of efficacy of tocilizumab is discussed as well.
Methods:
An observational study of the effectiveness of tocilizumab (TCZ) in routine clinical practice has been performed. Patients enrolled in the study met the criteria of the Czech Society for Rheumatology for the application of biological treatment and were filed into the national registry ATTRA. The study monitored the following parameters: demographic characteristics of a patient, previous and current treatment, the presence of RF and anti-CCP antibodies (ACPA), DAS 28, serum C-reactive protein (CRP), erythrocyte sedimentation rate (ESR), therapeutic response according to EULAR, achieving low disease activity (LDA) after 6 and 12 months (DAS 28 < 3.2) and achieving remission (DAS 28 < 2.6). Pre-treatment predictors of achievement of low disease activity at 6 and 12 months were evaluated.Statistical analysis:
Univariate logistic regression evaluating the effect of all factors to achieve LDA was performed as the first step. The main factors were assessed by ROC analysis to identify the threshold value that divides the factor preferably in the sense of prediction of achieving LDA.Results:
A total of 151 patients, whose test results were evaluated for safety, were enrolled into the registry. Data of 113 patients, who were newly started on TCZ at baseline, were used to assess the treatment efficacy. In the remaining 38 patients the efficacy was not evaluated because these were patients who continued therapy in the registry after the termination of clinical trials. Patients with advanced disease with a mean duration of 11 years and high disease activity (DAS 28 5.9, mean CRP 24.1 mg / l) were included in the analysis. The entire six-month monitoring was completed by 88% of patients treated concomitantly with disease-modifying antirheumatic drugs (DMARDs) and 85% of patients on monotherapy with TCZ. Therapeutic response according to EULAR at 6 months was reached by 88–89% of patients. After 12 months of treatment low disease activity was achieved by 67% of patients and 48% of patients were in remission. There were no differences found between the group treated with monotherapy or the group treated with combination of TCZ + DMARDs in achievement of LDA and remission. The only significant predictive indicator of achievement of low disease activity (LDA) after 12 months of treatment was the number of swollen joints. The incidence of adverse events was comparable between patients treated with monotherapy and combination of TCZ + DMARDs.Conclusion:
The results of our study show good efficacy of TCZ in patients with rheumatoid arthritis in routine clinical practice. No significant difference was found between patients treated with monotherapy or with combination of TCZ+DMARDs in the efficacy or safety. The only predictive indicator of response to treatment with TCZ was the number of swollen joints.Key words:
Rheumatoid arthritis, biological therapy, prediction of therapeutic response, tocilizumab
Autoři: K. Pavelka; K. Hejduk
; H. Mann
Působiště autorů: Revmatologický ústav a Klinika revmatologie 1. LF UK
Vyšlo v časopise: Čes. Revmatol., 21, 2013, No. 3, p. 132-139.
Kategorie: Původní práce
Souhrn
Tocilizumab je monoklonální protilátka proti IL-6R, která je registrována pro léčbu středně a vysoce aktivní revmatoidní artritidy v prvé i druhé linii biologické léčby. Tocilizumab byl registrován na základě řady randomizovaných studií fáze III klinického zkoušení. Další cenná data se získávají z registrů biologické léčby. Jeden z faktorů, který je diskutovaný, je také otázka prediktivních faktorů účinnosti tocilizumabu.
Metodologie:
Byla provedena observační studie účinnosti tocilizumabu (TCZ) v běžné klinické praxi. Pacienti zařazení do studie splňovali kritéria České revmatologické společnosti pro aplikaci biologické léčby a byli zavedeni do národního registru ATTRA. Ve studii byly sledovány následující ukazatele: demografická charakteristika pacienta, předcházející a současná léčba, přítomnost RF a anti-CCP protilátek (ACPA), DAS 28, sérová hladina C-reaktivního proteinu (CRP), sedimentace erytrocytů (FW), terapeutická odpověď dle EULAR, dosažení nízké aktivity choroby (low disease activity – LDA) po 6 a 12 měsících (DAS 28 < 3,2), dosažení remise (DAS 28 < 2,6). Byly vyhodnoceny faktory predikující před zahájením léčby dosažení stavu nízké aktivity po 6 a 12 měsících.Statistické metody:
V prvním kroku byla provedena jednorozměrná logistická regrese hodnotící vliv všech faktorů k dosažení LDA. Pro hlavní faktory byla provedena ROC analýza za účelem identifikace mezní hodnoty, která daný faktor dělí nejlépe ve smyslu predikce dosažení LDA.Výsledky:
Do registru bylo zařazeno 151 pacientů, jejichž výsledky byly zhodnoceny z hlediska bezpečnosti. Pro zhodnocení účinnosti léčby byly použity údaje 113 pacientů, kteří měli nově nasazen TCZ na začátku sledování. U zbývajících 38 pacientů nebyla účinnost hodnocena, protože šlo o pacienty, kteří pokračovali v léčbě v registru po ukončení klinických studií. Do sledování byli zařazeni pacienti s pokročilou chorobou s průměrným trváním 11 let a s vysokou aktivitou (DAS 28 5,9; průměrná hodnota CRP 24,1 mg/l). Celé šestiměsíční sledování dokončilo 88 % pacientů současně léčených chorobu modifikujícími léky (DMARDs) a 85 % pacientů na monoterapii TCZ. Terapeutické odpovědi dle EULAR dosáhlo za 6 měsíců 88–89 % pacientů. Po 12 měsících léčby docílilo nízké aktivity onemocnění 67 % pacientů a v remisi bylo 48 % pacientů. Nebyly shledány žádné rozdíly v dosažení LDA a remise mezi skupinou na monoterapii nebo na kombinaci TCZ + DMARDs. Jediný signifikantní prediktivní ukazatel dosažení nízké aktivity onemocnění (LDA) po 12 měsících léčby byl počet oteklých kloubů. Výskyt nežádoucích účinků byl stejný mezi skupinou léčenou monoterapií a kombinací TCZ + DMARDs.Závěr:
Výsledky naší studie ukazují dobrou účinnost TCZ u pacientů s revmatoidní artritidou v běžné klinické praxi. V účinnosti ani bezpečnosti nebyl prokázán rozdíl mezi nemocnými léčenými monoterapií nebo kombinací s DMARD. Jediným prediktivním ukazatelem odpovědi léčby TCZ byl počet oteklých kloubů.Klíčová slova:
Revmatoidní artritida, biologická léčby, predikce odpovědi, tocilizumabÚvod
Interleukin 6 (IL-6) je důležitý cytokin, který má výrazné prozánětlivé funkce v organismu. Je účasten na diferenciaci a růstu mnoha buněk, stimuluje syntézu reaktantů akutní fáze v játrech, je zodpovědný za systémové projevy revmatoidní artritidy a přímo aktivuje osteoklasty k resorpci kosti (1). Váže se na svůj receptor (IL-6R), který se sestává z části, která váže cytokin (IL-6Rα), a druhé části (gp = 130), která přenáší signály do buňky.
Tocilizumab (TCZ) je humanizovaná protilátka proti IL-6R, která váže selektivně a kompetitivně solubilní i membránově vázaný receptor pro IL-6. Jde v současné době o jediný registrovaný preparát s tímto mechanismem účinku. Tocilizumab byl nejprve zkoušen na experimentálních modelech artritidy a dále pak v rozsáhlém programu klinického zkoušení fází I-III, přičemž pro registraci byly zásadní především velké, randomizované studie fáze III. Tocilizumab byl zkoušen u širokého spektra pacientů s revmatoidní artritidou (RA), a to jak v kombinaci s MTX (a dalšími DMARD), tak v monoterapii. V klinickém hodnocení OPTION byl TCZ aplikován u nemocných se selhávajícím MTX (2) a v klinickém hodnocení TOWARD pak se selhávajícími DMARD včetně MTX (3). V klinickém hodnocení RADIATE byl TCZ aplikován nemocným se selháním nejméně jednoho anti-TNF (4). Naopak do klinického hodnocení AMBITION byli zařazeni nemocní, kteří byli naivní na léčbu MTX nebo dostávali MTX v minulosti s dobrým efektem (5). V tomto klinickém hodnocení byl zkoušen TCZ v monoterapii oproti monoterapii MTX. AMBITION je první studie, která prokázala u této subpopulace nemocných s RA větší účinnost monoterapie biologickým lékem oproti léčbě MTX. V klinickém hodnocení LITHE byla prokázána schopnost TCZ zpomalovat rentgenovou progresi RA (6). V klinickém hodnocení ADACTA, prvním přímém srovnání monoterapie dvěma různými biologiky, byl TCZ v monoterapii účinnější než anti-TNF preparát adalimumab (12). Důležitou informaci, která doplňuje poznatky z randomizovaných, dvojslepých studií, poskytují i registry biologické léčby. Potvrdily dobrý bezpečnostní profil TCZ a prokázaly i rychlou a mohutnou účinnost v podmínkách běžné klinické praxe (7).
Biologická léčba je jednoznačně nejúčinnější alternativou léčby RA, je však relativně nákladná. Bylo by tedy velmi výhodné podávat tuto léčbu pacientům, u kterých je větší pravděpodobnost úspěchu léčby, jinými slovy znát prediktivní faktory odpovědi na léčbu.
Cílem naší studie bylo jednak vyhodnotit účinnost a bezpečnost TCZ u pacientů v běžné klinické praxi národního registru, jednak se pokusit vyhodnotit prediktivní faktory terapeutické odpovědi.
Metodologie
Jednalo se o otevřenou, dlouhodobou observační studii pacientů zařazených do celonárodního registru ATTRA.
Pacienti: Biologickou léčbu může dostat v ČR pacient, který splňuje indikační kritéria České revmatologické společnosti (8). Ve stručnosti: pacientovi musí selhat léčba alespoň jedním DMARD, kterým by měl být přednostně methotrexát, v dávce minimálně 25 mg týdně (pokud je tolerován) a dále aktivita onemocnění podle DAS 28 musí být vyšší než 3,9. TCZ je podáván většinou jako biologický lék 2. volby (po selhání jednoho anti-TNF), ale může být podáván i jako biologický lék první volby. Zvláště je doporučován jako první lék u nemocných, kteří netolerují žádné DMARD a biologický lék dostávají v monoterapii.
Lék TCZ byl podáván v dávce 8 mg/kg v intravenózní infuzi každé 4 týdny. V případě navození stavu remise (DAS 28 méně než 2,6) bylo možné snížit dávku na 4 mg/kg/ á 4 týdny. Lék byl podáván pouze v centrech biologické léčby a každý pacient byl zařazen do celonárodního registru ATTRA. TCZ mohl být přidán k již aplikovanému DMARD, nebo podáván jako monoterapie. Toto rozhodnutí bylo zcela na ošetřujícím lékaři a nebylo upraveno žádným protokolem.
U všech pacientů byl před zahájením léčby TCZ proveden screening latentní tuberkulózy dle doporučení České revmatologické společnosti.
Sledované ukazatele: Kromě demografických údajů byly u pacientů sledovány následující ukazatele: délka trvání onemocnění, předcházející léčba DMARD, biologickými léky, glukokortikoidy a výsledky této léčby (selhání, nežádoucí účinky), DAS 28, CRP mg/l, FW, odpověď dle EULAR, dosažení nízké aktivity (LDA/DAS 28 < 3,2) dosažení remise (DAS 28 < 2,6). Na základě těchto údajů byly zjišťovány prediktivní faktory dosažení LDA po 6 a 12 měsících.
Statistické metody: V prvním kroku byla provedena jednorozměrná logistická regrese hodnotící vliv všech uvažovaných faktorů na dosažení LDA. Pro jednotlivé faktory byly vypočítány poměry šancí (odds ratio, OR) a statistická významnost (p-hodnota). Pro hlavní faktory byla provedena ROC analýza za účelem identifikace mezní hodnoty, která daný faktor dělí nejlépe ve smyslu dosažení LDA. Hlavní faktory byly dále analyzovány v rámci vícerozáměrového logistického modelu. Kvalita modelu je popsána pomocí senzitivity, specificity, pozitivní prediktivní hodnoty a negativní prediktivní hodnoty.
Výsledky
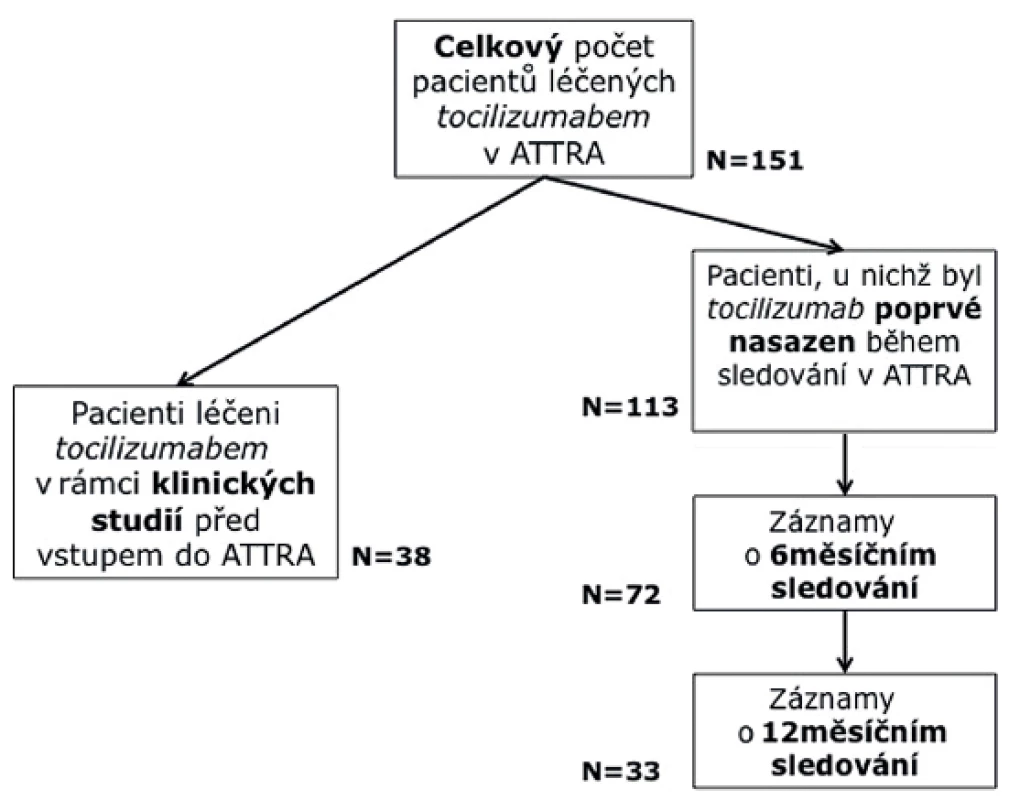
Do studie bylo zařazeno celkem 151 pacientů (obr. 1). 113 z nich bylo nově zařazeno do léčby z důvodů vysoké aktivity RA, 38 pacientů bylo zařazeno po ukončení lékové studie s tocilizumabem, přičemž interval od ukončení studie nebyl delší než 2 měsíce. Tyto dvě skupiny pacientů se liší statisticky ve všech parametrech aktivity (tab. 1). Pro účely určení účinnosti a prediktivních faktorů byly využity pouze nemocní s nově nasazeným TCZ. Celá skupina pak byla použita pro hodnocení ukazatelů bezpečnosti.
Tab. 1. Charakteristika pacientů ve studii 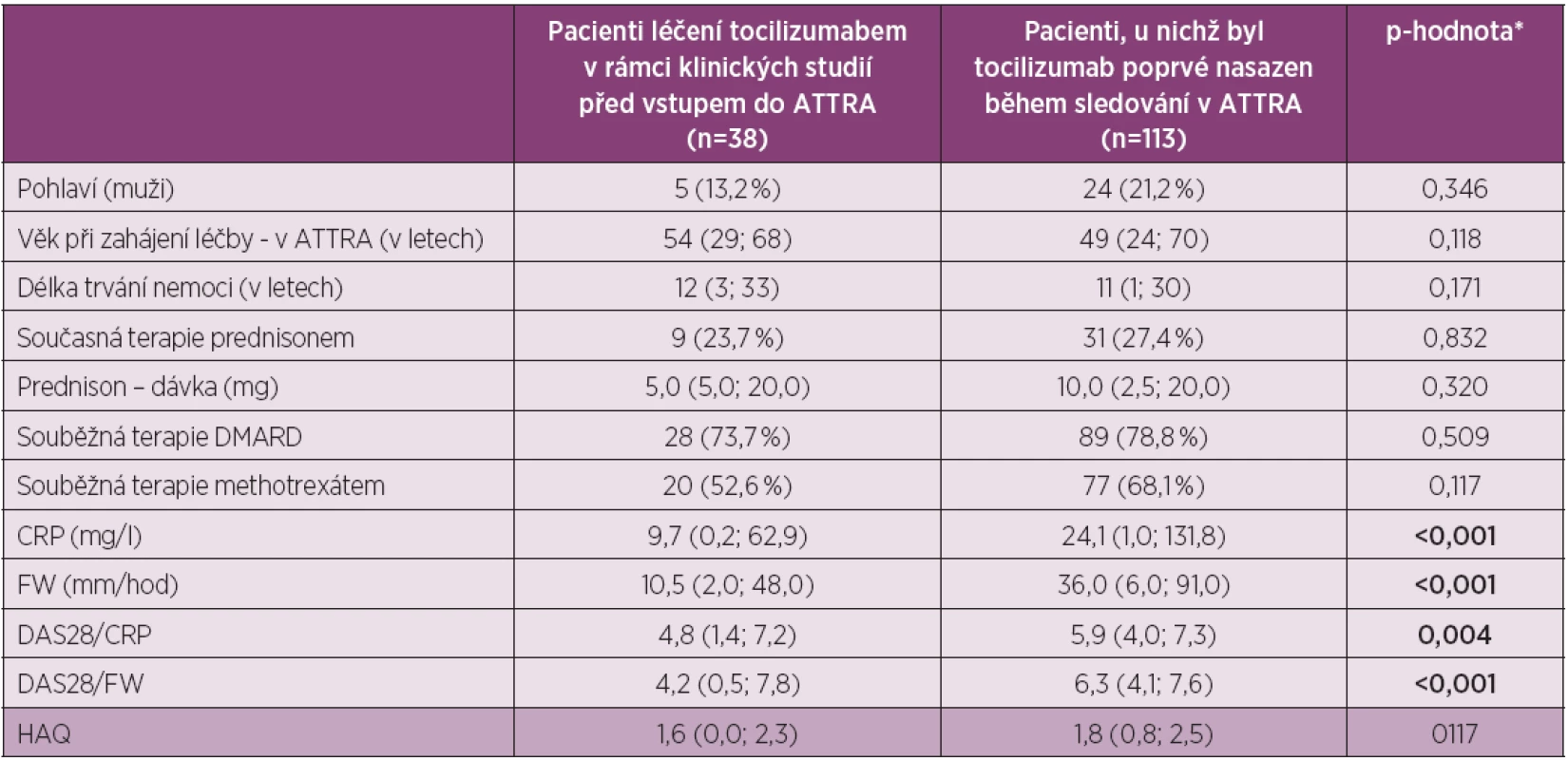
* Pro spojité proměnné je uveden medián (5%; 95% percentil) a p-hodnota odpovídá významnosti Mann-Whitney U testu; pro kategoriální proměnné jsou uvedeny jejich absolutní (relativní) četnosti a p-hodnota významnosti Fisherova exaktního testu Do hodnocené skupiny (N = methotr 113) bylo zařazeno 24 mužů (21,2 %) a 89 žen (78,2 %), průměrný věk byl 49 let (24–70) a průměrné trvání nemoci 11 let (11–30). Léčbu TCZ v kombinaci s DMARD užívalo 78,8 %, v nichž dominoval methotrexát (68 %). Prednison užívalo současně 27 % pacientů. Průměrná hodnota DAS 28 (FW) na začátku léčby byla 6,3 (4,0–7,6), průměrná hodnota DAS 28 (CRP) pak 5,9 (4–7,3), průměrná hodnota CRP byla 24,1 mg/l (1–131,8) a průměrná hodnota FW pak 36 mm/hod (6–91). Všechny tyto ukazatele svědčí o vysoké aktivitě onemocnění. Průměrná hodnota HAQ na začátku léčby byla 1,8 (0,8 – 2,5), což odpovídá významnému funkčnímu postižení.
Po 6 měsících setrvávalo na léčbě TCZ 88 % léčených v kombinaci s DMARD a 85 % pacientů na monoterapii. Po 12 měsících setrvávalo na léčbě 75 % pacientů léčených kombinací s DMARD a 85 % na monoterapii TCZ. U 38 pacientů, kteří ukončili léčbu, byla nejčastější příčinou neúčinnost (32 %), nežádoucí účinky (21,4 %), přání pacienta (14 %), remise onemocnění (4 %), jiný důvod ukončení (21,4 %). Ve sledované skupině došlo k jednomu úmrtí, které dle názoru ošetřujícího lékaře nesouviselo s léčbou (obr. 2).
Obr. 2. Setrvání na léčbě tocilizumabem* * K odhadu setrvání pacientů na léčbě byla použita metoda analýzy přežití dle Kaplana-Meiera. 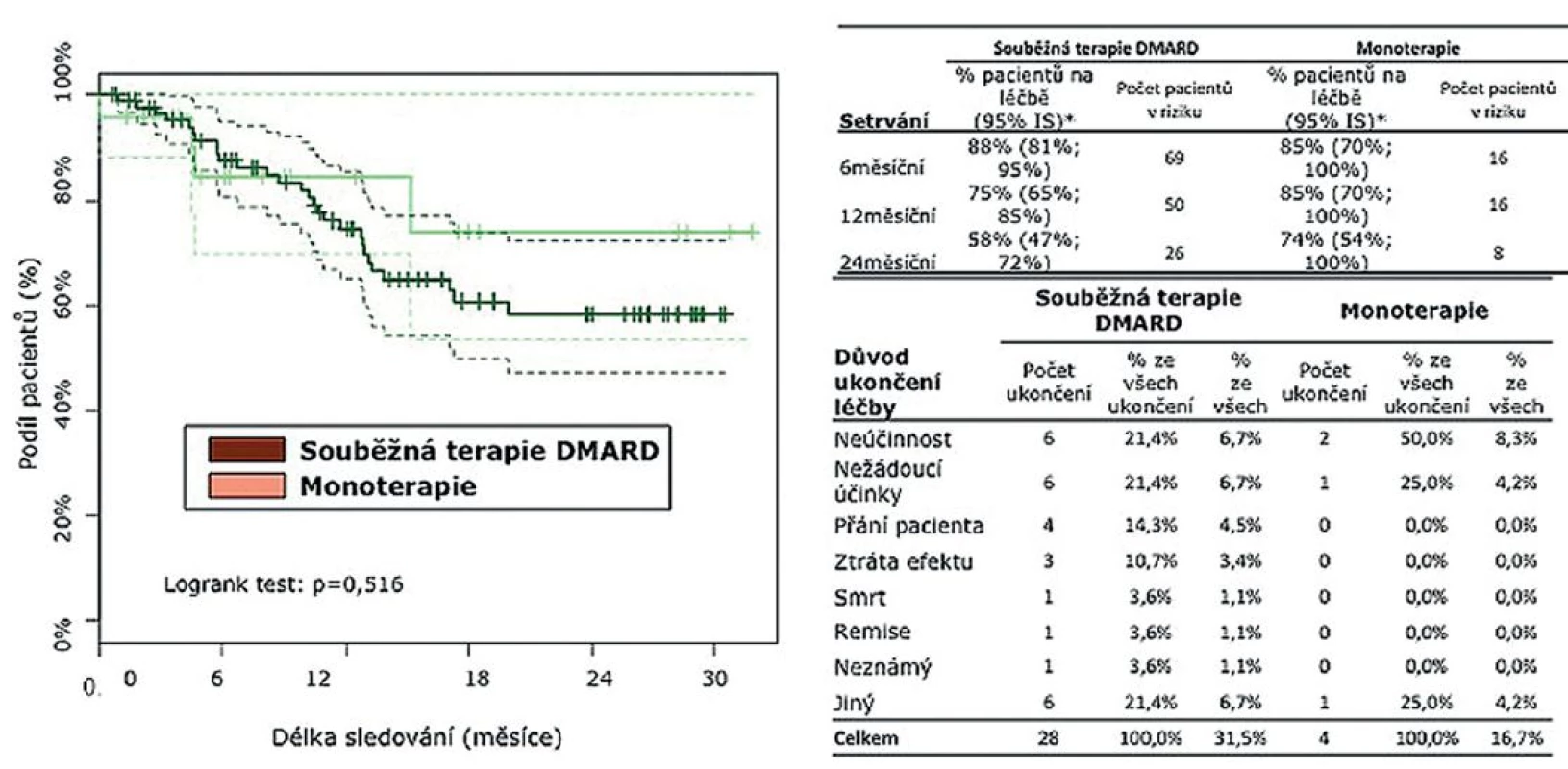
Terapeutické odpovědi dle EULAR (pokles DAS 28 o více než 1,2) dosáhlo za 6 měsíců 89 % a za 12 měsíců 88 % pacientů (obr. 3). Nízké aktivity onemocnění (LDA – DAS 28 < 3,2) docílilo za 6 měsíců 53 % a za 12 měsíců 67 % pacientů. V remisi (DAS 28 < 2,6) bylo po 6 měsících léčby 53 % nemocných a po 12 měsících 48 % nemocných.
Obr. 3. Aktivita onemocnění během 12 měsíců 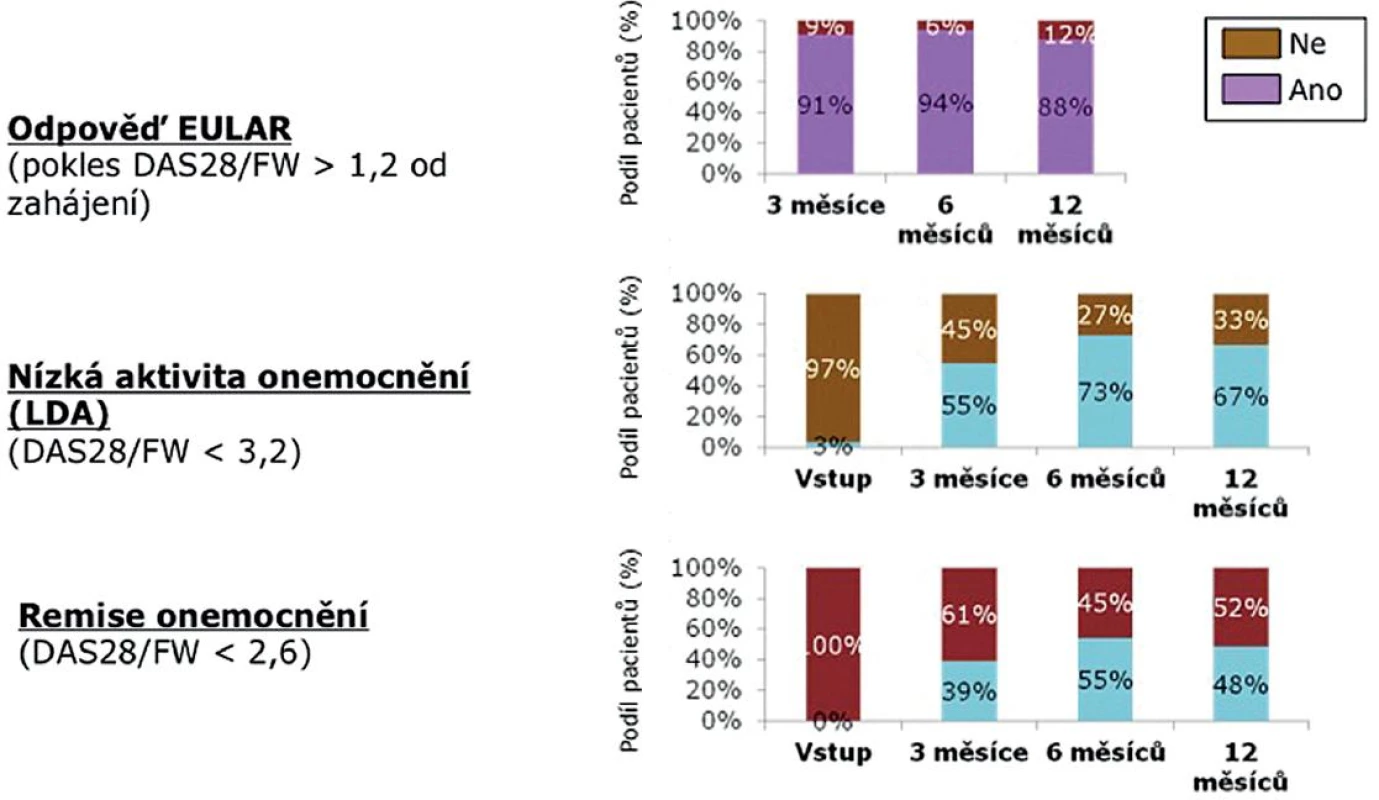
Dále jsme porovnali skupinu nemocných léčených současně TCZ s DMARD (N = 89) a skupinu léčenou monoterapií TCZ (24). Statisticky se obě skupiny nelišily, i když numericky byli pacienti na monoterapii starší (medián 59 vs. 47 let) a měli nižší CRP (medián 14,5 vs. 27,5 mg/l) (tab. 2). Rovněž medián počtu předcházejících DMARD (3) a předcházejících biologik (1) byl identický. V účinnosti nebyl shledán žádný signifikantní rozdíl mezi monoterapií a kombinovanou léčbou, přičemž odpovědi dle EULAR po 6 měsících dosáhlo 91 % nemocných na monoterapii a 89 % pacientů léčených kombinovanou léčbou. Stav nízké aktivity (LDA) byl dosažen u 73 % pacientů na monoterapii a 62 % nemocných ve skupině léčené kombinací (p = 0,73). Remise onemocnění dosáhlo 73 % pacientů na monoterapii a 49 % pacientů léčených kombinací s DMARD (p = 0,19) (obr. 4).
Obr. 4. Aktivita onemocnění během 6 měsíců 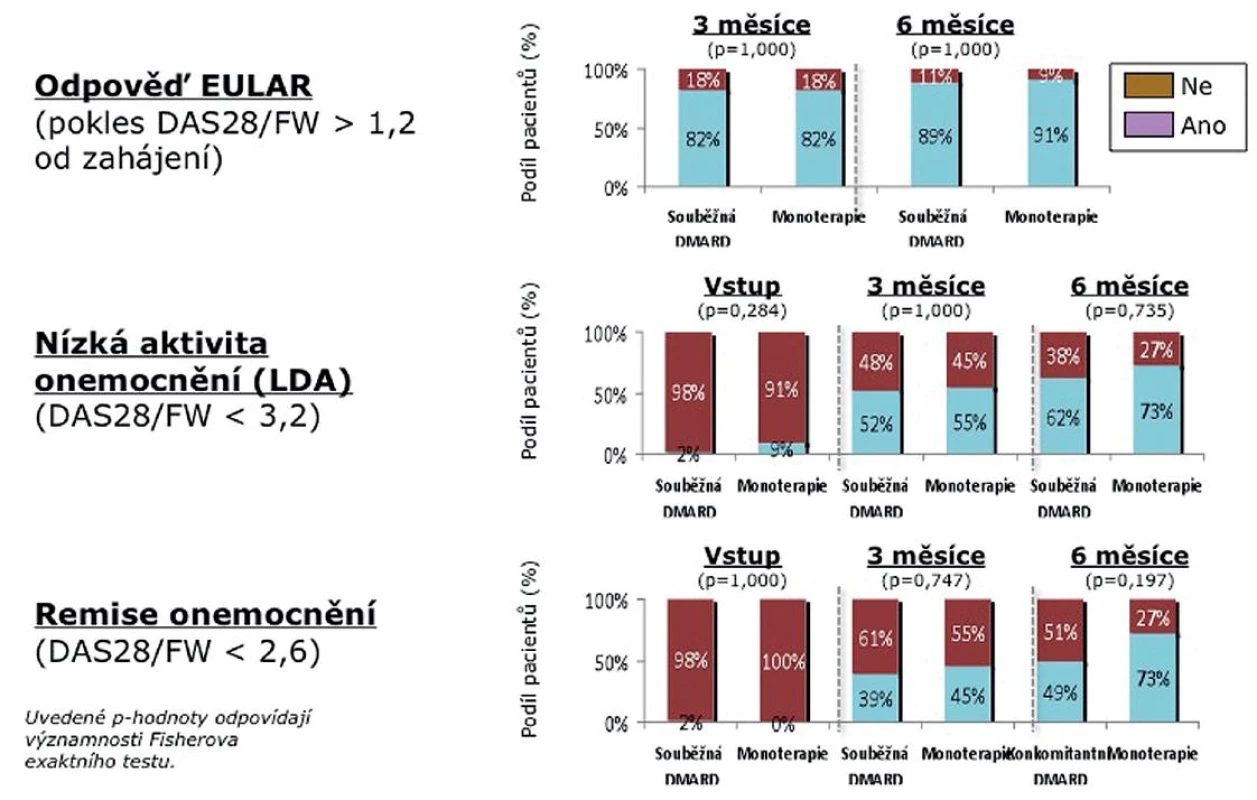
Nejvýznamnějším prediktivním ukazatelem dosažení nízké aktivity onemocnění po 6 či 12 měsících léčby se ukázal být počet oteklých kloubů při zahájení léčby. Při počtu 10 a více oteklých kloubů byla signifikantně snížena pravděpodobnost dosažení stavu nízké aktivity (LDA) (OR = 0,06; 0,01–0,32), (p < 0,001). Pozitivní prediktivní hodnota tohoto modelu byla 80,9 % a negativní prediktivní hodnota 93,8 %. Uvedené více rozměrové modely však popisují především vztah v rámci použitých dat a z důvodu malého počtu pacientů a absence použití validizačních technik je nelze uvažovat jako zobecnitelné predikční modely (obr. 5).
Obr. 5. Prediktivní faktory dosažení LDA* po 12 měsících * Dosažení nízké aktivity onemocnění (LDA – „low disease activity“) je definováno jako aktuální DAS28 < 3,2. 
Hodnocení výskytu nežádoucích účinků bylo ovlivněno malým počtem pacientů ve skupině na monoterapii. Celková expozice byla 104,8 paciento-roků ve skupině kombinované léčby a 21,7 paciento-roků ve skupině na monoterapii. Výskyt závažných NÚ ve skupině kombinační byl 6,7 % a ve skupině na monoterapii TCZ pak 0 %. Výskyt nezávažných NÚ byl 29,2 % ve skupině kombinované léčby a 20,8 % ve skupině léčené monoterapií. Mezi závažnými NÚ byly: 1 závažná infuzní rekace, 1 kardiovaskulární příhoda, 1 gastrointestinální reakce, 1 CNS projevy a dva jiné. Mezi nezávažnými NÚ dominovaly infekce (9,5 na 1 000 paciento-roků) (obr. 5).
Diskuse
Observační studie z národního registru ATTRA prokázala dobrou klinickou účinnost TCZ v běžné klinické praxi. Odpovědi EULAR dosáhlo po 6 a 12 měsících u 90 % pacientů, stavu nízké aktivity pak kolem 65 % pacientů a remise kolem 50 % pacientů. Tyto výsledky zhruba odpovídají výsledkům např. klinického hodnocení ACT - Sure, což je mezinárodní, multicentrická studie podobného typu fáze III B (7).
Biologická léčba RA může být podávána v kombinaci s MTX či jinými DMARD s výjimkou infliximabu a golimumabu, které musí být podávány v kombinaci s MTX. V klinickém hodnocení (PREMIER) (9) s adalimumabem se však ukázala kombinace anti TNF s MTX významně účinnější než monoterapie anti-TNF a od té doby je doporučována biologická léčba pokud možno v kombinaci s MTX nebo v případě jeho nesnášenlivosti s jiným DMARD. Nicméně v běžné klinické praxi se ukazuje, že 20–30 % pacientů nesnáší žádné DMARD a že jedinou možností je pro ně léčba monoterapií biologickým lékem. Tocilizumab je prvním biologickým lékem, u kterého byla prokázána větší účinnost v monoterapii ve srovnání s MTX (5) nebo jinými DMARD (10). Dále bylo prokázáno, že TCZ v kombinaci s MTX není významně účinnější než monoterapie TCZ (Studie ACT-RAY) (11). Recentně dokončená studie ADACTA pak ukázala větší účinnost TCZ v monoterapii oproti monoterapii adalimumabem. Naše výsledky tedy plně odpovídají zkušenostem z těchto zásadních studií (12).
Z výše uvedených poznatků vyplývá, že nejlepší data o účinnosti monoterapie má TCZ, který by měl být proto u nemocných indikovaných k monoterapii biologiky lékem první volby. Jak tedy postupovat u pacienta, který je na zavedené dávce MTX, kterou toleruje, ale nemá dostatečný efekt? Přidat TCZ k MTX nebo MTX vysadit a zahájit monoterapii TCZ? Výsledky studie ACT-RAY by podporovaly druhou alternativu. Nicméně se domníváme, že by toto rozhodnutí o pokračování či nepokračování v léčbě MTX (DMARD) mělo být individuální u každého pacienta. Je nutné vyčkat také dalších studií s delším trváním a s designem, který přinese na tuto specifickou otázku jasnou odpověď. Na základě vlastních dlouhodobých zkušeností a v souladu s SPC zatím spíše přidáváme TCZ k zavedené léčbě MTX, než bychom MTX vysazovali. Tolerance léčby a riziko přerušení léčby je dle provedených sledování obdobné při léčbě monoterapií TCZ nebo kombinací s MTX, event. jinými DMARD.
Biologická léčba je bezpochyby velmi účinná, ale je také drahá. Úkolem prediktivních modelů je identifikovat pacienty, kteří mají potenciálně nejhorší prognózu a kteří mohou z biologické léčby profitovat nejvíce. Prediktivní studie se snaží hledat jednak prediktivní faktory strukturální progrese, prediktivní faktory funkční progrese a dále prediktivní faktory odpovědi na léčbu a event. přerušení léčby (13). Někdy se také hovoří o tzv. personalizované medicíně, která bude získávat na důležitosti s tím, jak přibývají nové biologické léky. Velmi perspektivní je i hledání nových biomarkerů, které by mohly sloužit pro predikci odpovědi na léčbu. Biomarkery lze rozdělit do několika skupin: klinometrické, cytometrické, metabolické, genomické a proteomické (14). Byly provedeny stovky studií, které však zatím nepřinesly jednoznačný výsledek. Autoimunitní onemocnění a jeho léčba představují multifaktoriální děj a lze předpokládat, že i budoucí funkční biomarkery budou multifaktoriální. Na druhé straně je jasné, že příliš složité vyšetřování nemůže být nikdy proveditelné v běžné klinické praxi (15). Je tedy pravděpodobné, že v současné době se budou používat pro predikci odpovědi na biologickou léčbu i nadále především demografické a klinické ukazatele, reaktanty akutní fáze, autoprotilátky (revmatoidní faktory a ACPA protilátky), navíc pak některé ukazatele morfologické (rentgenové poškození, MRI). Hladiny cytokinu TNFα v séru nejsou schopné predikovat odpověď na anti-TNF léčbu (14). Pozitivita revmatoidních faktorů a ACPA protilátek zvyšuje pravděpodobnost odpovědi na rituximab, nikoliv však na anti-TNF léčbu (16). Studie z velkých randomizovaných studií a z registrů biologické léčby nedávají konzistentní výsledky. Např. v dánském registru DANBIO byly negativními prediktory odpovědi na anti-TNF léčbu vyšší věk, horší funkční stav na začátku léčby a současné používání prednisonu. Žádný prediktivní význam nemělo mužské pohlaví, trvání nemoci, současná léčba MTX a počet předchozích DMARD (17). Velice zajímavý se zdá koncept, že odpověď na anti-TNF léčbu po 12 týdnech léčby predikuje odpověď na léčbu po 1 roce léčby, jak bylo prokázáno ve studiích s certolizumabem (18).
Zatím není mnoho dat o predikci odpovědi na léčbu tocilizumabem v běžné klinické praxi. Naše pilotní studie ukázala, že jediným prediktivním faktorem odpovědi na léčbu v naší skupině, byl počet oteklých kloubů. Tím více se do popředí dostává otázka jak optimálně hodnotit oteklé klouby, zda subjektivní klinické hodnocení nedoplnit objektivnější a senzitivnější metodou, jako je např. ultrazvukové vyšetření kloubů.
Limitací našich výsledků je počet hodnocených pacientů, který je dán množstvím pacientů hrazených zdravotními pojišťovnami a zařazených do souboru.
Tato práce byla podpořena projektem Ministerstva zdravotnictví koncepčního rozvoje výzkumné organizace 023728 (Revmatologický ústav).
Adresa pro korespondenci:
MUDr. K. Pavelka
Revmatologický ústav a Revmatologická klinika 1. LF UK v Praze
Na Slupi 4
128 50 Praha 2
Zdroje
1. Redlich K, Smolen JS, et al. Inflammatory bone loss: pathogenetic and therapeutic intervention. Nat Rev Drug Discov 2012;11 : 234-250.
2. Smolen J, Beaulieu A, Rubbert-Roth A, et al. Effect of interleukin-6 inhibition with tocilizumab in patients with rheumatoid arthritis (OPTION study): a double blind, placebo-controlled, randomised study. Lancet 2008;371 : 987-97.
3. Genovese M, McKay JD, Nasonov E, et al. Interleukin - 6 receptor inhibition with tocilizumab reduces disease activity in rheumatoid arthritis with inadequate response to DMARD. Arthritis Rheum 2008;58 : 2968-2980.
4. Emery P, Keystone E, Tony HP, et al. IL-6 receptor inhibition with tocilizumab improves treatment outcomes in patients with rheumatoid arthritis refractory to anti. tumour necrosis factor biologicals: results from a 24 week multicentre, randomised placebo controlled study. Ann Rheum Dis 2008;67(11):1516-23.
5. Jones G, Sebba A, Gu J, et al. Comparison of tocilizumab monotherapy versus methotrexate monotherapy in patients with moderate to severe rheumatoid arthritis. Ann Rheum Dis 2010;69(1):88-96.
6. Kremer JM, Blanco R, Brzosko M, et al. Tocilizumab inhibits structural joint damage in rheumatoid arthritis patients with inadequate responses to methotrexate: results from the double-blind treatment phase of a randomized placebo-controlled trial of tocilizumab safety and prevention of structural joint damage at one year. Arthritis Rheum 2011;63(3):609-21.
7. Bykerk VP, Ostor AJ, Alvaro-Gracia J, Pavelka K, et al. Tocilizumab in patients with active rheumatoid arthritis and inadequate responses do DMARDs / or TNF inhibitors: a large, open label, study close to clinical practise. Ann Rheum Dis 2012 in print.
8. Pavelka K, Vencovský J. Doporučení České revmatologické společnosti pro léčbu revmatoidní artritidy. Čes Revmatol 2012;20 : 182-112.
9. Vencovský J. Bezpečnost biologické léčby – Doporučení České revmatologické společnosti. Čes Revmatol 2009;17 : 146-160.
10. Nishimoto N, Miysaka N, Yamamoto K, et al. Study of active controlled tocilizumab monotherapy for rheumatoid arthritis patients with inadequate response to methotrexate (SATORI): significant reduction in disease activity and serum vascular endothelial growth factor by IL-6 receptor inhibition therapy. Mod Rheumatol 2009;19 : 12-19.
11. Dougados M, Kissel K, Sheeran T, et al. Adding tocilizumab or switching to tocilizumab monotherapy in MTX inadequate responders: 24 - week symptomatic and structural results of a 2 year randomized, controlled strategy trial in RA (ACT-RAY). Ann Rheum Dis 2013;72(1):43-50.
12. Gabay C, Emery P, Vollenhoven R, et al. Tocilizumab monotherapy is superior to adalimumab monotherapy in reducing disease activity in patients with RA: 24 week data from the phase IV. study ADACTA trial. Abstract. Ann Rheum Dis 2012;71(Suppl.3):152.
13. Conaghan PC. Predicting outcomes in rheumatoid arthritis. Clinical Rheumatol 2011;30(Suppl.1):41-47.
14. Marotte H, Miossec P. Biomarkers for prediction of TNF alpha blockers response in rheumatoid arthritis. Joint Bone Spine 2010;77 : 297-305.
15. Ortea I, Roschitzki B, Ovalles JG, et al. Discovery of serum proteomic biomarkers for prediction of response to infliximab (a monoclonal anti-TNF antibody) treatment in rheumatoid arthritis. An exploratory analysis. J Proteomics 2012;77 : 372-82.
16. Klaasen R, Cantaert T, Wijbrandts CA, et al. The value of rheumatoid factor and anti-citrullinated protein antibodies as predictors of response to infliximab in rheumatoid arthritis: an exploratory study. Rheumatology 2011;50 : 1487-1493.
17. Sokka T, Hetland ML, Mäkinen H, et al. Remission and Rheumatoid Arthritis. Data on Patients Receiving usual Care in Twenty-Four Countries. Arthritis Rheum 2008;9 : 2642-51.
18. Curtis J, Luijtens K, Kavanaugh A. Predicting future response to certolizumab pegol in rheumatoid arthritis patients: features at 12 weeks associated with low disease activity at 1 year. Arthritis Care Res 2012;64 : 658-67.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2013 Číslo 3- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Prof. MUDr. Jiří Vencovský, DrSc., slaví 60 let
- Zemřel prof. MUDr. Ctibor Dostál, DrSc.
- Doporučení ČRS pro léčbu nemocných se SLE
- Zdravím podmíněná kvalita života u pacientů s revmatoidní artritidou v průběhu prvního roku anti-TNF léčby (hodnocení dotazníkem SF-36 a srovnání se vzorkem všeobecné populace České republiky) – výsledky z registru biologické léčby ATTRA
- Jaké jsou prediktivní faktory odpovědi na léčbu tocilizumabem v běžné klinické praxi? Zkušenosti z Českého národního registru ATTRA
- Mykofenolát mofetil v léčbě systémového lupus erythematodes
- Abstrakta přednášek z X. slapského sympozia o problémech revmatologie, rehabilitace a revmatochirurgie
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Doporučení ČRS pro léčbu nemocných se SLE
- Prof. MUDr. Jiří Vencovský, DrSc., slaví 60 let
- Zemřel prof. MUDr. Ctibor Dostál, DrSc.
- Mykofenolát mofetil v léčbě systémového lupus erythematodes
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání