-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaTřeboňské revmatologické dny Abstrakta odborného programu
Vyšlo v časopise: Čes. Revmatol., 17, 2009, No. 2, p. 96-110.
Kategorie: Abstrakta
Středa 7. 1. 2009
1. CERTOLIZUMAB V LÉČBĚ REVMATOIDNÍ ARTRITIDY
Vencovský J.
Revmatologický ústav Praha
Certolizumab je humanizovaný PEGylovaný Fab’ fragment monoklonální protilátky proti TNF alfa. Protože neobsahuje Fc část imunoglobulinové molekuly neaktivuje komplement a nevyvolává na protilátkách závislou buněčnou cytotoxicitu. Oproti ostatním anti-TNF preparátům nevyvolává v in vitro testech významnou apoptózu, což signalizuje, že tento mechanismus není nutný pro účinek anti-TNF preparátů. Menší molekula má i teoreticky lepší prostupnost do cílové tkáně. Certolizumab pegol má firemní název CIMZIA a zatím byl registrován v USA pro léčbu Crohnovy nemoci. Pro revmatoidní artritidu jsou klíčové 3 recentně publikovaná klinická hodnocení RAPID1, RAPID 2 a FAST 4WARD. Zatímco první dvě byla hodnocení, která porovnávala léčbu certolizumabem pegol v kombinaci s metotrexátem proti samotnému metotrexátu po dobu 52 nebo 28 týdnů, poslední hodnocení ukazuje výsledky monoterapie. Z výsledků prvních 2 hodnocení lze usoudit na významnou převahu počtu odpovídajících nemocných, kteří dostávali certolizumab, příbližně v řádu 58 %, 37 % a 21 % pro ACR 20, 50 a 70, proti hodnotám dosaženým u nemocných léčených pouze metotrexátem, které byly 14 %, 8 % a 3 %. Z těchto klinických hodnocení také vyplynulo, že nejvhodnější dávkování je 200 mg s.c. lx za 2 týdny. Léčba vede ke zpomalení až zástavě RTG progrese, která byla ve skupině s certolizumabem 0,4 jednotek podle modifikovaného Sharpova skóre a 2,8 ve skupině se samotným metotrexátem. Samostatné použití certolizumabu bez metotrexátu ukázalo rovněž významnou převahu počtu odpovídajících nemocných dle ACR 20, 50 a 70 u 46 %, 23 % a 6 % proti 9 %, 4 % a 0 %. Významné zlepšení bylo také zaznamenáno ve všech sledovaných parametrech uváděných pacienty. Otevřené pokračování léčby ukazuje přetrvávání odpovědi ve 2 letech sledování. Vedlejší nežádoucí účinky, které se vyskytly, jsou ty, které lze očekávat při neutralizaci TNF.
CIMZIA tak představuje další účinnou alternativu neutralizace TNF. Pro léčbu revmatoidní artritidy je lék ve schvalovacím řízení u FDA i EMEA.
2. DIACEREIN V LÉČBĚ OSTEOARTRÓZY KOLENNÍCH KLOUBŮ
Pavelka K.
Revmatologický ústav Praha
Terapie osteoartrózy (OA) by dle “Doporučení EULAR” měla být komplexní a skládat se z léčby nefarmakologické, farmakologické a chirurgické.
Ve farmakoterapii OA se uplatňují léky s ryze symptomatickým, krátkodobým účinkem, jako jsou analgetika a nesteroidní antirevmatika (NSA). Kromě toho jsou doporučeny i léky ze skupiny SYSADOA, které mají opožděný, ale dlouho - trvající účinek. Mezi tyto léky patří diacerein, jehož hlavním mechanismem účinku je sice inhibice IL-1, ale také stimuluje chrupavkové růstové faktory, jako je TGF beta. Účinnost diacereinu byla demonstrována jak na experimentálních modelech OA, tak v řadě klinických studí u OA kolenních a kyčelních kloubů. Ve tříleté studii u OA kyčelních kloubů byl potvrzen strukturu modifikující efekt diacereinu, když docházelo ke zpomalení rentgenové progrese. V prospektivní, dvojslepé, půlroční studii byl pacientům podáván 3 měsíce diacerein nebo placebo 3 měsíce, ale primární cíl studie (změna bolesti na škále WOMAC A) byl po 5 měsících, tedy 2 měsíce po skončení léčby. Primárního cíle bylo dosaženo, pacienti léčení diacereinem měli signifikantně nižší WOMAC A (p < 0,001) a celkový WOMAC (p < 0,001), přičemž tento efekt byl patrný od 2 měsíce léčby. Tento přetrvávající efekt po vysazení léčby (tzv. carry over effect) byl jasně prokázán.
Při metaanalýze publikované Rintelenem bylo prokázáno, že diacerein je v průběhu léčby stejně účinný jako NSA, po vysazení léčby je průběh dalších 2–3 měsíců efekt nadále na rozdíl od NSA stále průkazný. Snášenlivost diacereinu je přitom lepší než NSA.
Diacerein je dle evidence účinný v léčbě OA kolenních a kyčelních kloubů. Jeho efekt je opožděný (2–4 týdny) ale přetrvávající i po vysazení. Při dobré toleranci diacereinu lze prohlásit, že poměr účinnost / toxicita je u tohoto preparátu výhodný.
3. NOVÁ DATA O LÉČBĚ CHONDROITIN SULFÁTEM
Pavelková A.
Revmatologický ústav Praha
Osteoartróza (OA) je nejčastější příčinou muskuloskeletální bolesti a omezení pohyblivosti u starší populace po celém světě. Bolest kyčlí či kolenních kloubů je hlavní příčinou obtížné chůze, až 40 % pacientů ve věku nad 65 let má příznaky spojené s osteoartrózou nosných kloubů. Cílem léčby je zmenšení bolesti a ztuhlosti, zlepšení kloubní pohyblivosti, zamezení progresi postižení a zlepšení kvality života. K dosažení těchto cílů je k dispozici léčba farmakologická, nefarmakologická i chirurgická. Společnost OARSI (Osteoarthritis Research International) vydala doporučení pro léčbu OA kolenních a kyčelních kloubů, naposledy v roce 2007. Součástí doporučených postupů je v rámci farmakologické léčby i použití chondroitin sulfátu u pacientů s gonartrózou, který může mít i strukturu modifikující efekt.
Chondroitin sulfát je přirozeně se vyskytující složkou proteoglykanů chrupavky. Při použití u osteoartrózy účinkuje prostřednictvím snížení apoptózy chondrocytů, zvýšení syntézy proteoglykanů, snížení, aktivity metaloproteináz. Má i protizánětlivé účinky a vliv na subchondrální kost.
Jedna z posledních studií týkajících se účinků chondroitin sulfátu, dvouletá studie STOPP, ukázala, že chondroitin sulfát snižuje bolest efektivněji než placebo, redukuje spotřebu nesteroidních antirevmatik a zpomaluje rentgenovou progresi osteoartrózy.
V dávkování 800 mg/denně chondroitin sulfátu je patrný jeho strukturu modifikující efekt, jak ukazuje i metaanalýza 5 placebem kontrolovaných randomizovaných klinických studií. Rozdíl v rentgenové progresi během dvou let je ve prospěch chondroitin sulfátu
Závěr: Chondroitin sulfát je součástí doporučení OARSI pro farmakologickou léčbu OA. Má symptomatický efekt u pacientů s gonartrózou a strukturu modifikující efekt.
4. SOUČASNÉ PŘÍSTUPY K DIGITÁLNÍM ULCERACÍM U SYSTÉMOVÉ SKLERODERMIE
Bečvář R., Soukup T.1
Revmatologický ústav Praha, 12. interní klinika, Fakultní nemocnice, Hradec Králové
Systémová sklerodermie (SSc) je autoimunitní onemocnění charakterizované zánětem a fibrózou kůže a viscerálních orgánů. K obrazu této nemoci patří také cévní postižení – fibrotická sklerotizace středních, malých tepen a kapilár, která důsledkem protrahovaných atak Raynaudova fenoménu. Důsledkem této vazoneurózy jsou trofické projevy na akrech mezi které patří digitální ulcerace (DU), nekrózy a gangrény prstů. DU jsou jednou z hlavních příčin pracovní neschopnosti u SSc.
V patogenezi cévních změn jsou klíčovými ději dysfunkce a poškození endotelu, které mají řadu důsledků. Hlavími buněčnými elementy jsou endotelie, pericyty a buňky hladké svaloviny. Hlavními procesy jsou zánět na autoimunitním podkladě a následná fibróza, je změněna vazoreaktivita. Následně dochází k cévním uzávěrů na podkladě trombózy.
Podle literárních zdrojů se výskyt DU uvádí u 30–50 % nemocných SSc, v databázi sdružení EUSTAR (Eular Scleroderma Trial And Research group) byla u nemocných SSc prevalence DU 36,2%. Ve sledování dvou center SSc (Praha a Hradec Králové) je celkem 37 nemocných s torpidními a/nebo rekurentními DU. K zvýšení záchytu této komplikace a sledování vývoje DU slouží právě otevřený epidemiologický registr DUO.
Mikroangiopatie u SSc prokazatelná v časné fázi choroby pomocí kapilaroskopie nehtových valů, která je jednoduchá, neinvazivní a má vysokou diagnostickou výtěžnost. Tato metoda umožňuje včas rozpoznat nemocné s vysokým rizikem vzniku DU. Důležitou součástí vyšetřovacího algoritmu jsou také angiologické metody.
Terapie DU je komplexní a zahrnuje režimová opatření, farmakologickou léčbu, chirurgické a lokální. K celkově podávaným léků patří kontinuálně blokátory kalciových kanálů, pentoxyfylin, sartany, infuze analogů prostaglandinů, antagonisté receptorů pro endotelin (bosentan, sitaxentan) a blokátory 5-fosfodiesterázy (sildenafil). Jako slibné se ukazuje dlouhodobé užívání statinů. K nefarmakolgickým metodám patří hyperbaroxie a chirurgická nebo chemická sympatektomie. Nezbytnou součástí terapie je lokální léčení defektů ve spolupráci s dermatology a chirurgy.
5. INDIKACE PRO ZAHÁJENÍ LÉČBY DMARD, RIZIKOVÉ FAKTORY PROGRESE A MONITOROVÁNÍ ÚČINNOSTI, STRATEGIE LÉČBY (DOPORUČENÍ ACR 2008)
Pavelka K.
Revmatologický ústav Praha
ACR publikovala svoje Doporučení pro léčbu RA v roce 2008, kterými inovovala svoje předchozí z roku 2003. Koncepčně novým prvkem je rozdělení pacientů s RA podle délky trvání onemocnění na tři skupiny: < 6 měsíců, 6–24 měsíců a > 24 měsíců. Kromě toho je doporučeno u každého pacienta před zahájením léčby určit aktivitu (např. v kategoriích DAS 28, aktivita < 3,2 nízká, > 3,2 < 5,1 střední a > 5,1 vysoká. Třetím pilířem rozhodování v léčbě je přítomnost rizikových faktorů progrese. Jako nejdůležitější faktory špatné prognózy byly určeny: funkční postižení (HAQ), mimokloubní postižení (SS, plíce, vaskulitida), pozitivita RF a/nebo anti CCP, kostní eroze na rtg. Jako další rizikové faktory progrese byly určeny: vysoký počet oteklých a citlivých kloubů, vysoké reaktanty akutní fáze, kouření cigaret a sdílený epitop (HLA-DRD1). Evidence o účinnosti kombinací DMARDs existuje pro kombinace MTX + HCQ, MTX + SAS, MTX + LEF, MTX + HCQ, MTX + SAS + HCQ.
MTX nebo leflunomid jsou doporučovány pro všechny kategorie trvání nemoci, všechny stupně aktivity, s nebo bez špatných prognostických ukazatelů. Evidence A pro MTX je u: špatné prognózy, vysoké aktivity, střední aktivity a krátkého trvání RA. Evidence A u leflunomidu je pro: vysokou aktivitu, špatnou prognózu a delší trvání nemoci. Pro ostatní situace je evidence B. Hydroxychlorochin je doporučován pouze u RA bez špatných prognostických ukazatelů, trvání < 24 měsíců a nízká aktivita. Sulfasalazin je doporučován jako monoterapie u pacientů bez špatných prognostických ukazatelů pro všechny stupně klinické aktivity.
Kombinace MTX + LEF je doporučována při trvání nemoci > 6 měsíců, vysoká aktivita nemoci a nezávisle na přítomnosti rizikových faktorů. Anti TNF léčba jako první postup v kombinaci s MTX při trvání < 3 měsíce, vysoké aktivitě špatných prognostických ukazatelů a absenci bariér ze strany plátce. Anti TNF léčba u RA střední a delší délky trvání RA jsou doporučována: selhání předcházející léčby MTX (dalšího DMARD, u střední aktivity + špatné prognostické ukazatele, nebo u vysoké aktivity bez špatných prognostických ukazatelů). Biologický lék se přidává s MTX nebo dalším DMARD. Abatacept je určen pro pacienty se selháním MTX, u pacientů s minimálně střední aktivitou a špatnými prognostickými ukazateli. Rituximab je indikován u pacientů se selháním léčby DMARD, u pacientů s vysokou aktivitou a se špatnými prognostickými ukazateli.
6. DOPORUČENÍ ČRS A DALŠÍCH SPOLEČNOSTÍ PRO LÉČBU RA DMARD
Bečvář R., Vencovský J., Němec P.1, Suchý D.,
Procházková L.1, Pavelka K.
Revmatologický ústav, Klinika revmatologie 1. LF UK,
Praha, 1Interní klinika, FN U sv. Anny, Brno
Revmatoidní artritida (RA) je autoimunitní onemocnění charakterizované přítomností chronické symetrické synovitidy, která vede ke vzniku kloubních erozí.
Podle doporučení České revmatologické společnost (ČRS) je cílem léčby navození remise. Pokud není remise možná, je nutné docílení velmi nízké aktivity. Dalším cílem léčby je zastavení nebo zpomalení rentgenové progrese onemocnění. Klinická doporučení (“návody”) Americké revmatologické společnosti (ACR) hovoří o předcházení nebo kontrole poškození kloubu, prevenci ztráty funkce a potlačení bolesti. Britská revmatologická společnost (BSR) uvádí tyto cíle: časná identifikace osob s RA, podpora jedinců s RA, vývoj účinné, ekonomicky výhodné a na důkazech založené klinické péči o osoby s RA.
Podle ČRS by se stanovení diagnózy RA mělo provést podle kritérii Americké revmatologické asociace (ARA). Iniciální vyšetření pacienta s RA by mělo obsahovat vyšetření aktivity, která zahrnuje o subjektivní symptomy pacienta, funkční stav, objektivní známky aktivity, mechanické kloubní problémy a přítomnost mimokloubních příznaků. Návody ACR se od těchto doporučení zásadně neliší.
Doporučenou metodikou ČRS pro hodnocení aktivity RA je tzv. DAS skóre (hodnocení kloubní nálezu, FW, hodnocení bolesti a pacientem). Sledování rentgenové progrese je nedílnou součástí hodnocení RA. Zlatým standardem je Sharpovo skóre modifikované van der Heijde. Doporučené intervaly vyšetření jsou 6–12 měsíců. Návody ACR obsahují hodnocení aktivity ACR20, 50 a 70 a dotazníky HAQ a Arthritis Impact Measurement Scales. BSR standardy obsahují roční formální stanovení aktivity.
Co se týká doporučení ČRS k vlastní léčbě RA, neliší se zásadně od amerických návodů. Obě obsahují farmakologickou a nefarmakologickou složku. Farmakologická léčba zahrnuje užití chorobu modifikujících léků, glukortikoidů, biologických preparátů, nesteroidních antirevmatik a analgetik. Standardy BSR více zdůrazňují multidisciplinární přístup.
7. KONTRAINDIKACE LÉČBY DMARD A LÉČBA DMARD PŘI DALŠÍCH ONEMOCNĚNÍCH
Šléglová O.
Revmatologický ústav Praha
Kontraindikace léčby DMARD lze rozdělit do několika skupin. Především jsou to infekční onemocnění jako akutní závažné bakteriální infekce, infekce, které vyžadují léčbu antibiotiky nebo respirační infekce horních cest dýchacích provázené vysokou horečkou. Do této skupiny patří i TBC či intersticiální pneumonitida (ať už se jedná o pneumonitidu v souvislosti s revmatoidní artritidou či neznámé příčiny).
Hematologické a onkologické kontraindikace zahrnují myelodysplazii, lymfoproliferativní onemocnění a významný pokles leukocytů či krevních destiček.
Z kardiologických postižení jsou pro léčbu nevhodní pacient s pokročilým srdečním selháním (NYHA III. nebo IV.) a poklesem ejekční frakce levé srdeční komory pod 50 %.
Mezi dlouhodobě diskutované omezení léčby DMARD patří elevace jaterních transamináz a akutní hepatitda B nebo C. Při chronické hepatitidě B nebo C je rozhodující hodnocení pomocí Child-Pugh klasifikace.
Z dalších kontraindikací je nutné zmínit pokles clearence kreatininu pod 30 ml/minutu či demyelinizační postižení.
8. MONITOROVÁNÍ BEZPEČNOSTI DMARDs PODLE NOVÝCH DOPORUČENÍ ACR
Forejtová Š.
Revmatologický ústav Praha
Nová doporučení, která byla publikována v roce 2008, vyvinula ACR (American College of Rheumatology) za účelem provést praktický návod, jak monitorovat bezpečnost při léčbě jednotlivými chorobu modifikujícími léky. Tato doporučení však musí být individualizovaná u každého jednotlivého pacienta dle jeho zdravotního stavu, nejsou mandatorní.
Doporučení obsahují praktický návod, jak monitorovat bezpečnost léčby DMRDs před jejich zahájením, dále pak doporučují frekvenci kontrolních vyšetření při jejich podávání. Podrobně podává i návody, jak postupovat při vakcinaci během léčby DMARDs i biologiky.
Podporováno výzkumnými záměry MZ NO: 000 000 23728
9. VYŠETŘENÍ NA LATENTNÍ TUBERKULÓZU PŘED ZAHÁJENÍM BIOLOGICKÉ LÉČBY
Vencovský J.
Revmatologický ústav Praha
Tuberkulóza (TBC) může být vážnou komplikací biologické léčby TNF neutralizujícími přípravky. Uvádí se asi 6–10násobné riziko proti jinak léčeným nemocným. O něco více případů je při podávání monoklonálních protilátek než solubilního receptoru, ale riziko je zvýšeno obecně. Přibližně 50 % nemocných má mimoplicní postižení. TBC se objevuje o něco častěji v časnějších fázích léčby, i když jsou známy případy vzniklé i po několika letech. Obecně se soudí, že ve většině případů jde o aktivaci latentní tuberkulózní infekce (LTBI), kdy neutralizace TNF umožní rozpad granulomů normálně udržujících přežívající bacily tuberkulózy pod kontrolou. Proto je indikované vyšetření každého kandidáta anti-TNF terapie před zahájením léčby. Riziko aktivace TBC při léčbě rituximabem není zvýšeno, a není zřejmě ani vyšší při léčbě abataceptem, nicméně v druhém případě zatím doporučujeme podobný přístup jako k nemocným léčeným anti-TNF. Sekce pro tuberkulózu České pulmonologické a ftitzeologické společnosti uveřejnila na webových stránkách zápis z jednání, ve kterém navrhuje určité postupy pro vyšetření LTBI a další postup v případě pozitivního nálezu (http://www.pneumologie.cz/zapisy/2005/sekce-TBC-20051201.php). V zásadě jde o kombinaci vyšetření RTG plic, tuberkulinového testu a schopnosti sekrece interferonu gama T lymfocyty po stimulaci specifickými mykobakteriálními antigeny (Quantiferon TB-Gold) a závěrečného zhodnocení plicařem. Při podezření na LTBI je pacient léčen isoniazidem po dobu 6 měsíců, přičemž zahájit léčbu anti-TNF může začít po 2 měsících. Je doporučeno sledování ve tříměsíčních intervalech a poté lkrát ročně. Tyto navržené postupy lze považovat za ideální a pravděpodobně nejcitlivější v detekci možného vývoje TBC. Praxe však ukazuje, že v mnoha případech je dodržení těchto postupů obtížné z mnoha důvodů. Česká revmatologická společnost akceptuje tyto postupy jako optimální, nicméně navrhuje k diskuzi minimální požadavky, kterými jsou: RTG plic a vyšetření tuberkulinového testu před začátkem léčby, testu Quantiferon před začátkem, po 3 měsících a lkrát ročně. Konzultace plicního lékaře je na počátku potřebná v jakémkoliv případě odchylného výsledku. Opakování RTG plic lkrát ročně je ponecháno na zvážení ošetřujícího lékaře, přičemž je ve všech případech doporučována extrémní pečlivost a pozornost možnému vývoji TBC během biologické léčby a v případě pochybností rigorózní postup, včetně pravidelné konzultace plicního odborníka.
10. DOPORUČENÍ ČRS A DALŠÍCH SPOLEČNOSTÍ PRO MONITOROVÁNÍ BEZPEČNOSTI LÉČBY REVMATOIDNÍ ARTRITIDY DMARDs
Šedová L.
Revmatologický ústav Praha
Česká revmatologická společnost (ČRS) vydává letos doporučení pro monitorování bezpečnosti léčby revmatoidní artritidy preparáty ze skupiny DMARD (disease modifying anti-rheumatic drugs). V letošním roce byly zároveň publikována doporučení Britské revmatologické společnosti (British Society for Rheumatology – BSR) a Americké revmatologické společnosti (American College of Rheumatology – ACR).
Sdělení se zabývá hlavními odlišnostmi mezi těmito dokumenty.
Před zahájením léčby nejsou v kontrolovaných parametrech výrazné rozdíly. Všechny společnosti doporučují vyšetření sérologie hepatitid u metotrexátu i leflunomidu.
V případě antimalarik postupuje ČRS dle doporučení Americké oftalmologické společnosti tj. roční kontroly jen u vysokého rizika retinopatie. Jinak jednou za 5 let. Britská doporučení trvají na ročních kontrolách u všech pacientů bez ohledu na riziko.
Nová americká doporučení pro ostatní preparáty jsou maximálně zjednodušena: laboratorní kontroly u salazopyrinu (SSZ), metotrexátu (MTX) i leflunomidu (LEF) jsou sjednocena na jednou za 2–4 týdny v 1. trimestru, jednou za 8–12 týdnů v 2. trimestru a dále jednou za 3 měsíce.
Naše rozlišují intervaly laboratorních kontrol pro MTX a SSZ (jednou za 4 týdny v 1. trimestru, dále jednou za 12 týdnů) oproti LEF, kde kontroly po 4 týdny jsou prodlouženy na prvních 6 měsíců a po prvním půl roce na jednou za 8 týdnů. Britská doporučení si žádají častější kontroly jak u MTX, tak u LEF v 1. trimestru.
Cyklosprin A je kontrolován dle českých i britských doporučení jednou měsíčně v 1. trimestru, dále jednou za 3 měsíce. Americká doporučení tento preparát nezahrnují do skupiny DMARDs.
Britský dokument obsahuje doporučení k vakcinaci proti chřipce ročně u pacientů léčených MTX a LEF. Doporučení ACR uvádějí vhodnost vakcinace proti chřipce ročně u všech DMARDs včetně antimalarik, proti pneumokoku u SSZ, MTX a LEF a proti hepatitidě B u MTX a LEF u rizikových pacientů. Česká doporučení se vyjadřuje jen ke kontraindikaci očkování živou vakcínou u MTX, LEF a cyklosporinu A.
Monitorovací schémata bezpečnosti léčby DMARDs vznikla na podkladě literárních údajů a koncensu odborníků a mají charakter doporučených postupů, jejichž úpravy jsou nutné u individuálního pacienta dle vývoje klinického stavu a laboratorních nálezů.
Poděkování: Tato práce vznikla za podpory Výzkumných záměrů MZ č. 00023728.
11. POSTAVENÍ LEFLUNOMIDU V DOPORUČENÍCH ODBORNÝCH SPOLEČNOSTÍ VE SVĚTĚ A U NÁS
Suchý D.
Oddělení klinické farmakologie, Fakultní nemocnice v Plzni
Leflunomid (LEF) je moderní DMARD inhibující syntézu pyrimidinů, což vede k blokádě klonální expanze T buněk. Monoterapie LEF se ukázala v léčbě revmatoidní artritidy (RA) stejně účinná jako léčba metotrexátem (MTX) a sulfasalazinem (SAS). Rovněž byl prokázán příznivý vliv LEF na rozvoj kloubního poškození (RTG progresi) a disabilitu. U pacientů s nedostatečnou odpovědí na léčbu metotrexátem vede přidání leflunomidu k signifikantnímu zlepšení kontroly onemocnění.
Dle aktuálních doporučení České revmatologické společnosti z r. 2007 jsou pacienti se střední aktivitou RA nejprve indikováni k léčbě metotrexátem a při neúčinnost léčby leflunomidem. V případě vysoké aktivity s rychlým rozvojem erozí se doporučuje opět léčba MTX ve vyšších dávkách nebo parenterálně, případně léčba leflunomidem.
U nemocných s časnou RA je léčba LEF indikována u pacientů s vysokou aktivitou onemocnění, zejména v přítomnosti negativních prognostických faktorů a s rychlým rozvojem kloubních erozí. LEF je vyhrazen pacientům s kontraindikací nebo intolerancí jiných DMARD (MTX a SAS).
American College of Rheumatology (ACR) vydala v tomto roce nová doporučení k použití nebiologických a biologických DMARDs v léčbě revmatoidní artritidy. Je provedena stratifikace terapeutických postupů v závislosti na délce trvání onemocnění (< 6 měsíců, 6–24 měsíců, > 24 měsíců ), aktivity a přítomnosti negativních prognostických faktorů (funkční postižení, extraartrikulární projevy, pozitivita RF/ aCCP nebo eroze dle RTG). Léčba metotrexátem nebo leflunomidem je doporučena v monoterapii u pacientů s jakýmkoliv trváním onemocnění i aktivitou, nezávisle na přítomnosti negativních prognostických faktorů. V kombinaci je MTX a LEF indikován v léčbě RA s intermediárním nebo delším trváním, nezávisle na prognostických faktorech. Nová ACR doporučení tedy řadí leflunomid již mezi léky první linie a neváží jeho použití na předchozí selhání léčby MTX nebo jiným chorobu modifikujícím lékem.
Literatura u autora
Čtvrtek 8. 1. 2009
12. NORMATIVNÍ PŘÍSTUP K SYNDROMU GENERALIZOVANÉ FIBROMYALGIE
Hrnčíř Zb.
2. interní klinika LF UK a FN Hradec Králové
Východiska: Generalizovaná fibromyalgie (FM) je multidisciplinární problém. Zainteresovaní specialisté k němu přistupují z nestejných výchozích pozic. Rozhodující úloha revmatologa je výzvou k deklaraci normativních přístupů k diagnóze, diferenciální diagnóze a k účinné terapii na základě důkazů.
Metodika: 1. FM je klinický syndrom bez objektivního nálezu, definovaný plošnou bolestí a konkomitujícím souborem 11–18 bodů se zvýšenou bolestivostí na tlak (kritéria ACR/1990, senzitivita 88,4 %, specificita 81,1%). 2. Diferenciální diagnostika FM má určité zvláštnosti: a) FM se nevylučuje (e principe) s žádnou jinou diagnózou, ale syndromologické vyhodnocení algie může být chybné; příkladem je záměna tlakové bolesti FM bodu s algií myofasciálního spoušťového bodu, kde je odlišný přístup k terapii, b) FM může přesahovat do jiného idiopatického, v podstatě rovněž funkčního syndromu, zpravidla do chronického únavového syndromu (CHUS), c) FM může být asociována s organickým revmatickým/nerevmatickým onemocněním, a modifikovat některé ukazatele používané pro hodnocení aktivity. Příkladem je VAS bolesti u revmatických chorob, na prvním místě u revmatoidní artritidy. 3. Přístupy k hodnocení účinnosti farmakologické/nefarmakologické terapie na základě důkazů vycházející ze zprávy American Pain Society (2004): základem pro strukturované hodnocení byla dispozice/chybění randomizovaných kontrolovaných studií a jejich validizovaných meta-analýz.
Závěr: Hlavní normativní přístupy představují dostatečně pevné zázemí pro validní rozhodování revmatologa o FM v pozici léčícího lékaře i v pozici významného spolupracovníka pro širokou škálu dalších odborníků se vztahem k FM.
13. CO JE NOVÉHO V ETIOPATOGENEZI FIBROMYALGIE?
Tomš J.
2. interní klinika, Lékařská fakulta UK a Fakultní nemocnice Hradec Králové
Fibromyalgie (FM) je poměrně časté revmatologické onemocnění charakterizované chronickou plošnou bolestivostí. Snížený práh pro vnímání bolesti se projevuje hyperalgézií a alodynií. Výzkum z posledních dvou desetiletí ukazuje na multifaktoriální charakter tohoto syndromu. Již v 90. letech 20. století byly kromě možného genetického podkladu zjištěny abnormality na úrovni neurohormonů a mediátorů bolesti (serotonin, substance P, prolaktin, růstový hormon aj.) v plazmě a/nebo v mozkomíšním moku.
Pro genetickou dispozici svědčí jednak epidemiologická data o familiární agregaci, jednak práce studující polymorfismus genů pro transport serotoninu, 5-HT2A receptorů nebo COMT, kdy byla prokázány signifikatní asociace s výskytem event. závažnějším průběhem FM. Při použití moderních zobrazovacích metod (SPECT) byly popsány změny v regionálním mozkovém krevním průtoku – hyperperfuze somatosenzorického kortexu (senzorická dimenze bolesti) a naopak hypoperfuze frontálního, cingulárního a středního temporálního kortexu (emocionální dimenze bolesti). Morfometrické vyšetření pomocí 3D-MRI odhalilo změny v objemu šedé hmoty mozkové v různých oblastech CNS, navíc byl zjištěn signifikatně vyšší úbytek šedé hmoty závislý na stoupajícím věku a také trvání FM, což vede k hypotéze o urychleném stárnutí mozku u pacientů s FM. Pacienti s FM mají sníženou vazebnou kapacitu centrálních μ-opioidních receptorů v regionech, které hrají roli při modulaci bolesti (např. amygdala, cingulum). To by mohlo vysvětlit, proč opiáty nejsou dostatečně účinné k tlumení bolesti u FM.
Ačkoliv původní představa o FM jako primárně svalovém onemocnění nebyla potvrzena následnými histopatologickými studiemi, v posledních letech některé práce poukazují na periferní změny na úrovni nervových zakončení („balonovité“ Schwannovy buňky) nebo nižší obsah intramuskulárního kolagenu (který může podmiňovat sklon k mikrotraumatům). Výzkum FM se zaměřil i na možný vztah k změnám imunitního systému, byla popsána např. signifikatní redukce cytotoxických CD8+ lymfocytů, zvýšená exprese L-selektinu na monocytech a neutrofilech nebo zvýšená frekvence antipolymerních protilátek. První spánkové studie u FM byly provedeny už více než před 30 lety a tehdy prokázály abnormální střídání α-δ vln ve fázi IV NREM spánku. Nejnovější práce zjistily kratší trvání II. fáze REM spánku, což predikovalo vyšší intenzitu bolesti u pacientů s FM.
Závěr: Přes významný pokrok ve výzkumu zůstává etiopatogeneze FM nejasná. Byla sice popsána řada abnormalit, ale jejich význam je stále nejednoznačný. Nejvíce přijímaná hypotéza je neuropatofyziologická, podle které u geneticky predisponovaných osob indukují různé fyzikální nebo emocionální stresory zvýšenou vnímavost k bolesti a hypersenzitivitu na nejrůznější další stimuly.
14. REVMATOIDNÍ ARTRITIDA A KONKOMITUJÍCÍ FIBROMYALGIE
Tomš J., Soukup T., Bradna P., Baštecká D., Daňková M., Hrnčíř Zb.
2. interní klinika, Lékařská fakulta UK a Fakultní nemocnice Hradec Králové
Revmatoidní artritida (RA) je chronické zánětlivé kloubní onemocnění, které významně ovlivňuje kvalitu života pacientů a může vést k různému stupni disability. Fibromyalgie (FM), syndrom charakterizovaný chronickou difúzní bolestí, může v případě asociace s RA ovlivnit vnímání bolesti.
Cíl: Posoudit, jak konkomitující FM u pacientů s RA ovlivňuje kvalitu života, úroveň disability a hodnocení aktivity revmatoidní artritidy.
Metody: Vyšetřili jsme 120 pacientů (29 mužů, 91 žen) s RA sledovaných v terciárním centru na přítomnost konkomitující fibromyalgie dle ACR kritérií (1990). Definované fibromyalgické body byly hodnoceny na základě protokolu MTPS (Standardised Manual Tender Point Survey, 1996). O vyšetřených osobách byly zaznamenány následující údaje: demografická data, terapie RA, laboratorní parametry (FW – sedimentace erytrocytů, CRP, revmatoidní faktor), DAS-28 a počet bolestivých bodů (TPC). Všichni pacienti vyplnili tyto dotazníky: HAQ, SF-36, EuroQol (EQ), FIQ (Fibromyalgia Impact Questionnaire) a Zungův dotazník deprese a úzkosti (SDS).
Výsledky: Klasifikační kritéria pro FM splnilo 24 pacientů (20,0 %) s RA (3 muži, 21 žen). Mezi pacienty s RA oproti pacientům s RA a FM (RA/FM) nebyly nalezeny statisticky významné rozdíly ve vztahu k věku, zastoupení pohlaví, trvání RA, pozitivitě RF, hodnotě FW a CRP. Pacienti RA/FM měli ve srovnání s pacienty s RA statisticky významně vyšší hodnotu TPC, DAS-28, počtu bolestivých kloubů (TJC), VAS bolesti, únavy a ztuhlosti. Rozdíl v počtu oteklých kloubů (SJC) nebyl mezi oběma skupinami statisticky významný.
Se stoupající hodnotou DAS-28 se zvyšovalo zastoupení pacientů s RA/FM oproti RA. Pacienti s RA/FM měli významně horší kvalitu života (SF-36, EQ) a úroveň disability (HAQ) ve srovnání s RA pacienty.
Závěr: Konkomitující FM má významný negativní vliv na kvalitu života a úroveň disability u pacientů s RA; navíc může vést k nadhodnocení aktivity RA při využití skóre DAS-28, což je dáno vysokými hodnotami VAS bolesti a TJC při sníženém prahu bolesti.
15. MOŽNOSTI LÉČBY FIBROMYALGIE
Jarošová H.
Revmatologický ústav Praha
Fibromyalgický syndrom (FMS)
Fibromyalgie je chronický, generalizovaný, nezánětlivý, muskuloskeletální (myofasciální) syndrom projevující se plošnou bolestivostí s ranní a večerní ztuhlostí a body se zvýšenou citlivostí na tlak. Prezentuje se jako allodynie. Některé studie prokázaly abnormality cerebrálního toku krve talamu a v nucleus caudatus. Byly zjištěny vyšší koncentrace substance P v CF tekutině (3x), dále byly nalezeny snížené hladiny serotoninu a endorfinů. Etiologie a patogeneze je neznámá. Nemoci často asociované s fibromyalgií jsou: revmatoidní artritida, osteoartóza, Sjögrenův syndrom, bolestivý sy horních a dolních zad, infekční hepatitida C a Lymeská nemoc.
Epidemiologie: Prevalence fibromyalgie je 2 % v populaci. Není rozdíl v rasách, poměr ženy:muži je 8 : 1, 3,5 % žen, 0,5 % mužů. Fibromyalgie je nejčastější v 5. deceniu žen a je vzácná u prepubescentálních dívek. Fibromyalgie postihuje 7 % žen mezi 60 a 79 lety.
Klinický obraz: Plošná bolest trvající minimálně 3 měsíce, bolest je v pravé a levé polovině těla a bolest nad pasem a pod pasem. Dále musí být přítomna axiální bolest: šíje, přední plocha hrudníku, oblast hrudních nebo bederních segmentů páteře. Citlivé body specifických lokalit minimálně 11 z 18 definovaných. Kritéria vykazují senzitivitu 88,4 % a specificitu 81,1 %. Chronická plošná svalová bolesti může být asociována s dalšími charakteristickými symptomy: poruchy spánku – non restoratorní, chronická únava u 80 % nemocných, ranní ztuhlost (od 30 minut do několika hodin), cefalea, syndrom iritovaného měchýře (12 %), iritované stolice 40 %, psychologický distress, deprese a anxieta je zjištěna u 40 % nemocných.
Terapie: Psychoterapie, kognitivní behaviorální terapie, edukace nemocného. Z fyzioterapie strečink, relaxační techniky; intenzivní cvičení spíše stav zhoršuje. Akupunktura, hypnoterapie, biofeedback, balneoterapie. Medikamentózní terapie: Amitriptylin, cyclobezaprine, tramadol v kombinaci s acetaminophenem nebo bez něho, fluoxetine, venlafaxine, milnacipran, duloxetine, pregabalin, tropisetron. Podrobný výklad medikamentózní terapie je předmětem přednášky.
16. EXISTUJE VZTAH MEZI OBEZITOU, KLINICKOU AKTIVITOU, STRUKTURÁLNÍ PROGRESÍ NEBO PATOGENEZÍ REVMATICKÉHO ONEMOCNĚNÍ?
Šenolt L., Haluzík M.1
Revmatologický ústav Praha, 1III. interní klinika 1. LF UK a VFN Praha
Obezita patří mezi nejčastější metabolickou poruchu. Tuková tkáň nepředstavuje pouhý zdroj a rezervu energie v organizmu, termální izolaci nebo mechanickou ochranu. Jedná se o aktivní metabolický orgán produkující řadu proteinů – takzvaných adipokinů, mezi které patří různé cytokiny, chemokiny a hormonům podobné faktory regulující fyziologické a patologické procesy metabolismu, imunity a zánětu. Vztah mezi obezitou a progresí osteoartrózy není novinkou. V posledních letech přibývá důkazů o vlivu leptinu nejen na regulaci příjmu potravy, ale také na degradaci kloubní chrupavky. Leptin byl popsán jako první adipokin již v roce 1994 a lze ho považovat za potenciální molekulární podstatu asociace mezi obezitou a osteoartrózou. Diskutována bude také otázka vedlejšího projevu biologické terapie ve smyslu zvýšení indexu tělesné hmotnosti revmatických pacientů a možného ochranného významu nadváhy na strukturální progresi revmatoidní artritidy. Podrobně bude dále představen význam dalších adipokinů, zejména resistinu, adiponectinu a visfatinu v patogenezi autoimunity a zánětu u revmatických onemocněních.
17. Metabolický syndrom u zánětlivých revmatických nemocí
Hrnčíř Zb.
2. interní klinika LF UK a FN Hradec Králové
Východiska: Metabolický syndrom (MS) je soubor klinických a laboratorních ukazatelů výrazně zvýšeného rizika aterosklerózy a kardiovaskulárního onemocnění (KVO). Zánětlivá revmatická onemocnění, zvl. revmatoidní artritida (RA) a systémový lupus erytematodes (SLE) jsou prokazatelně nezávislým rizikovým faktorem aterosklerózy a KVO. MS u RA, SLE a popř. i dalších zánětlivých revmatických nemocí dále zvyšuje riziko aterosklerózy a KVO. Cílem sdělení je upozornit na některé výsledky klinického výzkumu s významem pro každodenní praxi revmatologických ordinací.
Metodika: 1. Klasifikace MS podle SZO zahrnuje abdominální obezitu (obvod pasu 94 cm u mužů a 80 cm u žen) a 2 ze 4 dalších deskriptorů: TAG nad 1,7 mmol/l nebo léčba, HDL-Ch pod 1,0 mmol/l u mužů a pod 1,3 mmol/l u žen, TK 135/85 nebo léčba a glykemie na lačno 5,6 mmol/l. Někteří badatelé používají starší definici ATP III s volnějšími požadavky na obvod pasu, glykemii na lačno a odlišným způsobem celkového hodnocení. 2. U RA žen je signifikantně častější zjevná i subklinická hypotyreóza, a tato kombinace znamená signifikantně větší riziko KVO. MS je signifikantně častější u RA s hypotyreózou nebo cukrovkou. Sledování IMT (Intima-Media-Thickness) via UZ karotid u časné RA ukázalo aterogenezu detekující signifikantní vzestup IMT už za 18 měsíců od stanovení diagnózy. 3) U SLE byl zjištěn MS (dle definice SZO) v 32,4 % při 10,9 % frekvenci u kontrol (p 0,001), signifikantně častěji u SLE se zvýšenou hodnotou CRP. Obezita a inzulinová rezistence byly zkoumány i na myším modelu SLE. Podle některých výstupů je frekvence MS u SLE a RA obdobná, v obou případech s pozitivní asociací ke kouření.
Závěr: Aktuální téma MS u RA, SLE a dalších zánětlivých revmatických nemocí povede nepochybně k explozi výstupů v odborné literatuře. Ordinující revmatolog by měl zachytit tento trend a umět využívat informační zisk v sofistikované péči o své nemocné.
18. ABSOLUTNÍ RIZIKO ZLOMENINY (FRAX) U NEMOCNÝCH S RECENTNÍ ZLOMENINOU PROXIMÁLNÍHO FEMURU A U KONTROLNÍ SKUPINY OSOB BEZ TÉTO ZLOMENINY:
KDY LÉČIT OSTEOPORÓZU?
Štěpán J.
Revmatologický ústav Praha
Měření množství kostního minerálu (BMD), které se osvědčilo při osteodenzitometrické diagnostice osteoporózy podle doporučení W.H.O. z roku 1994, nepostačuje pro klinické rozhodování koho a jak léčit. Přesnější posouzení individuálního rizika zlomeniny by bylo možné na základě hodnocení nejen množství, ale také kvality kostní hmoty a jejího uspořádání. Předpokladem toho jsou však nákladná, technicky náročná a často invazivní vyšetření. V praxi výhodnějším kompromisem je rozhodování o vhodnosti léčby podle absolutního rizika zlomeniny u daného pacienta na základě změřené hodnoty BMD a klinicky dostupných faktorů, nezávislých na BMD (pohlaví, věk, prodělaná zlomenina, zlomenina kyčle u rodičů, užívání glukokortikoidů, revmatoidní artritis, sekundární příčiny osteoporózy, kouření, abusus alkoholu, případně zrychlený úbytek kostní hmoty). W.H.O. v r. 2007 doporučila algoritmus odhadu individuálního rizika prodělat zlomenin během dalších 10 let (FRAX). Britská odborná společnost uvedla prahové hodnoty tohoto rizika, kdy je léčba vhodná. Uvedený algoritmus však nezohledňuje riziko pádů, které jsou asociovány s 95% všech zlomenin proximálního femoru.
Cílem naší studie bylo ověřit naši hypotézu, že výpověď FRAX nepostačuje pro stanovení prahu rizika, kdy má být pacient léčen.
Metody: Vyšetřili jsme rizikové faktory u 159 žen, které si právě zlomily proximální femur (věk 78 ± 9 let, prevalentní zlomenina u 58 %, zlomenina kyčle v rod. anamnéze 12 %) a vypočetli jsme hodnotu FRAX před recentní frakturou. Kontrolní skupinu tvořilo 150 žen bez zlomeniny kyčle (věk 76 ± 15 let, prevalentní zlomenina u 58 %, zlomenina kyčle v rod. anamnéze 11 %).
Výsledky: Pouze 2 % žen v obou skupinách bylo zatím léčeno antiresorpčními léky, pouze 8 % žen dostávalo suplementaci vitaminem D a kalciem. Více než 90 % žen mělo insuficienci nebo deficienci vitaminu D. Hodnota FRAX pro zlomeninu v oblasti kyčle i pro jakoukoli osteoporotickou frakturu byla srovnatelná ve skupině žen s právě prodělanou frakturou proximálního femoru i v kontrolní skupině. Více než třetina žen s prodělanou zlomeninou kyčle by nesplnila doporučená kritéria pro zahájení léčby byť i nejlevnějšími přípravky.
Souhrn: Algoritmus FRAX nepostačuje pro identifikaci osob s vysokým rizikem zlomeniny v oblasti kyčle. Je nezbytné současně posuzovat riziko pádu. Léčba by měla být zahajována ve všech věkových kategoriích při hodnotě FRAX pro zlomeninu kyčle převyšující %. Léčen by měl být každý pacient s nízko-traumatickou zlomeninou kyčle.
19. GOTFRIEDOVA PC.C.P. DLAHA V TERAPII TROCHANTERICKÝCH ZLOMENIN
Skládal M., Pink M., Lisý M.
Ortopedické oddělení, Nemocnice Třebíč
Autoři ve svém sdělení hodnotí soubor pacientů operovaných na Ortopedickém oddělení Nemocnice Třebíč Gotfriedovou PC.C.P. dlahou. Tento nový implantát používáme na našem pracovišti od roku 2004. V souboru hodnocených pacientů je doba sledování minimálně jeden rok. V období 11/2004 – 6/2007 jsme touto technikou ošetřili 78 pacientů. Převládaly ženy, průměrný věk pacienta v souboru byl 74,5 let.
Indikací k použití PC.C.P. dlahy jsou trochanterické zlomeniny, vyjma patologických. Autoři hodnotí přínos užití Gotfriedovy PC.C.P. Operační technika umožňuje minimalizovat operační trauma, poskytuje dostatečnou stabilitu k zatížení poraněné končetiny a v pooperačním režimu tak lze časně mobilizovat pacienta.
20. FRAKTURA PROXIMÁLNÍHO FEMURU – ANALÝZA NEMOCNÝCH BĚHEM HOSPITALIZACE
Kučerová I.
Nemocnice České Budějovice a.s., Interní oddělení – Osteocentrum
Péče o nemocné po prodělané fraktuře proximálního femuru je náročná po stránce léčebné, ošetřovatelské i rehabilitační. U většiny těchto nemocných ale v praxi nenajdeme individuální zhodnocení rizika fraktury a nemocným není nasazena adekvátní léčba osteoporózy. Přitom riziko další fraktury je až 6krát vyšší a prevalence nedostatku D vitaminu se pohybuje mezi 50–80 %. Lze předpokládat dle literárních údajů, že u 40–50 % těchto nemocných denzitometricky prokážeme osteoporózu. V naší práci jsme sledovali nemocné starší 50 let, kteří byli hospitalizováni pro frakturu proximálního femuru v roce 2006–2007 (57 mužů a 139 žen). Největší počet nemocných byl ve skupině 80–89 let (51,5 %). Cílem našeho sdělení je stručně shrnout výsledky zaměřené na profil nemocných (diagnózy, polypragmazie), na léčbu osteoporózy a na sociální problematiku. Během hospitalizace zemřelo celkem 16 % nemocných, 17 % nemocných zůstalo v ústavech sociální péče (11 % ležících ) a 67 % nemocných bylo propuštěno do domácí péče (58 % schopno chůze s ortopedickými pomůckami). Průměrný počet léků/ den byl nejvyšší ve věkové skupině 80–89 let (6,3 ± 2). Pro osteoporózu před frakturou bylo léčeno 3 % nemocných. Během hospitalizace bylo denzitometricky vyšetřeno 5,3 % nemocných (4,2 % mělo prokázáno pásmo osteoporózy). 4,8 % nemocných dostalo při propuštění kalcium a D vitamin, 1 % samotný D vitamin a 1,2 % antiresorpční léčbu. Všichni byli ve věku nad 70 let.
Závěr: U hospitalizovaných byla zaměřena péče hlavně na fyzioterapii a časnou mobilizaci. Vzhledem k nízkému počtu denzitometrických vyšetření byla antiresorpční léčba indikována u 1,2 % nemocných. Finančně nenáročná léčba kalciem a D vitaminem byla doporučena v ambulantní péči u 4,8 % nemocných. Je úkolem ambulantních ošetřujících lékařů po stabilizaci stavu zhodnotit rizikové faktory a perspektivní mobilní nemocné odeslat k osteologickému vyšetření.
21. OSTEOPORÓZA A REHABILITACE
Votavová M., Jarošová H.
Revmatologický ústav Praha
Osteoporóza je systémové metabolické onemocnění skeletu charakterizované poruchou mechanické odolnosti kosti. Mechanická odolnost kosti je podmíněna především množstvím a kvalitou kostního minerálu a organické matrix, a mikroarchitekturou kosti. Nerovnováha či úbytek těchto komponent může vést ke zvýšenému riziku zlomenin i při nevelké zátěži. Ke klasifikaci se užívají kritéria z pohledu etiopatogeneze nebo denzitometrická klasifikace. Po stanovení diagnózy a dle výsledků potřebných vyšetření stanoví ošetřující lékař další léčebné postupy. Hlavním úkolem fyzioterapie by měla být prevence, tedy spoluúčast při zajištění vyšší mechanické odolnosti kosti. V případě vzniku komplikací onemocnění (osteoporotických fraktur) je rozdílný přístup v akutním stadiu a po zhojení fraktury. Základní léčba je traumatologicko-ortopedická, neboť jde o trauma na patologickém terénu. Prodělaná zlomenina znamená výrazně zvýšené riziko další zlomeniny. Kompresivní zlomeniny obratlů jsou spojeny se zvýšenou morbiditou i mortalitou. Mortalita během prvního roku po prodělané zlomenině kyčle se pohybuje kolem 20 %. Nemocní, kteří přežijí 1. rok po zlomenině kyčle jsou ve 2/3 případů odkázáni na pomůcky a pomoc okolí, polovina zůstává imobilizována nebo odkázána na ústavní péči. Dominantní postavení v rehabilitaci zaujímá léčebná tělesná výchova, jak již bylo zdůrazněno individuální, „ušitá pacientovi na míru“, vycházející z podrobné znalosti klinického stavu a v případě zlomenin z doporučení ortopeda či traumatologa. Analgeticky lze užít i fyzikální léčbu. Pro každého pacienta by měl být stanoven krátkodobý a dlouhodobý léčebný plán. V případě vysokého rizika jsou diskutována protektivní opatření – např. hipprotektory. Pravidelná vhodně zvolená tělesná aktivita by měla být u těchto pacientů běžnou součástí života.
Byly vydány guidelines k prevenci a léčbě glukokortikoidy indukovanou osteoporózu u pacientů s revmatickými nemocemi (Růžičková, Bayer, Pavelka, Palička, 2004). Guidelines pro diagnostiku a terapii postmenopauzální osteoporózy žen (Rosa, 2007). Diagnostický a léčebný guidelines pro léčbu osteoporózy pro všeobecné praktické lékaře (Blahoš, Palička, Býma, 2006). Doporučené postupy s celoevropskou platností byly publikovány nedávno (Kanis et al., 2008).
22. VLIV ABATACEPTU NA ZPOMALENÍ RENTGENOVÉ PROGRESE REVMATOIDNÍ ARTRITIDY
Pavelka K.
Revmatologický ústav Praha
Cílem dnešní léčby RA je navození klinické remise, inhibice rentgenové progrese (respektive stavu non-progrese) a udržení normální funkce. Nejefektivnějším cílem k dosažení těchto cílů je optimalizace léčených postupů ve smyslu zahájení intenzivní, kombinované léčby biologického léku s metotrexátem u časné revmatoidní artritidy. Tento postup by měl být aplikován především u pacientů se silně aktivní RA, při přítomnosti ukazatelů špatné prognózy a při trvání < 3 měsíce.
Abatacept je biologický lék RA nové generace, který se liší od TNF blokujících léků mechanismem účinku. Je blokátorem kostimulace aktivace T lymfocytů, které hrají klíčovou úlohu jak u časné, tak i etablované RA. Řada klinických, randomizovaných, dvojslepých studií fáze I-III potvrdila výraznou účinnost abataceptu jak u MTX selhaných pacientů (I linie biologické léčby), tak u TNF selhání (II linie biologické léčby).
Pacienti zařazeni do studie AIM, byli hodnoceni z hlediska rentgenové progrese po 1, 2 a 3 letech. K hodnocení bylo použito Gennantem modifikované Sharpovo skóre. Pacienti léčení abataceptem vykazovali stoupající míru redukce progrese, když progrese v jednotlivých letech byla 0,89; 0,43 a 0,25 celkového Sharpova skóre. Stoupající počet pacientů v průběhu léčby vůbec neprogredoval.
Tento významný strukturální efekt adalimumabu je možné vysvětlit i nově popsaným přímým vlivem CTLA-4 na inhibici aktivace osteoklastů.
23. DLOUHODOBÁ LÉČBA ANKYLOZUJÍCÍ SPONDYLITIDY INFLIXIMABEM
Pavelka K., Forejtová Š., Štolfa J.
Revmatologický ústav Praha
Terapie ankylozující spondylitidy (AS) infliximabem je jedinou dostupnou účinnou léčbou AS, která je účinná jak na axiální, ale i na periferní kloubní syndrom, dále ovlivňuje entezitidy a snižuje i výskyt extraskeletálních komplikací. Pravděpodobné je i snížení kardiovaskulární mortality. Účinnost infliximabu potvrdily důležité randomizované, dvojslepé studie v délce až 12 měsíců. Studie pak byly prodlouženy v otevřených extenzích. Výsledky 7leté extenze ukazují, že po 7 letech je až 32 % nemocných s AS léčených infliximabem v parciální remisi a kritérium odpovědi ASAS 20 splňuje 83 % pacientů.
V českém registru ATTRA bylo léčeno infliximabem (> 1 rok) celkem 153 pacientů. Hodnoty BASDAI před léčbou a po třech letech jsou 6,9 ± 1,5 vs. 3,6 ± 2,8, CRP před léčbou 30,4 ± 24,2 mg/l vs. 9,0 ± 20,3 mg/l, sedimentace erytrocytů před léčbou 41,2 ± 21,8 mm/h vs. 11,7 ± 13,9 mm/h, BASDAI < 45,4 % před léčbou vs. 56,3 % po léčbě. Adherence k léčbě byla u AS signifikantně vyšší než u revmatoidní artritidy.
Závěr: Infliximab je dlouhodobě účinný u AS v běžné klinické praxi a adherence k léčbě je vyšší než u RA.
Tato studie byla podpořena Výzkumnými záměry MZ č. MZO 000 00023728
24. VÝZNAM POMĚRU RANKL/OPG U PRIMÁRNÍ A SEKUNDÁRNÍ OSTEOPORÓZY
Skácelová S.
Revmatologický ústav Praha
Diferenciace, proliferace a maturace osteoklastů je regulována především systémem RANKL/RANK/OPG. Osteo-blasty secernují do kostního mikroprostředí cytokiny RANKL (ligand pro receptor aktivující nukleární faktor kappa B) a OPG (osteoprotegerin). Osteoklasty a jejich prekurzory exprimují RANK (receptor aktivující nukleární faktor kappa B). Po vazbě RANKL-RANK dochází k diferenciaci osteoklastů z prekurzorových buněk, k aktivaci zralých osteoklastů a následné akceleraci kostní resorpce. OPG je vazebným receptorem pro RANKL, který je rovněž schopen vazby na RANK a na principu kompetitivní inhibice blokuje vazbu RANKL-RANK. Poměr RANKL/OPG v kostním mikroprostředí je tedy určujícím pro míru stimulace osteoklastogeneze a tedy i kostní resorpce. Působení různých signálů ovlivňujících kostní remodelaci (hormony, prozánětlivé cytokiny, růstové faktory, prostaglandiny) je zprostředkováno právě tímto univerzálním cytokinovým systémem. Zvýšený poměr RANKL/OPG je charakteristickým rysem patogeneze kostní ztráty, která je důsledkem zvýšené kostní resorpce. Exprese RANKL osteoblasty je zvýšena při deficitu estrogenů u postmenopauzální osteoporózy. U nemocných revmatoidní artritidou je RANKL exprimován ve zvýšené míře osteoblasty, ale také aktivovanými T-lymfocyty a synoviocyty. Blokáda RANKL pomocí monoklonální protilátky vede k poklesu poměru RANKL/OPG a zabraňuje kostní ztrátě u postmenopauzální osteoporózy či vzniku erozí u revmatoidní artritidy (1). Denosumab je monoklonální, plně humánní protilátka proti RANKL, jejíž podávání (60 mg s.c. v intervalu 6 měsíců) vedlo k signifikantnímu vzestupu BMD, poklesu kostního obratu a redukci rizika vertebrálních i nevertebrálních fraktur u nemocných postmenopauzální osteo-porózou (2, 3).
Literatura u autora
25. CO NOVÉHO V PROBLEMATICE PLICNÍ HYPERTENZE U SYSTÉMOVÝCH ONEMOCNĚNÍ POJIVA
Jansa P., Bečvář R.1
Centrum pro plicní hypertenzi, II. interní klinika Všeobecné fakultní nemocnice a 1. LF UK, Praha, 1Revmatologický ústav, Praha
Plicní hypertenze je syndrom charakterizovaný zvýšením středního tlaku v plicnici nad 25 mmHg v klidu nebo nad 30 mmHg při zátěži a současně zvýšením plicní cévní rezistence nad 3 WU (Woodovy jednotky). Etiologie plicní hypertenze u systémových onemocnění pojiva je heterogenní. Příčinou může být intersticiální plicní fibróza s hypoxemií, dále pasivní přenos elevovaných tlaků z levého srdce při diastolické dysfunkci levé komory nebo tromboembolická obstrukce plicních cév při hyperkoagulačním stavu. K nejzávažnějším patří plicní arteriální hypertenze (PAH). Ta komplikuje systémovou sklerodermii asi ve 12 % případů, u ostatních systémových onemocnění pojiva se vyskytuje ve 2 až 10 % případů.
V roce 2007 jsme se pokusili stanovit výskyt PAH u systémové sklerodermie v ČR. Screeningovou transtorakální echokardiografií bylo vyšetřeno 203 pacientů se systémovou sklerodermií. Z analýzy byli vyloučeni nemocní s významným ventilačním postižením a srdečním onemocněním. Echokardiografické známky plicní hypertenze při skríningovém vyšetření byly přítomny u 15 nemocných, diagnóza PAH byla katetrizačně potvrzena v 5 případech. Odhadnutá prevalence PAH při systémové sklerodermii v ČR je 7,1 %.
Léčbu PAH u systémových onemocnění pojiva lze dělit na léčbu konvenční, specifickou léčbu základního onemocnění (její efekt lze očekávat jen u menšiny nemocných, prakticky nikdy u pacientů se systémovou sklerodermií) a specifickou léčbu PAH (prostanoidy, antagonisté receptorů pro endothelin a inhibitory fosfodiesterázy 5), která umožňuje nejen zmírnit symptomy onemocnění, ovlivnit hemodynamické parametry ale také zlepšit kvalitu života a prognózu nemocných. Největší výzvou však nadále zůstává časná identifikace nemocných s komplikující plicní hypertenzí. Tato strategie umožňuje zahájení léčby v méně pokročilých a prognosticky perspektivnějších stadiích onemocnění.
26. NOVÉ TRENDY V LÉČBĚ SLE
Horák P., Skácelová M., Ciferská H., Smržová A.,
Zadražil J.
III. interní klinika, LF UP a FN Olomouc
Systémový lupus erythematodes (SLE) i přes nesporný pokrok v možnostech farmakoterapie představuje léčebnou výzvu. Mezi léčenými nemocnými je značný počet nedostatečných léčebných odpovědí, situaci komplikují také časté relapsy aktivity choroby, rozvoj orgánových manifestací, projevy antifosfolipidového syndromu a projevy toxicity běžně užívaných léčiv. Snaha o zavedení nových léčiv a léčebných postupů s lepším poměrem účinnosti a bezpečnosti je proto zcela legitimní.
Mezi nefarmakologickými postupy představuje plazmaferéza zákrok, který bývá indikován v případě rychle progredující glomerulonefritidy či při rozvíjejícím se hemolyticko-uremickém syndromu. Plazmaferézu lze synchronizovat s podáním pulzů cyklofosfamidu. Ostatní nefarmakologické postupy jsou spíše experimentální, ať už se jedná o transplantaci hemopoetických buněk, fotochemoterapii či imunoadsorpci s C1q složkou komplementu.
Reverzní inhibitor enzymu inosin monofosfát dehydrogenázy mykofenolat mofetil se postupně stává součástí standardních léčebných schémat zejména u nemocných s lupusovou nefritidou. Představuje jistou alternativu podání cyklofosfamidu u lupusové nefritidy III.–IV. stupně, podává se perorálně v dávce 1–3 g denně. Jeho efekt lze využít i u léčebně rezistentní formy choroby.
Úspěšným směrem v léčbě SLE jsou biologické léky zaměřené na buď přímo na B-lymfocyty-rituximab (anti CD20) a epratuzumab (anti CD22), nebo ovlivňující B lymfocyty prostřednictvím interakcí molekul Blyss a April – monoklonální protilátka proti Blyss (belimumab), solubilní receptor vážící Blyss a April (atacicept), solubilní receptor vážící pouze Blyss (BAFF-R Ig) či anti-Blyss peptibody.
Mezi dalšími potenciální směry v léčbě SLE patří indukce autotolerance (DNAsa, LJP 394,), ovlivnění komplementového systému (anti C5b), cytokinové sítě (anti IL10, IL4, anti IL6R), (NF)κB pomocí map-kináz či janus-kináz či blokáda kostimulačních molekul (CD40/CD40L-riplizumab, CTLA-4 Ig - abatacept). Odpověď na otázku, která s uvedených látek se nakonec stane součástí léčebné palety SLE, přinesou výsledky klinických studií.
27. PROBLEMATIKA REHABILITACE PO ALOPLASTIKÁCH RAMENNÍCH KLOUBŮ U REVMATICKÝCH PACIENTŮ
Javůrková M.
Revmatologický ústav Praha
Náhrada ramenního kloubu je dnes relativně běžnou operací na řadě ortopedických a traumatologických pracovišť. Užívá se nejen při resekcích proximálního konce humeru pro tumorózní afekce, v traumatologických indikacích, ale stále více i při destrukcích ramenního kloubu při chronických degenerativních i zánětlivých onemocněních.
Postižení ramenního kloubu u revmatoidní artritidy není nijak vzácné. Po 15 letech trvání má ramenní klouby postižena polovina nemocných a asi 25 % má těžké destruktivní změny kloubů.
V mé prezentaci bych ráda ukázala, že stavy po operacích aloplastik ramenních kloubů u revmatických pacientů můžeme efektivně léčit konzervativně, a to pravidelným a pozorným cvičením, které po nácviku zvládne každý pacient. Dále může tato práce sloužit jako teoretický podklad pro následnou praktickou práci s revmatickými pacienty po operacích aloplastik ramenních kloubů.
Pečlivá a individuálně sestavená fyzioterapeutická péče u pacientů po těchto operacích může zcela jednoznačně urychlit a zkvalitnit proces dosažení dobrých funkčních výsledků a tudíž usnadnit pacientův návrat do běžného života.
28. APLIKACE BIOLOGICKÝCH LÉKU U ČASNÉ RA – STUDIE COMET
Pavelková A.
Revmatologický ústav Praha
Revmatoidní artritida je zánětlivé revmatické onemocnění, které postihuje asi 1% populace. Ve svém důsledku vede často k vývoji funkčního postižení a disability. Cílem bazální terapie dosud bylo potlačit laboratorní a klinickou aktivitu a zabránit rentgenové progresi onemocnění. Jelikož maximum rentgenových změn vzniká v časné fázi onemocnění, nejčastěji v prvních dvou letech trvání choroby, je třeba zahájit bazální terapii co nejdříve.
S nástupem biologické léčby (anti TNF terapie) jsou však cíle terapie ještě odvážnější. Účinnost a bezpečnost biologické léčby, stejně tak i vliv na rentgenovou progresi, byla prokázána již v řadě klinických studií.
V poslední době byla provedena studie COMET, která jako první a zatím jediná měla za primární cíl dosažení remise u pacientů s revmatoidní artritidou (DAS28 < 2,6), léčených po dobu 52 týdnů kombinací etanercept + metotrexát (ETN + MTX). Do studie bylo zařazeno 542 pacientů s aktivní časnou (do 2 let trvání) revmatoidní artritidou. V týdnu 52 dosáhlo 50 % pacientů léčených touto kombinací remise, oproti 28 % pacientů léčených samotným methotrexatem (p < 0,001), nízké aktivity (DAS28 ≤ 3,2) dosáhlo 64 % pacientů léčených kombinací etanercept + metotrexát oproti 41 % pacientů léčených monoterapií metotrexátem. Z hodnocení rentgenové progrese vyplývá, že 79,7 % pacientů léčených kombinací ETN + MTX neprogredovalo rentgenově (Totální Sharpovo skóre – TSS ≤ 0,05). Současně tato studie hodnotila i pracovní výkonnost a pracovní neschopnost i funkci (HAQ dotazník). V hodnocení pracovní neschopnosti dosahuje významně nižších hodnot kombinace etanercept + metotrexát již v týdnu 12, tento rozdíl se zvětšuje až do týdne 52. Normální funkce (HAQ ≤ 0,5) dosáhlo v týdnu 52 55% pacientů léčených kombinací ETN + MTX oproti 39 % pacientů léčených monoterapií MTX).
Závěr: K zabránění vzniku funkčního postižení u revmatoidní artritidy je třeba časné zahájení basální terapie běžnými DMARDs či účinnějšími biologickými (zejména anti TNF) léky. Studie COMET ukázala možnost dosažení remise u pacientů s časnou revmatoidní artritidou léčených kombinací etanercept + metotrexát i významný vliv na snížení pracovní neschopnosti u těchto pacientů. Reálným cílem basální terapie revmatoidní artritidy se stává remise.
29. REMISE JAKO CÍL LÉČBY
Vencovský J.
Revmatologický ústav Praha
Cílem terapie revmatoidní artritidy je remise či udržení dlouhodobé nízké aktivity. K dosažení tohoto cíle máme k dispozici nástroje, kterými jsou konvenční bazální léky, jejich kombinace, a biologické preparáty. Postupy, které můžeme použít zahrnují časnou léčbu, intenzivní využití léků, pravidelné měření aktivity a snahu o maximální snížení této aktivity při použití flexibilního přístupu, který zahrnuje především výměnu preparátu při jeho suboptimálním účinku. Několik klinických hodnocení prokázalo větší účinnost kombinace léčby metotrexátem společně s preparátem neutralizujícím TNF, ve srovnání s použitím samotného anti-TNF přístupu. V klinickém hodnocení COMET bylo zjišťováno, jak může časná terapie biologickým lékem ovlivnit navození remise ve srovnání s časnou terapií samostatným metotrexátem. Pacienti v COMET měli trvání RA kratší než 2 roky, DAS28 více než 3,2, FW nad 28 nebo CRP nad 20 mg/l a nebyli dosud léčeni metotrexátem. Po dobu 52 týdnů dostávali všichni metotrexát, přičemž část byla léčena navíc etanerceptem a část placebem. Primárním cílem hodnocení bylo dosažení remise podle EULAR kritérií, manifestované poklesem DAS28 pod 2,6. Hodnocena byla i RTG progrese. Zásadním výsledkem bylo navození remise u 50 % nemocných ve skupině s etanerceptem, což bylo signifikantně více než u 28% pacientů ve skupině se samostatným metotrexátem. RTG progrese dle modifikovaného Sharpova skóre byla pouze 0,27 při použití etanerceptu a 2,44 při léčbě samotným metotrexátem. Významně více pacientů dosáhlo také normální funkční schopnosti hodnocené podle HAQ s hodnotou menší než 0,5. COMET tedy ukazuje, že remise je reálným cílem pro 50% pacientů s RA, kteří jsou léčeni poměrně časně v prvních 24 měsících choroby a že je možné prakticky zastavit vývoj destruktivního poškození a zabránit tak vývoji později nereparovatelných kloubních změn.
30. ETANERCEPT V LÉČBĚ ANKYLOZUJÍCÍ SPONDYLITIDY
Pavelka K.
Revmatologický ústav Praha
Ankylozující spondylitida (AS) je časté onemocnění (0,5–1 % populace), které postihuje především mladé nemocné u kterých vyvolává stejný stupeň disability jako revmatoidní artritida, u 47 % vede v ČR k invaliditě. Do současné doby nebyla dostupná účinná léčba. Anti TNF terapie představuje významný pokrok v léčbě AS. Účinnost etanerceptu byla dokumentována v řadě randomizovaných, klinických studiích a v jejich extenzích. Poměrně málo je známa z klinické praxe, např. z kohortových, observačních studií, či registrů.
Do registru ATTRA bylo zařazeno celkem 527 pacientů s AS, z nichž 310 je léčeno nejméně 1 rok. K analýze byla data 153 pacientů s infliximabem, 127 pacientů s etanerceptem a 30 s adalimumabem.
BASDAI před zahájením léčby etanerceptem bylo 6,4 ± 1,7 a pokleslo na finální (po 3 letech léčby) 2,4 ± 2,1, CRP pokleslo z průměrných 31,6 ± 30,2 na finální 5,8 ± 8,6, sedimentace z 39,3 ± 24,3 mm/h na finální 12,1 mm/h. Podíl pacientů s BASDAI < 4 před zahájením léčby byl 11,1 %, na konci léčby 81,9 %. Setrvání na léčbě bylo po etanerceptu delší než po infliximabu (p < 0,01). Setrvání na léčbě bylo delší u AS než u revmatoidní artritidy.
Závěry: Etanercept je dlouhodobě vysoce účinný u AS. Adherence k léčbě u AS je lepší než u RA. Adherence k léčbě je lepší u etanerceptu než u infliximabu.
Pátek 9. 1. 2009
31. KOINCIDENCE DERMATOMYOZITIDY A AXIÁLNÍ FORMY PSA
Mann H.
Revmatologický ústav Praha
Dermatomyozitida je vzácné autoimunitně podmíněné onemocnění, které se může rozvinout i jako součást překryvného syndromu s jiným systémovým onemocněním pojiva. Prevalence psoriázy v populaci je odhadována na 1–3% a vzhledem k obdobné distribuci kožních projevů, bývá toto onemocnění někdy zdrojem diagnostických omylů u nemocných s dermatomyozitidou. U některých pacientů mohou být přítomna obě onemocnění zároveň (1). Psoriáza i myozitida mohou být projevem nežádoucích účinků léčby blokátory TNF alfa (2, 3).
57letému nemocnému s třicetiletou anamnézou axiální formy psoriatické artritidy a opakovaných uveitid, byl po selhání léčby chorobu modifikujícími léčivy nasazen adalimumab. Anti TNF alfa léčba byla ukončena po 11 měsících pro infekční komplikace (komunitně získaná pneumonie). U pacienta se postupně rozvíjela svalová slabost, která výrazně progredovala v průběhu léčby adalimumabem. Nově se objevil exanthem charakteristický pro dermatomyozitidu. Svalové enzymy nebyly výrazně zvýšené, na MRI byla prokázána atrofie bez aktivního zánětlivého infiltrátu, svalová biopsie byla konzistentní s diagnózou dermatomyozitidy. Imunologické vyšetření prokázalo pozitivitu ANA (anti Ro, anti histony), pro myozitidu specifické autoprotilátky nebyly přítomny. Maligní onemocnění u pacienta zjištěno nebylo. Byla zahájena léčba kombinací glukokortikoidů s metotrexátem.
Literatura u autora
32. KOMPLIKOVANÝ PRŮBĚH WEGENEROVY GRANULOMATÓZY U MLADÉ ŽENY
Hviščová K.
Revmatologický ústav Praha
Wegenerova granulomatóza je nekrotizující vaskulitida postihující malé cévy, která charakteristickým způsobem postihuje horní i dolní dýchací cesty a ledviny. Onemocnění se vyskytuje častěji u mužů, obvykle středního věku, etiologie je neznámá a klinický obraz různorodý.
Časté jsou nespecifické celkové příznaky – únava, hmotnostní úbytek, febrilie. Typické je postižení horních dýchacích cest projevující se epistaxí, chronickou rýmou, sinusitidou. Může dojít i k ulceraci sliznice nosní někdy až s destrukcí nosní chrupavky s obrazem typického „sedlovitého nosu“. Postižení dolních dýchacích cest s tvorbou plicních granulomů s centrálním rozpadem se projevuje kašlem, hemoptýzou či bolestí na hrudi. Dále jsou časté chronické záněty středouší a převodní porucha sluchu. Postižení ledvin glomerulonefritidou nepatří mezi úvodní symptomy, ale může pak vést k renálnímu selhání a to v případě fulminantního průběhu i ve velmi krátkém časovém horizontu dní až týdnů. Méně časté je postižení periferních nervů ve formě mononeuritis multiplex a také postižení hlavových nervů s příslušnou symptomatologií při lokalizaci granulomů na baze lební a v retrofaryngeální oblasti. Pestrá je oční symptomatologie, přítomná může být konjunktivitida, episkleritida, korneální vředy, vaskulitida optického nervu či okluze retinálních tepen. Postižení gastrointestinálního traktu se projevuje průjmy, krvácením do GIT, bolestmi břicha a endoskopicky lze prokázat hemoragie až ulcerace, které mohou vést i k perforaci střeva.
Klinické projevy nemusí být na začátku nemoci plně vyjádřeny a diagnóza může být proto velmi obtížná.
Kazuistika popisuje konkrétní případ mladé ženy, u které bylo v úvodu nemoci prokázáno jen limitované postižení v ORL oblasti. Postupně se pak vyvinulo i postižení plicní, kde v rámci diferenciální diagnózy byla potřeba zvážit i možnost jiných plicních afekcí např. tuberkulózy jako možného následku dlouhodobé imunosupresivní léčby. V závěru jsou zvažovány terapeutické možnosti, které nám přináší současný rozvoj nových biologických léků.
33. RYCHLÝ ROZVOJ OSTEOPORÓZY U PACIENTKY S NOVĚ DIAGNOSTIKOVANÝM SLE
Tomčík M., Forejtová Š.
Revmatologický ústav Praha
V průběhu posledních několika desítek let bylo dosaženo významného snížení mortality u pacientů se systémovým lupusem (SLE). V poslední době se pozornost soustředí na prevenci komorbidit spojených s touto nemocí a její léčbou. Mezi důležitou komorbiditu u SLE, které se dá předcházet, patří i osteoporóza. Práce z posledních let potvrdily zvýšené riziko osteoporózy a zlomenin u pacientů se SLE oproti zdravé populaci. Mezi potenciální mechanismy ztráty kostní hmoty patří jednak faktory pro nemoc specifické (indukce prozánětlivých cytokinů podporujících kostní resorpci, postižení ledvin a endokrinní faktory, chronická artritida a s ní spojená snížená fyzická aktivita), jednak i faktory spojené s léčbou onemocnění (vyhýbání se slunečnímu záření s následným nedostatkem vitaminu D, vedlejší účinky léčby glukokortikoidy, imunosupresivní léčby a chronické antikoagulace).
Prezentujeme zde případ rychlého rozvoje osteoporózy s četnými kompresivními frakturami u postmenopauzální pacientky s nově diagnostikovaným SLE.
34. OMEZENÝ VÝZNAM PROCALCITONINU V ODLIŠENÍ SEPTICKÉHO STAVU OD EXACERBACE AUTOIMUNITNÍHO ONEMOCNĚNÍ
Dejmková H., Šléglová O., Pavelka K., Uhrová J.1
Revmatologický ústav Praha, 1Ústav klinické biochemie
a laboratorní diagnostiky VFN, Praha
Závažný diagnostický problém představuje odlišení aktivity základního autoimunitního procesu od komplikující bakteriální či mykotické infekce. Záměna těchto dvou stavu může mít pro nemocného fatální důsledky. Imunosupresivní léčba vede spolu s imunologickými změnami provázejícími základní onemocnění k výrazné náchylnosti k infekci. Infekční komplikace SLE se staly například v posledních 10 letech vedoucí příčinou smrti nemocných s SLE a podílí se 30–50 % na morbiditě a mortalitě nemocných (2–4). Odlišit, zda zhoršení klinického stavu souvisí se vzplanutím základní choroby, s infekcí nebo je podmíněno přítomností obou faktorů, je obtížné. Horečka může provázet jak aktivitu autoimunitního onemocnění, tak komplikující infekci. Naproti tomu někteří nemocní mohou být při infekční komplikaci afebrilní v důsledku utlumení imunitního (5). Leukocytóza může být přítomna nejen v důsledku infekce, ale i v důsledku léčby vyššími dávkami glukokortikoidů. Vyšší hodnoty C-reaktivního proteinu (CRP), které pravidelně doprovází závažnější bakteriální infekce, bývají přítomny i u neinfekčních procesů v důsledku destruktivních orgánových změn při autoimunitním onemocnění. Předností CRP je vysoká senzitivita, neboť jeho hladina se zvyšuje i při lokalizované infekci.V posledních letech se řada prací zabývá úlohou PCT v diferenciální diagnóze sepse a SARS s rozporuplnými výsledky. Jeho nevýhodou je nízká specifika (8). Přednost PCT spočívá dle literatury ve vysoké specificitě v případě těžké systémové bakteriální infekce. Nevýhodou PCT je naopak nižší senzitivita, neboť u mírnějších nebo lokalizovaných bakteriálních infekcí zůstává jeho hladina nezměněna nebo dochází jen k jejímu mírnému zvýšení. U zdravého člověka je hodnota PCT v séru velmi nízká (do 0,5 μg/l), neboť je uvolňován z místa svého vzniku – z C-buněk štítné žlázy, minimálně. Naopak v případě systémové bakteriální nebo plísňové infekce hladina výrazně stoupne již v prvních hodinách a může dosáhnout mnohonásobného zvýšení. Při lokalizované infekci však nemusí být zvýšení hladiny PCT v séru výrazné, což ovlivňuje negativně senzitivitu vyšetření. Uspokojivou specificitu lze předpokládat i v případě nemocných se SLE, neboť hodnota PCT by neměla být ovlivněna zánětlivým procesem nebakteriální etiologie. Vysoká specificita tohoto vyšetření byla již například popsána u nemocných s akutní bakteriální artritidou, u pooperačních bakteriálních komplikací, v případě horeček nejasného původu a v četných dalších situacích (8–12). Výhoda PCT oproti CRP spočívá v rychlejší kinetice. U nemocných s bakteriální infekcí sérová hodnota PCT rychleji stoupá a naopak po zahájení vhodné antibiotické léčby rychleji klesá než je tomu u CRP(7).
V současné době probíhá v Revmatologickém ústavě grant zabývající se významem PCT v diferenciální diagnóze mezi akutním vzplanutím autoimunitního onemocnění a mezi komplikující bakteriální infekcí. Současný soubor není ještě kompletní a nelze tudíž tuto situaci jednoznačně vyhodnotit. Z dosavadních výsledků se však bohužel zdá, že úlohu PCT v revmatologii nelze přeceňovat. Rádi bychom tento předběžný závěr dokumentovali na 2 kazuistikách.
Literatura u autora
35. REVMATOIDNÍ NEBO PSORIATICKÁ ARTRITIDA? OBTÍŽE V DIFERENCIÁLNÍ DIAGNOSTICE
Vaněčková M., Šedová L.1
II. interní klinika FN Hradec Králové, 1Revmatologický ústav Praha
Revmatoidní artritida (RA) a polyartrikulární forma psoriatické artritidy (PsA) jsou nejčastěji se vyskytující artritidy, které mohou činit obtíže v diferenciální diagnostice polyartritidy. Správné určení diagnózy je zásadní pro další léčbu nemocného a odhad prognózy onemocnění.
Nyní 56letý muž, kuřák, s negativní osobní a rodinnou anamnézou, je od svých 35 let léčen pro psoriázu. Kloubní obtíže se objevily v roce 1996: artritida zápěstí, MTP kloubů, daktylitida a bolesti obou plosek. Byly přítomny známky zánětu, pozitivní revmatoidní faktor (RF) v titru 1 : 1280. RTG kromě suspektních uzurací na pravém sakroiliakálním skloubení byl v normě. Pacientovi byl nasazen Metotrexát (MTX) a Prednison. V dalších letech nebyl sledován a neužíval MTX. V lednu 2006 byl přijat pro zhoršení stavu. Byla zjištěna ankylóza obou zápěstí, artritida drobných ručních kloubů a levého kolenního kloubu, kde byl prokázán septický výpotek. Byly zjištěny vysoké známky zánětu, přetrvávající pozitivita RF/LFT (1 : 1280). Dle RTG došlo k výrazné progresi nálezu: destrukce a subluxace MTP a IP kloubů nohou, ankylóza obou zápěstí, destrukce a subluxace v MCP a PIP kloubech a známky periostální apozice na ulně oboustranně a na distálních článcích prstů rukou. Navíc byla diagnostikována plicní TBC s nutností léčby antituberkulotiky. Po přeléčení byl nasazen Salazopyrin. V roce 2007 byl na RTG zjištěn významný mobilní posun C1/C2, kde na MRI byl přítomen zánětlivý panus v destrukcí dentu. Laboratorně se objevila pozitivita RF ve všech třídách, RF/LFT (1 : 2560), pozitivita protilátek proti citrulinovanému peptidu (anti-CCP) 62,7 U/ml, antigen HLA B27 byl negativní. Pro kloubní aktivitu byl do léčby navrácen MTX. V roce 2008 vzhledem k výrazným bolestem pravého nártu, které přetrvávaly i přes dříve provedenou resekci dle Hoffmanna, bylo rozhodnuto o provedení trojí artrodézy subtalo. Vzhledem k progresi atlanto-axiálního posunu bude však třeba v prvním kroku provést stabilizační operaci krční páteře.
V kazuistice jsme chtěli ukázat obtížnost diferenciální diagnostiky mezi RA a PsA. U nemocného, u kterého byla původně diagnostikovaná PsA jsme na základě klinického průběhu, RTG nálezu (postižení MCP, PIP, zápěstí, krční páteř), pozitivity RF a anti-CCP přehodnotili diagnózu na overlap syndrom RA/PsA. Pro přetrvávající aktivitu kloubního i kožního syndromu bude v budoucnu důležité vyřešit otázku další léčby a to i s ohledem na riziko infekčních komplikací (prodělaná TBC). Chtěli jsme rovněž upozornit na možné závažné postižení krční páteře u RA i PsA.
36. SCHNITZLERŮV SYNDROM – ÚSKALÍ LÉČBY A DIFERENCIÁLNÍ DIAGNOSTIKY – KAZUISTIKA
Fojtík Z., Adam Z., Krejčí M., Pour L., Neubauer J.,
Prášek J., Hájek R.
Revmatologická ambulance, Interní hematoonkologická klinika LF MU a FN Brno a Radiologická klinika, Klinika nukleární medicíny LF MU a FN Brno
Autory je popisován Schnitzlerův syndrom, který je charakterizován urtikariální vaskulitidou spojenou s kostními změnami a s přítomností monoklonálního IgM. K laboratorním nálezům patří monoklonální IgM, zvýšená FW a CRP. Dle RTG, CT a MRI lze znázornit změny struktury skeletu typu hyperostózy až kombinace osteosklerotických a osteolytických změn.
Je popisován případ pacienta, u kterého byl stav hodnocen jako Schnitzlerův syndrom. Dominantním klinickým projevem byly urtikariální vaskulitida, laboratorně přítomnost mono-klonálního IgM a vyšší parametry zánětu. Po zjištění osteolyticko-osteosklerotických změn v oblasti pánve, v místech s intenzivní bolestí, byl nemocný léčen bisfosfonáty s uspokojivým analgetickým efektem. Po přerušení této léčby se bolesti obnovily. Dále byl nemocný léčen kortikoidy, kdy tato léčba odstranila kopřivkové problémy, ale pouze jen po dobu podávání. Pro přetrvávající aktivitu na pohybovém aparátu a pro urtikariální vaskulitidu byl postupně podáván 2-chlordeoxyadenosin, interferon alfa, fototerapie metodou PUVA, bortezomib, thalidomid, kdy příznivý vliv na kožní výsev a algický kostní a kloubní syndrom byl časově omezený. V roce 2007 byla zahájena léčba anakinrou. Kožní projevy po první aplikaci vymizely a nyní je nemocný bez kožních projevů, algický kloubní syndrom postupně odezněl. Došlo k normalizaci laboratorních hodnot, zejména CRP, hemoglobinu, poklesu imunoglobulinů. Dle našeho sledování je zřejmé, že pouze léčba anakinrou u pacientů s tímto syndromem vede k dlouhodobé a uspokojivé remisi a vymizení klinických i laboratorních parametrů charakteristických pro tento syndrom.
Diferenciálně diagnosticky je nutno zvažovat další onemocnění autoinflamatorního charakteru, Stillovu chorobu, hyper IgD syndrom.
37. POSTIŽENÍ POHYBOVÉHO APARÁTU U DIALYZOVANÉHO NEMOCNÉHO S NEFROKALCINÓZOU, KAZUISTIKA
Pešková M.
Interní odd., Nemocnice České Budějovice, a.s.
Kostní změny, vyvíjející se v průběhu chronických onemocnění ledvin a dialyzačního léčení, patří mezi metabolické osteopatie.
Porucha fosfokalciového metabolismu nastává již při poklesu funkce ledvin přibližně o 50 procent. Asi 5 procent naší populace je postiženo chronickým onemocněním ledvin se snížením glomerulární filtrace o více než polovinu.
Kazuistika dokumentuje průběh stonání 21letého dialyzovaného muže, který byl od dětství léčen pro nefrokalcinózu. Během komplexní terapie nezvratného ledvinného selhání dochází u nemocného k rychlému snížení kvality života a ke ztrátě soběstačnosti pro změny pohybového aparátu.
V etiopatogenezi postižení pohybového aparátu se uplatňuje minerálová a kostní nemoc při chronickém onemocnění ledvin, způsob terapie, dialyzační taktika, malnutrice, omezená pohybová aktivita, deprese. Vrozená porucha metabolismu šťavelanů – primární hyperoxalurie nebyla genetickým vyšetřením dosud prokázána.
38. OD KONVENČNÍ LÉČBY REVMATOIDNÍ ARTRITIDY K LÉČBĚ BIOLOGICKÉ
Němec P.
Revmatologická ambulance, II. interní klinika, FN u sv. Anny v Brně a LF MU, Brno
Revmatoidní artritida představuje závažné zánětlivé onemocnění vedoucí k destrukci kloubní chrupavky, erozím subchondrální kosti a k vývoji deformit postižených kloubů. Svým negativním působením nejen na pohybový aparát přispívá k výraznému zhoršení kvality života nemocných. Velký důraz je v současné době kladen na včasnou a efektivní terapii revmatoidní artritidy, která by byla schopna zastavit, případně zpomalit vývoj onemocnění. Hlavním cílem léčby by mělo být navození remise, zabránění vývoje strukturálního poškození kloubů a rozvoje dlouhodobé disability. Klasické chorobu modifikující léky nemají dostatečný efekt u všech pacientů, často mají opožděný nástup účinku a jejich použití může být spojeno s výskytem nežádoucích účinků. Zavedením biologických léků do schématu léčby revmatoidní artritidy znamenalo přelom v terapii tohoto onemocnění. Biologické léky v řadě případů splňují požadavky, které na moderní léčbu revmatoidní artritidy klademe a umožňují zásadní změnu stavu pacienta.
39. PREVENCE PRACOVNÍ NESCHOPNOSTI A ZTRÁTY ZAMĚSTNÁNÍ U ČASNÉ RA U PACIENTŮ LÉČENÝCH ADALIMUMABEM (PROWD)
Pavelka K.
Revmatologický ústav Praha
Aktivní RA vede po 10 letech k neschopnosti pracovat a trvalé invaliditě u 50 % pacientů. Nepřímé náklady na tyto pacienty jsou velmi vysoké.
Srovnat disabilitu a ztrátu zaměstnání nebo hrozící ztrátu zaměstnání u pacientů s časnou, aktivní RA léčených adalimumab (ADA) + metotrexátem (MTX) oproti MTX samotnému.
Multicentrická, prospektivní, randomizovaná studie u pacientů s RA (< 2 roky trvání), kteří neužívali předtím MTX a kteří byli randomizováni do skupiny léčené ADA + MTX nebo MTX + placebo po dobu 56 týdnů. Primárním cílem bylo zhodnocení počtu případů ztráty zaměstnání / hrozící ztráty zaměstnání. Sekundárními cíly bylo HAQ a RA kvalita života (RAQol).
Počet případů ztráty zaměstnání byl nižší ve skupině ADA + MTX (14 z 75 pacientů) ve srovnání u skupiny MTX samotný (29 z 73 pacientů) v intervalu 0–56 týdnů (p = 0,005). Skupina léčená ADA + MTX měla signifikantně větší změnu u DAS 28, HAQ a RAQol a rovněž menší ztrátu pracovních dní.
Kombinace ADA + MTX u časné RA zlepšuje pracovní produktivitu, oproti monoterapii MTX, což podporuje koncepci časného užití biologické léčby a výhodnost farmakoekonomického aspektu této léčby.
40. “MISSION IS REMISSION” – SOUČASNÝ POHLED NA LÉČEBNÉ CÍLE, INDIKACE ZAHÁJENÍ, DEFINICE SELHÁNÍ BIOLOGICKÉ LÉČBY
Vencovský J.
Revmatologický ústav Praha
Léčba revmatoidní artritidy zaznamenala obrovský pokrok v posledních 10–12 letech. Ukazuje se, že pokud jsou nemocní léčeni bazálními léky agresivně již od časnějších fází a pokud je léčba rigorózně sledována a zaměněna v případě suboptimálního účinku, tak je osud pacientů podstatně příznivější, než tomu bylo při běžně užívaných přístupech. Přetrvávající aktivita nemoci, ale i fluktuující aktivita, jsou nepříznivými prognostickými známkami vývoje nemoci a těžšího funkčního postižení. Cílem by tedy dnes mělo být navození dlouhotrvající remise, nebo alespoň dlouhotrvající nízké aktivity choroby. Pro to, jak definovat remisi máme několik nástrojů, nicméně ukazuje se, že mezi nimi není dostatečná shoda, a že možná každý přístup měří poněkud něco jiného. Nejtvrdší hodnocení remise je stále vyžadováno podle kritérií ACR. Ukázalo se také, že část nemocných splňujících kritéria remise, má přetrvávající synovitidu, detekovatelnou sofistikovatelnými zobrazovacími technikami či má progresi destruktivního postižení na RTG. Záleží tedy na tom, zda remisi definujeme jen podle toho, že momentálně nejsou známky zánětu a pacientovi se daří subjektivně dobře, nicméně onemocnění do jisté míry progreduje, nebo si dáme náročnější cíl ve smyslu zástavy destruktivního potenciálu nemoci s plně zachovanou dlouhodobou sociální a pracovní schopností. Praxe ukazuje, že druhého cíle je možné dosáhnout při použití biologické léčby, nikoliv však u všech nemocných. Otázkou pak je, zda sel-hání dosažení permanentní remise je dáno limitací této léčby nebo zda je to způsobeno nedokonalým využitím potenciálu těchto léků. Naše současná indikační kritéria vyžadují poměrně vysokou aktivitu onemocnění měřenou podle DAS28 > 5,1 při selhání 1 bazálního léku po dobu alespoň 6 měsíců. U nemocných s nepříznivými prognostickými rysy to však může znamenat zafixování aktivního onemocnění s již vytvořeným poškozením. Vyžadujeme pokles DAS28 o více než 1,2 jako ukazatel efektu. Toto splní celá řada nemocných, nicméně řada z nich zůstává pak ještě v pásmu střední aktivity, což je např. dokumentováno v registru ATTRA průměrnou hodnotou DAS28 ve skupině nemocných na anti-TNF lécích přibližně v rozmezí 4,0–4,5. Jak postupovat u těchto nemocných není zatím zcela jasné, ale agresivní přístup založený na pravidelném hodnocení, podobný záměnám bazálních léků, bude pravděpodobně nutné aplikovat i v případě biologických léků. Tento postup se nabízí především proto, že je již známa účinnost záměny mezi jednotlivými anti-TNF preparáty, či byla prokázána účinnost výměny těchto léků za rituximab či abatacept. Kritéria pro jasné doporučení výměny léků však není na základě dosud známých údajů lehké vytvořit. Tato kritéria budou diskutována a závěry poslouží k formulaci nového návrhu České revmatologické společnosti pro terapii biologickými léky.
41. ZHODNOCENÍ VÝSLEDKŮ Z REGISTRU ATTRA – MABTHERA VE SVĚTLE POZNATKŮ Z NOVÝCH KLINICKÝCH STUDIÍ.
Pavelka K.
Revmatologický ústav Praha
Rituximab je nový biologický lék na léčbu revmatoidní artritidy, který působí mechanismem selektivní deplece CD 20 pozitivních B lymfocytů. V současné době je indikován pro léčbu středně těžké a těžké revmatoidní artritidy u pacientů, u kterých selhala anti TNF léčba. Nedávno byly publikovány některé nové významné studie a byly již také získány zkušenosti z klinické praxe v České republice.
Do studie REFLEX byli zařazeni pacienti se selháním jednoho anti TNF preparátu a byli léčeni jednou sérií dvou injekcí rituximabu. Primárním cílem bylo stanovit odpověď v týdnu 24 a rentgenová kritéria byla hodnocena po 52 týdnech. V současné době byla prezentována data o extenzi studie REFLEX, která ukazují dobrou klinickou odpověď na opakované série a např. zvýšení počtu pacientů, kteří dosáhli remise či low disease activity stavu po třetím cyklu (34 %). Dále byly prezentovány výsledky studie SUNRISE, kde byli rovněž zařazeni pacienti se selháním anti TNF, kteří dostali jednu sérii rituximabu a v týdnu 24 byli randomizováni na léčbu další sérií nebo placebem. Pacienti s revmatoidní artritidou, kteří obdrželi dvě série rituximabu měli zlepšenou klinickou účinnost v týdnu 48 ve srovnání s pacienty, kteří obdrželi pouze jednu sérii. Pacienti měli 2–4x zvýšené riziko, že ztratí původně příznivou odpověď jestliže série nebyla opakována. Závěr studie podporuje hypotézu o vhodnosti aplikace druhé série rituximabu v intervalu 6 měsíců u pacientů, kteří měli iniciálně příznivou odpověď na léčbu.
V druhé části sdělení budou prezentována data 115 pacientů léčených rituximabem a zařazených do registru ATTRA v České republice. Průměrný věk pacientů byl 52,3 roků a délka trvání nemoci 12 let. 80 % pacientů mělo selhání alespoň jednoho anti TNF preparátu, u 20 % byl rituximab podáván jako první. Došlo k poklesu DAS z iniciálních 6,6 ± 0,9 na 4,8 ± 1,4 v týdnu 24. V týdnu 32 byl již DAS opět vyšší. Průměrná doba do retreatmentu v registru byla 31 týdnů. Výsledky našeho registru podporují vhodnost aplikace druhé série rituximabu v týdnu 24.
42. BLOKÁDA IL-6 TOCILIZUMABEM V LÉČBĚ REVMATOIDNÍ ARTRITIDY
Mann H.
Revmatologický ústav Praha
Interleukin 6 (IL-6) je klíčový cytokin podílející se na regulaci immunitní odpovědi a je přímo zodpovědný nejen za rozvoj chronického kloubního zánětu při RA, ale i za celou řadu mimokloubních projevů tohoto onemocnění. Tocilizumab je humanizovaná monoklonální protilátka, která se váže s vysokou afinitou na transmembránovou i solubilní formu receptoru pro IL-6 a tím blokuje účinky tohoto cytokinu. Tocilizumab je podáván ve formě intravenózních infuzí v dávce 8 mg/kg v intervalu 4 týdnů. V posledním roce byly zveřejněny výsledky pěti souběžně provedených klinických hodnocení III. fáze s obdobným designem, která prokázala účinnost tocilizumabu u různých skupin nemocných. Ve studii OPTION (TOcilizumab Pivotal Trial in Methotrexate Inadequate respONders) bylo zařazeno celkem 623 nemocných s nedostatečnou odpovědí na léčbu MTX (1). Základním hodnoceným parametrem bylo dosažení odpovědi ACR20 v týdnu 24. Tohoto cíle dosáhlo 120 (59 %) nemocných léčených tocilizumabem v dávce 8 mg/kg, 102 (48 %) nemocných léčených tocilizumabem v dávce 4 mg/kg a 54 (26%) nemocných z kontrolní skupiny (OR 4,0 95 % CI 2,6-6,1 P < 0,0001 pro tocilizumab 8 mg versus placebo). Odpovědi ACR 70 a remise podle DAS 28 kritérií dosáhlo ve skupině 8 mg/kg 45 (22 %) a 47 (27%) nemocných, ve skupině 4 mg/kg 26 (12 %) a 21 (13 %) nemocných a ve skupině kontrolní 4 (2%) a 1 (0,8 %) pacient (P < 0,0001). Ve studii TOWARD (Tocilizumab in cOmbination With traditional DMARD therapy) bylo celkem 1220 nemocných s RA po selhání léčby různými DMARDs randomizováno v poměru 2 : 1 k léčbě tocilizumabem v dávce 8 mg/kg nebo placebem po dobu 24 týdnů (2). V týdnu 24 dosáhlo odpovědi ACR 20 dosáhlo 61 % nemocných léčených tocilizumabem a 25% nemocných v kontrolní skupině. ACR 50 a 70 dosáhlo 38 % a 21% nemocných léčených tocilizumabem ve srovnání s 9 % a 3 % pacientů v kontrolní skupině (P < 0,0001). Rozdíl v aktivitě onemocnění mezi oběma skupinami byl patrný již po dvou týdnech léčby. Cílem klinického hodnocení RADIATE (RheumAtoiD Arthritis Study in Anti-TNF FailurEs) bylo prokázat účinnost tocilizumabu po selhání léčby anti TNFα (3). Celkem 499 nemocných s aktivní chronickou RA trvající průměrně 11–13 let, u nichž selhala léčba jedním nebo více inhibitory TNF, bylo randomizováno k léčbě tocilizumabem v dávce 4 mg/kg, 8 mg/kg nebo i.v. placebem v kombinaci s MTX (průměrná dávka 16 mg týdně). Odpovědi ACR 20 dosáhlo ve 24. týdnu 50% nemocných na dávce 8 mg/kg, 30,4 % nemocných na 4 mg/kg a 10,1 % nemocných v kontrolní skupině. Nebyl zjištěn žádný vztah mezi odpovědí a celkovým počtem nebo posledním podávaným TNFα blokátorem. V klinickém hodnocení AMBITION (The Actemra versus Methotrexate double-Blind Investigative Trial In mONotherapy) byla u 572 nemocných srovnávána účinnost monoterapie tocilizumabem v dávce 8 mg/kg s monoterapií MTX v dávce 20 mg týdně (4). V týdnu 24 dosáhlo odpovědi ACR20, ACR50 a ACR70 70 %, 44 % a 28 % nemocných léčených tocilizumabem ve srovnání s 53 %, 34 % a 15 % nemocných na MTX. Remise RA podle kritérií DAS 28 dosáhlo 34 % nemocných na tocilizumabu a 12 % nemocných v kontrolní skupině. Toto klinické hodnocení je první, které prokázalo při léčbě RA vyšší účinost biologického léčiva v porovnání s MTX. Ve studii LITHE (TociLIzumab safety and THE prevention of structural joint damage trial) bylo ve skupině 1190 nemocných prokázáno významné zpomalení rentgenové progrese RA při léčbě tocilizumabem versus MTX (5).
Po roce sledování bylo bez rentgenové progrese 85 % nemocných léčených dávkou 8 mg/kg, 81% léčených 4 mg/kg a 67 % nemocných v kontrolní skupině. Grafické znázornění účinnosti tocilizumabu v pěti klinických studiích III. fáze klinického hodnocení je na obrázku 1 a 2. Profil nežádoucích účinků je příznivý, léčba není spojena se zvýšeným rizikem TBC. U nemocných je třeba v průběhu léčby monitorovat krevní obraz, transaminázy a spektrum lipidů. Zvýšenou pozornost je také třeba věnovat riziku perforací gastrointestinálního traktu, zvláště u nemocných s divertikulózou.
Obr. 1. Procento nemocných v jednotlivých klinických hodnoceních III. fáze klinického zkoušení, kteří dosáhli klinické odpovědi ACR20. TCZ tocilizumab MTX metotrexát DMARDs chorobu-modifikující léky 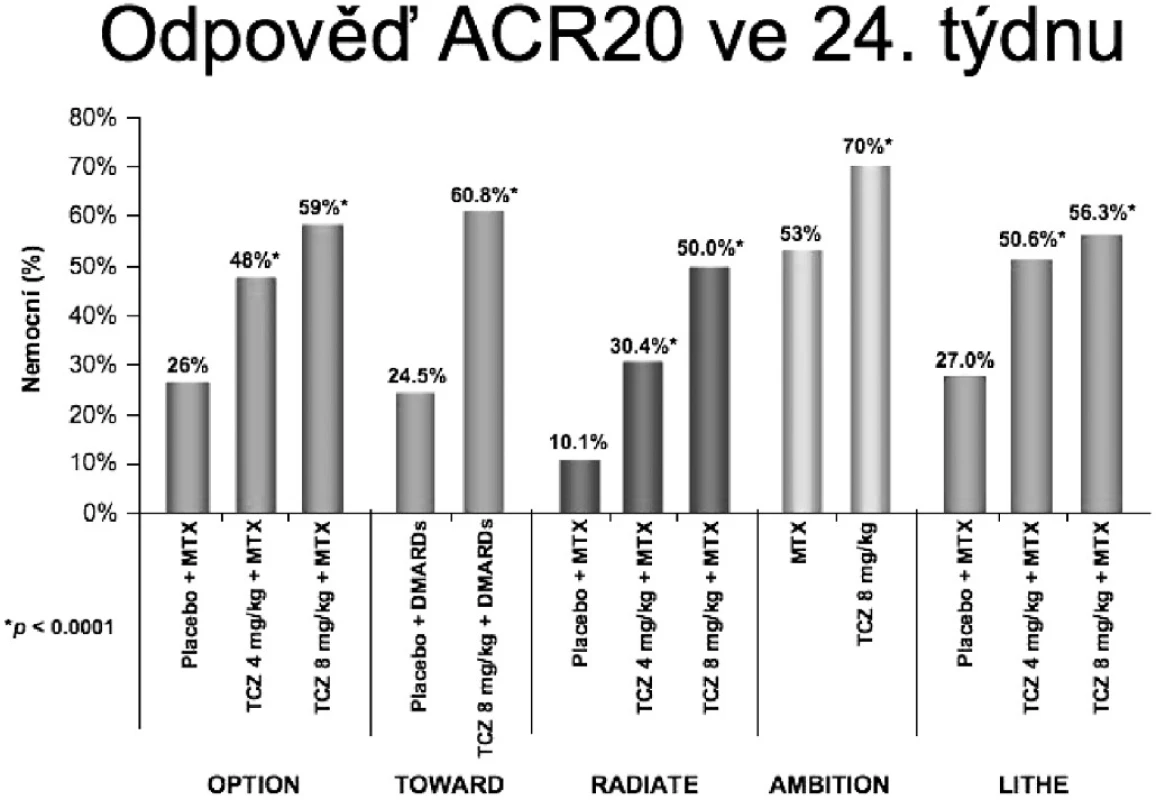
Obr. 2. Procento nemocných v jednotlivých klinických hodnoceních III. fáze klinického zkoušení, kteří dosáhli remise definované jako DAS 28 skóre < 2,6. 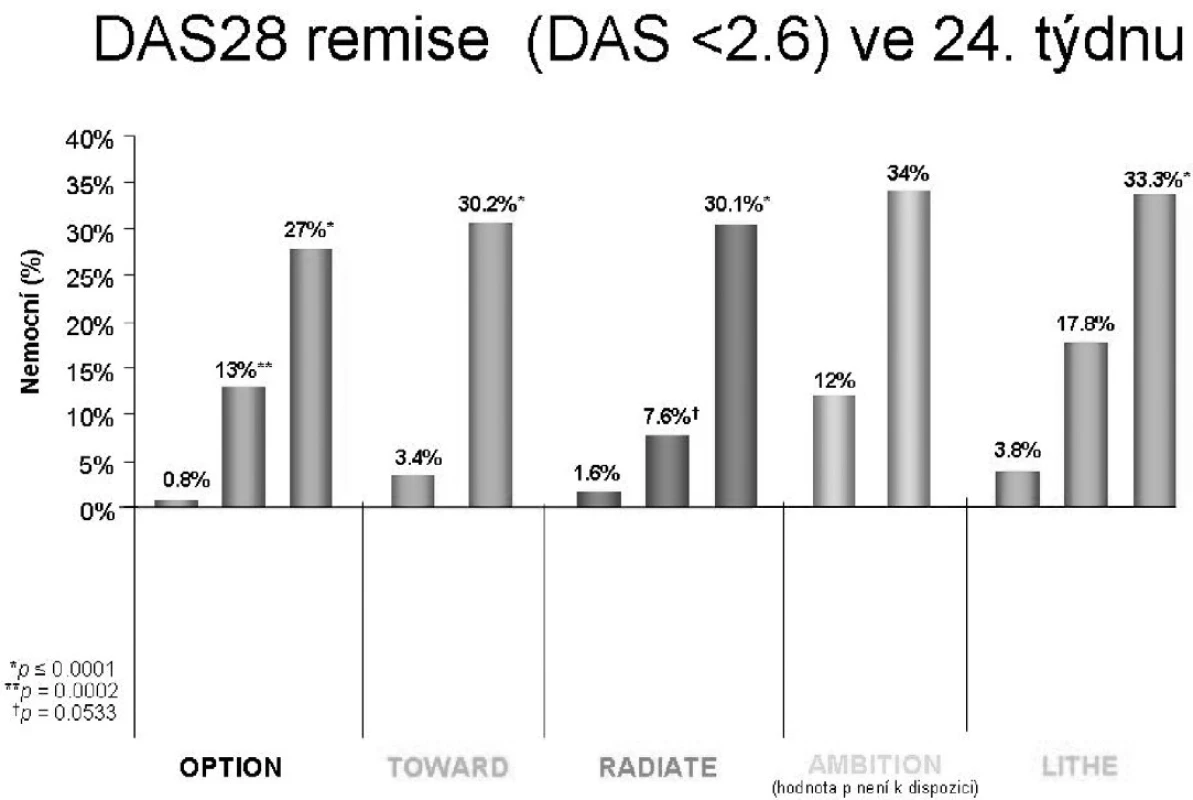
Literatura u autora
43. PROBLEMATIKA PRŮBĚHU A LÉČBY SLE V GRAVIDITĚ
Tegzová D., Andělová K.1
Revmatologický ústav v Praze, 1ÚPMD v Praze
Průběh gravidity i laktace u pacientek s revmatickou nemocí a farmakoterapie těchto chorob může být riziková. Riziko vyplývá ze samotné revmatické choroby, z terapie matky před koncepcí, v průběhu těhotenství a i laktace. Rizikem může být i terapie otce v období krátce před koncepcí. Výběr léčby revmatických chorob v graviditě a v laktaci je dán předně charakterem choroby, jejím obvyklým průběhem v graviditě, aktivitou, eventuální přítomností orgánového postižení a interkurentního onemocnění ženy, věkem nemocné apod. Proto je přístup k terapii jednotlivých revmatických chorob odlišný. Na rozdíl od revmatoidní artritidy je průběh onemocnění SLE v graviditě dosti rizikový, což je dáno řadou okolností: vysokým rizikem vzplanutí nemoci, zejména pod obrazem kožně kloubních změn a leukopenie, ale často i renálního relapsu, dále rizikem vzniku lupus neonatorum s téměř ireverzibilním AV blokem až III. stupně u novorozence matek s pozitivitou anti Ro a anti La protilátek a dále rizikem opakovaných abortů v důsledku antifosfolipidového syndromu. Rovněž samotná nutnost soustavné imunosupresivní léčby SLE i v době gravidity má svá závažná rizika. Nízké dávky kortikosteroidů a antimalarika jsou bezpečná. Léčba azatioprinem a cyklosporinem A není v graviditě vhodná, ale v určitých zcela výjimečných situacích ji lze připustit. Přísně kontraindikována je léčba metotrexátem a cyklofosfamidem. Při léčbě těmito léky je nutno zajistit účinnou antikoncepci a včas léky před plánovanou koncepcí vysadit. Při terapii cyklofosfamidem je nutno před koncepcí preventivně zajistit ochranu vajíčka, aby nevznikla ireverzibilní amenorea, a to nejlépe pomocí hormonální antikoncepce nebo zmrazením vajíčka.
44. PREDIKČNÍ ALGORITMY U NEMOCNÝCH ČASNOU ARTRITIDOU
Bradna P., Baštecká D., Hrnčíř Zb., Soukup T., Tomš J.
Revmatologické oddělení, 2. interní klinika LF a FN Hradec Králové
O významu časně zahájené intenzivní léčby artritidy byl podán již dostatek důkazů.
Vzhledem k určitému riziku podávaných chorobu modifikujících léků a i sklonu časné artritidy ke spontánním remisím je důležité hledání znaků, vymezujících nemocné s význačným rizikem destruktivního průběhu, u nichž je riziko terapie přijatelné vzhledem k hrozícímu zdravotnímu poškození. Dalším důležitým momentem je predikce navození remise či nízké aktivity choroby záhy po zahájení terapie.
Za obecně přijímané rizikové faktory závažné choroby je považován počet oteklých kloubů, erozivní změny a rychlý vývoj funkčního omezení. Z laboratorních parametrů pak zejména vyšší titry revmatoidních faktorů a aCCP, případně obou – tzv. dvojí pozitivita.
Aletaha a spol. zveřejnili pomůcku k odhadu reakce na terapii, vycházející ze změn SDAI po 3 měsících léčby. Van der Helm a spol. zveřejnili predikční skóre, vycházející ze souboru 9 klinických a laboratorních parametrů. Naproti tomu Hiderová a spol. našli velmi slabou predikční schopnost běžných klinických a laboratorních parametrů v predikci efektu DMARD terapie.
Náš soubor nemocných tvoří 34 pacientů, sledovaných pro časnou nebo velmi časnou artritidu. Soubor dělíme podle jednotlivých predikčních systémů a výsledky konfrontujeme se stavem po roce léčby.
Při skórování podle van der Helm – 66 % nemocných se skóre na počátku nad 8 mělo po 12 měsících erozivní změny. 87,5 % skupiny nemocných s indexem pod 6 nezaznamenalo rtg progresi ve 12 měsíci. Naproti tomu klinická remise po 12 měsících byla dosažena i u nemocných s vysokým skóre. Vysoce aktivní nemocný, převáděny na biologika, měl nízké iniciální skóre.
Při použití hodnoty SDAI po 3 měsících léčby (podle Aletahy) jsme dosáhli remise ve 12 měsíci u 91,6 % pacientů s SDAI < 10, naproti tomu 66 % nemocných se skóre v horním kvartilu remise nedosáhlo. U nemocných v horním kvartilu podle SDAI po 3 měsících měli rovněž ve 100 % ve 12 měsíci onemocnění rtg změny na drobných kloubech.
Přibližné závěry o destruktivnosti průběhu artritidy lze provést již na počátku onemocněním skórováním podle van der Helmové. Stanovení SDAI po 3 měsících léčby předpovídá neúspěch léčby po roce a může být použito jako podpůrný argument pro včasné převedení nemocného na biologickou léčbu.
45. WEGENEROVA GRANULOMATÓZA A OPERAČNÍ ZÁKROKY
Vítová J.
Interní oddělení Nemocnice České Budějovice, a.s.
Je předkládána kazuistika nemocného s Wegenerovou granulomatózou s mononeuritidou, chronickou sinusitidou a otitidou a těžkým postižením ledvin a jejich následným selháním.
Po šestiměsíční chronické dialyzační péči byla pacientovi transplantována ledvina. Následovalo období vcelku stabilizovaného stavu i přes recidivující infekce a chronickou infekci v ORL oblasti (Staphylococcus aureus). Po dalších dvou letech ale dochází k nekróze hlavice kyčelního kloubu.
Za vzájemné mezioborové spolupráce a po pečlivé přípravě byla pacientovi implantována TEP L kyčelního kloubu.
Pacient vede velmi slušný život již 7 let s WG, 5 let s transplantovaným orgánem a 3 roky implantovanou TEP Autorka chce zdůraznit nezbytnost “mezioborového kolektivu” u závažných chorob.
46. LABORATORNÍ DIAGNOSTIKA AUTOPROTILÁTEK U NEMOCNÝCH S REVMATICKÝM POSTIŽENÍM
Půtová I., Vencovský J.
Revmatologický ústav Praha
Rozvoj oboru revmatologie nepochybně souvisí s kontinuálním vývojem imunologických vyšetřovacích technik, které umožňují a usnadňují diferenciální diagnostiku onemocnění. Diagnóza RA (revmatoidní artritidy) je primárně založena na pozitivních nálezech klinických, radiologických a imunologických vyšetření. Přítomnost revmatoidního faktoru (RF) je jedním z kritérií American College of Rheumatology pro klasifikaci RA. RF není specifický pouze pro nemocné s RA, jelikož je často přítomen u nemocných s jinými autoimunitními chorobami (SLE, SS), chronickými infekcemi (HCV) a u starších zdravých jedinců (nad 65 let). V roce 1998 Schellekens a kol. uvedli, že autoprotilátky, reagující s lineárními syntetickými peptidy obsahujícími citrulin, byly přítomny u 76 % sér s RA. V následujících studiích Schellekens a kol. prokázali, že ELISA test založený na cyklickém citrulinovaném peptidu (CCP) vykazuje vyšší senzitivitu a specificitu než lineární úseky. Antigen je neustále vyvíjen, nyní jsou k dispozici testy III. generace. Pro rutinní laboratorní praxi jsou k dispozici pod názvem ACPA (anti citrullinated protein antibodies). Ve většině přehledů je senzitivita a specificita anti-CCP protilátek pro RA lepší než stejné údaje týkající se RF. Vzhledem k jejich specifičnosti mohou anti-CCP pomoci v diferenciální diagnóze.Velice důležitý je také jejich prognostický význam, neboť jejich přítomnost souvisí se závažnějším průběhem RA. Aktivovaná PAD může přeměnit arginin na citrulin v různých proteinech, např. fibrinu, vimentinu, histonech. V současné době jsou pro diagnostiku RA k dispozici rovněž komerčně dostupné soupravy pro detekci anti-MCV (mutovaného citrulinovaného vimentinu). V souvislosti s diferenciální laboratorní diagnostikou SLE stojí za zmínku detekce antinukleozomálních protilátek a anti-C1q protilátek, které jsou přítomny zvláště u nemocných s lupusovou nefritidou. V rámci laboratorní diagnostiky revmatických onemocnění by neměl být ze strany laboratorního pracovníka zanedbatelný popis cytoplazmatického fluorescenčního obrazu (anti-Jo-1 a anti SRP protilátky pro diferenciální diagnostiku PM/DM, anti-vinkulinové protilátky u autoimunitních onemocnění např. myasthemia gravis a imunitní trombocytopenie, protilátky proti cytokeratinu u pacientů s RA, autoimunitními hepatitidami, malobuněčným karcinomem plic a Crohnovou chorobou, protilátky proti aktinu u nemocných s aktivní hepatitidou, PBC a smíšeným onemocněním pojiva). Rovněž důležité je upozornění na výskyt protilátek proti mitochodriím (u nemocných s PBC, u nemocných se sklerodermií, CREST, SLE a SS) a protilátek proti ribozomům (10–20 % SLE nemocných bez přítomnosti ds DNA protilátek, u nemocných s neuropsychiatrickými symptomy).
Závěr: Výsledky imunologických vyšetření stejně jako ostatní laboratorní vyšetření je nutno posuzovat komplexně a vždy s ohledem na klinický stav pacienta.
47. PROJEKT CRAB – VČASNOU DIAGNOSTIKOU MNOHOČETNÉHO MYELOMU ZA LEPŠÍ KVALITU ŽIVOTA
Straub J., Adam Z., Gregora E., Kessler P., Maisnar V., Ščudla V1., Schulzová M., Špička I., Hájek R.
I. interní klinika hematoonkologie VFN a 1.LF–UK Praha, Interní hematoonkologická klinika FN a MU Brno, Oddělení klinické hematologie a transfuziologie Okresní nemocnice Pelhřimov, II. interní klinika, OKH FN a LF UK Hradec Králové, 1III. interní klinika UP a FN Olomouc, Hematologicko-onkologické oddělení FN a UK Plzeň
Mnohočetný myelom se svojí incidencí 4/100 000 obvyvatel patří do skupiny vzácně se vyskytujících nemocí. Nemoci z této skupiny obvykle dělají lékařům problémy při jejich časném rozpoznání, protože s nimi zákonitě nemají praxi. Mezi základní klinické projevy mnohočetného myelomu patří kostní postižení (Bone) s hyperCalcemií, Anemie a Renální postižení – tento soubor se proto nazývá „CRAB“. Pacienta k lékaři přivádí bolesti skeletu, projevy anémie (většinou normo - či makrocytární), renální nedostatečnosti, či projevy imunodeficitu (zejména opakované respirační či urologické infekce). Mnoho pacientů je diagnostikováno na základě patologického laboratorního nálezu v rámci preventivních prohlídek. Pozdě diagnostikovaný pacient je ohrožen vážnými irreverzibilními komplikacemi: patologickou frakturou (při postižení axiálního skeletu i neurologickými komplikacemi způsobenými míšním útlakem s rozvojem paraparézy či plegie DK), renálním selháním, fatální infekcí. Vzhledem k polymorfním iniciálním příznakům, někdy imitujícím systémové onemocnění (většinou s výrazně zvýšenou sedimentací), bývají tito pacienti vstupně vyšetřováni právě v ambulanci revmatologa.
U každého nemocného, který má bolesti skeletu déle než jeden měsíc, dále u každého člověka s osteoporózou, nevysvětlitelnou normocytární anémií a u všech osob s nově vzniklým nefrotickým syndromem a by měla být v rámci základního screeningu provedena tato vyšetření: krevní obraz, sedimentace erytrocytů, ionty včetně Ca, kreatinin, urea, kyselina močová, albumin, celková bílkovina, elektroforéza séra a moče kvantifikace polyklonálních imunoglobulinů rentgenový snímek suspektní oblasti.
Pokud je některý parametr jednoznačně patologický, je nutno naplánovat u tohoto nemocného pokračování diagnostického procesu s cílem odhalit případné maligní postižení skeletu. Včas diagnostikovaný pacient má při současným léčebných možnostech vysokou pravděpodobnost na mnoho let kvalitního života. Čím později je myelom diagnostikován, tím více se kvalita života zhoršuje.
48. AKCELEROVANÁ ATEROSKLERÓZA U SYSTÉMOVÉHO LUPUS ERYTHEMATODES
Smržová A., Horák P., Skácelová M., Žurek M.,
Ciferská H.
III. interní klinika, Fakultní nemocnice Olomouc
Systémový lupus erythematodes je autoimunitní onemocnění postihující nemocné především v mladší a střední věku s mediánem v 2.–4. dekádě. V posledních letech se účinnou léčbou dosáhlo 5leté přežití až 90 % a 20leté přežití až u 60 % pacientů. Riziko aterosklerózy u SLE je až 6krát vyšší než ve zdravé populaci a až 3krát vyšší než u jiných systémových chorob pojiva. Ateroskleróza se u SLE nejčastěji klinicky projeví jako angina pectoris, infakt myokardu či tranzitorní ischemická ataka nebo cévní mozková příhoda, vzácněji jsou to trombóza, koronární vaskulitida či arteriální embolie. Z těchto důvodů se v poslední době změnil managament terapie, kdy se zaměřuje na prevenci a léčbu pozdních komplikací SLE, mezi než patří rovněž ateroskleróza. Ta je u SLE akcelerovaná, a to jak samotným zánětlivým charakterem onemocnění, tak je projevem vedlejších účinků léčby a také zvýšeným výskytem tradičních rizikových faktorů aterosklerózy, kdy až 32 % nemocných se SLE splňuje kritéria metabolického syndromu.
V současné době jsou snahy o nalezení vhodných markerů subklinické aterosklerózy. Jako potencionální vhodné ukazatele se jeví markery aktivity choroby, zánětu (zvláště high sensitivity CRP), dyslipidemie (především ox-LDL, proinflamatory HDL), markery podílející se na dysfunkci endotelu (hlavně ICAM, VCAM, vWf, protilátky proti beta2-glykoproteinu 1), antifosfolipidové protilátky, lupus antikoagulans a další. V potenciaci aterosklerózy hrají také důležitou roli preparáty užívané v léčbě, a to zvláště glukokortikoidy, které působí jak poruchy lipidového spektra, tak zvyšují prevalenci tradičních rizikových faktorů. Zdá se, že nově užívaná anti TNF léčba má spíše protektivní účinek, stejně tak i cyklofosfamid či hydroxychlorochin.
Nalezení vhodného postupu prevence aterosklerózy rozhodně zlepší kvalitu života a sníží morbiditu i mortalitu nemocných s tak závažným onemocněním jako SLE.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2009 Číslo 2- Kterým pacientům se SLE nasadit biologickou léčbu?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Třeboňské revmatologické dny Abstrakta – sekce Středně zdravotnických pracovníků v revmatologii
- HLA-Cw*0602 jako predispoziční alela rozvoje psoriatické artritidy
- Utilizace zdravotní péče a náklady pacientů s revmatoidní artritidou léčených TNF-α inhibitory v České republice
- Omezený význam prokalcitoninu v odlišení septického stavu od vzplanutí autoimunitního onemocnění
- Vliv biologické úpravy povrchu vybraných implantačních materiálů na proliferaci a syntetickou aktivitu kostních buněk. Studie in vitro
- Sekundární imunodeficitní stav s infekčními komplikacemi po imunosupresivní terapii u nemocné se systémový lupus erytematodes
- Třeboňské revmatologické dny Abstrakta odborného programu
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- HLA-Cw*0602 jako predispoziční alela rozvoje psoriatické artritidy
- Třeboňské revmatologické dny Abstrakta odborného programu
- Omezený význam prokalcitoninu v odlišení septického stavu od vzplanutí autoimunitního onemocnění
- Sekundární imunodeficitní stav s infekčními komplikacemi po imunosupresivní terapii u nemocné se systémový lupus erytematodes
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



