-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVliv biologické úpravy povrchu vybraných implantačních materiálů na proliferaci a syntetickou aktivitu kostních buněk. Studie in vitro
The impact of biological modification of the surface of selected implant materials on the proliferation and synthetic activity of bone cells. In vitro study
Aim of the study:
To study the impact of surface properties of selected implant materials on adherence of some blood components (plasma, serum), and the impact of these proteins, adsorbed on the implant surface, on the adhesion and synthetic activity of cultured osteoblasts using in vitro experiments.Methods:
In selected materials such as etched titanium (Ti-Etch), plasma-sprayed titanium (Ti-PlaSpray), titanium with hydroxyapatite layer (Ti-HA), and carbon composite (C/C), the physiochemical parameters were determined (roughness, wettability, and free surface energy). Tissue culture polystyrene (TCPS) was used as a control. Biological modification of materials was performed by overlaying of one of two selected blood components – plasma or serum. Osteoblasts were cultured on materials without overlay, as well as materials with biological modification, and consequently, the proliferation of osteoblasts was evaluated due to the mitochondrial oxidation activity of monolayer (MTT assay). In the obtained culture medium, the activity of osteoblasts was determined as the level of bone alkaline phosphatase (BAP) and the production of inflammatory cytokines (TNF-α, IL-8) using enzyme-linked immunosorbent assay (ELISA).Results:
High roughness of implants affected the increased proliferation in titanium materials (Ti-PlaSpray). A decreased proliferation of C/C is attributed to almost zero value of polar component of surface energy. Overlaying of materials by activated plasma (fibrin network) led to formation of unified surface in terms of both proliferation and synthetic activity. However, overlaying of implants by serum (albumin) did not have the anticipated stimulatory effect on osteoblasts.Conclusion:
Overalying of selected implant materials by activated plasma (i.e. fibrin network) leads to formation of a surface with required balance between the proliferation rate and synthetic activity of osteoblasts as a model of organisms’s immune response to an applied implant.Key words:
implant materials, surface properties, serum, plasma, proliferation, synthetic activity, osteoblasts, physiochemical parameters, cytokines
Autoři: V. Pešáková 1; D. Kubies 2; T. Riedel 2; E. Třesohlavá 2; L. Himmlová 3
Působiště autorů: Revmatologický ústav, Praha 1; Ústav makromolekulární chemie AVČR, Praha 2; Výzkumný ústav stomatologický VFN a 1. LF, Praha 3
Vyšlo v časopise: Čes. Revmatol., 17, 2009, No. 2, p. 84-90.
Kategorie: Původní práce
Souhrn
Cíl:
pomocí pokusů in vitro studovat vliv povrchových vlastností vybraných implantačních materiálů na adherenci některých krevních složek (plazma, sérum) a sledovat vliv těchto adsorbovaných proteinů na povrchu implantátu na adhezi i syntetickou aktivitu kultivovaných osteoblastů.Metodika:
U zvolených materiálů : titan leptaný (Ti-Etch), titan plazma-sprayovaný (Ti-PlaSpray), titan s hydroxyapatitovou vrstvou (Ti-HA), a uhlíkový kompozit (C/C) byly stanoveny fyzikálně-chemické parametry povrchu (drsnost, smáčivost a volná povrchová energie). Jako kontrola sloužil polystyren kultivačních destiček pro tkáňové kultury (TCPS). Biologická úprava materiálů byla provedena pokrytím jednou ze dvou vybraných krevních komponent–plazma nebo sérum. Na materiálech bez pokrytí i s biologickou úpravou byly kultivovány osteoblasty a následně byla z mitochondriální oxidační aktivity monolayeru buněk (MTT test) vyhodnocena jejich proliferace. V získaném kultivačním médiu byla pomocí enzymoimunosorbentní analýzy (ELISA) stanovena aktivita osteoblastů jako hladina kostní alkalické fosfatázy (BAP) a produkce zánětlivých cytokinů (TNF-α, IL-8).Výsledky:
Vysoká drsnost implantátů ovlivnila zvýšenou proliferaci u titanových materiálů (Ti-PlaSpray). Nízká proliferace C/C je přičítána téměř nulové hodnotě polární složky povrchové energie. Potažení materiálů aktivovanou plazmou (fibrinovou sítí) vedlo ke vzniku unifikovaného povrchu jak z hlediska proliferace, tak i z hlediska syntetické aktivity. Oproti tomu při potažení implantátů sérem (albuminem) nebyl pozorován takový stimulační efekt na osteoblasty jaký jsme předpokládali.Závěr:
Pokrytí vybraných implantačních materiálů aktivovanou plazmou (tj. fibrinovou sítí) vede k vytvoření povrchu s potřebnou rovnováhou mezi mírou proliferace a syntetickou aktivitou osteoblastů jako modelu imunitní odpovědi organizmu na zavedený implantát.Klíčová slova:
implantační materiály, povrchové vlastnosti, sérum, plazma, proliferace, syntetická aktivita, osteoblasty, fyzikálně-chemické parametry, cytokiny1. ÚVOD
Implantáty jsou materiály, které jsou používány pro doplnění chybějící tkáně téměř ve všech odvětvích medicíny. Velmi často slouží implantáty jako náhrada pojivové kostní tkáně. Po zavedení implantátu do tkáně dochází k vzájemné reakci cizího implantačního materiálu a živé tkáně. Na každý implantát reaguje tkáň jako na cizí těleso, protože dosud neexistuje materiál, který by ve tkáni oboustranné reakce nevyvolával (1, 2). Jejich intenzita a průběh jsou závislé na aktivitě fyzikálně-chemického i mechanického dráždění tkáně v okolí implantátu a klíčovou roli v těchto procesech mají fyzikálně-chemické parametry povrchu materiálů (3).
Místem prvního kontaktu mezi cizorodým implantačním materiálem a živou tkání příjemce je krev. Povrch implantátu je po kontaktu s krví modifikován aktivitou krevních buněk a mechanismem výměny iontů i proteinů (4). Při interakcích mezi povrchem implantačního materiálu a buňkami v in vitro podmínkách předchází adhese proteinů vždy adhezi buněčné a rovněž interakce povrchu materiálu s krví jsou regulovány fyzikálně-chemickými vlastnostmi implantátu (5). Proto je viabilita buněk v nejbližším okolí implantátu v přítomnosti různých krevních komponent důležitým krokem k porozumění procesu vhojování. Krev obsahuje množství plazmatických bílkovin, které spolu s krevními elementy zajišťují homeostázu. Tekutou fázi krve představuje po odstranění buněk plazma, a tato zbavená fibrinogenu tvoří sérum. Abychom zjistili zda přítomnost vybraných krevních složek ovlivní integraci implantačního materiálu do okolní tkáně, rozšířili jsme in vitro model „tkáň-implantát“, o přirozenou biologickou vrstvu krevních bílkovin (albumin, fibrin). Tímto modelem implantátu s biologickou úpravou povrchu jsme se pokusili o vytvoření prostředí, které názorněji imituje situaci in vivo a lépe umožní odpovědět na otázku, které krevní složky stimulují osteoinduktivní procesy, případně evokují zánětlivý efekt při vhojování implantátů do kosti.
2. MATERIÁL A METODIKA
2.1. Použité materiály
Pro testování byly zvoleny následující materiály: titan leptaný (Ti-Etch, Fopos, Praha ČR), titan plazma-sprayovaný (Ti-PlaSpray, Beznoska, Kladno, ČR), titan s hydroxyapatitovou vrstvou (Ti-HA, Lasak, Praha, ČR) a uhlíkový kompozit složený z uhlíku s horní vrstvou tvořenou tlakově zpolymerovanými plošně spletenými uhlíkovými vlákny ve fenolové pryskyřici (C/C, Ústav mechaniky a struktury hornin AV ČR, Praha). Mechanická úprava povrchů byla provedena u daného materiálu jeho výrobci. Jako kontrolní povrch byly zvoleny standardně používané polystyrénové kultivační nádoby (TCPS, Nunc A/S, Roskilde, Dánsko).
Testované materiály byly proprány v ultrazvukové lázni v ethanolu a v deionizované vodě (30 min). Před použitím byly materiály určené pro stanovení povrchových parametrů i materiály pro experimenty s buněčnými kulturami za standardních podmínek autoklávovány.
2.2. Stanovení fyzikálně - chemických parametrů povrchů
U povrchů materiálů byla sledována jejich drsnost, smáčivost ve vodě (kontaktní úhel) a volná povrchová energie (γ).
Měření drsnosti povrchů materiálů: Drsnost povrchu vzorků byla měřena přístrojem Hommeltester 1000T (Hommelwerke, SRN). Byly sledovány tyto základní povrchové charakteristiky: Ra - střední aritmetický průměr výšky profilu; Rz - průměrná střední výška profilu v 5 měřených úsecích; Rmax – maximální jednotlivá hloubka drsnosti z 5 měřených úseků.
Smáčivost povrchu materiálů – Povrchové napětí vody bylo měřeny metodou visící kapky (přístroj OCA 20 vybaven video-kamerou, Dataphysics, Filderstadt, SRN). Smáčivostpovrchu byla stanovena na základě hodnot postupujícího (θA, měřeno při ponořování vzorku) a ustupujícího (θR, měřeno při vynořování vzorku)kontaktního úhlu ve vodě měřením dynamickou metodou Wilhelmyho destičky (tensiometer Kruss K12, Hamburg, SRN).
Volná povrchová energie (γ) byla stanovena určením smáčivosti ve třech rozpouštědlech o různých interakčních parmetrech (voda, formamid dijodomethan). Hodnoty kontaktních úhlů (θ) byly získány měřením kontaktních úhlů statickou kapkovou metodou (přístroj OCA 20 vybaven video-kamerou, Dataphysics, Filderstadt, SRN). Průměrná hodnota θ získaná fitováním Young-Laplace rovnicí byla použita k výpočtu volné povrchové energie γ a její polární γP a dispersní složky γD podle OWCK metody.
2.3. Biologická povrchová úprava materiálů
Pro kultivace osteoblastů byly použity implantáty kruhového tvaru o průměru 20 mm a tloušťce 1mm. Biologická úprava materiálů byla provedena pokrytím povrchu implantátu jednou ze dvou vybraných krevních komponent vždy ve stejný den, těsně před vložením buněk na materiály podle následujících postupů:
Potahování krevním sérem – vzorky byly inkubovány 60 minut s lidským sérem (Cambrex, Bio Sci, USA) při pokojové teplotě. Poté bylo přebytečné sérum odsáto a vyměněno za pufrovaný fyziologický roztok, pH = 7,4.
Potahování plazmou – zmražená lidská CPD plazma s přídavkem citrátu (ÚHKT, Praha, ČR) byla rozmražena ve vodní lázni při teplotě 37 ºC. Poté byl přidán chlorid vápenatý na vyvázání stabilizačního citrátu za účelem aktivace koagulační kaskády (vytvoření fibrinové sítě). Byl proveden test rychlosti tvorby koagula na modelovém TCPS povrchu. Vzorky byly ponořeny do aktivované plazmy a po 6 minutách inkubace byla plazma postupně odsávána za současného přilévání fyziologického roztoku pH = 7,4 tak, aby nedošlo ke vzniku krevního koagula. Po úplném nahrazení plazmy byly vzorky následně 3krát promyty fyziologickým roztokem a vloženy do kultivačních jamek.
2.4. Buněčné kultivace
2.4.1. Stanovení proliferace osteoblastů
Lidské osteoblasty (NHOst, Cambrex Bio Science Walkersville, Inc., USA) byly kultivovány v kultivačním mediu (OGM BulletKit, Cambrex Bio Science Walkersville, Inc.,) do 3.–4. pasáže. Implantáty byly za sterilních podmínek vloženy na dno 6jamkových kultivačních destiček (Nunc A/S, Roskilde, Dánsko). Osteoblasty byly v jednotlivých testech inokulovány na povrch implantátů v průměrném počtu 15 000 buněk/cm2 a kultivovány za standardních podmínek po dobu 4 dnů (6). Pro další stanovení bylo použito jak získané kultivační médium, tak i sklizené buňky.
Míra proliferace osteoblastů byla stanovena z mitochondriální oxidační aktivity monovrstvy buněk po 4denních kultivacích na testovaných materiálech za použití MTT testu podle Laughtona (7). Souběžně s MTT testem na implantátech byl proveden stejný MTT test pro získání kalibrační křivky z koncentrační řady osteoblastů vložených do jamek polystyrenových destiček (TCPS) bez přítomnosti implantačních materiálů (7, 8). Díky tomuto postupu jsme mohli získané hodnoty absorbance pro snadnější orientaci vyjádřit jako počet buněk / ml média.
Buněčné kultivace osteoblastů byly opakovány ve 3 nezávislých experimentech vždy s novou inokulací osteoblastů a se třemi paralelními vzorky pro každý typ povrchu. Jako kontrola pro všechna stanovení sloužila kultivace osteoblastů na TCPS s odpovídající biologickou povrchovou úpravou. Pro porovnávání výsledků mezi různými typy potažení i mezi třemi opakovanými nezávislými pokusy byl počet adherovaných buněk přepočten na %. Jako referenční hodnota 100 % byl zvolen počet buněk rostoucích na kontrolním TCPS pro každou sadu povrchů (nepotažené, potažené sérem nebo plazmou) v jednotlivých experimentech.
2.4.2. In vitro stanovení syntetické aktivity osteoblastů.
Hladiny exprese vybraných cytokinů byly kvantitativně sledovány v kultivačním mediu osteoblastů po 4 dnech kultivace na testovaných materiálech pomocí „sandwich“ enzymo-imunosorbentní analýzy (ELISA) s komerčně dostupnými kity fy. Bender (MedSystems, Vídeň, Rakousko). Byla stanovena produkce kostní specifické alkalické fosfatázy (BAP), prozánětlivého cytokinu tumor necrosis faktor (TNF-α) a zánětlivého chemokinu (IL-8).
Pro porovnávání výsledků mezi různými typy potažení i mezi třemi opakovanými nezávislými pokusy bylo množství produkovaných cytokinů získané metodou ELISA (BAP v U/l na 100 000 buněk, IL-8 a TNF-α v ng/ml na 100 000 buněk) přepočteno na procenta (%). Jako referenční hodnota 100 % byla zvolena hladina cytokinu produkovaného na kontrolním TCPS. Tato referenční hodnota 100 % byla zavedena vždy zvlášť pro každou sadu povrchů (nepotažené, potažené sérem nebo plazmou) v jednotlivých experimentech.
2.5. Rastrovací elektronová mikroskopie (SEM)
Vzorky pro SEM byly připraveny paralelně se vzorky pro buněčné experimenty. Po ukončení potahování aktivovanou plazmou byly vzorky převedeny etanolovou řadou do čistého etanolu, vysušeny a mikroskopovány pomocí digitálního rastrovacího mikroskopu VEGA TESCAN.
3. VÝSLEDKY A DISKUSE
3.1. Charakterizace fyzikálně-chemických vlastností povrchu
Data získaná měřením drsnosti, hodnoty volné povrchové energie i její polární γP a dispersní γD složky a hodnoty kontaktních úhlu jsou uvedeny v tabulce 1. Sledované povrchy jsou seřazeny podle klesající hodnoty polární složky γP povrchové volné energie γP, která je považována za jeden z důležitých faktorů ovlivňujících biologické interakce (9, 10).
Z důvodu lepší přehlednosti je prezentován jako parameter drsnosti jenom střední aritmetický průměr výšky profilu Ra jako hlavní ukazatel míry nerovnosti povrchu. Depozice další titanové vrstvy nebo bioaktivního hydroxyapatitu plazmatickým nástřikem na původní hladký titanový povrch (Ra = 0,15 ± 0,024 μm) vedla ke vzniku materiálů s vysokou drsností a současně s vysokou nehomogenitou (odchylka v Ra přes 20 %). Metoda plazmatické depozice titanu vedla k povrchu s nejvyšší drsností (Ra = 14,5 ± 2,74 μm) což má za cíl zejména zvětšení kontaktní plochy implantátu se živou tkání (9). Taktéž povrchová úprava uhlíkového kompozitu vedla ke vzniku nehomogenního povrchu, avšak s nižší drsností (Ra = 2,68 ± 0,585 μm). Na druhé straně proces chemické úpravy leptáním titanu povrchu roztokem o konstantním chemickém složení (Ti-Etch) umožnil připravit povrch o relativně vysoké homogenitě se standardní odchylkou pod 10 %.
U sledovaných materiálů byly pozorované velké rozdíly ve volné povrchové energii γP (7,23 až 70,21 mN/m). Nejvyšší hodnota γ a γP byla naměřena u TCPS (což odpovídá nejlepší proliferaci, viz kap. 3.2.). I když hodnoty γnebyly měřeny kvůli vysoké drsnosti povrchu uTi-PlaSpray přímo, zařazení Ti-PlaSpray za TCPS v tabulce 1. mělo následující důvod: když uvážíme, že γ je dána povrchovými vlastnostmi založenými na fyzikálně-chemických interakcích na úrovni atomů, pak hodnoty volné povrchové energie získané pro leštěný titan a to γ= 47,01 γP± 1,54 (mN/m), γP = 15,97 ± 0,54 (mN/m) a γD = 31,05 ± 0,98 (mN/m) (11), by v přiblížení mohly být aplikovány i pro titanové povrchy upravené na různou drsnost. Extrémně nízké hodnoty parametrů γP a γD byly stanoveny u titanu s horní anorganickou hydroxyapatitovou vrstvou, nicméně γPparametr u Ti-HA má relativně vysokou hodnotu 4,62 mN/m. Další nekovový povrch, tj. C/C kompozit, je charakterizován hodnotou γ = 47,08 mN/m, ale s téměř nulovou hodnotou γP (což odpovídá nejhorší proliferaci, viz kap. 3.2.).
Tab. 1. Volná povrchová energie (γ), její polární (γP) a disperzní (γD) složky a hodnoty postupujícího (θA) a ustupujícího (θR) kontaktního úhlu. 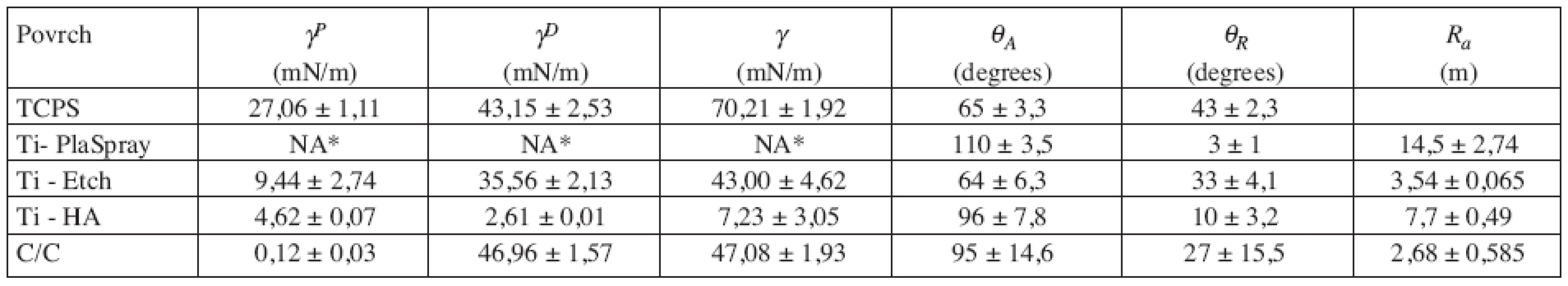
NA – neanalyzováno pro vysokou drsnost, komentář v textu kap.3.1 Smáčivost povrchů vodou je považována za jeden z hlavních faktorů odrážející míru adheze buněk na umělý povrch (11). TCPS a leptaný titan Ti-Etch s kontaktními úhly θA pod 70º reprezentují relativně smáčivé povrchy. V případě TCPS se jedná o speciální povrchovou úpravu výrobcem. U leptaného titanového povrchu je vysoká smáčivost způsobena hydratovanou TiO2 vrstvou vytvořenou v průběhu leptání směsí kyselin. Vysoký kontaktní úhel θA u Ti-PlaSpray vzorků je důsledkem vysoké drsnosti povrchu, když u původního leštěného Ti byla naměřena θA= 62º (12). Nekovové povrchy Ti-HA a C/C kompozit představují hydrofobní povrchy s θA přes 90º bez pozorovaného vlivu drsnosti na smáčivost.
Následně byla provedena vizualizace povrchů nepotažených i potažených krevní plazmou pomocí rastrovací elektronové mikroskopie (SEM). Na obrázku 1 jsou zobrazeny povrchy testovaných materiálů potažené aktivovanou plazmou, tj. fibrinovou sítí, která vzniká síťováním fibrinu po vyvázání stabilizačního citrátu přítomného v plazmě. Potažení sérem, tj. albuminem není možné vizualizovat pomocí SEM, protože tato metoda neumožňuje zvětšení potřebné pro vizualizaci vrstev proteinů.
Obr. 1. Povrchy potažené aktivovanou lidskou plazmou, (SEM): a); C/C komposit 
Obr. 1. Povrchy potažené aktivovanou lidskou plazmou, (SEM): b) Ti-Etch 
Obr. 1. Povrchy potažené aktivovanou lidskou plazmou, (SEM): c) Ti-PlasSpray 
Obr. 1. Povrchy potažené aktivovanou lidskou plazmou, (SEM): d) Ti – HA. 
3.2. Proliferace osteoblastů
Proliferace osteoblastů kultivovaných na čistých nepotažených vzorcích a na implantačních materiálech potažených biologickou vrstvou je znázorněna na obrázku 2 . Buněčná proliferace byla podle očekávání na všech sledovaných nepokrytých materiálech ve srovnání s kontrolním polystyrenem (TCPS) nižší (obr. 2, skupina „bez potažení“). U většiny těchto povrchů však byla pozorovaná vysoká proliferace, a to zejménaz důvodu přidání osteokonduktivní anorganické vrstvy v případě Ti-HA, nebo zavedení funkčních skupin zvyšujících hydrofilitu stejně jako povrchovou drsnost v případě leptaného titanu (Ti-Etch). Vysoká povrchová drsnost vedoucí ke zvětšení povrchu dostupného pro adhezi v případě plazmatického nástřiku titanu (Ti-PlaSpray) společně s vysokou hodnotou polární složky γP pro titanový povrch také způsobila zvýšení proliferace. Na druhé straně nízká proliferace pozorovaná na uhlíkovém kompozitu je z hlediska fyzikálně-chemických vlastností způsobená téměř nulovou hodnotou polární složky γP volné povrchové energie a vysokou hydrofobicitou povrchu. Tento povrch je možné považovat za negativní kontrolu v naší studii.
Na vytvoření biologické vrstvy byly použity 2modelové systémy a to potažení sérem (tj. albuminem) a potažení aktivovanou krevní plazmou (tj. fibrinovou sítí). Z hlediska chemického původu povrchu implantátu jsme zjistili, že u vzorků Ti-Etch a C-C kompozitu v podstatě nebyly detekovány žádné signifikantní změny bez ohledu na typ biologického potažení. U povrchů Ti-PlaSpray bylo pozorováno mírné zvýšení proliferace ve srovnání s původním povrchem jen u potažení aktivovanou plazmou. Pouze potažení vzorků Ti-HA oběma typy krevních komponentů vedlo ke vzniku povrchů s výrazně vyšší proliferací osteoblastů, dokonce vyšší než u kontrolního TCPS.
Z hlediska typu potažení je možné vyvodit následující závěry (obr. 2). Pokrytí aktivovanou krevní plazmou, tj. fibrinovou sítí, vedlo ke vzniku povrchů se srovnatelně vysokou proliferací bez ohledu na původní materiál pod vrstvou plazmy. Na druhé straně, potažení sérem (albumin) nemá podobný stimulační efekt na proliferaci osteoblastů tak, jako bylo pozorováno v případě vzorků potažených plazmou.
Obr. 1. Proliferace osteoblastů na původních materiálech a na povrchu s biologickou úpravou (potažením sérem a aktivovanou plazmou). Výsledky ze 3 nezávislých experimentů se 3 paralelními vzorky. Počet buněk je vyjádřen v procentech, kdy 100 % byla zvolena hodnota naměřená pro kontrolní TCPS povrch u každého experimentu zvlášť pro každé jednotlivé potažení. 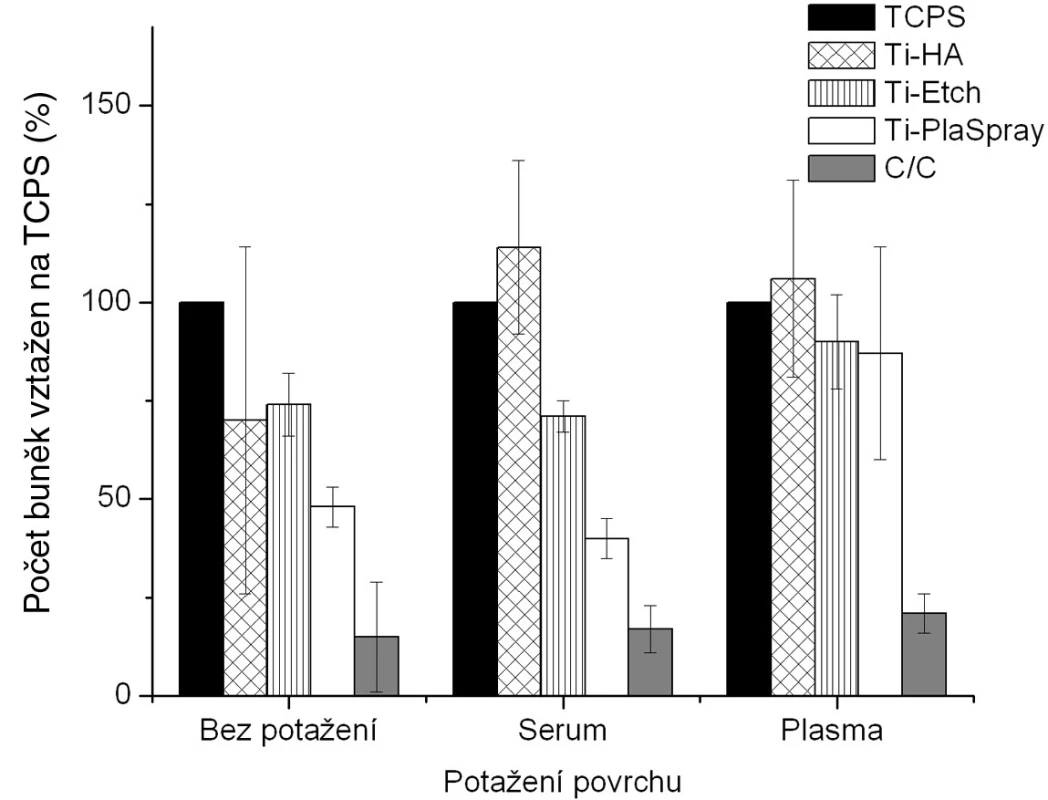
3.3. Syntetická aktivita osteoblastů
V kultivačním médiu osteoblastů rostoucích 4 dny na původních materiálech i na materiálech s biologickou úpravou byla kvantitativně sledována hladina exprese vybraných tkáňových mediátorů. Za ukazatele osteoblastické aktivity byla zvolena kostní specifická alkalická fosfatáza (BAP) jako biochemický marker kostního metabolismu (13). Za ukazatele zánětlivé reakce byly zvoleny tumor necrosis faktor alfa (TNF-α) jako hlavní mediátor zánětlivých reakcí, který má silný cytotoxický a katabolický účinek (14) a interleukin 8 (IL-8), tj. prozánětlivý chemokin zvyšující expresi adhezivních molekul na povrchu buněk (15). Výsledky jsou prezentovány na obrázcích 3–5.
Obr. 2. Produkce BAP osteoblasty kultivovanými na původních materiálech a na površích s biologickou úpravou (potažení sérem, aktivovanou plazmou). Výsledky ze 3 nezávislých experimentů se 3 paralelními vzorky. Produkce BAP je vyjádřena v procentech , kdy 100 % byla zvolena hodnota naměřená pro kontrolní TCPS povrch u každého experimentu zvlášť pro jednotlivá potažení. 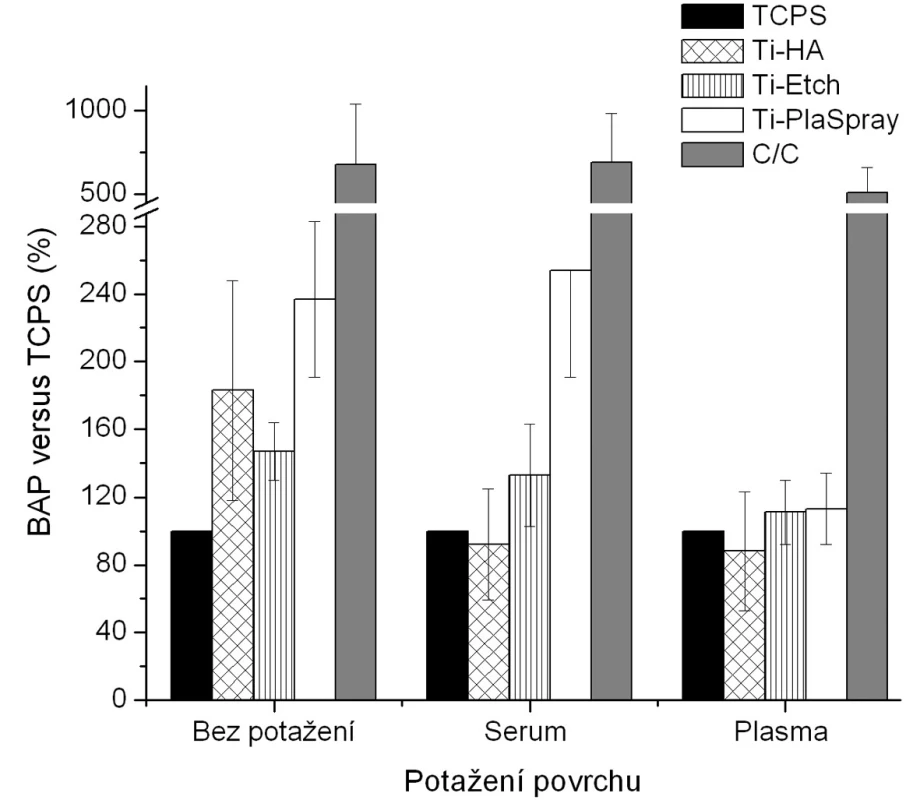
Obr. 3. Produkce IL-8 osteoblasty kultivovanými na původních materiálech a na površích s biologickou úpravou (potažení sérem, aktivovanou plazmou). Výsledky ze 3 nezávislých experimentů se 3 paralelními vzorky. Produkce IL-8 je vyjádřena v procentech , kdy 100 % byla zvolena hodnota naměřená pro kontrolní TCPS povrch u každého experimentu zvlášť pro jednotlivá potažení. 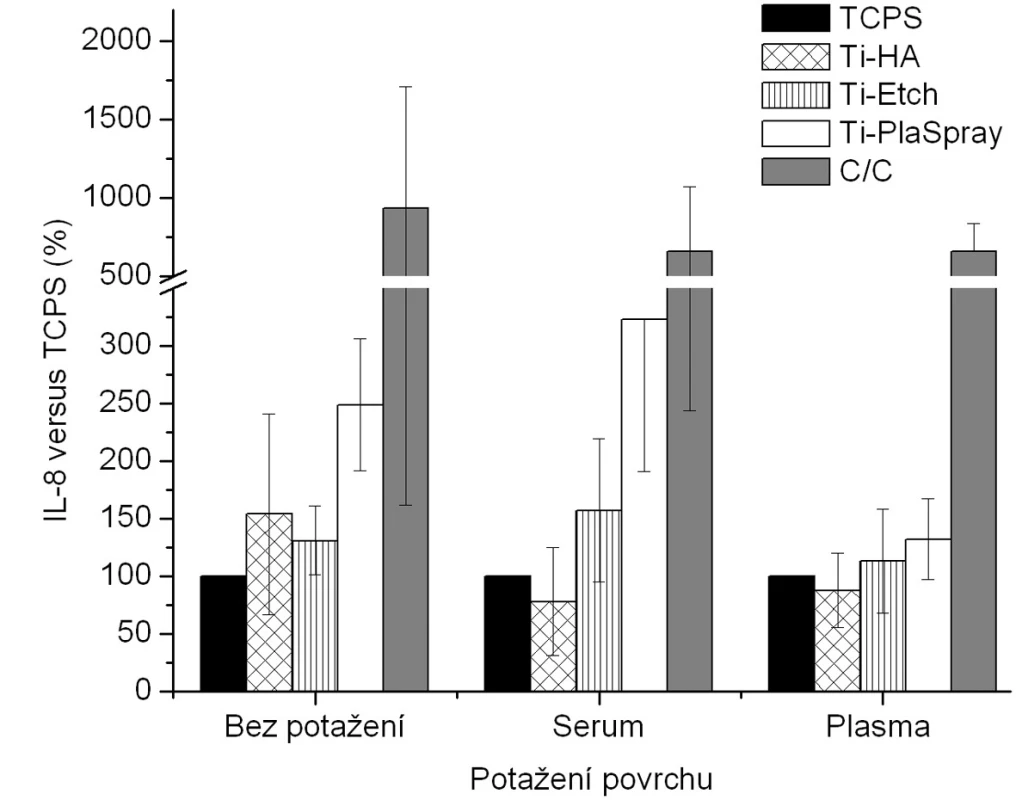
Obr. 4. Produkce TNF-α osteoblasty kultivovanými na původních materiálech a na površích s biologickou úpravou (potažení sérem, aktivovanou plazmou). 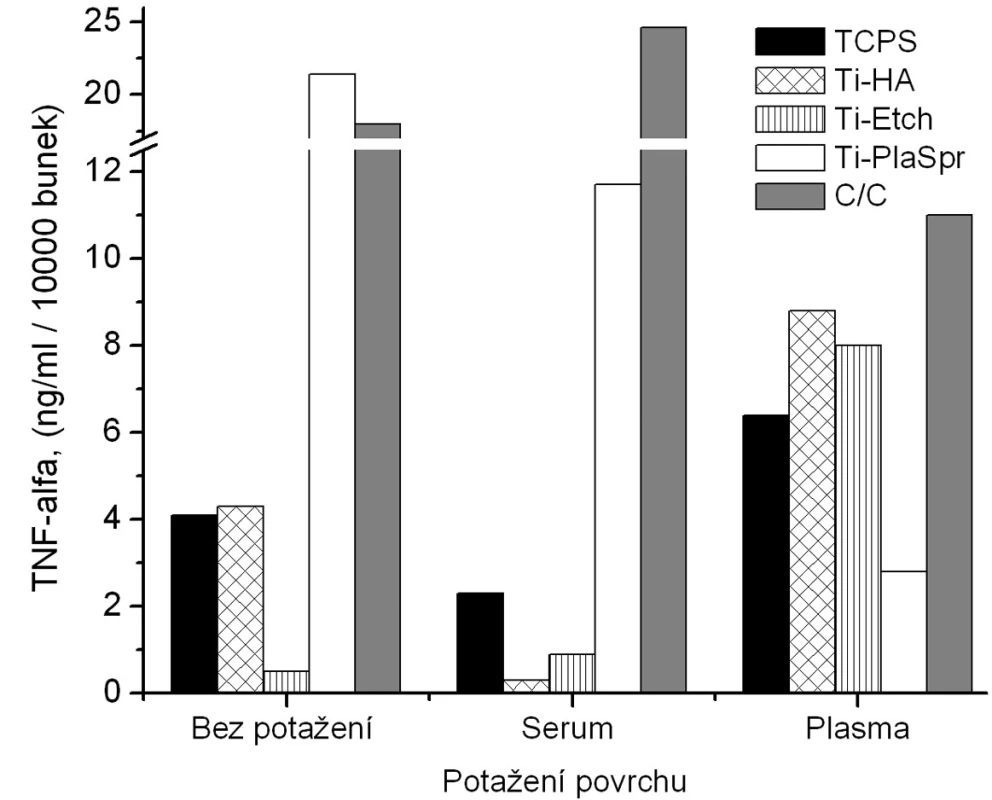
Z hlediska původního chemického složení povrchů byla pozorována u nepotažených materiálů vzrůstající tendence v expresi BAP (obr. 3) v řadě Ti-HA → Ti-Etch → Ti-PlaSpray → C/C kompozit což je ve shodě s klesající proliferací na daných materiálech (obr. 2). Z hlediskabiologického potaženístejná exprese BAP, srovnatelná s TCPS kontrolou, je pozorována u potažení aktivovanou plazmou (analogicky s proliferací) (vyjma C/C kompozitu). Žádné signifikantní změny produkce BAP bez ohledu na typ biologického potažení nebyly detekovány u Ti-Etch. U povrchu Ti-PlaSpray bylo pozorováno snížení exprese BAP jen u potažení aktivovanou plazmou. Pouze pokrytí vzorků C/C kompozitu oběma typy krevních komponentů nevedlo ke změnám v produkci BAP. Obdobné závěry jako pro BAP byly nalezeny též pro zánětlivý chemokin IL-8 (obr. 4).
V případě produkce TNF-α jsou na obrázku 5 uvedeny výsledky jenom z jedné kultivace osteoblastů, jelikož výsledky ostatních ELISA analýz ze zbývajících dvou kultivací byly velice rozporuplné. Data na obrázku 5 mají spíše informativní charakter a jakékoliv obecné závěry by byly zavádějící. Jediným závěrem je, že zatímco pokrytí implantačních materiálům sérem vedlo ke snížení produkce TNF-α , potažení plazmou mělo vliv opačný.
4. ZÁVĚR
Vysoká proliferace byla na nepotahovaných površích způsobena osteokonduktivní vrstvou v případe Ti-HA, přítomností funkčních skupin zvyšujících hydrofilitu a drsnost u Ti-Etch a díky vysoké drsnosti materiálu Ti-PlaSpray. Na druhé straně nízká proliferace byla nalezena u C/C kompozitu, kvůli jeho téměř nulové hodnotě polární složky γP povrchové energie.
Buněčná proliferace je nižší na nepotažených površích ve srovnání s TCPS kontrolou. Potažení aktivovanou plazmou (fibrinovou sítí) vedlo ke vzniku unifikovaného povrchu se srovnatelnou proliferací osteoblastů. Oproti tomu, sérum (albumin) nemá takový stimulační efekt na osteoblasty jak jsem předpokládali.
Při hodnocení syntetické aktivity byla zjištěna vzrůstající tendence v expresi markeru osteoblastické aktivity BAP u nepotažených materiálů v řadě Ti-HA → Ti-Etch → Ti-PlaSpray → C/C kompozit u všech vzorků, což odpovídá klesající proliferaci. Obdobná situace je pozorována u zánětlivého chemokinu IL-8. Z pokusů je možné vyvodit, že potažení plazmou, tj. fibrinovou sítí vede k unifikaci povrchů jak z hlediska proliferace, tak i z hlediska syntetické aktivity.
Závěrem je možné konstatovat, že pokrytí aktivovanou plazmou (tj. fibrinovou sítí) vede k povrchu s potřebnou rovnováhou mezi mírou proliferace a syntetické aktivity osteoblastů jako modelu imunitní odpovědi organismu na zavedený implantát.
Práce byla podpořena grantem IGA MZCR No. 8829 – 3 / 2006
prom. biolog Vlasta Pešáková
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
e-mail: pesakova@seznam.cz
Zdroje
1. Groth T, Altankov G. Cell-surface interactions and the tissue compatibility of biomaterials. New Biomedical Materials, Haris P.I. and Chapman D. (Eds.) IOS Press, 199; 12–23.
2. Puleo DA, Nanci A. Understanding and controlling the bone-implant interface. Biomaterials 1999; 20 : 2311–21.
3. ISO 10993–5: Biological evaluation of medical device.
4. Park JY, Gemmell CH, Davies JE. Platelet interactions with titanium: modulation of platelet activity by surface topography. Biomaterials 2001; 22 : 2671–77.
5. Jones MI, McColl JR, Grant DM, Parker KG, Parker TL. Protein adsorption and platelet attachment and activation, on TiN, TiC; 52 : 413–21.
6. Pešáková V, Smetana K Jr, Balík K, Hruška J, Petrtýl M, Hulejová H, Adam M. Biological and biochemical properties of the carbon composite and polyethylene implant materials. J Mater Sci: Mater Med 2003; 14 : 531–37.
7. Laughton C. Quantification of attached cells in microtiter plates based on Coomassie Brilliant blue G-250. Staining of total cellular protein. Anal Biochemistry 1984; 140 : 417–23.
8. Mosmann T. Rapid colorimetric assay for cell proliferation and survival application to proliferation and cytotoxicity assays. J Immun Methods 1983; 65 : 55–61.
9. Quirynen M, Bollen C.M.L. The influence of surface roughness and surface free energy on supra - and subgingival plaque formation in man. A review of the literature. J Clin Periodontol 1995; 22 : 1–20.
10. Milleding P, Gerdes S, Holmberg K, Karlsson S. Surface energy of noncorroded and corroded dental ceramic materials before and after contact with salivary proteins. Eur J Oral Sci 1999; 107 : 384–392.
11. Groth T, Altankov G, Klosz K. Adhesion of human peripheral blood lymphocytes is dependent on surface wettability and protein preadsorption. Biomaterials 1994; 15 : 423–28
12. Pesakova V, Kubies D, Hulejova H, Himmlova L. The influence of implant surface properties on cell adhesion and proliferation. J Mater Sci: Mater Med 2007; 18 : 465–73.
13. Price C.P. Multiple forms of human serum alkaline phosphatase: Detection and quantitation. Ann Clin Biochem 1993; 30 : 355–72.
14. Nanes M.S. Tumor necrosis factor : molecular and cellular mechanisms in skeletal pathology. Gene 2003; 321 : 1–15.
15. Fritz EA, Glant TT, Vermes C, Jacobs JJ, Roebuck KA. Titanium particles induce the immediate early stress responsive chemokines IL-8 and MCP-1 in osteoblasts. J Orthop Res 2002; 20 : 490–98.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2009 Číslo 2- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Třeboňské revmatologické dny Abstrakta – sekce Středně zdravotnických pracovníků v revmatologii
- HLA-Cw*0602 jako predispoziční alela rozvoje psoriatické artritidy
- Utilizace zdravotní péče a náklady pacientů s revmatoidní artritidou léčených TNF-α inhibitory v České republice
- Omezený význam prokalcitoninu v odlišení septického stavu od vzplanutí autoimunitního onemocnění
- Vliv biologické úpravy povrchu vybraných implantačních materiálů na proliferaci a syntetickou aktivitu kostních buněk. Studie in vitro
- Sekundární imunodeficitní stav s infekčními komplikacemi po imunosupresivní terapii u nemocné se systémový lupus erytematodes
- Třeboňské revmatologické dny Abstrakta odborného programu
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- HLA-Cw*0602 jako predispoziční alela rozvoje psoriatické artritidy
- Třeboňské revmatologické dny Abstrakta odborného programu
- Omezený význam prokalcitoninu v odlišení septického stavu od vzplanutí autoimunitního onemocnění
- Sekundární imunodeficitní stav s infekčními komplikacemi po imunosupresivní terapii u nemocné se systémový lupus erytematodes
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



