-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vaginální mikrobiom
Vaginal microbiome
Objective:
Presentation of complex information about the vaginal microbiota from historical view to current concepts with focus on latest findings on the structure and functioning of the vaginal microbiome.
Design:
Review article.
Setting:
Department of Clinical Microbiology, University Hospital and Faculty of Medicine in Hradci Králové, Charles University in Prague.
Methods:
Literature review using the databases (PubMed, Web of Science, Ovid, etc.) with keywords (vaginal microbiota/ microbiom; vaginal discharge; bacterial vaginosis; vulvovaginitis; vaginal Lactobacillus).
Results:
The vaginal microbiome is a specific compartment of the human microbiome. Unique conditions of the vagina are characterized by a few microbial species, usually lactobacilli, which are able to utilize glycogen, which is under control of estrogens. Lactobacilli and other fermentative bacteria together with vaginal epithelial cells produce lactic acid and are responsible for acidifying vaginal milieu. Lactic acid occurs in two isomeric forms, and their relative ratio is likely to give the vaginal microbiota a certain degree of stability and ability to withstand some infections. This microbiota is manifested by a low degree of diversity and by the high dynamics of changes of its composition under the influence of various exogenous and endogenous factors. Increase in diversity can be paradoxically associated with a dysbiosis such as bacterial vaginosis. Individual species of lactobacilli mainly Lactobacillus crispatus characterize the main community state types in the vagina. Apart from lactobacilli, healthy women may be colonized with a non-lactobacillary microbiota whose rate is dependent on ethnicity. Conclusion: The definition of vaginal microbiota cannot be only related to the presence or absence of individual microorganisms, although the incidence of some of them can be correlated with dysbiosis or eubiosis. The composition of microbiota is important, but it is only one of the basic attributes of normal vaginal microbiota, but not sufficient; that is the functional definition of vaginal microbiota in relation to its structure and dynamics, including the influence of ethnicity, physiological status of the vagina, and genetic disposition of woman.
Keywords:
vaginal microbiome, dysbiosis, community state types, Lactobacillus, lactic acid, pH, H2O2, sexual hormones, historical and recent concept
Autoři: V. Buchta
Působiště autorů: Ústav klinické mikrobiologie FN a LF UK, Hradec Králové, přednostka doc. MUDr. H. Žemličková, Ph. D.
Vyšlo v časopise: Ceska Gynekol 2018; 83(5): 371-379
Kategorie: Přehledový článek
Souhrn
Cíl studie:
Podat komplexní informace o vaginální mikrobiotě z historického pohledu až po nejnovější poznatky o struktuře vaginálního mikrobiomu a jeho fungování.
Typ studie:
Přehledový článek.
Název a sídlo pracoviště:
Ústav klinické mikrobiologie, Fakultní nemocnice a LF UK, Hradec Králové.
Metodika:
Literární rešerše a kompilace dat s využitím databází PubMed, Web of Science, Ovid, a dalších na základě klíčových slov (vaginal microbiota/ microbiom; vaginal discharge; bacterial vaginosis; vulvovaginitis; vaginal Lactobacillus).
Výsledky:
Vaginální mikrobiom představuje specifický kompartment lidského mikrobiomu. Jedinečné podmínky poševního prostředí charakterizuje relativně chudá a vysoce specifická nutriční nabídka ve formě glykogenu, jehož dostupnost je pod kontrolou estrogenů. Kyselé pH je výsledkem produkce laktátu vaginálními epiteliemi, a zvláště fermentativními bakteriemi, kterým dominují laktobacily. Kyselina mléčná se vyskytuje ve dvou izomerních formách a jejich vzájemný poměr pravděpodobně uděluje vaginální mikrobiotě určitý stupeň stability a schopnosti odolávat některým, zejména pohlavně přenosným infekcím. Výsledkem je nízká diverzita vaginální mikrobioty a naopak vysoká dynamika změn jejího složení pod vlivem různých exogenních a endogenních faktorů. Zvýšení diverzity může být paradoxně spojeno s dysbiotickým stavem, jako je bakteriální vaginóza. Jednotlivé vaginální laktobacily, typicky Lactobacillus crispatus, charakterizují hlavní komunitní typy vaginálního společenstva. Vedle toho však může u zdravých žen existovat také alternativní ne-laktobacilární mikrobiota, jejíž frekvence výskytu je závislá na etnickém původu.
Závěr:
Definici vaginální mikrobioty nelze jednoznačně vztáhnout na přítomnost či absenci jednotlivých mikroorganismů, i když výskyt některých z nich relativně silně koreluje s dysbiózou či eubiózou. Složení mikrobioty je důležité, ale je jen jedním ze základních atributů přirozené mikrobioty pochvy. Funkční definice vaginální mikrobioty vyplývá z její struktury a dynamiky, ale také vztahu k etnicitě, fyziologickému statusu poševního prostředí a genetické výbavě ženy.
Klíčová slova:
vaginální mikrobiom, dysbióza, komunitní typy, Lactobacillus, kyselina mléčná, pH, H2O2, sexuální hormony, historický koncept, současný pohled
ÚVOD
Studium lidské mikrobioty v posledním desetiletí poodhalilo mnohá skrytá území nepoznaného a plně nepochopeného společenství mikroorganismů a jejich působení na zdraví a nemoci člověka. Výsledky reprezentované „Human Microbiome Project“ potvrdily a platí to také o vaginálním mikrobiomu, že si bude nutné poopravit naši představu o skutečném významu mikroorganismů, které osídlují naše těla [27]. Přibývající poznatky o mikrobiotě nás postupně přenášejí od místopisného studia k jejich funkčnímu významu. Vaginální mikrobiota zaujímá zvláštní místo, které je implicitně dáno anatomickou lokalizací, specifickou potravní nabídkou a, v souvislosti s reprodukční rolí, úzkou vazbou na sexuální hormony. Ale také historickým kontextem, protože pionýrské kroky na poli studia vaginální mikrobioty byly položeny již na úsvitu éry moderní mikrobiologie, na přelomu 19. a 20. století.
TRADIČNÍ POHLED NA POŠEVNÍ MIKROBIOTU
Když v roce 1892 profesor Albert Döderlein studoval vaginální sekret a popisoval grampozitivní nepohyblivé a nesporulující tyčky, si už tehdy uvědomil, že tvorba kyseliny mléčné uděluje těmto bakteriím kompetiční výhodu v potlačování nepříznivé mikroflóry v pochvě [14]. Pojem Döderleinův bacil se na dlouhá desetiletí usídlil v učebnicích gynekologie, samotná bakterie byla později klasifikována Stanley Thomasem jako Lactobacillus acidophilus [63]. Koncept přirozené vaginální mikrobioty vycházel z osy estrogen – glykogen – laktobacily – kyselé pH, ve kterém laktobacily masivně osídlují vaginální sliznici pod vlivem pohlavních hormonů. Estrogeny podporují tvorbu a ukládání glykogenu v epiteliálních buňkách, který je následně katabolizován laktobacily, což v konečném důsledku vede k acidifikaci prostředí a potlačení patogenních mikroorganismů (obr. 1) [14, 42, 53]. Odtud laktobacily coby synonymum poševního zdraví. Tento koncept se postupně rozvíjel jednak směrem k laktobacilární složce, jednak k mikrobům, které odpovídaly za poruchy a nemoci pochvy infekčního původu.
Obr. 1. Tradiční koncept vaginální mikrobioty 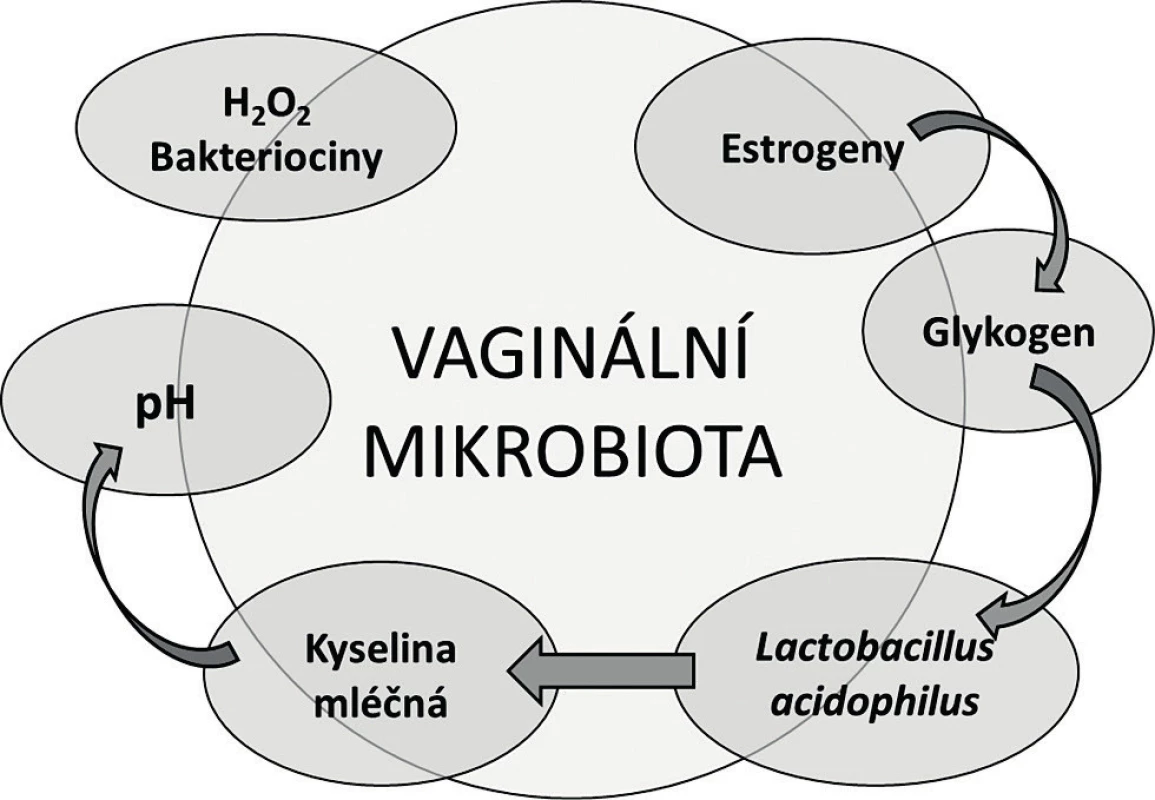
Již před sto lety řada autorů poukázala na značnou morfologickou a fyziologickou heterogenitu vaginálních izolátů laktobacilů a zpochybňovala existenci jediného druhu – L. acidophilus [42, 53]. Pokračující studium ve 20. a 30. letech minulého století vyústilo v návrh klasifikace mikrobioty pochvy do tří typů (grades): grade I, odpovídající L. acidophilus, grade II, směs laktobacilů a difteroidů, a grade III, směs difteroidů, enterokoků, stafylokoků, koliformních bakterií. Typ I byl považován za zdravou mikrobiotu, typ III za patogenní a typ II za přechodnou mikrobiotu [69]. Konkrétní bakterie, které se podílely na patologii vaginálního prostředí, však nebyly blíže identifikovány. Odpověď poskytly až práce Gardnera a Dukese, kteří nežádoucí projevy v pochvě popsali jako nespecifickou vaginitidu, kterou spojili s pleomorfní tyčinkou Gardnerella vaginalis, nedlouho předtím popsanou Leopoldem [24, 34]. Tato etapa studia vaginální mikrobioty byla završena Spieglovou a Nugentem, kteří gardnerely spolu se zástupci rodu Mobiluncus a Bacteroides zakomponovali do Nugentova skóre, které se stalo zlatým standardem mikroskopického hodnocení poševního sekretu ve vztahu k bakteriální vaginóze (BV) [35, 36, 44, 58]. Výsledné skóre popisuje poměrné zastoupení zdravé (laktobacily) a potenciálně patogenní (anaerobní bakterie) mikrobioty, které představovalo laboratorní alternativu ke klinické diagnóze BV podle Amselových kritérií [3].
Ačkoliv se Nugentovo skóre ukázalo u většiny pacientek užitečné v rozlišení zdravé mikrobioty (skóre 3 a méně) a bakteriální vaginózy resp. deskvamační (aerobní) vaginitidy (skóre nad 7), šedá zóna reprezentující skóre 4–6 a také nálezy potenciálních bakteriálních patogenů u zdravých žen naznačily, že ho nelze aplikovat resp. správně interpretovat ve všech případech. I přes dílčí snahu o vylepšení Nugentova skóre či zavedení jiných skórovacích systémů, jako byl laktobacilární grading k diagnóze aerobní vaginitidy, bylo stále více zřejmé, že klasický koncept poševní mikrobioty není schopen vysvětlit všechny aspekty spojené se zdravou, atypickou a patologickou vaginální mikrobiotou a jejími projevy [15, 28, 30, 52]. To vedlo k postupné revizi tradičního pohledu na poševní mikrobiom.
ZMĚNY KONCEPTU POŠEVNÍ MIKROBIOTY
V 80. letech definitivně padla představa taxonomické uniformity poševních laktobacilů, když se potvrdilo, že L. acidophilus je ve skutečnosti komplex více druhů [33, 50]. Přesto se ve většině studií opakovala jména jen několik druhů, jako L. crispatus, L. gasseri a L. jensenii, zatímco ostatní laktobacily byly izolovány méně často, např. L. plantarum, L. rhamnosus, L. salivarius či L. vaginalis [59]. Jeden druh dlouho unikal pozornosti mikrobiologů kvůli odlišným kultivačním nárokům. Jednalo se o L. iners, který dnes představuje nejčastěji izolovaný druh laktobacila z pochvy [18]. Jedna základní charakteristika spojená s vaginálními laktobacily se však neměnila, pokud byly přítomny, obvykle dominoval jeden nebo dva druhy [50, 65]. Také přibývalo studií, které poukazovaly na těsnější vztah mezi druhem laktobacila a etnickým původem ženy [50].
Podobně jako u laktobacilů prošel vývojem i pohled na potenciálně patogenní mikrobiotu. Vedle tradičních představitelů, jako jsou G. vaginalis, rod Mobiluncus či Bacteroides, přibývaly na seznam možných původců BV zástupci dalších anaerobních bakterií, jako jsou Megasphaera, Mycoplasma hominis, Porphyromonas, Prevotella, Sneathia (Leptotrichia), Eggerthella-like [25, 50, 59]. Typickým příkladem je Atopobium vaginae – anaerobní tyčinka, jejíž patologické projevy se téměř výhradně pojí s vysokými náložemi anebo se současným výskytem s G. vaginalis [37]. Kmeny A. vaginae se vyznačují sníženou citlivostí k metronidazolu, což může vysvětlovat terapeutické selhání a recidivy u některých pacientek s BV [19]. Další studium poodhalilo významnou populační heterogenitu atopobií a gardnerel, která vysvětlovala, proč jejich nález v pochvě není spolehlivým indikátorem BV. Analýza na kmenové úrovni ukázala, že virulence G. vaginalis je značně variabilní, vázaná na schopnost adherence k epiteliím, tvorbu vaginolyzinu, a zejména biofilmu. Biofilm se podílí na pohlavním přenosu a zároveň je předpokladem koinfekce A. vaginae [62]. V případě A. vaginae se navíc ukázalo, že tento druh není jediným zástupcem tohoto rodu, který se vyskytuje v pochvě [38].
K dalším potenciálním patogenům BV patří i nově popsaná skupina klostridií označovaná jako BVAB (bacterial vaginosis-associated bacteria), zastoupených BVAB1, BVAB2 a BVAB3 (dnes Mageeibacillus indolicus) [4, 25]. Řada těchto bakterií byla studována jako možný indikátor BV. Byl tady ale problém, že většina výše uvedených kandidátů BV se vyskytuje také u zdravých žen. Platí to jak pro G. vaginalis, tak pro A. vaginae a ukazuje na komplexnost dané problematiky. Přesto se postupně začal vyčleňovat užší okruh bakterií nebo jejich konsorcií, u kterých bylo možno vysledovat tendenci jejich návaznosti na nežádoucí či patologické projevy v pochvě. Avšak tato spojitost, napříč dysbiotickými stavy, nebyla absolutní. Bylo zřejmé, že hledání jednoho univerzálního patogena narazilo na své limity.
BUDOVÁNÍ NOVÉHO KONCEPTU POŠEVNÍ MIKROBIOTY
Klíčem k pochopení, co je přirozená vaginální mikrobiota, je fyziologie poševního prostředí v širším slova smyslu, včetně mikrobů, které je spoluvytváří. Dominantní druhy vaginálních laktobacilů představují do značné míry funkčně konzistentní skupinu fermentativních bakterií, jejichž přítomnost a působení na vaginální sliznici odpovídá za unikátní vlastnost tohoto kompartmentu – kyselé pH. Člověk je v tomto ohledu mezi ostatními savci včetně nejbližších příbuzných, primátů, výjimkou, protože ti mají pH vyšší [73]. Vzhledem k tomu, že kyselé pH je považováno za protektivní a je spojeno s vyššími počty laktobacilů a tvorbou laktátu, lze v duchu klasického konceptu vaginální mikrobioty předpokládat, že dominance laktobacilů a acidita (< 4,5) jsou příznakem zdravého poševního prostředí. Avšak snížené pH pochvy není jenom výsledkem metabolické aktivity laktobacilů, významnou roli hrají také vaginální epitelie a jiné bakterie.
KYSELINA MLÉČNÁ A pH POCHVY
Historicky byla kyselina mléčná ve vagině popsána jako racemát [42]. Dnes je zřejmé, že se jedná o dvě funkčně ne zcela identické izoformy; jejich aktivita je závislá na protonizaci a vzájemný podíl je klíčový pro vyvážené poměry ve vaginálním lumen [46]. Zatímco na tvorbě L-izomeru se podílejí vaginální epitelie a různé laktobacily, produkce D-izomeru je spojena jen s několika druhy laktobacilů, zejména L. crispatus a L. jensenii, ale už ne s nejhojněji se vyskytujícím L. iners [72]. Předpokládá se, že relativní nedostatek D-formy činí poševní prostředí zranitelnějším nejenom směrem k dysbiotické anaerobní mikrobiotě, ale i k riziku ascendentních infekcí horních partií ženského genitálu. D-forma totiž kontroluje extracelulární induktor metaloproteinázy (EMMPRIN), a tím nepřímo aktivitu matrixové metaloproteinázy 8 (MMP 8), která může narušovat integritu cervikální zátky, a tím zvyšovat náchylnost vůči mikrobiální invazi [72]. Na druhé straně byl naznačen pozitivní podíl L-laktátu na protizánětlivém charakteru BV a regulaci iontových poměrů v pochvě [41]. Působení laktátu je také spojeno s jeho antimikrobním účinkem na původce pohlavně přenosných nemocí, jako jsou Chlamydia trachomatis, Neisseria gonorrhoeae, Trichomonas vaginalis, HIV, herpes-simplex virus nebo lidský papiloma virus [1]. Shrnuto, kyselina mléčná zůstává ukotvena v tradičním konceptu vaginálního mikrobiomu, ale její význam je širší. Hlavním producentem zůstávají laktobacily, ale ty mohou být zastoupeny jinými fermentativními bakteriemi. Výsledný účinek laktátu je závislý na chiralitě a protonizaci molekuly [46].
Pro tvorbu kyseliny mléčné v pochvě je klíčová dostupnost glykogenu. Tento předpoklad byl však od samého začátku studia vaginálního prostředí zpochybňován, což bylo ve zdánlivém protikladu k všeobecně přijímanému názoru a dokladům přímého spojení mezi depozitem glykogenu v epiteliích, kolonizací laktobacily a kyselým pH [42, 53]. Teprve nedávno přinesly pokusy více světla do této záležitosti. Ve vaginální tekutině byla detekována α-amyláza jako klíčový enzym, který je odpovědný za štěpení glykogenu. Překvapivě se ukázalo, že není mikrobiálního, ale hostitelského původu [57]. To podporuje evolučně pokročilejší stupeň adaptace laktobacilů na poševní poměry u lidí.
Je zřejmé, že role laktátu a pH v pochvě je mnohem komplexnější. Vedle dominantního vlivu laktobacilů (hlavní producenti D-formy) a vaginálních epitelií (producenti L-formy) se na ní podílejí i další bakterie. Zvláštní na této alternativní skupině producentů laktátu je, že se složením do značné míry překrývá s BV. Můžeme ji definovat jako funkčně konzistentní skupinu heterofermentativních bakterií, které zvyšují diverzitu vaginálního mikrobiomu ve srovnání s laktobacilární mikrobiotou. Univerzální vyznění osy estrogen-glykogen-laktobacilus-kyselé pH je také do určité míry zpochybněno klinickými nálezy. Bylo zjištěno, že laktobacily mohou kolonizovat pochvu premenarcheálních dívek při nízkých koncentracích estrogenu a při současně vysokých hladinách volného glykogenu. A naopak, dívky, které nebyly osídleny laktobacily, měly kyselé vaginální pH [40]. Acidita pochvy je tak důležitou podmínkou pro rozvoj a stabilitu zdravé mikrobioty, ale pH samo o sobě stejně jako složení mikrobioty nemusí být spolehlivým indikátorem jejího zdraví. Klíčový je klinický korelát s ohledem na mikrobiologický a fyziologický kontext.
ROLE PEROXIDU VODÍKU
Na rozdíl od kyseliny mléčné a kyselého pH role H2O2 zůstává do značné míry kontroverzní [45, 54, 64]. Reálné poměry poševní sliznice pro tvorbu a stabilitu H2O2 nejsou optimální, protože zde panuje silně hypoxické prostředí. Navíc, samotná vaginální tekutina má výraznou antioxidační aktivitu a samotné laktobacily nevynikají přílišnou odolností vůči H2O2 [45, 46]. V praxi může být obtížné vždy oddělit účinek laktátu od H2O2 u zdravých žen, protože ty jsou obvykle osídleny H2O2-produkujícími kmeny laktobacilů, jako je L. crispatus [17]. Ani klinické studie do této problematiky nevnesly více světla, i když v jedné z nich více než polovina žen s BV reagovala pozitivně na výplach 3% H2O2 [10]. Kontroverze kolem účinku H2O2 na bakterie, ale podobně i na kvasinky tak zůstávají [21, 61]. To může být do značné míry dáno skutečností, že většina studií historicky pracovala s L. acidophilus, který, jak dnes víme, je komplexem více druhů.
FAKTORY OVLIVŇUJÍCÍ VAGINÁLNÍ PROSTŘEDÍ
V pochvě se vedle kyseliny mléčné a H2O2 uplatňují i další endogenní a exogenní faktory s dopadem na přirozenou mikrobiotu, a podtrhují tak komplexní a dynamickou povahu vaginálního ekosystému. Mezi exogenní patří především sexuální aktivita (frekvence, chráněný vs. nechráněný sex, sexuální praktiky). Při nechráněném styku dochází k mikrotraumatizaci sliznice, přechodnému zvýšení pH po ejakulaci a pravděpodobně ke zvýšené aeraci poševního kanálu [5, 64]. K nepříznivým vlivům patří nadužívání intimní hygieny, časté výplachy pochvy s nevhodným pH, ale také kouření [5, 6]. Do této kategorie lze zařadit i antikoncepci s vyšším podílem hormonů a v neposlední řadě neadekvátní podávání antibiotik u poševních infekcí, které nemají oporu ve správné diagnostice.
Endogenní faktory reprezentují sexuální hormony, které podstatným způsobem formují vaginální kompartment interakcí s vaginálními mikroorganismy a imunitou hostitele. Estrogeny spolu s progesteronem určují základní parametry poševního prostředí, jako je podpora tvorby glykogenu, imunitní vyladění pochvy a v neposlední řadě, možná, i přímý účinek na některé vaginální mikroby [70, 71]. Za zmínku stojí rovněž působení depotní formy progesteronu (DMPA – depotní medroxyprogesteron acetát), která se používá u substituční hormonální terapie a která snižovala podíl H2O2-produkujících kmenů laktobacilů a kolonizaci kandidami [39]. To může vysvětlovat pozitivní výsledky léčby tímto gestagenem u části pacientek s rekurentní vulvovaginální kandidózou [56, 71].
VAGINÁLNÍ MIKROBIOTA
Vaginální mikrobiota je v rámci lidského mikrobiomu do značné míry výjimečná svou relativně nízkou diverzitou, která je u většiny zdravých žen spojována s dominancí laktobacilů [27, 50]. Pokud jde o původ vaginálních laktobacilů, předpokládá se, že pocházejí ze střevního rezervoáru, podobně jako gardnerely a kandidy. V průběhu evoluce se pak laktobacily specializovaly na specifické podmínky pochvy, charakterizované vysokou nabídkou glykogenu a nízkým pH. V posledních letech také přibývá dokladů o spojitosti mezi mikrobiotou dutiny ústní a pochvou [16, 47].
Odpověď na otázku, jak funguje vaginální mikrobiom, nám spíše než přítomnost mikroba a mikrobiální spektrum řekne množství a proporce jednotlivých druhů a jejich vlastnosti. Vaginální mikrobiota vytváří vyšší celky, komunitní typy (CST, community state types), které charakterizují a spoluurčují hlavní atributy vaginálního kompartmentu [65].
Akcelerátorem výzkumu vaginálního mikrobiomu se stalo zavedení kultivačně nezávislých metod založených na analýze sekvence genů 16S rRNA do rutinní experimentální praxe [26]. Výsledky metagenomických studií prokázaly v pochvě existenci několika, v závislosti na metodice dvou až sedmi, základních komunitních typů [65]. Klasická práce Ravela et al. [50] rozlišuje pět CST, ve kterých, až na jeden resp. jeho dva podtypy (CST IV A, CST IV B), dominoval jeden druh laktobacila (L. crispatus, L. gasseri, L. iners, L. jensenii) (tab. 1). Tyto nálezy modifikovaly původní koncept zdravé pochvy ve smyslu nahrazení komplexu L. acidophilus za jednotlivé druhy laktobacilů, zejména L. crispatus (CST I). Potvrdilo se, že spektrum laktobacilů je odlišné na základě etnického původu. Navíc, překvapivě, u části zdravých žen, zejména afroamerické a hispánské populace, laktobacily v pochvě buď zcela chyběly, nebo byly přítomny jen marginálně [23, 50]. Tyto ne-laktobacilární, diverzifikované komunity (CST IV A, CST IV B) se vyznačovaly mírně zvýšeným pH (4,5–5,0) a svým složením se blížily dysbiotické mikrobiotě BV (odtud také označení BV-like nebo BV-associated bacteria) (tab. 1). Ukazuje se, že BV-like bakterie významně zasahují do metabolického a imunologického profilu vaginální mikrobioty, zejména schopností produkovat aminy a mastné kyseliny s krátkým řetězcem, jako jsou acetát, butyrát nebo sukcinát [1]. Tyto metabolity, na rozdíl od střevní mikrobioty, vykazují v pochvě prozánětovou aktivitu, alkalizují poševní milieu a zřejmě mohou mít i přímý inhibiční účinek na některé imunitní funkce [2].
Tab. 1. Charakteristika hlavní typů mikrobiálních společenstev vaginálního mikrobiomu* 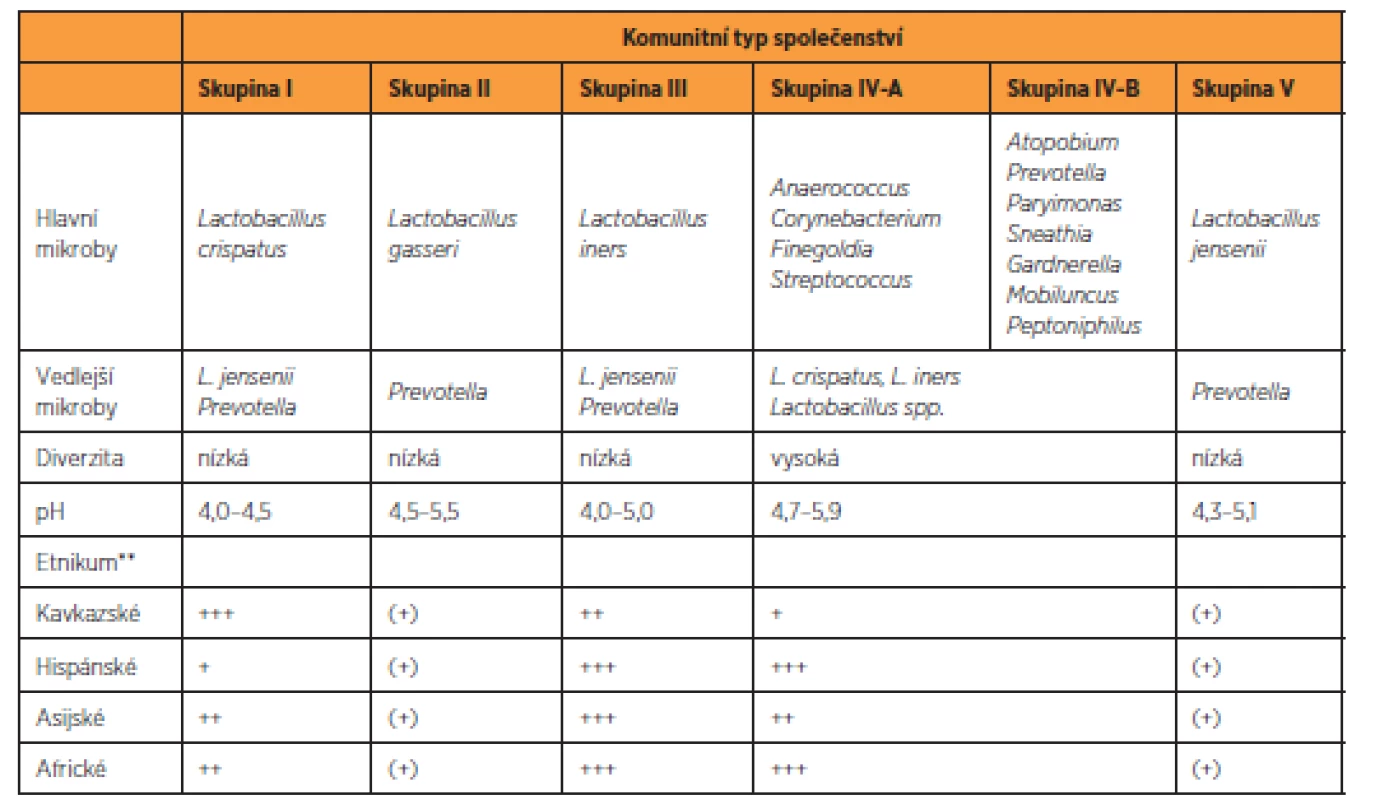
* angl. community state type (CST), podle Ravel et al. 2011 [50]
** zastoupení v rámci skupiny: +++ 30-50%; ++ 30-15%; + 15-10; (+) <10 %LAKTOBACILY, VAGINÁLNÍ MIKROBIOTA – VZTAH KE ZDRAVÍ A NEMOCI
Význam jednotlivých laktobacilů a komunitních typů v pochvě je v současnosti předmětem zvýšeného zájmu, protože takové informace lze v budoucnosti využít jak v diagnostice přirozených a dysbiotických stavů mikrobioty, tak při manipulaci vaginální mikrobioty pomocí probiotik a prebiotik [51, 74]. Jako perspektivní a slibné se jeví výsledky transplantace vaginálních sekretů z matky na novorozence po porodu, i když v případě rutinního zavedení je na místě obezřetnost [12]. U většiny zdravých žen, zvláště u kavkazské a asijské populace, dominuje v pochvě L. crispatus, menší podíl komunitních typů zahrnuje L. gasseri a L. vaginalis. Pokud jde o L. jensenii, nebývá vždy identifikován jako hlavní složka vaginální komunity. Lactobacillus crispatus je obecně považován za stabilizující prvek poševní mikrobioty, který snižuje náchylnost k dysbióze v porovnání s ostatními druhy vaginálních mikrobů [55, 68]. Mezi hlavní nástroje antimikrobního působení L. crispatus patří kyselina mléčná, včetně vysokého podílu D-izomeru, schopnost koagregace a tvorba bakteriocinů a toxinů [60]. Z hlediska reprodukční funkce je důležité, že L. crispatus spolu s L. gasseri a L. jensenii je v nepřímém vztahu k zánětlivým markerům v pochvě [32]. Tyto atributy, spolu s kyselým pH, jsou vystupňovány během těhotenství, což naznačuje, že se L. crispatus významně podílí na zajištění a udržení vhodných reprodukčních podmínek [68]. Příznivý efekt L. crispatus a nižší riziko BV bylo doloženo při současné kolonizace rekta a pochvy [16].
Naproti tomu L. iners je univerzální laktobacilus přítomný u většiny žen, ať už zdravých, nebo s BV. Ne vždy je zastoupen početněji, často sdílí své postavení s jinými laktobacily nebo i potenciálně patogenními anaeroby [55]. Má se za to, že L. iners představuje vysoce adaptibilní druh laktobacila, který se dokáže lépe přizpůsobit a odolávat široké škále podmínek ve srovnání s L. crispatus [22]. Tomu nasvědčuje kvantitativní pokles L. crispatus v průběhu menstruace, zatímco počty L. iners se zvyšují [23, 55, 59]. Změna mikrobioty směrem k dominanci nebo přítomnosti L. iners často reprezentuje nestabilní anebo přechodnou vaginální mikrobiotu (Nugent 4 až 6). Tomu odpovídá jeho vyšší zastoupení u žen s BV, syndromem vulvální vestibulitidy, a chronickým vulvovaginálním dyskomfortem. Nález L. iners také predisponuje k riziku infekce vyvolané Chlamydia trachomatis [8, 20, 66]. U těhotných žen je přítomnost L. iners dávána do souvislosti s negativními důsledky pro poševní zdraví, jako je předčasný porod [48].
Z klinického hlediska je rovněž důležité, že ne-laktobacilární mikrobiota je u afroamerických žen spojena s vyšší náchylností k přenosu původců sexuálně přenosných nemocí, jako je HIV, HSV, HPV, chlamydie či trichomonády, ale také s častějšími infekčními komplikacemi po operacích [7, 9, 11, 13, 66]. Samotná etnicita není jediným faktorem, který přispívá k těmto komplikacím. Otázkou je, zda s etnicitou spíše nesouvisí nějaký typ genetické predispozice ve smyslu genového polymorfismu, jaký byl např. popsán či naznačen u rekurentní vulvovaginální kandidózy či BV vyvolané A. vaginae [43, 68]. Spotřeba alkoholu, kouření, počet sexuálních partnerů se mohou také nepříznivě podílet na vzniku dysbiózy. Rovněž přibývá důkazů a indicií, že BV-like mikrobiota podobně jako bakterie BV mají negativní vliv na průběh těhotenství a průběh porodu, jako jsou předčasný porod, potrat nebo nízká váha novorozence [37, 31]. Kromě toho je atypická BV-like mikrobiota spojována se zvýšeným rizikem neúspěšné in vitro fertilizace [67].
Obr. 2. Současný pohled na vaginální mikrobiom 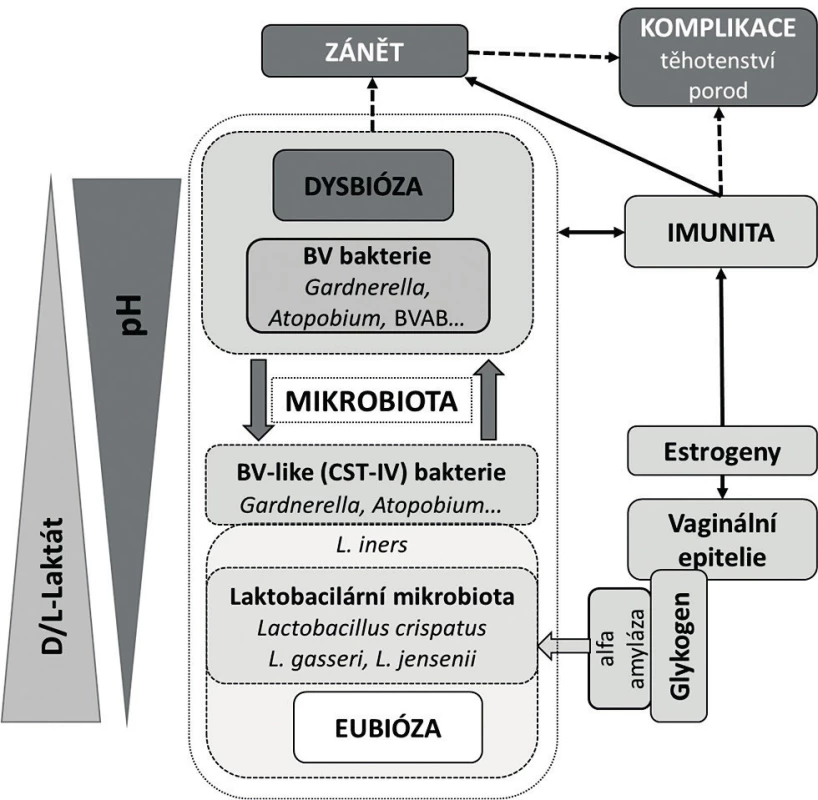
Charakteristickým rysem vaginální mikrobioty je její nápadná dynamika během ontogeneze a pod vlivem různých endogenních a exogenních inzultů [23, 29, 49]. Složení vaginální mikrobioty je primárně pod silným vlivem sexuálních hormonů, a to zejména v období nástupu puberty a po menopauze. V průběhu sexuálně aktivní periody se projevuje v závislosti na menstruačním cyklu jednak prostřednictvím kolísání hladin estrogenu a progesteronu, jednak během menstruace alkalizací poševního prostředí krví. Studie dlouhodobě sledující ženy ukázaly, že u toho samého subjektu změny vaginální mikrobioty během menstruačního cyklu podléhají častým, ale za normálních poměrů reverzibilním změnám [29]. Takové změny, zvláště ty vyplývající z přirozených příčin, nelze však a priori považovat samy o sobě za škodlivé či doklad nefunkční mikrobioty. Jejich vyznění se odvíjí především od intenzity a délky trvání, schopnosti mikrobioty adekvátně reagovat, odolávat a navrátit se do původního stavu. Za přirozených okolností je většina takových změn reverzibilních s minimálním dopadem na zdraví pochvy. Za nežádoucí jsou považovány především ty změny, výsledkem jejichž působení je více či méně trvalé či dlouhodobé poškození složení mikrobioty resp. fyziologie poševního prostředí.
Dosavadní výzkum naznačuje, že termín normální mikrobiota je relativní a v určitých situacích může být až zavádějící, pokud je definován pouze spektrem vaginální organismů. Posouzení významu toho či onoho druhu bakterie v poševním mikrobiomu musí být kontextuální s ohledem na dynamické změny, které jsou svázané s jeho funkčním postavením ve struktuře vaginální mikrobioty a které berou ohled na přítomnost jiných bakterií, na dané fyziologické podmínky v pochvě, na vyladění imunity a v neposlední řadě na klinický obraz. Nová definice vaginálního mikrobiomu tak nebude jenom primárně etiologická, ale bude stát na funkčním postavení a vlastnostech jednotlivých mikroorganismů, které ho utvářejí.
Práce byla podpořena z programového projektu Ministerstva zdravotnictví ČR s reg. č. 15-29225A. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Doc. RNDr. Vladimír Buchta, CSc.
Ústav klinické mikrobiologie FN
Sokolská 581
500 05 Hradec Králové
e-mail: vladimir.buchta@fnhk.cz
Zdroje
1. Aldunate, M., Srbinovski, D., Hearps, AC., et al. Antimicrobial and immune modulatory effects of lactic acid and short chain fatty acids produced by vaginal microbiota associated with eubiosis and bacterial vaginosis. Front Physiol, 2015, 6, p. 164. doi: 10.3389/fphys.2015.00164.
2. Al-Mushrif, S., Eley, A., Jones, BM. Inhibition of chemotaxis by organic acids from anaerobes may prevent a purulent response in bacterial vaginosis. J Med Microbiol, 2000, 49, p. 1023–1030.
3. Amsel, R., Totten, PA., Spiegel, CA., et al. Nonspecific vaginitis. Diagnostic criteria and microbial and epidemiological associations. Am J Med, 1983, 74, p. 14–22.
4. Austin, MN., Rabe, LK., Srinivasan, S., et al. Mageeibacillus indolicus gen. nov., sp. nov.: a novel bacterium isolated from the female genital tract. Anaerobe, 2015, 32, p. 37–42.
5. Beigi, RH., Wiesenfeld, HC., Hillier, SL., et al. Factors associated with absence of H2O2-producing Lactobacillus among women with bacterial vaginosis. J Infect Dis, 2005, 191(6), p. 924–949.
6. Brotman, RM., He, X., Gajer, P., et al. Association between cigarette smoking and the vaginal microbiota: a pilot study. BMC Infect Dis, 2014, 28, 14, p. 471. doi: 10.1186/1471-2334-14-471.
7. Brotman, RM., Bradford, LL., Conrad, M., et al. Association between Trichomonas vaginalis and vaginal bacterial community composition among reproductive-age women. Sex Transm Dis, 2012, 39(10), p. 807–812.
8. Buchta, V., Andrys, C., Bolehovska, R., et al. The role of Candida yeasts in vaginal microbiome in women with chronic vulvovaginal discomfort. J Internat Soc Microbiota, 2017, 4, p. 71 doi: 10.18143/JISM_v4i1.
9. Buve, A., Jespers, V., Crucitti, T., Fichorova, RN. The vaginal microbiota and susceptibility to HIV. AIDS, 2014, 28(16), p. 2333–2344.
10. Cardone, A., Zarcone, R., Borrelli, A., et al. Utilisation of H2O2 hydrogen peroxide in the treatment of recurrent bacterial vaginosis. Minerva Ginecol, 2003, 55(6), p. 483–492.
11. Cherpes, TL., Meyn, LA., Krohn, MA., et al. Association between acquisition of herpes simplex virus type2 in women and bacterial vaginosis. Clin Infect Dis, 2003, 37, p. 319–325.
12. Clemente, JC., Dominguez-Bello, MG. Safety of vaginal microbial transfer in infants delivered by caesarean, and expected health outcomes. BMJ, 2016, 31, 352, p. i1707. doi: 10.1136/bmj.i1707.
13. Dareng, EO., Ma, B., Famooto, AO., et al. Prevalent high-risk HPV infection and vaginal microbiota in Nigerian women. Epidemiol Infect, 2016, 144(1), p. 123–137.
14. Döderlein, A. Das scheidensekret und seine bedeutung fur puerperalfieber. Zentralblatt fur Bakteriology, 1892, 11, S. 699.
15. Donders, GG. Definition and classification of abnormal vaginal flora. Best Pract Res Clin Obstet Gynaecol, 2007, 21, p. 355–373.
16. El Aila, NA., Tency, I., Claeys, G., et al. Identification and genotyping of bacteria from paired vaginal and rectal samples from pregnant women indicates similarity between vaginal and rectal microflora. BMC Infect Dis, 2009 14, 9, p. 167.
17. Eschenbach, DA., Davick, PR., Williams, BL., et al. Prevalence of hydrogen peroxide-producing Lactobacillus species in normal women and women with bacterial vaginosis. J Clin Microbiol, 1989, 27, p. 251–256.
18. Falsen, E., Pascual, C., Sjödén, B., et al. Phenotypic and phylogenetic characterization of a novel Lactobacillus species from human sources: description of Lactobacillus iners sp. nov. Int J Syst Bacteriol, 1999, 49(Pt 1), p. 217–221.
19. Ferris, MJ., Masztal, A., Aldridge, KE., et al. Association of Atopobium vaginae, a recently described metronidazole resistant anaerobe, with bacterial vaginosis. BMC Infect Dis, 2004 13, 4, p. 5.
20. Ferris, MJ., Norori, J., Zozaya-Hinchliffe, M., Martin, DH. Cultivation independent analysis of changes in bacterial vaginosis flora following metronidazole treatment. J Clin Microbiol, 2007, 45, p. 1016–1018.
21. Fitzsimmons, N., Berry, DR. Inhibition of Candida albicans by Lactobacillus acidophilus: evidence for the involvement of a peroxidase system. Microbios, 1994, 80, p. 125–133.
22. France, MT., Mendes-Soares, H., Forney, LJ. Genomic comparisons of Lactobacillus crispatus and Lactobacillus iners reveal potential ecological drivers of community composition in the vagina. Appl Environ Microbiol, 2016, 82(24), p. 7063–7073.
23. Gajer, P., Brotman, RM., Bai, G., et al. Temporal dynamics of the human vaginal microbiota. Sci Transl Med, 2012, 4(132), p. 132.
24. Gardner, HL., Dukes, CD. New etiologic agent in non-specific bacterial vaginitis. Science, 1954, 120, p. 853.
25. Haggerty, CL., Totten, PA., Ferris, M., et al. Clinical characteristics of bacterial vaginosis among women testing positive for fastidious bacteria. Sex Transm Infect, 2009, 85(4), p. 242–248.
26. Hugenholtz, P., Goebel, BM., Pace, NR. Impact of culture-independent studies on the emerging phylogenetic view of bacterial diversity. J Bacteriol, 1998, 180, p. 4765–4774.
27. Human Microbiome Project Consortium. Structure, function and diversity of the healthy human microbiome. Nature, 2012, 486(7402), p. 207–214.
28. Ison, CA., Hay, PE. Validation of a simplified grading of Gram stained vaginal smears for use in genitourinary medicine clinics. Sex Transm Infect, 2002, 78, p. 413–415.
29. Keane, FE., Ison, CA., Taylor-Robinson, D. A longitudinal study of the vaginal flora over a menstrual cycle. Int. J.STD & AIDS, 1997, 8, p. 489–494.
30. Kestřánek, J., Jílek, P., Matula, V., et al. Jaký je aktuální stav diagnostiky vulvovaginálního dyskomfortu v České republice? Pilotní analýza. Čes Gynek, 2013, 78(6), s. 522–527.
31. Koucký, M., Malíčková, K., Hrdý, J., et al. Úloha mateřské imunity a mikrobiomu ženy v patogenezi předčasného porodu. Čes Gynek, 2017, 82(5), s. 407–410.
32. Kyongo, JK., Jespers, V., Goovaerts, O., et al. Searching for lower female genital tract soluble and cellular biomarkers: defining levels and predictors in a cohort of healthy Caucasian women. PLoS One, 2012, 7(8), p. e43951. doi: 10.1371/ journal.pone.0043951.
33. Lauer, E., Helming, C., Kandler, O. Heterogeneity of the species Lactobacillus acidophilus (Moro) Hansen and Mocquot as revealed by biochemical characteristics and DNA-DNA hybridization. Zentbl Bakteriol Microbiol Hyg Abt, 1980, 1, p. 150–168.
34. Leopold, S. Heretofore undescribed organism isolated from the genitourinary system. U S Armed Forces Med J, 1953, 4(2), p. 263–266.
35. Mašata, J., Jedličková, A., Poislová, M., et al. Současné možnosti diagnostiky vulvovaginálních infekcí. Čes Gynek, 2010, 75(2), s. 111–117.
36. Mašata, J., Poislová, M., Jedličková, A., et al. Modifikovaná klasifikace mikroskopického hodnocení poševních infekcí. Čes Gynek, 2010, 75(3), s. 199–208.
37. Menard, JP., Mazouni, C., Salem-Cherif, I., et al. High vaginal concentrations of Atopobium vaginae and Gardnerella vaginalis in women undergoing preterm labor. Obstet Gynecol, 2010, 115(1), p. 134–140.
38. Mendes-Soares, H., Krishnan, V., Settles, ML., et al. Fine-scale analysis of 16S rRNA sequences reveals a high level of taxonomic diversity among vaginal Atopobium spp. Pathog Dis, 2015, 73(4). pii: ftv020. doi: 10.1093/femspd/ftv020. Epub 2015 Mar 15.
39. Miller, L., Patton, DL., Meier, A., et al. Depomedroxyprogesterone-induced hypoestrogenism and changes in vaginal flora and epithelium. Obstet Gynecol, 2000, 96(3), p. 431–439.
40. Mirmonsef, P., Hotton, AL., Gilbert, D., et al. Glycogen levels in undiluted genital fluid and their relationship to vaginal ph, estrogen, and progesterone. PLoS One, 2016, 19, 11(4), p. e0153553. doi: 10.1371/journal.pone.0153553.
41. Mitchell, C., Fredricks, D., Agnew, K., Hitti, J. Hydrogen peroxide-producing lactobacilli are associated with lower levels of vaginal interleukin-1β, independent of bacterial vaginosis. Sex Transm Dis, 2015, 42(7), p. 358–363.
42. Miura, H. Beiträge zum Studium über die Vaginasekrete. Mitt. Med. Akad. Kioto, 1928, 2, Heft 1, 1.
43. Nedovic, B., Posteraro, B., Leoncini, E., et al. Mannose-binding lectin codon 54 gene polymorphism and vulvovaginal candidiasis: a systematic review and meta-analysis. Biomed Res Int, 2014, p. 738298. doi: 10.1155/2014/738298.
44. Nugent, RP., Krohn, MA., Hillier, SL. Reliability of diagnosing bacterial vaginosis is improved by a standardised method of Gram‘s stain interpretation. J Clin Microbiol, 1991, 29, p. 297–301.
45. O‘Hanlon, DE., Moench, TR., Cone, RA. In vaginal fluid, bacteria associated with bacterial vaginosis can be suppressed with lactic acid but not hydrogen peroxide. BMC Infect Dis, 2011, 11, p. 200.
46. O‘Hanlon, DE., Moench, TR., Cone, RA. Vaginal pH and microbicidal lactic acid when lactobacilli dominate the microbiota. PLoS One, 2013, 8(11), p. e80074.
47. Petricevic, L., Domig, KJ., Nierscher, FJ., et al. Characterisation of the oral, vaginal and rectal Lactobacillus flora in healthy pregnant and postmenopausal women. Eur J Obstet Gynecol Reprod Biol, 2012, 160(1), p. 93–99.
48. Petricevic, L., Domig, KJ., Nierscher, FJ., et al. Characterisation of the vaginal Lactobacillus microbiota associated with preterm delivery. Sci Rep, 2014, 30, 4, p. 5136. doi: 10.1038/ srep05136.
49. Ravel, J., Brotman, RM., Gajer, P., et al. Daily temporal dynamics of vaginal microbiota before, during and after episodes of bacterial vaginosis. Microbiome, 2013, 2, 1(1), p. 29. doi: 10.1186/2049-2618-1-29.
50. Ravel, J., Gajer, P., Abdo, Z., et al. Vaginal microbiome of reproductive-age women. Proc Natl Acad Sci U S A., 2011, 108, Suppl. 1, p. 4680–4687.
51. Reid, G. Probiotic and prebiotic applications for vaginal health. J AOAC Int, 2012, 95(1), p. 31–34.
52. Rodrigues, FS., Peixoto, S., Adami, F., et al. Proposal of a new cutoff for Nugent criteria in the diagnosis of bacterial vaginosis. J Microbiol Methods, 2015, 115, p. 144–146.
53. Rogosa, M., Sharpe, ME. Species differentiation of human vaginal lactobacilli. J Gen Microbiol, 1960, 23, p. 197–201.
54. Rosenstein, IJ., Fontaine, EA., Morgan, DJ., et al. Relationship between hydrogen peroxide-producing strains of lactobacilli and vaginosis-associated bacterial species in pregnant women. Eur J Clin Microbiol Infect Dis, 1997, 16(7), p. 517–522.
55. Santiago, GL., Tency, I., Verstraelen, H., et al. Longitudinal qPCR study of the dynamics of L. crispatus, L. iners, A. vaginae, (sialidase positive) G. vaginalis, and P. bivia in the vagina. PLoS One, 2012, 7(9), p. e45281. doi: 10.1371/ journal.pone.0045281.
56. Špaček, J., Kestřánek, J., Jílek, P., et al. Comparison of two long-term gestagen regimens in the management of recurrent vulvovaginal candidiasis: A pilot study. Mycoses, 2017, 60(4), p. 260–265. doi:10.1111/myc.12593.
57. Spear, GT., French, AL., Gilbert, D., et al. Human α-amylase present in lower-genital-tract mucosal fluid processes glycogen to support vaginal colonization by Lactobacillus. J Infect Dis, 2014, 210(7), p. 1019–1028.
58. Spiegel, CA., Amsel, R., Holmes, KK. Diagnosis of bacterial vaginosis by direct Gram-stain of vaginal fluid. J Clin Microbiol, 1983, 18, p. 170–177.
59. Srinivasan, S., Liu, C., Mitchell, CM., et al. Temporal variability of human vaginal bacteria and relationship with bacterial vaginosis. PLoS One, 2010, 5(4), p. e10197.
60. Stoyancheva, G., Marzotto, M., Dellaglio, F., Torriani, S. Bacteriocin production and gene sequencing analysis from vaginal Lactobacillus strains. Arch Microbiol, 2014, 196(9), p. 645–653.
61. Strus, M., Brzychczy-Włoch, M., Gosiewski, T., et al. The in vitro effect of hydrogen peroxide on vaginal microbial communities. FEMS Immunol Med Microbiol, 2006, 48(1), p. 56–63.
62. Swidsinski, A., Mendling, W., Loening-Baucke, V., et al. Adherent biofilms in bacterial vaginosis. Obstet Gynecol, 2005, 106(5, part 1), p. 1013–1023.
63. Thomas, S. Döderlein‘s bacillus: Lactobacillus acidophilus. J Infect Dis, 1928, 43, p. 218–227.
64. Vallor, AC., Antonio, MA., Hawes, SE., Hillier, SL. Factors associated with acquisition of, or persistent colonization by, vaginal lactobacilli: role of hydrogen peroxide production. J Infect Dis, 2001, 184(11), p. 1431–1436.
65. van de Wijgert, JH., Borgdorff, H., Verhelst, R., et al. The vaginal microbiota: what have we learned after a decade of molecular characterization? PLoS One, 2014, 22, 9(8), p. e105998. doi: 10.1371/journal.pone.0105998.
66. van Houdt, R., Ma, B., Bruisten, SM., et al. Lactobacillus iners – dominated vaginal microbiota is associated with increased susceptibility to Chlamydia trachomatis infection in Dutch women: a case-control study. Sex Transm Infect, 2017, 25. pii: sextrans-2017-053133. doi: 10.1136/sextrans-2017-053133.
67. van Oostrum, N., De Sutter, P., Meys, J., Verstraelen, H. Risks associated with bacterial vaginosis in infertility patients: a systematic review and meta-analysis. Hum Reprod, 2013, 28, p. 1809–1815
68. Verstraelen, H., Verhelst, R., Claeys, G., et al. Longitudinal analysis of the vaginal microflora in pregnancy suggests that L. crispatus promotes the stability of the normal vaginal microflora and that L. gasseri and/or L. iners are more conducive to the occurrence of abnormal vaginal microflora. BMC Microbiol, 2009, 9, p. 116.
69. Weinstein, L. The bacterial flora of the human vagina. Yale J Biol Med, 1938, 10(3), p. 247–260.
70. White, S., Larsen, B. Candida albicans morphogenesis is influenced by estrogen. Cell Mol Life Sci, 1997, 53, p. 744–749.
71. Wira, CR., Fahey, JV., Ghosh, M., et al. Sex hormone regulation of innate immunity in the female reproductive tract: the role of epithelial cells in balancing reproductive potential with protection against sexually transmitted pathogens. Am J Reprod Immunol, 2010, 63(6), p. 544–565.
72. Witkin, SS., Mendes-Soares, H., Linhares, IM., et al. Influence of vaginal bacteria and D - and L-lactic acid isomers on vaginal extracellular matrix metalloproteinase inducer: implications for protection against upper genital tract infections. Mbio, 2013, 4(4). pii: e00460-13.
73. Yildirim, S., Yeoman, CJ., Janga, SC., et al. Primate vaginal microbiomes exhibit species specificity without universal Lactobacillus dominance. ISME J, 2014, 8(12), p. 2431–2444.
74. Záhumenský, J., Hederlingová, J., Pšenková, P. Význam materského mikrobiómu v tehotnosti. Čes Gynek, 2017, 82(3), p. 211–217.Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek Pánevní aktinomykóza a IUD
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2018 Číslo 5- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Magnosolv a jeho využití v neurologii
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Faktory ovlivňující sérovou hladinu anti-Müllerian hormonu
- Hladina hCG po embryotransferu jako prognostický ukazatel fyziologického těhotenství
- Vyšší věk matky – rizikový faktor pro nízkou porodní váhu
- Efekt cerkláže na délku děložní hrdla a vliv změn délky hrdla na prognózu těhotenství
- Úskalí screeningu gestačního diabetu v České republice – průzkum mezi pacienty
- Opakovaná děložní intrapartální ruptura po endoskopické operaci hluboké endometriózy rektovaginálního septa a močového měchýře
- Poruchy příjmu potravy v těhotenství
- Faktory ovplyvňujúce vznik sarkómov maternice a možnosti ich klinickej diagnostiky
- Vaginální mikrobiom
- Vliv polychlorovaných bifenylů a organochlorovaných pesticidů na lidskou reprodukci
- Pánevní aktinomykóza a IUD
- Screening a diagnostika gestačného diabetes mellitus
- Gestační diabetes mellitus Mezioborová spolupráce
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hladina hCG po embryotransferu jako prognostický ukazatel fyziologického těhotenství
- Vaginální mikrobiom
- Faktory ovlivňující sérovou hladinu anti-Müllerian hormonu
- Pánevní aktinomykóza a IUD
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



