-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaFaktory ovlivňující sérovou hladinu anti-Müllerian hormonu
Introduction: Anti-Müllerian hormone (AMH) is an important parameter for prediction of ovarian response to IVF stimulation as well as an ovarian reserve parameter. Its serum levels are affected by many factors.
Objective: To determine the dependence of AMH serum levels on age, length of menstrual cycle, smoking, and testosterone levels.
Design: An original article, a retrospective study.
Setting: The clinic of reproductive medicine and gynecology Zlín, Laboratory Imalab, Zlin.
Methods: 1958 patients took part in the study that was performed in 2013–2017 and was based on obtaining anamnestic data (age, length of menstrual cycle, smoking) and laboratory diagnostics of AMH and testosterone serum levels. An ordinary linear regression model was used to model the AMH level of the above variables. Hypothesis testing was performed at a 5% significance level. Statistical analyzes were processed using R software.
Results: Age, length of the menstrual cycle, PCOS diagnosis and testosterone level have been shown to be statistically significant factors associated with AMH. Until the age of approximately 31 years, the AMH level declined only slowly (2.4% per year, p = 0.0010), followed by a steeper fall (9.3% per year, p < 0.0001). Women with a 27–29 day cycle have a 25.2% (p < 0.0001) higher average AMH level than women with a cycle shorter than 27 days. Women with a cycle longer than 29 days, on the other hand, have an average AMH level of 25.2% higher than women with a cycle of 27–29 days (p < 0.0001).
Another factor with a significant influence on the AMH level is the diagnosis of PCOS. The presence of PCOS is associated with an average AMH higher by 58.9% (p < 0.0001). Statistically significantly higher serum AMH concentrations of 21.3% (p < 0.0001) were found in women with serum testosterone levels > 1.5 nmol/l. The effect of smoking on serum AMH concentrations was not demonstrated in our study (p = 0.653).
Conclusion: We have proved an age-related dependence of AMH with a significant declining trend after the 31st year of life. The length of the menstrual cycle shows a positive correlation with serum AMH levels – women with a longer menstrual cycle (more than 29 days) show significantly higher serum AMH levels. Another positive correlation was found between serum levels of testosterone and AMH levels. Both AMH correlation with cycle length and correlation with testosterone levels fit into the concept of PCOS diagnosis and prediction of an excessive response to ovarian stimulation. Determination of AMH should be included in the patient‘s examination algorithm prior to ovarian stimulation.
Keywords:
anti-Müllerian hormone, AMH, testosterone, age, PCOS, menstrual cycle, smoking
Autoři: T. Rumpíková 1; M. Štelcl 2; O. Vencálek 3; M. Vavruša 3,4; S. Bělašková 4
Vyšlo v časopise: Ceska Gynekol 2018; 83(5): 324-328
Kategorie: Retrospektivní studie
Souhrn
Úvod: Anti-Müllerian hormon je v současnosti často používaným parametrem k hodnocení ovariální rezervy a k předpovědi ovariální reaktivity na stimulaci při IVF cyklu.
Cíl studie: Stanovit závislost sérových hladin anti-Müllerian hormonu (AMH) na věku, délce menstruačního cyklu, kouření a hladinách testosteronu.
Typ studie: Původní článek, retrospektivní studie.
Název a sídlo pracoviště: Klinika reprodukční medicíny a gynekologie, Zlín.
Materiál a metodika: Studie se zúčastnilo 1958 pacientek, probíhala v letech 2013–2017 a byla založena na získání anamnestických dat (věk, délka menstruačního cyklu, kouření), dále na laboratorní diagnostice sérových hladin AMH a testosteronu. K modelování závislosti hladiny AMH na výše uvedených proměnných byl použit běžný lineární regresní model. Testování hypotéz bylo provedeno na 5% hladině významnosti. Statistické analýzy byly zpracovány pomocí softwaru R.
Výsledky: Jako statisticky významné faktory související s hladinou AMH se ukázaly věk, délka menstruačního cyklu, diagnóza PCOS a hladina testosteronu. Až do věku přibližně 31 let hladina AMH klesala jen pozvolna (2,4 % za rok, p = 0,0010), poté byl pokles strmější (9,3 % za rok, p < 0,0001). Ženy s cyklem 27–29 dní měly o 25,2 % (p < 0,0001) vyšší průměrnou hodnotu AMH než ženy s cyklem kratším než 27 dní. Naopak u žen s cyklem delším než 29 dní byla průměrná hodnota AMH o 25,2 % vyšší než u žen s cyklem 27–29 dní (p < 0,0001).
Dalším faktorem se signifikantním vlivem na hladinu AMH byla diagnóza PCOS. Přítomnost PCOS byla spjata s průměrnou hladinou AMH vyšší o 58,9 % (p < 0,0001). Statisticky významně vyšší sérové koncentrace AMH o 21,3 % (p < 0,0001) byly nalezeny u žen, které mají sérové hladiny testosteronu > 1,5 nmol/l. Vliv kouření na sérové koncentrace AMH nebyl v naší studii prokázán (p = 0,653).
Závěr: Prokázali jsme závislost hladiny AMH na věku s výrazně klesající tendencí po 31. roce života. Hladiny AMH vykazovaly pozitivní korelaci jak s délkou menstruačního cyklu, tak hladinou testosteronu, což zapadá do konceptu diagnostiky PCOS a předpovědi excesivní reakce na ovariální stimulaci. Stanovení hladiny AMH by mělo být zařazeno do vyšetřovacího algoritmu pacientek před ovariální stimulací.
Klíčová slova:
anti-Müllerian hormon, AMH, testosteron, věk, PCOS, menstruační cyklus, kouření
ÚVOD
Anti-Müllerian hormon (AMH) je v současnosti často používaným parametrem k hodnocení ovariální rezervy a k předpovědi ovariální reaktivity na stimulaci při IVF cyklu. Je produkován granulózovými buňkami preantrálních a časných antrálních folikulů [17]. Přítomnost AMH v séru i folikulární tekutině u žen byla poprvé popsána v 90. letech [8]. Rozsáhlá metaanalýza Broekmanse et al. [2] z roku 2006 ukázala, že AMH a antral follicle count (AFC) jsou při srovnání s folikulostimulačním hormonem (FSH), inhibinem a dalšími parametry, jediné dva užitečné ukazatele předpovídající ovariální reakci během IVF cyklu. Broer et al. [3] publikovali v roce 2013 analýzu, ve které potvrdili silnou prediktivní hodnotu sérových hladin AMH při předpovědi nízké ovariální reaktivity (poor ovarian response – POR). V roce 2014 stejná autorka potvrdila totéž u excesivní ovariální reakce s rizikem ovariálního hyperstimulačního syndromu (OHSS) [4]. Vzhledem k tomu, že je stanovení hladiny AMH stále častěji používáno nejen v asistované reprodukci, ale i v běžné gynekologické praxi k hodnocení tzv. ovariální rezervy a poradenství ohledně plánování gravidity, zaměřili jsme se v naší studii na faktory ovlivňující jeho sérovou hladinu. Zkoumán byl vliv věku, kouření, závislost AMH na délce cyklu a hladině testosteronu v krvi.
SOUBOR A METODIKA
Studie se zúčastnilo 1958 pacientek, probíhala v letech 2013–2017 na Klinice reprodukční medicíny a gynekologie ve Zlíně. Studie byla založena na získání anamnestických dat (věk, délka menstruačního cyklu, nepravidelnost menstruačního cyklu, kouření), dále na laboratorní diagnostice sérových hladin AMH a testosteronu. Hladina AMH v séru byla měřena systémem Elecsys AMH plus (firma Roche) a udávána v ng/ml. Stanovení hladiny testosteronu v séru bylo provedeno imunochemickým analyzátorem AIA 900 a udáváno v nmol. Pokud byla pacientka zařazena do skupiny syndrom polycystických vaječníků (PCOS), znamená to, že splňovala kritéria pro PCOS ustanovená v Rotterdamu roku 2003 [14].
K modelování závislosti hladiny AMH na výše uvedených proměnných (věk, kouření, délka menstruačního cyklu, testosteron) byl použit běžný lineární regresní model. Nebyla modelována přímo hladina AMH, ale její logaritmus, neboť hladina AMH má logaritmicko-normální rozdělení. Testování hypotéz bylo prováděno na 5% hladině významnosti. Statistické analýzy byly zpracovány pomocí softwaru R [13]. Základní číselné charakteristiky kvantitativních znaků – věk, AMH a testosteron jsou shrnuty tabulce 1.
Tab. 1. Základní charakteristiky souboru 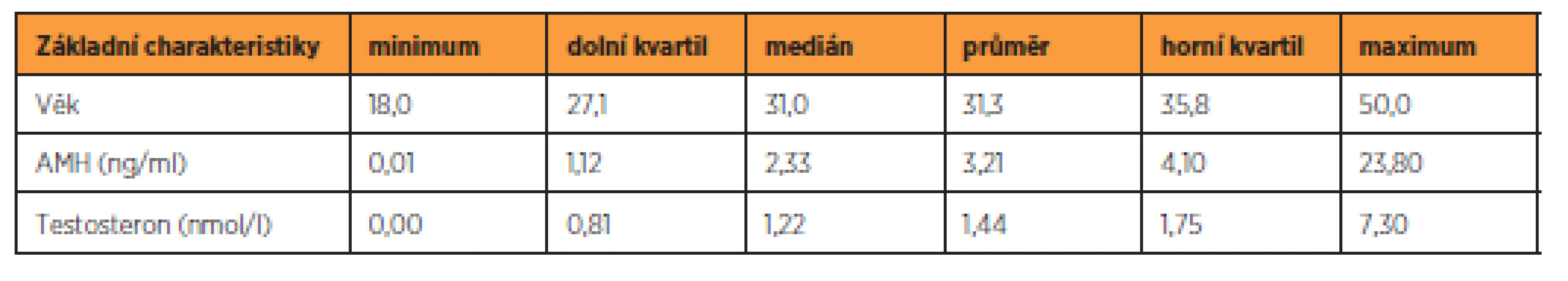
Hodnoty AMH se pohybují v rozmezí 0,01 až 23,80 ng/ml, přičemž medián je 2,33 ng/ml. Interval určený kvartily obsahující 50 % hodnot při vynechání nejmenších a největších hodnot má podobu (1,12, 4,10). Tvar rozdělení odpovídá logaritmicko-normálnímu rozdělení, jak je patrno z obrázku 1.
Obr. 1. Histogram rozdělení koncentrace AMH 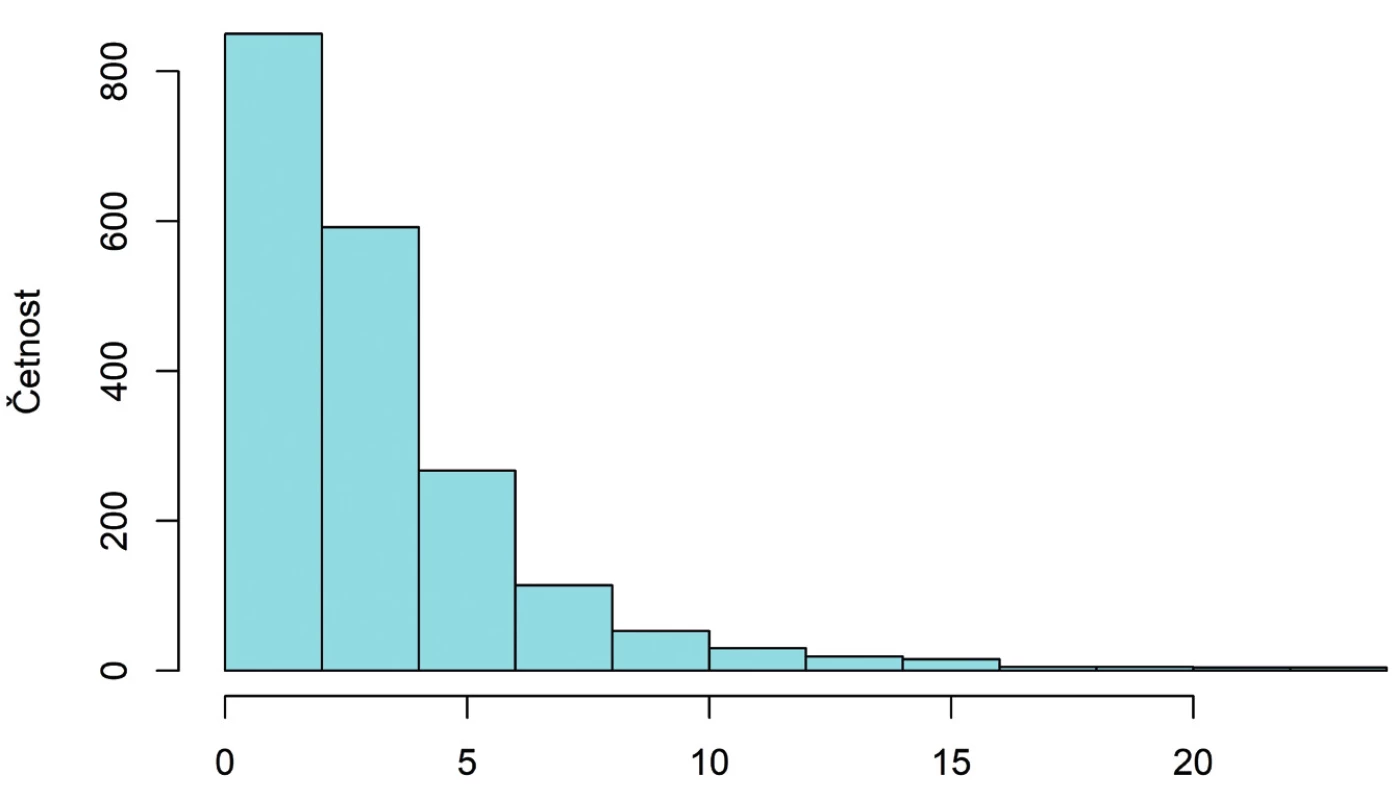
Veličina hladina testosteronu byla kategorizována do tří skupin: nulová hladina testosteronu (8,4 %), nenulová hladina testosteronu menší než 1,5 nmol/l (56, 7 %) a hladina vyšší než 1,5 nmo/l (33,8 %). Nejčastěji uváděná délka cyklu byla 28 dnů (62,9 % žen). Tuto veličinu jsme kategorizovali do tří kategorií: 27–29 dnů (72,2 % žen), kratší než 27 dnů (9,2 %) a delší než 29 dnů (18,6 %). Amenorea byla zjištěna pouze u 28 (1,4 %) pacientek, PCOS u 111 z 1958 (5,7 %). Údaje o kouření byly k dispozici u 1893 pacientek, z toho 18,9 % byly kuřačky, 81,1 % nekuřačky.
VÝSLEDKY
Jako statisticky významné faktory související s hladinou AMH se ukázaly věk, délka menstruačního cyklu, diagnóza PCOS a hladina testosteronu. Závislost průměrné hladiny AMH na věku je znázorněna na obrázku 2. Až do věku přibližně 31 let hladina AMH klesala jen pozvolna (2,4 % za rok, p = 0,0010), poté byl pokles strmější (9,3 % za rok, p < 0,0001).
Obr. 2. Závislost hladiny AMH na věku 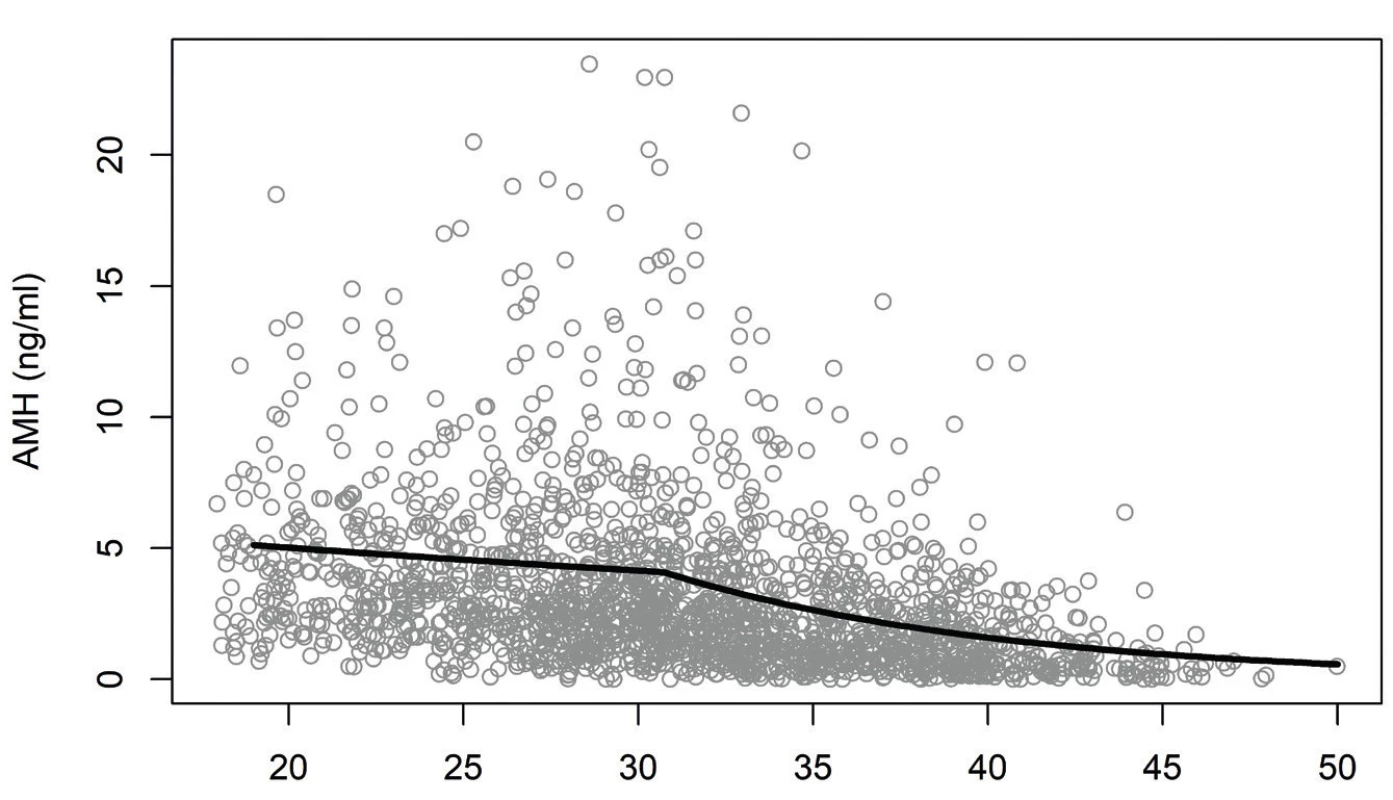
Průměrná sérová hladina AMH vykazovala vyšší hodnotu u žen s delším cyklem. Ženy s cyklem 27–29 dní měly o 25,2 % (p < 0,0001) vyšší průměrnou hodnotu AMH než ženy s cyklem kratším než 27 dní. Naopak u žen s cyklem delším než 29 dní byla průměrná hodnota AMH o 25,2 % vyšší než u žen s cyklem 27–29 dní.
Dalším faktorem se signifikantním vlivem na hladinu AMH byla diagnóza PCOS. Přítomnost PCOS je spjata s průměrnou hladinou AMH vyšší o 58,9 % (p < 0,0001).
Hladina AMH mezi ženami s nulovou hladinou testosteronu a nenulovou hladinou testosteronu ≤ 1,5 nmol/l nevykazovala statisticky významný rozdíl. Naopak statisticky významně vyšší sérové koncentrace AMH o 21,3 % (p < 0,0001) byly nalezeny u žen, které mají sérové hladiny testosteronu > 1,5 nmol/l ve srovnání s ženami s hladinou testosteronu ≤ 1,5 nmol/l (bez ohledu na to, zda hladina testosteronu byla nulová, nebo nenulová).
Vliv kouření na sérové koncentrace AMH nebyl v naší studii prokázán (p = 0,653). Přehled všech statisticky významných vlivů na AMH je uveden v tabulce 2.
Tab. 2. Faktory ovlivňující hladinu AMH 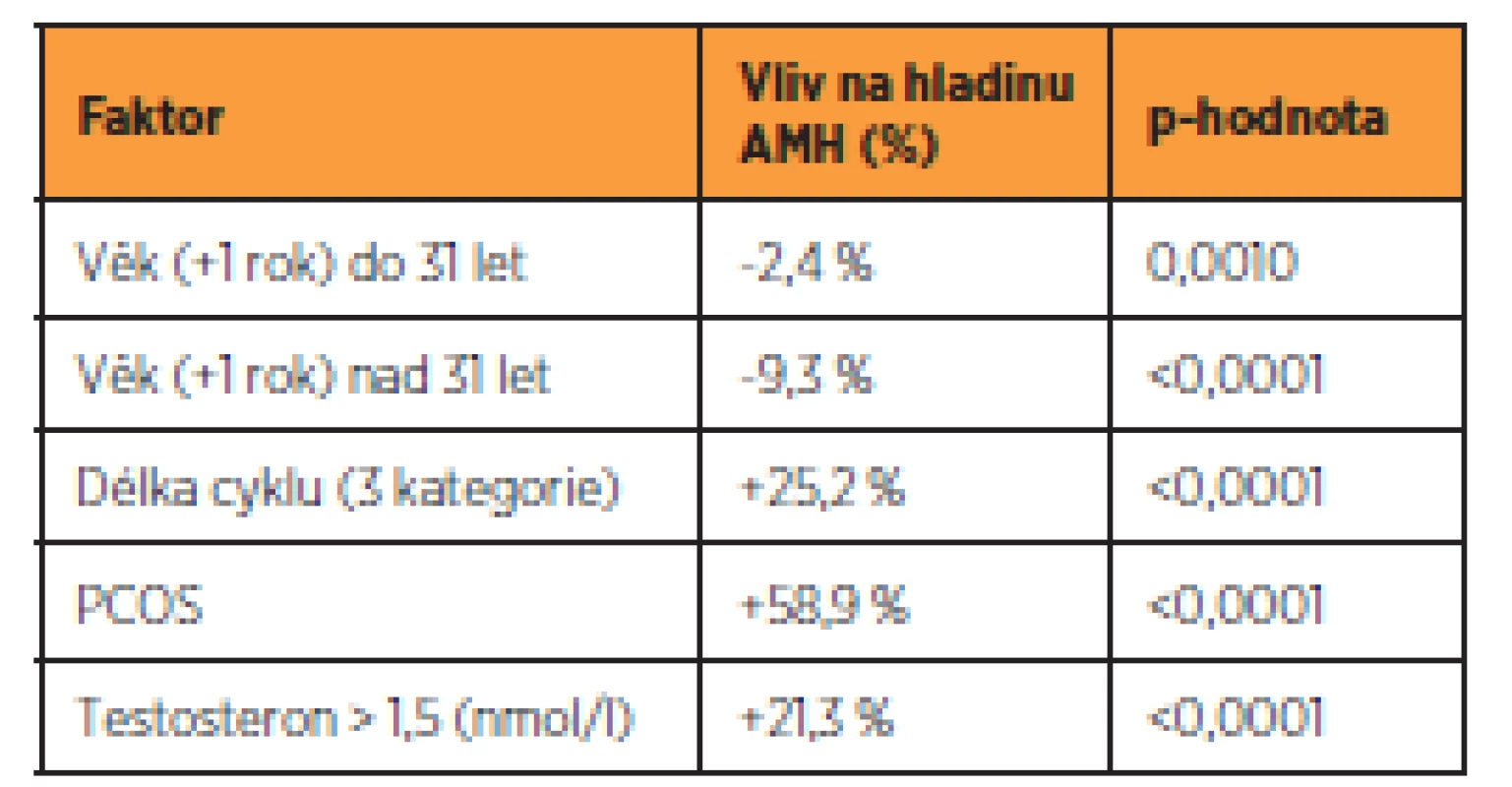
Hodnoty AMH v nejpočetněji zastoupených skupinách a jejich průměrnou hodnotu podle modelu znázorňuje obrázek 3.
Obr. 3. Pozorované a modelové (očekávané) hodnoty AMH v největších skupinách podle kategoriálních signifikantních prediktorů AMH 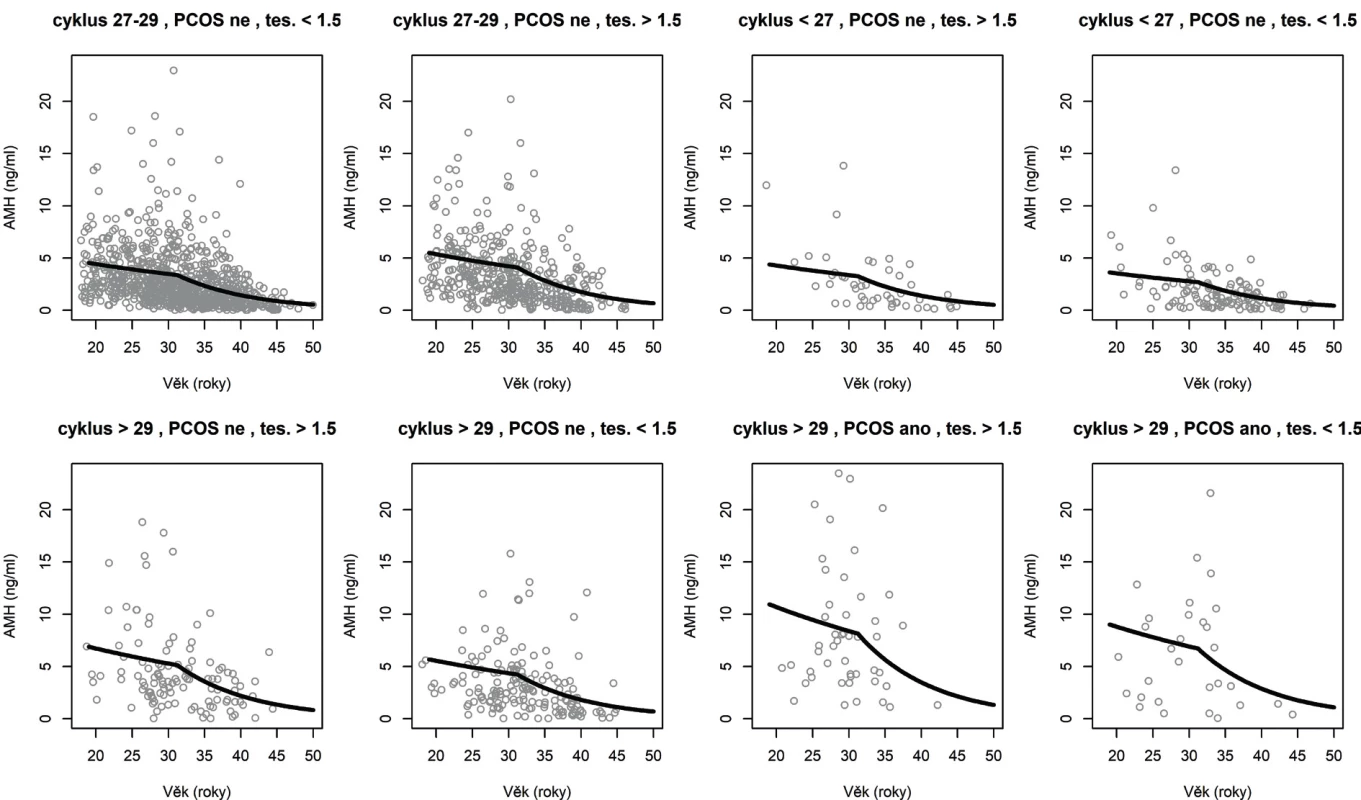
DISKUSE
Námi pozorovaný vývoj křivky AMH v závislosti na věku se shoduje s dosud publikovanými pracemi [11]. Ve studii Kelseyho et al. [10] byl pozorován stejně bifázický průběh křivky, přičemž prudký zlom a pokles zaznamenali autoři této studie o něco později, až kolem 35. roku života. Naše studie prokázala tento zlom již kolem 31. roku života. Jiná studie [18], zabývající se jak poklesem AMH, tak poklesem AFC se zvyšujícím se věkem, prokázala zlom křivky v podobném věku, jako vykazoval náš soubor (kolem 30 let věku života). Věk je tak jasným ukazatelem stárnutí vaječníků, není ale možné využít pouze věk k predikci ovariální reaktivity. Studie provedena Andersonem et al. [1] byla zaměřena na užitečnost věku k předpovědi nízké nebo naopak nadměrné ovariální reakce na stimulaci. Věk samotný v ROC analýze vykazoval jen slabou předpovědní sílu. AMH v této studii mělo jednoznačně lepší průběh ROC křivky. AMH je tak mnohem lepším parametrem predikce ovariální reaktivity než samotný věk.
Kouření je rizikovým faktorem mnoha chorob, neplodnost nevyjímaje. Plante et al. [12] pozorovali u kuřaček až o 40 % nižší sérové hladiny AMH ve srovnání s nekuřačkami (nezávisle na počtu vykouřených cigaret), přičemž u kuřaček kouřících více než 15 cigaret denně byly nalezeny hladiny až o 60 % nižší ve srovnání s nekuřačkami. V naší studii jsme nenašli statisticky významný rozdíl mezi nekuřačkami a kuřačkami, a to ani po rozdělení do věkových kategorií. Vliv tohoto faktoru bude třeba podrobit ještě dalšímu zkoumání.
Závislost AMH na délce menstruačního cyklu, zejména signifikantně vyšší hladiny AMH u pacientek s velmi dlouhým cyklem a diagnostikovaným PCOS a také u pacientek se zvýšeným testosteronem dobře korespondují s diagnostickými kritérii PCOS Rotterdam (známky hyperandrogenismu, nepravidelnost cyklu a ultrazvukový obraz vaječníků) [14]. Vzhledem k tomu, že AMH je produkován převážně v preantrálních a v časných antrálních stadiích folikulů do velikosti asi 8 mm [5, 6] a u syndromu polycystických ovarií je dominance zejména malých antrálních folikulů, není tento výsledek nikterak překvapivý. Proto se AMH doporučuje jako velmi citlivý parametr právě pro diagnostiku polycystických vaječníků a k predikci excesivní reakce vaječníků, což bylo opakovaně potvrzeno řadou studií [4, 15].
Pozitivní korelace sérových hladin testosteronu na výsledky IVF byla již také popsána. Frattareli et al. [7] stanovili cut off hladiny testosteronu ≤ 20 ng/dL (0,2 nmol/l) jako hranici, pod kterou byly signifikantně horší výsledky IVF léčby.
Vzhledem k tomu, že je korelace AMH s počtem získaných oocytů evidentní [16], jsou vyšší sérové hladiny AMH spojeny s lepšími výsledky IVF cyklu na základě vyššího počtu získaných oocytů – dochází tak k vyšší pravděpodobnosti vykultivování euploidní blastocysty [9].
ZÁVĚR
Prokázali jsme závislost hladiny AMH na věku s výrazně klesající tendencí po 31. roce života, po dosažení tohoto věku sérová hladina AMH klesá o 9,3 % ročně. Hladiny AMH vykazovaly pozitivní korelaci jak s délkou menstruačního cyklu, tak hladinou testosteronu, což zapadá do konceptu diagnostiky PCOS a předpovědi excesivní reakce na ovariální stimulaci. Stanovení hladiny AMH by mělo být součástí vyšetřovacího algoritmu pacientek před zahájením ovariální stimulace.
Podpořeno projektem č. LQ1605 z Národního programu udržitelnosti II (MŠMT).
MUDr. Taťána Rumpíková, Ph.D.
Klinika reprodukční medicíny a gynekologie
U Lomu 638
760 01 Zlín
e-mail: tatana.rumpikova@ivfzlin.cz
Zdroje
1. Anderson, RA., Anckaert, E., Bosch, E., et al. Prospective study into the value of the automated Elecsys antimüllerian hormone assay for the assessment of the ovarian growing follicle pool. Fertil Steril, 2015, 103(4), p. 1074–1080.
2. Broekmans, FJ., Kwee, J., Hendriks, DJ., et al. A systematic review of tests predicting ovarian reserve and IVF outcome. Hum Reprod Update, 2006, 12, p. 685–718.
3. Broer, SL.,van Disseldorp, J., Broeze, KA., et al. Added value of ovarian reserve testing on patient characteristics in the prediction of ovarian response and ongoing pregnancy: an individual patient data approach. Hum Reprod Update, 2013, 19(1), p. 26–36.
4. Broer, SL., Broekmans FJM., Laven, JSE, Fauser, BCJM. Anti-Müllerian hormone: ovarian reserve testing and its potential clinical implications. Hum Reprod Update, 2014, 20(5), p. 688–701.
5. Durlinger, ALL., Kramer, P., Karels, B., et al. Control of primordial follicle recruitment by anti-Müllerian hormone in the mouse ovary. Endocrinology, 1999, 140, p. 5789–5796.
6. Durlinger, ALL., Visser, JA., Themmen, APN. Regulation of ovarian function: the role of anti-Müllerian hormone. Reproduction, 2002, 124, p. 601–609.
7. Frattarelli, JL., Peterson, EH. Effect of androgen levels on in vitro fertilization cycles. Fertil Steril, 2004, 81(6), p. 1713–1714.
8. Hudson, PL., Dougas, I., Donahoe, PK., et al. An immunoassay to detect human müllerian inhibiting substance in males and females during normal development. J Clin Endocrinol Metab, 1990, 70(1), p. 16–22.
9. Kahraman, S., Cil, AP., Our, C., et al. Probability of finding at least one euploid embryo and the euploidy rate according to, the number of retrieved oocytes and female age using FISH and array CGH. J Reprod Biotech Fertil, 2016, 5, p. 1–9.
10. Kelsey, TW., Wright, P., Nelson, SM., et al. A validated model of serum anti-müllerian hormone from conception to menopause. PLoS One, 2011, 6(7), e22024.
11. Kučera, R., Topolčan, O., Rumpíková, T., et al. Stanovení anti-Müllerova hormonu u žen. Čes Gynek, 2013, 78(3), s. 282–288.
12. Plante, BJ., Cooper, GS., Baird, DD., Steiner, AZ. The impact of smoking on antimüllerian hormone levels in women aged 38 to 50 years, Menopause, 2010, 17(3), p. 571–576.
13. R Core Team (2017). R. A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. URL https://www.R-project.org/.
14. Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome. Fertil Steril, 2004, 81(1), p. 19–25.
15. Sahmay, S., Aydin, Y., Oncul, M., Senturk, LM. Diagnosis of Polycystic Ovary Syndrome: AMH in combination with clinical symptoms. J Assist Reprod Genet, 2014, 31(2), p. 213–220.
16. Stelcl, M., Belaskova, S., Machac, S., et al. Antimüllerian hormone (AMH) levels and antral follicle count (AFC) as predictors of the ovarian reaction in young healthy women. Biomed Pap, 2017, 161(1), p. 50–53.
17. Vrublovský, P., Machač, Š. Hodnota AMH jako prediktor výsledku ovariální stimulace. Čes Gynek, 2016, 81(1), s. 23–26.
18. Wiweko, B., Prawesti, DMP., Hestiantoro, A., et al. Chronological age vs biological age: an age-related normogram for antral follicle count, FSH and anti-Mullerian hormone. J Assist Reprod Genet, 2013, 30(12), p. 1563–1567.Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek Vaginální mikrobiomČlánek Pánevní aktinomykóza a IUD
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2018 Číslo 5- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Faktory ovlivňující sérovou hladinu anti-Müllerian hormonu
- Hladina hCG po embryotransferu jako prognostický ukazatel fyziologického těhotenství
- Vyšší věk matky – rizikový faktor pro nízkou porodní váhu
- Efekt cerkláže na délku děložní hrdla a vliv změn délky hrdla na prognózu těhotenství
- Úskalí screeningu gestačního diabetu v České republice – průzkum mezi pacienty
- Opakovaná děložní intrapartální ruptura po endoskopické operaci hluboké endometriózy rektovaginálního septa a močového měchýře
- Poruchy příjmu potravy v těhotenství
- Faktory ovplyvňujúce vznik sarkómov maternice a možnosti ich klinickej diagnostiky
- Vaginální mikrobiom
- Vliv polychlorovaných bifenylů a organochlorovaných pesticidů na lidskou reprodukci
- Pánevní aktinomykóza a IUD
- Screening a diagnostika gestačného diabetes mellitus
- Gestační diabetes mellitus Mezioborová spolupráce
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hladina hCG po embryotransferu jako prognostický ukazatel fyziologického těhotenství
- Vaginální mikrobiom
- Faktory ovlivňující sérovou hladinu anti-Müllerian hormonu
- Pánevní aktinomykóza a IUD
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



