-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Je třeba revidovat doporučení prevence trombembolické nemoci u těhotných?
Is it necessary to revise the guidelines on prevention of thrombembolic disease in pregnancy?
Aim of the study:
Analysis of the issue of thrombembolic complications in pregnant women.Type of the study:
Current concepts review.Setting:
Department of Obstetrics and Gynecology 2nd Medical Faculty of Charles University and Teaching Hospital Motol, Prague.Methods:
Analysis of practical implementation of the guideline on the thrombembolic complication prevention during pregnancy. Notes on individual conditions and situations from the viewpoint of thrombembolic complication risk, using “evidence based medicine”. Comparison of the Czech and Anglo-American guidelines.Conclusions:
There is no general consensus on implementation of the guideline on thrombembolism prevention in pregnant women in the Czech Republic and many mistakes may be found in this respect. Although the issue falls primarily into the competence of haematologists, there is a number of situations that must be resolved by the obstetrician.Key words:
thrombembolic disease prevention, pregnancy.
Autoři: T. Binder
Působiště autorů: Gynekologicko-porodnická klinika 2. LF UK a FN Motol, Praha, přednosta prof. MUDr. L. Rob, CSc.
Vyšlo v časopise: Ceska Gynekol 2011; 76(4): 316-320
Souhrn
Cíl studie:
Rozbor problematiky prevence trombembolických komplikací u těhotných žen.Typ studie:
Přehledový článek.Název a sídlo pracoviště:
Gynekologicko-porodnická klinika 2. LF UK a FN Motol, Praha.Metodika:
Analýza realizace doporučeného postupu prevence trombembolických komplikací u těhotných žen v praxi. Poznámky k jednotlivým stavům a situacím z hlediska rizika trombembolických komplikací na základě „evidence based medicine“ Porovnání českého doporučeného postupu s anglo-americkými doporučeními.Závěr:
V realizaci doporučeného postupu prevence trombembolismu u těhotných v ČR v praxi není obecný konsenzus a lze zaznamenat řadu chyb. I když problematika primárně přísluší hematologům, je mnoho situací, které je nucen řešit porodník.Klíčová slova:
prevence trombembolické nemoci, těhotenství.ÚVOD
Trombembolická nemoc (TEN) přes veškerou snahu zůstává jednou z nejčastějších příčin život ohrožujících komplikací u těhotných žen. Přes veškerá preventivní opatření se nedá říci, že by se absolutní počty trombóz v průběhu těhotenství výrazně snížily [5], rozhodně ale poklesl počet fatálních případů končících úmrtím ženy. Nakolik se na tomto faktu podílí prevence a nakolik se podílí včasná diagnostika a léčba, lze obtížně rozklíčovat.
Těhotenství samo o sobě představuje trombofilní situaci. Na prevenci TEN v průběhu těhotenství, porodu a šestinedělí, která je dnes výhradně zajišťována pomocí nízkomolekulárních heparinů, se vynakládá poměrně značné množství finančních prostředků. Indikace se historicky týkají především peripartální prevence a v posledních asi 20 letech je věnována zvýšená pozornost ženám nosičkám některého z trombofilních stavů, a to především nosičkám trombofilních mutací (TM) již v průběhu samotného těhotenství. Zatím co peripartální prevence je plně v kompetenci porodníků, prevenci TEN v průběhu těhotenství indikují v drtivé většině hematologové. V ČR není mnoho odborníků, kteří se zabývají čistě problematikou koagulace a zároveň jsou obeznámeni s porodnickou problematikou. Není proto divu, že přístup a přijatá opatření se pracoviště od pracoviště někdy až diametrálně liší. Trombofilie je dávána v posledních letech do souvislosti jak s časnými opakovanými těhotenskými ztrátami, tak s pozdními těhotenskými komplikacemi, jako jsou IUGR, preeklampsie, HELLP syndrom a intrauterinní smrt plodu.
Prevence obecně má být cílená a efektivní. Je otázkou, zda tomu tak v případě prevence trombembolických komplikací skutečně je. Je všeobecně známo, že plošný screening trombofilních mutací je neefektivní. V současnosti se cílený screening TM provádí u žen s epizodou TEN v anamnéze, prokázané mutace u rodinných příslušníků v přímé linii, u žen s habituálním potrácením a žen s anamnézou pozdních těhotenských ztrát a závažných komplikací. To v praxi znamená, že většina nosiček trombofilních mutací není odhalena a projde těhotenstvím bez jakékoli profylaxe. Při odhadované incidenci leidenské mutace kolem 5 % a protrombinové mutace kolem 3 % v české populaci to reprezentuje stovky, možná i několik tisíc těhotných žen ročně.
Je prokázáno, že přibližně polovina klinicky manifestních trombóz a trombembolických příhod je diagnostikována u jedinců, u kterých žádné nosičství trombofilních mutací neprokážeme. Lze u nich však většinou ex post vystopovat trombofilní situaci (operační zákrok, dehydratace, imobilizace, pobyt ve vysokohorském prostředí apod.) nebo rizikový faktor (i.v. aplikace drog, kouření, obezita, vyšší věk) v době, kdy k manifestaci TEN došlo. Těmto většinou tranzitorním rizikovým faktorům, které jsou, jak ukazují statistiky, velmi závažné, není na rozdíl od nosičství trombofilních mutací v praxi taková pozornost věnována. Dalším závažným rizikovým faktorem vzniku TEN jsou neidentifikované získané trombofilie (antifosfolipidový syndrom, lupus erythematodus apod.).
V praxi tak profylaxi vzniku TEN cílíme v průběhu těhotenství na poměrně úzkou skupinu těhotných a i zde se zdá, že nalezneme prostor pro zlepšení její efektivnosti.
České guidelines prevence TEN u těhotných byly revidovány v roce 2010. Vycházejí z doporučení 7. konference ACCP z roku 2004, která se touto problematikou zabývala [1]. Závěry koncipované na základě metaanalýzy výsledků doposud publikovaných prací zpracovali Bates, Greer, Hirsch a Ginsberg, tedy přední světoví odborníci v dané problematice. Doporučení lze pokládat za „evidence based“. Obdobně jako české guidelines, tak i ostatní národní doporučení vycházejí ze závěrů této konference a jsou až na drobné detaily s našimi doporučeními srovnatelné (American College of Chest Physicians Evidence-Based Clinical Practice Guidelines [8th Ed.], Royal College of Obstetricians and Gynecologist – Guideline No. 37) [2, 7]. V praxi však nejsou v mnoha ohledech naplňovány.
PROFYLAXE V PRŮBĚHU TĚHOTENSTVÍ
Míru rizika vzniku TEN je třeba stanovit již na počátku těhotenství, v některých případech již v prekoncepčním období a revidovat ji pokaždé při přijetí do nemocnice, a především před samotným porodem. V ČR je již zaběhlou praxí, že profylaxi TEN v průběhu těhotenství zajišťují hematologové.
Nejrizikovější skupinu tvoří ženy nosičky kombinace trombofilních mutací nebo nosičky mutace antitrombinu III nebo nosičky trombofilní mutace (FV, F II) v homozygotní konfiguraci, zde je situace jasná a zahájení profylaxe TEN je plně indikováno již v průběhu první poloviny těhotenství.
U žen s anamnézou trombembolické příhody je třeba posoudit, v jaké situaci k manifestaci onemocnění došlo. U tranzitorních příčin nesouvisející s těhotenstvím není obecně riziko další příhody zvýšené. V průběhu těhotenství u pacientky monitorujeme hemokoagulační parametry cca jednou za 6 týdnů a profylaxi zahajujeme až před porodem. Je-li žena zároveň nosičkou některé z trombofilních mutací nebo trombembolická příhoda byla v souvislosti s předchozím těhotenstvím nebo příčina nebyla objasněna, pak obvykle je nutné zahájit profylaxi TEN od poloviny probíhajícího těhotenství.
Největší nejednotnost v přístupu lze nalézt u asymptomatických nosiček nejčastěji se vyskytujících mutací: leidenské a protrombinové v heterozygotní konfiguraci. Obě mutace v heterozygotní konfiguraci představují tzv. „mild“ rizikový faktor (riziko vzniku TEN u leidenské mutace je stanoveno na 1/500 a protrombinové mutace 1/200). U nich je v současnosti doporučeno zahájit profylaxi TEN dnem porodu a pokračovat dále v průběhu celého šestinedělí. Přesto je u mnoha asymptomatických nosiček těchto mutací zahajována profylaxe již v průběhu těhotenství. Odůvodnitelné je to pouze v případech, kdy se asymptomatická nosička v průběhu těhotenství ocitne v trombofilní situaci nebo se přidruží další rizikové faktory TEN.
Samostatnou kapitolu představují nositelky mutace metyltetrahydrofolát reduktázy (MTHFR), jejíž incidence v naší populaci představuje více než 15 %. Z hlediska hemokoagulace, pokud není spojena s hyperhomocysteinémií, což není časté, nemá větší význam. Profylaktické podávání LMWH není u těchto nosiček indikované, přesto se to v praxi poměrně často, patrně z neznalosti, děje [1]. Dostatečnou profylaxí je suplementace těhotné kyselinou listovou.
HABITUÁLNÍ POTRÁCENÍ
Za habituální potrácení je možné považovat stav, kdy žena potratí 3krát po sobě. Nosičství trombofilní mutace je mnohými autory považováno za jednu z hlavních příčin. Objektivně vzato, problematika habituálního potrácení je velmi složitá a možných příčin je celá řada. V praxi se setkáváme se situacemi, kdy je profylakticky podáván LMWH po celou dobu těhotenství i u žen s anamnézou jednoho, ale zcela běžně dvou potratů. Profylaxi často indikuje genetik nebo hematolog, bez toho, že by žena bylo komplexně gynekologicky vyšetřena a byly vyloučeny jiné příčiny. I když mnoho publikovaných studií dokládá benefit této profylaxe, řada jiných autorů tato tvrzení zpochybňuje. Jednoznačný důkaz doposud chybí. Rozhodně prozatím nelze bez komplexního vyšetření všech možných příčin potrácení doporučit u těchto žen plošně profylakticky podávat LMWH. Tím je řečeno i to, že finální rozhodnutí je v kompetenci gynekologa, a nikoliv genetika nebo hematologa. Výjimkou jsou ženy s anamnézou habituálního potrácení, u kterých byl diagnostikován antifosfolipidový syndrom (APLA), zvláště ty, které navíc prodělaly trombembolickou příhodu [1].
POZDNÍ TĚHOTENSKÉ KOMPLIKACE
To, co bylo řečeno u habituálního potrácení, platí v mnohem větší míře u pozdních těhotenských komplikací. Metaanalýzou výsledků publikovaných studií docházíme k velmi kontroverzním závěrům [1]. Incidence těchto komplikací u žen nosiček trombofilních mutací se nijak neliší od žen, které nosičkami nejsou. Nebyla prokázána souvislost mezi nosičstvím trombofilní mutace a vznikem intrauterinní růstové retardace (IUGR), ani u preeklampsie a HELLP syndromu nejsou výsledky přesvědčivé. K těmto závěrům jsme došli i v naší právě ukončené studii. Kontroverzní je i profylaktické podávání LMWH k zabránění opakování pozdní těhotenské komplikace v následujícím těhotenství. Indikace jsou postaveny v jednotlivých selektovaných případech čistě na základě „authority based medicine“. Plošnou prevenci pozdních těhotenských komplikací LMWH u těchto žen nelze doporučit [1].
PERIPARTÁLNÍ PROFYLAXE TEN
V tabulce 1 jsou uvedeny indikace k peripartálnímu podávání LMWH. Srovnáváme-li tento přehled s doporučeními jiných vyspělých zemí, zásadní rozdíly nenajdeme [2, 6, 7].
Tab. 1. Indikace k peripartální profylaxi trombembolické nemoci LMWH 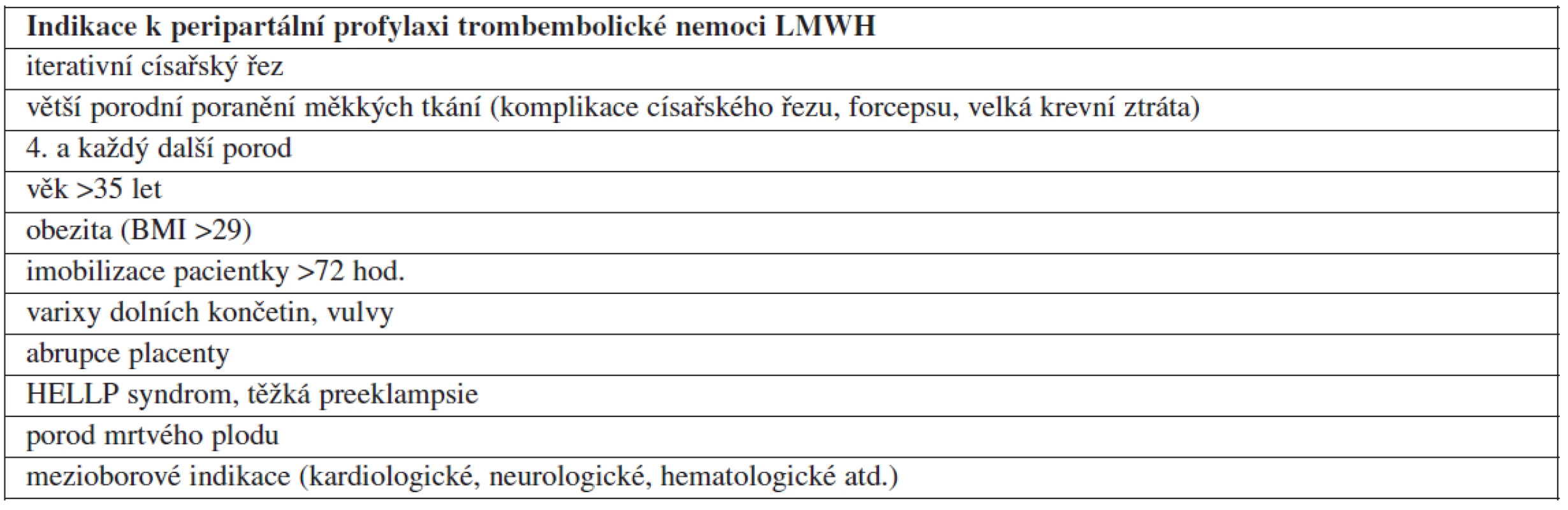
Výjimkou je doporučení týkající se císařského řezu. Na rozdíl od anglosaských zemí v českých guidelinech není zmíněn akutní císařský řez [6]. Toto opomenutí bude nutné v další revizi doporučení doplnit. Je obecně známo, že akutní císařský řez prováděný především v závěrečných fázích porodu může být technicky obtížnější, komplikovaný obtížnějším vybavením plodu, které může vést ke vzniku ruptur v dolním děložním segmentu a větší krevní ztrátě.
Na mnoha pracovištích v ČR je LMWH podáván po každém císařském řezu. Takovému postupu vcelku až na zvýšené finanční náklady nelze nic vytknout. Je ale otázkou, zda je to skutečně nutné u elektivních císařských řezů prováděných u zcela zdravých žen do 30 let, kde není znám žádný přidružený rizikový faktor a operace proběhne bez komplikací. Je skutečně nekomplikovaný elektivní císařský řez trvající 25 minut více rizikový z hlediska vzniku TEN než spontánní vaginální porod? Při stále stoupajícím počtu císařských řezů v ČR je to jistě téma k zamyšlení.
NAČASOVÁNÍ ZAHÁJENÍ PROFYLAXE
Pro aplikaci regionální metody anestezie je anesteziology vyžadován interval od poslední aplikace LMWH nejméně 12 hodin. Na to je třeba myslet u žen, které dostávají profylaktické nebo i léčebné dávky LMWH již v průběhu těhotenství, a doporučit jim, aby si LMWH aplikovaly v ranních hodinách. Spontánní porody začínají obvykle v noci, takže se ranní aplikaci v den porodu rodička většinou vyhne a interval od poslední aplikace je pro anesteziologa dostatečný. U plánovaných císařských řezů, popřípadě u plánovaných indukcí porodu u žen s vyšším rizikem vzniku TEN se osvědčil model s aplikací první profylaktické dávky LMWH večer (22.00) před plánovaným výkonem. Možné je samozřejmě aplikovat první dávku až po provedeném výkonu, obvykle 2‑3 hodiny po skončení operace. Je-li ponechán zavedený epidurální katétr pro pooperační analgezii, je vhodné dohodnout s anasteziologem čas první aplikace LMWH.
Tato doporučení anesteziologů je třeba v zájmu pacientky dodržovat. Guidelines anesteziologů pro aplikaci regionální anestezie zdůvodňuje výše uvedený časový interval zvýšeným rizikem vzniku hematomu v místě aplikace regionální analgezie a má jistě empirický základ. Je ale třeba konstatovat, že doposud nebyl publikován žádný případ této lokální komplikace v souvislosti s časnějším podáním profylaktické dávky LMWH u rodičky. Byly publikovány práce popisující lokální hematomy při epidurální analgezii u velmi starých žen po ortopedických operacích zlomenin krčku femuru.
Obecným pravidlem je, že u rodiček s terapeutickou dávkou LMWH snížíme dávku před porodem na profylaktickou.
DÉLKA PROFYLAKTICKÉHO PERIPARTÁLNÍHO PODÁVÁNÍ LMWH
Všechna doporučení uvádějí délku peripartální profylaxe na 5-7 dnů. Na řadě pracovišť v ČR je tato doba patrně z praktických důvodů (propuštění), ale i z důvodů ekonomických krácena na dobu 3 dnů. Statisticky je dokázáno, že ve 40 % případů se manifestují příznaky TEN až po propuštění z porodnice a z tohoto počtu k tomu dojde v 60 % do 7. dne od propuštění. Z tohoto pohledu se u rizikových pacientek třídenní aplikace ukazuje jako nedostatečná, zvláště to platí pro pacientky po císařském řezu [1, 2, 6, 7].
U mnoha rodiček se rizikové faktory kumulují a je třeba zvážit, zda není nutné profylaxi TEN prolongovat po dobu celého šestinedělí nebo i déle.
Praktickou pomocnou indikační pomůckou jsou skórovací tabulky používané např. ve Velké Británii. Pro potřeby porodníků se zdá nejpřehlednější skórovací tabulka z encyklopedie Wikipedia (tab. 2).
Tab. 2. Skórování rizika vzniku TEN (Wikipedia encyklopedie) 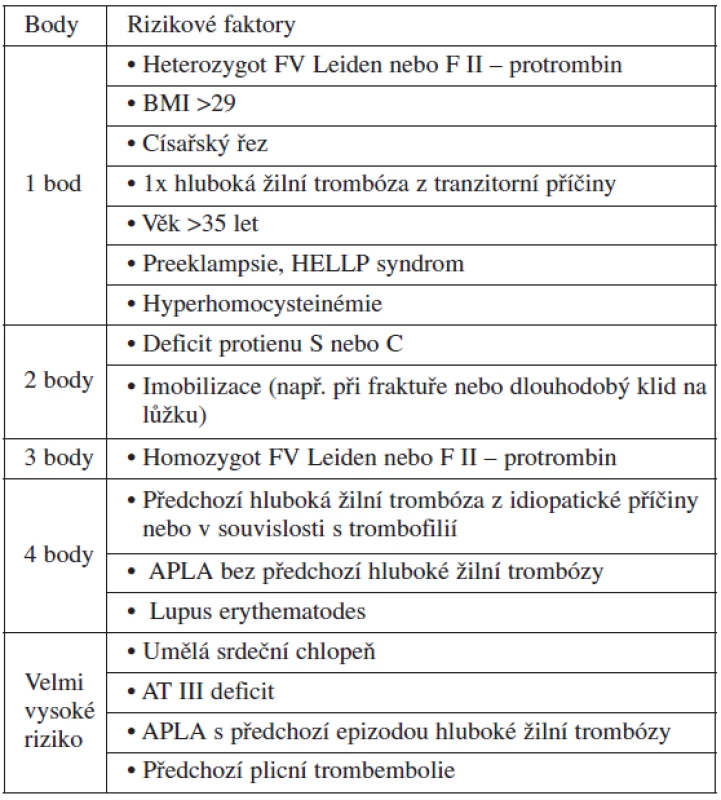
Interpertace dosaženého skóre: 1 bod – profylaxe není indikována; 2 body – krátkodobá profylaxe; 3 body – profylaxi prodloužit na 6 týdnů po porodu; 4 a více bodů – profylaxi je nutno zahájit velmi pravděpodobně již antepartálně a pospartálně se profylaxe prodlužuje na 6–12 týdnů LABORATORNÍ MONITOROVÁNÍ ÚČINNOSTI PODÁVANÉ DÁVKY LMWH
Obecně chceme laboratorním monitorováním léčebného prostředku optimalizovat dávkovací schéma ve snaze zvýšit efekt a/nebo udržet bezpečnost. U většiny léčebných prostředků existuje jen velmi malý vztah mezi dávkou a toxicitou (penicilin, ß-andrenergní blokátory) a mohou být podány v excesivní dávce ve snaze dosáhnout maximálního efektu. U některých léků můžeme snadno měřit jejich efekt např. měřením krevního tlaku u antihypertenziv, délku APTT u nerefrakciovaného heparinu, plazmatickou koncentraci u digoxinu nebo cyklosporinu. Pokud je plazmatická koncentrace podávaného léku přesně odvoditelná z podané dávky a tělesné hmotnosti pacienta, pak je monitorování zbytečné.
LMWH se nevážou na endotel a plazmatické proteiny. Po subkutánní aplikaci se vyznačují vysokou biologickou dostupností. Jediným důvodem, proč je monitorovat, je dosáhnout vyššího terapeutického účinku nebo bezpečnosti. LMWH neprodlužují časy APTT. Nejrozšířenějším testem, který koreluje s podávanou dávkou LMWH, je měření aktivity antifaktoru Xa v plazmě. Jinými používanými testy antitrombotického potenciálu podané dávky jsou chronometrický Heptest a měření endogenního trombinového potenciálu. Zkušenosti s těmito 2 testy jsou však velmi omezené [3].
Je třeba konstatovat, že existují i limity interpretace výsledku anti Xa testu. Je prokázáno, že rozpětí aktivity anti Xa / anti IIa jsou pro různé preparáty LMWH odlišná, a že je špatná srovnatelnost mezi komerčně dostupnými anti Xa chromogenními assayemi. Velmi důležité je i načasování odebraného krevního vzorku ve vztahu k času aplikace dávky LMWH. Čas odběru vzorku se musí shodovat s vrcholem plazmatické koncentrace LMWH, ten je určen u 2x denní aplikace na 3-4 hodiny po první dávce a u jednorázové denní aplikace na 4-6 hodin. LMWH se vylučují výhradně ledvinami, proto u žen s renální insuficiencí je nutné zabránit jejich kumulaci v organismu, proto je doporučeno u těchto žen provést test anti Xa těsně před další aplikací [4].
Každý LMWH má odlišný farmakodynamický model, koncentrační peak pak je u různých preparátů odlišný a může při nerespektování tohoto faktu vést k předávkování pacienta [3].
V neposlední řadě je nutné zmínit, že anti Xa aktivita nemusí reprezentativně odrážet antitrombotické vlastnosti LMWH, protože tyto sloučeniny ovlivňují funkce krevních destiček a mají vliv i na inhibitor tkáňového faktoru (TFPI) produkovaného endotelem.
Shrneme-li výše uvedené, měření aktivity anti Xa u LMWH léčených pacientů může poskytnout chybné informace a důsledkem může být nesprávné nastavení managementu pacienta. Aktivita anti Xa nekoreluje s rizikem rekurence trombembolické příhody a nekoreluje ani s rizikem krvácení. Tato konstatování jsou podpořena celou řadou tromboprofylaktických studií [3].
Opakované měření antikogulační aktivity anti Xa je ale doporučeno v několika speciálních indikacích zahrnujících předávkování, extrémní tělesnou hmotnost, děti a renální insuficienci. Při předávkování záleží na konkrétní situaci, zda pacientka krvácí, či nikoliv. Je třeba mít na paměti, že antidotum protamin chlorid, protamin sulfát jsou v případě LMWH méně účinné než u nefrakciovaného heparinu [3].
Při obezitě je třeba mít na paměti, že nadměrná vrstva podkožního tuku ovlivní lokální resorpci LMWH a jeho farmakokinetiku a může rezultovat v nevypočitatelný antikoagulační efekt.
Novorozenci vyžadují individuálně variabilní dávky LMWH. Do 2 měsíců věku je u nich monitorování aktivity anti Xa plně indikováno.
Adjustace podávané dávky LMWH u těhotných podle zvyšující se hmotnosti v průběhu těhotenství zůstává kontroverzním tématem. Mnoho kliniků monitoruje anti Xa v průběhu těhotenství jedenkrát za měsíc ve snaze korigovat podávanou dávku LMWH. Neexistují však pevná doporučení a ani jednoznačná data podporující tuto aktivitu. Monitorování při profylaktických dávkách LMHW není nutné. V případech, kdy je nutné dosažení terapeutických dávek u těhotných, může být laboratorní monitorování aktivity anti Xa užitečné [8].
ZÁVĚR
I když prevence a léčba trombózy a embolie patří primárně hematologům, našeho oboru se velmi úzce dotýká. V průběhu těhotenství a porodu se porodník setkává s celou řadou situací, které by měl adekvátně současným poznatkům a doporučením řešit samostatně. Bazální orientace v problematice trombembolismu je nutná v zájmu pacientky i pro dobrou spolupráci s hematologem.
Vypracováno za podpory grantu IGA MZ ČR NS9905-4.
Doc. MUDr. Tomáš Binder, CSc.
Gynekologicko-porodnická klinika
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
Zdroje
1. Bates, SM., Greer, IA., Hirsh, J., Ginsberg, JS. Use of Antithrombotic Agents During Pregnancy. The Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy; Evidence Based Guidelines; http//hestjournal.chestpubs.org/content/126/ 3_suppl/627S.full 2004.
2. Bates, SM., Greer, IA., Pabinger, I., et al. Venous thrombembolism, thrombophilia, antithrombic therapy, and pregnancy: American College of Chest Physicians Evidence Based Clinical Practice Guidelines. 8th Ed. Chest, 2008, 133 (6 Suppl), p. 844S‑886S.
3. Bounameaux, H., De Moerloose, P. Is laboratory monitoring of low-molecular-weigh heparin therapy necessary? J Thromb Haemost, 2004, 2, p. 551-554.
4. Greaves, M. Limitations of the laboratory monitoring of heparin therapy. Thromb Haemost, 2002, 87, p. 163-164.
5. O’Connor, DJ., Scher, LA., Gargiulo, NJ 3rd, et al. Incidence and characteristics of venous thromboembolic disease during pregnancy and the postanatal period: a contemporary series. Ann Vasc Surg, 2010, 26.
6. Penka, M., Binder, T., Unzeitig, V., Dulíček, P. Návrh antitrombotické profylaxe a péče o trombofilní stavy v gynekologii a porodnictví – doporučený postup. Čes Gynek 2010, 75, (S1), s. 23-25.
7. Royal College of Obstetricians and Gynaecologist. Thromboprophylaxis During Pregnancy, Labour and After vaginal Delivery, RCOG Guideline No.37, 2004.
8. Sephton, V., Farquharson, RG., Topping, J., et al. A longitudinal study of maternal dose - response to low mlecular weight heparin in pregnancy. Obstet Gynecol, 2003, 101, p. 1307-1311.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek Abstrakt
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2011 Číslo 4- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Doporučené postupy – závazné, nebo nezávazné?
- Transabdominální ultrazvukové vyšetření v gynekologii
- Minimálně invazivní výkony pod ultrazvukovou kontrolou v onkogynekologii
- Aplikace metody SNP array v prenatální diagnostice
- Vplyv exogénneho luteinizačného hormónu na parametre IVF/ICSI cyklov
- Metylácia vybraných tumor-supresorických génov v benígnych a malígnych ovariálnych nádoroch
- Současná klasifikace zhoubných nádorů v onkogynekologii – část I
- Biochemické aspekty fetálnej hypoxie
- Nová metoda screeningu Downova syndromu v I. trimestru: One-Stop-Clinic for Assessment of Risk (OSCAR)
- Trikuspidální regurgitace u plodu
- Je třeba revidovat doporučení prevence trombembolické nemoci u těhotných?
- Riziko vzniku prolapsu „de novo“ v primárne nepostihnutom kompartmente pri použití syntetického implantátu v rámci operačnej liečby prolapsu panvových orgánov
- Profesor MUDr. Vojtěch Šnaid, DrSc.Významná osobnost české gynekologie a porodnictví21. 9. 1911 – 25. 6. 2001
- Abstrakt
- Postřehy z ENTOG exchange Manchester, Velká Británie
- Entog exchange ve Velké Británii 2. 5.–7. 5. 2011
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Trikuspidální regurgitace u plodu
- Aplikace metody SNP array v prenatální diagnostice
- Transabdominální ultrazvukové vyšetření v gynekologii
- Současná klasifikace zhoubných nádorů v onkogynekologii – část I
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



