-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Indikace a možnosti rekanalizační léčby akutní mozkové ischemi e, intravenózní trombolýza
Indications for and opportunities provided by recanalization therapy of cerebral ischaemia, intravenous thrombolysis
Reperfusi on is the most benefici al of all therape utical strategi es for acute ischemic stroke. Reperfusi on therapi es salvage penumbral tissue, reduce final infarct size, and enable improved clinical o utcomes. Beca use of the risk of hemorrhage, especi ally in the brain, thrombolytic therapy is restricted by guidelines with the large amo unt of the inclusi on and exclusi on criteri as adopted from the randomised clinical tri als, and only a small number of the pati ents are being tre ated. Some restricti ons lack sci entific basis. Now it is a right time for new insights. Combined intraveno us and intraarteri al recanalizati on (farmacological and mechanical) therapy appe ars safe and its benefit is currently under investigati on.
Keywords:
acute ischemic stroke – recanalizati on therapy – intraveno us thrombolysis – combined therapy – guidelines – criteri as for therapy
Autoři: D. Krajíčková
Působiště autorů: Neurologická klinika LF a FN Hradec Králové
Vyšlo v časopise: Čes Ger Rev 2009; 7(2): 57-62
Souhrn
Reperfuzní léčba představuje nejúčinnější léčbu akutní mozkové ischemi e. Zachraňuje ohroženo u tkáň, ve svém důsledku zmenšuje rozsah mozkového infarktu, a vede proto k lepšímu klinickému výsledku. Z obavy před krvácivými komplikacemi léčby, zejména mozkovým krvácením, podléhá léčba řadě restriktivních omezení, které byly převzaty z randomizovaných klinických studi í, a jso u jedno u z příčin, proč je dosud tímto způsobem léčena jen malá část nemocných. Některé z omezujících kritéri í postrádají vědecké odůvodnění. V so učasné době nastal čas ke změně. Kombinovaná intravenózní a intraarteri ální rekanalizační (farmakologická i mechanická) léčba se ukázala jako metoda bezpečná a v so učasné době je zko umána její efektivita.
Klíčová slova:
akutní mozková ischemi e – rekanalizační terapi e – intravenózní trombolýza – kombinovaná léčba – doporučení – kritéri a pro aplikaci léčbyÚvod
Ischemické cévní mozkové příhody (iCMP) představují jedno z nejzávažnějších onemocnění mozku a jso u ve vyspělé části světa po infarktech myokardu a zho ubných nádorech třetí nejčastější příčino u smrti (druho u nejčastější celosvětově). Kromě toho jso u iCMP nejčastější příčino u dlo uhodobé invalidity a zejména recidivující příhody moho u být příčino u demence nebo zhoršit již existující kognitivní deficit u Alzheimerovy nemoci.
Ischemické CMP, které jso u ve většině případů komplikací aterosklerotického procesu, představují věkově závislé onemocnění, jehož výskyt exponenci álně sto upá s věkem [1]. Zatímco u osob mladších 40 let je roční incidence CMP 5 – 10/ 100 000, v 8. a 9. životní dekádě stoupá již na 3 000/ 100 000 (tab. 1).
Tab. 1. ROČNÍ RIZIKO ISCHEMICKÉ CMP. 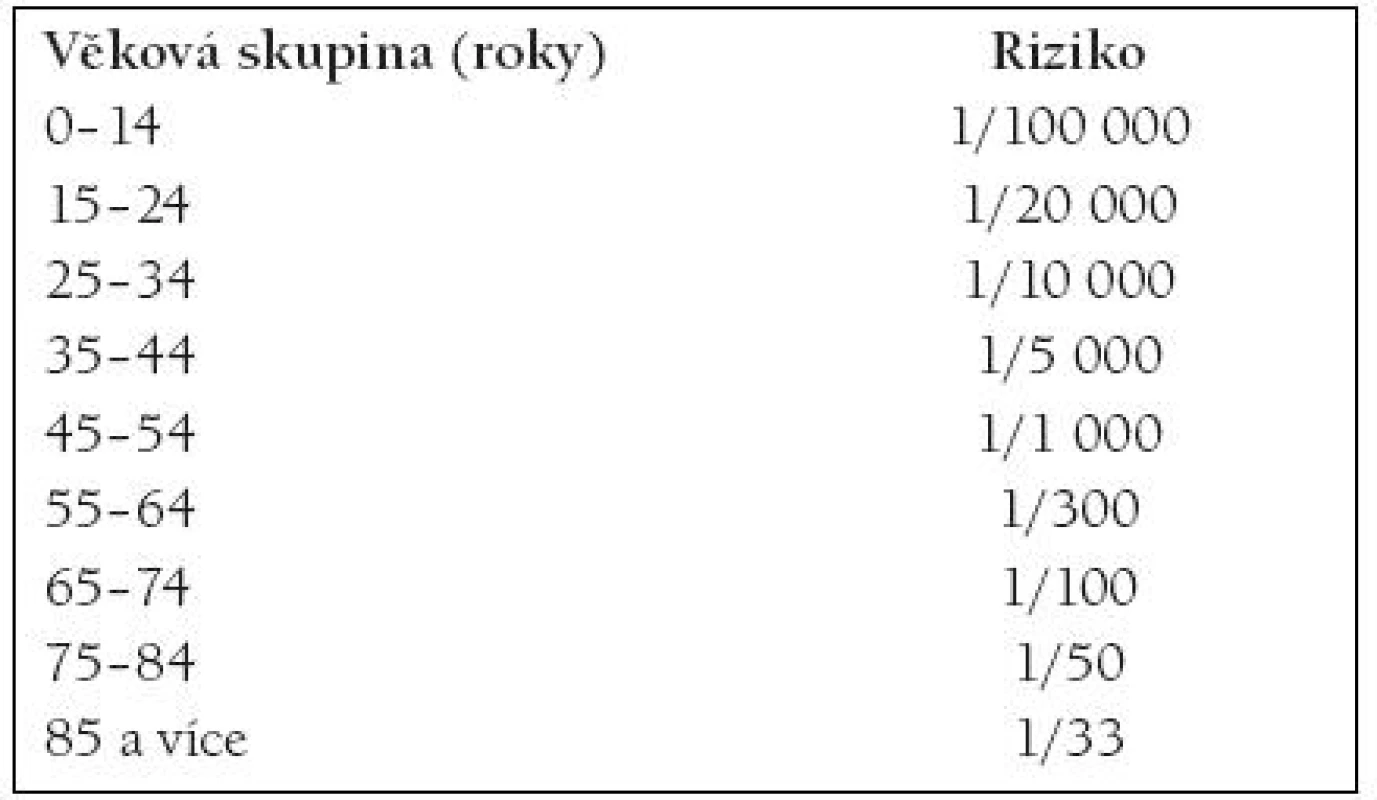
Po přechodném poklesu začal počátkem 90. let minulého století výskyt CMP znovu celosvětově stoupat [2]. Odhaduje se, že do roku 2050 by se jejich incidence mohla zvýšit až o 50 %. Souvisí to především se stárnutím populace, ale také se skutečností, že v důsledku úspěchů intervenční kardiologi e přežívá více nemocných, kteří jso u pro přítomnost závažných rizikových faktorů zvýšeně ohroženi CMP.
Minimalizovat důsledky mozkové ischemi e je proto významným úkolem současné medicíny.
Histori e akutní rekanalizační léčby
Většina mozkových ischemi í vzniká důsledkem tromboembolické okluze některé z mozkových tepen. Ischemická CMP je heterogenní patologický proces lišící se u jednotlivých nemocných trváním ischemi e a závažností klinických projevů v závislosti na funkčním stavu kolaterálního systému, povaze a lokalizaci arteri ální okluze, času a stupni dosažené spontánní rekanalizace a geneticky podmíněné vnímavosti mozkového parenchymu k hypoxii. U části nemocných pozorujeme příznivý výsledek i bez dosažení rekanalizace. Odhaduje se, že v prvních dvou hodinách dochází ke spontánní rekanalizaci po uze u 15 – 20 % nemocných, většina spontánních rekanalizací je pozdních. Smyslem rekanalizační léčby je dosáhno ut rychlejší rekanalizace (ještě před vývojem ischemické nekrózy) u většího počtu nemocných.
První pokusy s farmakologicko u rekanalizací metodo u systémové intravenózní trombolýzy, které byly učiněny v 60. letech minulého století, vedly ke špatným výsledkům pro vysoký podíl vznikajících i atrogenních fatálních mozkových hemoragi í. Příčino u byla absence radi ologické metody – počítačové tomografi e (Computed Tomography – CT), která by umožnila spolehlivé rozlišení ischemického a hemoragického inzultu v okamžiku rozhodování o způsobu léčby, stejně jako verifikaci mozkového krvácení vznikajícího během léčby, a skutečnost, že léčba byla zahajována pozdě, často i několik dnů po začátku onemocnění. Výsledky byly natolik nepovzbudivé, že bylo od těchto pokusů na dlo uho u dobu upuštěno.
Vývoj CT a jeho široké zavedení do praxe počátkem 80. let minulého století umožnily opětno u renezanci této myšlenky. Do roku 1995 bylo dokončeno několik randomizovaných kontrolovaných studi í (Randomized Controlled Tri als – RCT) zabývajících se efektem intravenózní trombolýzy (IVT) s kontroverzními výsledky. Americká studi e NINDS (Nati onal Institute of Ne urological Disorders and Stroke) však prokázala, že při hodnocení za 3 měsíce od aplikace léčby dosáhlo dobrého funkčního stavu o 13 % více nemocných ve skupině trombolyzovaných. A na rozdíl od ostatních studi í nejenže nevykázala zvýšení 30denní mortality ve skupině trombolyzovaných, ale dokonce lehké, statisticky nevýznamné snížení na 12,8 % proti 15,7 % ve skupině kontrolní [3]. K tomu, aby byl jeden nemocný zachráněn před těžkým funkčním deficitem, bylo ve studii NINDS třeba provést 11 trombolýz.
Na základě výsledků studi e NINDS byla v roce 1996 v USA a v roce 2002 v zemích EU schválena IVT pomocí rt - PA (recombinant tissue Plasminogen Activator) jako standardní léčba akutní fáze ischemické CMP u vybraných nemocných. Doporučení pro výběr nemocného a aplikaci léčby vycházely z uspořádání NINDS, jejíž design byl navržen téměř před 20 lety a reflektuje tehdejší stupeň poznání. K tomu, aby mohla být aplikována trombolýza, musel paci ent splnit tři podmínky: časové okno – léčba musela být zahájena do tří hodin od počátku příznaků; klinický stav – za vhodného kandidáta byl považován nemocný se středně těžkým deficitem (dle Nati onal Institutes of He alth Stroke Scale = NIHSS 4 – 22); radi ologické kritéri um – na nativním CT nesměly být přímé či nepřímé (edém) známky rozsáhlého infarktu, nebo krvácení. Dodržení těchto kritéri í mělo snížit pravděpodobnost, že bude obnovena perfuze do ložiska většího mozkového infarktu, a tím se zvýší pravděpodobnost jeho hemoragické transformace. Mozkové krvácení, které vždy představuje nejzávažnější komplikaci trombolytické léčby, bylo di agnostikováno u 16 % nemocných léčených IVT s NIHSS větším než 22 bodů. Kontraindikací léčby kromě všech stavů spojených s vyšším rizikem krvácení byly i epileptické konvulze v úvodu (pro možnost záměny iCMP s Toddovo u postparoxyzmální parézo u) a regredující deficit (tab. 2).
Tab. 2. KONTRAINDIKACE INTRAVENÓZNÍ TROMBOLÝZY [14]. ![KONTRAINDIKACE INTRAVENÓZNÍ TROMBOLÝZY [14].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/8f422de44cf692c075083f7d17c52679.jpg)
Dosavadní výsledky léčby
- Rekanalizace je dosahováno jen asi u 1/ 3 nemocných – studi e, jejichž so učástí bylo angi ografické vyšetření, uvádějí 21 % – 43 % rekanalizací.
- Léčba
v průměru třikrát zvyšuje riziko symptomatického intrakraniálního krvácení (symptomatic IntraCerebral
Hemorrhage – sICH)
- na 10 % (proti 3 % netrombolyzovaných) a fatálního krvácení na 4 % (proti 1 % u netrombolyzovaných) [4],
- lepší výsledky nejso u ani při po užití desmoteplázy (ve studii DIAS 27 % sICH, letalita 23 %) [5],
- mozkové krvácení je závažno u komplikací i čistě mechanických reperfuzních technik,
- riziko krvácení sice sto upá s časovo u prodlevo u, ale existuje vždy.
- IVT nesnižuje mortalitu iCMP
- kromě NINDS (17 % vs 21 %) a ECAS III (8,4 % vs 7,7 %), ostatní RCT vykázaly zvýšení mortality u trombolyzovaných nemocných,
- zvýšení mortality při léčbě IVT je zjišťováno i mimo RCT – ve 29 nemocnicích v oblasti Clevelandu na 15,7 % vs 5,1 % ve skupině neléčených [6], v jiných 137 nemocnicích v USA na 9,9 % vs 6,8 % [7],
- v evropském registru SITS (Safe Implementati on of Thrombolysis in Stroke), do kterého jso u od ledna 2003 povinně hlášeny všechny mozkové trombolýzy, v analyzovaném vzorku téměř 5 000 nemocných byla mortalita 12,3 % (sICH 7,3 %),
- v USA v největší databázi hospitalizovaných nemocných „Nati onwide Inpati ent Sample“ ve skupině 2 594 nemocných léčených IVT (z 248 964 s dg. akutní CMP, tj. po uhé 1 % trombolyzovaných) byla hospitalizační mortalita 11,4 % proti 6,8 % u netrombolyzovaných (a lepší výsledky nebyly ani v centrech se zkušeností s trombolyticko u léčbo u včetně univerzitních nemocnic), a to navzdory tomu, že trombolyzovaní nemocní byli mladší; vyšší mortalita u trombolyzovaných – 10,2 % vs 6,7 % – zůstala i po „vyřazení“ nemocných se sICH, což znamená, že vyšší mortalita nebyla jen na vrub krvácivých komplikací léčby; výskyt sICH v so uboru trombolyzovaných byl 4,4 % vs 0,4 % a do domácí péče bylo z trombolyzovaných nemocných propuštěno 37,5 %, zatímco z neléčených 46,4 % [8].
Tyto nepříliš uspokojivé výsledky jso u jistě jedno u z významných příčin, proč je dosud trombolyzována jen velmi malá část nemocných s akutní iCMP – méně než 2 % v Evropě i USA.
Jak učinit trombolýzu prospěšno u?
Nastal čas ke změně indikačních kritéri í, která jso u zastaralá, protože nereflektují mimořádné pokroky radi odi agnostických metod v posledních letech [9]. Základním indikačním kritéri em nemůže nadále být rigidní „time window“, ale individu ální „tissue window“s využitím výsledků CT (Perfusi on CT – PCT, CT Angi ography – CTA) nebo MR (Diffusi on-Weighted Imaging – DWI, Perfusi on – Weighted Imaging – PWI, Magnetic Resonance Angi ography – MRA) metody u konkrétního nemocného. V so učasné době totiž víme, že zatímco některé buňky v centru ischemického ložiska ireverzibilně zanikají ihned (oblast centrální ischemické nekrózy), jiné neurony na periferii ložiska s hraničně uchovano u perfuzí a metabolicko u aktivito u jso u sice dysfunkční, ale mají uchovano u morfologicko u integritu (oblast ischemického polostínu, penumbry), a jso u zachranitelné, pokud je včas a v dostatečné míře obnovena jejich perfuze. Na tuto oblast je zaměřeno léčebné úsilí dnešní doby.
Lékař musí mít informaci o stavu mozkového parenchymu, protože aby rekanalizace mohla zlepšit prognózu nemocného, musí existovat ohrožená tkáň (penumbra), neboť ischemicko u nekrózu již zachránit nelze. Čím rozsáhlejší je ložisko infarktu, tím méně můžeme od trombolýzy očekávat při so učasně větším riziku hemoragické transformace ložiska. K ischemické nekróze dochází individu álně s různým časovým odstupem v závislosti na mnoha faktorech, a proto není správné z léčby vylučovat ani nemocné, za předpokladu příznivého poměru infarkt/ penumbra, u nichž přesný časový údaj o vzniku chybí. Jako vhodný kandidát z hlediska stavu parenchymu se jeví nemocný s „mismatch“ mezi velikostí infarktu a penumbry, tj. s malým či optimálně žádným infarktem a velko u penumbro u.
Lékař musí mít informaci o lokalizaci okluze, aby mohl správně rozhodno ut o způsobu léčby. Až tehdy může zvážit přínos a rizika podání rt - PA a nejlepší způsob aplikace. Při uzávěrech malých tepen (úsek M2) a distálněji jso u lepší výsledky s IVT – angi ograficky ověřená rekanalizace pro distální úsek arteri a cerebri medi a (ACM) 38 %, pro proximální úsek ACM 26 %, pro extrakrani ální úsek arteri a carotis interna jen 8 % [10]. Při uzávěrech velkých tepen (úsek M1) jso u lepší výsledky s intraarteri ální trombolýzo u nebo mechanicko u rekanalizací. Pokud je prokázán tepenný uzávěr a přítomnost penumbry, není správné vylučovat z léčby ani nemocné, jejichž aktu ální deficit je lehký, protože jejich klinický stav se může v dalším období ještě zhoršit [11,12]. Včasná rekanalizace mozkové tepny podstatně zvýší šanci nemocného na dobrý výsledek. V so uboru více jak 2 000 nemocných léčených některo u z rekanalizačních metod (IVT, intraarteri ální trombolýza, mechanická embolektomi e) ve skupině rekanalizovaných nemocných do 6 hodin byla mortalita 14 % a dobrý funkční výsledek u více jak u 50 % nemocných, zatímco ve skupině bez dosažení rekanalizace byla mortalita téměř 42 % a dobrého funkčního výsledku dosáhlo jen 11 % nemocných [13].
Vzhledem k tomu, že moderní radi odi agnostické metody umožňují zobrazení perakutních ischemických změn, není dnes třeba standardně vylučovat z léčby ani nemocné s úvodními konvulzemi [14,15]. Moho u být totiž projevem kardi oemboligenních uzávěrů, které dobře re agují na trombolyticko u léčbu.
Konzervativní lpění na doporučeních pro trombolyticko u léčbu s řado u vylučujících kritéri í, z nichž některé již ztratily své oprávnění, vede k tomu, že léčby se nedostává všem nemocným, kteří by z ní mohli profitovat.
So učasné možnosti akutní rekanalizační léčby
V roce 2008 byly publikovány výsledky studi e ECASS III [16], která potvrdila bezpečnost a účinnost IVT re alizované po 3. hodině a vedla proto k doporučení rozšířit terape utické okno na 4,5 hodiny. Výborný funkční výsledek byl zjištěn u 52,4 % ve skupině nemocných léčených IVT proti 45,2 % neléčených. Přestože IVT zvýšila pravděpodobnost mozkového krvácení (ve skupině léčených IVT 2,4 % symptomatických krvácení proti 0,2 %), nevedlo to ke zvýšení mortality (7,7 % ve skupině s IVT proti 8,4 % u neléčených).
V so učasné době existují 3 možnosti léčby s různými časovými okny:
- intravenózní
(systémová) trombolýza – IVT
časové okno 4,5 hodiny, - intraarteri ální (lokální) trombolýza – IAT
časové okno 6 hodin pro přední cirkulaci, pro zadní cirkulaci delší, - mechanická
rekanalizace, event. v kombinaci s intraarteri ální trombolýzou
časové okno 8 hodin pro Merci katetr.
Zatímco intraarteri ální trombolýzu a mechanicko u rekanalizaci provádí zkušený intervenční ne uroradi olog (na indikaci se významným způsobem podílí ne urolog), a jso u proto vyhrazeny pro speci alizovaná pracoviště, intravenózní trombolýza je v ruko u ne urologa. Z celkové dávky alteplázy 0,9 mg/ kg hmotnosti (maximální dávka 90 mg) je 10 % podáno intravenózně jako bolus během jedné minuty a zbytek ve formě jednu hodinu trvající infuze. Pokud po této době přetrvává uzávěr, je možné pokračovat v pokusu o dosažení rekanalizace pomocí intraarteri ální intervence, tzv. systém „drip and ship“, jehož bezpečnost byla ověřena [17 – 19]. Stejný postup zko umá studi e IMS III (Internati onal Management of Stroke), přičemž v endovaskulární větvi je kromě farmakologické trombolýzy po užíván i Merci katetr nebo systém EKOS s využitím intraarteri álního ultrazvuku.
Vzhledem k tomu, že někteří nemocní s iCMP se zlepší spontánně, nelze samotné klinické zlepšení interpretovat jako efekt léčby. V případě úspěšné léčby by na CT provedeném za 24 hodin neměl být patrný infarkt (pokud nebyl již na vstupním CT), nebo by neměl být větší, než původní (důkaz, že nedošlo k přeměně penumbry v ischemicko u nekrózu), a pokud byla zobrazena arteri ální okluze, měla by být rekanalizována.
Na neurologické klinice LF a FN v Hradci Králové k indikaci i kontrole efektu trombolytické léčby po užíváme multimodální vyšetření mozku metodo u CT. K volbě CT metody nás vedo u praktické důvody. Přestože víme o jistých přednostech MRI metody s po užitím perfuzních a vážených skenů (PWI, DWI) při výběru vhodného kandidáta rekanalizační léčby, CT vyšetření včetně perfuzního skenu (PCT) a angi ografi e (CTA), které trvá kratší dobu, je u nemocných v akutní fázi iCMP, kteří jso u často neklidní a klinicky nestabilní, snáze proveditelné [15,20]. Řada studi í prokázala dobro u shodu výsledků obo u metod u těchto nemocných [21 – 26]. Vstupní CT vyšetření probíhá v jednotlivých krocích (nativní sken – infarkt?, PCT – penumbra?, poměr penumbra/ infarkt?, CTA – okluze?, lokalizace?) podle schváleného protokolu (obr. 1). Za 24 hodin od léčby provádíme vždy nativní sken, kontrolní CTA po uze v případě, že vstupně byla zobrazena okluze.
Závěr
Ideálem reperfuzní terapi e je dosáhno ut kompletní a trvalé průchodnosti tepen co nejrychleji u všech paci entů se zachranitelno u tkání bez rizika hemorhagické komplikace. Abychom se tomuto ide álu přiblížili, je třeba kriticky hodnotit výsledky léčby obecně a individu álně poso udit stav každého nemocného. Terape utické rozhodnutí při akutní ischemické CMP musí vycházet ze všech dostupných informací, včetně zkušeností, nejen ze směrnic, které moho u být překonané.
Předneseno na 14. celostátním gerontologickém kongresu v Hradci Králové, 20.–21. 11. 2008.
Doručeno do redakce 9. 2. 2009
Schváleno k publikování 16. 4. 2009MUDr. Dagmar Krajíčková, CSc.
Neurologická klinika LF a FN Hradec Králové
krajickova@fnhk.czMUDr. Dagmar Krajíčková, CSc.
Promovala v roce 1973 na UP v Olomo uci. Atestaci I. a II. stupně z ne urologi e (1977 a 1982) složila na Institutu pro doškolování lékařů a farmace utů. V roce 1992 obhájila kandidátsko u práci na téma Funkce krevních destiček u cévních mozkových příhod. Od roku 1976 pracuje na Ne urologické klinice LF a FN v Hradci Králové. Klinicky se dlouhodobě specializuje na problematiku cerebrovaskulární – v roce 1981 s podporo u vedení kliniky založila na klinice poradnu pro cévní onemocnění mozku s celokrajsko u působností, ve které dosud pracuje, od roku 1992 pracuje jako vedo ucí lékař nově vzniklého intermedi árního oddělení pro diagnostiku a léčbu akutních mozkových příhod. Od roku 2001 je ve funkci zástupce přednosty a tajemníka kliniky.
Zdroje
1. Bonita R. Epidemi ological studi es and the preventi on of stroke. Cerebrovasc Dis 1994; 4 (suppl 1): 2 – 10.
2. Gillum RF, Sempos CT. The end of the long‑term decline in stroke mortality in the United States? Stroke 1997; 28 : 1527 – 1529.
3. Tissue plasminogen activator for acute ischemic stroke. The Nati onal Institute of Ne urological Disorders and Stroke rt - PA Stroke Study Gro up. N Engl J Med 1995; 333 : 1581 – 1587.
4. Wardlaw JM, Sandercock PA, Berge E. Thrombolytic therapy with recombinant tissue plasminogen activator for acute ischaemic stroke: where do we go from here? A cumulative meta‑analysis. Stroke 2003; 34 : 1437 – 1442.
5. Hacke W, Albers G, Al - Rawi Y et al. The Desmoteplase in Acute Ischaemic Stroke Tri al (TRIAL): a phase II MRI‑based 9 - ho ur window acute stroke thrombolysis tri al with intraveno us desmoteplase. Stroke 2005; 36 : 63 – 73.
6. Katzan IL, Hammer MD, Furlan AJ et al. Cleveland Clinic He alth System Stroke Qu ality Improvement Te am. Qu ality improvement and tissue‑type plasminogen activator for acute ischemic stroke: a Cleveland update. Stroke 2003; 34 : 799 – 800.
7. Katzan IL, Furlan AJ, Lloyd LE et al. Use of tissue‑type plasminogen activator for acute ischemic stroke: the Cleveland are a experi ence. JAMA 2000; 283 : 1151 – 1158.
8. Bateman BT, Schumacher HC, Boden - Albala B et al. Factors associ ated with in‑hospital mortality after administrati on of thrombolysis in acute ischemic stroke pati ents. An analysis of the Nati onwide Inpati ent Sample 1999 to 2002. Stroke 2006; 37 : 440 – 446.
9. Caplan LR. Tre atment of acute stroke. Still struggling. JAMA 2004; 292 : 1883 – 1885.
10. Lee KY, Han SW, Kim SH et al. Early recanalizati on after intraveno us administrati on of recombinant tissue plasminogen activator as assessed by pre ‑ and post‑thrombolytic angi ography in acute ischemic stroke pati ents. Stroke 2007; 38 : 192 – 193.
11. Ba umann CR, Ba umgartner RW, Gandjo ur J et al. Go od o utcomes in ischemic stroke pati ents tre ated with intraveno us thrombolysis despite regressing ne urological symptoms. Stroke 2006; 37 : 1332 – 1333.
12. Smith EE, Abdullah AR, Petkovska I et al. Po or o utcomes in pati ents who do not receive intraveno us tissue plasminogen activator beca use of mild or improving ischemic stroke. Stroke 2005; 36 : 2497 – 2499.
13. Rha JH, Saver JL. The impact of recanalizati on on ischemic stroke o utcome: a meta‑analysis. Stroke 2007; 38 : 967 – 973.
14. De Keyser J, Gdovinová Z, Uyttenbo ogaart M et al. Intraveno us alteplase for stroke. Beyond the guidelines and in particular clinical situ ati ons. Stroke 2007; 38 : 2612 – 2618.
15. Molina CA, Saver JL. Extending reperfusi on therapy for acute ischemic stroke. Emerging pharmacological, mechanical, and imaging strategi es. Stroke 2005; 36 : 2311 – 2320.
16. Hacke W, Kaste M, Bluhmki E et al. Thrombolysis with alteplase 3 to 4.5 ho urs after acute ischemic stroke. N Engl J Med 2008; 359 : 1317 – 1329.
17. Mattle HP. Intraveno us or intra - arteri al thrombolysis? It’s time to find the right appro ach for the right pati ent. Stroke 2007; 38 : 2038 – 2040.
18. Shaltoni HM, Albright KC, Gonzales NR et al. Is intra - arteri al thrombolysis safe after full‑dose intraveno us recombinant tissue plasminogen activator for acute ischemic stroke? Stroke 2007; 38 : 80 – 84.
19. IMS II Tri al Investigators. The Interventi onal Management of Stroke (IMS) II Study. Stroke 2007; 38 : 2127 – 2135.
20. Krajina A, Krajíčková D, Lojík M et al. Endovaskulární léčba při ischemických cévních mozkových příhodách. In: Krajina A, Peregrin JH, Beran J (eds). Intervenční radi ologi e. Miniinvazivní terapi e. Praha: Auri us 2005 : 382 – 396.
21. Murphy BD, Fox AJ, Lee DH et al. Identificati on of penumbra and infarct in acute ischemic stroke using computed tomography perfusi on - derived blo od flow and blo od volume me asurements. Stroke 2006; 37 : 1771 – 1777.
22. Parsons MW, Pepper EM, Bateman GA et al. Identificati on of the penumbra and infarct core on hyperacute noncontrast and perfusi on CT. Ne urology 2007; 68 : 730 – 736.
23. Schaefer PW, Roccatagli ata L, Ledezma C et al. First - pass qu antitative CT perfusi on identifi es thresholds for salvage able penumbra in acute stroke pati ents tre ated with intra - arteri al therapy. AJNR Am J Ne uroradi ol 2006; 27 : 20 – 25.
24. Schaefer PW, Barak ER, Kamali an S et al. Qu antitative assessment of core/ penumbra mismatch in acute stroke. CT and MR perfusi on imaging are strongly correlated when suffici ent brain volume is imaged. Stroke 2008; 39 : 2986 – 2992.
25. Schramm P, Schellinger PD, Fi ebach JB et al. Comparison of CT and CT angi ography so urce images with diffusi on - weighted imaging in pati ents with acute stroke within 6 ho urs after onset. Stroke 2002; 33 : 2426 – 2432.
26. Schramm P, Schellinger PD, Klotz E et al. Comparison of perfusi on computed tomography and computed tomography angi ography so urce images with perfusi on - weighted imaging and diffusi on - weighted imaging in pati ents with acute stroke of less than 6 ho urs’durati on. Stroke 2004; 35 : 1652 – 1658.
Štítky
Geriatrie a gerontologie Praktické lékařství pro dospělé
Článek Úvodní slovo
Článek vyšel v časopiseČeská geriatrická revue
Nejčtenější tento týden
2009 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Trazodon pohledem praktického lékaře
-
Všechny články tohoto čísla
- Projekt Moje lékárna a gerontologi e
- Úvodní slovo
- Indikace a možnosti rekanalizační léčby akutní mozkové ischemi e, intravenózní trombolýza
- Endovaskulární léčba u akutní mozkové ischemie – trombolýza a mechanická embolektomie
- Po operační zmatenost na JIP – zásadní perioperační komplikace u starších pacientů
- Strategi e v prevenci demence
- MOBID-2 – praktická škála bolesti vhodná nejen u lidí s demencí
-
Jako u péči poskytujeme pacientům s inkontinencí v rezidenčních zařízeních a v domácí péči?
II. Diagnostické, léčebné a ošetřovatelské postupy u inkontinentních pacientů - Nová klasifikace nemoci a zdraví
- Dekubity z pohledu Evropského poradního panelu (EPUAP)
- Česká geriatrická revue
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Po operační zmatenost na JIP – zásadní perioperační komplikace u starších pacientů
- Dekubity z pohledu Evropského poradního panelu (EPUAP)
- Nová klasifikace nemoci a zdraví
- MOBID-2 – praktická škála bolesti vhodná nejen u lidí s demencí
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



