-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam molekulární pitvy v soudním lékařství
The importance of molecular autopsy in forensic medicine
Standard autopsy does not always detect a cause of individual’s death. It occurs often in cases of sudden death. The reason for decease, at least in a part of unsolved cases, can be revealed using methods of molecular biology and genetics. This approach is called molecular autopsy.
First application dates to the end of 20th century when cause of sudden unexplained death of a young woman was provided only after execution of molecular autopsy. Molecular autopsy (also known as post-mortem genetic testing) finds its application particularly in cases of sudden death of young people or infants as their decease is more frequently associated with hereditary diseases linked for example to heart or metabolic conditions. In terms of methodical development, the form of molecular testing has been improved until now. Originally, targeted analysis of small number of genes was used. Nowadays, whole-exome and whole-genome sequencing slowly becomes a new standard for molecular autopsy. Although molecular autopsy has a potential to be integrated into an autopsy as a standard part of it, for now it has not become a standardised routine part of forensic autopsy.
Keywords:
molecular autopsy – sudden infant death syndrome – sudden death
Autoři: Jana Orlíčková 1; Martin Zeman 2; Tomáš Vojtíšek 2; Ondřej Slabý 1,3
Působiště autorů: Středoevropský technologický institut, Masarykova univerzita, Brno 1; Ústav soudního lékařství LF MU a FN u sv. Anny, Brno 2; Biologický ústav LF MU, Brno 3
Vyšlo v časopise: Čas. Lék. čes. 2022; 161: 207-211
Kategorie: Přehledový článek
Souhrn
Standardní pitva vždy neodhalí příčinu úmrtí jedince. Často se tak děje v případech tzv. náhlého úmrtí. Pomocí metod molekulární biologie a genetiky však může být u části neobjasněných případů zjištěno, z jakého důvodu ke smrti došlo. Souhrnně je tento přístup označován jako molekulární pitva. Nejčastěji je molekulární pitva (nebo také posmrtné genetické testování) využita u případů náhlého úmrtí kojenců a mladých jedinců, kdy bývá příčina úmrtí častěji spjatá s dědičnými onemocněními, například srdečními či metabolickými poruchami.
Poprvé bylo molekulární pitvy využito na konci 20. století, kdy byla příčina úmrtí mladé ženy nalezena až po provedení genetických analýz. Do dnešních dní prochází metodika molekulární pitvy kontinuálním vývojem. Původně byly pomocí cílené sekvenace analyzovány jednotky genů. V dnešní době se přechází na celoexomové a celogenomové analýzy, které se postupně v rámci molekulární pitvy stávají novým standardem. Dosud se však molekulární pitva nestala standardní součástí pitvy v případech náhlých nevysvětlitelných úmrtí, a to i přesto, že skýtá obrovský potenciál na poli diagnostiky post mortem.
Klíčová slova:
molekulární pitva – náhlé úmrtí – syndrom náhlého úmrtí kojenců
DEFINICE MOLEKULÁRNÍ PITVY
Molekulární pitva je definována jako soubor metod molekulární biologie a genetiky, který je možné využít v případě, že při standardní pitvě nebyla nalezena příčina smrti. V praxi se můžeme setkat také s pojmem genetické testování post mortem, který akcentuje příslušnost molekulární pitvy k standardní pitvě coby její součást (1). Termín „molekulární pitva“ je však používanější, a to i z toho důvodu, že příměji oslovuje komunitu patologů (2).
Poprvé byla molekulární pitva využita před více než 20 lety Michaelem J. Ackermanem. Jednalo se o případ zdravé 19leté dívky, která byla nalezena na dně bazénu, a to přesto, že byla dobrou plavkyní. Následná resuscitace byla sice úspěšná, po pár hodinách však ztratila vědomí a o 12 dní později zemřela. Standardní pitva neodhalila příčinu úmrtí. Ackermanův tým poté přistoupil ke genetické analýze genomu zemřelé. Byla nalezena mutace v genu KVLQT1, který je spojován se syndromem dlouhého intervalu QT (LQTS) (3). Ten se řadí mezi tzv. kanálopatie, což jsou onemocnění způsobená mutacemi v genech pro iontové kanály v membránách buněk.
VYUŽITÍ MOLEKULÁRNÍ PITVY
Z popisu první molekulární pitvy je patrné, že pomáhá objasnit zejména náhlá neočekávaná úmrtí (SUD – sudden unexpected death). Dále byla využita také při post mortem studiu nádorů (4) a metabolických poruch (7). Účelem pitvy je kromě určení příčiny smrti také stanovení doby, kdy k ní došlo. Proto pokud bychom uvažovali o molekulární pitvě sensu lato, k ní lze zařadit také molekulárně biologický přístup při určování doby úmrtí – například pomocí sledování degradace molekul RNA (8).
SUD je definováno jako smrt jedince do jedné hodiny od prvotních symptomů, nebo jako úmrtí zdravé osoby, která byla do 24 hodin od posledního sociálního kontaktu nalezena bez známek života (10). 65–85 % případů SUD je připisováno srdečním abnormalitám, hovoříme o tzv. náhlé srdeční smrti (SCD – sudden cardiac death) (11, 12). U mladých jedinců (ve věku do 35 let) hrají významnou roli také genetické predispozice (13). U starších jedinců (ve věku nad 35 let) se jedná především o ischemickou chorobu srdeční (14). Případy SUD jsou taktéž spojovány s krvácením do mozku a dalšími neuropatologickými stavy, kterým je kupříkladu epileptický záchvat (pak hovoříme o SUDEP – sudden unexpected death in epilepsy). Neočekávaná smrt může nastat také kvůli potížím respiračního systému (např. v důsledku infekce, astmatu či plicní embolie) či metabolickým poruchám (14).
POSTUP PŘI MOLEKULÁRNÍ PITVĚ
Po standardní pitvě, která neodhalila přesnou příčinu smrti, je prostor pro provedení pitvy molekulární. Ta sestává z izolace DNA z biologického materiálu a následné molekulárně biologické analýzy (obr. 1).
Obr. 1. Postup při molekulární pitvě (upraveno podle: 2). 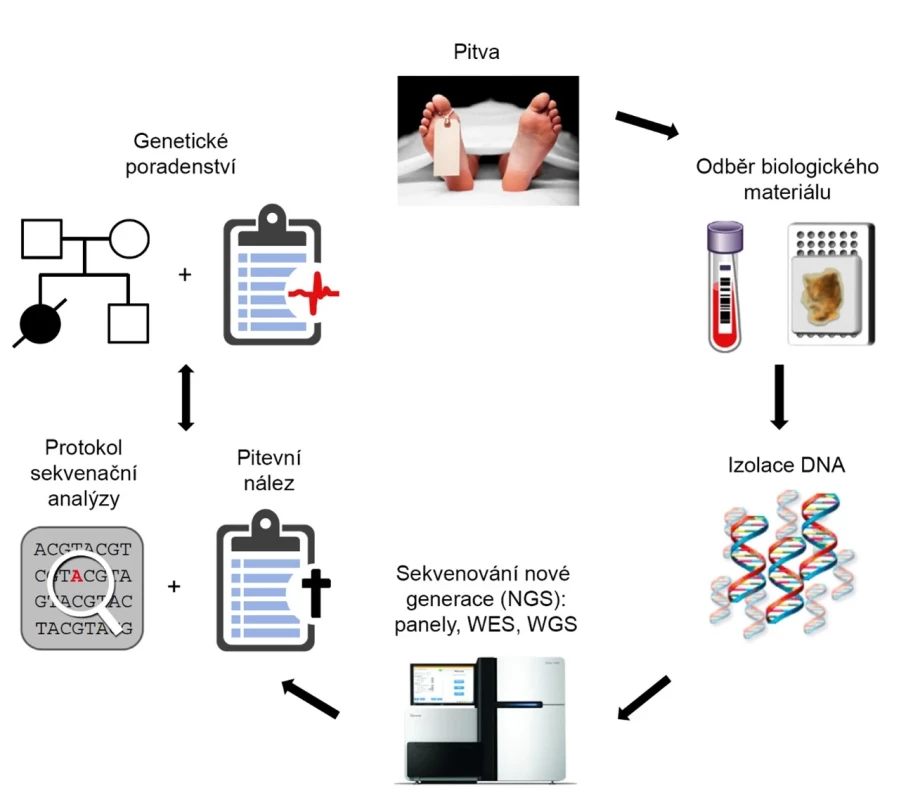
Po odběru biologického materiálu v průběhu standardní pitvy následuje izolace DNA a její molekulárně biologická analýza. Dále probíhá zpracování získaných dat. V případě nálezu potenciálně patologické varianty je příbuzným zemřelého doporučeno genetické poradenství. V začátcích byly využity zejména metody založené na analýze jednotlivých polymorfismů, např. SSCP (15). Další možností bylo užití přímého sekvenování (Maxamovo‑Gilbertovo sekvenování, Sangerovo sekvenování) (3). Prvotní studie se zaměřovaly na jednotlivé geny (viz dále) spojované nejčastěji s dědičnými arytmogenními chorobami – kardiomyopatiemi (tj. onemocnění srdečního svalu spojené s poruchami funkce srdce) a kanálopatiemi. Jak název napovídá, obě skupiny onemocnění spojuje přítomnost arytmií.
U kardiomyopatie nastává porucha srdečního rytmu kvůli strukturálním změnám srdečního svalu; v případě kanálopatie je arytmie způsobena poruchami převodního systému a žádné morfologické změny myokardu nejsou pozorovány. Výskyt arytmií tedy nelze často potvrdit provedením standardní pitvy, jelikož srdeční onemocnění nemusí zanechávat stopy v podobě morfologických změn na srdci, které by byly detekovatelné. Původní molekulární pitva zahrnovala analýzu čtveřice genů spjatých s LQTS, syndromem Brugadových (BrS) a katecholaminergní polymorfní ventrikulární tachykardií (CPVT). Jedná se o dědičné poruchy srdečního rytmu (kanálopatie) (16).
Výběr genů souvisel s prvotními aplikacemi molekulární pitvy, která se zaměřovala na mladší jednice, u kterých, jak už bylo výše zmíněno, bývá často skrytou příčinou smrti monogenně dědičné srdeční onemocnění. Na základě genetické analýzy mutací v genech KCNQ1, KCNH2, SCN5A a RYR2 tak bylo možné identifikovat až 30 % příčin v případech nejasné náhlé smrti (17). Zbylých 70 % však zůstávalo neobjasněných.
Postupem času se proto panel zkoumaných genů zvětšoval na desítky a stovky genů spojených zejména se srdeční činností. V dnešní době se postupně přechází na analýzu exomu, případně celého genomu. Lidský genom tvoří celkem 3,2 miliardy párů bází (bp – base pairs), ze kterých přibližně 1 % (30–40 milionů bp) tvoří tzv. exom neboli soubor všech exonů dohromady čítajících asi 23 tisíc genů. Tato kódující část genomu je přepisována do struktury proteinů a její sekvenční variabilita tak může mít přímý dopad na buněčné funkce. Odhaduje se, že přibližně 85 % mutací zodpovědných za vznik geneticky podmíněných onemocnění leží právě v exomové části genomu (18). Z toho důvodu je v současné době exomové sekvenování využíváno častěji než sekvenování celogenomové.
Větší panel genů, případně celý exom však již není možné efektivně analyzovat pomocí metod přímého sekvenování. S rostoucím počtem zkoumaných genů rostlo tedy také využití metod masivního paralelního sekvenování (MPS; označované také sekvenování nové generace, NGS). Základním rozdílem mezi metodou přímého sekvenování a MPS je skutečnost, že v případě MPS může být sekvenováno obrovské množství fragmentů DNA současně.
Terminologicky výrazy NGS a MPS označují totéž. MPS však v názvu zdůrazňuje podstatu metody, kdežto NGS se názvem hlavně vymezuje vůči metodám „staré“ generace (tedy kupříkladu Sangerovu sekvenování) (19). Oproti starším metodám MPS disponuje řadou dalších výhod. Pro analýzu je potřeba menšího množství vstupního materiálu. Samotná analýza je navíc časově výhodnější, a to zejména kvůli možnosti sekvenovat více úseků genomu a také vzorků pacientů zároveň, a tím relativně levněji.
MPS můžeme využít pro tzv. panelové sekvenování, celoexomové sekvenování (WES – whole exome sequencing) a celogenomové sekvenování (WGS – whole genome sequencing). Panelové sekvenování je vhodné zejména pro rutinní diagnostiku, kdy jsou sekvenovány jednotky až stovky genů. Výhodou této varianty sekvenace je bezesporu malá časová i finanční náročnost. Omezení sekvenace na předem vybrané úseky genomu poskytuje také nejvyšší senzitivitu, jednotlivé fragmenty DNA jsou sekvenovány v nejvíce opakováních, tj. vykazují tzv. největší hloubku čtení.
Nemusí však dojít k zachycení všech potenciálně klinicky významných variant. Sekvenovat veškeré exony (WES) znamená kompletně sekvenovat kódující oblasti genomu (asi 23 tisíc genů), což činí zhruba 1 % z celého jeho rozsahu. Na druhou stranu se patogenní genetické varianty vyskytují až z 85 % právě v oblasti exomu, což v porovnání s panelovým sekvenováním výrazně zvyšuje šanci na zachycení potenciálně klinicky významných variant.
Velkou nevýhodou je však detekce variant s nejasným rizikem pro jejich nositele. Nicméně oproti WGS (viz dále) bioinformatická analýza dat z WES poskytuje jednodušší interpretaci. Skrze WGS je získáno obrovské množství výstupních dat, která mohou být často těžko interpretovatelná. Také je časově a finančně nejnáročnějším přístupem ze všech tří jmenovaných. WGS však poskytuje nejkomplexnější pohled na genom jedince. Lze detekovat různé typy genetických variant v kódujících i nekódujících regionech, např. variabilitu v počtu kopií (CNV – copy number variation), jednonukleotidové polymorfismy (SNP – single nucleotide polymorphism), malé inzerce a delece (indels) a další (20).
Z ČEHO PROVÉST MOLEKULÁRNÍ PITVU?
Biologický materiál, ze kterého se molekulární pitva provádí, je nejčastěji fixovaný formalínem a zalitý parafínem (tzv. vzorky FFPE – formalin-fixed paraffin‑embedded). Pro účely molekulární pitvy je však vhodnější využít krev či přímo kousek tkáně (nejčastěji srdce, mozku a sleziny), a to z důvodu lepší kvality nukleové kyseliny, která je stěžejní pro provedení molekulární pitvy. Vzorky tkáně pak mohou být zpracovány rovnou nebo je lze ihned po odběru zamrazit na –80 °C a pracovat s nimi později. V mnoha případech, zejména při retrospektivních studiích, je však k dispozici pouze biologický materiál z FFPE. A to také z toho důvodu, že je dodnes standardem konzervovat vzorky odebrané patologem právě tímto způsobem (21). Integrita DNA může být však touto konzervací porušena, navíc mohou mezi DNA a proteiny vznikat křížové vazby.
Oba tyto jevy pak často vedou k inhibici polymerázové řetězové reakce (PCR), důležitému kroku před samotným sekvenováním DNA. Touto problematikou se přímo zabývalo několik studií (např. Kofanova et al.), které se snažily optimalizovat protokoly pro práci s FFPE vzorky tak, aby bylo možné dosáhnout co nejvíce vypovídajících výsledků (21).
EPIDEMIOLOGIE SUD/SCD
Každoročně umírá v důsledku SCD asi 9 milionů lidí na celém světě (22). SUD je z 65 až 85 % způsobena SCD (viz výše), což představuje asi 10,5–13,8 milionu náhlých úmrtí ročně. Pravděpodobnost SCD s věkem stoupá (10). U mladších jedinců (do 45 let) taktéž není výskyt tak častý, na druhou stranu bývá častěji obtížné stanovit příčinu, pokud k náhlé smrti dojde. U třetiny případů SCD není standardní pitvou určena příčina smrti, u mladších jedinců (do 35 let) se může jednat až o 40 % náhlých úmrtí (23).
V Evropě se incidence náhlých neočekávaných úmrtí bez zjevné příčiny stabilně pohybuje okolo 3 na 100 000 obyvatel, což je přibližně 26 tisíc náhle zemřelých jedinců za jeden rok. Z toho je přibližně 18 tisíc (tedy více než dvě třetiny) jedinců ve věku do 44 let (24). Tedy, čím mladší jedinec náhle zemře, tím menší je pravděpodobnost nalezení příčiny jeho úmrtí.
Genetické pozadí SCD
Dědičná srdeční onemocnění jsou příčinou smrti u 5–10 % případů SCD (25). U jedinců mladších 50 let je až 30 % případů SCD spojeno se srdečními arytmiemi (26). Jak již bylo zmíněno výše, studie se ze začátku zaměřovaly na čtyři geny spojené s LQTS, BrS a CPVT. Mutace v genech KCNQ1, KCNH2 a SCN5A, kódujících α‑podjednotky draslíkových či sodíkových kanálů, zodpovídají za tři nejčastější podtypy LQTS (LQTS 1–3), tj. až 85 % všech případů (27). Mutace v genu SCN5A se zároveň vyskytují také v případě BrS (20–30 % všech jedinců) (27).
Příčina SUD se tedy v závislosti na věku oběti mění. U jedinců zemřelých v důsledku SUD a zároveň starších 50 let bývá nejčastěji pozorovanou příčinou smrti ischemická choroba srdeční (10). U mladších jedinců se kromě srdečních patologií případy SUD váží také například k neuropatologiím a epilepsii (14).
NÁHLÁ ÚMRTÍ KOJENCŮ
Samostatnou kapitolou jsou náhlá úmrtí v kojeneckém období (tj. do jednoho roku života). Hovoříme o tzv. náhlém úmrtí kojenců (SUDI – sudden unxpected death in infancy). V roce 2019 zemřelo v Evropské unii 14 100 kojenců, což odpovídá 3,4 zemřelým kojencům na 1 000 narozených dětí (28). V Česku se jednalo o 288 kojenců, což odpovídá 2,6 zemřelým jedincům na 1 000 narozených dětí (29).
Je důležité zmínit, že v posledních 30 letech došlo k výraznému snížení mortality kojenců v celém západním světě (30). V Česku se za posledních 30 let snížila úmrtnost kojenců téměř na jednu pětinu. Jednoznačný podíl na snížení incidence kojenecké úmrtnosti, a to až o 50 %, mají celosvětové osvětové kampaně (např. Back To Sleep v USA), které probíhaly v 90. letech minulého století a doporučovaly neukládat kojence v pozici na břiše. Jedná se totiž o jeden z faktorů významně zvyšující pravděpodobnost jeho úmrtí. I přes úspěšné kampaně zůstává SUDI, potažmo SIDS (viz dále) jednou z nejčastějších příčin úmrtí dětí do jednoho roku života (31).
SUDI bývá často spojeno s udušením dítěte, např. v důsledku nesprávné polohy při spánku či sdílení postele s rodiči (30). Až polovina všech případů SUDI je však spojena se syndromem náhlého úmrtí kojence (SIDS – sudden infant death syndrome). Jedná se o situaci, kdy dojde k úmrtí dítěte do jednoho roku života a není možné určit příčinu úmrtí ani na základě pitvy, ani po podrobném vyšetření místa úmrtí (31). Podobně jako u starších náhle zemřelých jedinců v důsledku SCD, přibližně 20 % všech úmrtí v rámci populace západního světa (22), také SIDS se významně podílí na celkové úmrtnosti ve své věkové kategorii, tj. u dětí do jednoho roku života. V Evropě se v mnoha státech často jedná o nejčastější diagnózu úmrtí kojence (32). K úmrtí dochází nejčastěji v prvních 6 měsících života (90 %), a to převážně v noci (31). Častějšími obětmi jsou chlapci, poměr vůči zemřelým dívkám je přibližně 3 : 2 (31).
Příčiny náhlých úmrtí kojenců
Do dnešních dní zůstává SIDS diagnózou per exclusionem. Příčina SIDS tedy není jasná. Existuje však řada teorií, které se pokouší fenomén SIDS (a celkově SUDI) vysvětlit. Tou nejznámější je tzv. hypotéza trojího rizika. Je založena na 3 faktorech, které při souběžném výskytu mohou vyústit v úmrtí kojence – zranitelnost kojence, kritické období vývoje a externí stresový faktor (30).
Ona zranitelnost zahrnuje jak podněty z vnějšího okolí kojence, tak také genetické pozadí. Genetické abnormality nervového a imunitního systému společně se srdečními a metabolickými odchylkami mohou učinit dítě zranitelnějším např. k infekci (externí stresový faktor), která poté vede k jeho smrti. Role infekce je podle mnoha odborníků klíčová (33). Je zahrnována také v jiných teoriích, např. v teorii fatálního trojúhelníku. Ta se opírá také o trojici faktorů, které zahrnují kritickou fázi vývoje centrální nervové soustavy (CNS) a imunitního systému sliznic; genetické predispozice a astrogliózu (nadměrný počet astrocytů vlivem odumírání neuronů CNS), a nakonec působení vnějšího podnětu (např. virové infekce) vedoucí k přílišné stimulaci imunitního systému (34).
Každá z teorií tedy přikládá váhu různým faktorům. Téměř všechny teorie se však shodují na tom, že pro fatální konec je potřeba spolupůsobení vícera faktorů. To poukazuje na multifaktoriální povahu SIDS, kdy právě dochází k interakci vnitřních a vnějších faktorů. Bylo např. prokázáno, že kouření matky v těhotenství a postnatální vystavení dítěte cigaretovému kouři zvyšuje riziko výskytu SIDS a kromě špatné spánkové kultury je významným rizikovým faktorem přispívajícím k úmrtí dítěte (35). Je ale potřeba dodat, že fatální bude expozice tabákovému kouři až v případě, že je dítě také geneticky predisponováno např. pro sníženou schopnost odbourávat metabolity kouření (36). A právě na genetické pozadí jedince se v současnosti soustředí největší pozornost v oblasti výzkumu SIDS.
Pro pochopení, proč k SIDS dochází, se zdá být znalost genetických predispozic jedince nezbytná, a to nejen v případě kojenců. Nástrojem pro toto zkoumání je právě molekulární pitva, která v podobě panelového sekvenování či WES může objasnit až 35 % případů SIDS (18), které se tedy přesouvají z kategorie SIDS do kategorie SUDI.
Genetické pozadí SUDI/SIDS
Genetické studie se soustředí zejména na geny a jejich varianty, které souvisí s metabolickými dráhami, defekty signálních drah CNS, imunodeficiencí či srdečními abnormalitami (35, 37). Nejčastěji pozorovanou poruchou metabolismu, která je spojená s rizikem SIDS, je deficience enzymu acyl-CoA dehydrogenázy mastných kyselin se středně dlouhým řetězcem. Mnoho z detekovaných poruch metabolismu bylo postupně zařazeno do rutinního novorozeneckého screeningu. Bohužel ne vždy jsou jím metabolická onemocnění detekována (37). Vrozené vady metabolismu stojí za 1 až 2 % případů úmrtí kojenců (35).
Náhlá nevysvětlitelná smrt kojence může být způsobena také defekty signálních drah CNS, zejména v oblasti mozkového kmene. Jedním z důvodů studia právě této části mozku je skutečnost, že během prvních šesti měsíců života, tedy kritickému období výskytu SIDS, dochází k intenzivnímu vývoji tohoto oddílu mozku. Naeye už v roce 1976 pozoroval u obětí SIDS astrogliózu (viz výše) v mozkovém kmeni, kterou přičítal chronické hypoventilaci a hypoxemii (38).
V dnešní době se od této teorie upouští a studie se zaměřují na přenos vzruchu a neurotransmitery, např. serotonin. Ten je zodpovědný za přenos signálů právě v mozkovém kmeni. Poruchy signálních drah serotoninu mohou vést k poklesu excitability a skutečnosti, že dítě zemře. Bylo popsáno několik genů, jejichž polymorfismy nebo různé úrovně exprese mohou být z hlediska SIDS patogenní – SLC6A4 (gen pro transportér serotoninu 5-HTT), TPH2 (gen pro regulátor hladiny serotoninu), HTR1A (gen pro serotoninový receptor).
U náhlé smrti kojenců se pravidelně objevuje také infekce a zánět. Ve studii z Velké Británie byla pozorováno prodělání nemoci v posledním týdnu života u 26 % kojenců. Teorie spojené se zánětem předpokládají buď hromadění toxinů v důsledku kolonizace sliznice infekčními agens, nebo dysregulaci zánětlivé imunitní odpovědi, která je následována cytokinovou bouří přispívající ke smrti dítěte. Infekce přitom může mít mírný průběh a nic tedy nenasvědčuje komplikacím. Dokonce se klinicky nemusí infekce vůbec projevit. Kandidátními geny, jejichž polymorfismy jsou asociovány s náhlým úmrtím kojenců, jsou např. IL1A či TNF (37).
Stejně jako u starších jedinců, je mnoho kojeneckých úmrtí připisováno srdečním abnormalitám, v této věkové kategorii však dědičným arytmogenním chorobám, nejčastěji s monogenní dědičností (16). Patogenní genetické varianty jsou nalézány v genech KCNQ1, KCNH2, SCN5A a RYR2 (viz výše). Existují však desítky dalších genů spojených s dědičnými arytmickými syndromy (např. SCN1B, SCN3A, SCN9A, TRPM4 atd.) (35). V menší míře mohou za SIDS stát také kardiomyopatie, které nebyly standardní pitvou odhaleny. Nejčastěji se jedná o hypertrofickou kardiomyopatii s asociovanými polymorfismy genů MYH7 a MYBPC (geny pro sarkomerní proteiny) (37).
ZÁVĚR
Přestože první molekulární pitva byla provedena již v roce 1999 (3), do dnešních dnů se při objasňování příčiny úmrtí v případě náhlé smrti jedince nestala rutinní záležitostí (39). Její přínos na poli určování příčiny smrti je však nepopiratelný. Od několika jednotek vyšetřovaných genů pokročila molekulární pitva ke genetickým analýzám exomu. Objevují se také již první celogenomové studie, které mohou přinést informace i o nekódujících oblastech a CNV, které mohou být také zapojeny do etiologie SIDS a SUD obecně (37). Konkrétně v Dánsku, kde byly analyzovány genomy a transkriptomy obětí SCD (40). Jak u WES, tak tím spíše u WGS je však potřeba velké opatrnosti při interpretaci získaných dat (13).
Častým problémem bývá otázka míry patogenity nalezených variant. V tomto případě může pomoci jak další zkoumání např. v podobě funkčních studií (35), tak také genetické vyšetření rodinných příslušníků obětí SUD. Zejména u dětí a kojenců může genetický screening pomoci s prevencí tragické události u sourozenců zemřelých dětí. Genetické vyšetření rodinných příslušníků také pomůže odhalit varianty, které vznikly de novo (37).
Seznam použitých zkratek
BrS syndrom Brugadových
CNS centrální nervová soustava
CNV variace v počtu kopií (copy number variation)
CPVT katecholaminergní polymorfní komorová tachykardie (catecholaminergic polymorphic ventricular tachycardia)
FFPE tkáň fixovaná formalínem a zalitá v parafinu (formalin‑fixed, paraffin-embedded)
LQTS syndrom dlouhého intervalu QT (long QT syndrome)
MPS masivní paralelní sekvenování (massive parallel sequencing)
NGS sekvenování nové genereace (next generation sequencing)
SCD náhlá srdeční smrt (sudden cardiac death)
SIDS syndrom náhlého úmrtí kojence (sudden infant death syndrome)
SNP jednonukleotidový polymorfismus (single nucleotide polymorphism)
SSCP polymorfismus konformace jednořetězcové DNA (single-strand conformation polymorphism)
SUD náhlé neočekávané úmrtí (sudden unexpected death)
SUDEP náhlá smrt u epileptiků (sudden unexpected death in epilepsy)
SUDI náhlé úmrtí kojenců (sudden unexpected death in infancy)
WES celoexomové sekvenování (whole-exome sequencing)
WGS celogenomové sekvenování (whole-genome sequencing)
Adresa pro korespondenci:
prof. RNDr. Ondřej Slabý, Ph.D.
Biologický ústav LF MU
Univerzitní kampus Bohunice, Pavilon B06
Kamenice 5, 625 00 Brno
e-mail: oslaby@med.muni.cz
Zdroje
1. Edwards WD, Ackerman MJ. Molecular autopsy vs postmortem genetic testing [3] (multiple letters). Mayo Clin Proc 2005; 80 : 1234–1235.
2. Ackerman MJ. Molecular Autopsy vs postmortem genetic testing: in response. Mayo Clin Proc 2005; 80 : 1235–1236.
3. Ackerman MJ, Tester DJ, Porter BJ, Edwards WD. Molecular diagnosis of the inherited long-QT syndrome in a woman who died after near-drowning. N Engl J Med 1999; 341 : 1121–1125.
4. Ahrendsen JT, Filbin MG, Chi SN et al. Increasing value of autopsies in patients with brain tumors in the molecular era. J Neurooncol 2019; 145 : 349–355.
5. Simon CT, Skala SL, Killen PD et al. Plasmacytoid urothelial carcinoma: a rapid autopsy case report with unique clinicopathologic and genomic profile. Diagn Pathol 2019; 14 : 113.
6. Ahrendsen JT, Torre M, Meredith DM et al. IDH-mutant gliomas with additional class-defining molecular events. Mod Pathol 2021; 34 : 1236–1244.
7. Lee HCH, Lai CK, Siu TS et al. Role of postmortem genetic testing demonstrated in a case of glutaric aciduria type II. Diagn Mol Pathol 2010; 19 : 184–186.
8. Maiese A, Scatena A, Costantino A et al. MicroRNAs as useful tools to estimate time since death. A systematic review of current literature. Diagnostics 2021; 11 : 64.
9. Scrivano S, Sanavio M, Tozzo P, Caenazzo L. Analysis of RNA in the estimation of post-mortem interval: a review of current evidence. Int J Legal Med 2019; 133 : 1629–1640.
10. Bayés de Luna A, Elosua R. Sudden Death. Rev Española Cardiol 2012; 65 : 1039–1052.
11. Zeman M, Sepši M, Vojtíšek T, Sindler M. Suddenly deceased young individuals autopsied at the Department of forensic medicine, Brno – analysis. Česko-slovenská patologie a Soudní lékařství 2012; 48/57 : 44–47.
12. Campuzano O, Allegue C, Partemi S et al. Negative autopsy and sudden cardiac death. Int J Legal Med 2014; 128 : 599–606.
13. Iglesias M, Ripoll-Vera T, Perez-Luengo C et al. Diagnostic yield of genetic testing in sudden cardiac death with autopsy findings of uncertain significance. J Clin Med 2021; 10 : 1806.
14. Drory Y, Turetz Y, Hiss Y et al. Sudden unexpected death in persons <40 years of age. Am J Cardiol 1991; 68 : 1388–1392.
15. Splawski I, Shen J, Timothy KW et al. Spectrum of mutations in Long-QT Syndrome genes: KVLQT1, HERG, SCN5A, KCNE1, and KCNE2. Circulation 2000; 102 : 1178–1185.
16. Bezzina CR, Lahrouchi N, Priori SG. Genetics of sudden cardiac death. Circ Res 2015; 116 : 1919–1936.
17. Bagnall RD, Das K J, Duflou J, Semsarian C. Exome analysis-based molecular autopsy in cases of sudden unexplained death in the young. Hear Rhythm 2014; 11 : 655–662.
18. Neubauer J, Lecca MR, Russo G et al. Post-mortem whole-exome analysis in a large sudden infant death syndrome cohort with a focus on cardiovascular and metabolic genetic diseases. Eur J Hum Genet 2017; 25 : 404–409.
19. Battelle Insider. MPS vs. NGS: What’s the difference. Inside Battelle, 2017. Dostupné na: http://inside.battelle.org/home/mps-vs.-ngs-what's-the-difference
20. Slabý O. Precizní medicína v onkologii. 1. část: Technologie genomového sekvenování pro účely precizní onkologie. proLékaře.cz, 2019. Dostupné na: www.prolekare.cz/kreditovane-kurzy/precizni-medicina-v-onkologii-109447/technologie-genomoveho-sekvenovani-pro-ucely-precizni-onkologie
21. Kofanova O, Bellora C, Garcia Frasquilho S et al. Standardization of the preanalytical phase of DNA extraction from fixed tissue for next-generation sequencing analyses. N Biotechnol 2020; 54 : 52–61.
22. Wong CX, Brown A, Lau DH et al. Epidemiology of sudden cardiac death: global and regional perspectives. Hear Lung Circ 2019; 28 : 6–14.
23. Bagnall RD, Weintraub RG, Ingles J et al. A Prospective study of sudden cardiac death among children and young adults. N Engl J Med 2016; 374 : 2441–2452.
24. WHO. European Mortality Database (1980–2020). Dostupné na: https://gateway.euro.who.int/en/datasets/european-mortality-database
25. Campuzano O, Sanchez-Molero O, Mademont-Soler I et al. Rare titin (TTN) variants in diseases associated with sudden cardiac death. Int J Mol Sci 2015; 16 : 25773–82577.
26. Mak CM, Mok NS, Shum HC et al. Sudden arrhythmia death syndrome in young victims: A five-year retrospective review and two-year prospective molecular autopsy study by next-generation sequencing and clinical evaluation of their first-degree relatives. Hong Kong Med J 2019; 25 : 21–29.
27. Giudicessi RJ, Ackerman MJ, Fatkin D, Kovacic JC. Precision medicine approaches to cardiac arrhythmias. J Am Coll Cardiol 2021; 77 : 2573–2591.
28. Eurostat. Infant mortality sharply declined over the past decades. 2021. Dostupné na: https://ec.europa.eu/eurostat/web/products-eurostat-news/-/ddn-20210604-1
29. Český statistický úřad. Pohyb obyvatelstva – rok 2019. Dostupné na: www.czso.cz/csu/czso/cri/pohyb-obyvatelstva-rok-2019
30. Fleming PJ, Blair PS, Pease A. Sudden unexpected death in infancy: aetiology, pathophysiology, epidemiology and prevention in 2015. Arch Dis Child 2015; 100 : 984–948.
31. Perrone S, Lembo C, Moretti S et al. Sudden infant death syndrome: beyond risk factors. Life 2021; 11 : 184.
32. de Visme S, Chalumeau M, Levieux K et al. National variations in recent trends of sudden unexpected infant death rate in western Europe. J Pediatr 2020; 226 : 179–185.e4.
33. Goldwater PN. Sudden infant death syndrome, infection, prone sleep position, and vagal neuroimmunology. Front Pediatr 2017; 5 : 223
34. Rognum TO, Saugstad OD. Biochemical and immunological studies in SIDS victims. Clues to understanding the death mechanism. Acta Paediatr 1993; 389 (Suppl.): 82–85.
35. Johannsen EB, Baughn LB, Sharma N et al. The genetics of sudden infant death syndrome – towards a gene reference resource. Genes (Basel) 2021; 12 : 216.
36. Filonzi L, Magnani C, Lavezzi AM et al. Detoxification genes polymorphisms in SIDS exposed to tobacco smoke. Gene 2018; 648 : 1–4.
37. Keywan C, Poduri AH, Goldstein RD, Holm IA. Genetic factors underlying sudden infant death syndrome. Appl Clin Genet 2021; 14 : 61–76.
38. Naeye RL. Brain-stem and adrenal abnormalities in the sudden-infant-death syndrome. Am J Clin Pathol 1976; 66 : 526–530.
39. Fellmann F, van El CG, Charron P et al. European recommendations integrating genetic testing into multidisciplinary management of sudden cardiac death. Eur J Hum Genet 2019; 27 : 1763–1773.
40. Andersen JD, Jacobsen SB, Trudsø LC et al. Whole genome and transcriptome sequencing of post-mortem cardiac tissues from sudden cardiac death victims identifies a gene regulatory variant in NEXN. Int J Legal Med 2019; 133 : 1699–1709.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek ÚVODEMČlánek Obezita a štítná žláza
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
-
Všechny články tohoto čísla
- ÚVODEM
- 125 let od narození profesora Josefa Charváta
- Josef Charvát, pamětník a komentátor své doby
- Profesor Josef Charvát a informatika
- Svačina Š. O době minulé i dnešní
- Obezita a štítná žláza
- Diagnostika a terapie endokrinní orbitopatie – update 2022
- Význam molekulární pitvy v soudním lékařství
- Hippokratova Přísaha a současné lékařské sponze
- 70 let prof. MUDr. Štěpána Svačiny, DrSc., MBA
- Zemřel profesor Miroslav Zeman
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hippokratova Přísaha a současné lékařské sponze
- Diagnostika a terapie endokrinní orbitopatie – update 2022
- 125 let od narození profesora Josefa Charváta
- Obezita a štítná žláza
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



