-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Diagnostika a terapie endokrinní orbitopatie – update 2022
Management of Graves’ ophthalmopathy – 2022 update
Graves’ ophthalmopathy (GO) occurs in 25–50% cases of Graves’ disease. Most cases are just mild, only 5% represents eye threatening diseases. About 5–10% of cases could be euthyroid and 10% hypothyroid, respectively. All patients with GO should be assessed for activity (clinical activity score – CAS) and severity of the disease. Essential conditions of the successful treatment are well controlled thyroid dysfunction, smoking cessation and to refer patients with moderate to severe and sight threatening GO to specialized thyroid eye centers as soon as possible.
Local therapy to maintain wet eye (lubricants) and supplementation of selenium deficiency is adequate in mild cases of GO. In cases of moderate to severe and sight threatening GO, administration of intravenous glucocorticoids in thyroid eye centers is first line treatment and a combination with mycophenolate or radiotherapy could be considered. When the first-line treatment fails or a contraindication/intolerance to them is present, non-steroid immunosuppressive drugs (mycophenolate, ciclosporin), rituximab, or radiotherapy could be considered. In rare cases of sight threatening GO urge surgical orbital decompression or tarsorrhaphy is warranted.
Keywords:
radiotherapy – mycophenolate mofetil – rituximab – Graves’ orbitopathy – clinical activity score – dysthyroid optic neuropathy – intravenous glucocorticoids
Autoři: Jan Jiskra
Působiště autorů: 3. interní klinika – klinika endokrinologie a metabolismu 1. LF UK a VFN v Praze
Vyšlo v časopise: Čas. Lék. čes. 2022; 161: 198-206
Kategorie: Přehledový článek
Souhrn
Endokrinní orbitopatie (EO) se vyskytuje u čtvrtiny až poloviny nemocných s Gravesovou-Basedowovou chorobou. Podmínkami pro její úspěšnou léčbu jsou dobrá kontrola tyreoidální dysfunkce, zanechání kouření a u středně těžkých a těžkých případů včasné odeslání do specializovaného centra. Před zahájením terapie má být vždy provedena klinická klasifikace aktivity (CAS skóre) a závažnosti choroby.
Většinou je EO lehká nebo střední až těžká, u 5 % pacientů je ohrožen zrak. U lehkých forem postačuje lokální léčba k udržení vlhkého oka (lubrikanty – umělé slzy) a suplementace selenového deficitu. Střední až těžké aktivní formy EO se v 1. linii léčí intravenózními glukokortikoidy (metylprednisolonem) a zvažuje se současné podávání mykofenolátu, případně ozáření ve specializovaných centrech. Pokud léčba 1. linie selže, nebo je kontraindikovaná či špatně tolerovaná, lze použít nesteroidní imunosupresiva (mykofenolát, cyklosporin), rituximab nebo ozáření (konvenční nebo Leksellovým gama nožem). U vzácných zrak ohrožujících případů jsou na místě i včasné chirurgické výkony (dekomprese či tarzorafie).
Klíčová slova:
radioterapie – endokrinní orbitopatie – rituximab – Gravesova-Basedowova choroba – skóre klinické aktivity – intravenózní glukokortikoidy – mykofenolát
Věnováno 125. výročí narození prof. MUDr. Josefa Charváta, DrSc.
ÚVOD
Klinicky významná endokrinní orbitopatie (EO) je ve srovnání s ostatními tyreopatiemi poměrně vzácné onemocnění. Incidence aktivní střední až těžké a zrak ohrožující EO se udává asi 16 žen a 3 muži na 100 000 obyvatel ročně (1), je ale závislá na geografické oblasti. Klinické známky lehké EO mohou být až u 25–50 % pacientů s Gravesovou-Basedowovou chorobou (GBD) a známky EO na CT či MRI může mít až 90 % pacientů s GBD (2, 3). Většinou je EO lehká, jen u 5 % pacientů je u ní ohrožen zrak (4). U 5–10 % může EO probíhat bez tyreoidální dysfunkce a až 10 % EO se vyskytne ve spojení s hypotyreózou (jde buď o pacienty s autoimunitní hypotyreózou, nebo pacienty léčené pro GBD) (1, 4).
PATOGENEZE
Patogeneticky jde o autoimunitní odpověď namířenou proti receptoru TSH nebo i jiným dosud neznámým antigenům na strukturách orbity (fibroblastům, okohybným svalům, tuku, pojivové tkáni). V časných stadiích nemoci dochází k aktivaci především TH1 imunitní odpovědi s produkcí příslušných cytokinů (IFN-γ, IL-2, IL-12, TNF-α, GM-CSF), v pozdější stadiích se aktivuje TH2 imunitní odpověď (IL-4, 5, 9, 10, 14, TGF-β) (2) a stoupá produkce protilátek proti receptoru TSH (TRAK), které u většiny pacientů (ale ne vždy) korelují s aktivitou choroby (5–7). To ale neplatí vždy a vyskytují se i případy těžké EO s negativními TRAK. Klinické zkušenosti ukazují, že právě u těchto pacientů je nemoc často rezistentní k léčbě.
RIZIKOVÉ A ZHORŠUJÍCÍ FAKTORY
Rizikovými faktory vzniku a těžšího průběhu EO je nevyřešená GBD a tyreoidální dysfunkce, kouření, ozáření (zevní a radiojodem 131I) a vysoké titry TRAK (4).
Ke vzniku či zhoršení EO může dojít až u 15 % pacientů s GBD léčených radiojodem 131I, zejména jde-li o kuřáky. Toto riziko se významně snižuje po zajištění terapie radiojodem malými dávkami glukokortikoidů (0,3–0,5 mg prednisonu/kg denně) (4).
NÁSLEDKY A KOMPLIKACE
Hlavní komplikace EO jsou následující:
- Poškození zrakového nervu kompresí (DON – dystyreózní neuropatie optického nervu), která se projeví snížením zrakové ostrosti a/nebo poruchou zorného pole a/nebo ztrátou barvocitu).
- Poškození a ulcerace rohovky při protruzi bulbu a lagoftalmu (ohrožení rohovky bývá většinou spojeno s nepřítomností Bellova fenoménu – stáčení bulbů vzhůru při pohybu předmětu proti oku simulujícím ohrožení oka).
- Diplopie (dvojité vidění), jež může být buď intermitentní (přítomná jen při únavě očí), nekonstantní (přítomné jen při pohledu určitým směrem) nebo konstantní (přítomná stále).
DIAGNOSTIKA
Klasifikace aktivity a závažnosti
Správná klasifikace onemocnění je zásadní pro racionální indikaci terapie (na první místě jde o systémovou imunosupresi glukokortikoidy), která může mít i závažné nežádoucí účinky. V indikaci k terapii bychom se měli řídit doporučením Evropské pracovní skupiny pro endokrinní orbitopatii EUGOGO (Consensus statement of the European Group on Graves’ orbitopathy on management of GO) (4, 8, 9), ze které vychází i národní doporučený postup České endokrinologické společnosti ČLS JEP (ČES) novelizovaný v roce 2022 (10).
Vychází se z oddělené klasifikace aktivity a závažnosti. Pro určení aktivity bylo upraveno původní desetibodové Mouritsovo skóre klinické aktivity CAS z roku 1989 (11) tak, že byly vypuštěny poslední 3 body (tab. 1) a za aktivní EO se považuje přítomnost ³ 3 bodů. Při hodnocení závažnosti nahradila klasickou Wernerovu klasifikaci NOSPECS (12) praktičtější klasifikace podle EUGOGO (tab. 2) (9). Ke zhodnoceni vlivu EO na kvalitu života, a to zejména při hodnocení efektu léčby, se doporučuje použít dotazník, který je ke stažení v originální verzi na webových stránkách EUGOGO nebo v české mutaci na stránkách ČES (13).
Tab. 1. Skóre klinické aktivity endokrinní orbitopatie 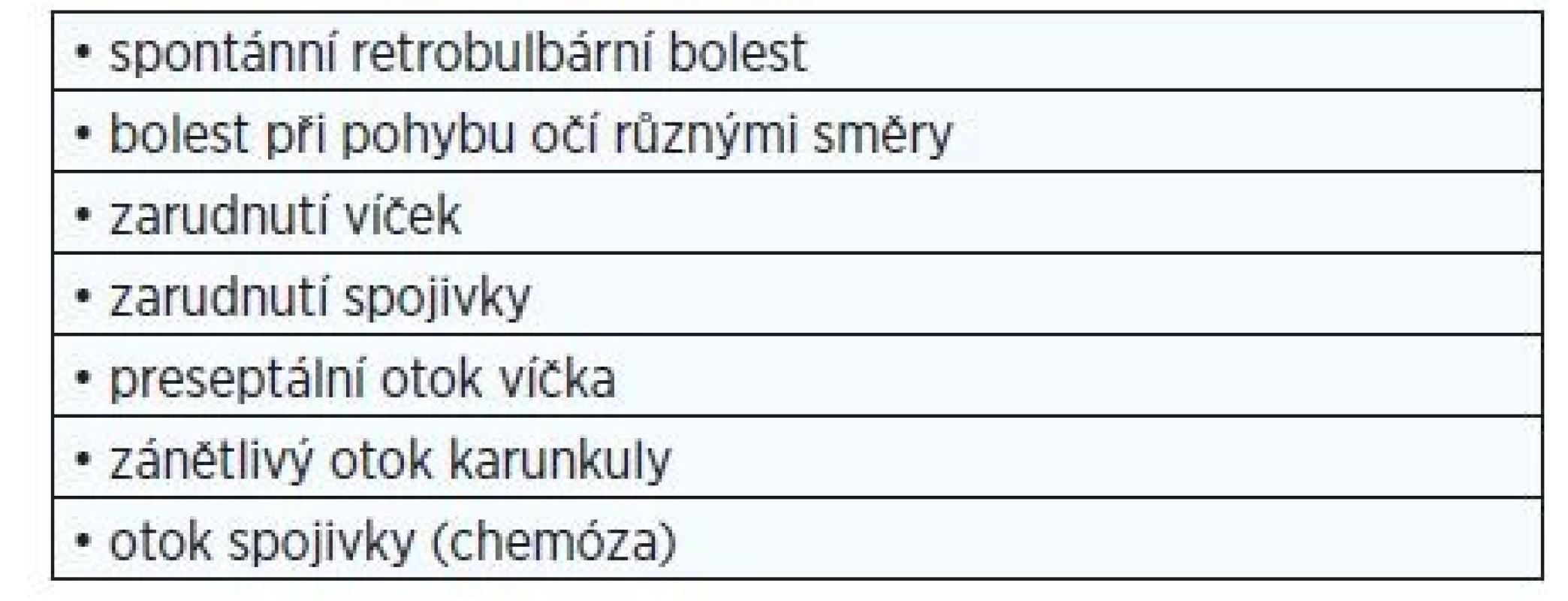
(upraveno dle: EUGOGO; 8). Za přítomnost každého příznaku 1 bod, aktivní endokrinní orbitopatie ≥ 3 body. Tab. 2. Klasifikace závažnosti endokrinní orbitopatie (upraveno dle: EUGOGO; 8) 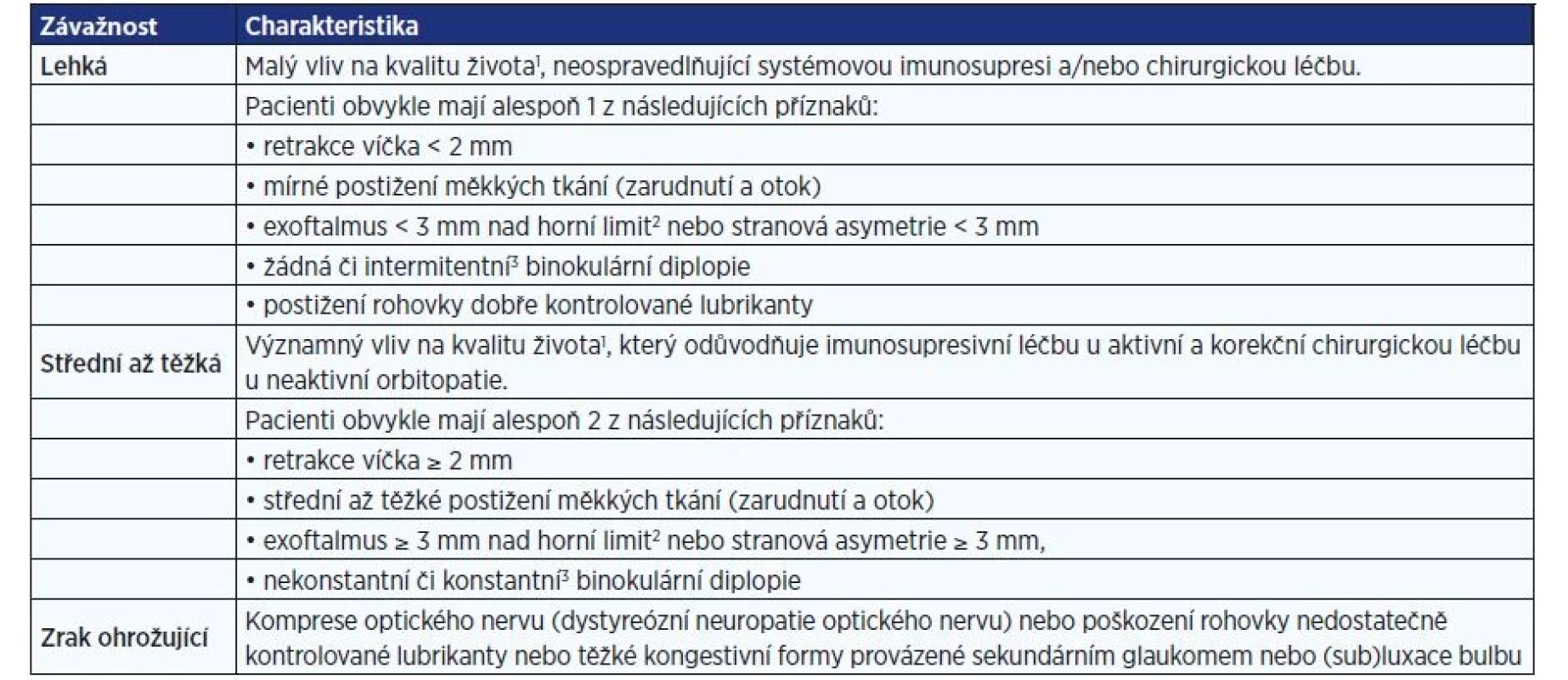
Pozn.:
1) Viz dotazník kvality života.
2) Horní limit je závislý na pohlaví a rase. Běloši: ženy 19 mm, muži 21 mm. Afroameričané: ženy 23 mm, muži 24 mm. Asiaté: ženy 16 mm, muži 17 mm (Thajci) nebo 18,6 mm (Číňani). Pro střední až závažnou formu také svědčí stranová asymetrie a změna v čase o ≥ 3 mm.
3) Intermitentní: přítomná jen po zátěži očí. Nekonstantní: přítomná jen v některém pohledovém směru. Konstantní: přítomná i v primárním postavení očí.Pacienti s aktivní EO by měli být vždy vyšetřeni endokrinologem a očním lékařem a mělo by být konsenzuálně rozhodnuto o případném odeslání pacienta do specializovaného centra, pokud se zvažuje systémová imunosupresivní léčba (aktivní střední až těžká a zrak ohrožující EO). K včasnému rozpoznání případů aktivní EO lze využít edukační materiály na stránkách ČES ČSL JEP (14), určené jak pro lékaře, tak pro pacienty.
Laboratorní testy
Kromě klinického vyšetření očí můžeme získat informaci o aktivitě onemocnění vyšetřením protilátek TRAK v séru. Vysoké titry protilátek TRAK většinou nacházíme u aktivní EO, (4–7), jsou však i výjimky, kdy jsou i u velmi aktivního onemocnění negativní. Ze zkušenosti lze říci, že případy s negativním protilátkami TRAK také hůře reagují na terapii. Vyšetření TSH a tyreoidálních hormonů (volného tyroxinu – fT4, eventuálně volného trijodtyroninu – fT3) je důležité z důvodu požadavku dobré kontroly základního onemocnění (GBD, případně autoimunitní hypotyreózy) při léčbě všech případů EO.
Zobrazovací metody
Převažuje konsenzus, že případy aktivní a nejméně středně těžké aktivní EO by měly být vyšetřeny zobrazovací metodou. Důvody pro vyšetření očí a hlavy jsou u endokrinní orbitopatie dva:
- Diferenciální diagnostika jiných příčin exoftalmu (zejména jednostranného), jako jsou nádory, zánětlivý pseudotumor očnice, arteriovenózní malformace či karotido-kavernózní píštěl.
- Zhodnocení aktivity EO (prosáknutí retrobulbárního tuku, rozšíření a zánětlivé prosáknutí okohybných svalů, event. edém slzné žlázy).
K prvnímu účelu lze využít výpočetní tomografii CT, jejíž výhodou je dobrá dostupnost, nevýhodou ovšem malá výpovědní hodnota stran aktivity choroby. Ultrazvuk (UZ) okohybných svalů při dobré vyšetřitelnosti a zkušenosti vyšetřujícího (obraz normálního okohybného svalu je na obr. 1) poměrně dobře odliší aktivní zánětlivé změny svalů (svaly jsou hypoechogenní a rozšířené) (obr. 2) od chronických fibrotických změn (svaly jsou izoechogenní či hyperechogenní, špatně odlišitelné od okolních struktur) (obr. 3). Nevýhodou UZ je špatná vyšetřitelnost a snížená spolehlivost vyšetření vertikálních svalů (dolní přímý, horní přímý/horní šikmý), špatná přehlednost svalů v zadní třetině orbity a nemožnost odlišit jiné patologické procesy ve vrcholu očnice a za ní. Magnetická rezonance (MRI) podobně jako CT vyloučí jiné příčiny exoftalmu, a navíc pravděpodobně lépe zhodnotí aktivní zánětlivé změny tuku a svalů, i když tento předpoklad není dosud ověřen klinickými studiemi (obr. 4).
Preference stran zobrazovacích metod jsou v jednotlivých centrech odlišné a závisí na dostupnosti i místní zkušenosti. Každopádně musí být nález při vyšetření zobrazovací metodou vždy interpretován v kontextu klinického vyšetření (CAS, klasifikace závažnosti, kvality života) a je třeba varovat před indikací k systémové imunosupresivní léčbě s možnými závažnými nežádoucími účinky pouze na základě nálezu zobrazovací metodou.
Obr. 1. Obraz normálního okohybného svalu na UZ 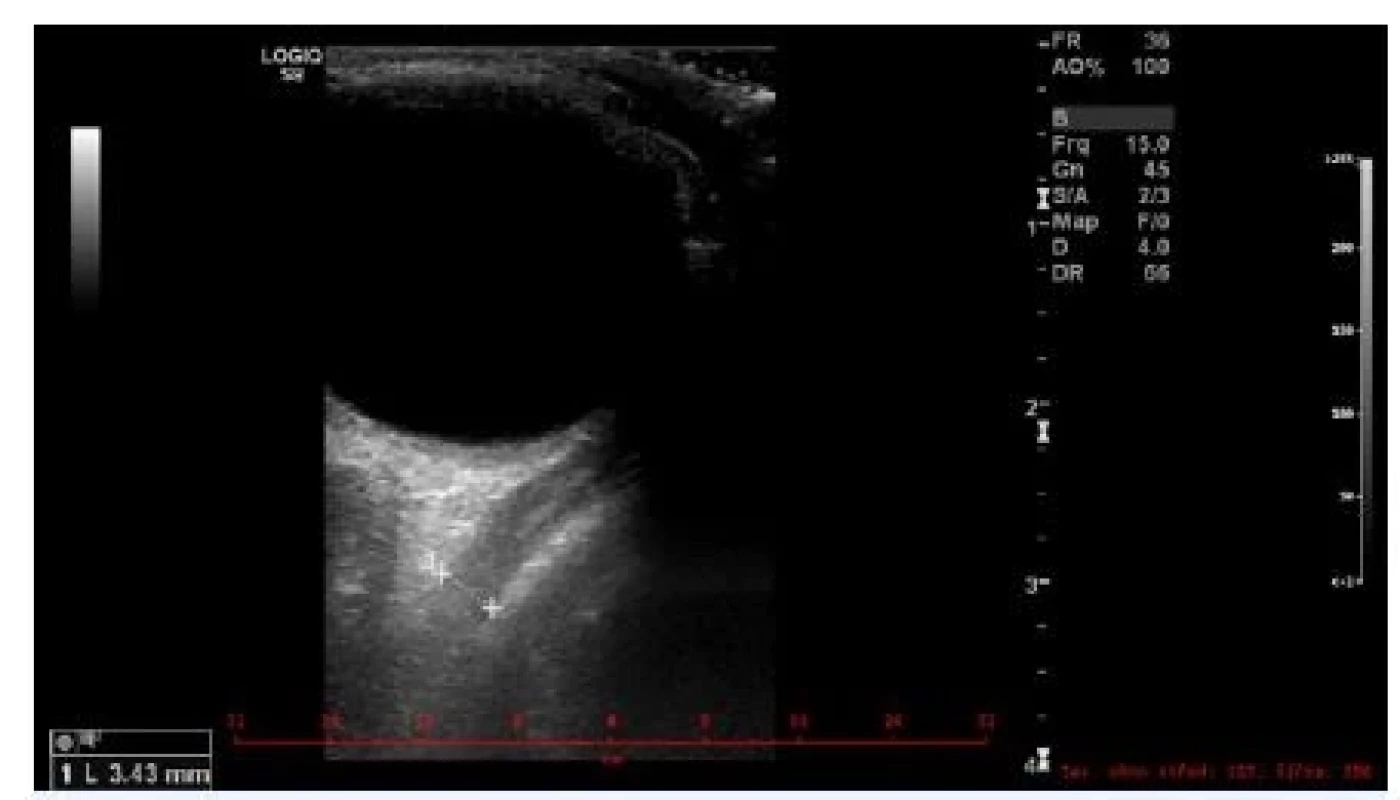
Obr. 2. Obraz aktivní myopatie se zánětlivě prosáklým a rozšířeným okohybným svalem na UZ 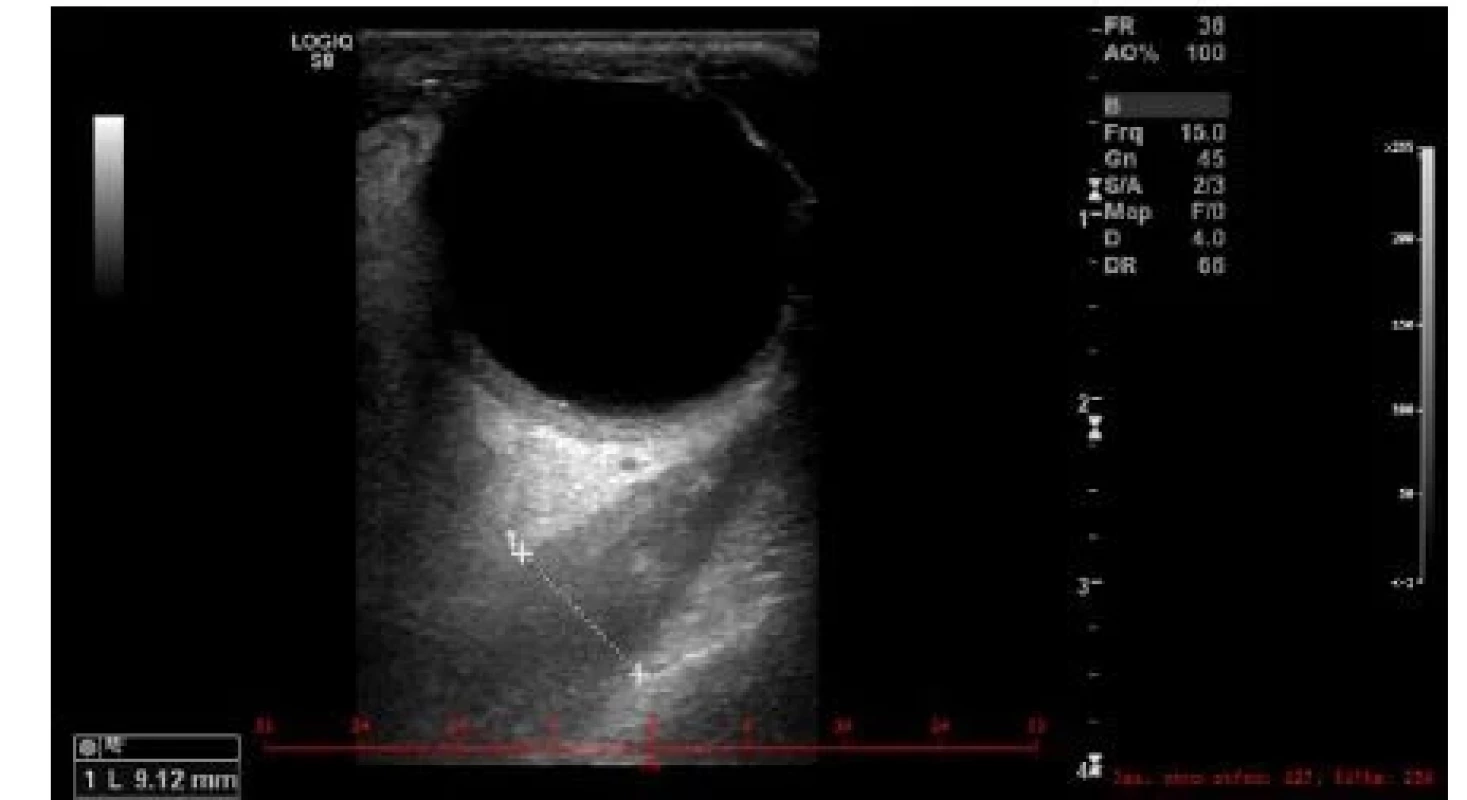
Obr. 3. Obraz fibrotizace okohybného svalu na UZ 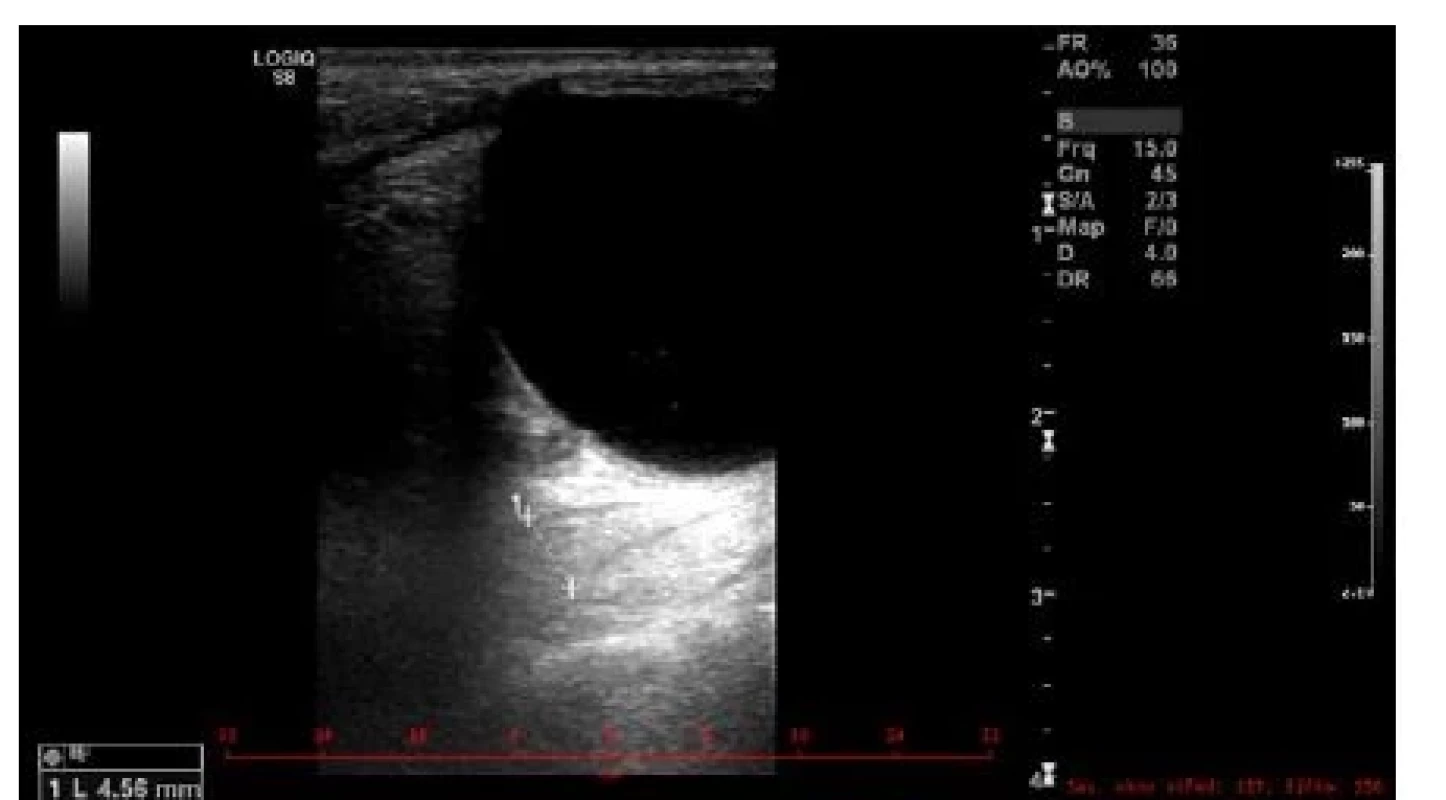
Obr. 4. Obraz rozšířených okohybných svalů na MRI 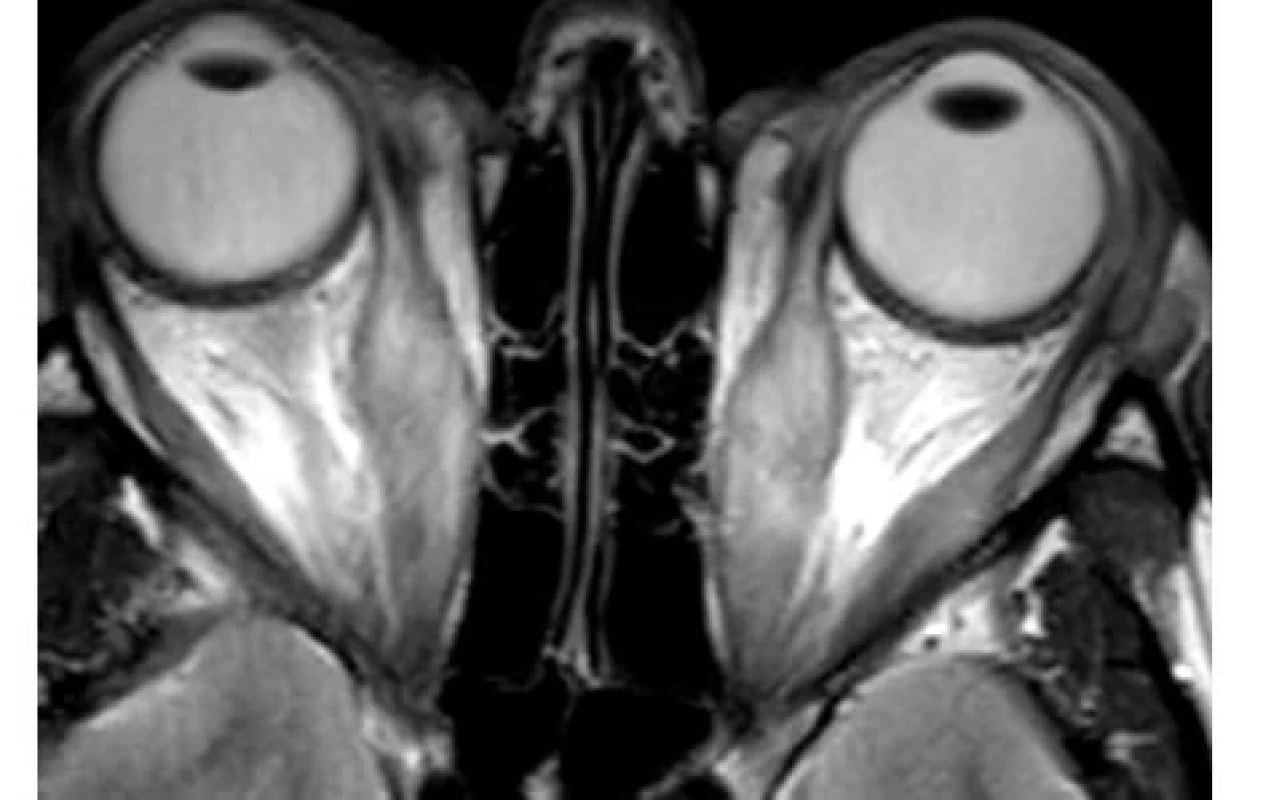
LÉČBA
Terapie EO vychází z doporučení EUGOGO 2008, 2016 a 2021 (4, 8, 9) a ATA 2011 a 2016 (15, 16) a závisí i na zvyklostech a na dosavadních zkušenostech pracoviště. Základní podmínky léčby jsou dobrá kontrola základního onemocnění a udržení normální tyreoidální funkce, intervence k zanechání kouření (viz dále), a včasné odeslání případů s aktivní střední až těžkou či zrak ohrožující EO do specializovaného centra.
U středně těžké až těžké aktivní EO by mělo být vyšetření ve specializovaném centru, pokud možno do 6 týdnů, u středně těžké až těžké neaktivní EO do 12 týdnů, u zrak ohrožující EO z důvodu ohrožení/postižení rohovky do 24 hodin a u zrak ohrožující EO z důvodu komprese zrakového nervu nebo (sub)luxace bulbu do týdne. Léčebné postupy jsou schematicky znázorněny na obr. 5 a 6.
Obr. 5. Léčebný postup u lehké a střední až těžké endokrinní orbitopatie 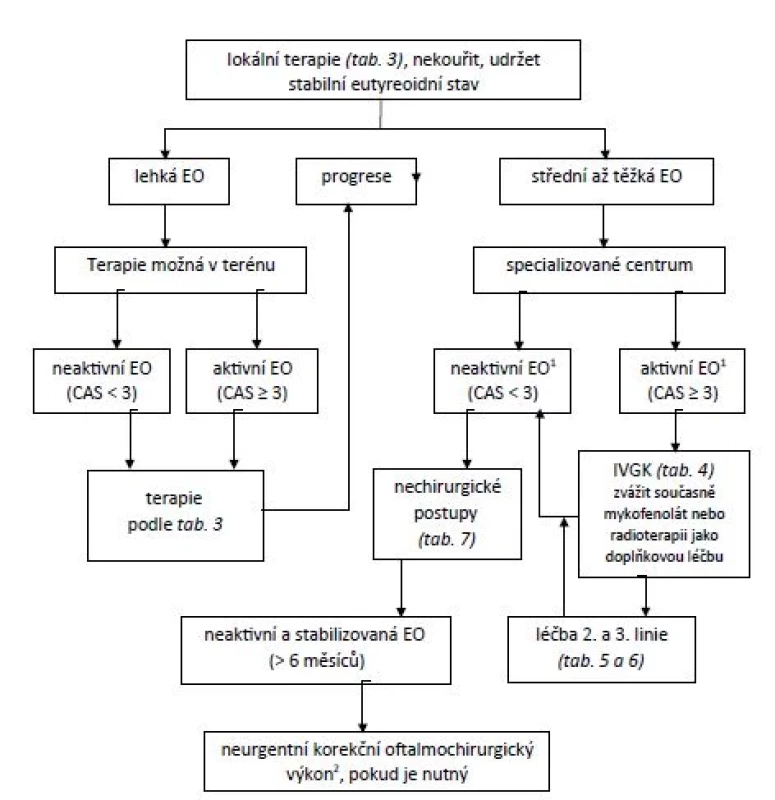
Pozn.:
1) K posouzení zánětlivé aktivity na okohybných svalech lze využít UZ nebo MRI.
2) Plastika/prodloužení očních víček, korekce strabismu a diplopie, eventuálně dekomprese z kosmetických důvodů.
EO – endokrinní orbitopatie; CAS – skóre klinické aktivity;
IVGK – intravenózní glukokortikoidy.Obr. 6. Léčebný postup u zrak ohrožující aktivní endokrinní orbitopatie 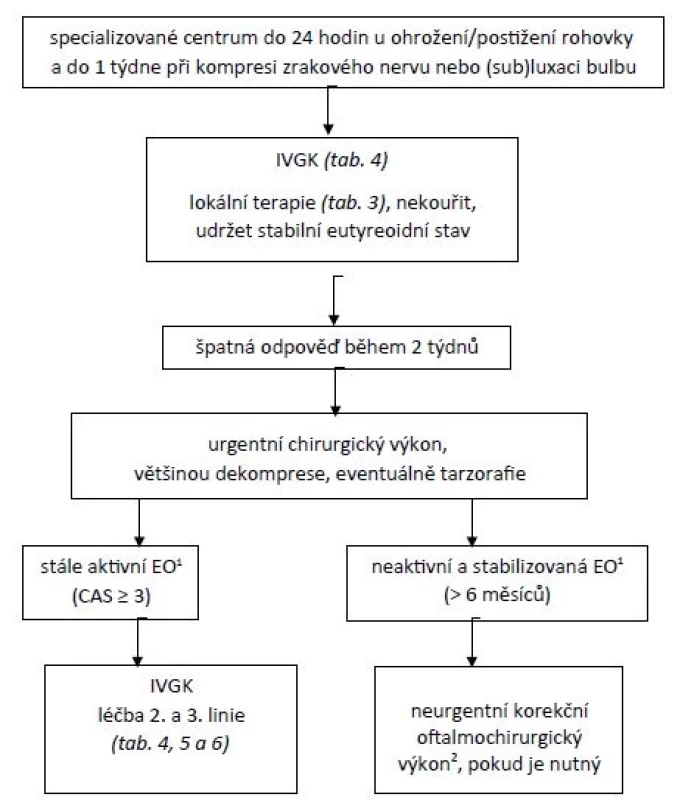
Pozn.:
1) K posouzení zánětlivé aktivity na okohybných svalech lze využít UZ nebo MRI.
2) Plastika/prodloužení očních víček, korekce strabismu a diplopie, eventuálně dekomprese z kosmetických důvodů.
EO – endokrinní orbitopatie; CAS – skóre klinické aktivity;
IVGK – intravenózní glukokortikoidy.Základní léčebné modality jsou:
- Lokální léčba k udržení vlhkého oka (lubrikanty – umělé slzy) (tab. 3).
- U lehké aktivní EO suplementace selenového deficitu (4, 9, 17) (tab. 3).
- U aktivní střední až těžké a zrak ohrožující orbitopatie systémová imunosuprese – v 1. linii intravenózní glukokortikoidy (IVGK) (tab. 4) a zvážit současné podávání mykofenolátu.
- U aktivní středně těžké až těžké myopatické formy zvážit zevní radioterapii (frakcionovaně, eventuálně ozáření Leksellovým gama nožem), jako doplňkovou léčbu k systémové imunosupresi, zejména je-li špatná nebo žádná reakce na léčbu.
- Léčba 2. linie (tab. 5 a 6) v případě žádné či špatné reakce nebo kontraindikace/intolerance IVGK (mykofenolát, rituximab, cyklosporin).
- Léčba 3. linie (tab. 5) v případě žádné či špatné reakce nebo kontraindikace/intolerance IVGK a léčby 2. linie (experimentální léčba, která se sice v minulosti zkoušela, avšak není podpořena dostatečnými důkazy a nelze ji rutinně doporučit).
- Urgentní chirurgická dekomprese, eventuálně tarzorafie u aktivní zrak ohrožující EO, která nereaguje na IVGK;
- Nechirurgická léčba (tab. 7) a event. korekční oftalmochirurgické výkony u neaktivní střední až těžké EO s významným vlivem na kvalitu života.
Tab. 3. Terapie lehké aktivní a neaktivní endokrinní orbitopatie v terénní ambulanci 
Tab. 4. Doporučení pro terapii intravenózními glukokortikoidy 
Pozn.: EO – endokrinní orbitopatie; p.o. – perorální podání. Tab. 5. Možnosti terapie 2. a 3. linie u aktivní střední až těžké EO ve specializovaném centru 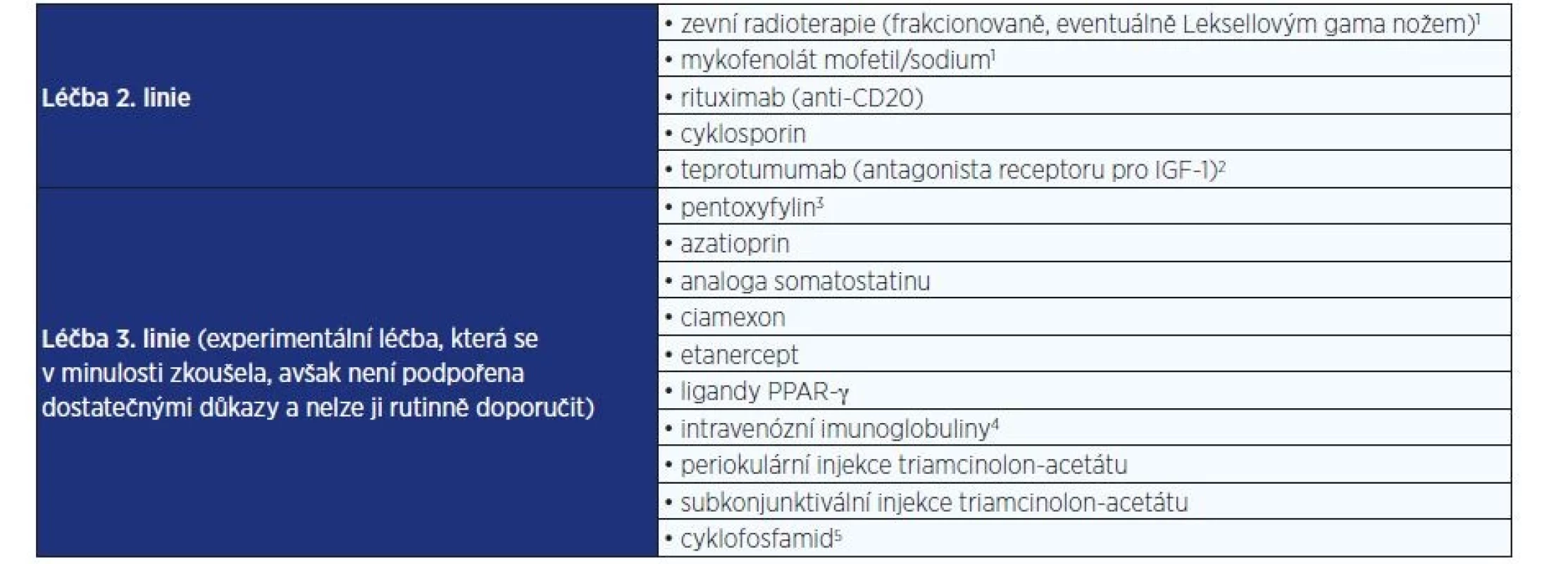
Pozn.:
1) Lze zvažovat i jako doplňkovou léčbu 1. linie.
2) V Evropě zatím není schválen.
3) V dávce 1200 mg denně po dobu 3–6 měsíců měl zlepšoval kvalitu života v jedné randomizované studii u neaktivní EO (39).
4) Nevýhodami oproti IVGK jsou vysoká cena a potenciální alergické reakce při srovnatelném efektu (40), zvažovanou indikací může být raritní potřeba léčby aktivní těžké EO v graviditě.
5) V minulosti byl v některých centrech používán pří selhání kortikoterapie, je zde ale riziko závažných nežádoucích účinků, použití u EO není podloženo důkazy a není součástí standardního postupu.
EO – endokrinní orbitopatie; IVGK – intravenózní glukokortikoidy.Tab. 6. Možnosti terapie 2. a 3. linie u aktivní střední až těžké EO ve specializovaném centru 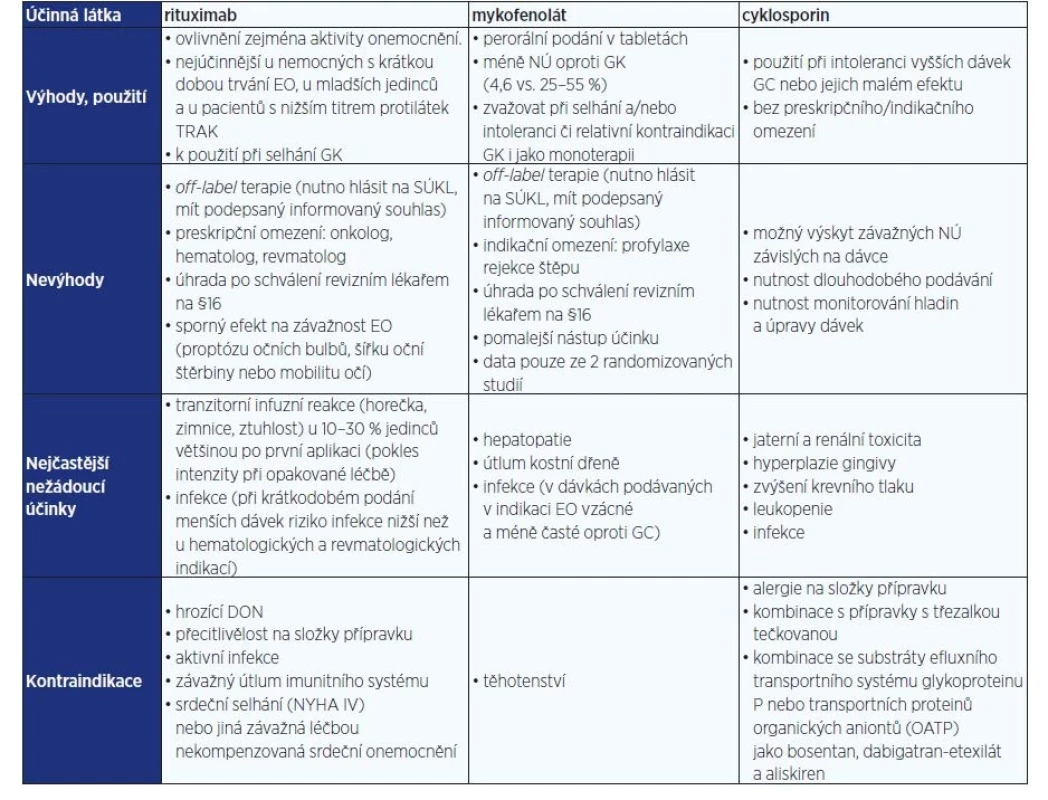
Tab. 7. Terapie neaktivní, minimálně středně těžké EO ve specializovaném centru (nechirurgické postupy) 
Intravenózní glukokortikoidy
Efekt glukokortikoidů a porovnání jejich perorálního (POGK) a pulzního intravenózního podávání (IVGK) byl v letech 1987–2009 hodnocen v 13 nerandomizovaných a 9 randomizovaných studiích celkem na 1844 pacientech. Lze shrnout, že většina studií ukázala, že IVGK mají ve srovnání s POGK lepší terapeutickou odpověď (80 % vs. 50 %) a méně nežádoucích účinků (43 vs. 73 %) a měly by tedy být první volbou u pacientů s aktivní střední až těžkou a zrak ohrožující EO (18).
Hlavní závažné nežádoucí účinky IVGK jsou hepatotoxicita závislá na kumulativní dávce (> 8 g metylprendisolonu) (4) a kardiovaskulární (KV) příhody, které jsou spíš závislé na způsobu podání než na kumulativní dávce. Byla popsána 2 úmrtí a 3 případy závažných KV příhod při podání 1,0 g 5 dní po sobě (19).
Závažné KV příhody se tedy vyskytly pouze při dávkách vyšších než 0,5 g metylprednisolonu při podávání denně nebo ob den). Celkem byla prevalence závažných nežádoucích účinků IVGK (hepatotoxicita a KV příhody) 6,5 % a mortalita 0,6 % (4 úmrtí na jaterní selhání, 1 na CMP a 1 na plicní embolii z 1045 studovaných pacientů) (18). EUGOGO tedy doporučuje nepřekračovat kumulativní dávku 8 g metylprednisolonu a nepodávat dávky vyšší než 0,5 g po sobě následující dny, s výjimkou zrak ohrožující endokrinní orbitopatie. Doporučení pro terapii IVGK jsou shrnuta v tab. 4.
Nesteroidní imunosupresiva
K dispozici máme studie, které ukázaly, že imunosupresivum mykofenolát má lepší efekt a méně nežádoucích účinků než POGK (mykofenolát mofetil) (20) a rovněž jeho přidání k terapii IVGK zlepšuje efekt a má minimum nežádoucích účinků (mykofenolát sodný) (21). Recentně byl publikován i dobrý efekt nízkých dávek POGK (prednisolon 5 mg denně) v kombinaci s mykofenolát mofetilem (2× 500 mg denně) (22).
Z tohoto důvodu se doporučuje zvážit podávání mykofenolátu v tabletách (mykofenolát mofetil dvakrát 500 mg denně nebo mykofenolát sodium 2× 360 mg denně) již v 1. linii současně s IVG po dobu 6 měsíců (9). Mykofenolát se také jeví jako zvlášť vhodná alternativa, pokud se po IVGK zvažuje pokračování v terapii perorálními glukokortikoidy. V Česku lze v této indikaci požádat dle paragrafu 16 o úhradu mykofenolát mofetilu v tabletách (2× 500 mg p.o. denně po dobu 6 měsíců) (tab. 6).
V případě intolerance/kontraindikace glukokortikoidů anebo jejich malém efektu, lze zvážit cyklosporin, jehož výhodou je, že nemá preskripční ani indikační omezení, nevýhodou je vyšší výskyt na dávce závislých nežádoucích účinků (jaterní a renální toxicita, hyperplazie gingivy, zvýšení krevního tlaku, leukopenie, infekce) ve srovnání s mykofenolátem a nutnost monitorování hladin a úprava dávek.
Biologická léčba
Již několik let je v léčbě 2. linie (není-li efekt, nebo je kontraindikace/intolerance IVGK) po schválení revizním lékařem k dispozici rituximab (protilátka proti CD20 lymfocytů), byť data na efektivitu léčby jsou částečně kontroverzní (23–26). Rituximab ovlivňuje zejména aktivitu onemocnění a nejúčinnější je u nemocných s krátkou dobou trvání EO, u mladších jedinců a u jedinců s nižším titrem protilátek TRAK. Byly však publikovány i studie, které efekt rituximabu neprokázaly, a dokonce byly popsány případy zhoršení DON (25). Proto je rituximab u přítomné nebo hrozí komprese zrakového nervu kontraindikován (10). Sporný je efekt rituximabu na závažnost EO (proptózu nebo mobilitu očí) (27).
Jeho hlavním nežádoucím účinkem je transitorní „infuzní“ reakce (horečka, zimnice, ztuhlost) u 10–30 % jedinců většinou po první aplikaci (její intenzita při opakované léčbě klesá). V poslední době byl prokázán dobrý efekt i dobrá tolerance při podávání menších dávek (tab. 6) (28–30). Při krátkodobém podání menších dávek je u EO zejména nižší riziko infekce než u hematologických a revmatologických indikací.
Recentně máme k dispozici dvě randomizované studie ze stejného pracoviště, které ukázaly dobrý efekt antagonisty receptoru pro IGF-1 teprotumumabu. V jedné byla popsána významná redukce proptózy a CAS (31) a v druhé zlepšení diplopie a kvality života (32). Ačkoliv zatím teprotumumab není v Evropě schválen, může představovat naději, jak ovlivnit již počínající fibrotizaci okohybných svalů a z toho rezultující diplopii.
Radioterapie
Radioterapie se nedoporučuje jako primární léčba u zrak ohrožující EO. Lze ji někdy zvažovat jako doplněk k IVGK či chirurgické dekompresi. Radioterapie měla dobrý efekt u střední až těžké aktivní EO, která se projevuje převážně diplopií a sníženou motilitou bulbů, když byla aplikovaná jako doplňková léčba k IVGK (33–36). Frakcionovaná kumulativní dávka 10 Gy v týdenních až dvoutýdenních intervalech měla stejný efekt a byla lépe tolerována než kumulativní dávka 20 Gy (37). Kontraindikací k radioterapii jsou pacienti <35 let, diabetická retinopatie a vaskulární retinopatie u těžké arteriální hypertenze.
Dosud byla publikována jedna práce, kde byl u pěti pacientů prokázán dobrý efekt a tolerance ozáření orbit Leksellovým gama nožem (38). Výhodou této metody je vedle dobré tolerance (jde o jednorázové ozáření) i možnost selektivního ozáření okohybných svalů nebo retrobulbárního tuku podle převažujícího postižení a minimální dávka aplikovaná na ostatní struktury oka. K ověření efektivity jsou však nutné další studie.
Chirurgická léčba
Chirurgická léčba EO zahrnuje akutní výkony při ohrožení zraku, kam patří urgentní dekomprese orbity při kompresi n. opticus (DON) a tarzorafie při ohrožení rohovky vysycháním při velké protruzi a lagoftalmu. U neaktivní a stabilní (≥6 měsíců) EO, s negativními protilátkami TRAK pak lze indikovat rehabilitační (korekční) oftalmochirurgické výkony (plastiku / prodloužení očních víček, korekci strabismu a diplopie, event. dekompresi z kosmetických důvodů).
Léčba hypertyreózy u pacientů s endokrinní orbitopatií
Dobrá kontrola základní choroby (většinou Gravesovy-Basedowovy, méně často autoimunitní hypotyreózy) a udržení stabilní normální tyreoidální funkce jsou podmínkou úspěšné léčby EO. U pacientů s EO se někdy doporučuje prodloužená doba podávání malých dávek tyreostatik až na čtyři roky jako prevence relapsů. Pokud se nepodaří dosáhnout rychle stabilizace základní choroby a navození farmakologické remise, je nutno přistoupit k některému z definitivních řešení choroby – totální tyreoidektomii či léčbě radiojodem 131I. Terapie radiojodem 131I se nedoporučuje u střední až těžké a zrak ohrožující aktivní EO (9, 15, 16). Strategie léčby Gravesovy-Basedowovy tyreotoxikózy u pacienta s endokrinní orbitopatií je popsána v tab. 8.
Tab. 8. Strategie léčby Gravesovy-Basedowovy tyreotoxikózy u pacienta s endokrinní orbitopatií 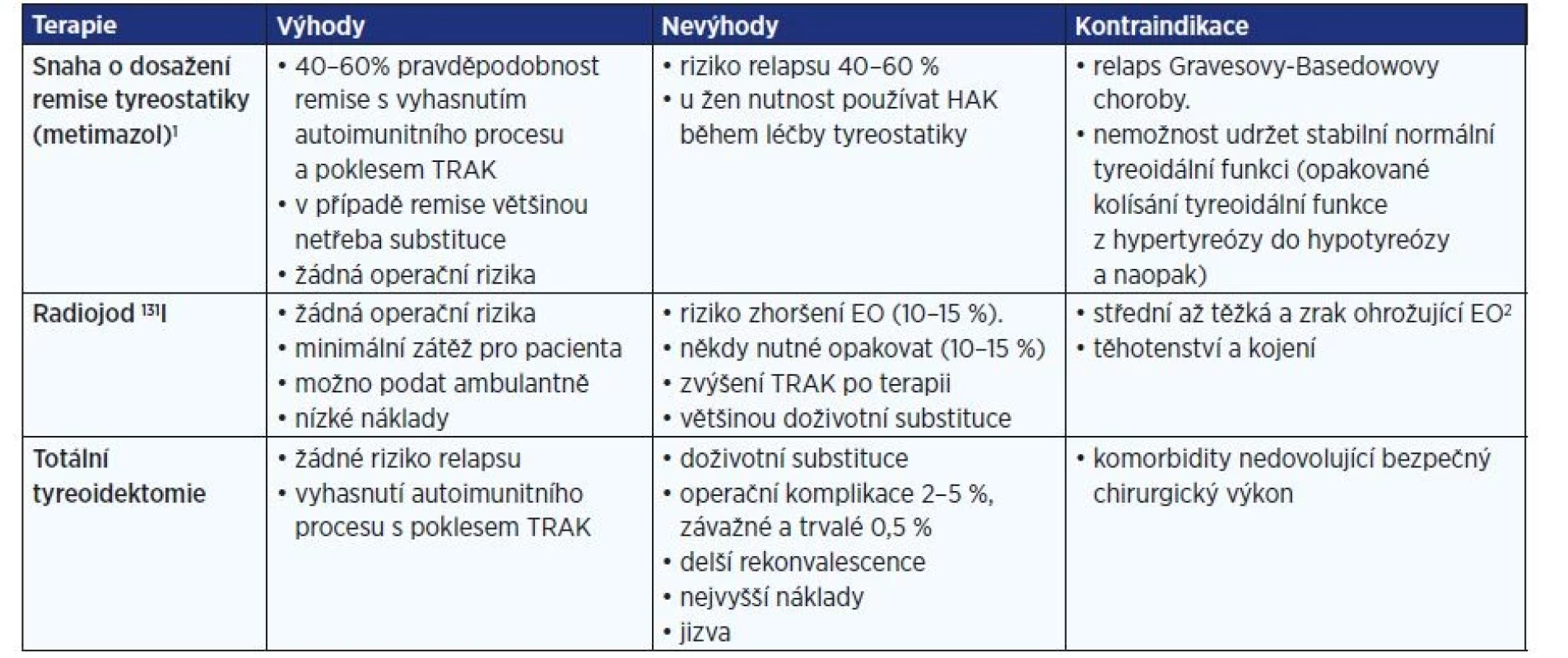
Pozn.:
1) Pokud je snaha o dosažení dlouhodobé remise tyreostatiky, doporučuje se před ukončením farmakoterapie vyšetřit protilátky TRAK, a pokud nedošlo k jejich negativizaci, pokračovat v terapii malými dávkami dalších 12–18 měsíců.
2) Léčba 131I není doporučena u pacientů se středně těžkou až těžkou nebo zrak ohrožující EO. U lehké aktivní EO lze v individuálních případech radiojod 131I použít a zajistit terapii preventivně glukokortikoidy, především u kuřáků (0,3–0,5 mg/kg prednisonu 1–2 dny po aplikaci radiojodu 131I na 4 týdny, pak postupné vysazení během 1–2 měsíců). Zajištění tyreoidektomie glukokortikoidy se rutinně nedoporučuje.KOUŘENÍ
Kouření je rizikovým faktorem vzniku EO a rozvoje její závažnější formy včetně DON. Kouření navíc zhoršuje a prodlužuje odpověď na léčbu, a to jak IVGK, tak radioterapii a zvyšuje riziko komplikací u jakýchkoli případných oftalmochirurgických zákroků (9). Je proto zcela nezbytné, aby u každého případu EO byla provedena intervence směřující k zanechání kouření a v těžších případech byl pacient i doporučen do poradny/centra pro odvykání kouření.
PREVENCE
Primární prevence vzniku EO při úrovni současných poznatků není možná. Pokud se uvažuje u Gravesovy-Basedowovy tyreotoxikózy s lehkou aktivní EO o terapii radiojodem 131I, doporučuje se zajištění glukokortikoidy, a to především u kuřáků (0,3–0,5 mg/kg prednisonu 1–3 dny po aplikaci radiojodu 131I na 4 týdny, pak postupné vysazení během 1–2 měsíců) (9). Zajištění tyreoidektomie glukokortikoidy se rutinně nedoporučuje, nicméně u pacientů s aktivní střední až těžkou nebo těžkou EO je vhodné dokončit terapii IVGK ještě před plánovanou operací.
Seznam použitých zkratek
CAS klinické skóre aktivity
CT výpočetní tomografie
DON dystyreózní neuropatie optického nervu
EO endokrinní orbitopatie
fT3 volný trijodtyronin
fT4 volný tyroxin
GBD Gravesova-Basedowova choroba
GM-CSF faktor stimulující kolonie granulocytů a makrofágů
IVGK nitrožilní kortikoterapie
KV kardiovaskulární
MRI magnetická rezonance
POGK perorální kortikoterapie
TGF-β transformující růstový faktor beta
TNF-α tumor nekrotizující faktor alfa
TRAK protilátka proti receptoru TSH
TSH tyreoideu stimulující hormon (tyreotropin)
UZ ultrasonografie
ADRESA PRO KORESPONDENCI:
doc. MUDr. Jan Jiskra, Ph.D.
3. interní klinika 1. LF UK a VFN
U Nemocnice 1, 128 08 Praha 2
Tel.: 224 962 919, 958
e-mail: jan.jiskra@lf1.cuni.cz
Zdroje
- Soeters MR, van Zeijl CJJ, Boelen A et al. Optimal management of graves orbitopathy: a multidisciplinary approach. Netherland J Med 2011; 69 : 302–308.
- Bahn RS. Graves’ ophthalmopathy. N Engl J Med 2010; 362 : 726–738.
- Forbes G, Gorman CA, Brennan MD et al. Ophthalmopathy of Graves’ disease: computerized volume measurements of the orbital fat and muscle. Am J Neuroradiol 1986; 7 : 651–656.
- Bartalena L, Baldeschi L, Boboridis K et al; European Group on Graves’ Orbitopathy (EUGOGO). The 2016 European Thyroid Association/European Group on Graves' Orbitopathy Guidelines for the Management of Graves’ Orbitopathy. Eur Thyroid J 2016; 5 : 9–26.
- Lipman LM, Green DE, Snyder NJ et al. Relationship of long-acting thyroid stimulator to the clinical features and course of Graves’ disease. Am J Med 1967; 43 : 486–498.
- Gerding MN, van der Meer JW, Broenink M et al. Association of thyrotrophin receptor antibodies with the clinical features of Graves’ ophthalmopathy. Clin Endocrinol (Oxf) 2000; 52 : 267–271.
- Eckstein AK, Plicht M, Lax H et al. Thyrotropin receptor autoantibodies are independent risk factors for Graves’ ophthalmopathy and help to predict severity and outcome of the disease. J Clin Endocrinol Metab 2006, 91 : 3464–3470.
- Bartalena L, Baldeschi L, Dickinson A et al.; European Group on Graves’ Orbitopathy (EUGOGO). Consensus statement of the European Group on Graves’ orbitopathy (EUGOGO) on management of GO. Eur J Endocrinol 2008; 158 : 273–285.
- Bartalena L, Kahaly GJ, Baldeschi L et al.; EUGOGO. The 2021 European Group on Graves’ orbitopathy (EUGOGO) clinical practice guidelines for the medical management of Graves’ orbitopathy. Eur J Endocrinol 2021; 185: G43–G67.
- Jiskra J, Gabalec F, Diblík P a kol. Doporučený postup pro diagnostiku a léčbu endokrinní orbitopatie – novelizace 3/2022. Česká endokrinologická společnost, 2022. Dostupné na: www.endokrinologie.cz/cs/doporuceny-postup-pro-diagnostiku-a-lecbu-endokrinni-orbitopatie
- Mourits MP, Koornneef L, Wiersinga WM et al. Clinical criteria for the assessment of disease activity in Graves’ ophthalmopathy: a novel approach. Br J Ophthalmol 1989; 73 : 639–644.
- Werner SC. Modification of the classification of the eye changes of Grave’s disease. Am J Ophthalmol 1977; 83 : 725–7257.
- Česká endokrinologická společnost ČLS JEP. Dotazník kvality života pacientů s endokrinní orbitopatií. Dostupné na: www.endokrinologie.cz/cs/dotaznik-kvality-zivota-pacientu-s-endokrinni-orbitopatii
- Česká endokrinologická společnost ČLS JEP. Endokrinní orbitopatie – informační materiál pro endokrinology. Dostupné na: www.endokrinologie.cz/cs/endokrinni-orbitopatie-informacni-material-pro-endokrinology
- Bahn Chair RS, Burch HB, Cooper DS et al.; American Thyroid Association; American Association of Clinical Endocrinologists. Hyperthyroidism and other causes of thyrotoxicosis: management guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists. Thyroid 2011; 21 : 593–646.
- Ross DS, Burch HB, Cooper DS et al. 2016 American Thyroid Association Guidelines for Diagnosis and Management of Hyperthyroidism and Other Causes of Thyrotoxicosis. Thyroid 2016; 26 : 1343–1421.
- Marcocci C, Kahaly GJ, Krassas GE et al.; European Group on Graves’ Orbitopathy. Selenium and the course of mild Graves’ orbitopathy. N Engl J Med 2011; 364 : 1920–1931.
- Zang S, Ponto KA, Kahaly GJ. Intravenous glucocorticoids for Graves’ orbitopathy: efficacy and morbidity. J Clin Endocrinol Metab 2011; 96 : 320–332.
- Lendorf ME, Rasmussen AK, Fledelius HC, Feldt-Rasmussen U. Cardiovascular and cerebrovascular events in temporal relationship to intravenous glucocorticoid pulse therapy in patients with severe endocrine ophthalmopathy. Thyroid 2009; 19 : 1431–1432.
- Ye X, Bo X, Hu X et al. Efficacy and safety of mycophenolate mofetil in patients with active moderate-to-severe Graves’ orbitopathy. Clin Endocrinol (Oxf) 2017; 86 : 247–255.
- Kahaly GJ, Riedl M, König J et al.; European Group on Graves’ Orbitopathy (EUGOGO). Mycophenolate plus methylprednisolone versus methylprednisolone alone in active, moderate-to-severe Graves' orbitopathy (MINGO): a randomised, observer-masked, multicentre trial. Lancet Diabetes Endocrinol 2018; 6 : 287–298.
- Rajabi MT, Rafizadeh SM, Mohammadi A et al. Mycophenolate mofetil (CellCept®) in combination with low dose prednisolone in moderate to severe Graves’ orbitopathy. Front Med (Lausanne) 2022; 9 : 788228.
- Salvi M, Vannucchi G, Campi I et al. Treatment of Graves’ disease and associated ophthalmopathy with the anti-CD20 monoclonal antibody rituximab: an open study. Eur J Endocrinol 2007; 156 : 33–40.
- Khanna D, Chong KK, Afifiyan NF et al. Rituximab treatment of patients with severe, corticosteroid-resistant thyroid-associated ophthalmopathy. Ophthalmology 2010; 117 : 133–139.
- Stan MN, Salvi M. Rituximab therapy for Graves’ orbitopathy – lessons from randomized control trials. Eur J Endocrinol 2017; 176: R101–R109.
- Shen WC, Lee CH, Loh EW et al. Efficacy and safety of rituximab for the treatment of Graves’ orbitopathy: A meta-analysis of randomized controlled trials. Pharmacotherapy 2018; 38 : 503–510.
- Wang C, Ning Q, Jin K et al. Does rituximab improve clinical outcomes of patients with thyroid-associated ophthalmopathy? A systematic review and meta-analysis. BMC Ophthalmol 2018; 18 : 46.
- Salvi M, Vannucchi G, Currò N et al. Small dose of rituximab for graves orbitopathy: new insights into the mechanism of action. Arch Ophthalmol 2012; 130 : 122–114.
- Karásek D, Cibíčková L, Karhanová M et al. Clinical and immunological changes in patients with active moderate-to-severe Graves' orbitopathy treated with very low-dose rituximab. Endokrynol Pol 2017; 68 : 498–504.
- Insull EA, Sipkova Z, David J et al. Early low-dose rituximab for active thyroid eye disease: An effective and well-tolerated treatment. Clin Endocrinol (Oxf) 2019; 91 : 179–186.
- Smith TJ, Kahaly GJ, Ezra DG et al. Teprotumumab for thyroid-associated ophthalmopathy. N Engl J Med 2017; 376 : 1748–1761.
- Douglas RS, Kahaly GJ, Patel A et al. Teprotumumab for the treatment of active thyroid eye disease. N Engl J Med 2020; 382 : 341–352.
- Mourits MP, van Kempen-Harteveld ML, Garcia MB et al. Radiotherapy for Graves’ orbitopathy: randomised placebo-controlled study. Lancet 2000; 355 : 1505–1509.
- Prummel MF, Terwee CB, Gerding MN et al. A randomized controlled trial of orbital radiotherapy versus sham irradiation in patients with mild Graves’ ophthalmopathy. J Clin Endocrinol Metab 2004; 89 : 15–20.
- Kim JW, Han SH, Son BJ et al. Efficacy of combined orbital radiation and systemic steroids in the management of Graves' orbitopathy. Graefes Arch Clin Exp Ophthalmol 2016; 254 : 991–998.
- Oeverhaus M, Witteler T, Lax H et al. Combination therapy of intravenous steroids and orbital irradiation is more effective than intravenous steroids alone in patients with Graves' orbitopathy. Horm Metab Res 2017; 49 : 739–747.
- Kahaly GJ, Rosler HP, Pitz S, Hommel G. Low - versus high-dose radiotherapy for Graves’ ophthalmopathy: a randomized, single blind trial. J Clin Endocrinol Metab 2000; 85 : 102–108.
- Antico JC, Crovetto L, Tenca E, Artes C. Initial experience with gamma knife surgery for endocrine ophthalmopathy. J Neurosurg 2005; 102 (Suppl.): 272–275.
- Finamor FE, Martins JR, Nakanami D et al. Pentoxifylline (PTX) – an alternative treatment in Graves’ ophthalmopathy (inactive phase): assessment by a disease specific quality of life questionnaire and by exophthalmometry in a prospective randomized trial. Eur J Ophthalmol 2004; 14 : 277–283.
- Antonelli A, Saracino A, Alberti B et al. Highose intravenous immunoglobulin treatment in Graves’ ophthalmopathy. Acta Endocrinol (Copenh) 1992; 126 : 13–23.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek ÚVODEMČlánek Obezita a štítná žláza
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- ÚVODEM
- 125 let od narození profesora Josefa Charváta
- Josef Charvát, pamětník a komentátor své doby
- Profesor Josef Charvát a informatika
- Svačina Š. O době minulé i dnešní
- Obezita a štítná žláza
- Diagnostika a terapie endokrinní orbitopatie – update 2022
- Význam molekulární pitvy v soudním lékařství
- Hippokratova Přísaha a současné lékařské sponze
- 70 let prof. MUDr. Štěpána Svačiny, DrSc., MBA
- Zemřel profesor Miroslav Zeman
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hippokratova Přísaha a současné lékařské sponze
- Diagnostika a terapie endokrinní orbitopatie – update 2022
- 125 let od narození profesora Josefa Charváta
- Obezita a štítná žláza
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



