-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Výšková nemoc
Mountain sickness
Mountaineering brings many health risks, one of which is mountain sickness. Its mildest form - acute mountain sickness – is mainly characterized by subjective symptoms (headache, loss of appetite, insomnia, weakness, nausea and rarely also vomiting). Advanced and life-threatening forms are characterized by tissue edema – cerebral or pulmonary high altitude edema. The common denominator of these acute forms is the low oxygen tension leading to hypoxemia and tissue ischemia. Sum of maladaptive or adaptive processes can modify the clinical picture. Underlying mechanisms of the chronic forms of pulmonary disease are the adaptation processes – pulmonary hypertension and polycythemia leading to heart failure.
The only causal therapeutic intervention is to restore adequate oxygen tension, descend to lower altitudes or oxygen therapy. Pharmacotherapy has only a supportive effect. The prophylaxis includes stimulation of the respiratory center by carbonic anhydrase inhibitors (acetazolamide) antiedematous treatment with glucocorticoids (dexamethasone), increase lymphatic drainage of the lungs and brain by β2-agonists (salmeterol) or mitigation of pulmonary hypertension by calcium channel blockers or phosphodiesterase-5 inhibitors (sildenafil or tadalafil).Keywords:
acute mountain sickness – high-altitude pulmonary edema – high-altitude cerebral edema – pathophysiology – clinical picture – treatment
Autoři: Jan Bultas
Působiště autorů: Ústav farmakologie 3. LF UK, Praha
Vyšlo v časopise: Čas. Lék. čes. 2015; 154: 280-286
Kategorie: Přehledový článek
Souhrn
Vysokohorská turistika přináší řadu zdravotních rizik, jedním z nich je výšková nemoc. Její nejmírnější forma – akutní výšková nemoc – je charakterizována zejména subjektivními potížemi (bolestí hlavy, nechutenstvím, nespavostí, slabostí, vzácněji nauzeou a zvracením). Pokročilejší a život ohrožující formy jsou charakterizovány edémem tkání – mozkovým či plicním výškovým edémem. Společným jmenovatelem těchto akutních forem je nízká tenze kyslíku vedoucí k hypoxemii a tkáňové ischemii. Souhrn adaptačních a maladaptačních pochodů pak modifikuje klinický obraz. Podkladem chronické formy plicní nemoci jsou právě ony adaptační mechanismy – plicní hypertenze a polycytemie vedoucí k srdečnímu selhání.
Jediným kauzálním léčebným zásahem je obnovení dostatečné tenze kyslíku, sestupem do nižších poloh či oxygenoterapií. Farmakoterapie má jen podpůrný účinek. K profylaktickým zásahům patří stimulace dechového centra inhibitory karboanhydrázy (acetazolamid), anti-edematózní léčba glukokortikoidy (dexametazon), zvýšení lymfatické drenáže plic a mozku β2-sympatomimetiky (salmeterolem) či mitigace plicní hypertenze blokátory kalciového kanálu nebo inhibitory fosfodiesterázy 5 (sildenafil či tadalafil).Klíčová slova:
akutní výšková nemoc – výškový plicní edém – výškový mozkový edém – patofyziologie – klinický obraz – léčbaÚVOD
Rozmach turistiky a ztráta respektu z vysokohorského prostředí přináší řadu komplikací. Jednou z nich může být výšková (vysokohorská) nemoc. Mírná forma, která při rychlém vystavení pobytu ve výšce nad 4000 m n. m. postihne asi třetinu mužů a dvě třetiny žen, je akutní výšková nemoc. Tato forma se projevuje bolestmi hlavy, nevolností, nechutenstvím a nespavostí. Většinou po krátké aklimatizaci bez následků odezní. Daleko závažnějšími projevy, které se objevují u 10–25 % osob pobývajících ve výšce kolem 5000 m n. m., jsou plicní a mozkový edém. Tyto stavy již nemocného akutně ohrožují na životě a vyžadují rychlý přesun do nižších poloh či léčbu kyslíkem a lékařskou péči. Vzhledem k tomu, že stále více lidí navštěvuje velehory, často málo zkušených, stává se prevence, diagnostika a léčba těchto stavů aktuálnější.
VÝSKYT VÝŠKOVÉ NEMOCI
Při rekreačním pobytu v horách je dokumentován výskyt akutní mírné formy výškové nemoci, jako je bolest hlavy, nespavost, nechutenství či nauzea u 5–10 % osob při pobytu ve výšce 2500–3000 m n. m., u 20–40 % ve výšce 3000–3500 m n. m. a ve výšce nad 4000 m n. m. je již postižena asi polovina cestovatelů. Závažnější stav, jakým je výškový plicní edém se objevuje v prostředí nad 4000 m n. m. v 10–15 % a mírná až těžká forma mozkového edému v 15–25 % (1, 2). Riziko úmrtí na výškovou nemoc je při pobytu do 5000 m n. m. relativně vzácné, u horolezců, kteří zdolávají sedmi - či osmitisícovky, je však riziko úmrtí na plicní či mozkový edém nesrovnatelně vyšší. Podle statistiky z Himalájí se u horolezců pohybujících se nad 6000 m n. m. mortalita pohybovala lehce nad 1 %, plicní či mozkový edém byl příčinou úmrtí téměř v polovině případů. Navíc letargie, desorientace se špatným odhadem situace, spolu s poruchou motorických funkcí na podkladě výškové nemoci významně přispívá ke zvýšené nehodovosti a zvyšuje riziko prochladnutí a hypotermie (3–5).
RIZIKOVÉ FAKTORY VZNIKU VÝŠKOVÉ NEMOCI
Tolerance nadmořských výšek od 3000 m je velmi individuální a nesouvisí příliš s fyzickou kondicí. Spíše je ovlivněna věkem, pohlavím, individuální vnímavostí, stupněm fyzické zátěže a samozřejmě kvalitou aklimatizace.
Zatímco mírné formy akutní výškové nemoci se vyskytují stejně často u adolescentů jako u dospělých, incidence u žen je asi o polovinu větší než u mužů. Jinak je tomu u závažnějších forem, tj. u plicního či mozkového edému. Plicní edém se vyskytuje převážně u osob mladších, se stoupajícím věkem náchylnost k edému klesá. Rizikovými faktory plicního či mozkového edému jsou vedle zmíněného věku predisponující plicní onemocnění, kouření, obezita, větší fyzická aktivita a rychlost dosažení vyšší nadmořské výšky. Kouření se uplatní jak vyšší prevalencí strukturálního plicního postižení, tak akutním poškozením endotelu tabákovým kouřem. S každou desítkou aktuálně vykouřených cigaret výskyt plicního edému stoupá o 90 %, tedy riziko kuřáka 20 cigaret je čtyřnásobné (6). Fyzická netrénovanost má obdobný efekt. Významným negativním faktorem je též spaní ve výškách, platí stará zásada „lez výše, spi níže“. Zde zřejmě hraje roli prohloubení hypoxemie při běžně se objevujících poruchách ventilace Cheyneova-Stokesova typu dýchání (na podkladě hypoxie dechového centra).
Vnímavost k působení hypoxie se mění i v průběhu času, tak například u horolezců se setkáváme s plicním edémem paradoxně v polohách, které byly při předchozích expedicích dobře tolerovány. Nelze tedy říci, že když jsme neměli problémy v určité výšce jednou, že je nebudeme mít ani podruhé.
Na rozdílech v individuální vnímavosti se podílejí i genetické vlivy. K hypoxickému poškození cévní stěny přispívá řada faktorů, často faktorů výrazně polymorfních. Příkladem je hypoxia-inducible factor-1α (HIF-1α) či vascular endothelial growth factor (VEGF). Jak ukázala genetická analýza čínských dělníků vystavených v Tibetu práci ve výškách nad 4000 m n. m., výskyt plicního či mozkového edému byl v těsném vztahu k několika polymorfismům těchto dvou faktorů kontrolujících jejich regulaci, zvyšujících jejich nabídku a vedoucí k poškození bazální membrány cév (7). Tedy adaptační mechanismy, které pomáhají organismu čelit hypoxickému poškození, nefungovaly. U populací neuzpůsobených práci ve vysokohorském prostředí byly tyto „nevýhodné“ polymorfismy časté, naopak u Tibeťanů je selekční tlak téměř vymýtil.
Pobyt ve vyšších výškách zvyšuje riziko také u kardiaků: Hypoxie vedoucí ke tkáňové ischemii zvyšuje riziko arytmií a zvýšená trombotická pohotovost potencuje riziko koronární či mozkové příhody. Tento typ příhod má na svědomí až třetinu úmrtí, se kterými se setkáváme při rekreačním pobytu ve středních výškách, tj. kolem 3000–4000 m n. m., např. při alpském lyžování.
PATOFYZIOLOGICKÝ MECHANISMUS VZNIKU VÝŠKOVÉ NEMOCI A VÝZNAM ADAPTACE
Společným jmenovatelem všech stavů spojených s výškovou nemocí je nízký obsah kyslíku ve vdechovaném vzduchu. Pokles přívodu kyslíku vede ke tkáňové hypoxii, neboli nízkému tlaku kyslíku, rozhodující je tlak na mitochondriálních membránách. Ve výšce kolem 5000 m n. m. je totiž parciální tlak kyslíku (pO2) poloviční a ve výšce vrcholu Mont Everestu je tlak třetinový. To vede k poklesu pO2 v tepenné krvi (hypoxemii) a nízké saturaci tkání kyslíkem.
Adaptační mechanismy
Organismus je schopen se ve velké míře na hypoxii adaptovat. Některé adaptační reakce mohou být aktivovány ihned, jiné vyžadují několik dnů na jejich zapojení.
Akutně příznivě působí zejména tachypnoe a hyperventilace, což zvyšuje alveolární ventilaci a relativně dlouho udrží uspokojivé podmínky pro saturaci krve kyslíkem. Rychle je aktivován též druhý významný aklimatizační pochod, kterým jsou metabolické změny – zejména vývoj respirační alkalózy a stimulace glykolýzy. Příčinou alkalózy je hypokapnie navozená hyperventilací. Vzestup pH krve posouvá disociační křivku hemoglobinu doleva, což umožní větší saturaci erytrocytů při nízkém parciálním tlaku kyslíku. Podobně posouvá disociaci zvýšená nabídka 2,3-difosfoglycerolu, jehož koncentrace při hypoxii významně stoupá (8). Preference glykolýzy nad β-oxidací mastných kyselin je při hypoxemii energeticky výhodnější, ve fázi anaerobní glykolýzy totiž získáváme asi 15 % makroergního ATP bez spotřeby kyslíku. Vzhledem k přesunu metabolismu na glykolýzu je ve vysokohorském prostředí výhodná strava bohatá na glycidy, toto staré pravidlo má racionální podklad (9).
Další důležitou adaptací (či v některých případech spíše maladaptací), je vzestup koncentrace hemoglobinu v krvi na hodnoty kolem 200 g/l. Vzhledem k pomalému vývoji polycytemie má tento mechanismus pro krátkodobý pobyt malý význam. Z přístupu patofyziologického i klinického je vzestup hemoglobinu problematickým adaptačním mechanismem. Podkladem výškové nemoci není snížená transportní kapacita krve, ale nízký parciální tlak kyslíku na úrovni alveolární membrány.
Nabídku kyslíku na alveolokapilárních membránách zvýší hyperventilace, snadnější vazbu kyslíku na hemoglobin usnadní metabolické změny. Úloha vzestupu hemoglobinu v krvi je však problematická. Zvýšení koncentrace hemoglobinu sice zlepší transportní kapacitu krve pro kyslík, ta však nutně zůstává nevyužita, neboť saturace hemoglobinu při hypoxii významně klesá, je limitována nízkým parciálním tlakem kyslíku (10–12).
Hemokoncentrace se může uplatnit negativně zvýšením viskozity krve, což zhoršuje reologické podmínky na úrovni mikrocirkulace a zvyšuje trombogenní pohotovost krve. Z fyziologického pohledu je vzestup koncentrace hemoglobinu ve vysoké nadmořské výšce maladaptačním procesem. U obyvatelů And a Tibetu vede chronická polycytemie a hyperviskozita, spolu s plicní vazokonstrikcí, k chronické plicní hypertenzi a pravostrannému srdečnímu selhání – stavu označovanému jako chronická horská nemoc.
V etiopatogenezi plicního a mozkového edému hraje dominantní úlohu odpověď rezistenčních arteriol a prekapilárních sfinkterů na nízký parciální tlak kyslíku. Na hypoxii a hypoxemii odpovídá jinak plicní a jinak systémový oběh.
Reakce plicního řečiště
V plicním řečišti vede nízký parciální tlak kyslíku k vazokonstrikci plicních arteriol a k výrazné akutní plicní hypertenzi. Tato prekapilární plicní hypertenze na podkladě hypoxické vazokonstrikce plicních arteriol je velmi výrazná, tlaky v plicnici dosahují hodnot výrazně nad 50 mm Hg. Plicní vazokonstrikce je v případě reakce na nízký parciální tlak kyslíku další typickou maladaptační reakcí. Nicméně, je-li již prekapilární hypertenze přítomna, pak chrání kapilární řečiště před nadměrným hydrostatickým tlakem a před plicním edémem. Bohužel vazokonstrikce není trvalá a jednotlivé okrsky plic se v chování liší. Paralelně totiž – díky hyperventilaci – klesá parciální tlak CO2 a výsledná hypokapnie přispívá k paralýze autoregulace na úrovni plicních arteriol. Tkáňová ischemie vede k lokálnímu vyplavení řady působků s vazokonstrikční nebo naopak s vazodilatační aktivitou, jako jsou tromboxan A2, natriuretický peptid A i B, endotelin-1 či oxid dusnatý (13). Takto se setkáváme s oblastmi plic, v nichž převažuje vazokonstrikce, a plicní kapiláry jsou tak před nežádoucím vzestupem hydrostatického tlaku částečně chráněny, a s okrsky, kdy paralýza plicních arteriol umožní plicní hypertenzi působit přímo na úrovni vlásečnic. Plicní kapiláry jsou vystaveny významné plicní hypertenzi a na základě Starlingových sil dochází k nadměrné transudaci plazmy a později i erytrocytů do plicního intersticia s vývojem nekardiogenního plicního edému. Vedle zvýšení kapilárního tlaku se etiopatogeneticky podílí i narušená integrita endoteliální bariéry při hypertenzi a snížený odtok tkáňové tekutiny lymfatickými cestami. Tkáňová hypoxie s deplecí makroergních fosfátů totiž navodí dysfunkci Na/K ATPázy, aktivní pumpy udržující drenáž tekutin z alveolárního prostoru do lymfatických cest. S hromaděním tekutiny v plicních sklípcích se objevuje edém alveolární a zhoršuje se přestup kyslíku k plicním kapilárám. Pro praxi a léčbu je důležité, že Na/K ATPáza je pod kontrolou adrenergních receptorů β2 a může být stimulována betamimetiky. Vývojem alveolokapilární blokády se uzavírá circulus vitiosus, kdy progresivní zhoršení poměrů výměny krevních plynů dále hypoxemii kriticky prohlubuje (4–12).
Pro vznik nekardiálního plicního výškového edému pak máme několik faktorů, na které můžeme cílit naši léčbu. Samozřejmě primárním etiopatogenetickým momentem je hypoxemie vedoucí k hemodynamické a humorální odpovědi. K této odpovědi patří generalizovaná vazokonstrikce plicních arteriol při hypoxemii, vedoucí k plicní hypertenzi i lokální vazodilatace při hypokapnii a uvolnění lokálních vazoaktivních působků umožňující hypertenzi působit až na úrovni plicních kapilár. Zvýšení intrakapilárního tlaku přispívá k plicnímu edému. Je nutné zdůraznit, že oba typy reakcí působí v plicích současně. Kdyby nebylo plicní hypertenze, vlastní lokální vazodilatace by nebyla tolik na závadu. Proto se zdánlivě paradoxně snažíme vývoji plicní hypertenze farmakologicky zabránit (např. blokátory fosfodiesterázy-5).
Třetím ovlivnitelným faktorem je dysfunkce endotelu umožňující zvýšený přestup tekutiny do intersticia a alveolárního prostoru a konečně posledním je zlepšení drenáže alveolární tekutiny. Při zvažování optimální strategie léčby musíme brát v úvahu i jednotlivé fáze plicního postižení. Léčebným cílem se tak stává úprava hypoxemie, plicní cévní rezistence, funkce endotelu a drenáže intersticiální tekutiny.
Reakce systémové cirkulace
Poněkud odlišně se chová systémová cirkulace. Hypoxemie navodí v mimoplicních tkáních výraznou arteriolodilataci, rezultující zvýšení tlaku na úrovni kapilár vede k následnému přesunu plazmy do intersticia, tedy obdobné reakci, kterou vídáme např. při léčbě blokátory kalciového kanálu. Edém tkání je nejvyšší v místech vystavených i vyššímu hydrostatickému tlaku, tj. na dolních končetinách. Výsledná hypovolemie v cévním řečišti musí být hrazena zvýšeným příjmem tekutin, jinak hrozí intravaskulární hypovolemie se zhroucením cirkulace.
Reakce mozkové cirkulace
V etiopatogenezi mozkového edému se uplatní zejména hypoxemie a regulační mechanismy, které modifikují obraz. V akutní odpovědi se uplatní hypoxická cerebrální vazodilatace, hypokapnická cerebrální vazokonstrikce, hypoxická a hyperkapnická hyperventilace, která hypokapnii a hypoxii upravuje.
Hypoxemie ve velkých tepnách navodí vazodilataci (často se projevující prodromálními bolestmi hlavy), v menších arteriolách naopak hypokapnie a respirační alkalóza navodí vazokonstrikci. Tkáňová ischemie při hypoxemii a vazokonstrikci spolu s oxidačním stresem vede k malfunkci iontových kanálů. Nejvíce je postižena (obdobně jako v plicích) energeticky náročná Na/K ATPáza. Její dysfunkce potencuje vznik intracelulárního edému mozkových buněk, nejvíce postiženy edémem bývají astrocyty. Deprivace energie a postižení endotelií naruší rovněž transportní systémy hematoencefalické bariéry. Do mozkomíšního moku tak proniká řada toxinů poškozujících neurony. Současně probíhající aktivace řady cytokinů a volných radikálů, spolu s ischemií tkání pak dále poškozuje bazální membránu kapilár a edém tkání se prohlubuje a intracerebrální tlak se zvyšuje. Edém mozku nemocného ohrožuje nejen poruchou vyšší nervové činnosti, ale lebka limituje rozpínání tkáně a může dojít k herniaci mozečku v okcipitální oblasti s útlakem prodloužené míchy. Novější práce však výraznější nárůst intrakraniálního tlaku popírají a zdůrazňují funkční změny, zejména tkáňovou hypoxii, osmoticko-oxidační stres a vystavení nervových buněk toxinům při poruše hematoencefalické bariéry (4–8, 14, 15).
Z pohledu léčebných zákroků vycházejících z patofyziologických pochodů se nabízí, vedle úpravy hypoxemie, zejména antiedematózní léčba a úprava funkce hematoencefalické bariéry. Z tohoto pohledu je zajímavé, že glukokortikoidy užívající se k léčbě výškového mozkového edému, konkrétně dexametazon, má jak antiedematózní účinek, tak stimulací funkce transportních proteinů a metabolických systémů může zlepšit funkci hematoencefalické bariéry.
Aktivace hemostázy
Relativně málo je zdůrazňován význam protrombotického stavu, který nedílně patří do celkového obrazu výškové nemoci. Aktivace primární (destičkové) i sekundární hemostázy (koagulace) pak v kombinaci s hemokoncentrací, aktivací endotelií a s poškozením jejich bazální membrány významně přispívá k riziku trombotických či trombembolických komplikací. V pozadí za aktivací destičkové hemostázy je vyplavení von Willebrandova faktoru a dysfunkce endotelu, hyperkoagulační stav je navozen zvýšenou syntézou faktorů koagulační kaskády, zejména však fibrinogenu v prvých dnech expozice hypoxemii. Klinickým korelátem aktivované hemostázy je vyšší výskyt aterotrombotických příhod, zejména infarktu myokardu a náhlé koronární smrti. Jiným projevem hyperkoagulačního stavu je trombóza mozkových žil. Ta je běžným nálezem u osob, které zemřely na komplikace výškové nemoci. V etiopatogenezi trombózy se uplatňuje též polycytemie a oblenění průtoku při intravaskulární hypovolemii (3, 16).
KLINICKÉ PROJEVY VÝŠKOVÉ NEMOCI
Výšková nemoc má několik forem: akutní výškovou nemoc, výškový mozkový edém, výškový plicní edém, trombotické kardio - a cerebrovaskulární komplikace a výškové krvácení do sítnice. Zatímco akutní výšková nemoc postihne více než polovinu těch, kteří zavítají do poloh nad 4000 m n. m. a není výjimkou i při pobytu v polohách nižších, závažné projevy jsou naštěstí vzácné.
Akutní výšková nemoc
S touto benigní formou nemoci se můžeme setkat u citlivých osob již od výšky 2500–3000 m n. m. Ve výšce kolem 4000 metrů je u neaklimatizovaných velmi častá, objevuje se nejméně u třetiny osob (17). Incidence je stejná u žen i u mužů, fyzická kondice riziko akutní výškové nemoci, na rozdíl od plicního edému, nesnižuje. Stejně tak nechrání ani nižší věk. Výskyt je vyšší, pobývali-li jsme předtím v nížině, častěji jsou postiženi lidé obézní či s plicním onemocněním.
Postavení diagnózy akutní výškové nemoci je založeno na přítomnosti klinických známek, zejména subjektivních symptomů, není jasné diagnostické kritérium, jehož přítomnost či nepřítomnost by potvrzovala či vylučovala chorobu. Projevy akutní výškové nemoci mají převážně neurologickou symptomatologii. K typickým projevům patří bolest hlavy, nechutenství, nespavost, zejména poruchy usínání, slabost až malátnost, vzácněji nauzea i zvracení. Příznaky se mohou objevit již do hodiny, zpravidla se však, při pobytu ve výškách kolem 4000 m n. m., objevují až po 6–10 hodinách a trvají zpravidla několik hodin či dnů, vzácně přetrvávají i několik málo týdnů.
Bolest hlavy je zpravidla tupá, tlaková, objevuje se již během prvého dne, typicky oboustranně s maximem ve frontální či frontotemporální krajině. Cenným diagnostickým znakem je zvýšení intenzity potíží při manévrech zvyšujících intrakraniální tlak, jako je kašel, zapnutí břišního lisu či Valsalvův manévr. Po sestupu do nižších poloh mizí během několika hodin. Náhle vystavení výšce kolem 4000 m n. m. bývá asi u 2/3 exponovaných osob provázeno poruchami spánku. Typická je nespavost, ta může být provázena periodickým dýcháním (často typu Cheyneova-Stokesova) a apnoickými pauzami při střídání stimulace dechového centra hypoxií s následnou jeho inhibici při hypokapnii. Škála neurologických poruch bývá zastoupena rovněž poruchami paměti, zejména výbavnosti, emoční labilitou, špatným soustředěním a poruchami jemné motoriky.
Z pestré klinické symptomatologie bývá asi u 4/5 osob postižených akutní výškovou nemocí přítomno nechutenství až nauzea, které mají nepochybně centrální původ. Dušnost nepatří do klasické symptomatologie akutní horské nemoci, ta je zákonitým důsledkem nízkého parciálního tlaku kyslíku, hypoxemie a nutnosti hyperventilace. Na základě přítomnosti jednotlivých příznaků bylo stanoveno Lake Louise skóre pro stanovení akutní horské nemoci (tab. 1).
Tab. 1. Lake Louise skóre pro stanovení akutní horské nemoci, hodnota skóre ≥ 3 svědčí pro mírnou formu, hodnota ≥ 6 pro těžkou formu 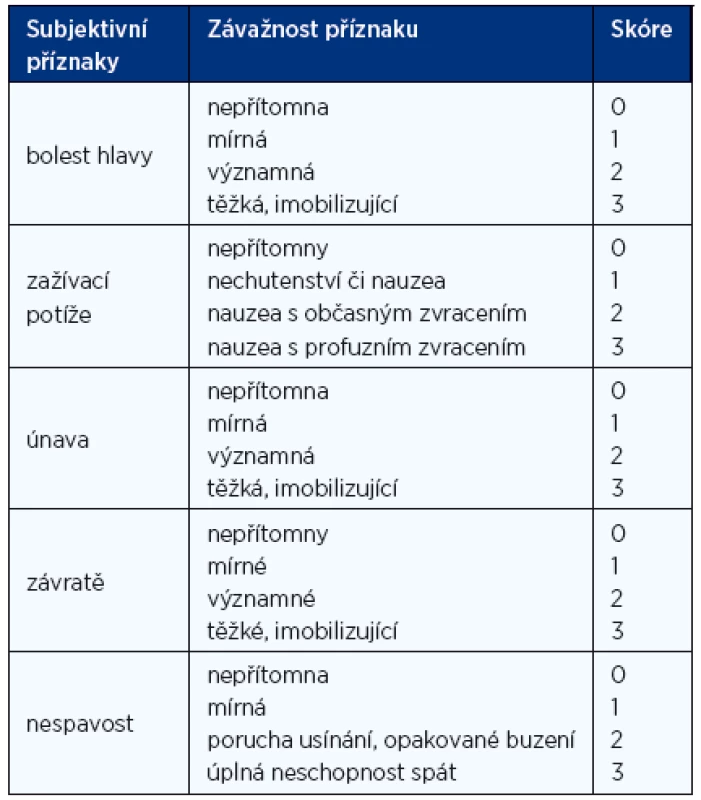
Podkladem potíží při akutní formě výškové nemoci je pravděpodobně mírná forma mozkového edému a osmoticko-oxidační stres s porušením hematoencefalické bariéry při hypoxii. Zdá se tak, že existuje plynulý přechod od akutní formy k vaskulárnímu výškovému plicnímu edému. Naštěstí akutní horská nemoc je zpravidla benigní záležitostí a spontánně – po aklimatizaci na výšku – vymizí. Proto ani léčba nebývá nutná, při výraznějších potížích stačí sestoupit do nižších poloh.
Výškový edém mozku
Akutní výšková nemoc může někdy přejít ve výškový edém mozku, v kóma a smrt. Jeho incidence bývá kolem 1 % u řádně neaklimatizovaných osob při pobytu nad 4500 metrů. Prodromy mohou být nenápadné, hlavně se objevují změny chování, poruchy intelektuálních funkcí i motoriky, progreduje bolest hlavy, nauzea a zvracení. Později se objevují halucinace, dezorientace, amnézie, otupělost až bezvědomí, vzácněji křeče. Cennou časnou známkou, která dominuje při orientačním neurologickém vyšetření, je ataxie. Typická je porucha chůze typu pata na špičku nohy, naopak jiné testy ataxie postiženy nebývají. Objeví-li ataxie se při pobytu ve vysoké nadmořské výšce, musíme vždy předpokládat, že je prvou známkou mozkového edému. Tak, jak ataxie jako prvá přichází, tak jako poslední při odeznívání mozkového edému mizí. Není výjimkou, že edém mozku se objeví společně s edémem plicním. Jak již bylo řečeno, příčina mozkového edému je obdobná jako u akutní výškové nemoci, jen je stav výrazně vystupňován. Rozlišit mezi těžším průběhem akutní výškové nemoci a počínajícím mozkovým edémem může být proto obtížné.
Výškový plicní edém
Plicní edém je vedle mozkového edému další závažnou a život ohrožující formou výškové nemoci. Při pobytu ve výšce od 4000 m n. m. se objevuje u 1–2 % lidí. Nicméně s výskytem plicního edému je nutné počítat již od výšky 3000 m n. m. či dokonce nižší. Riziko výškového plicního edému stoupá při příliš rychlém dosažení vyšší nadmořské výšky, při překonání příliš velkého výškového rozdílu s nedostatečnou aklimatizací a při přespávání ve vyšší nadmořské výšce. Nekardiální plicní edém bývá častěji pozorován u mladších jedinců, zejména u dětí, úlohu hraje i individuální vnímavost, zejména preexistující plicní postižení, často u kuřáků. Významné je, že jsou také rozdíly v délce aklimatizace u různých osob. Adaptace na jednotlivých úrovních, tj. změny na úrovni afinity hemoglobinu ke kyslíku či v přesunu metabolismu na glykolýzu, probíhají u jednotlivých osob různě rychle.
Příznaky se objevují nejčastěji 2. až 4. den, typicky druhou noc strávenou ve výšce. Zpočátku se setkáváme se suchým dráždivým kašlem, později s progredující námahovou, později i klidovou dušností. Plně vyvinutý plicní edém je provázen expektorací růžového zpěněného sputa a chrůpky až chropy. Pravidlem je ortopnoe, tachykardie, tachypnoe, hyperpyrexie, psychické poruchy – jako apatie či obluzení.
Trombotické a trombembolické komplikace
Ve vyšších nadmořských výškách se objevují stejné aterotrombotické komplikace jako v polohách nízkých. Rozdíl je jen v jejich častějším výskytu. Aktivace primární i sekundární hemostázy, stresová situace a tkáňová hypoxie vedou k častějšímu výskytu infarktu myokardu, jehož mortalita je však ve vyšších výškách významně větší. Obdobné faktory zvyšují také riziko náhlé koronární smrti na podkladě maligních arytmií. Je nutné zdůraznit nepoměrně vyšší riziko těchto příhod zejména u netrénovaných mužů, důvodem je pravděpodobně vyšší stresové zatížení než u osob trénovaných.
Specifickou komplikací provázející řadu úmrtí na podkladě výškové nemoci je trombóza mozkových žil. Podobně se mohou častěji vyskytnout flebotrombózy, nezřídka komplikované plicní embolizací. Zde jsou ohroženy více osoby s vrozenou či získanou trombofilií, často kuřačky užívající hormonální antikoncepci, které byly vystaveny delší cestě ve vynucené poloze (např. v letadle).
Výškou podmíněné krvácení do sítnice
Posledním projevem výškové nemoci mohou být hemoragie v sítnici. Mají většinou benigní charakter a pouze někdy, při krvácení do macula densa, jsou spojeny s výraznějšími poruchami vízu. Příčinou krvácení je nejspíše porucha endotelu při hypoxemii.
Oční projevy může mít též neurologické postižení jiné než přímo krvácení. Tranzitorní kortikální ischemie se může manifestovat atakami přechodné slepoty v rámci amaurosis fugas nebo dlouhodobější kortikální slepoty.
PROFYLAXE A LÉČBA VÝŠKOVÉ NEMOCI
Jaké jsou rady k prevenci vzniku závažnějších potíží na podkladě výškové nemoci? Základem je pomalá aklimatizace od výšky 3000 m se stoupáním o 300 až 500 m denně a od výšky 4000 m zpomalit stoupání jen na 200–300 výškových metrů denně. Všude tam, kde nám situace dovolí, volíme nocování v nižší nadmořské výšce. Porucha ventilace ve spánku může být kritická. Pokud se objeví příznaky akutní výškové nemoci, je třeba počkat s dalším stoupáním do jejich odeznění. Při závažnějších projevech neodkladně zahájit sestup, při plicním či mozkovém edému se snažíme zamezit fyzické aktivitě. Velký význam má dodržování pitného režimu, vyvarování se alkoholu, kouření, hypnotik, sedativ a jiných léků navozujících depresi dechového centra. Při výběru potravy volíme spíše glycidy podávané častěji v menších dávkách.
Profylaxe a léčba akutní výškové nemoci
V profylaxi akutní výškové nemoci bývá doporučován inhibitor karboanhydrázy – acetazolamid (Diluran). Zvýšené vylučování bikarbonátu v ledvině po inhibici enzymu karboanhydrázy navodí mírnou metabolickou acidózou s hyperventilací a následnou zvýšenou saturací krve kyslíkem. Navození metabolické acidózy acetazolamidem tak pravděpodobně stimuluje dechové centrum a zabrání nočním stavům relativní hypoventilace. Podávání acetazolamidu (v preventivní dávce 125 mg 2krát denně či v léčebné 250 mg 2krát denně) se doporučuje i v posledních doporučených postupech (18). Metaanalýzy dostupných studií ukazují pokles symptomatologie při profylaktickém podávání asi na polovinu, hlavním přínosem byla úprava poruch spánku v prvých dnech po dosažení vyšších výšek výsledky (18).
Aplikace preventivních dávek dexametazonu (Dexamethason Léčiva, Fortecortin) – 2krát denně 4 mg či a 4krát denně 2 mg – je doporučována při nemožnosti užít acetazolamid, nicméně tento postup není dostatečně doložen při profylaktickém užití, naopak vysoké dávky kortikoidů (4krát denně 4 mg) mají přesvědčivě doložený význam u pokročilejšího mozkového edému (20, 21).
Nepříjemným příznakem bývá bolest hlavy. Tu lze v počátečních stadiích zmírnit podáním nesteroidních antirevmatik, např. ibuprofenu (Ibalgin, Apo-ibuprofen aj.). Spolehlivější účinek však má kombinace antirevmatik či analgetik s gabapentinem (Gabalept, Gabapentin, Apo-gab aj.). K léčbě poruch spánku bývá doporučován zopiclon (Zoptin), který netlumí dechové centrum a neinhibuje plicní ventilaci (22–24).
Jediným spolehlivým účinným postupem jak potlačit výrazné potíže je sestup do nižších poloh, při mírných projevech stačí adaptace na místě. Důležité je též zabezpečit přísun tekutin, vyšší vypařování a přesun tekutiny do intersticia hrozí hypovolemií. Pravidlem by měl být dostatečný příjem tekutin. Alkoholu se zásadně vyhýbáme, je doložen vyšší výskyt příznaků – zejména bolesti hlavy.
Profylaxe a léčba výškového mozkového edému
Léčba obou typů edému v rámci výškové nemoci se mohou objevovat současně a léčba je v řadě postupů shodná, nicméně v řadě postupů se liší, bude proto výhodné je probrat odděleně. V přehledu jsou jednotlivé možnosti léčby spolu s uvedením významu (tab. 2).
Tab. 2. Možnosti profylaxe a léčby výškové nemoci 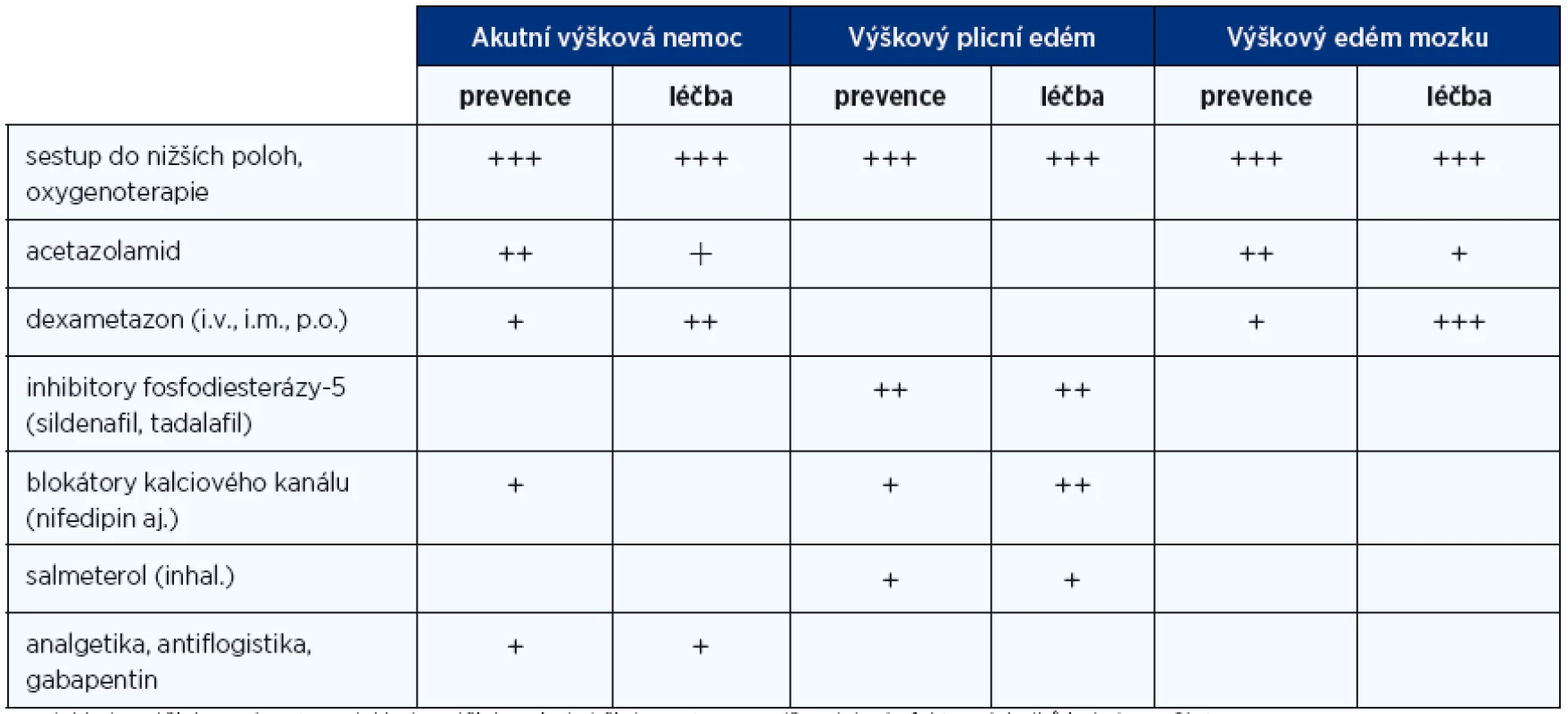
+++doklady o účinku z více st., ++doklady o účinku z jedné či dvou st., +pravděpodobný efekt z výsledků jedné menší st. Již při podezření na jednu z forem edému musíme zajistit zvýšení nabídky kyslíku. Vedle urychleného sestupu do nižších poloh můžeme užít podpůrné přístupy, jako je inhalace kyslíku maskou, optimálně při pozitivním end-expiračním tlaku (zvýšení odporu na konci výdechu) či uložení nemocného do hyperbarického vaku (např. Gamowův vak). Farmakologické postupy léčby výškového mozkového a plicního edému mají vysloveně podpůrný efekt.
Při mozkovém edému je lékem prvé pomoci dexametazon. Detailní mechanismus účinku není objasněn, potvrzen je pouze antiedematózní účinek. Předpokládá se stabilizace endoteliálních buněk, snížení propustnosti bazální membrány kapilár, aktivace Na/K ATPázy zvyšující drenáž tkáňové tekutiny i stimulace transmembranózních transportních proteinů se zlepšením hematoencefalické bariéry. Dexametazon aplikujeme v nárazové dávce 8 mg, sledovanou 4 mg v šestihodinových intervalech, aplikujeme dle možností, optimálně nitrožilně či nitrosvalově. Dokumentována je významná úleva postiženému, není však jasné, zda je možné očekávat i zlepšení prognózy. S podáváním glukokortikoidů pokračujeme do dosažení nižších poloh, jinak mohou potíže recidivovat (10, 25). Starší studie dokumentovaly i mírný efekt dexametazonu v léčbě výškového plicního edému v situaci, kdy nebyl možný sestup.
Ostatní postupy zkoušené v léčbě výškového edému mozku, jako inhibitory karboanhydrázy (acetazolamid), vazoaktivní působky z Ginkgo biloba, nesteroidní antirevmatika či diuretika selhávají. Na tomto místě je nutné zdůraznit negativní dopad diuretik na výškovou nemoc. Diuretika, zejména kličková (furosemid), navodí masivní pokles objemu cirkulující tekutiny, který může vést k překvapivě rychlému selhání oběhu.
Profylaxe a léčba výškového plicního edému
Profylaxe a léčba výškového plicního edému je snad ještě více problematická. Opět platí imperativ nutnosti zlepšit hypoxemii, postupy byly již popsány. Vytvoření jednotného postupu brání konfliktní výsledky jednotlivých léčebných metod a vzhledem k řídkému výskytu choroby i pochopitelná absence srovnávacích studií. Nesourodost výsledků pravděpodobně pramení z toho, že léčba byla podávána v různých fázích nemoci. V souhlase s předpokládanou etiopatogenezí by se zdálo být racionální zpočátku zabránit vzniku plicní hypertenze a stabilizovat endotel, později spíše aktivovat drenáž tkáňové tekutiny.
Poznatek o nižší nabídce NO vedl k nové léčebné strategii v léčbě hypoxické plicní hypertenze. Oxid dusnatý stimuluje cyklický guanosin monofosfát (cGMP), který navodí relaxaci hladké svaloviny v plicních arteriolách a prekapilárách. Nabízí se představa, že navození vazodilatace stimulací cGMP by mohla upravit plicní hypertenzi a snížit riziko plicního edému. Zvýšení nabídky cGMP lze dosáhnout stimulací (např. nitráty, eventuálně blokátory kalciového kanálu) či blokádou degradace cGMP inhibitory fosfodiesterázy-5 (sildenafilem či tadalafilem).
Obojí cesta byla úspěšně testována. Blokátory kalciového kanálu (např. nifedipin) v monoterapii i v kombinaci s nitráty se osvědčily u některých osob v profylaxi a zejména v léčbě plicní hypertenze různé etiologie. Nicméně u výškové plicní hypertenze je dokladů o účinnosti málo a výsledky jsou značně rozdílné. Data z klinických studií o efektu nifedipinu jsou značně nepřesvědčivá. Poněkud nadějnější je užití inhibitorů fosfodiesterázy-5 (PDE-5) – zejména sildenafilu (Revatio či Viagra) nebo tadalafilu (Cialis). V posledních letech se objevila řada menších studií prověřujících sildenafil či tadalafil v profylaxi i k léčbě výškového plicního edému. Po podání inhibitorů PDE-5 dochází k poklesu plicní hypertenze, k úpravě srdečního výdeje, nebylo však přesvědčivě doloženo zlepšení saturace krve kyslíkem (26). Nicméně aplikace sildenafilu a tadalafilu je užívána na řadě specializovaných pracovišť (10, 25–27). Podobný efekt, jako inhibitory PDE-5 mají i nespecifické inhibitory izoenzymů fosfodiesterázy – jako je kofein a jiné metylxantiny získané například z kokových listů. S pitím silného čaje z koky, tradičním nápojem jihoamerických indiánů, se jistě setkal každý návštěvník Kordiller v Bolívii či v Peru. Tak se ukazuje, že tradiční profylaxe výškové nemoci u indiánů metylxantiny z koky může mít racionální základ.
Stimulací odtoku tkáňové tekutiny působí β2-sympatomimetika. Stimulace receptorů β2 Na/K ATPázy (natriového kanálu) v alveolárních buňkách inhalovaným salmeterolem (Serevent) v dávce 2krát denně 100–150 µg významně zvyšuje alveolární drenáž a clearanci plicní intersticiální tekutiny. Po experimentálních modelech se tato metoda osvědčila i v klinické kontrolované studii v rámci prevence. Výskyt plicního edému poklesl proti placebu o více než polovinu (28, 29). Pro užití salmeterolu či jiných sympatomimetik v léčbě výškového plicního edému nejsou bohužel žádné validní studie, doporučení pro jeho užití tak zůstává na úrovni prevence. Nově navrhovaná skupina aquaporinů, látek stimulujících transport vody na úrovni alveolárních membrán, byla testována zatím pouze v experimentu.
Efekt dexametazonu byl již diskutován v rámci léčby mozkového edému. U plicního výškového edému máme pouze jednu malou studii, která dokumentovala mírný efekt v profylaxi, pro léčbu bohužel nemáme žádná data, nicméně řada pracovišť jej v léčbě plicního edému užívá (27, 28).
Acetazolamid, který může být užit k profylaxi akutní výškové nemoci, není v léčbě výškového plicního edému indikován, žádná studie nepotvrdila jeho efekt.
Vzhledem k tomu, že důkazy o klinické účinnosti nových farmakologických postupů jsou zatím ve fázi ověřování a u zavedené léčby máme nedostatek důkazů o jejich účinnosti, zůstává jediným racionálním postupem sestoupení do nižších poloh a zvýšení tlaku kyslíku.
Shrneme-li pak farmakologické postupy léčby výškového plicního edému, je slibná skupina inhibitorů PDE-5, konkrétně sildenafil a tadalafil. Podobně lze v prevenci doporučit inhalaci β2-mimetika – salmeterolu, neboť i tento postup byl úspěšně ověřen (4, 23). Kombinace obou postupů je užívána již na řadě specializovaných pracovišť zabývajících se léčbou výškové nemoci a odpovídá současné praxi (29). Pro užití blokátorů kalciového kanálu, ač se jedná o relativně starý léčebný postup, máme minimum dokladů. Pokud se však pro tuto skupinu rozhodneme, je otázkou zda užít doporučovaný nifedipin, neboť sympatoadrenální aktivace po podání nifedipinu je naprosto nežádoucí. Rovněž pro užití dexametazonu či acetazolamidu v léčbě či prevenci výškového plicního edému nemáme žádné podklady.
Profylaxe a léčba tromboembolických komplikací
Vzhledem k tomu, že dosažení oblastí s vyššími nadmořskými výškami předchází často delší cestování, zejména let letadlem, měla by být prevence trombóz zaměřena převážně na toto období. Zvýšeně ohroženy jsou osoby s vrozenou trombofilií v rámci polymorfismu koagulačních faktorů či s trombofilií získanou. Zde jsou ohroženy zejména ženy kuřačky užívající hormonální antikoncepci. Aplikace frakcionovaného heparinu (např. enoxaparinu – Clexane) bezprostředně před cestou by měla být v těchto případech pravidlem. Aplikace přímých inhibitorů trombinu – dabigatran (Pradaxa) či faktoru Xa – apixaban (Eliquis) a rivaroxaban (Xarelto) není ještě v této indikaci ověřena, v praxi se však nezřídka užívá.
Závěrem lze léčebnou strategii shrnout do několika vět: K léčbě akutní výškové nemoci není nutné volit farmakoterapii, zpravidla stačí aklimatizace, při nutnosti zásahu je možné volit inhibitor karboanhydrázy – acetazolamid, bolesti hlavy při akutní výškové nemoci mohou být spolehlivě potlačeny gabapentinem, optimálně v kombinaci s ibuprofenem. Kortikoidy, zejména dexametazon ve vyšších dávkách může být výhodný k prevenci a k léčbě mozkového edému. Léčba výškového plicního edému se pak opírá o inhibitory fosfodiesterázy-5 (konkrétně sildenafil nebo tadalafil), eventuálně v kombinaci s blokátory kalciového kanálu spolu s β2-mimetikem salmeterolem. Podání diuretika, tak jak jsme zvyklí v léčbě kardiálního plicního edému, by bylo hrubou chybou. I přes určitý pokrok v léčbě stále platí příkaz postupné aklimatizace na výšku a rychlý sestup do nižších poloh při známkách závažnějšího postižení.
Seznam použitých zkratek
cGMP cyklický guanosin monofosfát
HIF-1α hypoxia-inducible factor-1α
PDES-I inhibitor fosfodiesterázy-5
pO2 parciální tlak kyslíku
VEGF vascular endothelial growth factor
ADRESA PRO KORESPONDENCI:
prof. MUDr. Jan Bultas, CSc.
Ústav farmakologie 3. LF UK
Ruská 87, 100 00 Praha 10
e-mail: jbult@lf3.cuni.cz
Zdroje
1. Bloch KE, Turk AJ, Maggiorini M, et al. Effect of ascent protocol on acute mountain sickness and success at Muztagh Ata, 7546 m. High Alt Med Biol 2009; 10(1): 25–32.
2. Croughs M, Van Gompel A, Rameckers S, et al. Serious altitude illness in travelers who visited a pre-travel clinic, J Travel Med 2014; 21(6): 403–409.
3. Windsor JS, Firth PG, Grocott MP, et al. Mountain mortality: a review of deaths that occur during recreational activities in the mountains. Postgrad Med J 2009; 85(1004): 316–321.
4. West JB. Adventures in high-altitude physiology. Adv Exp Med Biol 2006; 588 : 7–16.
5. West JB. The physiologic basis of high-altitude diseases. Ann Intern Med 2004; 141(10): 789–800.
6. Vinnikov D, Brimkulov N, Blanc PD, et al. Smoking increases the risk of acute mountain sickness. Wilderness Environ Med 2015; 26(2): 164–172.
7. Zhang E, Zhang J, Jin J, et al. Variants of the low oxygen sensors EGLN1 and HIF–1AN associated with acute mountain sickness. Int J Mol Sci 2014; 15(12): 21777–21787.
8. Ge RL, Shai HR, Takeoka M, et al. Atrial natriuretic peptide and red cell 2,3-diphosphoglycerate in patients with chronic mountain sickness. Wilderness Environ Med 2001; 12(1): 2–7.
9. Yoshino M, Murakami K, Katsumata Y, et al. Stimulation of anaerobic metabolism in rats at high altitude hypoxia–adrenergic effects dependent on dietary states. Comp Biochem Physiol B 1987; 88(2): 651–654.
10. CATMAT. Statement on high-altitude illnesses. An Advisory Committee Statement (ACS). Can Commun Dis Rep 2007; 33(ACS–5): 1–20.
11. Qi Y, Niu W, Zhu T, et al. Synergistic effect of the genetic polymorphisms of the renin-angiotensin-aldosterone system on high-altitude pulmonary edema: a study from Qinghai-Tibet altitude. Eur J Epidemiol 2008; 23(2): 143–152.
12. Bartsch P, Mairbäurl H, Maggiorini M, et al. Physiological aspects of high-altitude pulmonary edema. J Appl Physiol 2005; 98(3): 1101–1110.
13. Ge RL, Mo VY, Januzzi JL, et al. B-type natriuretic peptide, vascular endothelial growth factor, endothelin-1, and nitric oxide synthase in chronic mountain sickness. Am J Physiol Heart Circ Physiol 2011; 300(4): H1427–433.
14. Bärtsch P, Swenson ER. Clinical practice: Acute high-altitude illnesses. N Engl J Med 2013; 368 : 2294–2302.
15. Ainslie PN, Subudhi AW. Cerebral blood flow at high altitude. High Alt Med Biol 2014; 15(2): 133–140.
16. Pichler HJ, Risch L, Hefti U, et al. Changes of coagulation parameters during high altitude expedition. Swiss Med Wkly 2010; 140(7–8): 111–117.
17. Shin T. High altitude illnesses in Hawai‘i. Hawaii J Med Public Health 2014; 73(11 Suppl 2): 4–6.
18. Luks AM, McIntosh SE, Grissom CK, et al. Wilderness Medical Society practice guidelines for the prevention and treatment of acute altitude illness: 2014 update. Wilderness Environ Med 2014; 25(4 Suppl): S4–14.
19. Ritchie ND, Baggott AV, Todd WT. Acetazolamide for the prevention of acute mountain sickness – a systematic review and meta-analysis. J Travel Med 2012; 19(5): 298–307.
20. Luks AM, Swenson ER. Medication and dosage considerations in the prophylaxis and treatment of high-altitude illness. Chest 2008; 133(3): 744–755.
21. Maggiorini M, Brunner-La Rocca HP, Peth S, et al. Both tadalafil and dexamethasone may reduce the incidence of high–altitude pulmonary edema: a randomized trial. Ann Intern Med 2006; 145(7): 497–506.
22. Wilson MH, Newman S, Imray CH, et al. The cerebral effects of ascent to high altitudes. Lancet Neurol 2009; 8(2): 175–191.
23. Jafarian S, Abolfazli R, Gorouhi F, et al. Gabapentin for prevention of hypobaric hypoxia-induced headache: randomized double-blind clinical trial. J Neurol Neurosurg Psychiatry 2008; 79(3): 321–323.
24. Pandit A, Karmacharya P, Pathak R, et al. Efficacy of NSAIDs for the prevention of acute mountain sickness: a systematic review and meta-analysis. J Community Hosp Intern Med Perspect. 2014;4(4).
25. Fagenholz PJ, Gutman JA, Murray AF, et al. Treatment of high altitude pulmonary edema at 4240 m in Nepal. High Alt Med Biol 2007; 8(2): 139–146.
26. Aldashev AA, Kojonazarov BK, Amatov TA, et al. Phosphodiesterase type 5 and high altitude pulmonary hypertension. Thorax 2005; 60(8): 683–687.
27. Xu Y, Liu Y, Liu J, et al. Meta-analysis of clinical efficacy of sildenafil, a phosphodiesterase type-5 inhibitor on high altitude hypoxia and its complications. High Alt Med Biol 2014; 15(1): 46–51.
28. Perimenis P. Sildenafil for the treatment of altitude-induced hypoxaemia. Expert Opin Pharmacother 2005; 6(5): 835–837.
29. Sartori C, Allemann Y, Duplain H, et al. Salmeterol for the prevention of high-altitude pulmonary edema. N Engl J Med 2002; 346(21): 1631–1636.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek ÚvodníkČlánek Chronické srdeční selháníČlánek Ladislav Syllaba (1868–1930)Článek GEORGE DAVIS SNELLČlánek Spolek českých lékařůČlánek JubilantiČlánek RejstříkyČlánek Diabetologie 2015
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
-
Všechny články tohoto čísla
- Úvodník
- Chronické srdeční selhání
- Studie PARADIGM-HF – změna paradigmatu v léčbě chronického srdečního selhání?
- Nekardiální plicní edém, syndrom akutní dechové tísně
- Výšková nemoc
- Zdravotní dopady černobylské katastrofy se zaměřením na endokrinní systém: část 2
- Diabetologie 2015
- Analýza vztahu sérových hladin párů těžkých/lehkých řetězců imunoglobulinu (Hevylite™) k výsledkům standardní gelové elektroforézy a nefelometrického vyšetření bílkovin séra při diagnóze mnohočetného myelomu
- Ladislav Syllaba (1868–1930)
- GEORGE DAVIS SNELL
- Komentář k práci Výplach žaludku při perorální intoxikaci – sporné pohledy na problematiku autorů Večeřa R, Ondra P, Jezdinský J, Adamus M. (Čas. Lék. čes. 2015; 154(4): 174–175)
- Nové složení výborů odborných společností a spolků lékařů ČLS JEP – 2015
- Elektronické zdravotnictví nelze zavádět bez účasti lékařů
- Tradiční setkání spolků lékařů
- Spolek českých lékařů
- Plánované akce složek ČLS JEP
- Doc. MUDr. Milan Špála, CSc. – 85 let (*20. listopadu 1930)
- Jubilanti
- Rejstříky
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Výšková nemoc
- Nekardiální plicní edém, syndrom akutní dechové tísně
- Chronické srdeční selhání
- Analýza vztahu sérových hladin párů těžkých/lehkých řetězců imunoglobulinu (Hevylite™) k výsledkům standardní gelové elektroforézy a nefelometrického vyšetření bílkovin séra při diagnóze mnohočetného myelomu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



