-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nekardiální plicní edém, syndrom akutní dechové tísně
Non-cardiogenic pulmonary edema, acute respiratory distress syndrome
Non-cardiogenic pulmonary edema is a clinical syndrome manifested by rapidly progressive respiratory distress leading, without therapy, to severe respiratory insufficiency and subsequent multiorgan failure. The pathophysiological causes are: the change in the pressure gradients in the pulmonary capillaries, the impaired membrane permeability of the alveolocapillary in the lungs, and impaired lymphatic drainage. Unlike in cardiogenic pulmonary edema, cardiac disease is not a cause, and there is no increase in wedge pressure (< 18 mm Hg). The aetiological base is diverse and includes more clinical pathological factors. The diagnosis and evaluation are usually very difficult due to the rapidly deteriorating clinical condition of the patients. A decisive, quick and comprehensive approach, using all available invasive and non-invasive methods is necessary. The basic steps of treatment are: the use of different types of ventilatory support in order to achieve adequate oxygenation, dealing with possible hemodynamic instability, and, when needed, other specific procedures. It is always important to keep in mind that this is a very serious condition with a high mortality rate. And there is a need for fast and efficient access to the best specialized clinic.
Keywords:
non-cardiogenic pulmonary edema – acute respiratory distress syndrome – protective ventilatory support – extracorporeal membrane oxygenation
Autoři: Hana Skalická; prof. MUDr. Jan Bělohlávek, Ph.D.
Působiště autorů: II. interní klinika – klinika kardiologie a angiologie 1. LF UK a VFN, Praha
Vyšlo v časopise: Čas. Lék. čes. 2015; 154: 273-279
Kategorie: Přehledový článek
Souhrn
Nekardiální plicní edém je klinický stav projevující se rychle progredující dechovou tísní vedoucí bez terapie k těžké respirační insuficienci a následně multiorgánovému selhání. Patofyziologickým základem je změna tlakových gradientů v plicních kapilárách, porucha permeability alveolokapilární membrány v plicních sklípcích, porucha lymfatické drenáže. Na rozdíl od kardiálního plicního edému chybí srdeční onemocnění jako příčina postižení a nedochází ke změně tlaku v zaklínění (< 18 mm Hg). Etiologický podklad je rozmanitý a zahrnuje více klinicko-patologických jednotek. Diagnostika a hodnocení jsou obvykle velmi složité vzhledem k rychle se zhoršujícímu klinickému nálezu. Rozhodný, rychlý a komplexní přístup s využitím všech dostupných invazivních i neinvazivních metod je nezbytný. Základem terapie jsou různé typy ventilační podpory s cílem dosažení adekvátní oxygenace, dále na zvládnutí případné hemodynamické nestability, a na dalších specifických postupech. Vždy je nutné mít na paměti, že se jedná o vysoce závažný stav zatížený vysokou mortalitou s nutností rychlého a efektivního přístupu, nejlépe na specializovaném pracovišti.
Klíčová slova:
nekardiální plicní edém – syndrom akutní dechové tísně – protektivní ventilace – venovenózní extrakorporální mimotělní podporaÚVOD
Plicní edém je z patofyziologického hlediska charakterizován nadbytkem extravaskulární tekutiny v plicích, resp. v plicním intersticiu a v plicních alveolech. Tento stav vzniká nerovnováhou Starlingových sil (zvýšení plicního kapilárního tlaku, snížení onkotického tlaku plazmy, snížení intersticiálního tlaku), zvýšenou permeabilitou alveolokapilární membrány či sníženou lymfatickou drenáží (1). Nejčastěji se setkáváme s pojmem kardiální plicní edém. Tento typ edému je definovaný jako plicní edém na podkladě kardiálního onemocnění, při kterém dochází k vzestupu tlaku v levostranných srdečních oddílech a přeneseně tak v plicních žilách, resp. v tzv. „zaklínění“ nad 18 mm Hg. Tento pojem je odvozen z hodnoty měřené při pravostranné katetrizaci pomocí dříve v intenzivní péči hojně využívaného plicnicového (Swanova-Ganzova) katétru, někdy se používá i pojem pulmonary artery occlusion pressure (PAOP). Nekardiální plicní edém (NPE) nemá vlastní jasnou, jednoduchou a výstižnou definici. Zjednodušeně lze říci, že o NPE jde tehdy, jedná-li se o plicní edém, který nevznikl na základě srdečního onemocnění. Vzniká na podkladě velmi různorodých faktorů (podrobněji uvedeno dále). Diagnóza a nalezení etiologického podkladu, včetně rozlišení patofyziologie vzniku a charakteru edému je klíčovým bodem k dalšímu managementu onemocnění (2).
Zmiňujeme nejčastější typy NPE, se kterými se můžeme v klinické praxi setkat. Vzhledem k četnosti výskytu, vývoji postupů a překryvu diagnostiky a terapie, budou další části především věnovány problematice řešení a terapii ARDS (acute respiratory distress syndrome), typické a nejčastější formě NPE.
Incidence nekardiálního plicního edému není přesně v literatuře verifikovaná. Lze ji tudíž pouze aproximovat k incidenci ARDS. Je udávaná v rozmezí od 1 do 79/100 000 obyvatel (3, 4), což v České republice představuje přibližně 800 případů na 1 rok. Nejčastější příčinou je septický šok (38 %), mezi další příčiny se řadí aspirace (30 %), diseminovaná intravaskulární koagulopatie (22 %), plicní kontuze (17 %) a pneumonie (12 %).
U hodnocení mortality NPE je obdobný problém jako u incidence. Mortalita se navíc pohybuje ve velmi širokém rozpětí od 40 do 75 %. V posledních cca 5 letech se snížila především ve specializovaných centrech na 32–45 %. Důvodem je mimo jiné i dostupnost nových metod, např. extrakorporální membránové oxygenace, ECMO, což je přístrojová mimotělní podpora oběhových a respiračních funkcí. Z dlouhodobého sledování je relativně příznivý fakt, že pokud pacient stav přežije, má za 1 rok až 50% šanci návratu do plného pracovního procesu (CESAR trial) (5).
ETIOLOGIE A PATOFYZIOLOGIE
Etiologie NPE je velmi rozmanitá úzce souvisí s patofyziologickým podkladem onemocnění. Nejčastější typy jsou uvedeny přehledně v tabulce 1.
Tab. 1. Shrnutí etiologických faktorů podílejících se na vzniku nekardiálního plicního edému 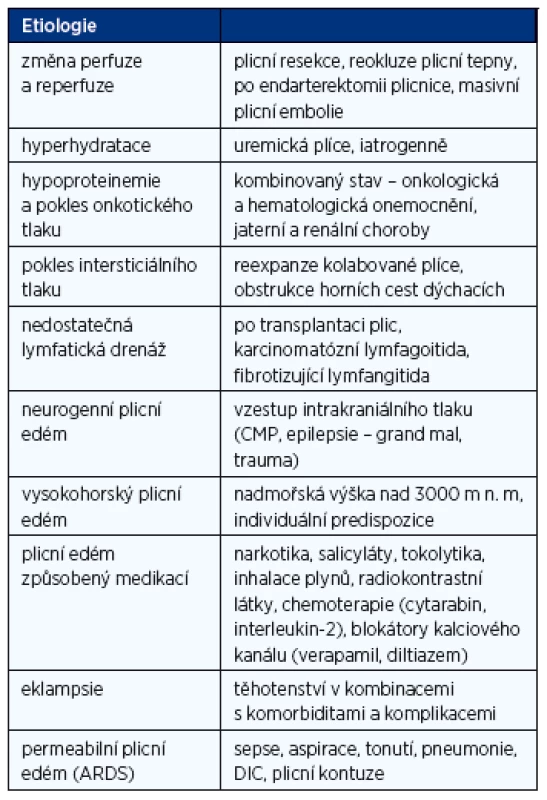
Mezi faktory vyvolávající NPE řadíme plicní edém vzniklý na podkladě zvýšené perfuze nebo reperfuze. Stav je navozen změnou, resp. vzestupem regionálního plicního průtoku a zvýšením tlaků (ovlivnění hydrostatických a onkotických sil Starlingovy rovnice) při rozšíření plicního řečiště o další dříve uzavřené kapiláry. Tento stav může být navozen například po velké plicní resekci, endarterektomii plicnice pro tromboembolickou plicní hypertenzi, dilataci periferní stenózy plicní tepny či masivní plicní embolii s nadměrnou perfuzí v neembolizovaných oblastech při nepoměru ventilace a perfuze (V/Q mismatch).
Dalším vyvolávajícím faktorem NPE může být hyperhydratace. K NPE v tomto případě dochází tehdy, jestliže se zvýší objem cirkulující krve nad kritickou mez vedoucí následně k vysokým kapilárním tlakům v plicním řečišti. Nejčastěji se s tímto typem edému setkáváme u nemocných s renálním selháváním (tzv. uremická plíce), typicky jde i o iatrogenní stav při nadměrném zatížení intravenózními infuzemi (6).
Nebo se může jednat o pokles plazmatického onkotického tlaku, obvykle při hypoproteinemii a s tím související nadměrné transsudaci tekutiny přes alveolokapilární membránu na základě změny rozložení tlakových gradientů. Většinou, ale pro plné rozvinutí NPE musí být přítomen ještě další přidružený faktor (zvýšení plicního kapilárního tlaku, zvýšení kapilární permeability).
NPE může být dále vyvolaný např. poklesem intersticiálního tlaku (7). V tomto případě hraje důležitou roli vliv subatmosférického intrapleurálního tlaku na plicní intersticium a pokles perivazálních tlaků v plicním kapilárním řečišti. Se stavem se lze setkat např. při reexpanzi kolabované plíce (např. po drenáži déletrvajícího pneumothoraxu), popř. obstrukci horních dýchacích cest (8). V řadě případů u tohoto NPE je patrný rychlý nástup, ale i rychlá odezva po odstranění příčiny.
Jiným typem NPE je edém vzniklý nedostatečnou lymfatickou drenáží, typicky obstrukcí ductus thoracicus. Pro vznik tohoto typu edému je také zapotřebí další spolupůsobící faktor. Do souvislosti se udává např. mírné zvýšení tlaku v levé síni, nadměrná hyperhydratace či transfuzní terapie. Většinou vzniká při závažných komorbiditách (karcinomatózní lymfagoitida, fibrotizující lymfangitida, po transplantaci plic apod.).
Dalším typem je neurogenní plicní edém (9). Vzniká na základě zvýšení intrakraniálním tlaku (poranění hlavy, záchvat epilepsie typu grand mal, cerebrovaskulární příhody, hyponatremická encefalopatie). Má poměrně rychlý nástup. Patofyziologický podklad není dosud jednoznačně vysvětlen. Předpokládá se, že stav je ovlivněn výraznou stimulací centrálních alfa-adrenergních receptorů, což vede ke generalizované vazokonstrikci a centralizaci oběhu. Stoupá systémová i plicní vaskulární rezistence, cévy se stávají tužšími a při zvýšeném objemu (vliv katecholaminů a další endokrinní stimulace) dochází ke zvýšení tlaků v plicích.
Mezi další typy NPE se řadí polékový NPE, dále vysokohorská nemoc, popř. plicní edém při eklampsii, po anestezii či operačních výkonech. S polékovým NPE se můžeme setkat při předávkování narkotiky (10), otravě salicyláty, tokolytiky, kontrastní látkou (11), po otravě inhalačně dráždivými plyny – amoniak, chlorovodík, sirovodík, slzný plyn. Není přesně jasný patofyziologický podklad, nicméně předpokládá se vliv přímého postižení alveolokapilární membrány. Problematika vysokohorské choroby byla publikována v řadě prací (12). Jedná se o komplexní proces související s řadou dalších hormonálních změn při pobytu ve výškách nad 3000 m. n. m. u neaklimatizovaných jedinců s velkou interindividuální variabilitou. Tento typ NPE je vyvolaný hypoxií, daný pravděpodobně nerovnoměrnou vazokonstrikcí a tomu neadekvátní perfuzí. Děj je většinou reverzibilní s nutností návratu do nižších výšek a oxygenoterapií.
SYNDROM AKUTNÍ DECHOVÉ TÍSNĚ (ARDS)
ARDS je vzhledem k četnosti výskytu a závažnosti nejdůležitějším typem NPE. V řadě zahraničních zdrojů je dokonce ARDS brán v užším smyslu jako nekardiální plicní edém. Tyto stavy se v mnoha vyvolávajících příčinách a projevech překrývají. ARDS je definované podle Berlínské definice z roku 2012 (13) jako typ akutního, difuzního, zánětlivého poškození plic, které vede ke zvýšení plicní vaskulární permeability, zvýšení hmotnosti plic, ztrátě vzdušnosti s hypoxemií, s rentgenovým nálezem opacit v obou křídlech vzniklých do 7 dní od inzultu. Morfologicky se jedná o nález difuzního alveolárního poškození (edém, zánět, hyalinní blanky nebo krvácení). Na základě vyvolávajících faktorů a stavů, za jakých k rozvinutí plicního edému došlo, rozeznáváme dva typy postižení: primární a sekundární (tab. 2).
Tab. 2. Rozdělení ARDS dle etiologie 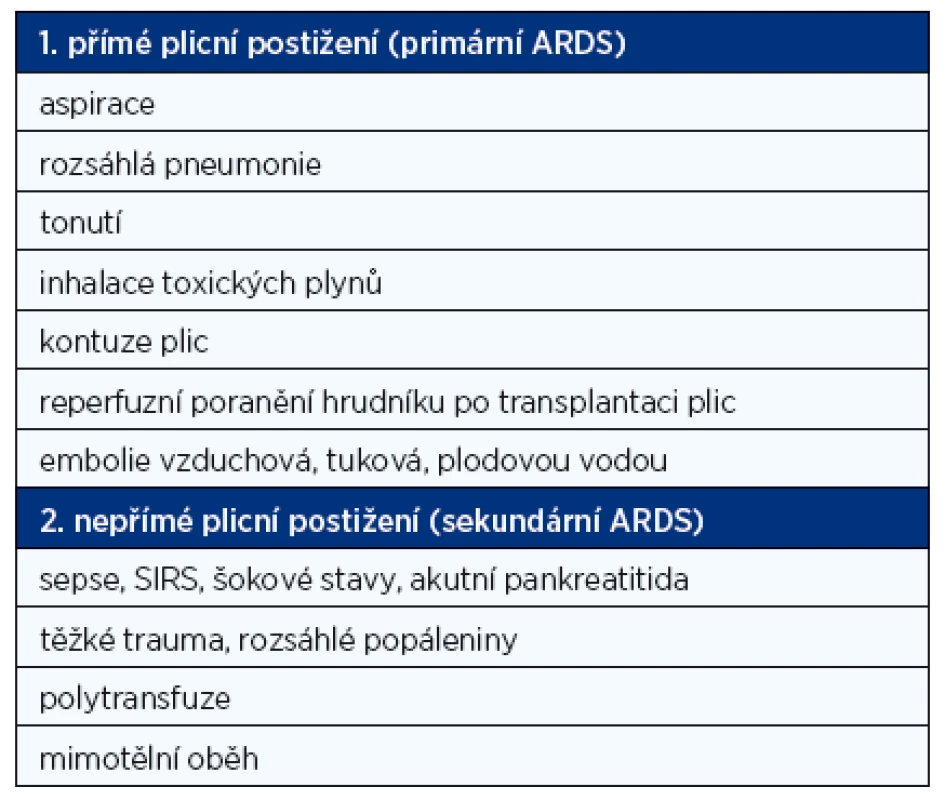
SIRS – systemic inflammatory response syndrome Klasifikace ARDS je hodnocena poměrem parciálního tlaku kyslíku v arteriální krvi a frakce kyslíku (PaO2/FiO2) na lehkou, středně těžkou a těžkou formu (tab. 3).
Tab. 3. Klasifikace ARDS podle poměru P<sub>a</sub>O<sub>2</sub>/FiO<sub>2</sub> (mm Hg/frakce kyslíku vyjádřená v rozmezí 0–1) 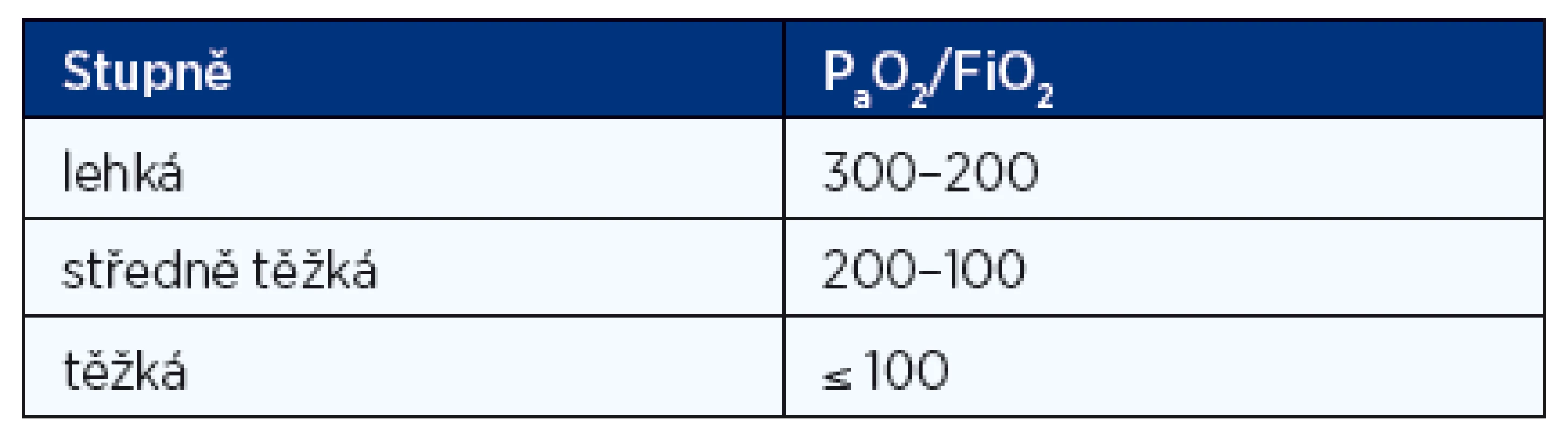
Tíži postižení hodnotíme dále pomocí tzv. Murrayho skóre (tab. 4). Hodnotí se zde čtyři parametry:
- poměr PaO2/FiO2,
- radiologický nález počtu postižených kvadrantů plic,
- plicní compliance (poddajnost),
- výše dosaženého PEEP (positive end-expiratory pressure).
Tab. 4. Hodnocení tíže závažnosti postižení pomocí Murrayho skóre 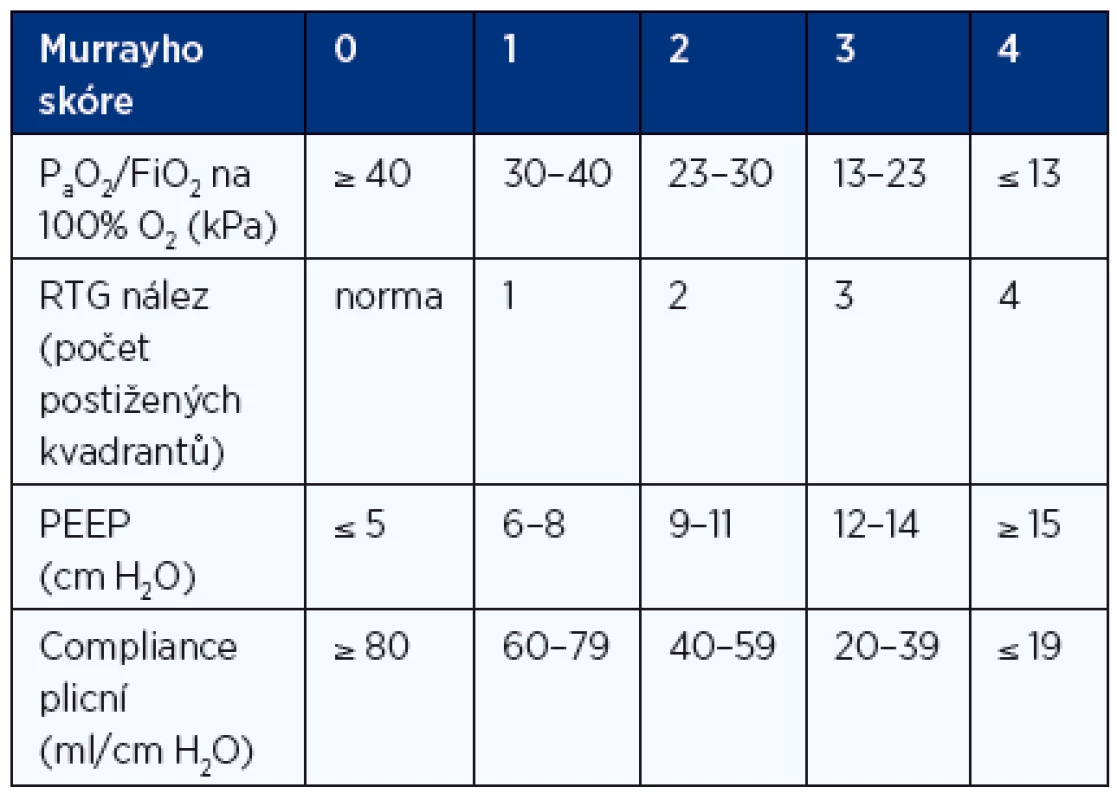
Celkový počet bodů se vydělí 4. Například pacient s PaO2 60 mm Hg, na 100% kyslíku, s difuzními infiltráty v obou dolních plicních polích, s PEEP 12 cm H2O a při compliance 19 ml/cm H2O má součet bodů 4 + 2 + 3 + 4 = 13 a Murrayho skóre je 3,25. Pokud je hodnota Murrayho skóre rovnající se 0, znamená to, že pacient je bez známek ARDS, při 0,1–2,5 jsou patrné známky lehkého až středního postižení a nad 2,5 se jedná o postižení závažné.
DIAGNOSTIKA
Vždy je nutný komplexní a rychlý postup. Vlastní provedení vyšetření, diagnostika a diferenciální diagnostika NPE (tab. 5) musí obsáhnout zhodnocení veškerých výsledků úzce specializovaným odborníkem v co nejširším úhlu pohledu (14).
Tab. 5. Shrnutí základních diagnostických vyšetřovacích metodik v rámci hodnocení NPE a ARDS 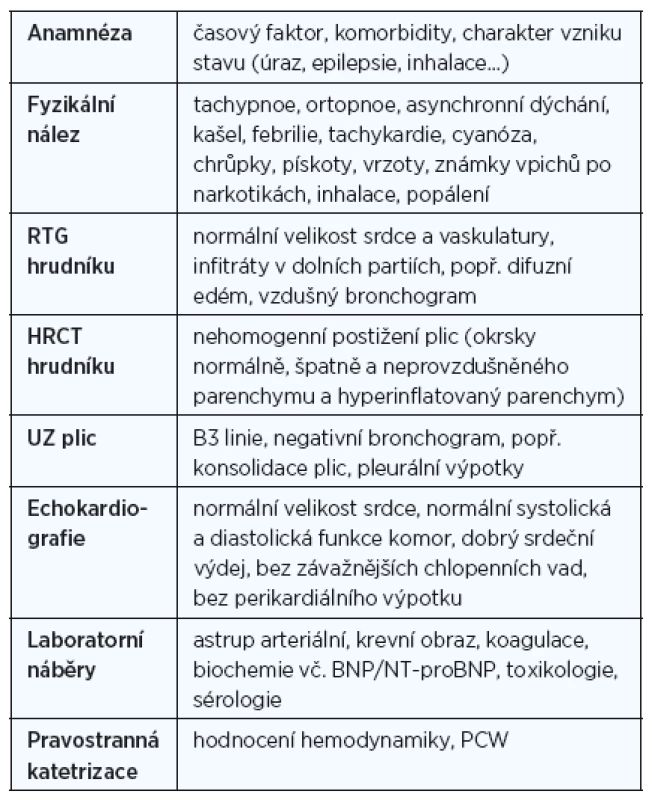
V prvé řadě je potřeba pečlivě přistoupit k zhodnocení anamnézy a klinického nálezu. Klíčová je znalost proběhlého recentního traumatu, expozice inhalace plynů, abúzu drog, chronická, resp. recentní medikace (salicyláty, tokolytika), recentní krevní převody, stav po úrazu elektrickým proudem, stav po proběhlém či probíhajícím infekčním onemocnění s febriliemi, poruchy polykání, neurologické onemocnění). Je nutné zjistit potenciální kardiální anamnézu pacienta a hodnocení časového faktoru, resp. délky trvání onemocnění.
Další důležitý moment představuje radiodiagnostika. Primárně všichni pacienti s respirační insuficiencí by měli mít provedený klasický zadopřední snímek hrudníku. V případě NPE je patrná normální velikost srdce a vaskulatury, dále zjišťujeme bilaterální infiltráty v dolních partiích, popř. difuzní edém a vzdušný bronchogram (obr. 1) (15).
Obr. 1. Zadopřední snímek hrudníku pacienta s ARDS 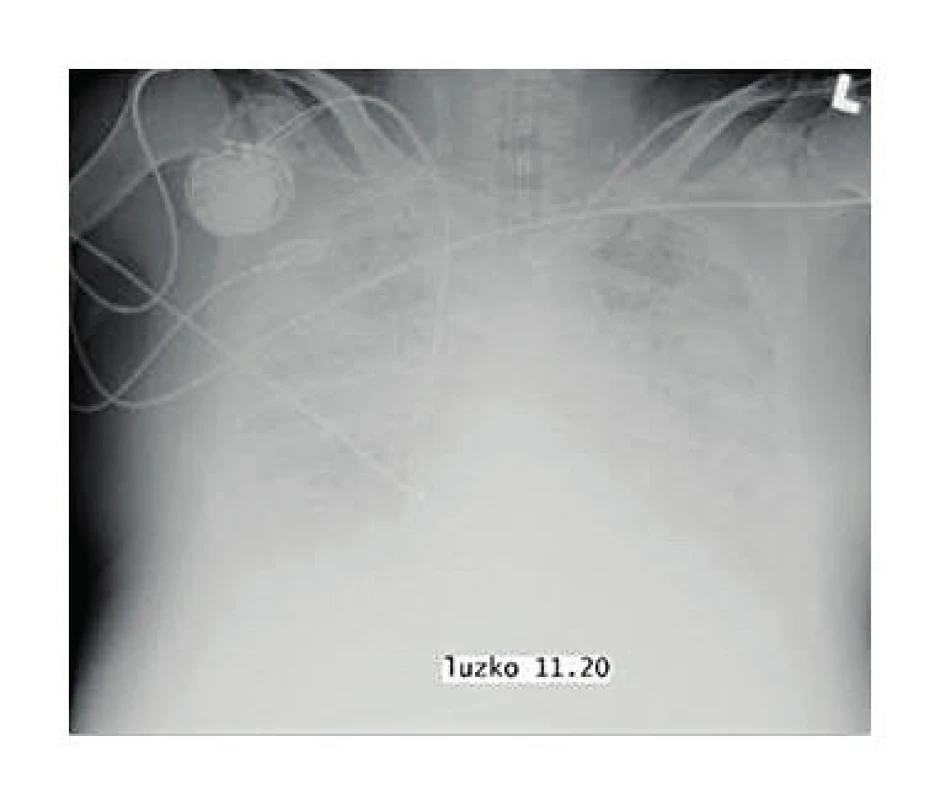
V případě diagnostických nejasností, popř. při potřebě detailnějšího zhodnocení plicního postižení, zůstává zlatým standardem provedení počítačové tomografie hrudníku, resp. HRCT (high resolution computed tomography) (16). Můžeme zde najít klasický obraz ARDS, ze kterého vychází tzv. „baby lung koncept“ (17). Jedná se o nehomogenní postižení plic, při kterém můžeme na HRCT nálezu zastihnout současně normálně provzdušnělý plicní parenchym, špatně provzdušněný parenchym, neprovzdušnělý parenchym a parenchym hyperinflatovaný (obr. 2).
Obr. 2. HRCT plic s nálezem ARDS (difuzní nehomogenní zastření plicního parenchymu), těžké bilaterální postižení při H1N1 intersticiální pneumonii 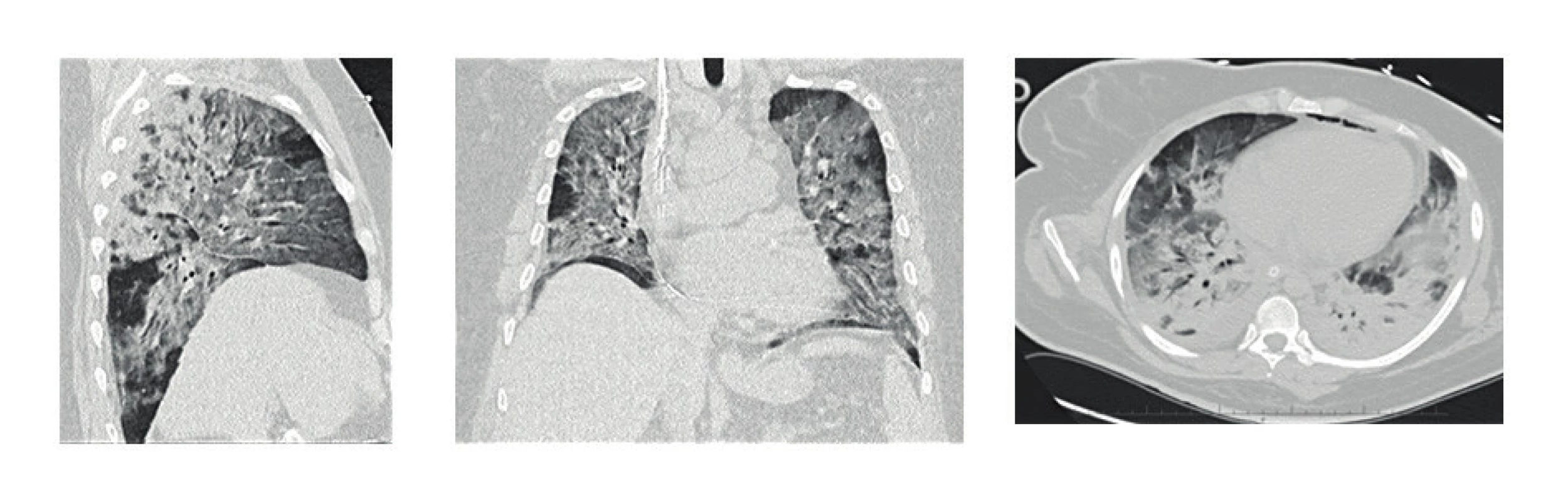
Další velmi přínosnou metodikou je plicní ultrazvuk (18–20). Jedná se metodiku relativně nově využívanou v této problematice a obecně více rozšířenou v akutní medicíně. Má výhodu ve snadné dostupnosti, neinvazivitě, relativní jednoduchosti a možnosti opakovaní bez zatěžování pacienta radiační zátěží a transportu. Při nálezu plicního edému je typická přítomnost tzv. B3 linií (obr. 3).
Obr. 3. Plicní ultrazvuk u pacienta s plicním edémem s patrnými B3 vertikálními liniemi 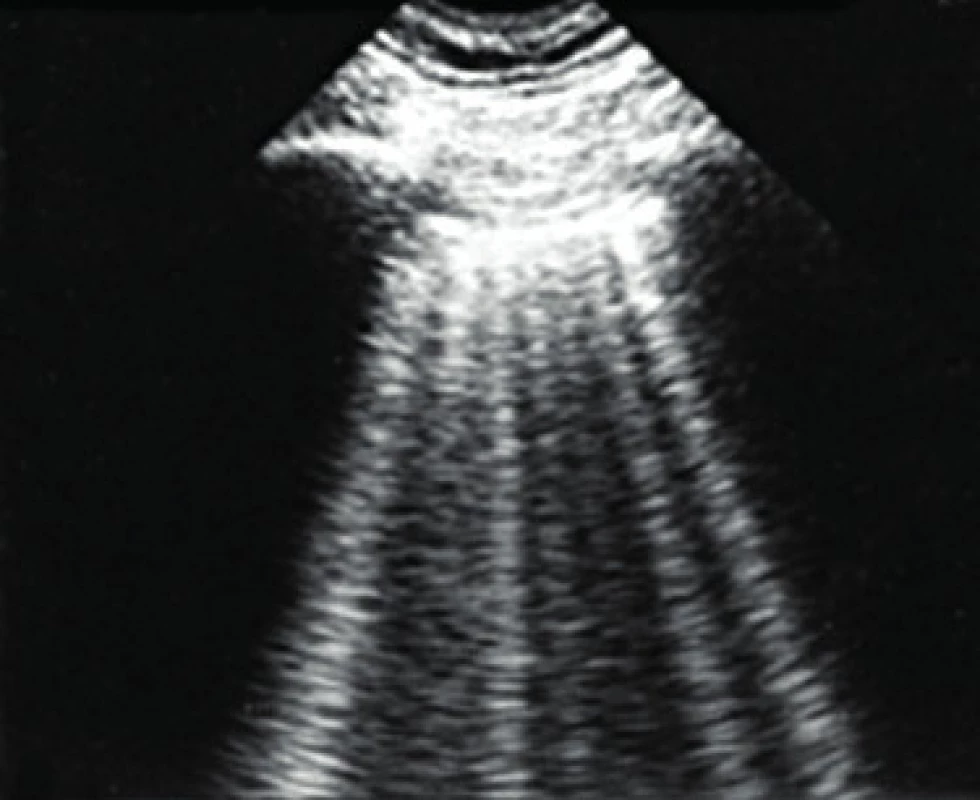
Echokardiografické vyšetření srdce má význam v rámci diferenciální diagnostiky. Umožňuje vyloučení kardiálního postižení, zhodnocení hemodynamiky (srdeční výdej, volemii – dolní dutá žíla, průtoky v jaterních žilách, kolísání transmitrálního průtoku). Vzhledem k neinvazivitě je v posledních letech toto vyšetření preferováno oproti, popř. měření srdečního výdeje klasicky invazivní cestou, prováděné pomocí punkce centrální žíly (jugulární, subklaviální) a zavedením Swanova-Ganzova plicnicového katétru. Od invazivní monitorace tohoto charakteru se v posledních letech výrazně upouští, invazivní přístup je vyhrazen speciálním případům, je preferováno neinvazivní zhodnocení a monitorace hemodynamiky.
Laboratorní vyšetření má výhodu v jednoduchosti a umožňuje nám nejenom hodnocení aktuálního stavu pacienta, ale pomáhá i v rámci diferenciální diagnostiky. V prvé řadě se soustředíme na hodnocení tíže respirační insuficience (hypoxie, hyper - či hypokapnie), stavu vnitřního prostředí (pH, laktát) a tíže závažnosti – Murrayho skóre(PaO2/FiO2, rentgen plic, PEEP, compliance). Nelze opomenout v rámci diferenciální diagnostiky ani hodnocení přítomnosti dalších koincidujících faktorů pomocí vyšetření krevního obrazu, koagulace, BNP (NT-proBNP), renální a jaterní parametry a zánětlivé parametry. Dle suspektní etiologie vycházející se zjištěných nálezů je možné provedení dalších cílených odběrů (sérologie, imunologie, bakteriologie atd.).
TERAPIE
Terapie NPE je obvykle velmi komplikovaná s nejasným výsledkem (21). Klíčová je rychlá kauzální léčba, tedy ta, která se soustředí na odstranění vyvolávající příčiny (odstranění zdroje sepse, stabilizace tkání postižených traumatem, obstrukce dýchacích cest apod.). Zásadní roli zde hraje časná diagnostika s navazující agresivní léčbou odpovídající extrémně rychlé progresi onemocnění (zásady terapie) (tab. 6).
Tab. 6. Terapeutický postup při NPE a ARDS 
VV ECMO – venovenózní extrakorporální mimotělní oběh, HFOV – vysokofrekvenční oscilační ventilace V prvé řadě je tedy nutné myslet na zajištění základních životních funkcí, hemodynamickou stabilizaci k udržení srdečního výdeje (terapie vazopresory, ionotropiky).
V dalším kroku je nutná snaha o zabránění rozvoje či odstranění již vzniklé hypoxie a zlepšení oxygenace tkání, současně zajistit udržení bezpečnosti při léčbě kyslíkem. Primárně přistupujeme k oxygenoterapii pomocí nosní kanyly a masky, následně při nedostatečném efektu k neinvazivní přetlakové ventilaci. V případě pokračující progrese stavu je nutné zvážit zahájení umělé plicní ventilace (UPV) (22). V posledních letech je u NPE, resp. ARDS preferována protektivní ventilační strategie (23). Tento typ ventilace je využíván s cílem snížit riziko dalšího poškození plic. Ventilaci je třeba provádět nízkými dechovými objemy s hodnotami do6–8 ml/kg, inspiračním tlakem pod 30 mm Hg (resp. 35 mm Hg), frakcí kyslíku (FiO2) pod 0,7, s PEEP (hodnota přetlaku, výdechového odporu v cm H2O, positive end-expiratory pressure) 6–8 mm Hg (max.10–15 mm Hg) a dechovou frekvencí pod 35/min. Při ventilaci u ARDS se snažíme o udržení permisivní hypoxie (není dosud definitivně určena hranice) a doporučené je i udržování permisivní hyperkapnie do parciálního tlaku CO2 (pCO2) 8,6 kPa se zachováním pH nad 7,2.
Důležitým bodem léčby je sledování tekutinové bilance (24, 25). Preferovaná je konzervativní strategie, představující tzv. restriktivní tekutinový režim s cílem udržení lehce negativní bilance s kontrolou centrálního žilního tlaku (kolem 4 mm Hg). Dochází tak ke zlepšení mobilizace intersticiálních tekutin (mobilizace probíhá pomaleji než u kardiálního plicního edému). Pozitivní kumulativní bilance (tedy bilance od přijetí pacienta do nemocnice) představuje nezávislý prediktor mortality a orgánové dysfunkce.
Efekt specifické farmakoterapie je nejasný a léčba je výrazně limitovaná dostupnými preparáty (26). Mezi testované léky především v rámci ARDS můžeme uvést kortikosteroidy, surfaktant a prostanoidy. Kortikosteroidy jsou doporučeny pouze jako „rescue“ postup u perzistujícího ARDS při Murrayho skóre > 2,5 (viz výše), nejdéle do 14 dní od vyvolávajícího faktoru. Rozhodně je nelze doporučit k podání ve všech případech (27–29). Kortikosteroidy představují vzhledem k imunosupresivnímu efektu riziko nozokomiální infekce a myopatie. V intenzivistických kruzích stále probíhají debaty na toto téma a jejich efekt, timing podání a rizika nejsou doposud přesně verifikovány. Surfaktant v léčbě ARDS u dospělých není využíván. Tento závěr vychází především z relativně recentně publikované studie CARD (30), ve které bylo prokázáno zhoršení prognózy pacientů s ARDS po inhalačním podání surfaktantu (rozvoj hypoxie, hypotenze). Jeho podávání je vhodné pouze u dětí. K podání inhalačních prostanoidů chybí dostatečná data. Ze závěru metaanalýzy publikované v lednu 2015 (31) bylo popsáno zlepšení parciálního tlaku kyslíku, pokles plicní hypertenze současně provázený hypotenzí. Indikace podání je otazná.
Doporučená je dostatečná hloubka analgosedace, využití svalové relaxace je spíše výjimečné, při umělé plicní ventilaci hrozí riziko rozvoje závažné polyneuropatie kriticky nemocných (32). Testovaly se i další léky, např. statiny, které sice nemají závažnější nežádoucí účinky, ale současně nezlepšují outcome (33). Na experimentální úrovni je zkoušena i buněčná terapie, zatím bez jasných závěrů pro klinickou praxi (34–36).
V případě rezistentního ARDS lze přistoupit k tzv. „rescue“ metodám. Řadí se sem ventilace v pronační poloze, vysokofrekvenční oscilační ventilace (HFOV – high frequency oscillatory ventilation) a extrakorporální mimotělní podpora (ECMO – extracorporeal membrane oxygenation). Metody tohoto typu jsou většinou vyhrazeny pro terciální, vysoce specializovaná centra, se zkušeností s těmito terapeutickými postupy.
Pronační poloha se provádí s cílem zlepšení ventilace a reexpanze plicních dorzálních atelektatických partií, homogenizace ventilačně perfuzních poměrů. Vede také k poklesu intrapulmonálních pravolevých zkratů a vzestupu funkční reziduální kapacity. Provedení pronační ventilační polohy zlepšuje oxygenaci, neboť se jedná o drenážní plicní polohu umožňující mobilizaci sekretu z dolních cest dýchacích a s tím související snížení incidence ventilátorové pneumonie, dále vede ke snížení rizika dorzálních dekubitů (37–40). Byla popsána 16% redukce relativního rizika úmrtí při použití pronace u nejtěžších forem ARDS s hodnotouPaO2/FiO2 pod 100 mm Hg. Efekt u primárního ARDS je patrný později (12 hod.) než u sekundárního ARDS (1–3 hod.). Ukončení pronace je indikované u pacientů nereagujících na pronaci, při zlepšení klinického stavu, při zlepšení ventilace (41, 42).
Vysokofrekvenční oscilační ventilace představuje metodu používající speciální ventilátor s oscilační membránou a možností ventilace malými dechovými objemy(1–4 ml/kg) při frekvenci 3,5–15 Hz (43). Ventilace nevyužívá klasické inspirium a expirium, je založena na konvekci, difuzi a promíchání plynů v alveolech s různou časovou konstantou. Z tohoto hlediska tedy nedochází k výrazným změnám tlaků a objemů v alveolech, a zmenšuje se tak riziko dalšího poškození plic. Publikované dvě velké studie OSCAR a OSCILLATE (44) nepotvrdily ovlivnění mortality ani délku hospitalizace touto metodou, využití v praxi je problematické, nicméně v selektovaných případech, zvláště u dětí je tato metoda nadále využívána.
Venovenózní (VV) ECMO (viz obr. 4) je invazivní přístrojová metoda mimotělní oxygenace krve rezervovaná pro těžké refrakterní formy potencionálně reverzibilního plicního selhání při ARDS. Např. provázející selhání štěpu po transplantaci, reperfuzním plicním edému, po endarterektomii plicnice, pandemické pneumonii a při respiračním selhání u novorozenců (45–52).
Obr. 4. VV ECMO (femoro-jugulární okruh – přes kanylu cestou v. femoralis zavedenou do dolní duté žíly je odebírána krev do mimotělního okruhu, oxygenovaná a navracena cestou jugulární žíly). VV ECMO – venovenózní extrakorporální mimotělní oběh, VJI – vena jugularis interna, ddž – dolní dutá žíla 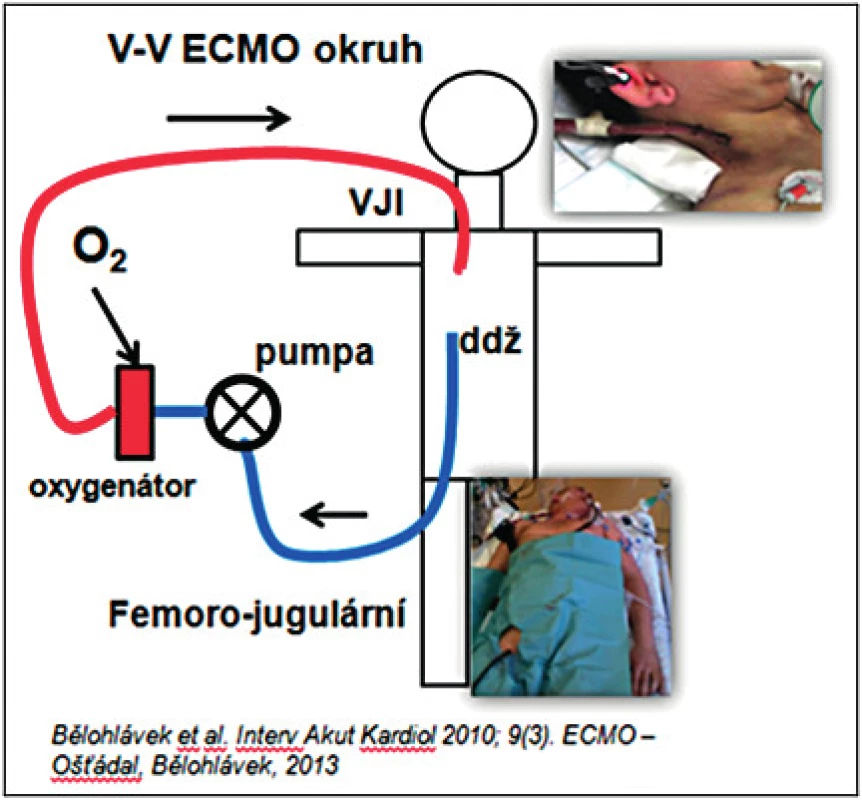
K indikaci napojení na VV ECMO je nutné splnění zásadních kritérií: Doba trvání ventilace by neměla být delší než 7 dní (roste riziko poškození plic umělou ventilaci, tzv. VILI (ventilator induced lung injury), inspirační tlaky jsou nad 30 mm Hg, FiO2 nad 0,8, Murray skóre > 3, přítomná aci-dóza s pH pod 7,2, pCO2 je nad 80 mm Hg (5, 53). Mezi kontraindikace zavedení VV ECMA se řadí poškození CNS, granulocytopenie (< 0,4 × 109/l), dysfunkce pravé nebo levé komory, plicní arteriální hypertenze. Uvedená metodika se v současnosti prudce rozvíjí, podobně jako zřizování specializovaných, tzv. ARDS center.
ZÁVĚR
Nekardiální plicní edém je klinický syndrom s velmi nepříznivou prognózou. Je charakterizovaný těžkou dušností se závažnou hypoxemií s typickým rentgenovým nálezem bilaterální alveolární infiltrace, bez současné přítomnosti kardiálního onemocnění. Pro různorodost vyvolávajících faktorů není diferenciální diagnostika jednoduchá. Jedná se o závažný rychle se rozvíjející těžký klinický stav se značně problematickou a velmi omezenou terapií. Je potřeba vždy včasná, rozhodná a přesná diagnostika. Agresivita a rychlost progrese stavu vyžaduje komplexní přístup, řešení za spolupráce řady specialistů. Zásadní v terapeutickém postupu je protektivní ventilační režim, konzervativní přístup k tekutinové bilanci. Není k dispozici specifická terapie. Při refrakteritě a progresi onemocnění je vhodná okamžitá centralizace do specializovaných center. Rescue postupy mají být ponechány pro nejtěžší, refrakterní formy ARDS. Je nutné mít stále na paměti, že řada postupů není zatím založena na dostatečné evidenci. Velké randomizované studie jsou problematické (relativně malý počet pacientů, etický problém) a vždy je potřeba k léčbě přistupovat přísně individuálně.
Seznam použitých zkratek
ARDS syndrom akutní dechové tísně (acute respiratory distress syndrome)
ECMO extrakorporální mimotělní podpora (extracorporeal membrane oxygenation)
HFOV high frequency oscillatory ventilation
HRCT high resolution computed tomography
NPE nekardiální plicní edém
NT-proBNP aminoterminální konec prohormonu BNP
PAOP pulmonary artery occlusion pressure
PEEP positive end-expiratory pressure
UPV umělá plicní ventilace
VILI ventilator induced lung injury
V/Q mismatch nepoměr ventilace a perfuze
VV venovenózní
ADRESA PRO KORESPONDENCI:
MUDr. Hana Skalická, Ph.D.
II. interní klinika kardiologie a angiologie 1. LF UK a VFN
U Nemocnice 2, 128 00 Praha 2
e-mail: hana.skalicka@vfn.cz
Zdroje
1. Braunwald E. Heart disease: a textbook of cardiovascular medicine. 4th ed. Philadelphia: Saunders 1992.
2. Burnham EL, et al. The fibroproliferative response in acute respiratory distress syndrome: mechanisms and clinical significance. Eur Respir J 2014; 43(1): 276–285.
3. Fowler AA, et al. Adult respiratory distress syndrome: risk with common predispositions. Ann Intern Med 1983; 98(5 Pt 1): 593–597.
4. Pepe PE, et al. Early prediction of the adult respiratory distress syndrome by a simple scoring method. Ann Emerg Med 1983; 12(12): 749–755.
5. Peek GJ, et al. Efficacy and economic assessment of conventional ventilatory support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicentre randomised controlled trial. Lancet 2009; 374(9698): 1351–1363.
6. Stein L, et al. Pulmonary edema during volume infusion. Circulation 1975; 52(3): 483–489.
7. Bhaskar B, Fraser JF. Negative pressure pulmonary edema revisited: Pathophysiology and review of management. Saudi J Anaesth 2011; 5(3): 308–313.
8. Edoote Y, Bar-Lavie Y. Non-cardiogenic pulmonary edema following upper airway obstruction in adults. Harefuah 2000; 139(9–10): 385–388.
9. Brambrink AM, Dick WF. Neurogenic pulmonary edema. Pathogenesis, clinical picture and therapy. Anaesthesist 1997; 46(11): 953–963.
10. Steinberg AD, Karliner JS. The clinical spectrum of heroin pulmonary edema. Arch Intern Med 1968; 122(2): 122–127.
11. Goldsmith SR, Steinberg P. Noncardiogenic pulmonary edema induced by nonionic low-osmolality radiographic contrast media. J Allergy Clin Immunol 1995; 96(5 Pt 1): 698–699.
12. Ladner E, et al. High altitude pulmonary edema at a medium height. A case report. Anaesthesist 1994; 43(3): 183–186.
13. Force ADT, et al. Acute respiratory distress syndrome: the Berlin Definition. JAMA 2012; 307(23): 2526–2533.
14. Colice GL. Detecting the presence and cause of pulmonary edema. Postgrad Med 1993; 93(6): 161–166, 169–170.
15. Milne EN, et al. The radiologic distinction of cardiogenic and noncardiogenic edema. AJR Am J Roentgenol 1985; 144(5): 879–894.
16. Grieser C, et al. Computed tomography findings from patients with ARDS due to Influenza A (H1N1) virus-associated pneumonia. Eur J Radiol 2012; 81(2): 389–394.
17. Gattinoni L, Pesenti A. The concept of „baby lung“. Intensive Care Med 2005; 31(6): 776–784.
18. Lichtenstein DA. BLUE-protocol and FALLS-protocol: two applications of lung ultrasound in the critically ill. Chest 2015; 147(6): 1659–1670.
19. Al Deeb M, et al. Point-of-care ultrasonography for the diagnosis of acute cardiogenic pulmonary edema in patients presenting with acute dyspnea: a systematic review and meta-analysis. Acad Emerg Med 2014; 21(8): 843–852.
20. Corradi F, Brusasco C, Pelosi P. Chest ultrasound in acute respiratory distress syndrome. Curr Opin Crit Care 2014; 20(1): 98–103.
21. Rubenfeld, GD. Who cares about preventing acute respiratory distress syndrome? Am J Respir Crit Care Med, 2015; 191(3): 255–260.
22. Villar J, Kacmarek RM. The American-European Consensus Conference definition of the acute respiratory distress syndrome is dead, long live positive end-expiratory pressure! Med Intensiva 2012; 36(8): 571–575.
23. Petrucci N, Iacovelli W. Lung protective ventilation strategy for the acute respiratory distress syndrome. Cochrane Database Syst Rev 2007; (3): CD003844.
24. National Heart L, et al. Comparison of two fluid-management strategies in acute lung injury. N Engl J Med 2006; 354(24): 2564–2575.
25. Silva PL, Pelosi P, Rocco PR. Fluids in acute respiratory distress syndrome: pros and cons. Curr Opin Crit Care 2014; 20(1): 104–112.
26. Spieth PM, Zhang H. Pharmacological therapies for acute respiratory distress syndrome. Curr Opin Crit Care 2014; 20(1): 113–121.
27. Petty TL, Fowler AA. 3rd, Another look at ARDS. Chest 1982; 82(1): 98–104.
28. Adhikari NK, Scales DC. Corticosteroids for acute respiratory distress syndrome. BMJ 2008; 336(7651): 969–970.
29. Peter JV, et al. Corticosteroids in the prevention and treatment of acute respiratory distress syndrome (ARDS) in adults: meta-analysis. BMJ 2008; 336(7651): 1006–1009.
30. Willson DF, et al. The Adult Calfactant in Acute Respiratory Distress Syndrome Trial. Chest 2015; 148(2): 356–364.
31. Fuller BM, et al. The use of inhaled prostaglandins in patients with ARDS: a systematic review and meta-analysis. Chest 2015; 147(6): 1510–1522.
32. Hraiech S, Dizier S, Papazian L. The use of paralytics in patients with acute respiratory distress syndrome. Clin Chest Med 2014; 35(4): 753–763.
33. McAuley DF, et al. Simvastatin in the acute respiratory distress syndrome. N Engl J Med 2014; 371(18): 1695–1703.
34. Maron-Gutierrez T, et al. Cell-based therapies for the acute respiratory distress syndrome. Curr Opin Crit Care 2014; 20(1): 122–131.
35. Liu KD, et al. Design and implementation of the START (STem cells for ARDS Treatment) trial, a phase 1/2 trial of human mesenchymal stem/stromal cells for the treatment of moderate-severe acute respiratory distress syndrome. Ann Intensive Care 2014; 4 : 22.
36. Gotts JE, Matthay MA. Endogenous and exogenous cell-based pathways for recovery from acute respiratory distress syndrome. Clin Chest Med 2014; 35(4): 797–809.
37. Abroug F, et al. The effect of prone positioning in acute respiratory distress syndrome or acute lung injury: a meta-analysis. Areas of uncertainty and recommendations for research. Intensive Care Med 2008; 34(6): 1002–1011.
38. Alsaghir AH, Martin CM. Effect of prone positioning in patients with acute respiratory distress syndrome: a meta-analysis. Crit Care Med 2008; 36(2): 603–609.
39. Mora-Arteaga JA, Bernal-Ramirez OJ, Rodriguez SJ. The effects of prone position ventilation in patients with acute respiratory distress syndrome. A systematic review and metaanalysis. Med Intensiva 2015; 39(6): 352–365.
40. Fernandez R, et al. Prone positioning in acute respiratory distress syndrome: a multicenter randomized clinical trial. Intensive Care Med 2008; 34(8): 1487–1491.
41. Romero CM, et al. Extended prone position ventilation in severe acute respiratory distress syndrome: a pilot feasibility study. J Crit Care 2009; 24(1): 81–88.
42. Beitler JR, et al. Prone positioning reduces mortality from acute respiratory distress syndrome in the low tidal volume era: a meta-analysis. Intensive Care Med 2014; 40(3): 332–341.
43. Naorungroj T, et al. High-frequency oscillatory ventilation for patients during exudative phase of severe ARDS. J Med Assoc Thai 2015; 98(4): 343–351.
44. Goffi A, Ferguson ND. High-frequency oscillatory ventilation for early acute respiratory distress syndrome in adults. Curr Opin Crit Care 2014; 20(1): 77–85.
45. Hayes D, Jr, et al. Extracorporeal life support for acute respiratory distress syndromes. Ann Thorac Med 2013; 8(3): 133–141.
46. Del Sorbo L, Cypel M, Fan E. Extracorporeal life support for adults with severe acute respiratory failure. Lancet Respir Med 2014; 2(2): 154–164.
47. Biderman P, et al. Extracorporeal life support in patients with multiple injuries and severe respiratory failure: a single-center experience? J Trauma Acute Care Surg 2013; 75(5): 907–912.
48. Zangrillo A, et al. Extracorporeal membrane oxygenation (ECMO) in patients with H1N1 influenza infection: a systematic review and meta-analysis including 8 studies and 266 patients receiving ECMO. Crit Care 2013; 17(1): R30.
49. Management and Writing Committee (Australia, New Zealand). Extracorporeal membrane oxygenation for 2009 influenza A(H1N1) acute respiratory distress syndrome. JAMA 2009; 302(17): 1888–1895.
50. Turner DA, et al. Extracorporeal membrane oxygenation for severe refractory respiratory failure secondary to 2009 H1N1 influenza A. Respir Care 2011; 56(7): 941–946.
51. Zampieri FG, et al. Extracorporeal membrane oxygenation for severe respiratory failure in adult patients: a systematic review and meta-analysis of current evidence. J Crit Care 2013; 28(6): 998–1005.
52. Noah MA, et al. Referral to an extracorporeal membrane oxygenation center and mortality among patients with severe 2009 influenza A(H1N1). JAMA 2011; 306(15): 1659–1668.
53. Nelson J, Cairns B, Charles A. Early extracorporeal life support as rescue therapy for severe acute respiratory distress syndrome after inhalation injury. J Burn Care Res 2009; 30(6): 1035–1038.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek ÚvodníkČlánek Chronické srdeční selháníČlánek Ladislav Syllaba (1868–1930)Článek GEORGE DAVIS SNELLČlánek Spolek českých lékařůČlánek JubilantiČlánek RejstříkyČlánek Výšková nemocČlánek Diabetologie 2015
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Úvodník
- Chronické srdeční selhání
- Studie PARADIGM-HF – změna paradigmatu v léčbě chronického srdečního selhání?
- Nekardiální plicní edém, syndrom akutní dechové tísně
- Výšková nemoc
- Zdravotní dopady černobylské katastrofy se zaměřením na endokrinní systém: část 2
- Diabetologie 2015
- Analýza vztahu sérových hladin párů těžkých/lehkých řetězců imunoglobulinu (Hevylite™) k výsledkům standardní gelové elektroforézy a nefelometrického vyšetření bílkovin séra při diagnóze mnohočetného myelomu
- Ladislav Syllaba (1868–1930)
- GEORGE DAVIS SNELL
- Komentář k práci Výplach žaludku při perorální intoxikaci – sporné pohledy na problematiku autorů Večeřa R, Ondra P, Jezdinský J, Adamus M. (Čas. Lék. čes. 2015; 154(4): 174–175)
- Nové složení výborů odborných společností a spolků lékařů ČLS JEP – 2015
- Elektronické zdravotnictví nelze zavádět bez účasti lékařů
- Tradiční setkání spolků lékařů
- Spolek českých lékařů
- Plánované akce složek ČLS JEP
- Doc. MUDr. Milan Špála, CSc. – 85 let (*20. listopadu 1930)
- Jubilanti
- Rejstříky
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Výšková nemoc
- Nekardiální plicní edém, syndrom akutní dechové tísně
- Chronické srdeční selhání
- Analýza vztahu sérových hladin párů těžkých/lehkých řetězců imunoglobulinu (Hevylite™) k výsledkům standardní gelové elektroforézy a nefelometrického vyšetření bílkovin séra při diagnóze mnohočetného myelomu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



