-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Šance na vyléčení dětí s akutní lymfoblastickou leukémií stoupla v České republicev 21. století na 90 % – výsledky studie ALL IC-BFM 2002
The prospects for children with acute lymphoblastic leukemia of being cured has increased in the Czech Republic in the 21st century to 90% – outcome of the ALL-IC BFM 2002 trial
Background.
Acute lymphoblastic leukemia (ALL) is the most frequent childhood malignancy. Treatment has been unified in the middle of 1980 in the Czech Republic. In 2002–2007 children and adolescents with acute lymphoblastic leukemia were treated in an international randomized trial ALL-IC BFM 2002 in the Czech Republic. 291 patients aged 1–18 years were enrolled; infants below 1 year entered a separate trial.Methods and results.
Patients were stratified into three risk groups according to their age, initial leukocyte count, prednisone response, presence of fusion genes BCR/ABL or MLL/AF4, bone marrow D+15 and remission status D+33. The whole therapy took 24 months. Randomized late intensification compared standard BFM therapy with extended, usually more intensive experimental treatment. The median follow-up was 8.7 years. Complete remission was achieved in 97.9% patients, 1% died in remission. 11% of children relapsed, 1.7% with CNS involvement. Six children (2.1%) developed secondary malignancy. Event free survival (EFS) 8 years from diagnosis was 83.5%, overall survival (OS) 91.4%. EFS and OS of the risk groups were: standard risk: 89.4%; 98.1%; intermediate risk: 82.6%; 89.6%; high risk: 68.8%; 78.1%. Male sex and age above 10 years were adverse prognostic factors.Conclusions.
In comparison with the previous trial ALL-BFM 95, significant improvement was achieved.Keywords:
acute lymphoblastic leukemia – children – chemotherapy – protocol ALL-IC BFM 2002
Autoři: Kateřina Zdráhalová 1; Jaroslav Štěrba 2; Jiří Domanský 2; Bohumír Blažek 3; Hana Ptoszková 3; Vladimír Mihál 4; Zbyněk Novák 4; Jiří Hak 5; Daniela Procházková 6; Zdena Černá 7; Pavel Timr 8; Yahia Jabali 8; Petr Sedláček 1; Petr Smíšek 1; Zuzana Zemanová 9; Marie Jarošová 10; Alena Houdková 11; Ester Mejstříková 1; Ondřej Hrušák 1; Jan Zuna 1; Iveta Janotová 1; Jan Trka 1; Jan Starý 1
Působiště autorů: Klinika dětské hematologie a onkologie 2. LF UK a FN Motol, Praha 1; Klinika dětské onkologie FN, Brno 2; Klinika dětského lékařství FN, Ostrava 3; Dětská klinika LF UP a FN, Olomouc 4; Dětská klinika FN, Hradec Králové 5; Dětská klinika IPVZ, Masarykova nemocnice v Ústí nad Labem, Krajská zdravotní a. s. 6; Dětská klinika FN, Plzeň 7; Dětská klinika FN České Budějovice, a. s. 8; Centrum nádorové cytogenetiky, Ústav klinické biochemie a diagnostiky 1. LF UK a VFN, Praha 9; Hemato-onkologická klinika LF UP a FN, Olomouc 10; Oddělení klinické hematologie FN Motol, Praha 11
Vyšlo v časopise: Čas. Lék. čes. 2015; 154: 79-89
Kategorie: Původní práce
Souhrn
Východisko.
Akutní lymfo-blastická leukémie (ALL) je nejčastější nádorové onemocnění u dětí. Její léčba byla v České republice sjednocena v polovině osmdesátých let. V letech 2002–2007 byli v České republice děti a dospívající s akutní lymfoblastickou leukémií léčeni v mezinárodní randomizované studii ALL-IC BFM 2002. Zařazen byl 291 pacient ve věku 1–18 let, kojenci byli léčeni samostatným protokolem.Metody a výsledky.
Pacienti byli stratifikováni do tří rizikových skupin podle věku, iniciálního počtu leukocytů, odpovědi na prednisonovou předfázi, přítomnosti fúzních genů BCR/ABL nebo MLL/AF4, nálezu v kostní dřeni D+15 a dosažení remise D+33. Léčba trvala celkem 24 měsíců. Pozdní intenzifikace srovnávala formou randomizace standardní BFM léčbu s protrahovanou, většinou intenzivnější léčbou experimentální. Medián sledování byl 8,7 roku. Kompletní remise dosáhlo 97,9 % pacientů, 1 % zemřelo v remisi. Relaps prodělalo 11 % dětí, 1,7 % s postižením CNS. U šesti dětí (2,1 %) se vyvinula sekundární malignita. Pravděpodobnost přežití do selhání (EFS) 8 let od diagnózy byla 83,5% a celkového přežití (OS) 91,4%. Pro jednotlivé rizikové skupiny byly EFS a OS: standardní riziko: 89,4 %; 98,1 %; střední riziko: 82,6 %; 89,6 %; vysoké riziko: 68,8 %; 78,1 %. Mužské pohlaví a věk nad 10 let představovaly negativní prognostický faktor.Závěry.
Ve srovnání s předchozím protokolem ALL-BFM 95 došlo k významnému zlepšení výsledků léčby.Klíčová slova:
akutní lymfoblastická leukémie – děti – chemoterapie – protokol ALL-IC BFM 2002ÚVOD
Akutní lymfoblastická leukémie (ALL) tvoří 25 % zhoubných nádorů v dětském věku, a je tak nejčastějším nádorovým onemocněním v této věkové kategorii. Léčba dětí s ALL byla v České republice sjednocena v roce 1986 podle protokolů německé pracovní skupiny Berlin-Frankfurt-Münster (BFM) a realizovala se zpočátku v deseti, v současnosti v osmi leukemických centrech dětských oddělení velkých nemocnic (FN Ostrava, FN Olomouc, FN Brno, FN Hradec Králové, Masarykova nemocnice v Ústí nad Labem, FN Plzeň, Nemocnice České Budějovice a.s., FN Motol v Praze) (1). V letech 1986–2002 bylo 1066 pacientů léčeno ve třech po sobě následujících studiích ALL-BFM 83 (1986–1990, n = 336), ALL-BFM 90 (1990–1996, n = 350) a ALL-BFM 95 (1996–2002, n = 380). Šance na vyléčení tohoto onemocnění, které bez intenzivní léčby rychle vede k smrti, stoupla v České republice během tohoto období z 30 % dosahovaných v první polovině osmdesátých let 20. století na 80 % v roce 2002 (2). Od druhé poloviny devadesátých let jsou kojenci mladší 1 roku vzhledem k odlišné biologii onemocnění léčeni v samostatné mezinárodní studii protokoly Interfant (3).
Leukemické národní skupiny spolupracují v rámci mezinárodní společnosti I-BFM-SG (www.ibfm.com), pod jejíž záštitou proběhla v 15 zemích tří kontinentů v letech 2002–2007 randomizovaná studie ALL – Intercontinental-BFM 2002 (ALL IC-BFM 2002), a představitelé Pracovní skupiny pro dětskou hematologii České republiky byly jejími hlavními koordinátory. Léčba vycházela z BFM protokolů a byla diferencována dle stupně rizika hodnoceného podle věku, nádorové masy při diagnóze, rizikového genotypu a časné odpovědi na léčbu. Formou randomizované studie srovnávala standardní pozdní intenzifikaci BFM protokolů s léčbou prodlouženou a v důsledku také pro většinu dětí intenzivnější.
Předkládáme výsledky léčby českých pacientů ve studii. Efekt randomizace pozdní intenzifikace byl hodnocen v rámci celé studie a publikován (4).
SOUBOR NEMOCNÝCH A POUŽITÉ METODY
V době od 1. listopadu 2002 do 15. listopadu 2007 bylo v České republice diagnostikováno 314 dětí ve věku 0–18 let s de novo akutní lymfoblastickou leukémií; 291 z nich splnilo kritéria zařazení do studie ALL-IC BFM 2002, která proběhla v osmi centrech. Charakteristika souboru je detailně uvedena v tabulce 1. Dva z pacientů zařazených do studie měli Downův syndrom. Medián sledování u 266 žijících pacientů je k 31. prosinci 2013 8,7 (6,1–10,9) roku.
Tab. 1. Schéma protokolu ALL-IC BFM 2002 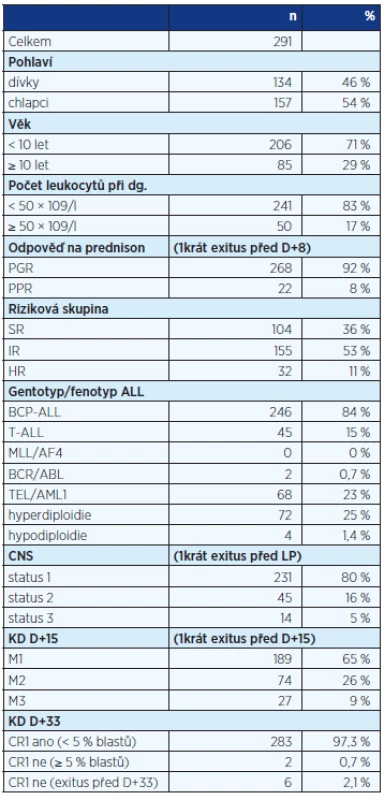
Do studie nebyli zařazeni kojenci do 1 roku věku, kteří byli léčeni podle kojeneckého protokolu Interfant 99, později Interfant 2006 (5). Zařazeni byli pouze dva pacienti s ALL s Filadelfským chromozomem (Ph+ ALL), neboť od června 2003 byl k léčbě této vysoce rizikové formy leukémie používán protokol EsPhALL kombinující chemoterapii s Imatinibem (6). Do studie nebylo celkem zařazeno 23 pacientů diagnostikovaných s ALL v daném období z následujících důvodů: závažné předléčení kortikoidy: 1, závažné genetické postižení: 1, Ph+ ALL léčená ve studii EsPhALL: 8, kojenecká ALL dětí mladších 1 roku: 9, bilineární leukémie (přítomen klon akutní lymfoblastické i myeloidní leukémie): 2, přesmyk (lineage switch) nádorového klonu do myeloidní řady v průběhu léčby: 2. Z těchto 23 dětí 13 žije v kompletní remisi; příčinou 10 exitů byly: infekce: 3, relaps nemoci: 6, smrt v indukci: 1.
Podmínkou diagnózy ALL byl nález ≥ 25 % lymfoblastů v kostní dřeni. Leukemická infiltrace mozku (CNS status 3) byla definována jako nález ≥ 5/µl jaderných buněk v mozkomíšním moku při současném nálezu lymfoblastů v nátěru z cytospinu. Za CNS postižení byla považována také leukemická infiltrace retiny nebo jinak nevysvětlitelná obrna hlavového nervu, a to i bez nálezu blastů v mozkomíšním moku. Jako CNS status 2 byl hodnocen nález blastů v mozkomíšním moku nesplňující kritéria CNS leukémie. Tito pacienti obdrželi v indukci navíc dvě intratékální aplikace metotrexátu (IT-MTX). Referenční laboratoř ve FN Motol, Praha prováděla centrálně u všech pacientů vyšetření imunofenotypu v souladu s mezinárodní EGIL klasifikací (7), stanovení DNA indexu a screeningové vyšetření fúzních genů BCR/ABL (BCR-ABL1), MLL/AF4 (KMT2A-AFF1) a TEL/AML1 (ETV6-RUNX1) metodou RT-PCR (8). Karyotyp leukemických buněk byl hodnocen v cytogenetických laboratořích fakultních nemocnic v Praze, Plzni, Hradci Králové, Olomouci a Brně s využitím standardních technik (9).
Hodnocení léčby, kritéria relapsu
Časná odpověď na léčbu (prednisone response) byla hodnocena 8. den léčby, tj. po 7 dnech perorálního podávání prednisonu a jedné intratékální aplikaci metotrexátu. Pokud počet blastů v nátěru z periferní krve byl < 1000/µl, výsledek byl hodnocen jako dobrá odpověď na prednison (prednisone good response, PGR), počet blastů ≥ 1000/ µl byl hodnocen jako špatná odpověď na prednison (prednisone poor response, PPR). Odpověď na indukční léčbu v kostní dřeni byla hodnocena 15. a 33. den od zahájení léčby. Kompletní remise (CR) byla definována nálezem méně než 5 % blastů v regenerující kostní dřeni den 33 a chyběním extramedulární leukémie. Nedosažení remise den 33 nebylo hodnoceno jako selhání léčby, ale zařadilo pacienta do vysokého rizika (HR). Rezistence na léčbu (non-response) byla definována jako nedosažení remise do začátku druhého konsolidačního HR bloku. Relaps v kostní dřeni byl definován jako nové objevení ≥ 25 % blastů v kostní dřeni. Kombinovaný relaps znamenal současný nález blastů v kostní dřeni a mimodřeňové lokalizaci.
Stratifikace do rizikových skupin
Pacienti byli řazeni do tří rizikových skupin dle následujících kritérií:
Standardní riziko (SR): PGR a věk ≥ 1 – < 6 let a iniciální počet leukocytů < 20 × 109/l, M1 (< 5 % blastů) nebo M2 (≥ 5% – < 25% blastů) kostní dřeň den 15 a M1 dřeň den 33 (všechna kritéria musí být splněna).
Střední riziko (IR): PGR a věk < 1 nebo ≥ 6 let a/nebo leukocyty ≥ 20 × 109/l a M1 nebo M2 dřeň den 15 a M1 dřeň den 33 nebo SR kritéria, ale M3 (≥ 25 % blastů) dřeň den 15 a M1 dřeň den 33.
Vysoké riziko (HR): alespoň jedno z následujících: PPR; IR a M3 dřeň den 15; M2 nebo M3 dřeň den 33; t(9;22) [BCR/ABL]; t(4;11) [MLL/AF4].
Jednotlivé rizikové skupiny byly zastoupeny následovně: SR 36 %, IR 53 %, HR 11 %.
Léčba
Schéma protokolu je uvedeno na obrázku 1 a detaily chemoterapie v tabulce 2. Pacienti SR rizikové skupiny s leukémií z B prekurzorových buněk (BCP-ALL) obdrželi pouze dvě dávky daunorubicinu v indukci ve srovnání se čtyřmi dávkami u všech ostatních. V konsolidaci byl vysokodávkovaný metotrexát (HD-MTX) podán v dávce 5 g/m2 u leukémie z T-lymfocytů (T-ALL) SR/IR rizika a 2 g/m2 u BCP-ALL SR/IR. Konsolidace pacientů vysokého rizika sestávala ze tří bloků intenzivní polychemoterapie. Ihned po skončení konsolidace byli pacienti randomizováni k experimentální nebo standardní léčbě pozdní intenzifikace. Randomizace proběhla v národním koordinačním centru ve FN Motol. V SR riziku byl protokol III opakován dvakrát v odstupu 12 týdnů v experimentálním rameni, zatímco jeden protokol II byl aplikován v kontrolním rameni. V IR byl protokol III podán třikrát v odstupu 6 týdnů v experimentálním rameni a protokol II jedenkrát v rameni kontrolním. U HR bylo experimentální rameno totožné s IR a bylo srovnáno s třemi HR bloky a protokolem II (BFM varianta léčby) v rameni kontrolním.
Tab. 2. Terapie – jednotlivé a kumulativní dávky 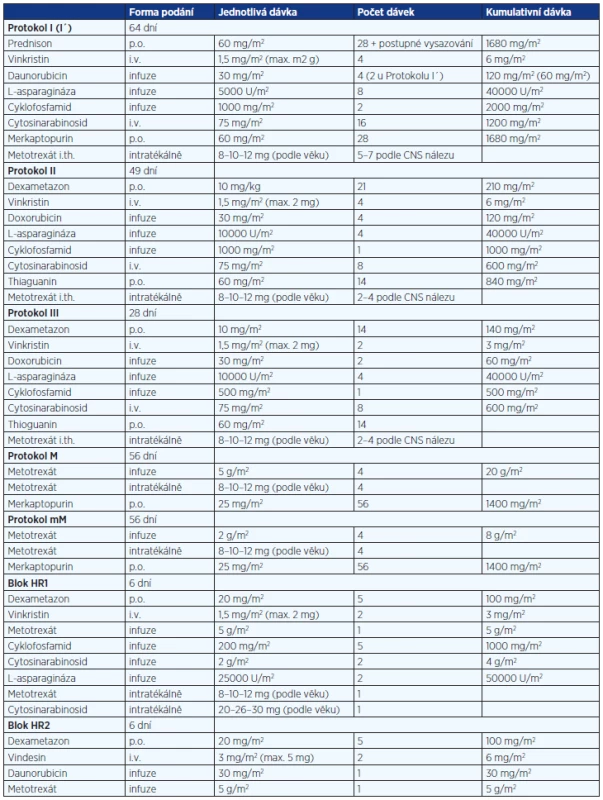
Profylaktické ozáření CNS 12 Gy bylo indikováno pouze u T-ALL a u pacientů vysokého rizika starších 1 roku. Léčebné ozáření bylo rezervováno pro iniciální leukemickou infiltraci CNS: 12 Gy pro děti ve věku 1–2 roky, 18 Gy pro děti starší 2 let.
Alogenní transplantace krvetvorných buněk (HSCT) od HLA identického sourozence byla doporučena u vysoce rizikových pacientů definovaných: nedosažením remise den 33; HR + M3 KD D+15; Ph+ALL; PPR + jakýkoli z následujících: T-ALL, proB ALL, leukocyty > 100 × 109/l, nebo t(4;11) [MLL/AF4] u dětí ve věku < 1 rok.
Statistická analýza
Křivky přežití byly konstruovány podle metody Kaplana-Meiera a rozdíly byly počítány podle log-rank testu (10, 11). Doba přežití byla hodnocena od stanovení diagnózy. Za selhání pro hodnocení celkového přežití (OS) byl považován exitus. Pro hodnocení přežití do selhání (EFS) byla za selhání považována časná smrt, smrt v remisi, relaps, sekundární malignita nebo non-response (selhání v čase nula). Pro srovnání zastoupení nominálních proměnných mezi skupinami pacientů byl použit χ2-test.
VÝSLEDKY
Výsledky léčby celého souboru pacientů a jednotlivých rizikových skupin jsou uvedeny v tabulce 3.
Tab. 3. Výsledky léčby 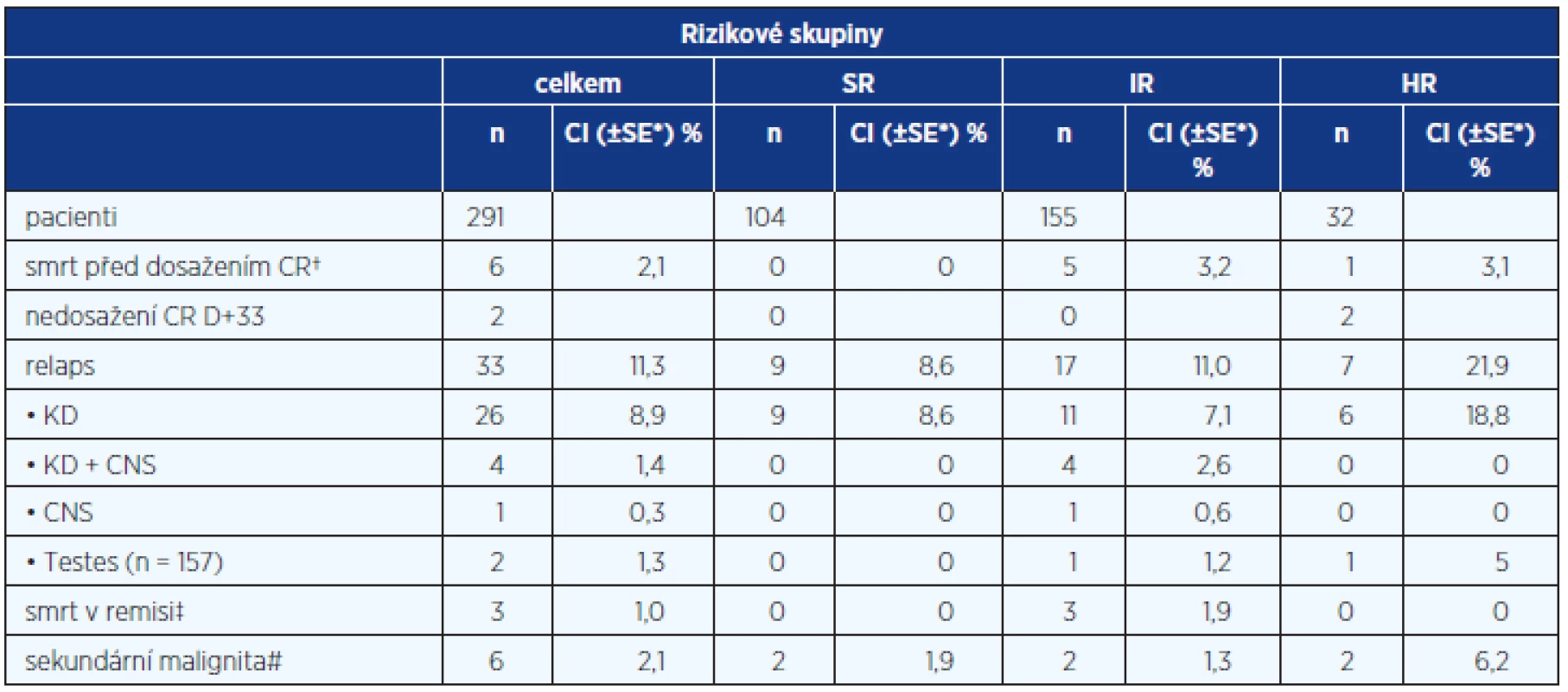
* absolutní hodnota standardní chyby (SE) byla ve všech případech < 0,26 % CR – kompletní remise, KD – kostní dřeň, CNS – centrální nervový systém, SR – standardní riziko, IR – střední riziko, HR – vysoké riziko, CI – kumulativní incidence v 8 letech od diagnózy †příčiny úmrtí: krvácení do CNS v důsledku leukémie na začátku indukce (n = 1); infekce (n = 5) ‡příčiny úmrtí: infekce (n = 3) #typy sekundárních malignit: MDS, AML: 2, potransplantační EBV indukovaný non-hodgkinský lymfom, histiocytóza z non-Langerhansových buněk; glioblastom Pravděpodobnost přežití do selhání (EFS) v 8 letech od diagnózy byla pro celou skupinu 291 pacientů 83,5% (± 2,2 %), pravděpodobnost celkového přežití (OS) 91,4 %(± 1,7 %) (graf 1). Pro jednotlivé rizikové skupiny byl EFS a OS následující: SR: 89,4% (±3,0%) a 98,1% (±1,4%); IR: 82,6 %(± 3,0 %) a 89,6 % (± 2,5 %); HR: 68,8 % (± 8,2 %) a 78,1 % (± 7,3 %) (graf 2, 3). Kompletní remise dosáhlo 97,9 % dětí, šest dětí (2,1 %) zemřelo časnou smrtí před skončením indukce, dva pacienti dosáhli remise později než den +33, nikdo nebyl non-responder. Tři pacienti (1 %) zemřeli v remisi.
Graf 1. Pravděpodobnost přežití do selhání (EFS) a pravděpodobnost celkového přežití (OS) protokolu ALL-IC BFM 2002 v 8 letech od diagnózy 
Graf 2. Srovnání EFS podle rizikových skupin 
Graf 3. Srovnání OS podle rizikových skupin 
V tabulce 4 je uvedena analýza výsledků léčby pacientů dle známých prognostických faktorů.
Tab. 4. Prognostické faktory a EFS 8 let od diagnózy 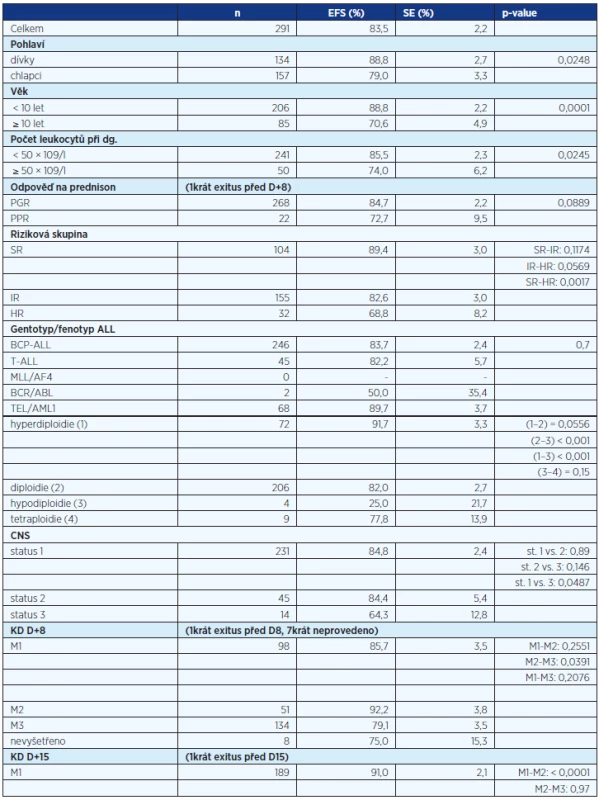
Osmiletá kumulativní incidence relapsu byla 11,3 %(± 0,04 %), izolovaného a kombinovaného relapsu CNS 1,7 % (± 0,01 %). Z 33 relapsů bylo 17 (51 %) pozdních, manifestujících se déle než 6 měsíců po skončení léčby, pět (15 %) velmi časných do 18 měsíců od diagnózy a jedenáct (33 %) časných nesplňujících kritéria velmi časného či pozdního relapsu. Dvacet (61 %) pacientů po léčbě relapsu žije.
Sekundární malignita (n = 6) byla diagnostikována s mediánem 31 měsíců od diagnózy, v pěti případech postihla chlapce, tři děti žijí (dva po HSCT) (tab. 3).
Tři pacienti s vysoce rizikovou ALL podstoupili alogenní HSCT v první remisi, všichni žijí, jeden v druhé remisi po EBV indukovaném potransplantačním nehodgkinském lymfomu.
DISKUZE
Léčba dětí s ALL v studii ALL IC-BFM 2002 znamenala významné zlepšení výsledků ve srovnání s předchozími protokoly (graf 4). Došlo k signifikantnímu zlepšení EFS i OS v důsledku snížení výskytů relapsů i toxických smrtí. Přestože bylo preventivní ozáření CNS provedeno pouze u 17 % dětí, byla kumulativní incidence CNS relapsů velmi nízká (1,7 %).
Graf 4. Srovnání EFS (a) a OS (b) protokolu ALL-IC BFM 2002 s předchozími léčebnými protokoly 
Pohlaví: Výsledky léčby byly u chlapců významně horší než u dívek (viz tab. 4) v důsledku vyššího výskytu relapsů (chlapci 23, dívky 10) i sekundárních malignit (chlapci 5, dívky 1), zatímco výskyt toxických smrtí byl stejný (4 chlapci,4 dívky). Chlapci měli více nepříznivých rizikových faktorů než děvčata (věk nad 10 let u 33 % chlapců vs. 25 % u děvčat, T-ALL 21 % vs. 9 %, iniciální počet leukocytů ≥ 50 × 109/l 21 % vs. 13 %, PPR 9 % vs. 6 %) a méně faktorů příznivých (hyperdiploidie u 29 % dívek vs. 21 % chlapců). Horší prognóza chlapců ve srovnání s dívkami je v souladu s výsledky jiných studií (12–14).
Věk a iniciální počet leukocytů: Pacienti ve věku nad 10 let při diagnóze a děti s iniciální leukocytózou ≥ 50 × 109/l měli stejně jako v předchozí studii a v souladu s publikovanými daty (13, 15, 16) horší výsledky než pacienti mladšía/nebo s nižší leukocytózou (tab. 4).
Časná odpověď na léčbu (odpověď na prednisonovou předfázi v periferní krvi a KD D+8, KD D+15): Pacienti se špatnou odpovědí na prednisonovou předfázi měli trend k horšímu EFS ve srovnání s PGR. Odběr KD den +8 nepřinesl ve srovnání s vyšetřením krve novou informaci a byl v následující studii opuštěn (tab. 4). Pacienti s méně než 5 % blastů v kostní dřeni 2 týdny od zahájení léčby měli významně lepší EFS než děti s M2 či M3 dření. Zařazení pacientů s M3 dření do vyššího rizika se mohlo podílet na zlepšení jejich výsledků léčby (žádný rozdíl v EFS mezi M2 a M3 dření D+15) (tab. 4). Časná odpověď na léčbu je významný prognostický faktor všech leukemických studií (13, 14, 17). V současnosti je hodnocena na úrovni minimální zbytkové nemoci průkazem přestaveb imunoreceptorových genů metodami molekulární biologie (PCR) a detekcí abnormálního fenotypu leukemických blastů průtokovou cytometrií (18, 19).
Imunofenotyp: Rozdíly v biologii a časné odpovědi na léčbu mezi T-ALL a BCP-ALL jsou uvedeny v tabulce 5. T-ALL postihuje častěji chlapce, její výskyt stoupá s věkem, horší časná odpověď na léčbu vede k vyššímu zastoupení pacientů vysokého rizika, vyšší iniciální leukocytóza je spojena s vyšším rizikem časné smrti. Relapsy se vyskytují časně, často ještě v průběhu chemoterapie. Tyto skutečnosti jsou v souladu s publikovanými fakty (13, 16, 20, 21). Ve srovnání s předchozím protokolem ALL-BFM 95 (EFS 64,8 %) jsme EFS u T-ALL významně zlepšili (tab. 4). Celkové přežití je ale stále horší než u BCP-ALL v důsledku neúspěšné léčby relapsů (13, 14, 16).
Rizikové skupiny: Přestože stratifikace do rizikových skupin nebyla zásadně odlišná oproti předchozímu protokolu ALL-BFM 95, ke zlepšení výsledků léčby došlo ve všech rizikových skupinách (SR 84,5 % vs. 89,4 %, IR 74,0 % vs. 82,6 %), ale k nejvýraznějšímu zlepšení došlo ve skupině vysokého rizika (43,1 % vs. 68,8 %). Vysvětlením může být zařazení intenzivní časné postindukční léčby v podobě rozšíření protokolu I o čtyřtýdenní blok obsahující cytosin-arabinosid, merkaptopurin, cyklofosfamid a IT-MTX, z které mohli těžit i pacienti s T-ALL, tvořící 50 % pacientů HR skupiny (22, 23). Současně se na velmi dobrých výsledcích HR pacientů podílelo vyřazení vysoce rizikové Ph+ALL do studie EsPhALL (6). Snížení dávky MTX z 5 na 2 g/m2 u BCP-ALL SR a IR neznamenalo nárůst mimodřeňových relapsů v CNS při současné aplikaci IT-MTX v časné udržovací léčbě (24). Experimentální ramena pozdní intenzifikace nepřinesla zlepšení výsledků léčby ve srovnání se standardní pozdní reindukcí (4).
Genotyp leukémie: Specifické strukturní i numerické chromozomové aberace mají vliv na prognózu léčby ALL (9). Sto čtyřicet dětí (48 %) souboru mělo jeden ze dvou nejčastějších genetických subtypů dětské BCP-ALL – kryptickou translokaci t(12;21) (p13;q22) s fúzním genem TEL/AML1(ETV6-RUNX1), nebo významnou hyperdiploidii s více než 50 chromozomy v leukemické buňce spojenou s výší DNA indexu ≥ 1,16 při vyšetření průtokovou cytometrií. Tyto dvě podskupiny dohromady dosahovaly EFS 91 % a OS 98 % (tab. 4), což je dokladem jejich mimořádné chemosenzitivity a současně vysvětlením excelentní prognózy dětí mezi 2–5 lety života. V tomto věku se nachází vrchol výskytu dětské ALL a oba genetické podtypy se nacházejí u dvou třetin z nich (9, 25). U dospívajících a dospělých pacientů s ALL se tyto genotypy leukémie nacházejí výjimečně, což je jedním z důvodů jejich významně horší prognózy ve srovnání s malými dětmi. Významná hypodiploidie s DNA indexem ≤ 0,8 byla vzácná (1,4 % dětí souboru), ale prognosticky velmi nepříznivá s EFS 25 %. Nepříznivé výsledky léčby tohoto podtypu leukémie vedly v současných protokolech ALL k doporučení HSCT v první remisi (9, 26).
Transplantace krvetvorných buněk: V našem souboru podstoupily alogenní HSCT pouze tři děti, což znamená 1 % pacientů zařazených do studie. Počty pacientů s vysoce rizikovou ALL indikovaných k HSCT v první remisi se pohybují mezi 5–8 %, profitují z ní zejména non-respondeři na indukční léčbu, T-ALL se špatnou časnou odpovědí na léčbu a pacienti s přetrvávající vysokou hladinou minimální zbytkové nemoci (27, 28).
Relaps: Kumulativní incidence relapsů 11,3 % je mimořádně nízká a částečně ovlivněná malým zastoupením pacientů vysokého rizika (11 %) v našem souboru pacientů (v celém souboru 5060 pacientů mezinárodní studie tvořili HR pacienti 16,7 %). Polovina relapsů (17/33) byla pozdních, kde je úspěšnost léčby vyšší než u relapsů velmi časných a časných. I díky tomu dosahuje ALL-IC BFM 2002 v 8 letech OS 91,4 %. Pacienti s relapsem byli v iniciální léčbě zařazeni nejčastěji jako střední riziko – IR (n = 17, 52 % relapsů); devět relapsů pocházelo ze skupiny standardního rizika a sedm z vysokého rizika. Charakter relapsů se lišil podle imunofenotypu. U T-ALL nastal relaps dříve, s mediánem doby od diagnózy ALL k relapsu 1,2 roky (0,4–2,3 roku), a ze čtyř pacientů nežije žádný. U BCP-ALL byly skoro 2/3 relapsů pozdní, medián od diagnózy do relapsu byl 2,6 roku (0,9–4,2 roku) a z 29 pacientů jich 69 % žije. CNS relaps (izolovaný nebo kombinovaný) postihl pouze 1,7 % dětí, přestože preventivní ozáření CNS podstoupilo jen 17 % pacientů.
Sekundární malignity: Šest dětí se sekundárními malignitami bylo v iniciální léčbě rovnoměrně léčeno podle všech tří rizik. Jejich časný vznik v rozmezí 16–46 měsíců od diagnózy ALL a složení (myeloidní malignity: 3, histiocytóza, glioblastom, potransplantační lymfom) zohledňují dobu sledování souboru 8,7 roku. Hematologické malignity a nádory mozku (bez meningeomů) se manifestují ze sekundárních nádorových onemocnění obvykle jako první. Karcinomy a meningeomy jsou diagnostikovány většinou déle než 10 let od diagnózy ALL (29). Myelodysplastický syndrom (MDS) byl typu refrakterní cytopenie s derivovaným šestým chromozomem, dítě bylo vyléčeno transplantací pupečníkové krve od nepříbuzného dárce. Ze dvou dětí s AML bylo jedno s monocytární leukémií a t(9;11) vyléčeno HSCT od nepříbuzného dárce, druhé zemřelo před zahájením chemoterapie. Histiocytární onemocnění bylo klasifikováno jako non-LCH histiocytóza a vedlo rychle k smrti, stejně jako glioblastom mozku postihnuvší pacienta s T-ALL 36 měsíců od terapeutické radioterapie krania v dávce 18 Gy pro leukemickou infiltraci CNS. Šestý pacient vyvinul EBV indukovaný nehodgkinský lymom 21 měsíců po HSCT provedené v první remisi, byl léčen chemoterapií a rituximabem a zůstává v remisi ALL (9 let) i lymfomu (6 let).
ZÁVĚR
Léčba podle protokolu ALL-IC BFM BFM 2002 znamenala další zlepšení výsledků léčby dětské lymfoblastické leukémie v České republice, s EFS přesahujícím 80 % a celkovým přežitím 90 %. Vyšší úspěšnosti léčby bylo dosaženo pro celý soubor pacientů, ale zejména u podskupin s horší prognózou jako T-ALL nebo HR ALL. Ve srovnání s předchozím protokolem bylo dosaženo lepších výsledků jak díky účinnější chemoterapii (častější dosažení kompletní remise, méně relapsů), tak zlepšením podpůrné léčby (nižší výskyt toxických smrtí). Naše celostátní výsledky jsou součástí výsledků mezinárodního protokolu ALL-IC BFM 2002, do kterého bylo zahrnuto celkem přes 5000 pacientů. V rámci celého mezinárodního souboru byla pravděpodobnost přežití bez příhody (EFS) v 5 letech od diagnózy 74 % a pravděpodobnost přežití (OS) 82 %. Výsledky randomizace celé mezinárodní studie ukazují, že intenzivnější pozdní intenzifikace nepřinesla vyšší úspěšnost léčby (4). Většina účastnických zemí zlepšila celkové léčebné výsledky ve srovnání s předchozími studiemi. Přesto je ale EFS a OS studie nižší než jsou výsledky vedoucích leukemických světových skupin, které dosahují přežití 90 %. Důvodem je vyšší výskyt toxických smrtí v ALL IC BFM 2002 studii, což ale nebyla situace České republiky. V sledovaném období 2002–2007 bylo celkem v České republice diagnostikováno 314 dětí s ALL včetně kojenců a jejich přežití bylo 88,8 % (graf 5). Naše výsledky léčby jsou tak srovnatelné se současnými západoevropskými studiemi a studiemi prováděnými v USA (30–32). V současné době směřuje další vývoj v léčbě dětské ALL k přesnější stratifikaci pacientů do rizikových skupin pomocí molekulárně genetických metod měřením minimální reziduální nemoci (MRD) v definovaných časných fázích léčby (33). Cílem je větší individualizace léčby.
Graf 5. Pravděpodobnost přežití do selhání (EFS) a pravděpodobnost celkového přežití (OS) všech pacientů s ALL ve věku 0–18 let v letech 2002–2007 8 letech od diagnózy 
Tab. 5. Srovnání T-ALL a BCP-ALL) 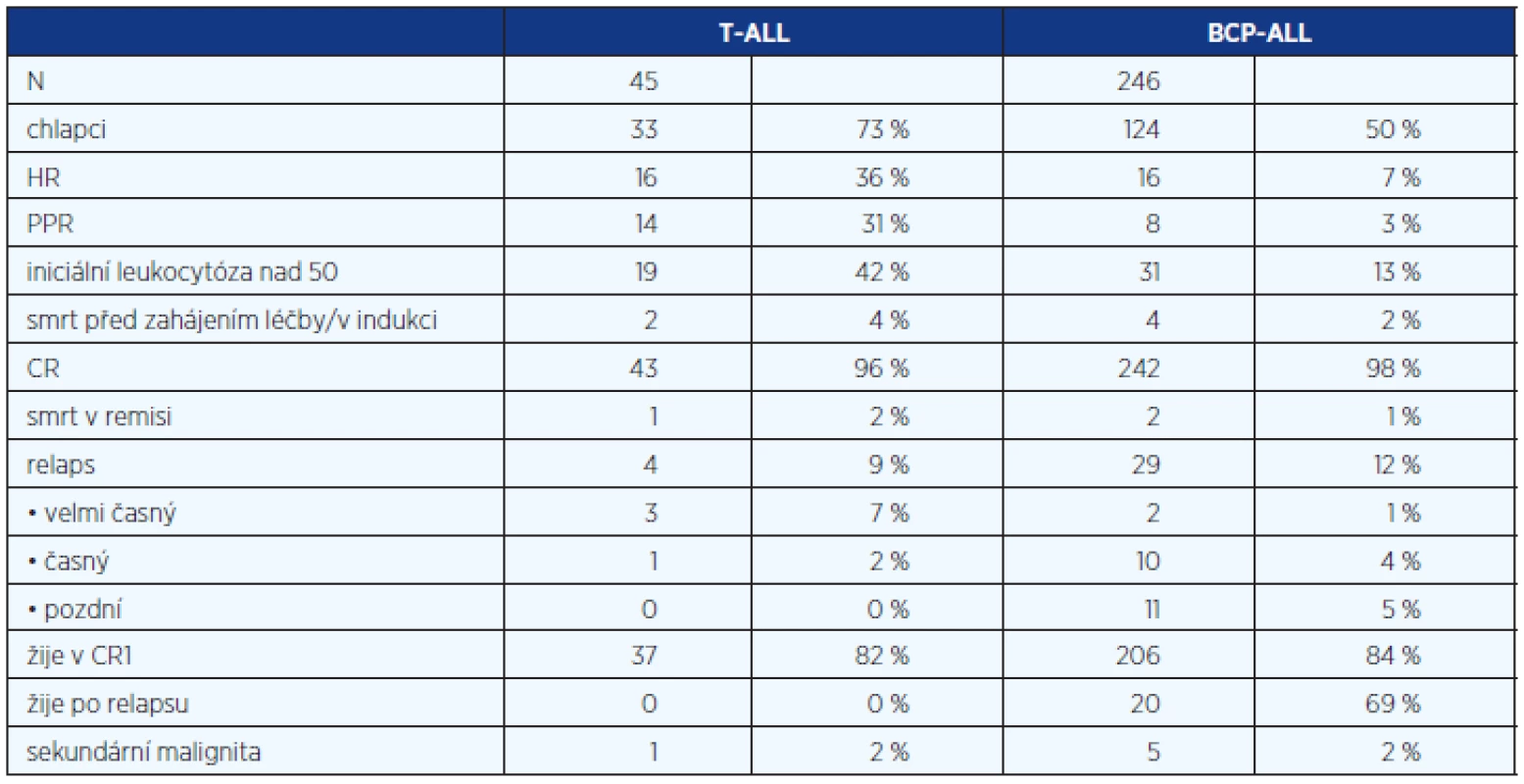
Zkratky
ALL akutní lymfoblastická leukémie
BCP-ALL akutní lymfoblastická leukémie z B prekurzorových buněk
BFM pracovní skupina Berlin-Frankfurt-Münster
CR kompletní remise
EFS pravděpodobnost přežití do selhání
HD-MTX vysokodávkovaný metotrexát
HR vysoké riziko
HSCT transplantace kmenových buněk krvetvorby
IR střední riziko
IT-MTX intratékálně podaný metotrexát
KD kostní dřeň
MDS myelodysplastický syndrom
MRD minimální reziduální nemoc
OS celková pravděpodobnost přežití
PGR dobrá odpověď na prednison (prednisone good response)
PPR špatná odpověď na prednison (prednisone poor response)
SR standardní riziko
Konflikt zájmů: žádný.
ADRESA PRO KORESPONDENCI:
prof. MUDr. Jan Starý, DrSc.
Klinika dětské hematologie a onkologie2. LF UK a FN Motol
V Úvalu 84, 150 06 Praha 5
e-mail: jan.stary@lfmotol.cuni.cz
Zdroje
1. Riehm H, Gadner H, Henze G, et al. Results and significance of six randomized trials in four consecutive ALL-BFM studies. Haematol Blood Transfus 1990; 33 : 439–450.
2. Stary J, Jabali Y, Trka J, et al. Czech Pediatric Hematology working group, Long-term results of treatment of childhood acute lymphoblastic leukemia in the Czech Republic. Leukemia 2010; 24 : 425–428.
3. Jabali Y, Starý J, Hak J, et al. Acute lymphoblastic leukemia in infants: a decade of experience in the Czech Republic. Med Pediatr Oncol 2000; 34 : 493–495.
4. Stary J, Zimmermann M, Campbell M, et al. Intensive chemotherapy for childhood acute lymphoblastic leukemia: results of the randomized intercontinental trial ALL IC-BFM 2002. J Clin Oncol 2014; 32 : 174–184.
5. Pieters R, Schrappe M, De Lorenzo P, et al. A treatment protocol for infants younger than 1 year with acute lymphoblastic leukaemia (Interfant-99): an observational study and multicentre randomised trial. 2007 Lancet; 370 : 240–250.
6. Biondi A, Schrappe M, De Lorenzo P, et al. Imatinib after induction for treatment of children and adolescents with Philadelphia-chromosome-positive acute lymphoblastic leukaemia (EsPhALL): a randomised, open-label, intergroup study. Lancet Oncol 2012; 13 : 936–945.
7. Bene MC, Castoldi G, Knapp W, et al. Proposals for the immunological classification of acute leukemias. European Group for the Immunological Characterization of Leukemias (EGIL). Leukemia 1995; 9 : 1783–1786.
8. Trka J, Zuna J, Haškovec C, et al. Detekce hybridních genů BCR/ABL, MLL/AF4 a TEL/AML1 a sledování minimální residuální nemoci u dětských pacientů s akutní lymfoblastickou leukémií. Čas. Lék. čes. 1999; 138 : 12–17.
9. Harrison CJ, Moorman AV, Barber KE, et al. Interphase molecular cytogenetic screening for chromosomal abnormalities of prognostic significance in childhood acute lymphoblastic leukaemia: a UK Cancer Cytogenetics Group Study. Br J Haematol 2005; 129 : 520–530.
10. Kaplan EL, Meier P. Non-parametric estimation from incomplete observations. J Am Stat Assoc 1958; 53 : 457–481.
11. Mantel N. Evaluation of survival data and two new rank order statistics arising in its consideration. Cancer Chemother Rep 1966; 50 : 163–170.
12. Puj CH, Boyett JM, Relling MV, et al. Sex differences in prognosis for children with acute lymphoblastic leukemia. J Clin Oncol 1999; 17 : 818–824.
13. Möricke A, Zimmermann M, Reiter A, et al. Long-term results of five consecutive trials in childhood acute lymphoblastic leukemia performed by the ALL-BFM study group from 1981 to 2000. Leukemia 2010; 24 : 265–284.
14. Gaynon PS, Angiolillo AL, Carroll WL et al. Long-term results of the Children’s Cancer Group studies for childhood acute lymphoblastic leukemia 1983–2002: a Children’s Oncology Group Report.; Children’s Oncology Group. Leukemia 2010; 24 : 285–297.
15. Starý J, Gajdoš P, Hrstková H, et al. Třetí celostátní protokol léčby dětské akutní lymfoblastické leukemie znamenal další zlepšení výsledků. Studie ALL-BFM 95 u dětí v České republice 1995-2002. Transfuze a hematologie dnes 2008; 14 : 102–109.
16. Pui CH, Pei D, Sandlund JT, et al. Long-term results of St Jude Total Therapy Studies 11, 12, 13A, 13B, and 14 for childhood acute lymphoblastic leukemia. Leukemia 2010; 24 : 371–382.
17. Lauten M, Möricke A, Beier R, et al. Prediction of outcome by early bone marrow response in childhood acute lymphoblastic leukemia treated in the ALL-BFM 95 trial: differential effects in precursor B-cell and T-cell leukemia. Haematologica 2012; 97 : 1048–1056.
18. Froňková E, Trka J. Detekce minimální reziduální nemoci u akutních lymfoblastických leukemií pomocí kvantifikace přestaveb genů pro imunoglobuliny a T-buněčné receptory: jak se vyhnout špatné interpretaci výsledků. Transfuze a hematologie dnes 2005; 11 : 110–115.
19. Mejstříková E, Froňková E, Kalina T, et al. Detection of residual B precursor lymphoblastic leukemia by uniform gating flow cytometry. Pediatr Blood Cancer 2010; 54 : 62–70.
20. Pullen J, Shuster JJ, Link M, et al. Significance of commonly used prognostic factors differs for children with T cell acute lymphocytic leukemia (ALL), as compared to those with B-precursor ALL. A Pediatric Oncology Group (POG) study. Leukemia 1999; 13 : 1696–1707.
21. Aricò M, Basso G, Mandelli F, et al. Good steroid response in vivo predicts a favorable outcome in children with T-cell acute lymphoblastic leukemia. The Associazione Italiana Ematologia Oncologia Pediatrica (AIEOP). Cancer 1995; 75 : 1684–1693.
22. Möricke A, Schrauder A, Zimmermann M, et al. Major improvement of outcome in pediatric high-risk acute lymphoblastic leukemia by addition of BFM chemotherapy element „Phase IB“: A comparative data analysis of trials ALL-BFM 95 and ALL-BFM 2000. ASH Annual Meeting Abstracts 2011; 118 : 1504.
23. Seibel NL, Steinherz PG, Sather HN, et al. Early postinduction intensification therapy improves survival for children and adolescents with high-risk acute lymphoblastic leukemia: a report from the Children’s Oncology Group. Blood 2008; 111 : 2548–2555.
24. Aricò M, Valsecchi MG, Rizzari C, et al. Long-term results of the AIEOP-ALL-95 Trial for Childhood Acute Lymphoblastic Leukemia: insight on the prognostic value of DNA index in the framework of Berlin-Frankfurt-Muenster based chemotherapy. J Clin Oncol 2008; 26 : 283–289.
25. Zuna J, Hrusák O, Kalinová M, et al. Significantly lower relapse rate for TEL/AML1-positive ALL. Leukemia 1999; 13 : 1633–1636.
26. Nachman JB, Heerema NA, Sather H, et al. Outcome of treatment in children with hypodiploid acute lymphoblastic leukemia. Blood 2007; 110 : 1112–1125.
27. Balduzzi A, Valsecchi MG, Uderzo C, et al. Chemotherapy versus allogeneic transplantation for very-high-risk childhood acute lymphoblastic leukaemia in first complete remission: comparison by genetic randomisation in an international prospective study. Lancet 2005; 366 : 635–642.
28. Schrauder A, Reiter A, Gauner H, et al. Superiority of allogeneic hematopoietic stem-cell transplantation compared with chemotherapy alone in high-risk childhood T-cell acute lymphoblastic leukemia: results from ALL-BFM 90 and 95. J Clin Oncol 2006; 24 : 5742–5749.
29. Schmiegelow K, Levinsen MF, Attarbaschi A, et al. Second malignant neoplasms after treatment of childhood acute lymphoblastic leukemia. J Clin Oncol 2013; 31 : 2469–2476.
30. Hunger SP, Lu X, Devidas M, et al. Improved survival for children and adolescents with acute lymphoblastic leukemia between 1990 and 2005: A report from the Children’s Oncology Group. J Clin Oncol 2012; 30 : 1663–1669.
31. Schrappe M, Valsecchi MG, Bartram CR, et al. Late MRD response determines relapse risk overall and in subsets of childhood T-cell ALL: results of the AIEOP-BFM ALL 2000 study. Blood 2011; 118 : 2077–2084.
32. Conter V, Bartram CR, Valsecchi MG, et al. Molecular response to treatment redefines all prognostic factors in children and adolescents with B-cell precursor acute lymphoblastic leukemia: results in 3184 patients in the AIEOP-BFM ALL 2000 study. Blood 2010; 115 : 3206–3214.
33. Fronkova E, Mejstrikova E, Avigad S, et al. Minimal residual disease analysis in the non-MRD-based ALL IC-BFM 2002 protocol for childhood ALL: is it possible to avoid MRD testing? Leukemia 2008; 22 : 989–997.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Mezinárodní den vrozených vad
- Kniha
- ALLAN MACLEOD CORMACK (1924–1998)
- LAUREÁT MAYDLOVY PŘEDNÁŠKY SPOLKU ČESKÝCH LÉKAŘŮ V PRAZE
- PLÁNOVANÉ AKCE SLOŽEK ČLS JEP
- SPOLEK ČESKÝCH LÉKAŘŮ
- Analýza informovaného konsenzu a jeho role v moderní medicíně
- Pozitivní aspekty stáří: senioři a humor
- Možnosti využití technik plicní rehabilitace pro léčbu snížené síly dýchacích svalů
- Masové zneužívání žen armádami v minulosti dávné i nedávné
- Šance na vyléčení dětí s akutní lymfoblastickou leukémií stoupla v České republicev 21. století na 90 % – výsledky studie ALL IC-BFM 2002
-
Ženská androgenetická alopecie, přehled příčin a léčebných možností
Mezoterapie – vlastní studie - Wáclav Leopold Gruber(1814–1890)
- 16. ázijský kongres o lyzozómových chorobách
- 8. celostátní konference Akné a obličejové dermatózy
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Možnosti využití technik plicní rehabilitace pro léčbu snížené síly dýchacích svalů
-
Ženská androgenetická alopecie, přehled příčin a léčebných možností
Mezoterapie – vlastní studie - Šance na vyléčení dětí s akutní lymfoblastickou leukémií stoupla v České republicev 21. století na 90 % – výsledky studie ALL IC-BFM 2002
- Pozitivní aspekty stáří: senioři a humor
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání






