-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Současné možnosti a perspektivy léčby akromegalie*
Contemporary options and perspectives in the treatment of acromegaly
Acromegaly, if untreated, leads to numerous complications and premature death of patients. In recent years, significant changes in the treatment of acromegaly were achieved. The surgical approach was innovated, what allows completely selective removal of most microadenomas without any damage of the pituitary and safe debulking of the tumor mass in macroadenomas. Radiosurgery took the first place among irradiation methods, in our conditions it is the irradiation by the Leksell gamma knife. It allows selective irradiation of an adenoma without damaging the surrounding tissue. However, its effect on the secretory activity of the adenoma remains to be long lasting. Before this effect is attained, it is necessary to suppress the secretory activity pharmacologically. The infrequently effective, but economically advantageous and comfortable for patients is cabergoline, which is administered in tablet form. If cabergolin is not efficient, depot injections of somatostatin analogues – octreotide LAR and lanreotide autogel or their combination with cabergoline are used. The most efficient but financially costly is pegvisomant, blocking the receptors for growth hormone. In our conditions it is reserved for patients unresponsive to other treatments. With sufficient dosage it is possible to normalize hormonal activity of acromegly in 95 % of patients. New forms of the drugs as octreotide implants, oral octreotide octreolin or a new blocker of growth hormone receptors ATL-1103 are in the development.
Keywords:
acromegaly – Leksell gamma-knife – cabergoline – octreotide LAR – somatuline autogel – pegvisomant
Autoři: Josef Marek
Působiště autorů: III. interní klinika 1. LF UK a VFN, Praha
Vyšlo v časopise: Čas. Lék. čes. 2014; 153: 131-136
Kategorie: Přehledový článek
*Článek je věnován k 90. narozeninám prof. MUDr. Vratislava Schreibera, DrSc.
Souhrn
Akromegalie, je-li neléčena, vede k četným orgánovým komplikacím a předčasnému úmrtí nemocného. V posledních letech doznala léčba akromegalie výrazných změn. Zdokonalil se operační přístup, který umožňuje u mikroadenomů ve většině selektivní odstranění bez poškození hypofýzy a u makroadenomů odstranění větší části nádorové masy. V ozáření zaujala prvé místo radiochirurgie, v našich podmínkách je to ozáření adenomu nebo jeho zbytku Leksellovým gama-nožem. Umožňuje selektivní ozáření adenomu bez poškození okolních tkání. Jeho účinek na sekreční aktivitu buněk adenomu je však pozvolný. Do tohoto účinku je nutné tlumit sekreční aktivitu akromegalie medikamentózně. K dispozici máme několik druhů léčebných přípravků: nejméně často účinné, ale ekonomicky nejvýhodnější a pro nemocné nejpohodlnější je kabergolin podávaný v tabletách. Není-li dostatečně účinný, léčíme depotními injekcemi somatostatinových analogů – oktreotidu LAR nebo lanreotidu autogel, případně jejich kombinací se zmíněným kabergolinem. Nejúčinnější, ale finančně nejnákladnější je blokátor receptorů pro růstový hormon pegvisomant, který je u nás vyhrazen pro nemocné nereagující na jinou léčbu. Při dostatečném dávkování se podaří znormalizovat hormonální aktivitu akromegalického procesu u 95 % nemocných. Zkouší se nové formy uvedených přípravků jako oktreotidové implantáty, perorální oktreotid oktreolin či nový blokátor receptorů pro růstový hormon ATL-1103..
Klíčová slova:
akromegalie – Leksellův gama nůž – kabergolin – oktreotid LAR – somatulin autogel – pegvisomantPROČ LÉČIT AKROMEGALII
Akromegalie je onemocnění, které, pokud je neléčeno, zkracuje život postižených v průměru o 10 let ve srovnání s normální populací a způsobuje řadu komplikací (tab. 1) (1). Prevalence akromegalie se pohybuje v jednotlivých sestavách mezi 38 a 69 nemocných na milion obyvatel. Incidence se udává 2,8–4,0 nemocných/1 mil. obyvatel/rok. Vyskytuje se ve všech obdobích dospělého věku. Charakteristické pro diagnostiku je, že mezi začátkem klinických příznaků a diagnózou uplyne několik let – u mladých jedinců pod 30 let je to v průměru 6 let, u nemocných nad 50 let však dokonce 12 let (2). Snahou by mělo být akromegalii co nejdříve rozpoznat a co nejefektivněji léčit.
Tab. 1. Komplikace neléčené akromegalie 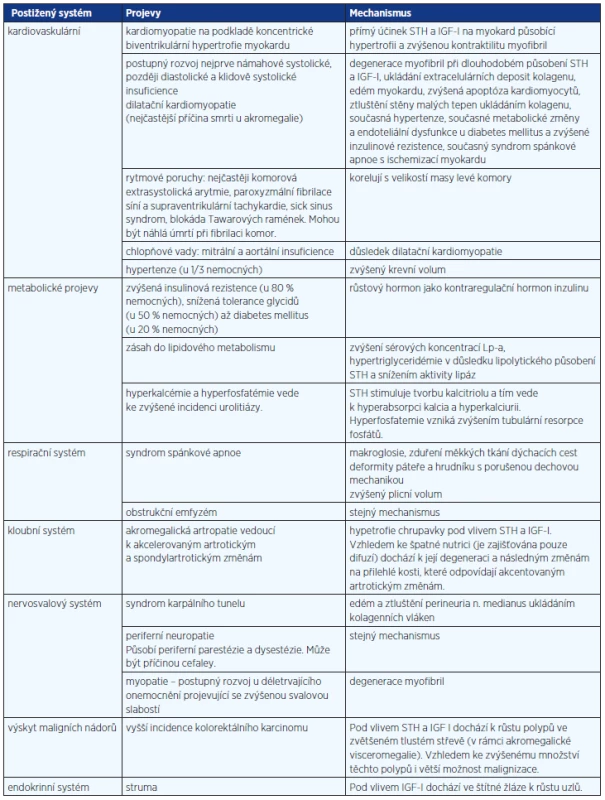
Za kritéria pro úspěšnou léčbu akromegalie se považuje: 1. kompletní odstranění adenomu s hormonální normalizací zvýšené sekrece růstového hormonu, 2. zachování normální funkce hypofýzy, 3. nepoškodit nemocného nežádoucími účinky léčby. Normalizaci hormonální aktivity hodnotíme podle dosažení tzv. bazálních hladin růstového hormonu (hladiny růstového hormonu mimo jeho pulzy) a podle normalizace hladin IGF I (inzulinu podobného faktoru I), které jsou příslušné věku nemocných (3).
NEUROCHIRURGICKÁ LÉČBA
V léčbě akromegalie se nám osvědčil postup, který uvádíme na obrázku 1. Za základ léčby považujeme neurochirurgickou operaci na pracovišti vybaveném moderní technikou (endoskop, peroperační magnetická rezonance) se specializovanými neurochirurgy pro hypofyzární operace. Světová neurochirurgická asociace považuje za specializovaného neurochirurga takového, který operuje ročně hypofýzu alespoň u 50 nemocných. Z doporučených postupů pro léčbu akromegalie z roku 2009 (4) vyplývá, že operace by se měla indikovat tam, kde lze očekávat odstranění adenomu, zatímco u adenomů s nepravděpodobností úspěchu operační léčby je indikovaná od začátku léčba medikamentózní. Sami se domníváme, že má význam operovat i takové adenomy, kde není naděje na jejich úplné odstranění. I neúplné odstranění nádorové masy (tzv. debulking) zvyšuje efekt následné medikamentózní a radiační léčby (5). Samozřejmá je nutnost operace u adenomů, které svým růstem ohrožují zrakovou dráhu. Úspěch neurochirurgické léčby závisí především na velikosti a lokalizaci adenomu. Na specializovaných neurochirurgických pracovištích se daří normalizace hormonální aktivity akromegalie u intraselárních mikroadenomů(do 10 mm v průměru) v 75–95 %, u neinvazivně rostoucích makroadenomů do 2 cm v průměru se udává efekt v 40–68 % a u makroadenomů větších než 2 cm v průměru klesá úspěšnost pod 20 % (6). Dosud nevyjasněnou otázkou je, zda výsledky operační léčby může zlepšit aplikace somatostatinových analogů několik měsíců před operací. Zprávy v literatuře jsou rozporné. Snad tento rozpor vyjasní v současné době probíhající velká celonárodní polská studie.
Obr. 1. Algoritmus léčby nemocného s aktivní akromegalií 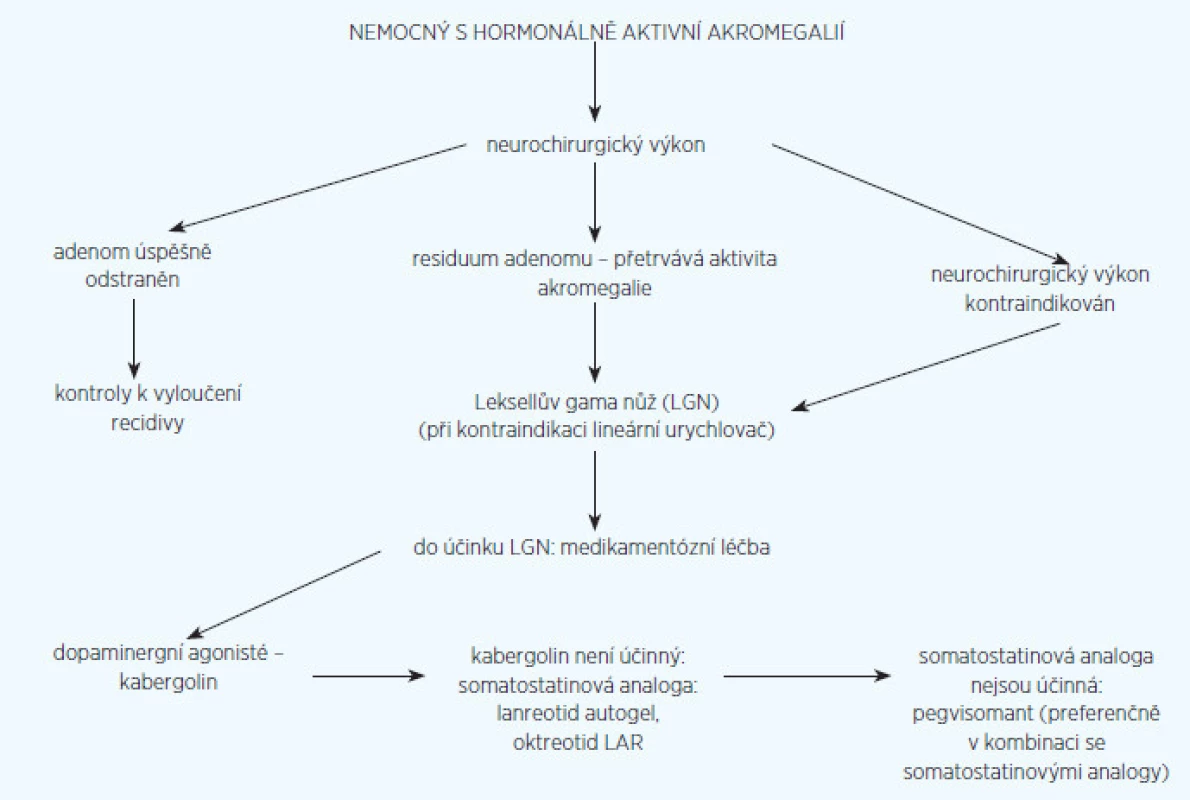
RADIAČNÍ LÉČBA
U nemocných, kde není možné pro kontraindikace provést operaci v celkové anestezii a u nemocných s residuem adenomu po operaci, doporučujeme radiochirurgickou léčbu, konkrétně na našem pracovišti ozáření Leksellovým gama nožem (7). Radiační léčba je obvykle v doporučených postupech uváděna až na poslední místo – u adenomů, které nebylo možné odstranit operací a nereagují na medikamentózní léčbu (4). Při konvenčním frakcionovaném ozáření dochází skutečně ve většině případů po několika letech k rozvoji hypopituitarismu. Hypopituitarismus se však objevuje v písemnictví i po ozáření gama-nožem. Je to v případě, kde se překračuje maximální radiační dávka na zdravou hypofyzární tkáň v okolí adenomu a na distální část hypofyzární stopky. Podle našich zkušeností by tato dávka neměla překročit 15 Gy (8); někteří autoři však zdůrazňují nutnost použít radiační dávky ještě nižší ( 9).
Ozáření má dvojí účinek. Bezprostředně se utlumí mitotická aktivita buněk adenomu a ten dále neroste, naopak dochází k jeho pozvolnému zmenšování. Kromě toho apoptózou sekrečních buněk dochází k postupnému odeznění sekreční aktivity. Podle našich zkušeností (10) dojde k normalizaci sérových hladin IGF I (jako jednoho z hlavních kritérií sekreční aktivity adenomu) v průběhu 1. roku u 25 % ozářených, v průběhu 3 let u 45 %, v průběhu 5 let u 68 % a v průběhu 8 let u 85 %. Do doby normalizace sekreční aktivity ozářením je nemocné třeba léčit medikamentózně. Výhodou ozáření je, že nákladná medikamentózní léčba je časově limitovaná a není doživotní jako u nemocných bez ozáření.
Podle zkušenosti v Nizozemí (11) je průměrná doba léčby nemocného s akromegalií 33 let a v případě operace a medikamentózní léčby jsou náklady na jeho terapii během této doby po přepočtu současným kursem 12 000 000 Kč. U nás zkracuje ozáření dobu léčby na 54 měsíců a naše průměrné náklady jsou za tu dobu přibližně 2 000 000 Kč.
Ozáření adenomu gama nožem má ovšem také svoje podmínky. Adenom nesmí být v kontaktu se zrakovou dráhou, nesmí přesahovat velikost 25 mm v největším průměru, musí být odlišitelný na MR od zdravé hypofyzární tkáně a nejedná se o cystický adenom.
MEDIKAMENTÓZNÍ LÉČBA
U našich nemocných se uplatňuje především v době mezi ozářením adenomu a jeho účinkem na hormonální aktivitu. Má ovšem svoji nezastupitelnou úlohu i tam, kde nebylo ozáření nebo operace a následné ozáření možné.
Máme v současné době tři skupiny léků, které se v léčbě akromegalie uplatňují: dopaminergní agonisté, somatostatinová analoga a blokátor receptoru pro růstový hormon.
Dopaminergní agonisté
V klinické praxi se dnes výhradně používá kabergolin (u nás přípravek Dostinex® tbl), protože jeho účinnost je podstatně větší než u dalších léků této skupiny (12). Jeho použití není uvedeno ve firemním souhrnu o přípravku (SPC), a je proto „off label“. Je to však léčba pro nemocné nejméně zatěžující – tablety s průměrným dávkováním 3krát 2 tablety týdně – léčba je většinou dobře snášena a je také nejméně nákladná. Dostatečný efekt je však možné očekávat jen u menší části méně aktivních akromegalií. Podle Abse et al. (13) dosáhneme normalizace sekreční aktivity u 30 % nemocných v případě, že hladiny IGF I před léčbou jsou nižší než 750 mg/ml. Má však svou důležitou úlohu při kombinační léčbě s jinými přípravky (viz níže).
Z nežádoucích účinků mohou být hypotenzivní reakce, dyspeptické potíže, zácpa, únava a spavost, závratě, bolesti hlavy.
Depotní somatostatinová analoga
Tradičně se u nás používají dvě depotní somatostatinová analoga: oktreotid LAR (Sandostatin LAR®) injekce 20 a 30 mg k i.m. aplikaci jednou za 4 týdny a lanreotid autogel (Somatulin autogel®) injekce 60 a 120 mg k hlubokému s.c. podání, rovněž 1krát za 4 týdny – je-li však účinnost 1krát za 4 týdny dobrá, je možné u lanreotidu autogel aplikaci jedné injekce prodloužit na 6–8 týdnů. V metaanalýze komparativních studií byla zjištěna stejná účinnost obou přípravků (14), v individuálních případech může být reakce na jeden z obou přípravků lepší než na druhý. Výhodou lanreotidu autogel je podkožní aplikace přípravku – přípravek si mohou aplikovat sami nemocní nebo jejich rodinní příslušníci.
Uvedená somatostatinová analoga brzdí tvorbu a sekreci růstového hormonu v adenomech. Podmínkou je navázání na somatostatinové receptory v buněčné stěně adenomu a následné vnikání (internalizace) tohoto komplexu do buňky. Somatostatinové receptory se dělí na pět základních subtypů: sst 1 až sst 5. U většiny adenomů secernujících růstový hormon převládá subtyp sst 2, na který se uvedená somatostatinová analoga nejlépe váží a snadno vnikají do buňky. U menší části adenomů u akromegalie však převažuje exprese subtypu sst5 (15).
Je obtížné odpovědět na otázku, u kolika procent léčených nemocných jsou somatostatinová analoga účinná. Studie nejsou srovnatelné výběrem nemocných – aktivitou akromegalie, jejich předchozí léčbou, velikostí aplikované dávky ani délkou léčby (účinnost somatostatinových analogů stoupá s dobou jejich podávání). Po 4 letech léčby se pohybuje podle jednotlivých autorů účinnost mezi 34 % (16) a 79 % (17). V metaanalýze udává Freda účinek oktreotidu LAR 66% (18). Je zajímavé, že ženy mají v průměru o 47 % vyšší hladiny oktreotidu než muži, muži by tak měli dostávat v průměru o 14 mg měsíčně vyšší dávku než ženy (19). Také u obézních stoupá hladina oktreotidu v krvi po jeho aplikaci méně (o 3,4 % na každou jednotku BMI) (19).
Je možné vystupňovat účinek somatostatinových analogů stupňováním dávky? Podle firemních souhrnů o přípravcích (SPC) je maximální doporučená dávka oktreotidu za 4 týdny 30 mg a maximální doporučená dávka lanreotidu autogel 120 mg. Celoitalská studie (20) vyzkoušela u nemocných rezistentních na 30 mg oktreotidu dávku 60 mg/4 týdny a zjistila, že 36 % takto léčených znormalizovalo hladinyIGF I v průběhu půl roku. Platí totéž pro lanreotid autogel? O tom je dosud málo údajů, publikovaných pouze jako kazuistiky.
Účinnost somatostatinových analog je možné zvýšit jejich kombinací s kabergolinem. Tato kombinace potlačí hormonální aktivitu až u 50 % nemocných, rezistentních na samotná somatostatinová analoga (21).
Z nežádoucích účinků somatostatinových analog jsou nejčastější abdominální potíže – průjmy, dyspeptické obtíže, nauzea až zvracení, výjimečně i abdominální křeče. Komplikací může být vznik cholecystolitiázy nebo žlučníkového bahna.
U rezistentních akromegalií na současná somatostatinová analoga se zkouší nyní i u nás dostupný nový somatostatinový analog pasireotid (Signifor®). Zatímco oktreotid i lanreotid účinkují převážně na somatostatinové receptory adenomu subtypu sst 2, pasireotid se váže především na subtyp sst 5, a může tak být účinný u adenomů, které mají více exprimovaný subytp sst 5 a nikoliv sst 2 (22). Širší použití pasireotidu však brání jeho vysoká cena. Nežádoucí účinky má obdobné jako dříve zmíněná somatostatinová analoga, navíc však vede k hyperglykémii až manifestaci diabetes mellitus.
Vývojovou perspektivou jsou oktreotidové implantáty. Peleta 84 mg oktreotidu v hydrogelové kapsli implantovaná pod kůži paže umožňuje postupnou difuzi oktreotidu v průběhu 6 měsíců. Účinek takové pelety by měl být stejný, jako je účinek okterotidu LAR v i.m. injekcích (23).
V klinickém zkoušení III. fáze je perorální forma oktreotidu – oktreolin (24). Přidaná substance nazvaná „transient permeability enhancer“ umožňuje její vstřebání střevní sliznicí.
Blokátor receptorů pro růstový hormon pegvisomant
Pegvisomant (Somavert® inj.s.c. 10, 15 a 20 mg) je nejúčinnějším lékem k potlačení hormonální aktivity akromegalie. Podle klinických zkoušek se to pegvisomantem podaří u 92 % léčených (25). Předpokladem je však dostatečné dávkování a u některých nemocných k dosažení účinků je zapotřebí vyšší dávky než 30 mg denně uvedených jako maximální dávka ve firemním SPC. Vzhledem k nejlepší účinnosti pegvisomantu na hormonální aktivitu u akromegalií by bylo logické jej použít jako prvého léku. Tomu však brání jeho vysoká cena, která při aplikaci 30 mg pegvisomantu denně dosahuje téměř 2 000 000 Kč ročně. Vzhledem k tomu je u nás preskripce omezena pouze na čtyři centra v republice.
Pegvisomant je odvozený od růstového hormonu – jeho molekula má pouze devět odlišných aminokyselin, z nichž jedna působí blokádu receptorů pro růstový hormon ve tkáních a zbývajících osm zvyšuje aviditu pegvisomantu k těmto receptorům, aby se preferenčně uplatnila jeho vazba před růstovým hormonem. Efekt pegvisomantu se pozná pouze podle poklesu hladin IGF-I, sekrece růstového hormonu z hypofýzy není ovlivněna a jeho hladiny zůstávají v cirkulaci zvýšené.
Možným nežádoucím účinkem je zvýšení jaterních transamináz AST a ALT. Pět až detsetinásobný vzestup se vyskytuje u 7,4 % léčených (26), při těchto vysokých hladinách se doporučuje léčbu přerušit. Vzestupy transamináz jsou plně reverzibilní a nevedou k poškození jater. Menší vzestupy transamináz jsou častější a nepovažují se za indikaci k přerušení léčby.
Důsledkem periferního působení pegvisomantu je i skutečnost, že hypofyzární adenom může v průběhu léčby pegvisomantem pokračovat v růstu. V evropské Acrostudy (27) byla progrese adenomu mezi 469 nemocnými pozorována u 5,1 %. Růstu adenomu se dá předejít předchozím ozářením anebo kombinací s depotními somatostatinovými analogy.
Kombinace s depotními somatostatinovými analogy umožňuje snížit dávku pegvisomantu. Při monoterapii pegvisomantem si nemocní aplikují dávku pegvisomantu každodenně. U většiny nemocných postačí při kombinované léčbě aplikovat pegvisomant v jedné až dvou dávkách týdně (28). Aplikované množství se pohybuje mezi 40–80 mg týdně. Jsou však špatní reaktoři, kteří vyžadují dávky větší. Nicméně u většiny nemocných lze kombinací snížit náklady na léčbu a méně častou aplikací pegvisomantu zlepšit compliance. V poslední době se objevují zprávy i o kombinaci pegvisomantu s kabergolinem nebo trojkombinaci pegvisomant, somatostatinová analoga a kabergolin (29).
Holandští autoři (30) prosazují nyní koncept tzv. extra-hepatické či tkáňové akromegalie. Podle jejich názoru somatostatinová analoga mohou svým suprimujícím vlivem na sekreci insulinu, a tak snížením koncentrace inzulinu v portální krvi, zvýšit rezistenci růstového hormonu v játrech a normalizovat sérové hladiny IGF I (90% IGF-I v krevním oběhu pochází z jaterní tkáně), aniž to znamená normalizaci IGF I ve tkáních. K normalizaci IGF I ve tkáních je třeba léčebně použít pegvisomant, i když sérové hladiny IGF I jsou normální. Laboratorně je zatím obtížné tento koncept dokázat. Autoři se opírají o výsledky dotazníkové akce kvality života, která jim při léčbě s pegvisomantem přináší lepší výsledky.
Ve druhé fázi klinického zkoušení je nyní nový přípravek blokující tvorbu informační ribonukleové kyseliny (mRNA) při stimulaci IGF-I vlivem růstového hormonu ve tkáních nazvaný ATL-1103 (31).
Závěr
Léčba akromegalie zaznamenala za poslední čtvrtstoletí nebývalý pokrok. Dnes dovedeme léčbou znormalizovat hormonální aktivitu akromegalie u 95 % nemocných. Tím předejdeme vzniku orgánových komplikací – za předpokladu, že akromegalie není diagnostikována pozdě. Přitom na akromegalii může upozornit kterýkoliv lékař, který je vnímavý k dysmorfickým změnám a klinickým příznakům akromegalie.
Zkratky
BMI – body mass index
IGF –inzulinu podobný růstový faktor
ADRESA PRO KORESPONDENCI:
prof. MUDr. Josef Marek, DrSc.
III. interní klinika 1. LF UK a VFN
U Nemocnice 1, 128 08 Praha 2
e-mail: jmarek@lf1.cuni.cz
Zdroje
1. Rajasoorya C, et al. Determinants of clinical outcome and survival in acromegaly. Clin Endocrinol (Oxf) 1994; 41 : 98–102.
2. Reid TJ, et al. Features at diagnosis of 324 patients with acromegaly did not change from 1981 to 2006: acromegaly remains under-recognized and under-diagnosed. Clin Endocrinol (Oxf) 2010; 72 : 203–208.
3. Vilar L, et al. Multiple facets in the control of acromegaly. Pituitary 2013; 17(Suppl 1) :11–17.
4. Melmed S, et al. Guidelines for acromegaly management: an update.J Clin Endocrinol Metab 2009; 94 : 1509–1517.
5. Petrossians P, et al. Gross total resection or debulking of pituitary adenomas improves hormonal control of acromegaly by somatostatin analogs. Eur J Endocrinol 2005; 152 : 61–66.
6. Nomikos P, et al. The outcome of surgery in 668 patients with acromegaly using current criteria of biochemical cure. Eur J Endocrinol 2005; 152 : 379–387.
7. Liščák R, et al. Stereotactic radiosurgery of pituitary adenomas. Neurosurg Clin N Am 2013; 24 : 509–519.
8. Marek J, et al. Is it possible to avoid hypopituitarism after irradiation of pituitary adenomas by the Leksell gamma knife? Eur J Endocrinol 2011; 164 : 169–178.
9. Leenstra JL, et al. Factors associated with endocrine deficits after stereotactic radiosurgery of pituitary adenomas. Neurosurgery 2010; 67 : 27–32.
10. Ježková J, et al. Gamma knife radiosurgery for acromegaly – long term experience. Clin Endocrinol (Oxf) 2006; 64 : 588–595.
11. Biermasz NR, et al. Cost-effectiveness of lanreotide Autogel in treatment algorithms of acromegaly. Expert Rev Pharmacoecon Outcomes Res 2009; 9 : 223–234.
12. Sandret L, et al. Place of cabergoline i n acromegaly: a meta-analysis.J Clin Endocrinol Metab 2011; 96 : 1327–1335.
13. Abs R, et al. Cabergoline in the treatment of acromegaly, a study in 64 patients. J Clin Endocrinol Metab 1998; 83 : 374–378.
14. Murray RD, et al. A critical analysis of clinically available somatostatin analog formulations for therapy of acromegaly. J Clin Endocrinol Metab 2008; 93 : 2957–2968.
15. Cuevas-Ramos D, et al. Somatostatin receptor ligands and resistance to treatment in pituitary adenomas. J Mol Endocrinol 2014. Epub ahead of print.
16. Mercado M, et al. A prospective, multicentre study to investigate the efficacy, safety and tolerability of octreotide LAR (long-acting repeatable octreotide) in the primary therapy of patients with acromegaly. Clin Endocrinol (Oxf) 2007; 66 : 859–868.
17. Cozzi R, et al. Primary treatment of acromegaly with octreotide LAR: A long-term (up to nine years) prospective study of its tumor shrinkage.J Clin Endocrinol Metab 2006; 91 : 1397–1403.
18. Freda PU. Somatostatin analogs in acromegaly. J Clin Endocrinol Metab 2002; 87 : 3013–3018.
19. Joseph S, et al. A prospective trial on the effect of body mass index and sex on plasma octreotide levels in patients undergoing long-term octreotide LAR therapy. Pancreas 2010; 39 : 964–966.
20. Giustina A, et al. High-dose intramuscular octreotide in patients with acromegaly inadequately controlled on conventional somatostatin analogue therapy: a randomized controlled trial. Eur J Endocrinol 2008; 161 : 331–338.
21. Sandret L, et al. Place of cabergoline in acromegaly: a meta-analysisJ Clin Endocrinol Metab 2011; 96 : 1327–1335.
22. Petersenn S, et al. Long-term efficacy of subcutaneous pasireotide in acromegaly: results from an open-ended, multicenter Phase II extension study. Pituitary 2014; 17 : 132–140.
23. Chieffo C, et al. Efficacy and safety on an octreotide implant in the treatment of patients with acromegaly. J Clin Endocrinol Metab 2013; 98 : 4047–4054.
24. Tuvia S, et al. Oral octreotide absorption in human subjects: comparable pharmacokinetics to parenteral octreotide and effective growth hormone suppression. J Clin Endocrinol Metab 2012; 97(7): 2362–2369. doi: 10.1210/jc.2012-1179. Epub 2012 Apr 26.
25. Van der Lely AJ, et al. Long-term treatment of acromegaly with pegvisomant, a growth hormone receptor antagonist. Lancet 2001; 358 : 1754–1759.
26. Biering H, et al. Elevated transaminases during medical treatment of acromegaly: a review of the German pegvisomant surveillance experience and a report of a patient with histologically proven chronic mild active hepatits. Eur J Endocrinol 2006; 154 : 213–220.
27. Brue T. Acrostudy: Status update on 469 patients. Horm Res 2009; 71(Suppl 1): 34–38.
28. Van der Lely AJ, et al. Coadministration of lanreotide Autogel and pegvisomant normalizes IGF1 levels and is well tolerated in patients with acromegaly partially controlled by somatostatin analogs alone. Eur J Endocrinol 2011; 164 : 325–333.
29. Giustina A, et al. Expert consensus document: A consensus on the medical treatment of acromegaly. Nature Rev Endocrinol 2014; 10 : 243–248.
30. Neggers SJ, et al. Hypothesis: Extra-hepatic acromegaly: a new paradigm? Eur J Endocrinol 2011; 164 : 11–16.
31. Störmann S, et al. Emerging drugs for acromegaly. Expert Opin Emerg Drugs 2013; 19 : 79–97.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek KOMPENDIUM STOMATOLOGIE IČlánek WERNER ARBER
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Přístrojový přístup k personalizaci medicíny (vyšetření u pacienta, Point of Care Testing)*
- CREATIVE DESTRUCTION OF MEDICINE
- Perspektivy farmakoterapie obezity*
- Současné možnosti a perspektivy léčby akromegalie*
- Upozornění na blížící se mezinárodní kongres
- Rezistence na tyreoidální hormony*
- Současné možnosti non-orální estrogen-progestinové antikoncepce
- Dobrá smrt: eutanazie očima studentů medicíny
- KOMPENDIUM STOMATOLOGIE I
- Vareniklin: bezpečná léčba závislosti na tabáku u kardiovaskulárních pacientů
- Plánované akce složek ČLS JEP
- Příspěvek k dějinám farmakologie (období raného římského císařství)
- Plánované akce složek ČLS JEP
- Kolorektální karcinom (část 2)
- Zdánlivá smrt někdy zachraňuje život
- Léčba v psychiatrii z pohledu léčby závislosti na tabáku
- Zirmův olomoucký diskuzní den
- Profesor Vratislav Schreiber devadesátiletý
- Doc. MUDr. Vojtěch Hainer, CSc., sedmdesátníkem
- Odešel plk. v.v. doc. MUDr. Pavel Petýrek, CSc.
- WERNER ARBER
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Rezistence na tyreoidální hormony*
- Kolorektální karcinom (část 2)
- Doc. MUDr. Vojtěch Hainer, CSc., sedmdesátníkem
- Dobrá smrt: eutanazie očima studentů medicíny
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




