-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vyšetření kondenzátu vydechovaného vzduchu u cystické fibrózy
Examination of exhaled breath condensate in cystic fibrosis
Examination of exhaled breath condensate belongs to experimental methods that are used in many pulmonary diseases and it can take part in the study of their pathophysiology. Its contribution to diagnostics and to monitoring of response to treatment is also evaluated. Many biomarkers of inflammation and oxidative stress were studied in exhaled breath condensate in cystic fibrosis. Examination of pH of exhaled breath condensate is considered to be useful in evaluation of inflammatory acidification of airways, together with evaluation of response to antibiotic treatment of pulmonary exacerbation, due to immediately accessible result. Other important biomarkers include 8-isoprostane and 3-nitrotyrosine as markers of oxidative stress (both with negative correlation with pulmonary function) and leukotriene B4 as marker of neutrophilic inflammation. Opposite to other pulmonary diseases, hydrogen peroxide does not belong to useful markers of oxidative stress in cystic fibrosis, due to abundant reduced thiols and glutathione peroxidase in sputum of these patients. Attempts to detect bacterial DNA in exhaled breath condensate in cystic fibrosis also failed. In spite of mentioned progress, examination of exhaled breath condensate remains a research method and it has not been introduced into clinical practice.
Key words:
cystic fibrosis, exhaled breath condensate, pathophysiology, diagnostics, therapy.
Autoři: Libor Fila; Jaromír Musil
Působiště autorů: Univerzita Karlova v Praze, 2. lékařská fakulta, Pneumologická klinika FN Motol
Vyšlo v časopise: Čas. Lék. čes. 2010; 149: 173-177
Souhrn
Vyšetření kondenzátu vydechovaného vzduchu v současnosti patří u řady plicních chorob k experimentálním metodám, kde se podílí na studiu patofyziologie onemocnění a je hodnocen přínos k diagnostice a k monitorování odpovědi na léčebné zásahy. U cystické fibrózy byla v kondenzátu vydechovaného vzduchu studována řada biomarkerů zánětu a oxidačního stresu. Za perspektivní se jeví vyšetření pH kondenzátu vydechovaného vzduchu jako biomarkeru zánětlivé acidifikace dýchacích cest, včetně hodnocení odpovědi na antibiotickou léčbu plicní exacerbace, a to vzhledem k možnosti prakticky okamžitě dostupného výsledku. Z dalších biomarkerů jde především o 8-isoprostan a 3-nitrotyrozin jako markery oxidačního stresu, u nichž je navíc prokazována negativní korelace s plicními funkcemi, a leukotrien B4 jako marker neutrofilního zánětu. Mezi vhodné biomarkery oxidačního stresu u cystické fibrózy na rozdíl od jiných plicních chorob nepatří peroxid vodíku, a to vzhledem k přítomnosti glutationperoxidázy a redukovaných tiolů nacházených ve sputu nemocných s cystickou fibrózou v nadbytku. Stejně tak u cystické fibrózy selhaly pokusy detekovat v kondenzátu vydechovaného vzduchu bakteriální DNA. Přes uvedené pokroky však vyšetření kondenzátu vydechovaného vzduchu zůstává výzkumnou metodou a nenašlo dosud uplatnění v klinické praxi.
Klíčová slova:
cystická fibróza, kondenzát vydechovaného vzduchu, patofyziologie, diagnostika, léčba.Úvod
Cystická fibróza (CF) je vrozené onemocnění vyvolané mutacemi genu pro transmembránový regulátor vodivosti (CFTR). Dysfunkce CFTR vede k poruše mukociliární clearance, chronické bakteriální infekci a neutrofilnímu zánětu dýchacích cest s rozvojem bronchiektazií a obstrukční ventilační poruchy (1). Na patogenezi CF se podílí rovněž porucha metabolismu oxidu dusnatého (NO) a polynenasycených mastných kyselin (PUFA) (2, 3).
Hodnotit tíži plicního postižení je možné řadou metod lišících se mírou invazivity. K neinvazivním metodám patří vyšetřování biomarkerů ve vydechovaném vzduchu a v kondenzátu vydechovaného vzduchu (KVV) (4). Potenciál využití vyšetření KVV u CF je v možnosti studovat patofyziologii nemoci, v hodnocení tíže zánětu a oxidačního stresu, v diagnostice (diferenciální diagnostika chronických plicních chorob, přítomnost plicních exacerbací) a v monitorování odpovědi na léčebné zásahy (5, 6). Přehled biomarkerů studovaných u CF je uveden v tabulce 1.
Tab. 1. Přehled biomarkerů vyšetřovaných v kondenzátu vydechovaného vzduchu u cystické fibrózy (dle 6) 
Objem, iontové složení a pH kondenzátu vydechovaného vzduchu u Cystické fibrózy
U pacientů s CF je produkce KVV vyšší než u kontrol – 6,1 vs. 5,3 ml/h. (p < 0,02). KVV u nemocných s CF obsahuje signifikantně více kalia – 15,3 vs. 3,0 μmol/l (p < 0,05) a zinku – 3,2 vs. 1,7 μmol/l (p < 0,02). Nesignifikantně vyšší jsou koncentrace natria – 26,9 vs. 14,1 μmol/l, kalcia – 13,1 vs. 6,5 μmol/l, a chloridů – 24,2 vs. 16,8 μmol/l (7).
Intenzivně byla studována problematika pH KVV. Stanovení pH v KVV je možné dvojím způsobem, a to jednak s využitím deaerace, jednak bez ní. Deaerace znamená odstranění plynných komponent (především o CO2 a NH3) ze vzorku KVV bezprostředně po odběru za pomoci probublávání argonem. To umožňuje delší skladování vzorku beze změny pH. Pokud není deaerace použita, je žádoucí vyšetření v co nejkratší době. V posledních letech je doporučováno deaeraci využívat (8). Vzhledem k možnosti vyšetření pH bezprostředně po odběru KVV jde o jeden z mála biomarkerů, jejichž výsledek je dostupný prakticky okamžitě.
U CF je prokazováno ve stabilní fázi nemoci pokles pH oproti kontrolám. Bez využití dearace jde o hodnoty 5,88 vs. 6,15 (p < 0,02), 5,77 vs. 6,08 (p < 0,01), resp. 5,48 vs. 6,11 (p = 0,01) (9–11), s využitím deaerace pak 7,23 vs. 7,85 (p < 0,001) (12). V období plicní exacerbace pH KVV dále klesá, bez využití deaerace na hodnoty 5,32 vs. 5,88 (p = 0,001), resp. 5,30 vs. 5,77 (p < 0,02) (9, 10), s využitím deaerace pak na 7,12 vs. 7,31 (p < 0,0001) (12). Po antibiotické léčbě plicní exacerbace lze prokázat vzestup pH KVV – 5,71 vs. 5,27 (p < 0,05) (9), stejně tak dochází k vzestupu pH KVV po léčbě inhalačními kortikoidy ve stabilní fázi nemoci – 6,17 vs. 5,48 (p < 0,01) (11).
Pokles pH KVV je u CF dán jednak zánětlivou acidifikací periciliární tekutiny, jednak poruchou transportu bikarbonátů při dysfunkci CFTR. Zánětlivá acidifikace periciliární tekutiny má za následek další snížení aktivity ciliárních buněk a antibakteriálních defenzinů a rovněž další zvýšení viskozity hlenu a vazby bakterií na mucin. Tím se podílí na patogenezi plicního postižení u CF (9).
Metabolity NO v kondenzátu vydechovaného vzduchu u Cystické fibrózy
Nemocní s CF mají podobně jako nemocní s primární ciliární dyskinezí nižší obsah NO ve vydechovaném vzduchu (FeNO). Nižší FeNO je u CF z důvodu nižší produkce, vyššího oxidativního metabolismu vlivem zánětu a rovněž vlivem bakteriálních reduktáz u nemocných kolonizovaných Pseudomonas aeruginosa. Vzhledem k biologickým úlohám NO v dýchacím ústrojí (stimulace mukociliární clearance, bronchodilatace, antibakteriální účinky a inhibice epiteliálního natriového kanálu) tak porucha metabolismu NO ovlivňuje patogenezi plicního onemocnění u CF (2).
V KVV byly u CF studovány tyto metabolity NO: nitrity, nitráty, 3-nitrotyrozin (NO-Tyr) a nitrozotioly (R-SNO). Koncentrace NO2- v KVV u CF ve stabilní fázi plicního onemocnění jsou ve srovnání s kontrolami vyšší nebo stejné – 1,46 vs. 0,45 μmol/l (p < 0,01), resp. 3,9 vs. 3,2 μmol/l (p > 0,05) (13, 14). Naproti tomu jsou koncentrace NO3- oproti kontrolám snížené – 4,2 vs. 16,0 μmol/l (p < 0,01), resp. 7,3 vs. 39,5 μmol/l (p < 0,001) (7, 11). Během léčby inhalačním kortikoidy ve stabilní fázi plicního onemocnění se koncentrace NO3- v KVV signifikantně zvyšuje – 20,9 vs. 7,3 μmol/l (p < 0,05) (11). Koncentrace NO-Tyr v KVV je u CF ve stabilní fázi vyšší oproti kontrolám – 25,3 vs. 6,3 ng/ml (p < 0,0001), negativně koreluje s hodnotou usilovně vydechnutého objemu na první sekundu (FEV1), r = -0,70 (p < 0,0001) a léčba inhalačními kortikoidy na ni nemá vliv – 25,5 vs. 24,2 ng/ml (p > 0,05) (13). Stejně tak jsou zvýšené koncentrace R-SNO – 0,35 vs. 0,11 μmol/l (p < 0,01) (14).
Při hodnocení uvedených nálezů je třeba vzít v potaz dvě pro CF důležité skutečnosti. Jednak bakteriální kolonizaci horních cest dýchacích (především orofaryngu) a její příspěvek ke koncentraci NO2- v KVV (15), jednak retenci NO a jeho metabolitů v sekretech dolních cest dýchacích (16). To alespoň z části vysvětluje vyšší koncentrace NO2- v KVV u CF, na nichž se kromě oxidace NO podílí i redukce NO3- bakteriálními reduktázami. Ty jsou odpovědné za redukci NO a jeho metabolitů až na amoniak, jehož obsah ve sputu pacientů s kolonizací P. aeruginosa je zvýšený (ve formě amonného kationu) (17). NO-Tyr je produktem reakce peroxinitritu (vzniklého reakcí NO a superoxidu) a tyrozinových zbytků v peptidech. Je tak jedním z markerů oxidačního stresu, který je více vyjádřen v pokročilejších stadiích plicního onemocnění a jeho negativní korelace s hodnotu FEV1 je tak v souladu s naopak pozitivní korelací FeNO a hodnoty FEV1, r = 0,64 (p < 0,02) (10). Rovněž zvýšené koncentrace R-SNO svědčí spíše proti výrazněji snížené produkci NO a podílí se na nich pravděpodobně i zvýšený obsah redukovaných tiolů v respiračních sekretech nemocných s CF (18).
Metabolity kyseliny arachidonové v kondenzátu vydechovaného vzduchu u Cystické fibrózy
Z metabolitů kyseliny arachidonové (ARA) byly v KVV u CF studovány zejména 8-izoprostan (IP), leukotrien (LT) B4 a prostaglandin (PG) E2.
Koncentrace 8-IP je u stabilní fáze CF vyšší oproti kontrolám – 42,7 vs. 15,2 pg/ml (p < 0,01), resp. 30,5 vs. 15,5 pg/ml (p < 0,001) (19, 20), negativně koreluje s hodnotou FEV1, r = ‑0,61 (p < 0,01) (19) a dále stoupá při plicní exacerbaci – 47,5 vs. 30,5 pg/ml (p < 0,001) (20). 8-IP je produktem neenzymatické oxidace ARA, a slouží tak jako biomarker oxidačního stresu. Negativní korelace s hodnotou FEV1 je analogická korelaci uvedené výše u NO-Tyr.
Koncentrace LTB4 jsou u stabilní fáze CF vyšší ve srovnání s kontrolami – 35,9 vs. 6,8 pg/ml (p < 0,0001), negativně korelují s pH KVV, r = -0,5 (p < 0,01), a dále stoupají při plicní exacerbaci – 47,8 vs. 24,2 pg/ml (p < 0,001) (12). Ve stabilní fázi CF jsou pak koncentrace LTB4 vyšší u nemocných s kolonizací P. aeruginosa než bez ní – 34,3 vs. 18,3 pg/ml (p < 0,01) a v případě plicní exacerbace klesají po antibiotické léčbě – 31,1 vs. 18,8 pg/ml (p < 0,01) (21). LTB4 je jako důležitý chemotaktický mediátor neutrofilních leukocytů u CF pochopitelně v popředí zájmu. Probíhají studie s cílem zmírnit projevy onemocnění pomocí suplementace n-3 PUFA jako prekurzory biologicky méně aktivního LTB5. Podávání n-3 kyseliny eikosapentaenové a kyseliny dokosahexaenové (PUFA) v dávce odpovídající 1,3 % kalorického příjmu po dobu šesti týdnů vedlo k nesignifikantnímu poklesu koncentrace LTB4 v KVV – 120,5 vs. 173,0 pg/ml, provázenému vzestupem pH KVV – 6,32 vs. 6,08 (p < 0,05), avšak bez ovlivnění plicních funkcí a systémových zánětlivých parametrů (22).
Rovněž koncentrace PGE2 je u stabilní fáze CF vyšší oproti kontrolám – 72,0 vs. 41,0 pg/ml (p < 0,001) a dále stoupá při plicní exacerbaci – 83,0 vs. 72,0 (p < 0,001) (20). PGE2 je u CF využíván jako marker zánětlivé aktivace cyklooxygenázy.
Cytokiny v kondenzátu vydechovaného vzduchu u Cystické fibrózy
Studovány byly především interleukin (IL) 8 a IL-6 a dále interferon (IFN) γ. Koncentrace IL-8 v KVV je u stabilní CF oproti kontrolám vyšší – 0,45 vs. 0,34 pg/ml (p < 0,05), navíc je vyšší u kolonizovaných P. aeruginosa než u nemocných bez kolonizace tímto patogenem – 0,73 vs. 0,45 pg/ml (p < 0,05) a pozitivně koreluje s koncentrací LTB4, r = 0,40 (p < 0,05) (23). IL-8 je stejně jako LTB4 důležitý chemotaktický mediátor neutrofilů, proto je jejich vzájemná korelace pochopitelná, a IL 8 může být rovněž zodpovědný za neuspokojivé výsledky léčby n-3 PUFA u CF.
Obdobně jako u IL-8 je i u IL-6 koncentrace vyšší u stabilní CF v KVV ve srovnání s kontrolami – 8,7 vs. 2,6 pg/ml (p < 0,0001) a u nemocných s kolonizací P. aeruginosa oproti nekolonizovaným – 9,3 vs. 6,9 pg/ml (p < 0,01). Po antibiotické léčbě plicní exacerbace koncentrace IL-6 klesá – 6,4 vs. 9,5 pg/ml (p < 0,01) (21). Koncentrace IFN-γ v KVV je u stabilní CF vyšší ve srovnání s kontrolami – 3,3 vs. 2,2 pg/ml (p < 0,05) a současné vyšetření koncentrací IFN-γ, IP a NO2- v KVV určuje diagnózu CF se 78% senzitivitou, 83% specificitou a AUC 0,906 (p < 0,001) (24). IL-6 i IFN-γ (jako jeden z markerů TH1 imunitní odpovědi) jsou prozánětlivé cytokiny a jejich zvýšení odráží lokální zánětlivou aktivitu v dolních cestách dýchacích, u kolonizovaných P. aeruginosa navíc i vyšší prozánětlivý potenciál tohoto patogenu (při vyšetření IL-6 a IL-8).
Purinové deriváty v kondenzátu vydechovaného vzduchu u Cystické fibrózy
Mezi purinové deriváty vyšetřované v KVV u CF patří adenosin (Ado), adenosinmonofosfát (AMP) a adenosintrifosfát (ATP). Koncentrace ATP v KVV je u stabilní CF vyšší než u kontrol (p < 0,05) a klesá při antibiotické léčbě plicní exacerbace (p < 0,02). V tekutině získané bronchoalveolární laváží korelují koncentrace ATP i AMP pozitivně se zastoupením neutrofilních granulocytů a dále negativně korelují poměry koncentrací ATP/Ado i AMP/Ado s hodnotou FEV1 (25). Poměr koncentrací AMP/urea v KVV je u stabilní CF vyšší než u kontrol – 1,3 vs. 0,75 (p < 0,05), kdežto zvýšení poměru koncentrací Ado/urea v KVV u stabilní CF oproti kontrolám – 1,0 vs. 0,4 statistické významnosti nedosahuje (p > 0,05). Po antibiotické léčbě plicní exacerbace byla zjištěna negativní korelace mezi vzestupem FEV1 a změnou poměrů koncentrací AMP/urea, r = -0,53 (p < 0,01) i Ado/urea, r = -0,55 (p < 0,01) v KVV (26). V této práci byla urea využívána jako marker diluce KVV.
Význam purinergní signalizace u nemocných CF se týká jednak zvýšení mukociliární clearance (vazba ATP na nukleotidový P2Y2 receptor), jednak chemotaxe neutrofilních granulocytů (vazba Ado na adenosinový A3 receptor).
Ostatní biomarkery v kondenzátu vydechovaného vzduchu u Cystické fibrózy
Z dalších biomarkerů byly v KVV u CF vyšetřovány H2O2, matrixová metaloproteináza (MMP) 9, tkáňový inhibitor metaloproteináz (TIMP) 1 a rovněž kyselina deoxyribonukleová (DNA).
H2O2 je dalším z biomarkerů oxidačního stresu v KVV a lze jej v současnosti stanovovat v KVV on-line pomocí přístroje ECoCheck (VIASYS Healthcare GmbH, SRN). U stabilní CF však nejsou koncentrace H2O2 v KVV oproti kontrolám zvýšené – 0,97 vs. 1,11 μmol/l (p > 0,05) (27), nicméně při antibiotické léčbě plicní exacerbace klesají – 0,12 vs. 0,28 mol/l (p < 0,01) (28). Důvodem pro obdobné koncentrace H2O2 v KVV u stabilní CF jako u kontrol jsou antioxidační vlastnosti sekretů dolních dýchacích cest nemocných s CF, a to vzhledem k dostatečnému množství redukovaných tiolů a glutationperoxidázy (18). H2O2 tak není vhodným biomarkerem oxidačního stresu u CF.
Nejnovější výzkumy se týkají MMP-9 v KVV u stabilní CF, kde jsou hladiny vyšší než u kontrol – 48,9 vs. 30,0 ng/ml (p < 0,05). Hodnoty MMP-9 u nemocných s bronchiektaziemi různého původu (při CF i z dalších příčin) negativně korelují s hodnotou FEV1, r = -0,79 (p < 0,001). Hodnoty TIMP-1 v KVV se u nemocných s CF a kontrol signifikantně nelišily (23,2 vs. 20,1 ng/ml) (29). Autoři této práce považují vyšetření MMP-9 v KVV za potenciální marker tkáňového poškození dýchacích cest u nemocných s bronchiektaziemi.
Dále byla snaha zjišťovat patogeny v dolních dýchacích cestách nemocných s CF pomocí detekce jejich DNA v KVV. Na rozdíl od nemocných s bronchogenním karcinomem, kde lze v KVV detekovat mutace onkogenů (30), nebyla snaha detekovat DNA P. aeruginosa a Burkholderia cepacia pomocí polymerázové řetězové reakce úspěšná. U nemocných, kteří neodkašlávají, je tak nutno využívat invazivnější metody (indukované sputum nebo bronchoskopie) k získávání materiálu z dolních cest dýchacích (31).
Závěr
Přehled nálezů při vyšetření jednotlivých biomarkerů KVV ve vztahu k CF je uveden v tabulce 2.
Tab. 2. Přehled nálezů u jednotlivých biomarkerů v kondenzátu vydechovaného vzduchu u cystické fibrózy 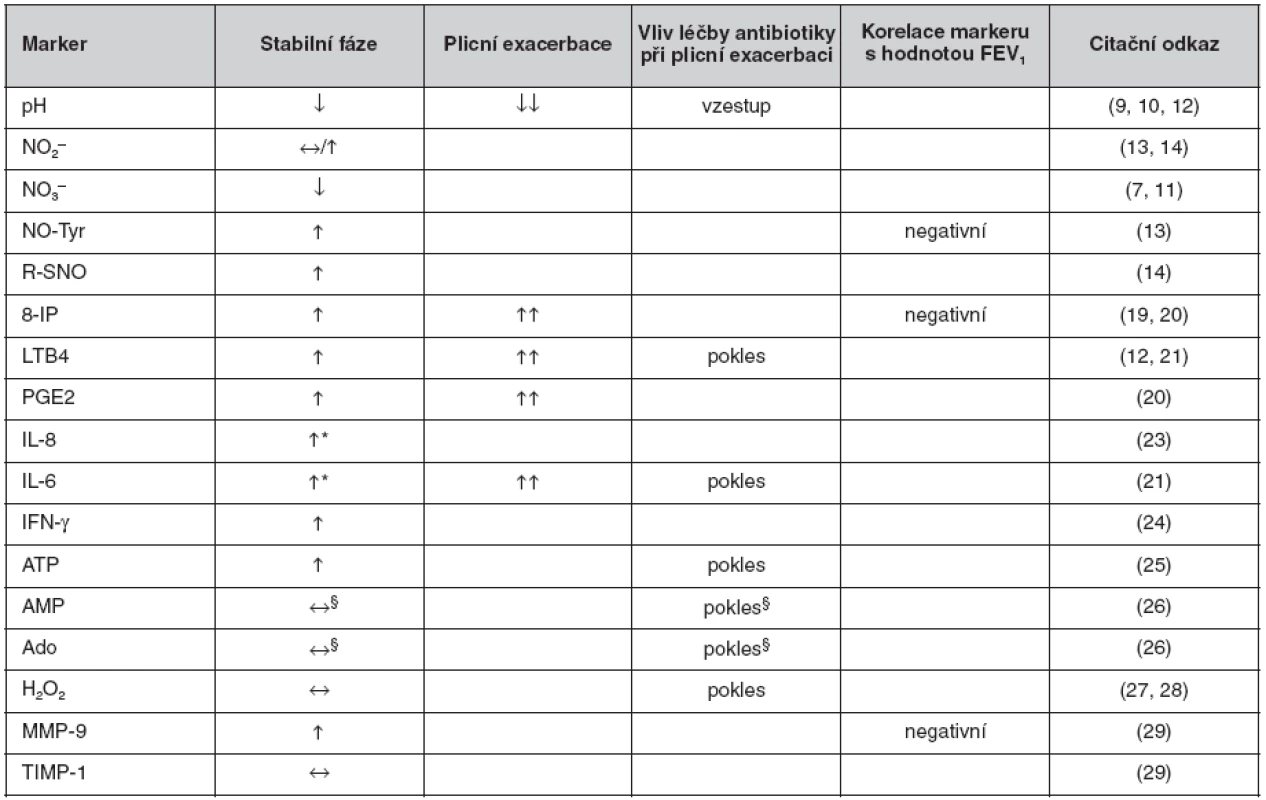
*vyšší u stabilní CF s kolonizací P. aeruginosa oproti nekolonizovaným. §poměr koncentrací AMP a urey, resp. Ado a urey. Ve srovnání s kontrolami: ↔ beze změny, ↓ nižší, ↑ vyšší. Ve srovnání se stabilní fází: ↓↓ nižší, ↑↑ vyšší. Zkratky: viz seznam zkratek Za nejperspektivnější lze pro klinické využití u CF považovat vyšetření pH KVV jako ukazatele zánětlivé acidifikace dolních cest dýchacích vzhledem k okamžité dostupnosti výsledku, např. ke kontrole účinnosti antibiotické léčby plicní exacerbace. Z dalších biomarkerů lze za perspektivní považovat 8-IP a NO-Tyr jako markery oxidačního stresu (v obou případech s prokázanými korelacemi s plicními funkcemi) a LTB4 jako marker zánětu, avšak s výsledky dostupnými s různě velkým časovým odstupem. V současnosti tedy zůstává vyšetření KVV u CF experimentálním postupem. Množství poznatků získaných díky vyšetření KVV u CF však narůstá, podobně jako je tomu i u dalších chronických plicních chorob, např. bronchiálního astmatu či chronické obstrukční plicní nemoci, u kterých již byly přehledové články v české odborné literatuře publikovány (32).
Zkratky
- Ado – adenosin
- AMP – adenosinmonofosfát
- ARA – kyselina arachidonová
- ATP – adenosintrifosfát
- CF – cystická fibróza
- CFTR – transmembránový regulátor vodivosti
- DNA – kyselina deoxyribonukleová
- FEV1 – usilovně vydechnutý objem za první sekundu
- FeNO – koncentrace oxidu dusnatého ve vydechovaném vzduchu
- IFN – interferon
- IL – interleukin
- IP – izoprostan
- KVV – kondenzát vydechovaného vzduchu
- LT – leukotrien
- MMP – matrixová metaloproteináza
- NO-Tyr – 3-nitrotyrozin
- PG – prostaglandin
- PUFA – polynenasycené mastné kyseliny
- R-SNO – nitrózotioly
- TIMP – tkáňový inhibitor metaloproteináz
Adresa pro korespondenci:
MUDr. Libor Fila
Pneumologická klinika 2. LF UK a FN Motol
V Úvalu 84, 150 06 Praha 5
fax: +420 224 436 620, e-mail: libor_fila@seznam.cz
Zdroje
1. Boucher RC. New concepts of the pathogenesis of cystic fibrosis lung disease. Eur Respir J 2004; 23 : 146–158.
2. de Winter-de Groot KM, van der Ent CK. Nitric oxide in cystic fibrosis. J Cyst Fibros 2005; 4 (Suppl 2): 25–29.
3. Freedman SD, Blanco PG, Zaman MM, et al. Association of cystic fibrosis with abnormalities in fatty acid metabolism. N Engl J Med 2004; 350 : 560–569.
4. Kharitonov SA, Barnes PJ. Exhaled markers of pulmonary disease. Am J Respir Crit Care Med 2001; 163 : 1693–1722.
5. Srbová M, Wilhelm J. Markery obsažené ve vydechovaném vzduchu při plicních onemocněních. Čas Lék čes 2003; 142 : 140–143.
6. Montuschi P. Analysis of exhaled breath condensate in respiratory medicine: methodological aspects and potential clinical applications. Ther Adv Respir Dis 2007; 1 : 5–23.
7. Griese M, Noss J, Schramel P. Elemental and ion composition of exhaled air condensate in cystic fibrosis. J Cyst Fibros 2003; 2 : 136–142.
8. Horváth I, Hunt J, Barnes PJ, et al. ATS/ERS Task Force on Exhaled Breath Condensate. Exhaled breath condensate: methodological recommendations and unresolved questions. Eur Respir J 2005; 26 : 523–548.
9. Tate S, MacGregor G, Davis M, et al. Airways in cystic fibrosis are acidified: detection by exhaled breath condensate. Thorax 2002; 57 : 926–929.
10. Ojoo JC, Mulrennan SA, Kastelik JA, et al. Exhaled breath condensate pH and exhaled nitric oxide in allergic asthma and in cystic fibrosis. Thorax 2005; 60 : 22–26.
11. Fila L, Musil J, Valentová Bartáková L, et al. Vliv terapie inhalačními kortikosteroidy na složení kondenzátu vydechovaného vzduchu u nemocných s cystickou fibrózou. Stud Pneumol Phthiseol 2008; 68 : 6–9.
12. Carpagnano GE, Barnes PJ, Francis J, et al. Breath condensate pH in children with cystic fibrosis and asthma: a new noninvasive marker of airway inflammation? Chest 2004; 125 : 2005–2010.
13. Balint B, Kharitonov SA, Hanazawa T, et al. Increased nitrotyrosine in exhaled breath condensate in cystic fibrosis. Eur Respir J 2001; 17 : 1201–1207.
14. Corradi M, Montuschi P, Donnelly LE, et al. Increased nitrosothiols in exhaled breath condensate in inflammatory airway diseases. Am J Respir Crit Care Med 2001; 163 : 854–858.
15. Marteus H, Tornberg DC, Weitzberg E, et al. Origin of nitrite and nitrate in nasal and exhaled breath condensate and relation to nitric oxide formation. Thorax 2005; 60 : 219–225.
16. Grasemann H, Ioannidis I, Tomkiewicz RP, et al. Nitric oxide metabolites in cystic fibrosis lung disease. Arch Dis Child 1998; 78 : 49–53.
17. Gaston B, Ratjen F, Vaughan JW, et al. Nitrogen redox balance in the cystic fibrosis airway: effects of antipseudomonal therapy. Am J Respir Crit Care Med 2002; 165 : 387–390.
18. Dauletbaev N, Rickmann J, Viel K, et al. Antioxidant properties of cystic fibrosis sputum. Am J Physiol Lung Cell Mol Physiol 2005; 288: L903–L909.
19. Montuschi P, Kharitonov SA, Ciabattoni G, et al. Exhaled 8-isoprostane as a new non-invasive biomarker of oxidative stress in cystic fibrosis. Thorax 2000; 55 : 205–209.
20. Lucidi V, Ciabattoni G, Bella S, et al. Exhaled 8-isoprostane and prostaglandin E(2) in patients with stable and unstable cystic fibrosis. Free Radic Biol Med 2008; 45 : 913–919.
21. Carpagnano GE, Barnes PJ, Geddes DM, et al. Increased leukotriene B4 and interleukin-6 in exhaled breath condensate in cystic fibrosis. Am J Respir Crit Care Med 2003; 167 : 1109–1112.
22. Fila L, Brázová J, Musil J. Vliv suplementace n-3 polynenasycenými mastnými kyselinami na složení kondenzátu vydechovaného vzduchu u nemocných s cystickou fibrózou. Stud Pneumol Phtiseol 2009; 69 : 216–220.
23. Bodini A, D’Orazio C, Peroni D, et al. Biomarkers of neutrophilic inflammation in exhaled air of cystic fibrosis children with bacterial airway infections. Pediatr Pulmonol 2005; 40 : 494–499.
24. Robroeks CM, Rosias PP, van Vliet D, et al. Biomarkers in exhaled breath condensate indicate presence and severity of cystic fibrosis in children. Pediatr Allergy Immunol 2008; 19 : 652–659.
25. Esther CR, Alexis NE, Clas ML, et al. Extracellular Purines are Biomarkers of Neutrophilic Airway Inflammation. Eur Respir J 2008; 31 : 949–956.
26. Esther CR Jr, Boysen G, Olsen BM, et al. Mass spectrometric analysis of biomarkers and dilution markers in exhaled breath condensate reveals elevated purines in asthma and cystic fibrosis. Am J Physiol Lung Cell Mol Physiol 2009; 296: L987–L993.
27. Worlitzsch D, Herberth G, Ulrich M, et al. Catalase, myeloperoxidase and hydrogen peroxide in cystic fibrosis. Eur Respir J 1998; 11 : 377–383.
28. Jöbsis Q, Raatgeep HC, Schellekens SL, et al. Hydrogen peroxide and nitric oxide in exhaled air of children with cystic fibrosis during antibiotic treatment. Eur Respir J 2000; 16 : 95–100.
29. Karakoc GB, Inal A, Yilmaz M, et al. Exhaled breath condensate MMP-9 levels in children with bronchiectasis. Pediatr Pulmonol 2009; 44 : 1010–1016.
30. Gessner C, Kuhn H, Toepfer K, et al. Detection of p53 gene mutations in exhaled breath condensate of non-small cell lung cancer patients. Lung Cancer 2004; 43 : 215–222.
31. Vogelberg C, Hirsch T, Rosen-Wolff A, et al. Pseudomonas aeruginosa and Burkholderia cepacia cannot be detected by PCR in the breath condensate of patients with cystic fibrosis. Pediatr Pulmonol 2003; 36 : 348–352.
32. Čáp P, Pehal F. Vyšetření kondenzátu vydechovaného vzduchu u nemocných s astmatem a chronickou obstrukční plicní nemocí. Čas Lék čes 2004; 143 : 742–746.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Průtok krve tukovou tkání a metabolický syndrom
- Hladina plazmatického citrulinu – spolehlivý neinvazivní ukazatel množství funkčních enterocytů
- Idiopatické střevní záněty a těhotenství
- Vyšetření kondenzátu vydechovaného vzduchu u cystické fibrózy
- Výzva redakce
- Nádorové multiplicity u české populace
- Toxoplazmóza centrálního nervového systému po alogenní transplantaci krvetvorných buněk
- Nová data týkající se problémů s alkoholem v české populaci jsou varovná
- Systém léčby závislosti na tabáku na Mayo Clinic
- 4. janskolázeňské sympozium
- Seminář věnovaný léčbě závislosti na tabáku s podporou zaměstnavatele
- XIII. olomoucké onkologické dny
- Závislost na tabáku, děti a adolescenti
- Český přínos k výzkumu umělého srdce
- Slavnostní předávání Ceny ministryně zdravotnictví za mimořádné výsledky v aplikovaném zdravotnickém výzkumu
- Projekty oceněné za mimořádné výsledky
- Nový vzdělávací program bude chránit pacienty
- Spolek lékařů českých
- Mařatka Z.: Zamyšlení nad medicínou, životem a světem
- JOHN CAREW ECCLES
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hladina plazmatického citrulinu – spolehlivý neinvazivní ukazatel množství funkčních enterocytů
- Idiopatické střevní záněty a těhotenství
- Nádorové multiplicity u české populace
- Vyšetření kondenzátu vydechovaného vzduchu u cystické fibrózy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



